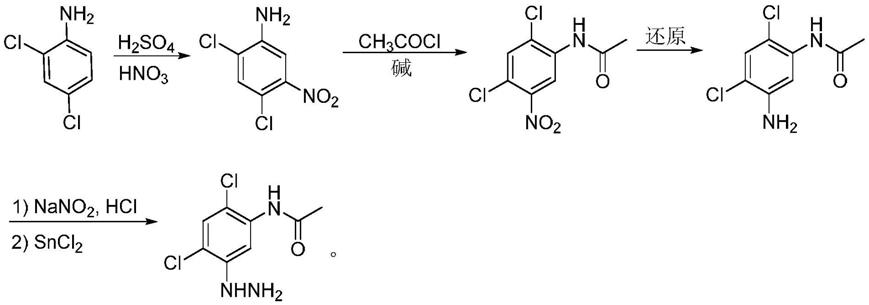
人baf45d融合蛋白表达和纯化方法及应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种人baf45d融合蛋白表达和纯化方法,还涉及人baf45d融合蛋白在寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白的应用。
背景技术:
2.baf45d,也被称为dpf2、double phd fingers 2或双锌指蛋白2,其属于新型kr
ü
ppel型锌指蛋白d4蛋白家族。baf45d基因定位于小鼠chr 19,已知其在小鼠胚胎脑组织中表达;此外,baf45d还定位于人11q13.1,位于人11号染色体长臂13区位置上,作为细胞内重要的基因表达调控因子之一,而这样一区域与多种形式肿瘤的发生有着密切的关系。
3.人胚胎干细胞具有自我更新和全能性的特点,可以分化为人体任意细胞,因而在再生医学中有着十分重要的应用价值。发现人胚胎干细胞相关蛋白质新的相互作用可以为其功能研究提供重要线索。baf45d作为一种在人胚胎干细胞内表达丰富的蛋白,他的生物学功能可能与人胚胎干细胞诱导分化有关,稳定的筛选鉴定与已知蛋白相互作用的未知蛋白,对生物及医学领域分子机制方面的研究具有重要意义。然而目前,国际及国内上缺乏人baf45d融合蛋白高效、高活性表达及纯化方法,更是缺乏利用baf45d纯化蛋白寻找鉴定其人胚胎干细胞来源的结合蛋白的研究或同类研究成果。
技术实现要素:
4.有鉴于此,本发明有必要提供一种人baf45d融合蛋白表达和纯化方法,提高菌体表达融合蛋白的效率,并保持较高蛋白活性,为后续利用该人baf45d融合蛋白寻找并鉴定与人胚胎干细胞来源的真核蛋白的结合蛋白提供基础。
5.为了实现上述目的,本发明采用以下技术方案:
6.本发明提供了一种人baf45d融合蛋白表达和纯化方法,包括下列步骤:
7.构建人baf45d原核表达载体,获得重组质粒pgex-5x-1-baf45d;
8.gst-baf45d融合蛋白的原核表达:将所述重组质粒pgex-5x-1-baf45d转入rosetta(de3)大肠杆菌,经iptg诱导表达,获得菌体沉淀;破碎细菌,收集上清;
9.gst-baf45d融合蛋白的纯化:将经过原核表达获得的上清经gst resin离心纯化。
10.进一步方案,所述iptg诱导表达的参数为:采用终浓度为0.3mm iptg,30℃、250rpm震荡培养诱导表达5h。
11.进一步方案,所述iptg诱导表达的步骤,具体为:
12.挑取已转入质粒大肠杆菌菌种gst-baf45d-rosseta接种于lb液体培养基中,震荡过夜,获得过夜培养物;
13.将所述过夜培养物接种到lb液体培养基中,震荡培养至od
600
=0.4-0.8后,加入100mm iptg至终浓度为0.3mm,30℃、250rpm震荡培养诱导表达5h后,离心培养物,弃去上清,获得菌体沉淀。
14.进一步方案,所述破碎细菌的步骤,具体为:预冷细菌裂解液,以100ml菌液沉淀比6-8ml细菌裂解液的比例将菌体沉淀悬起,收集后进行冰浴超声破碎细菌,收集上清。
15.进一步方案,所述细菌裂解液的组成为50mm tris、1mm edta、1%tritonx100、5mm dtt、2mm pmsf,ph=8。
16.进一步方案,所述超声的参数具体为:40%-60%功率425w,超声4s,停8s,工作4-6min。
17.进一步方案,所述gst resin离心纯化的步骤,具体为:
18.取30-50μl gst resin与1500-2000μl gst-baf45d-rosseta细菌裂解的gst-baf45d总蛋白,4℃孵育3小时,收集沉淀;使用1000-2000μl细菌裂解液洗杂质蛋白,在冰上振摇5min,收集沉淀;重复清洗杂质蛋白3次,收集沉淀,获得纯化后的gst-baf45d融合蛋白。
19.本发明进一步提供了一种寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白的方法,其特征在于,包括下列步骤:
20.提供纯化的gst-baf45d融合蛋白,其采用如权利要求1-7任一项所述的人baf45d融合蛋白表达和纯化方法获得;
21.采用gst-pull down方法将所述gst-baf45d纯化蛋白与人胚胎干细胞来源的真核总蛋白结合,寻找鉴定人胚胎干细胞来源的结合蛋白。
22.进一步方案,所述人胚胎干细胞来源的真核总蛋白选自h9细胞蛋白、nccit细胞蛋白或纯化后的his-smad3蛋白。
23.进一步方案,所述gst-pull down方法的步骤具体为:
24.将所述gst-baf45d融合蛋白和600-1000μl人胚胎干细胞来源的真核总蛋白于4℃旋转孵育过夜,收集沉淀;沿壁缓慢加入1-2ml np-40裂解液清洗beads,收集沉淀,并重复清洗beads 5-6次;向收集的沉淀中加入sds上样缓冲液,连同input一起100℃煮沸4-6min;经sds-page处理后ib验证。
25.与现有技术相比,本发明具有以下有益效果:
26.该表达和纯化方法能够实现菌体的高效率表达,提取菌体有活性的重组蛋白,且提取的重组蛋白具有较高的活性,可用于寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白。
27.获得的重组蛋白采用gst-pull down实验,从而寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白,并且在分子生物学领域降低gst-pull down实验难度,能够较为稳定的筛选鉴定与已知蛋白相互作用的未知蛋白,对生物及医学领域分子机制方面的研究具有重要意义。
附图说明
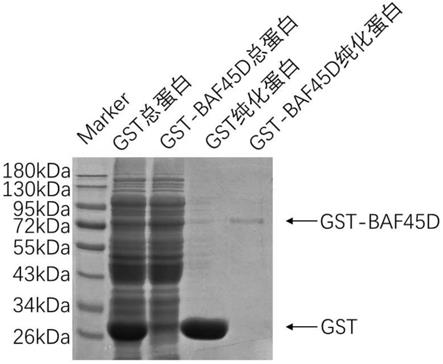
28.图1为已转入质粒大肠杆菌菌种gst-bl21、gst-baf45d-rosseta诱导表达、纯化的电泳示意图;
29.图2为融合蛋白gst、gst-baf45d分别和h9细胞蛋白结合的电泳示意图;
30.图3为融合蛋白gst、gst-baf45d分别和nccit细胞蛋白结合的电泳示意图;
31.图4为融合蛋白gst、gst-baf45d分别和纯化的his-smad3蛋白结合的电泳示意图。
具体实施方式
32.为了便于理解本发明,下面将结合具体的实施例对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明的公开内容理解的更加透彻全面。
33.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。
34.本发明第一方面提供了一种人baf45d融合蛋白表达和纯化方法,包括下列步骤:
35.首先,构建人baf45d原核表达载体,获得重组质粒pgex-5x-1-baf45d,该重组质粒的构建采用本领域中现有技术,具体的说,取野生型baf45d其蛋白序列如seq id no.1所示。
36.利用上游引物5
’‑
cggaattcccatggaagatggcggctgtggtggag-3’(seq id no.2)和下游引物5
’‑
acgcgtcgaccaagaggagttctggttctggtaga-3’(seq id no.3)从pcmv-sport6-dpf2(open biosystems,huntsville,al)载体中扩增得到baf45d cdna,并通过ecor i/sal i酶切位点克隆到pgex-5x-1载体(全序列中含有gst序列)中,获得重组质粒pgex-5x-1-baf45d。
37.然后进行gst-baf45d融合蛋白的原核表达:将所述重组质粒pgex-5x-1-baf45d转入rosetta(de3)大肠杆菌,挑取已转入质粒大肠杆菌菌种gst-baf45d-rosetta接种于lb液体培养基中,恒温震荡培养过夜,获得过夜培养物,本文中所述的“lb液体培养基”为本领域中常规的细菌基础培养基,具体采用10g tryptone、5g yest extract、10g nacl,10m naoh调ph=7,ddh2o定容至1l,高压灭菌后加入1ml amp配制,在本发明的一个或多个实施例中,震荡培养参数为37℃、270rpm;
38.将获得的过夜培养物按照1:100体积比接种到lb液体培养基中,37℃、270rpm震荡培养至od
600
=0.4-0.8之间,优选为0.6后,加入100mm iptg至终浓度为0.3mm,30℃、250rpm震荡诱导表达5h,离心获得菌体沉淀;
39.冰上预冷细菌裂解液(50mm tris、1mm edta、1%tritonx100、5mm dtt、2mm pmsf,浓hcl调ph=8),将获得菌体沉淀按照100ml比6-8ml细菌裂解液的比例将菌体沉淀悬起,收集进行冰浴超声,超声具体过程为40%-60%功率(优选为50%功率425w),超声4s,停8s,工作4-6min,离心获得沉淀,即gst-baf45d融合总蛋白。
40.最后进行gst-baf45d融合蛋白的纯化:将经过原核表达获得上清经gst resin离心纯化,具体的说,取30-50μl gst resin于2ml ep管中,并加入gst-baf45d融合总蛋白1500-2000μl,4℃孵育3小时后,4℃,12000rpm,离心5min,弃去上清。使用1000-2000μl细菌裂解液(50mm tris、1mm edta、1%tritonx100、5mm dtt、2mm pmsf,浓hcl调ph=8)洗杂质蛋白,在冰上振摇5min,4℃,12000rpm,离心1min,弃去上清。重复达到3次,弃上清留沉淀,获得大量纯化后的gst-baf45d融合蛋白,其蛋白序列如seq id no.4所示。
41.该方法中通过终浓度为0.3mm iptg在30℃诱导5h,可减少包涵体的产生,提高菌体的表达效率,从而能够高效的诱导菌体表达融合蛋白;进一步的使用离心纯化方法配合在4℃条件下使用圆盘旋转混匀仪孵育3h,使细菌总裂解蛋白与gst resin结合更加充分,保证纯化效率,从而获得有高活性的纯化融合蛋白。为后续与人胚胎干细胞结合孵育,筛选
与baf45d相互作用的蛋白提供支撑,使用人胚胎干细胞作为筛选与baf45d相互作用的目的细胞,以人的细胞为工具,具有较好的实际价值。
42.本发明第二方面提供了一种寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白的方法,通过本发明第一方面获得的gst-baf45d融合蛋白,采用gst-pull down方法寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白,其具体包括下列步骤:
43.提供纯化的gst-baf45d融合蛋白,其采用如本发明第一方面所述的人baf45d融合蛋白表达和纯化方法获得;
44.采用gst-pull down方法将所述gst-baf45d融合蛋白与人胚胎干细胞来源的真核总蛋白结合,寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白,具体的的说,将所述gst-baf45d融合蛋白和600-1000μl人来源的真核总蛋白于4℃旋转孵育过夜,收集沉淀;沿壁缓慢加入1-2ml np-40裂解液清洗beads,收集沉淀,并重复清洗beads 5-6次;向收集的沉淀中加入sds上样缓冲液,连同input一起100℃煮沸4-6min;经sds-page处理后ib验证。
45.进一步方案,所述人胚胎干细胞来源的真核总蛋白选自h9细胞蛋白、nccit细胞蛋白或纯化后的his-smad3蛋白。
46.由于该gst-pull down方法采用的gst-baf45d融合蛋白高效率的表达,且具有较高的蛋白活性,将其与人胚胎干细胞裂解总蛋白结合孵育,可简便的筛选出与目的蛋白结合的人胚胎干细胞来源的蛋白,可降低gst-pull down方法的实验难度。
47.下面结合具体的实施例对本发明的技术方案进行更加清楚完整的说明。
48.实施例1bl21菌种与rosseta菌种gst融合蛋白的诱导表达
49.将pgex-5x-1-baf45d重组阳性质粒转化e.coli rosetta(de3)菌株、pgex-5x-1质粒转化e.coli bl21菌株(作为阴性对照),获得已转入质粒大肠杆菌菌种gst-bl21,gst-baf45d-rosseta(均为本实验室制备保存);
50.分别挑取大肠杆菌菌种(gst-bl21,gst-baf45d-rosseta)接种于8ml lb液体培养基中,于37℃、270rpm的恒温震荡培养箱震荡过夜,获得过夜培养物;
51.将过夜培养物分别按1:100的体积比接种到lb液体培养基中,于37℃、270rpm震荡培养2-4h至od
600
约为0.6(酶标仪96孔板吸收光600nm检测);分别加入100mm iptg至终浓度为0.3mm;于30℃、250rpm震荡培养诱导5h,获得离心培养物及诱导前对照,室温下12000r离心10min,弃去上清;以100ml菌液的沉淀比6ml裂解液(组成为50mm tris、1mm edta、1%tritonx100、5mm dtt、2mm pmsf,ph=8)的比例将菌体沉淀悬起,将菌体诱导前后样本分别收集到50ml离心管中进行冰浴超声破碎,其中,超声50%功率(425w),超声开4s,停8s,工作5min;于4℃、12000r离心10min弃沉淀留上清,沉淀可置于-80℃保存备用,并经sds-page鉴定后再经考马斯亮蓝染色鉴定(结果见图1)。
52.图1中显示已转入质粒大肠杆菌菌种gst-bl21诱导表达后总蛋白在分子量26kda处有大量蛋白表达,gst-baf45d-rosseta菌种诱导表达后总蛋白在分子量70kda处有大量表达。
53.实施例2gst蛋白与gst-baf45d融合蛋白的纯化
54.取gst resin(transgen公司,code#dp201-01)试剂瓶,轻轻摇晃之,使其形成完全混悬液。移液吸头前端剪掉少许,扩大开口,每组取40μl于ep管中;使用1
×
pbs(ph7.4)清洗glutathione-sepharose 4b磁珠,每组1000μl,混匀,于4℃、12000rpm下离心3min,弃去上
清,共清洗三次;
55.取实施例1中菌体上清液即两种经gst-bl21、gst-baf45d-rosseta裂解的gst总蛋白和gst-baf45d总蛋白各1000μl分别加入清洗后的gst resin试剂瓶中,于4℃圆盘旋转混匀仪上孵育3小时后,再于4℃、12000rpm离心5min,弃去上清;使用1000μl超声裂解液(50mm tris、1mm edta、1%tritonx100、5mm dtt、2mm pmsf,浓hcl调ph=8)洗杂质蛋白,在冰上振摇5min,4℃、12000rpm离心1min,弃去上清;重复洗杂质蛋白3次后,沉淀中分别加入100μl洗脱液,并封口膜封口,于4℃旋转孵育1h。分别加入6x上样缓冲液,100℃水浴5min,sds-page鉴定纯化效果,结果见图1。
56.图1结果显示用gst resin ep管内纯化诱导表达的gst-baf45d蛋白,得到大小约为72kda的融合蛋白,纯化gst蛋白约为26kda。
57.实施例3gs-pull down下拉h9细胞和nccit细胞蛋白方法
58.准备matrigel(corning,ref356234)包被的六孔细胞培养板,消毒、紫外照射冰盒及160微升matrigel胶(冰上化冻)、六孔板、15ml离心管、10ml移液管、移液器、废液缸三十分钟以上;
59.打开超净台日光灯、风机,点燃酒精灯;
60.将dmem/f-12、1ml及200μl无菌吸头喷酒精消毒放进超净台,酒精灯灼烧瓶口后用移液管吸取12ml dmem/f-12于15ml离心管中,置于冰上。移液器吸取160微升matrigel胶,转移至12mldmem/f-12中,迅速混匀。转移至六孔板中,每孔1ml,轻轻晃动使液体分布均匀。室温放置1h或封口膜封口置于4℃备用。
61.h9细胞复苏传代及诱导
62.消毒预热dmem/f-12(hyclone,sh30023.01)(培养基)、mtesr
tm
1(stem cell technologies,#85850)(人胚胎干细胞培养基);快速在37℃水浴锅中轻柔持续摇动冷冻管解冻h9细胞,直至只剩下一个小冷冻团取出冻存管,酒精消毒;使用2ml的移液管将冻存管中液体转移至15ml离心管中;向离心管中逐滴加入dmem/f-12共7ml,室温500rpm离心细胞5min;弃置上清液,用移液管轻轻将细胞重新悬浮在2ml的mtesr
tm
1中,吹打一次保持细胞聚集状态;轻轻将培养板倾斜,用移液枪吸取多余的matrigel溶液,将含有细胞聚集体的mtesr
tm
1培养液转移至matrigel胶包被过的培养板上(1ml/孔);每孔再加入1ml的mtesr
tm
1培养液,放入37℃、5%co2培养箱中,快速前后左右晃动培养板使细胞团分散均匀。每天更换培养液mtesr
tm
1(2ml/孔);待生长至70%时进行传代(1:3),h9细胞经含终浓度10um y27623的mtesr
tm
1培养液在37℃培养箱孵育1h。使用accutase进行消化(1ml/孔)37℃消化6~8min,使用dmem/f12终止消化,吹打细胞脱落后转移至15ml离心管中。室温500rpm离心5min,弃去上清,使用含10um y27623的mtesr1培养液重悬细胞,吹打使之分散为单细胞状态,转移至matrigel胶包被过的六孔培养板上(2ml/孔),前后左右晃动培养板使细胞团分散均匀。次日更换为mtesr
tm
1及含5μm维甲酸(ra)的mtesrtm1培养液(2ml/孔)。培养五天,每天更换培养液。第五天收取细胞。
63.nccit细胞复苏传代及诱导
64.消毒预热rpmi-1640(hyclone,sh30809.01)完全培养液、pbs,紫外照射150mm细胞培养皿、15ml离心管、无菌移液吸头、移液器、废液缸三十分钟以上。打开超净台日光灯、风机,点燃酒精灯。液氮中取出冻存的nccit细胞,迅速置于37℃水浴锅中摇动,直至只剩下一
个小冷冻团取出冻存管,酒精消毒拿入超净台,转移至15ml离心管中,加入5ml pbs,室温1000rpm离心5min弃去上清。使用rpmi-1640培养液重悬细胞,转移至150mm细胞培养皿中,隔天更换rpmi-1640培养液。生长密度达75%时传代种板,使用0.5%胰酶消化液室温消化2min,加入pbs终止消化,使用移液器吹打细胞使细胞脱落,转移至15ml离心管中,室温1000rpm离心5min。使用rpmi-1640培养液重悬细胞,以1.5x106/皿(100mm)接种,生长48h后加维甲酸(ra)处理。诱导:视黄酸10μmol/l(1:1000)溶于rpmi-1640培养液中,每天更换培养液10ml/皿。诱导8d收取细胞。
65.h9/nccit细胞蛋白提取
66.将细胞密度达90%以上的细胞从培养箱取出;预冷1ml无菌吸头、pbs,冰上吸取培养液弃置,再加入预冷的pbs洗培养板1-2次。加入1ml/孔pbs,使用用细胞刮刮取皿底细胞,收集至1.5mlep管中,4℃,12000rpm,离心2min;弃上清,保留沉淀;再向每管加入150-200μl np-40裂解液,冰上裂解15-30min,期间用枪头吹打或轻弹ep管,4℃,12000rpm,离心20min,取上清转移至新的ep管,采用bca法测定蛋白浓度。
67.gst-pull down
68.将实施例2获得纯化的gst融合蛋白(gst、gst-baf45d)分别加入800μl h9细胞蛋白及nccit细胞蛋白4℃旋转孵育过夜;4℃,3000rpm,离心5min,弃上清,沿壁缓慢加入1ml np-40裂解液清洗beads;4℃,3000rpm,离心5min,弃上清,重复清洗beads 5-6次;弃上清,连同input加入sd上样缓冲液,一起100℃煮沸5min。
69.sds-page后进行western blot验证。上样顺序:input、
①
gst-beads pull-down、
②
gst-baf45d beads pull-down。结果见图2和图3。
70.图2a中显示gst和gst-baf45d融合蛋白分别与诱导前(0d)和诱导后(5d)h9细胞裂解液孵育和沉淀。反复洗涤后,进行sds-page和western blot免疫印迹分析鉴定,用抗体筛选鉴定与gst-baf45d相互作用蛋白磷酸化smad3(psmad3);显示h9未诱导正常培养细胞中,gst-baf45d与psmad3有相互作用,h9细胞经维甲酸(ra)诱导后psmad3增多,并且也与gst-baf45d有相互作用;oct4是人胚胎干细胞特征蛋白,诱导分化后表达减少几乎消失。图2b中显示,实验a所获pvdf膜经丽春红染色显示gst和gst-baf45d纯化蛋白。
71.图3a显示gst和gst-baf45d纯化蛋白分别与诱导前(0d)和诱导后(8d)nccit细胞裂解液孵育和沉淀。反复洗涤后,进行sds-page、转膜和western blot免疫印迹分析鉴定,用抗体筛选鉴定与gst-baf45d相互作用蛋白磷酸化smad3(psmad3)。oct4是人胚胎干细胞特征蛋白,诱导分化后表达减少几乎消失。图3b中显示,实验a所获pvdf膜经丽春红染色显示gst和gst-baf45d纯化蛋白。nccit细胞结果与h9细胞结果吻合。
72.实施例4 gs-pull down下拉纯化重组蛋白his-smad3方法
73.将实施例2中纯化后的融合蛋白(gst、gst-baf45d)分别加入10μg纯化的重组人smad3蛋白(ab89353),pbs补充体积至2ml,4℃旋转孵育过夜;4℃,3000rpm,离心5min,弃上清;沿壁缓慢加入1ml ripa清洗beads;4℃,3000rpm,离心5min,弃上清,重复清洗beads 5-6次;弃上清,加入sds上样缓冲液,连同input(0.25μg smad3)一起100℃煮沸10min。western blot分析,上样顺序:input、gst-beads pull-down、gst-baf45d beads pull-down。
74.结果如图4中所示的,可以看到gst-baf45d与his-smad3有体外结合现象,说明
gst-baf45d与his-smad3有直接相互作用。
75.通过上述实施例可以看出,本发明中的人baf45d融合蛋白表达和纯化方法能够获得高效、高活性的gst-baf45d融合蛋白,该gst-baf45d融合蛋白可用于寻找并鉴定人胚胎干细胞来源的真核蛋白的结合蛋白,且降低了gst-pull down方法的难度。
76.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
77.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。