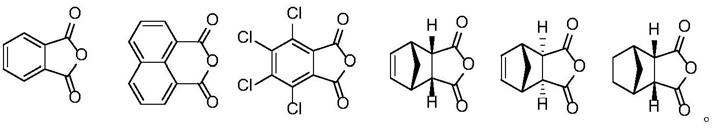
1.本发明涉及过渡金属催化反应的配体技术领域,具体涉及一种手性酰胺类化合物及其合成方法。
背景技术:
2.在有机化合物的转化中,选择合适的催化体系是至关重要的,而过渡金属催化在整个有机化学反应中起着至关重要的影响作用。过渡金属催化的不对称c
‑
h键活化符合原子和步骤经济性,是获取手性化合物的重要手段。金属钯催化与单保护氨基酸(mpaas)作为双齿手性配体的c
‑
h活化中取得了不错的效果。同时,经过cramer组的开创性工作以来,其他组也合成了几种类型的手性环戊二烯基配体及其金属配合物,在c
‑
h对映选择性功能化反应中取得了不错的效果。此外,非手性cp*m(m=rh,co,ir)配合物和单齿手性羧酸(cca)的结合已经成为一种替代策略,最近也有课题组采用对伞花烃氯化钌和手性羧酸也实现了硫手性化合物的合成。
3.然而不同的催化反应使用到的配体是不尽相同的,为了适应底物的多样性,开发新的配体显得十分重要。
技术实现要素:
4.针对现有技术中的不足之处,本发明旨在提供一种新型酰胺类化合物,其可作为配体与金属催化剂共同作用实现不对称c
‑
h键活化,且对底物适应性强,催化效率高。
5.为实现上述目的,本发明提供如下技术方案:
6.一种手性酰胺类化合物,具有如下结构式:
7.r选自
‑
h、
‑
ch3、
‑
ch2ch(ch3)2、
‑
och3、
‑
och2ch3、
‑
och(ch3)2、
‑
och(ch3)3、
‑
och(ch2ch3)2、中的一种;r1为叔丁基、甲基、苄基或异丁基;表示含芳环的取代基。
8.本发明进一步提供如上所述的手性酰胺类化合物的合成方法,包括如下步骤:
9.s1:将带有取代基的环状二羧酸酐和α
‑
氨基酸与甲苯一同加入到反应瓶中,于110℃下反应12h,得到产物1;
10.s2:将产物1、草酰氯、n,n
‑
二甲基甲酰胺和二氯甲烷全部添加到反应瓶中,在40℃下反应3h,然后将挥发物抽干得到产物2;
11.s3:将产物2、胺类化合物、三乙胺溶于二氯甲烷中,室温下反应3h,通过薄层色谱法或柱层析法分离得到目标产物手性酰胺类化合物。
12.优选地,所述带有取代基的环状二羧酸酐和α
‑
氨基酸的摩尔比为1:1;所述产物1与草酰氯的摩尔比为1:1.5;所述产物2与胺类化合物、三乙胺的摩尔比为1:1:1.5。
13.优选地,所述带有取代基的环状二羧酸酐选自如下结构式中的一种
14.优选地,所述α
‑
氨基酸选自丙氨酸、亮氨酸、苯丙氨酸、l
‑
叔亮氨酸中的一种。
15.优选地,所述胺类化合物的结构通式为rnh2;其中,r选自
‑
h、
‑
ch3、
‑
ch2ch(ch3)2、
‑
och3、
‑
och2ch3、
‑
och(ch3)2、
‑
och(ch3)3、
‑
och(ch2ch3)2、中的一种。
16.本发明的有益效果是:本发明以手性氨基酸为原料,通过简单的三步法合成酰胺类化合物,收率较高,得到的化合物的手性由原料氨基酸的手性决定,底物选择范围广;且得到的酰胺类化合物可作为配体,其具有多个位点可以修饰,既可以改变配体的电性,也可以增加配体的位阻,从而可以适应不同的催化反应,特别适用于制备膦手性化合物。
具体实施方式
17.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
18.此外,下面所描述的本发明不同实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。
19.本发明一种手性酰胺类化合物的合成方法,其合成路线如下所示:
20.第一步:取100ml圆底烧瓶,将手性α
‑
氨基酸(10mmol,1.0equiv.)、带有取代基的环状二羧酸酐(10mmol,1.0equiv.)、et3n(10mmol,1equiv.)溶于20ml甲苯中,于110℃下加热12小时。待冷却至室温后,拉干反应体系,所得的产物1无需进一步提纯即可用于下一步。
[0021][0022]
其中α
‑
氨基酸选自丙氨酸、亮氨酸、苯丙氨酸、l
‑
叔亮氨酸中的一种,即r1为叔丁基、甲基、苄基或异丁基;带有取代基的环状二羧酸酐优选为如下结构式中的一种
[0023]
第二步:取100ml圆底烧瓶,将产物1溶于30ml无水二氯甲烷,加入两滴n,n
‑
二甲基甲酰胺,滴加草酰氯(15mmol),在40℃下反应3h,然后将挥发物抽干得到产物2。
[0024][0025]
第三步:取100ml圆底烧瓶,将烷基胺(10mmol)或烷氧基胺(10mmol)与三乙胺(15mmol)溶于无水二氯甲烷(20ml)。将上一步制得的酰氯溶于10ml二氯甲烷,再滴加进胺溶液。室温反应3小时。拉干反应溶液,通过薄层色谱法或柱层析法分离得到产物。
[0026][0027]
r选自
‑
h、
‑
ch3、
‑
ch2ch(ch3)2、
‑
och3、
‑
och2ch3、
‑
och(ch3)2、
‑
och(ch3)3、
‑
och(ch2ch3)2、中的一种。
[0028]
通过任意组合上述原料,可得到如下具体实施例。
[0029]
实施例1:
[0030]
白色固体,90%收率。
[0031]1h nmr(400mhz,d2o:(cd3)2co=3:1)δ7.66
–
7.53(m,4h),4.35(s,1h),1.08(s,9h).
13
c nmr(101mhz,d2o:(cd3)2co=3:1)δ174.5,172.9,170.7,134.8,134.2,131.1,130.9,128.3,127.9,62.1,33.9,26.4.hrms(esi,m/z)calcd for c
14
h
17
n2o3[m h]
:261.1234,found 261.1229.
[0032]
实施例2:
[0033]
白色固体,95%收率。
[0034]1h nmr(400mhz,cdcl3)δ7.92
–
7.84(m,2h),7.82
–
7.75(m,2h),7.41(s,1h),4.82(s,1h),2.81(s,3h),1.13(s,9h).
13
c nmr(101mhz,cdcl3)δ169.1,167.7,134.5,131.2,123.6,65.7,47.1,36.0,28.3,28.2,20.2.hrms(esi,m/z)calcd for c
15
h
18
n2nao3[m na]
:297.1210,found 297.1215.
[0035]
实施例3:
[0036]
白色固体,95%收率。
[0037]1h nmr(400mhz,cdcl3)δ10.36(s,1h),7.92
–
7.85(m,2h),7.83
–
7.76(m,2h),4.78
(s,1h),3.76(s,3h),1.13(s,9h).
13
c nmr(101mhz,cdcl3)δ168.7,165.6,134.5,131.0,123.6,64.1,62.8,36.1,27.8.hrms(esi,m/z)calcd for c
15
h
18
n2nao4[m na]
:313.1159,found 313.1166.
[0038]
实施例4:
[0039]
白色固体,92%收率。
[0040]1h nmr(400mhz,cdcl3)δ10.26(s,1h),7.92
–
7.86(m,2h),7.82
–
7.76(m,2h),4.81(s,1h),3.97(s,2h),1.25(t,j=6.8hz,3h),1.13(s,9h).
13
c nmr(101mhz,cdcl3)δ168.8,165.7,134.5,131.1,123.7,72.0,63.4,36.2,27.9,13.3.hrms(esi,m/z)calcd for c
16
h
20
n2nao4[m na]
:327.1315,found 327.1321.
[0041]
实施例5:
[0042]
白色固体,95%收率。
[0043]1h nmr(400mhz,cdcl3)δ10.13(s,1h),7.94
–
7.74(m,4h),4.84(s,1h),4.14(s,1h),1.24(t,j=7.2hz,6h),1.14(s,9h).
13
c nmr(101mhz,cdcl3)δ168.9,165.8,134.6,131.1,123.7,77.8,63.7,36.2,28.0,20.5.hrms(esi,m/z)calcd for c
17
h
22
n2nao4[m na]
:341.1472,found 341.1476.
[0044]
实施例6:
[0045]
白色固体,90%收率。
[0046]1h nmr(400mhz,cdcl3)δ9.89(s,1h),7.92
–
7.84(m,2h),7.84
–
7.76(m,2h),4.89(s,1h),1.27(s,9h),1.15(s,9h).
13
c nmr(101mhz,cdcl3)δ168.9,166.4,134.5,131.0,123.6,81.7,63.8,36.2,28.0,26.2.hrms(esi,m/z)calcd for c
18
h
24
n2nao4[m na]
:355.1628,found 355.1630.
[0047]
实施例7:
[0048]
白色固体,95%收率。
[0049]1h nmr(400mhz,cdcl3)δ10.04(s,1h),7.93
–
7.85(m,2h),7.83
–
7.75(m,2h),4.87(s,1h),3.74(s,1h),1.68
–
1.53(m,4h),1.14(s,9h),0.95(t,j=7.2hz,6h).
13
c nmr
(101mhz,cdcl3)δ169.0,165.6,134.6,131.0,123.7,87.8,64.1,36.2,28.1,24.3,9.3,9.2.hrms(esi,m/z)calcd for c
19
h
26
n2nao4[m na]
:369.1785,found 369.1784.
[0050]
实施例8:
[0051]
白色固体,90%收率。
[0052]1h nmr(400mhz,cdcl3)δ10.14(s,1h),7.84(d,j=38.0hz,4h),4.85(s,1h),3.85(s,1h),2.01
–
1.87(m,2h),1.74(s,2h),1.55
–
1.02(m,15h).
13
c nmr(101mhz,cdcl3)δ169.0,165.7,134.6,131.1,123.7,83.0,63.9,36.2,30.5,28.1,25.4,23.6.hrms(esi,m/z)calcd for c
20
h
26
n2nao4[m na]
:381.1785,found 381.1791.
[0053]
实施例9:
[0054]
白色固体,85%收率。
[0055]1h nmr(400mhz,cdcl3)δ10.01(s,1h),6.32(s,2h),4.64(s,1h),3.78(s,1h),3.30(s,2h),2.75(s,2h),1.92(s,2h),1.74(s,2h),1.56
–
1.16(m,8h),1.09(s,9h).
13
c nmr(101mhz,cdcl3)δ179.2,178.2,165.8,137.8,137.7,83.0,64.4,47.40,47.4,45.5,45.4,42.9,35.8,30.4,28.1,25.4,23.5.hrms(esi,m/z)calcd for c
21
h
30
n2nao4[m na]
:397.2098,found 397.2102.
[0056]
实施例10:
[0057]
白色固体,85%收率。
[0058]1h nmr(400mhz,cdcl3)δ9.93(s,1h),6.16(s,2h),4.52(s,1h),3.78(s,1h),3.43(s,2h),3.35(s,2h),1.92(s,2h),1.75(s,2h),1.63
–
1.19(m,8h),1.03(s,9h).
13
c nmr(101mhz,cdcl3)δ178.5,165.5,135.0,134.6,82.9,64.3,52.4,45.7,45.4,45.2,45.1,35.7,30.4,28.1,25.34,23.5,23.5.hrms(esi,m/z)calcd for c
21
h
30
n2nao4[m na]
:397.2098,found 397.2099.
[0059]
实施例11:
[0060]
白色固体,80%收率。
[0061]1h nmr(400mhz,cdcl3)δ10.07(s,1h),4.71(s,1h),3.79(s,1h),2.80(s,2h),
2.00
–
1.89(m,2h),1.81
–
1.72(m,2h),1.70
–
1.18(m,14h),1.10(s,9h).
13
c nmr(101mhz,cdcl3)δ180.1,178.9,165.9,83.2,64.9,48.5,48.3,42.2,39.5,39.4,35.7,30.5,28.2,25.5,24.7,24.7,23.7,23.6.hrms(esi,m/z)calcd for c
21
h
32
n2nao4[m na]
:399.2254,found 397.2261.
[0062]
实施例12:
[0063]
白色固体,93%收率。
[0064]1h nmr(400mhz,cdcl3)δ7.94
–
7.86(m,2h),7.82
‑
7.76(m,2h),7.58(t,j=5.6hz,1h),4.86(s,1h),3.23(dt,j=12.8,6.4hz,1h),2.98(ddd,j=13.2,6.8,5.2hz,1h),1.90
–
1.75(m,1h),1.15(s,9h),0.93(d,j=6.8hz,6h).
13
c nmr(101mhz,cdcl3)δ169.1,167.7,134.5,131.2,123.6,65.7,47.1,36.0,28.3,28.2,20.2.hrms(esi,m/z)calcd for c
18
h
24
n2nao3[m na]
:339.1679,found 339.1688.
[0065]
实施例13:
[0066]
白色固体,45%收率。
[0067]1h nmr(400mhz,cdcl3)δ9.7(s,1h),4.77(s,1h),3.82(s,1h),1.95
–
1.86(m,2h),1.73(s,2h),1.56
–
1.49(m,1h),1.45
–
1.1(m,14h).
13
c nmr(101mhz,cdcl3)δ165.1,164.1,140.7,130.1,126.8,83.3,63.8,36.1,30.5,28.1,25.4,23.7.hrms(esi,m/z)calcd for c
20
h
22
n2cl4nao4[m na]
:517.0226,found 517.0216.
[0068]
实施例14:
[0069]
白色固体,65%收率。
[0070]1h nmr(400mhz,cdcl3)δ8.9(s,1h),8.5(d,j=40.8hz,2h),8.18(s,2h),7.83
–
7.50(m,2h),5.52(s,1h),3.81(s,1h),1.95(d,j=10.0hz,1h),1.86(d,j=10.0hz,1h),1.74
–
1.58(m,2h),1.52
–
1.05(m,15h).
13
c nmr(101mhz,cdcl3)δ168.3,164.9,163.9,134.0,131.6,131.3,127.7,126.9,122.3,121.9,82.94,59.1,36.5,30.4,28.4,25.4,23.6,23.6.hrms(esi,m/z)calcd for c
24
h
28
n2nao4[m na]
:431.1941,found 431.1937.
[0071]
实施例15:
[0072]
白色固体,87%收率。
[0073]1h nmr(400mhz,cdcl3)δ9.45(d,j=15.2hz,1h),7.86
–
7.81(m,2h),7.76
‑
7.71(m,2h),4.91(s,1h),3.84(s,1h),1.92(s,3h),1.68(d,j=7.2hz,5h),1.55
–
1.10(m,8h).
13
c nmr(101mhz,cdcl3)δ167.6,167.2,134.1,131.6,123.3,83.2,47.9,30.3,25.3,23.5,15.1.hrms(esi,m/z)calcd for c
17
h
20
n2nao4[m na]
:339.1315,found 339.1320.
[0074]
实施例16:
[0075]
白色固体,90%收率。
[0076]1h nmr(400mhz,cdcl3)δ9.32(s,1h),7.89
–
7.83(m,2h),7.78
–
7.71(m,2h),4.91(s,1h),3.84(s,1h),2.32(s,1h),1.97
–
1.70(m,5h),1.55
–
1.17(m,7h),0.93(d,j=6.4hz,6h).
13
c nmr(101mhz,cdcl3)δ167.8,166.4,136.2,134.1,131.2,128.8,128.5,126.8,123.4,83.3,54.3,34.7,30.3,25.4,23.6.hrms(esi,m/z)calcd for c
20
h
26
n2nao4[m na]
:381.1785,found 381.1790.
[0077]
实施例17:
[0078]
白色固体,75%收率。
[0079]1h nmr(400mhz,cdcl3)δ9.34(s,1h),7.78
–
7.70(m,2h),7.70
–
7.60(m,2h),7.20
–
7.06(m,5h),5.08(t,j=8.0hz,1h),3.82(s,1h),3.54(q,j=13.0,10.2hz,2h),1.90(s,2h),1.77
–
1.67(m,2h),1.55
–
1.10(m,6h).
13
c nmr(101mhz,cdcl3)δ167.8,166.4,136.2,134.1,131.2,128.8,128.5,126.8,123.4,83.3,54.3,34.7,30.3,25.4,23.6,23.6.hrms(esi,m/z)calcd for c
23
h
24
n2nao4[m na]
:415.1628,found 415.1631.
[0080]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的示例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。