一种itch基因敲除细胞株及其应用
技术领域
1.本发明涉及生物技术领域,具体涉及一种itch基因敲除细胞株及其应用。
背景技术:
2.itch,又称atrophin 1相互作用蛋白4(atrophin 1-interacting protein 4,aip4),最初是在研究小鼠表皮颜色时被发现的,因与皮肤瘙痒有关而命名。itch是一种高度保守的hect家族e3泛素连接酶,相对分子质量为113000,是含有854个氨基酸残基的单体蛋白,其结构包括:1个n端c2结构域,介导募集的底物蛋白进入细胞膜内;4个ww结构域介导与靶蛋白特异性相互作用,可募集具有丝氨酸/苏氨酸磷酸化位点或含ppxy结构域的底物蛋白;1个c端hect结构域可将活化的泛素分子由e2泛素结合酶转移至靶蛋白;1个prd结构域位于第195-246个氨基酸残基之间,参与分拣连接蛋白9(sorting nexin 9,snx9)等底物蛋白的募集。生理情况下,itch的ww结构域与含ppxy基序的底物特异结合,催化其泛素化并经蛋白酶体降解,参与底物介导的免疫调控、细胞周期等多种生物过程。已有研究显示,itch的作用靶点是多种信号通路的核心参与调控者,itch调控了一系列重要因子的泛素化降解过程,如c-jun、junb、notch、p73、p63、cflip、chcr4等。编码人类itch的基因的一个截断突变会导致炎症性疾病,包括肠病。近年来对于itch的研究有所欠缺,具体的分子机制有待更深一步研究。因此,构建itch基因敲除细胞株,在体外和体内研究itch基因的功能,对于研究itch在相关的多种信号通路中的作用机制具有重要意义。
3.实验室目前普遍使用的载体质粒可以将grna序列插入到u6启动子,当把该质粒转入细胞之后,质粒将表达特异性grna和cas9,在grna的介导下,cas9对基因进行切割。但是存在的难题是,被剪切的基因在细胞自我修复的过程中存在引入移码造成目的基因缺失的现象,转染后的细胞中存在转染效率低的现象,并且经过细胞自我修复后目的基因可能出现仅突变而没有发生移码的现象。
4.此外,基因敲除实验中蛋白质水平的验证也非常关键。蛋白水平的验证通常是通过western blot实现的,但以下两种常见现象,有可能导致截短蛋白仍然表达,从而致使wb验证时出现阳性情况。(1)基因产生移码突变后,下游atg密码子有可能启动翻译,从而导致蛋白表达。或者位于移码突变上游的外显子翻译表达,产生n末端截短蛋白。(2)细胞跳过被编辑的外显子翻译表达,产生内部序列缺失的蛋白质异构体。这些情况将会干扰wb验证结果及后续功能实验,因此,开发一种稳定敲除itch基因的nih-3t3细胞株及其应用具有重要意义。
技术实现要素:
5.为了解决上述技术问题,为了实现itch在相关的多种信号通路中的作用机制的进一步研究,本发明提供了一种稳定敲除itch基因的nih-3t3细胞株及其应用。本发明不仅为研究其分子机制提供了有效工具,还对发现其作为新型的药物靶标和药物发现提供了重要的研究思路。
6.发明目的
7.本发明的第一个目的在于提供一种敲除itch基因的sgrna序列。
8.本发明的第二个目的在于提供一种itch基因敲除细胞株。
9.本发明的第三个目的在于进一步提供itch基因敲除细胞株的应用。
10.技术方案
11.一种细胞株,其特征在于:所述细胞株为itch基因敲除的细胞株。
12.所述的细胞株,其特征在于通过基因编辑技术实现敲除,其中sgrna序列为
13.sgrna-a1:actgcatgagccgctgcctgagg
14.sgrna-a2:agtgttgccactgaagaaactgg。
15.所述的细胞株,其特征在于在小鼠胚胎成纤维细胞nih-3t3细胞基因组上敲除itch基因。
16.所述的细胞株在构建肺纤维化模型的应用。
17.有益效果
18.本发明相对于现有技术具有如下的优点及效果:
19.(1)本发明首次发现通过特异性靶向itch基因的sgrna,可构建itch基因敲除的nih-3t3细胞系。经过抗性筛选得到稳定敲除itch基因的细胞系,经过pcr实验及测序验证敲除itch基因成功。
20.(2)本发明构建的itch基因敲除的可传代小鼠胚胎成纤维细胞nih-3t3-itch-/-稳定细胞株,敲除细胞株活性、生长速度等方面均与对照细胞无明显差异,是较为理想的nih-3t3敲除的细胞模型。
21.(3)本发明构建的nih-3t3-itch-/-细胞系应用于肺纤维化模型,揭示了itch在肺纤维化中的作用,不仅为研究其分子机制,还对发现其作为新型的药物靶标和药物发现提供了重要的研究思路。
附图说明
22.图1是候选的待敲除外显子信息图。
23.图2是待敲除位点所在外显子图。
24.图3是pcr鉴定结果图。
25.图4是测序结果图。
26.图5是western blot结果图。
27.图6是细胞增殖测定结果图。
28.图7是α-sma(a)和col-l(b)测定结果图。
具体实施方式
29.下面将结合实施例对本发明的实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
30.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
31.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
32.本发明在ncbi查找小鼠itch基因(gene id:16396),找到该基因cds区,分析小鼠itch基因组结构,明确cds的外显子部分。选择外显子的原因在于,基因敲除的难度会随着敲除片段长度的增加而增加,而一般基因包含的外显子区都比较短,但内含子区却很大,敲除整个基因就会变得很困难。而且,在基因的内含子区,往往存在功能基因序列,有可能包含着其他基因的调控元件,如果全部敲除就会影响其他基因的表达,甚至影响了实验结果的可信度。因此,本发明根据外显子选择原理,首先找到该基因cds区,明确cds的外显子部分,避开靶向被跳跃的外显子,最终选择第四个外显子作为敲除位点。
33.根据靶位点的设计原理,进行小鼠itch基因的靶位点的筛选和针对该靶位点的sgrna的设计和筛选。考虑到脱靶效应和脱靶效率,首先通过软件对多组成对sgrna序列进行脱靶位点数预测,尽可能避免基因脱靶的产生。接下来对筛选出的特异性高,预测脱靶位点数少的多对sgrna序列进行可行性分析。综合考虑tm(56-62)、gc content(45~60%)及secondary structure来最终确定适合的sgrna序列。最终选择off-target较少的作为基因敲除的靶点,实现了小鼠itch基因的敲除和检测,并提供了itch基因敲除细胞株的应用。
34.以下实施例中以本发明设计的针对小鼠itch基因上下游各1个靶点为例进行效果说明。
35.实施例1特异性靶向小鼠itch基因的sgrna的获得和基因敲除载体的构建
36.1、敲除itch基因的外显子的确定
37.在编码基因敲除实验中,dna水平验证ko结果是首要的,此外,蛋白质水平的验证也非常关键。蛋白水平的验证通常是通过western blot实现的,但外显子跳跃,有可能导致截短蛋白仍然表达,从而致使wb验证时出现阳性情况。
38.因此,本发明根据外显子选择原理,首先找到该基因cds区,明确cds的外显子部分,候选的待敲除外显子如图1,分别为exon1、exon2、exon3、exon4、exon5、exon6,exon7。针对七个候选的待敲除外显子部分分别设计引物,用以识别位于潜在跳跃外显子上下游的外显子,以及预测的目的外显子。通过比较rt-qpcr结果,尽可能避免外显子跳跃的存在,以免影响基因敲除结果。如图2所示,最终筛选出第四个外显子(exon4)作为敲除位点。
39.2、特异性靶向小鼠itch基因的sgrna的获得
40.在基因敲除实验中,sgrna的选择将很大程度上影响敲除的成功率。在选择sgrna的时候,需要考虑到以下因素:1)预测sgrna效率;2)选择脱靶风险低的sgrna;3)同时使用多个sgrna以提高敲除效率。
41.本发明按照小鼠itch基因本身的性质,确定敲除位点后,根据sgrna设计原理,考虑到脱靶效应和脱靶效率,首先通过软件对多组成对sgrna序列进行脱靶位点数预测,尽可能避免基因脱靶的产生。接下来对筛选出的特异性高,预测脱靶位点数少的多对sgrna序列进行可行性分析。综合考虑tm(56-62)、gc content(45~60%)及secondary structure来最终确定适合的sgrna序列。
42.本发明以itch-201(ensembl transcript id为ensmust00000029126.15)为转录本,在exon4上下游各设计1个靶点,初选sgrna-1、sgrna-2和sgrna-3三条序列。序列如下:
43.sgrna-1-a1:agtcgctgtagtcgggctcggg
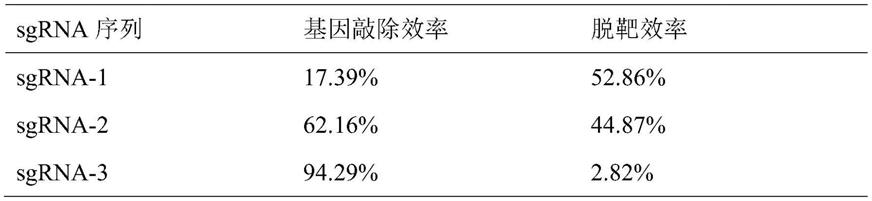
44.sgrna-1-a2:gtcgtcgccgccccgagtcccg
45.sgrna-2-a1:gtaacatgcatttcacagtggcct
46.sgrna-2-a2:tgactcagccattgagaacttcag
47.sgrna-3-a1:actgcatgagccgctgcctgagg
48.sgrna-3-a2:agtgttgccactgaagaaactgg
49.对sgrna序列基因敲除效率及脱靶效率进行检测,结果如表所示:
[0050][0051]
通过优化筛选,选择off-target较少的guide rna作为靶点,最终筛选获得了敲除效率最高的sgrna-3作为基因敲除的靶点。序列如下:
[0052]
sgrna-3-a1:actgcatgagccgctgcctgagg
[0053]
sgrna-3-a2:agtgttgccactgaagaaactgg
[0054]
3、基因敲除载体的构建
[0055]
复苏并扩大培养携带有tko179载体的菌株(购自湖南海星生物科技有限公司),按照诺唯赞dc201质粒提取试剂盒说明书,进行质粒提取,酶切后获得线性化载体tko179。将sgrna-3引物退火后与ddh2o、线性化载体tko179、t4dna ligase以及t4dna ligase buffer反应,然后转化大肠杆菌dh5α感受态,挑取反应得到的阳性单菌落进行pcr扩增验证,验证正确的即为含有特异性靶向鼠itch基因的sgrna-3的基因敲除载体tko179。
[0056]
实施例2itch基因的敲除和检测
[0057]
本实施例利用质粒转染法实现小鼠细胞itch基因的敲除,并对敲除细胞株进行检测。
[0058]
1、小鼠细胞itch基因的敲除
[0059]
(1)细胞培养与收集
[0060]
使用完全培养基复苏nih-3t3(小鼠胚胎成纤维细胞)细胞,传代3次后,待细胞进入对数生长期进行转染。转染前一天,将5
×
105~8
×
105个细胞接种至6孔板,并在每孔中加入2ml无抗生素培养基,当细胞密度达到70%-80%时进行转染。
[0061]
(2)转染
[0062]
按照rfect srna transfection reagent(购自常州百代生物科技股份有限公司)说明的要求,将含有特异性靶向小鼠itch基因的sgrna的基因敲除载体用rfect srna transfection reagent进行转染48h;以nc质粒(空质粒)作为对照。
[0063]
(3)药筛
[0064]
确定嘌呤霉素筛选浓度:以6孔板常规培养未转染质粒的nih-3t3细胞,分别加入0.5、1、1.5和2μg/ml嘌呤霉素的含10%fbs的nih-3t3细胞培养液,培养48h,确定将所有未转染的nih-3t3细胞杀死的最低浓度为1μg/ml;
[0065]
稳定细胞株的单克隆筛选:将转染后的细胞培养48h后,更换含1μg/ml嘌呤霉素的新鲜10%fbs的dmem细胞培养液培养24h,然后更换为含1.5μg/ml嘌呤霉素的新鲜10%fbs的dmem细胞培养液,继续培养24h。并在显微镜下观察,经嘌呤霉素筛选后的细胞数量。嘌呤
霉素筛选完成后换不加嘌呤霉素的培养液培养12h。
[0066]
(4)单克隆化
[0067]
将筛选后的细胞采用0.025%的胰酶消化,通过有限稀释法将细胞铺板于96孔板,进行敲除细胞的单克隆化。期间观察克隆生长状态,及时换液(贴壁细胞)或补液(悬浮细胞)。待克隆生长至足够数量,备份后送检pcr。
[0068]
2、itch基因表达水平的pcr鉴定
[0069]
提取克隆样品基因组进行pcr检测,鉴定grna打靶位点和敲除条带。结果如图3所示,初步判断敲除成功的单克隆细胞株。
[0070]
3、itch基因表达水平的测序鉴定
[0071]
将初步判断敲除成功的单克隆细胞株送检测序,测序结果如图4所示,经snapgene软件比对后确定敲除成功的单克隆细胞株。
[0072]
4、itch基因表达水平的western blot鉴定
[0073]
为了进一步验证敲除细胞株中itch的蛋白表达,通过rapi裂解液提取细胞总蛋白,以阴性克隆细胞株(wt)为对照组,western blot检测敲除后细胞itch的蛋白表达。结果如图5所示,在itch基因敲除细胞株中,未检测到itch蛋白的表达。
[0074]
实施例3itch基因敲除细胞株的应用
[0075]
1、肺纤维化细胞模型的构建
[0076]
(1)细胞培养
[0077]
使用完全培养基培养nih-3t3-itch-/-细胞株和nih-3t3-wt细胞株,待细胞进入对数生长期,将5
×
105~8
×
105个细胞接种至6孔板,并在每孔中加入2ml完全培养基,当细胞密度达到70%-80%时进行肺纤维化模型的构建。
[0078]
(2)模型的构建
[0079]
使用tgf-β1分别刺激nih-3t3-itch-/-细胞株和nih-3t3-wt细胞株,诱导肺纤维化细胞模型。
[0080]
2、细胞增殖的测定
[0081]
纤维性病灶是肺纤维化的基础病理改变。纤维性病灶的主要组成细胞是增殖的肌成纤维细胞和成纤维细胞。用cck-8法对细胞增殖进行检测,在肺纤维化模型下,检测nih-3t3-itch-/-细胞株和nih-3t3-wt细胞株的细胞增殖情况。结果如图6所示,nih-3t3-itch-/-细胞株可抑制肺纤维化造成的细胞异样增殖,揭示itch在肺纤维中具有一定的作用。
[0082]
3、α-sma和col-l的测定
[0083]
在活跃的纤维病灶中,肌成纤维细胞占主要地位,其中α-sma被认为是肌成纤维细胞形成过程的标志蛋白。肌成纤维细胞形成后,具有活跃的分泌胶原的能力,包括i型胶原等。通过pcr实验检测肺纤维化模型下,nih-3t3-itch-/-细胞株和nih-3t3-wt细胞株的α-sma、col-i表达情况,可揭示itch在肺纤维中的作用。结果如图7所示,与对照组相比,tgf-β1刺激后,nih-3t3-wt和nih-3t3-itch-/-细胞中α-sma、col-i的mrna水平均明显上调。说明tgf-β1刺激后,成纤维细胞激活,细胞内胶原积累,形成肺纤维化损伤。与nih-3t3-wt细胞相比,tgf-β1刺激后,nih-3t3-itch-/-细胞中α-sma、col-i的mrna水平上调幅度下降。说明itch的缺失能够抑制成纤维细胞的激活及细胞内胶原的积累,抵抗肺纤维化损伤。
[0084]
综上所述,利用本发明提供的特异性靶向小鼠itch基因的sgrna能够实现高效的
小鼠itch基因敲除;对该段基因组测序发现构建的细胞株十分稳定。且本发明提供的itch基因敲除细胞株的应用,揭示了itch在肺纤维化中的作用,为在体外和体内研究itch基因的功能提供了新的思路。
[0085]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。