使用与免疫检查点抑制剂组合递送的sirna沉默tgf-beta 1和cox2以治疗癌症
1.相关专利申请的交叉引用
2.本技术要求于2018年12月27日提交的美国临时专利申请第62/785,647号的权益和优先权,该申请通过引用整体并入本文。
技术领域
3.本发明涉及某些药物分子和组合物及其在治疗癌症中的用途,特别是涉及抑制tgf-beta 1和cox2的小干扰rna(sirna)分子单独使用或与免疫检查点抑制剂组合使用,用于治疗癌症的用途。
背景技术:
4.最近的工作已将免疫检查点抑制剂确定为对抗癌症的重要靶点。受体如pd-1(在t细胞表面)可以与肿瘤细胞表面的配体(例如pd-l1)相互作用,这些分子之间的这种结合导致向t细胞发出肿瘤不应该被破坏的信号。因此,已经对这种信号传导机制进行了彻底的研究以尝试确定阻断其的方法,从而促进对肿瘤的免疫识别,随之导致增加其产生的肿瘤杀伤。
5.已经发现了很多检查点,包括ctla4、lag3、tim3、pd-1和pd-l1。例如,抗pd1或抗pd-l1的抗体已被证明阻断pd-1受体和pd-l1配体之间的相互作用,这种阻断抑制从肿瘤细胞向t细胞发出的“不要吃我(do not eat me)”信号,否则该信号阻止t细胞通过释放杀伤细胞的酶来对肿瘤和其他外来细胞做出正常反应。
6.随着这些抗体(派姆单抗(pembrolizumab),可瑞达(keytruda)等)迁移至临床,发现用这些药剂治疗患者可以在约30%的患者中促进非常强的免疫反应,其导致这些患者的长期治疗。然而,不清楚为什么这种反应仅见于30%的受治疗的患者,因此研究已广泛关注可能在抑制免疫反应和t细胞的肿瘤细胞杀伤能力中发挥作用的其他通路和信号传导机制。
7.rna干扰(rnai)是一种序列特异性rna降解过程,其提供敲低(knockdown)或理论上沉默任何包含同源序列的基因的相对简单和直接的方法。在天然存在的rnai中,双链rna(dsrna)被rnase iii/解旋酶蛋白dicer切割成小干扰rna(sirna)分子,即19-27个核苷酸(nt)的在3’末端具有2-nt突出(overhang)的dsrna。然后,sirna整合至称为rna诱导沉默复合物(rna-induced-silencing-complex,risc)的多组分核糖核酸酶中。sirna的一条链保持与risc相关联以将复合物引导至同源rna,该rna具有与risc中的向导(guider)ss-sirna互补的序列。这种sirna引导的核酸内切酶消化rna,导致目标rna的截断和失活。最近的研究揭示了化学合成的21-27-nt sirna在哺乳动物细胞中表现出rnai作用的效用,并证明了sirna杂交(在末端或中间)的热力学稳定性在决定分子功能方面起着核心作用。科学文献中已描述了risc、sirna分子和rnai的更详细特征。
8.通过利用化学合成的sirna或内源性表达的sirna,已在实验室中成功证明了rnai
efflux,使用数字成像系统测量)来评估肿瘤的量。基于所有测试组中肿瘤的归一化,将动物分配至队列中。该图显示了分配至各组时产生的初始值——显示出开始治疗之前队列之间肿瘤大小的均匀性。
16.图3.在每次治疗后监测动物的体重,并对队列中所有动物的体重取平均值。数据作为给药前初始体重的百分比(%)绘图。
17.单独的索拉非尼(sorafenib,红色方块)诱导体重的轻微变化。然而,所有其他治疗方案(单独的stp707或 抗pdl1)都具有良好的耐受性,在治疗组中没有观察到显著的体重减少。
18.图4.通过将荧光素酶底物(荧光素)施用于麻醉动物,然后用ivis活体动物成像系统对产生的光进行成像,来进行肿瘤相关生物发光(tumor associated bioluminescence,tabl)测量。在整个给药阶段(灰色突出显示的区域)对动物施用治疗,并在其他时间进行未治疗的监测。
19.如较大的光信号所确定的,对照(载体)治疗的动物显示出肿瘤的快速生长。在给药阶段,索拉非尼和抗pdl1 mab治疗显示出对肿瘤生长的静态影响。stp707单独(每次注射40ug或约2mg/kg)或与抗pdl1 mab一起给药5至6次后,显示出肿瘤细胞的大幅减少。在这些治疗组中看不到肿瘤。
20.图5.对照(载体治疗的)动物显示出不受控制的肿瘤生长对动物生存力的大幅影响。由于在实验的给药阶段肿瘤负荷增加,50%的未治疗动物死亡或被安乐死。1只动物在索拉非尼治疗37天后被安乐死。在任何其他治疗组中没有动物死亡。
21.图6.数据显示,如使用ivis成像系统从动物外部读取流量(flux)所测量的,对照样品(加载有非沉默(non-silencing,ns)sirna的pnp)显示出肿瘤细胞生长的大幅增加。pdl1抗体显示出对肿瘤生长的微弱抑制作用。单独的stp707(1mg/kg)显示出比pdl1 ab甚至更大的肿瘤生长抑制作用,并且在抗pdl1 mab存在下,stp707在6次给药后完全消除了肿瘤——表明与抗体的作用具有一定的叠加性。
22.图7.将stp707施用于具有同基因原位hcc肿瘤的动物,1mg/kg给药3次,然后切除肝脏、切片和染色(h&e)以显示肿瘤位置和大小。注意到施用stp707这样短的一段时间时,肿瘤的大小大幅减小。在白框显示的区域中,通过染色和染色点计数来定量cd4 和cd8 t细胞的量。这些区域在每幅图的右侧放大,可以清楚地看到stp707治疗使肝脏-肿瘤边缘内存在的cd4 和cd8 t细胞数量产生大幅增加——表明stp707治疗使得更多的t细胞渗透至肿瘤中。
23.图8.使用与图7中所示图像相似的图像,在离开肿瘤边缘测量的各区段(segment)中(向内朝向肿瘤或向外朝向肝脏)进行t细胞定量。在每个区段(50um厚)内定量t细胞的数目并绘制在所示的图上。与单独的载体治疗相比,stp707与抗pdl1 ab一起治疗显示在肿瘤内500um深度处cd8 t细胞增加了2倍。其还显示在靠近肿瘤的肝脏内cd8 t细胞增加——表明围绕肿瘤的tgf-beta“壁(wall)”的降低可能诱导t细胞的募集。
具体实施方式
24.本发明涉及在受试者中抑制tgf-beta 1和cox2的小干扰rna(sirna)分子的用途,其单独或与免疫检查点抑制剂组合使用,用于在受试者中治疗癌症。如本文所用,术语“受
试者”是指任何哺乳动物,包括人。受试者可以是实验室动物,如啮齿动物、雪貂或非人灵长类动物。优选地,受试者是人。
25.在一个实施方案中,本发明涉及在受试者中杀伤癌细胞的方法,其通过向受试者施用治疗有效量的抗tgf-beta 1sirna进行。在该实施方案的一个方面,将抗tgf-beta 1sirna静脉内施用于受试者。在该实施方案的另一个方面,将抗tgf-beta 1sirna施用至受试者的肿瘤中。在该实施方案的又一个方面,将抗tgf-beta 1sirna在肿瘤附近施用或在允许递送至肿瘤的载体中全身施用。
26.在另一个实施方案中,本发明涉及在受试者中治疗癌的方法,其通过向受试者施用治疗有效量的抗tgf-beta 1sirna进行。在该实施方案的一个方面,将抗tgf-beta 1sirna静脉内施用于受试者。在该实施方案的另一个方面,将抗tgf-beta 1sirna施用至受试者的肿瘤中。在该实施方案的又一个方面,将抗tgf-beta 1sirna在肿瘤附近施用或在允许递送至肿瘤的载体中全身施用。
27.癌(和癌细胞)是任何折磨受试者的癌症。这样的癌症包括肝癌、结肠癌、胰腺癌、肺癌和膀胱癌。肝癌可以是原发性肝癌或从另外的组织转移至肝脏的癌。原发性肝癌包括肝细胞癌和肝母细胞瘤。转移癌包括结肠癌和胰腺癌。
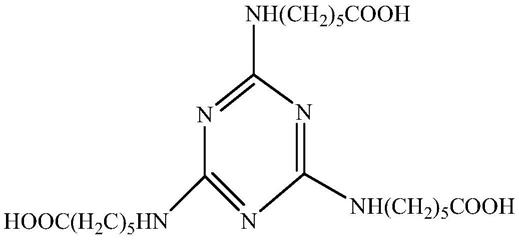
28.抗tgf-beta 1sirna分子包括表1中标识的序列。
29.表1:抗tgf-beta 1sirna序列
[0030][0031]
一方面,所述抗tgf-beta 1sirna包含以下序列:有义:5
’‑
cccaagggcuaccaugccaacuucu-3’;反义:5
’‑
agaaguuggcaugguagcccuuggg-3’。
[0032]
抗tgf-beta 1sirna在药学上可接受的载体中施用于受试者。这样的载体包括支化组氨酸-赖氨酸聚合物。在这样的聚合物的一个实施方案中,该聚合物具有式(r)k(r)-k(r)-(r)k(x),其中r=khhhkhhhkhhhkhhhk或r=khhhkhhhkhhhhkhhhk,x=c(o)nh2,k=赖氨酸,h=组氨酸。这样的聚合物与抗tgf-beta 1sirna形成纳米颗粒。该纳米颗粒可以静脉
内或瘤内施用于受试者。
[0033]
在另一个实施方案中,本发明涉及在受试者中杀伤癌细胞的方法,其通过向受试者一起施用治疗有效量的免疫检查点抑制剂与治疗有效量的抗tgf-beta 1sirna进行。在该实施方案的一个方面,一起施用免疫检查点抑制剂与抗tgf-beta1sirna增加了抗tgf-beta 1sirna的疗效。
[0034]
在另一个实施方案中,本发明涉及在受试者中治疗癌症的方法,其通过向受试者施用治疗有效量的免疫检查点抑制剂与治疗有效量的抗tgf-beta 1sirna进行。在该实施方案的一个方面,施用免疫检查点抑制剂与抗tgf-beta 1sirna增加了抗tgf-beta 1sirna的疗效。
[0035]
如上所述,将免疫检查点抑制剂和抗tgf-beta 1sirna静脉内施用于受试者、受试者的肿瘤中、肿瘤附近,或在允许递送至肿瘤的载体中全身施用。
[0036]
在该实施方案的一个方面,所述免疫检查点抑制剂是单克隆抗体,其阻断哺乳动物细胞(如人的细胞)上的受体(如pd-1、pd-l1、ctla4、lag3和tim3)与这些受体的配体之间的相互作用。在一个特别的方面,所述单克隆抗体是针对pd1或pdl1的单克隆抗体。单克隆抗体的示例包括阿特朱单抗(atezoluzimab)、德瓦鲁单抗(durvalumab)、纳武单抗(nivolumab)、派姆单抗(pembrolizumab)和伊匹单抗(ipilimumab)。
[0037]
在该实施方案的又一个方面,所述免疫检查点抑制剂是小分子,其阻断哺乳动物细胞(如人的细胞)上的受体(如pd-1、pd-l1、ctla4、lag3和tim3)与这些受体的配体之间的相互作用。在一个特别的方面,所述小分子阻断pd1和pdl1之间的结合。bms202和类似的配体是这样的小分子的示例。
[0038]
在一个进一步的实施方案中,本发明涉及在受试者中杀伤癌细胞的方法,其通过向受试者施用治疗有效量的抗cox-2sirna与治疗有效量的抗tgf-beta 1sirna进行。在该实施方案的一个方面,将该组合静脉内施用于受试者。在该实施方案的另一个方面,将该组合施用至受试者的肿瘤中。在该实施方案的又一个方面,将该组合在肿瘤附近施用或在允许递送至肿瘤的载体中全身施用。
[0039]
在一个又进一步的实施方案中,本发明涉及在受试者中治疗癌症的方法,其通过向受试者施用治疗有效量的抗cox-2sirna与治疗有效量的抗tgf-beta 1sirna进行。在该实施方案的一个方面,将该组合静脉内施用于受试者。在该实施方案的另一个方面,将该组合施用至受试者的肿瘤中。在该实施方案的又一个方面,将该组合在肿瘤附近施用或在允许递送至肿瘤的载体中全身施用。
[0040]
所述抗cox2 sirna分子包括表2中标识的序列。
[0041]
表2:抗cox2 sirna序列
[0042][0043]
一方面,所述抗cox2 sirna包含以下序列:有义:5
’‑
ggucuggugccuggucugaugaugu-3’;反义:5
’‑
acaucaucagaccaggcaccagacc-3’。
[0044]
抗tgf-beta 1sirna和抗cox2 sirna在药学上可接受的载体中施用。这样的载体包括支化组氨酸-赖氨酸聚合物。在这样的聚合物的一个实施方案中,该聚合物具有式(r)k(r)-k(r)-(r)k(x),其中r=khhhkhhhkhhhkhhhk或r=khhhkhhhkhhhhkhhhk,x=c(o)nh2,k=赖氨酸,h=组氨酸,n=天冬酰胺。这样的聚合物与抗tgf-beta 1sirna和抗cox2 sirna形成纳米颗粒。该纳米颗粒可以静脉内或瘤内施用于受试者。
[0045]
如上文所述,关于抗tgf-beta 1sirna,抗tgf-beta 1sirna和抗cox2 sirna的组合所靶向的癌(和癌细胞)可以是折磨受试者的任何癌。这样的癌包括肝癌、结肠癌、胰腺癌、肺癌和膀胱癌。肝癌可以是原发性肝癌或从另外的组织转移至肝脏的癌。原发性肝癌包括肝细胞癌和肝母细胞瘤。转移癌包括结肠癌和胰腺癌。
[0046]
在一个进一步的实施方案中,本发明涉及在受试者中杀伤癌细胞的方法,其通过向受试者施用治疗有效量的免疫检查点抑制剂与治疗有效量的抗tgf-beta 1sirna和治疗有效量的抗cox2 sirna进行。该方法所针对的癌细胞和癌是折磨受试者的任何癌,包括上述的那些癌。在该实施方案的一个方面,施用免疫检查点抑制剂与所述抗tgf-beta 1sirna和抗cox2 sirna增加了单独的任一sirna的疗效。
[0047]
在一个又进一步的实施方案中,本发明涉及在受试者中治疗癌症的方法,其通过向受试者施用治疗有效量的免疫检查点抑制剂与治疗有效量的抗tgf-beta 1sirna和治疗有效量的抗cox2 sirna进行。该方法所针对的癌细胞和癌是折磨受试者的任何癌,包括上述的那些癌。在该实施方案的一个方面,施用免疫检查点抑制剂与所述抗tgf-beta 1sirna和抗cox2 sirna增加了单独的任一sirna的疗效。
[0048]
如上所述,将免疫检查点抑制剂、抗tgf-beta 1sirna和抗cox2 sirna静脉内施用于受试者、受试者的肿瘤中、肿瘤附近,或在允许递送至肿瘤的载体中全身施用。
[0049]
与sirna分子组合施用的免疫检查点抑制剂是如上所述的单克隆抗体或小分子。其可以在sirna分子组合之前、之后或同时施用。
[0050]
本发明涉及某些药物组合物。在一个实施方案中,该组合物包含在如本文所述的药学上可接受的载体中的如本文所述的抗tgf-beta 1sirna。
[0051]
在另一个实施方案中,该药物组合物与如本文所述的免疫检查点抑制剂组合使用。因此,本发明的该实施方案涉及治疗性药物的组合,其包括免疫检查点抑制剂和药物组合物,所述药物组合物包含在如本文所述的药学上可接受的载体中的抗tgf-beta 1sirna。
[0052]
在另一个实施方案中,本发明涉及治疗性药物的组合,其包括免疫检查点抑制剂和药物组合物,所述药物组合物包含如本文所述的抗tgf-beta 1sirna、抗cox2 sirna和药学上可接受的载体。
[0053]
本文所述的治疗性药物组合还可用于增强免疫检查点抑制剂在患有癌症的受试者中的抗肿瘤疗效。将治疗有效量的包含抗tgf-beta 1sirna和抗cox2 sirna的药物组合物与治疗有效量的检查点抑制剂施用于受试者。抗tgf-beta 1sirna降低受试者对癌的炎症反应,并使得t细胞和其他免疫细胞更好地渗透至肿瘤中。与单独由检查点抑制剂造成的免疫反应相比,其还对受试者中的癌造成更强的免疫反应。这种反应涉及更强的t细胞激活和渗透至癌中。抗cox2 sirna降低受试者对癌的炎症反应和/或减少癌周围耗竭的t细胞(exhausted t-cell)或调节性t细胞的形成。
[0054]
本文所述的治疗性药物组合还可用于在受试者中抗原性地启动(priming)t细胞以识别和杀伤癌细胞,并可用于在受试者中促进t细胞介导的针对癌的免疫。向受试者施用治疗有效量的所述组合。所述癌是本文所述的那些。
[0055]
在一个特别的实施方案中,本发明涉及在受试者中治疗肝癌的方法,其通过向受试者施用治疗有效量的本发明的药物组合物或本发明的治疗性药物组合进行。在该实施方案的一个方面,所述肝癌是原发性肝癌。在一个特别的方面,所述原发性肝癌是肝细胞癌或肝母细胞瘤。在该实施方案的另一个方面,所述肝癌是从受试者体内的另外的组织转移至肝脏的癌。这样的转移癌包括结肠癌和胰腺癌。在该实施方案的一个方面,所述受试者是人。
[0056]
在另一个特别的实施方案中,本发明涉及在人中杀伤肝细胞癌细胞的方法,其包括向人施用治疗有效量的药物组合物,所述药物组合物包含在药学上可接受的载体中的抗tgf-beta 1sirna和抗cox2 sirna,所述载体包括支化组氨酸-赖氨酸聚合物,其与所述抗tgf-beta 1sirna和抗cox2 sirna形成纳米颗粒,其中所述抗tgf-beta 1sirna包含以下序列:有义:5
’‑
cccaagggcuaccaugccaacuucu-3’;反义:5
’‑
agaaguuggcaugguagcccuuggg-3’,并且所述抗cox2 sirna包含以下序列:有义:5
’‑
ggucuggugccuggucugaugaugu-3’;反义:5
’‑
acaucaucagaccaggcaccagacc-3’。
[0057]
在又一个特别的实施方案中,本发明涉及在人中杀伤肝细胞癌细胞的方法,其包括向人施用治疗有效量的免疫检查点抑制剂和药物组合物,所述药物组合物包含在药学上可接受的载体中的抗tgf-beta 1sirna和抗cox2 sirna,所述载体包括支化组氨酸-赖氨酸聚合物,其与所述抗tgf-beta 1sirna和抗cox2 sirna形成纳米颗粒,其中所述抗tgf-beta 1sirna包含以下序列:有义:5
’‑
cccaagggcuaccaugccaacuucu-3’;反义:5
’‑
agaaguuggcaugguagcccuuggg-3’,并且所述抗cox2 sirna包含以下序列:有义:5
’‑
ggucuggugccuggucugaugaugu-3’;反义:5
’‑
acaucaucagaccaggcaccagacc-3’,且其中所述检查点抑制剂包括能够结合并阻断pd1和pdl1之间相互作用的单克隆抗体。这样的单克隆抗体包括阿特朱单抗(atezoluzimab)、德瓦鲁单抗(durvalumab)、纳武单抗(nivolumab)、派姆单抗(pembrolizumab)和伊匹单抗(ipilimumab)。
[0058]
在一个进一步特别的实施方案中,本发明涉及治疗性药物的组合,其包含免疫检查点抑制剂和药物组合物,所述药物组合物包含在药学上可接受的载体中的抗tgf-beta 1sirna和抗cox2 sirna,其中所述免疫检查点抑制剂包括选自阿特朱单抗(atezoluzimab)、德瓦鲁单抗(durvalumab)、纳武单抗(nivolumab)、派姆单抗(pembrolizumab)和伊匹单抗(ipilimumab)的单克隆抗体,所述抗tgf-beta1sirna包含以下序列:有义:5
’‑
cccaagggcuaccaugccaacuucu-3’;反义:5
’‑
agaaguuggcaugguagcccuuggg-3’,所述抗cox2 sirna包含以下序列:有义:5
’‑
ggucuggugccuggucugaugaugu-3’;反义:5
’‑
acaucaucagaccaggcaccagacc-3’,并且所述药学上可接受的载体包括支化组氨酸-赖氨酸聚合物,其与抗tgf-beta 1sirna和抗cox2 sirna形成纳米颗粒。在该实施方案的一个方面,所述支化组氨酸-赖氨酸聚合物具有式(r)k(r)-k(r)-(r)k(x),其中r=khhhkhhhkhhhkhhhk或khhhkhhhkhhhhkhhhk,x=c(o)nh2,k=赖氨酸,h=组氨酸,n=天冬酰胺。
[0059]
定义
[0060]
肝癌是肝脏内的任何原发性癌,即在肝脏中开始的癌;或肝脏内的任何继发性癌,即从哺乳动物体内另外的组织转移至肝脏的癌。原发性肝癌的一个示例是肝细胞癌。继发性肝癌的一个示例是结肠癌。
[0061]
癌是任何恶性肿瘤。
[0062]
恶性肿瘤是一团赘生细胞。
[0063]
治疗(treating/treatment)是杀伤一些或全部癌细胞,减小癌的大小,抑制癌的生长或降低受试者中癌的生长速率。
[0064]
抗tgf-beta 1sirna是sirna分子,其降低或阻止哺乳动物细胞中编码tgf-beta 1蛋白合成的基因的表达。
[0065]
抗cox2 sirna是sirna分子,其降低或阻止哺乳动物细胞中编码cox2蛋白合成的基因的表达。
[0066]
sirna分子是双链体寡核苷酸,其是短双链多核苷酸,其在引入细胞中后干扰该细胞中基因的表达。例如,其靶向并结合单链目标rna分子中的互补核苷酸序列。通过本领域技术人员已知的技术化学合成或以其他方式构建sirna分子。这样的技术描述于美国专利no.5、898,031、6,107,094、6,506,559、7,056,704和欧洲专利no.1214945和1230375中,其通过引用整体并入本文。按照本领域的惯例,当通过具体的核苷酸序列标识sirna分子时,该序列是指双链体分子的有义链。可以通过本领域已知的技术化学修饰该分子包含的一种或多种核糖核苷酸。除了在其一个或多个个体核苷酸的水平上修饰之外,也可以修饰寡核苷酸的主链。其他修饰包括使用小分子(例如糖分子)、氨基酸、肽、胆固醇和其他大分子与sirna分子偶联。
[0067]
支化组氨酸-赖氨酸聚合物是由组氨酸和赖氨酸氨基酸组成的肽。通过从一个共同的赖氨酸核心合成多个氨基酸,该肽由4个臂或支链组成。这样的聚合物描述于美国专利
号7,070,807b2(2006年7月4日授权)、7,163,695b2(2007年1月6日授权)和7,772,201b2(2010年8月10日授权)中,其通过引用整体并入本文。
[0068]
免疫检查点抑制剂是药物,其阻断一些类型的免疫系统细胞(如t细胞和一些癌细胞)产生的某些蛋白质。这些检查点蛋白帮助保持免疫反应受控制,并可以防止t细胞杀伤癌细胞。当阻断这些检查点蛋白时,释放免疫系统的“刹车(brake)”,t细胞能够更好地杀伤癌细胞。在t细胞或癌细胞上发现的检查点蛋白的示例包括pd-1/pd-l1和ctla-4/b7-1/b7-2。
[0069]
癌附近是指靠近或围绕肿瘤或一系列肿瘤细胞的组织或细胞。
[0070]
增强抗肿瘤疗效是指提供肿瘤细胞生长速率的更大降低,提供杀伤肿瘤细胞和/或减少肿瘤质量的更大效果,并最终通过延长患有肿瘤的受试者的寿命产生更好的治疗效果。这种作用可能是由对肿瘤细胞本身的直接作用或由t细胞活性的增强或由以下机制介导,通过所述机制,在初始治疗后,t细胞能更好地接近肿瘤细胞和/或被激活以促进针对肿瘤的更强免疫反应,且识别肿瘤细胞的能力增加或不增加。
[0071]
以下实施例说明了本发明的某些方面,并且不应被解释为限制其范围。
[0072]
实施例
[0073]
实验结果
[0074]
stp707由受多肽递送纳米颗粒保护的2种sirna(靶向tgf-beta 1和cox2基因)组成,所述纳米颗粒由支化多肽hkp(组氨酸赖氨酸聚合物)组成。stp707描述于美国专利9,642,873b2(2017年5月9日)和美国再颁发专利re46,873e(2018年5月29日)中,其公开内容通过引用整体并入本文。
[0075]
通过使用由组氨酸和赖氨酸氨基酸(hkp)组成的支化多肽纳米颗粒,我们已证明静脉注射使得肝脏内的细胞以更高的效率摄取纳米颗粒。通过使用流式细胞术测量纳米颗粒中荧光标记的sirna的摄取,我们已证明可以递送至肝脏内的特定细胞类型,包括星形细胞、lsec细胞、肝细胞以及库普弗细胞(图1)。因此,这表明我们可以获得非常好的sirna向肝脏内这些细胞的递送效率,由此沉默这些细胞内的目标靶点。
[0076]
我们在原位鼠肝细胞癌模型中,使用hepa 1-6细胞系的生物发光变体以允许随时间监测肿瘤负荷,检查了stp707作为单一疗法和与抗pd-l1单克隆抗体(mab)(抗pd-l1单克隆抗体10f.9g2克隆,来自bioxcell,west lebanon,nh03784)的组合。
[0077]
我们使用了原位植入模型,其中通过手术将hcc肝癌肿瘤细胞(hepa 1-6细胞)植入其来源器官(肝脏)。修饰小鼠肝癌细胞系以表达荧光素酶(hepa 1-6-lux)。然后,在向动物加入底物后,可以使用发光检测系统监测这些动物肝脏中肿瘤的生长程度。这允许以对动物无害的非侵入性方式测量肿瘤生长。我们使用这种方法监测了肿瘤的生长速度。我们检查了不进行任何治疗(对照组)、使用人肝细胞癌治疗的黄金标准(索拉非尼,激酶抑制剂;50mg/kg qd施用)和经过验证显示在患有原位hepa1-6肿瘤的动物中抑制肿瘤生长的小鼠抗pdl1抗体(5mg/kg biw施用)的肿瘤生长速度。
[0078]
我们还比较了使用hkp肽纳米颗粒(以每次注射40ug或20ug的剂量biw静脉施用)递送的显示抑制tgf-beta和cox2的sirna(stp707)的作用。我们进一步分析了stp707与抗pdl1抗体施用时的作用。
[0079]
我们使用同基因原位鼠肝细胞癌模型,使用hepa 1-6细胞系的生物发光变体以允
许随时间监测肿瘤负荷,检测了stp707在治疗hcc中的疗效。
[0080]
使用来自charles river labs的c57bl/6j小鼠品系进行实验。
[0081]
载体(hkp 非沉默sirna;对照)或stp707均静脉内施用。
[0082]
每个治疗组随机分配8只动物。治疗组如下:
[0083]
1.仅载体
[0084]
2.索拉非尼(50mg/kg)p.o.,qd
[0085]
3.抗pd-l1(5mg/kg)i.p.,biw
[0086]
4.抗pd-l1(5mg/kg)i.p.,biw 20ug stp707/biw静脉注射
[0087]
5.抗pd-l1(5mg/kg)i.p.,biw 40ug stp707/biw静脉注射
[0088]
6.40ug stp707/单独biw静脉注射
[0089]
在实验开始时基于重量将动物随机分组。如图2所示,随机化提供了在每组内所选择的动物中非常相似的体重分布。
[0090]
在疗效研究的给药阶段每天测量动物的体重。绘制了每组的平均体重的图(图3)。单独的索拉非尼诱导了体重的轻微变化。然而,所有其他治疗方案(单独的stp707或 抗pdl1)都具有良好的耐受性,在治疗组中没有观察到显著的体重减少。
[0091]
通过生物发光成像监测肿瘤生长,并通过肿瘤相关生物发光(tabl)定量反映肿瘤生长。按研究日绘制tabl的图,示于图4。
[0092]
在完成预定的给药阶段后,监测2至6组的肿瘤发展(outgrowth)。在研究的最后一天(第50天)之前没有观察到肿瘤再生长,表明该治疗对抑制肿瘤生长和防止再生长非常有效,表明对肿瘤生存力有显著作用。
[0093]
对研究中所有小鼠的生存分析(使用人道替代终点)进一步强调了该组合疗法的作用(图5)。肿瘤达到最大允许大小或当肿瘤显示不良临床症状时,定义为人道终止的终点。如log-rank(mantel-cox)检验(p=0.0001)和gehan-breslow-wilcoxon检验(p=0.0002)所证明的,所有治疗方案都产生了统计学上显著改善的存活。在治疗组之间没有观察到存活的差异。
[0094]
为了验证上述获得的结果,我们使用较低剂量的stp707(1mg/kg)重复了该研究(图6)。
[0095]
获得的数据支持该观察:stp707显示出针对肿瘤的单药作用——相对于对照(未治疗)队列生长减少。stp707组比单独的抗体组(pdl1)显示出更好的疗效。
[0096]
在该研究中,stp707的单药活性优于单独的抗pdl1抗体。然而,将stp707与抗体治疗组合,在4次给药后将肿瘤降低到检测不到的水平。
[0097]
由于在stp707治疗组中均没有明显的肿瘤,我们重复了这项研究,但只使用了1mg/kg的stp707给药3次。第三次给药后,将动物安乐死,取出肝脏并切片,并使用免疫组织化学染色cd4 和cd8 t细胞。
[0098]
甚至在这些降低剂量的研究中,我们也看到未治疗(对照)样品和stp707治疗样品在总体肿瘤大小方面的大幅差异。在未治疗的动物中,肿瘤几乎完全是肝脏的大小,而在stp707样品中,肿瘤大为缩小(图7)。
[0099]
此外,cd4 和cd8 t细胞的ihc染色显示渗透stp707治疗样品的肿瘤的这些t细胞大幅增加(图7和图8)。
[0100]
进行图像分析以量化肿瘤和肝脏之间边缘的cd4 和cd8 t细胞,如肿瘤样品中的彩色线所示。这些线画在距肿瘤边缘50um的距离处——向内朝向肿瘤或向外远离肿瘤但朝向肝脏。对每50um区段中的所有cd8 t细胞进行图像分析以计数,数据绘制如图8所示。
[0101]
stp707与抗pdl1 ab一起治疗显示向内朝向肿瘤500um处cd8 t细胞增加了2倍。其还显示靠近肿瘤的肝脏内cd8 t细胞增加——表明围绕肿瘤的tgf-beta“壁(wall)”的降低可能诱导t细胞的募集。
[0102]
结论
[0103]
本研究的主要目的是在原位鼠肝细胞癌模型中,使用hepa 1-6细胞系的生物发光变体,确定stp707(含有针对tgf-beta 1和cox2的sirna的hkp多肽纳米颗粒)作为单一疗法和与抗pd-l1组合的耐受性和疗效。
[0104]
在测试的剂量和配方下,所有治疗方案都具有良好的耐受性;在任何治疗组中均未发现不良临床症状或体重减轻。
[0105]
与对照相比,所有治疗方案均产生了统计学上显著降低的肿瘤生长。然而,stp707单一疗法(2mg/kg)导致肿瘤生长减少,这在与抗pdl1 ab组合时也观察到。将stp707的剂量降低至1mg/kg表明单独使用stp707的作用较低,但此时与抗pdl1 ab的相加性更加明显。
[0106]
抗pd-l1 5mg/kg和stp705(每次注射20ug(1mg/kg))组合显得比stp705单一疗法更有效,stp705单一疗法比抗pd-l1 5mg/kg更有效。
[0107]
我们的结果表明stp707增强了抗pdl1抗体的作用——其也导致肿瘤活力大幅降低,即使在停止给药2周以上后,肿瘤细胞不会再生长。我们显示的将静脉内给予的这种制剂递送至肝脏的事实表明,我们可以用这种方案治疗存在于肝脏中的肿瘤。这将包括在肝脏中自然发生的任何肿瘤(肝母细胞瘤或肝细胞癌(hcc))或转移至肝脏的肿瘤(例如结肠癌)。
[0108]
此外,在之前的研究中,我们已经证明了当该产品通过注射(例如皮内)施用时能够降低这2个基因靶点的基因表达。这表明当该产品通过注射施用于肿瘤附近时,我们将能够获得相同的促进对肿瘤的免疫反应的治疗受益。这可以用于皮肤癌(例如非黑色素瘤皮肤癌或皮肤中的黑色素瘤肿瘤),或用于其他器官的肿瘤,其中可以靠近肿瘤部位注射材料以促进相同的作用。
[0109]
参考文献
[0110]
[1]liu等人,cancer cell int(2015)15:106-112“cyclooxygenase-2promotes tumor growth and suppresses tumor immunity”[0111]
[2]zelenay等人,cell(2015)162:1257
–
1270“cyclooxygenase-dependent tumor growth through evasion of immunity”[0112]
[3]mariathasan等人,nature(2018)554;544-548“tgfβattenuates tumour response to pd-l1 blockade by contributing to exclusion of t cells”[0113]
本文中标识的所有出版物,包括已发布的专利和公开的专利申请,以及由url地址或登录号标识的所有数据库条目,均通过引用整体并入本文。
[0114]
尽管本发明已经结合其某些实施方案进行了描述,并且为了说明的目的已经阐述了许多细节,但是对于本领域技术人员来说显而易见的是,本发明易于采用另外的实施方案,并且本文所描述的某些细节在不背离本发明的基本原理的情况下可以有变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。