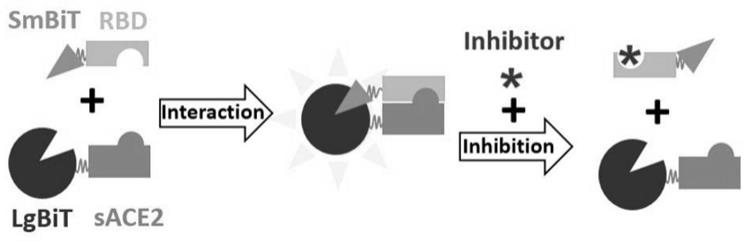
1.本发明涉及溶菌酶检测技术领域,具体涉及一种检测口腔护理产品中溶菌酶的方法。
背景技术:
2.溶菌酶广泛存在于动物体液、禽类蛋白、植物以及微生物中。溶菌酶能够水解致病菌中的黏多糖,还具有抗菌、消炎、抗病毒、增强免疫力等诸多药理作用,它还被广泛的应用于牙膏和漱口液的制造中,可以有效的防止龋齿的发生。因此,溶菌酶在口腔护理产品中得到广泛的应用,对口腔护理产品中溶菌酶活性的检测也变得越来越必要。
3.现有技术中,对口腔护理用品中的溶菌酶的活性进行检测的方法主要有:琼脂平板法和比浊法。琼脂平板法的原理是通过溶菌酶溶解藤黄微球菌的细胞壁致细菌死亡形成溶菌圈,通过计量溶菌圈来实现对酶活的表征。但是,绝大多数的口腔护理产品都含有香精、防腐剂、抑菌剂等具有抑菌效果的成分,产品本身抑菌性能会造成假阳性结果,故该方法不适用于口腔护理产品中溶菌酶活性的鉴别。另外,有最新标准《qbt 5601-2021口腔清洁护理用品牙膏和口腔清洁护理液中溶菌酶抗菌活性的测定》发布,解决了产品抑菌性能对溶菌酶活性的干扰,但是其只能对溶菌酶进行定性检测,且打孔方法繁琐,操作复杂。比浊法对单个样品的测定速度快,但是方法受菌体分散性、反应前的预热时间长短、环境温度、终止反应的时间控制等多方面的影响,造成结果的相对标准偏差较大,测量准确度低;在现行国标中,通常建议测量时每分钟吸光度变化范围在0.03-0.08之间,若不在此范围需要调整试样的浓度,因此,对于未知含量的样品,测量时需要摸索稀释浓度。另外,多样品测量时所用的溶液和菌体量大,牙膏等实验样品必须通过离心等进行前处理。因此,比浊法不利于开展大批量样品的溶菌酶活性检测。
4.综上所述,适合口腔护理产品包括牙膏及其他清洁护理液的溶菌酶活性的定性定量检测未见报道。有必要探索一种不受口腔护理产品中原料干扰,且可实现定性定量检测的口腔护理产品中溶菌酶活性的检测方法,并将反应体系微量化,使其更适用于大批量口腔护理产品中溶菌酶活性的快速检测。
技术实现要素:
5.本发明意在提供一种检测口腔护理产品中溶菌酶的方法,以解决难以对口腔护理产品中的溶菌酶活性进行准确且快速的检测的技术问题。
6.为达到上述目的,本发明采用如下技术方案:
7.一种检测口腔护理产品中溶菌酶的方法,将待检样品和活性底物混合并孵育,然后加入终止液,再离心取上清,检测上清的od
550
值,获得待检样品的吸光光度值;所述活性底物中含有标记有活性艳红k-2bp的藤黄微球菌;所述待检样品来源于口腔护理用品,所述口腔护理用品为液体类制剂或固体/半固体类制剂;所述液体类制剂包括漱口水和口喷中的至少一种;所述固体/半固体类制剂包括牙膏、牙粉和固体清洁片的至少一种。
8.本方案的原理及优点是:
9.在本技术方案中,使用标记有活性艳红k-2bp的藤黄微球菌作为待检样品中的溶菌酶的作用对象,溶菌酶破坏藤黄微球菌的细胞壁之后,活性艳红k-2bp便游离到液相中,通过离心取上清,然后再检测上清的od
550
值,可以获得待检样品的吸光光度值信息,从而定性或者定量地获取待检样品中的溶菌酶活性信息。
10.本技术方案针对于口腔护理用品的检测非常有效。由于口腔护理用品中含有大量的除溶菌酶外的其他物质,这些物质会对溶菌酶发挥作用产生一定的干扰,有些物质甚至还会对待测细菌产生一定的抑制作用。所以,使用传统的方法很难准确检测口腔护理用品中溶菌酶的活性。发明人尝试了使用纸片琼脂平板扩散法来进行口腔护理用品中的溶菌酶活性的测定,发现测定结果和这些口腔护理用品的实际溶菌酶含量存在非常大的差距,导致该检测方法不能应用到口腔护理用品中的溶菌酶的活性检测中(详见对比例1)。发明人进而尝试了比浊法测定溶菌酶的含量,该法受环境温度以及时间控制的影响,造成结果的相对标准偏差较大,测量结果和真实值存在一定差距。并且对于未知含量的样品,测量时需要摸索稀释浓度,多样品测量时所用的溶液和菌体量大,牙膏等实验样品必须通过离心进行前处理。此方法操作繁琐,不利于开展大批量样品的溶菌酶活性检测(详见对比例2)。
11.采用本技术方案对口腔护理用品中的溶菌酶进行测量,可以克服现有技术中的种种问题,检测准确度高、偏差小、与真实值更为接近,并且本检测方法的操作步骤相对简便,适合于开展大批量样品的溶菌酶活性检测。
12.进一步,标记有活性艳红k-2bp的藤黄微球菌在活性底物中的含量为1.75-3wt.%。将本技术方案使用到口腔护理用品的检测中,并不是所有的检测条件均能实现准确检测。由于口腔护理用品中的其他物质的影响,使得活性底物中的标记有活性艳红k-2bp的藤黄微球菌的量必须维持在一定水平,才能保证检测的准确度。如果标记有活性艳红k-2bp的藤黄微球菌在活性底物中的含量大于3wt.%,则会出现测试所得的酶活值远远低于真实值的情况,有的测试结果甚至比真实值低了25%左右。发明人分析原因在于口腔护理用品中的非溶菌酶成分与菌体发生不同程度的聚集,加快了菌体的沉淀,使得反应不完全,导致结果偏低。如果标记有活性艳红k-2bp的藤黄微球菌在活性底物中的含量小于1.75wt.%,则会出现高浓度酶活性的样品不能完全反应的情况,导致检测得到的值比理论值偏低(详见实施例5中的实验结果)。
13.进一步,所述孵育的时间为4-14h、温度为36
±
1℃。
14.在50-1000u/ml的线性浓度范围内,最佳的反应时间控制在4-14h为最佳。
15.进一步,所述离心的转速为3000-4000r/min,时间为10-15min。
16.采用上述的离心参数,可实现菌与上清液的有效分离。时间过短和转速过低,菌体和染色上清难以分离,导致检测结果不准确。时间过长或者转速过高,对提升检测准确度的效果不明显,故为了节约操作时间和能源,时间不宜过长且转速不宜过高。
17.进一步,标记有活性艳红k-2bp的藤黄微球菌由如下方法制备:使用营养肉汤培养基培养藤黄微球菌,然后取菌体,并对菌体进行冷冻干燥处理,获得冻干菌粉;在冻干菌粉中加入活性艳红k-2bp和naoh溶液,经染色孵育后,收集染色菌体;染色菌体经洗涤去除游离染料后,获得标记有活性艳红k-2bp的藤黄微球菌。
18.在naoh溶液的作用下,活性艳红k-2bp和藤黄微球菌的细胞壁结合,实现对细菌的
染料标记。
19.进一步,冻干菌粉和活性艳红k-2bp的质量比为1:0.5。
20.采用上述比例,可实现活性艳红k-2bp对藤黄微球菌的充分染色。活性艳红k-2bp用量过低,染色不充分,但是,活性艳红k-2bp用量过高,会导致过度染色,在清洗除去游离染料的时候会耗费更长时间。
21.进一步,所述染色孵育的时间为18-24h,温度为25
±
1℃;所述营养肉汤培养基的配方为胰化蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l;使用营养肉汤培养基培养藤黄微球菌的方法为:取3-5代藤黄微球菌接种于营养肉汤培养基中,37℃振荡培养16h;所述终止液包括体积比为1:4吐温80溶液和盐酸溶液。
22.上述染色孵育的条件,可以保证活性艳红k-2bp对藤黄微球菌的充分染色。上述营养肉汤培养基为藤黄微球菌的常规培养基,易于配制且可有效促进藤黄微球菌扩增。上述终止液可以有效地终止溶菌酶对藤黄微球菌的酶促分解作用,获得待检样品检测液,以供后续吸光光度值检测。
23.进一步,待检样品由如下方法获取:将口腔护理用品分散于缓冲液中,获得待检样品。
24.在使用本方法对牙膏进行检测时,将样品进行充分分散即可,前处理简单,不用对样品进行特别的处理(详见实施例4)。而采用其他现有技术的方法则需要对样品进行离心取上清液处理,操作复杂。
25.进一步,将溶菌酶做梯度稀释,获得若干不同浓度的溶菌酶溶液;将所述溶菌酶溶液与所述活性底物混合,经孵育后加入终止液,再离心取上清,检测上清的od
550
值,获得标准品的吸光光度值;建立标准品的吸光光度值相对于溶菌酶溶液浓度的标准曲线;将待检样品的吸光光度值代入所述标准曲线,计算获得待检样品的酶活数值。
26.如果需要对样品中的溶菌酶活性进行定量测量,可使用溶菌酶标准品绘制标准曲线,然后将待检样品的吸光光度值代入所述标准曲线,计算获得待检样品的酶活数值。
27.本发明还提供了一种检测口腔护理产品中溶菌酶的试剂盒,包括用于制备活性底物的试剂组合和终止液;所述活性底物中含有1.75-3wt.%的标记有活性艳红k-2bp的藤黄微球菌;用于制备活性底物的试剂组合包括藤黄微球菌的冻干菌粉、活性艳红k-2bp和naoh溶液;所述终止液包括终止液a和终止液b;终止液a为吐温80溶液,终止液b为盐酸溶液。
28.本方案的试剂和包括制备活性底物的原料,在需要进行样品的溶菌酶活性检测的时候,使用藤黄微球菌的冻干菌粉、活性艳红k-2bp和naoh溶液,制备标记有活性艳红k-2bp的藤黄微球菌。然后将标记有活性艳红k-2bp的藤黄微球菌分散于缓冲液中,获得活性底物。活性底物与样品中的溶菌酶反应一定时间,再由吐温80溶液和盐酸溶液组成的终止液终止反应,获得待检样品检测液,再对待检样品检测液进行吸光光度值的检测。进而实现对样品中的溶菌酶活性的定量或者定性的检测。
附图说明
29.图1为实施例2的标准曲线。
30.图2为实施例2的待检样品检测液的实验照片。
31.图3为实施例6的样品与底物的反应时间曲线。
32.图4为对比例1的抑菌圈法测试的标准曲线。
具体实施方式
33.下面结合实施例对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施例以及实验例所用的技术手段为本领域技术人员所熟知的常规手段,且所用的材料、试剂等,均可从商业途径得到。
34.实施例1
35.一种检测口腔护理产品中溶菌酶的方法的实施流程如下:
36.(1)试剂准备:
37.活性底物:取3-5代藤黄微球菌新鲜培养菌种,接种于现有技术常规的营养肉汤培养基中,37℃振荡培养16h,离心沉淀后,冷冻干燥,获得干燥的菌体(冻干菌粉)。染色菌体进行冷冻干燥的步骤是:采用冷冻干燥机进行冷冻干燥,先将菌悬液进行预冻2h以上,温度达到-20
‑‑
35℃左右,随即启动真空冷冻干燥程序,待样品呈疏松块状或松散片状,冻干完成,为现有技术中常规操作手段。营养肉汤培养基的成分是:胰化蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,naoh调节ph至7.4,121℃,高压灭菌20min。按照每克冻干菌粉加0.5g活性艳红k-2bp、1.25m naoh 10-15ml作染色反应,25
±
1℃轻微振荡染色18-24h。离心收集染色菌体,加双蒸水,作4000r/min离心10min,反复多次洗涤去除游离染料,至上清取样od值检测不再变化为止。之后加入0.5m ph 6.5的pbs,使菌液终浓度在1.75-3wt.%(活性底物),4℃保存。
38.终止液:将5wt.%吐温80溶液与0.4m盐酸溶液按1:4混合,即为终止液,现配现用。
39.(2)样品处理
40.针对漱口水等液体类样品:根据样品中酶的含量,用0.5m ph 6.5的pbs作适当稀释到标准曲线浓度范围内即可,获得待检样品备用。
41.针对牙膏等固体或者半固体类样品:取待测牙膏样品5克,加入0.5m ph 6.5的pbs 15ml,搅拌均匀置于25℃振荡器上振荡充分分散,获得待检样品备用。
42.(3)反应体系的建立以及样品检测
43.向96孔平底聚苯乙烯酶标板中加入50μl上述待检样品,再加入100μl 1.75-3%的活性底物,置于37℃摇床中反应4-14h,加入160μl终止液,将全部反应液转入0.5ml ependorf管中离心沉淀(离心转速为3000-4000r/min,离心时间为10-15min),吸取160μl作od
550
检测。
44.设50μl pbs空白反应对照,250u/ml溶菌酶标准品作阳性对照,待检样品如有颜色,则需要作待检样品颜色消除对照。最终结果为待检样品实测od值减去样品颜色对照od值,获得待检样品相对od值,将待检样品相对od值代入标准曲线(标准曲线的绘制方法见后文),即可计算获得待检样品中的溶菌酶的浓度。
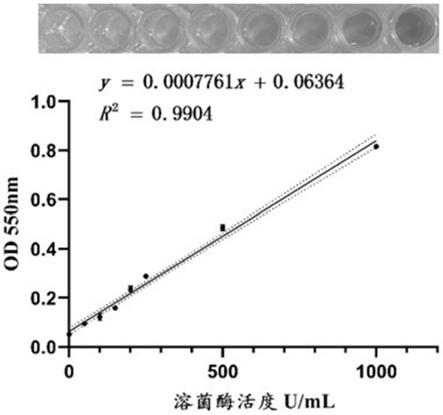
45.(5)标准曲线的绘制
46.将溶菌酶作0、50、100、150、200、250、500和1000u/ml梯度稀释,每个梯度作5个重复,按上述体系建立反应条件,根据反应结果绘制反应标准曲线。即在96孔平底聚苯乙烯酶标板中加入50μl每个梯度稀释的溶菌酶溶液,再加入100μl 1.75-3wt.%的活性底物,置于37℃摇床中反应4-14h,加入160μl终止液,将全部反应液转入0.5ml ependorf管中离心沉
淀(离心转速为3000-4000r/min,离心时间为10-15min),吸取160μl作od
550
检测。然后,根据od
550
检测结果和溶菌酶溶液浓度进行线性拟合,绘制反应标准曲线。
47.实施例2:实际样品检测
48.(1)口腔护理用品样品情况:
49.样品1:含酶漱口水配方a:水(余量)、甘油(10wt.%)、泊洛沙姆(1wt.%)、清爽薄荷香精(0.3wt.%)、硝酸钾(0.5wt.%)、氢化蓖麻油(0.5wt.%)、三氯半乳糖(0.01wt.%)、ci 16035(0.0005wt.%)、溶菌酶(理论添加250u/ml),对照样1为不含溶菌酶的对应产品。
50.样品2:含酶漱口水配方b:水(余量)、甘油(10wt.%)、泊洛沙姆(1wt.%)、清爽薄荷香精(0.3wt.%)、硝酸钾(0.5wt.%)、氢化蓖麻油(0.5wt.%)、三氯半乳糖(0.01wt.%)、溶菌酶(理论添加600u/ml);对照样2为不含溶菌酶的对应产品。
51.样品3:含酶漱口水配方c:水(余量)、甘油(10wt.%)、泊洛沙姆(1wt.%)、清爽薄荷香精(0.3wt.%)、硝酸钾(0.5wt.%)、氢化蓖麻油(0.5wt.%)、三氯半乳糖(0.01wt.%)、西比氯胺(0.004wt.%)、溶菌酶(理论添加550u/ml),对照样3为不含溶菌酶的对应产品。
52.样品4:市售李施德林薄荷香草零酒精漱口水,批号为l184l。
53.样品5:含酶牙膏配方a:水(余量)、山梨醇(23wt.%)、水合硅石(20.5wt.%)、聚乙二醇-6(4wt.%)、月桂酰肌氨酸钠(1wt.%)、清爽薄荷香精(1wt.%)、羧甲基纤维素(0.75wt.%)、卡拉胶(0.5wt.%)、糖精钠(0.28wt.%)、西比氯胺(0.03wt.%),溶菌酶(理论添加量为400u/g);对照样5为不含溶菌酶的对应产品。
54.样品6:含酶牙膏配方b:水(余量)、山梨醇(23wt.%)、水合硅石(20.5wt.%)、聚乙二醇-6(4wt.%)、月桂酰肌氨酸钠(1wt.%)、清爽薄荷香精(1wt.%)、羧甲基纤维素(0.75wt.%)、卡拉胶(0.5wt.%)、糖精钠(0.28wt.%)、溶菌酶(理论添加量为450u/g);对照样6为不含溶菌酶的对应产品。
55.样品7:含酶牙膏配方c:水(余量)、山梨醇(23wt.%)、水合硅石(20.5wt.%)、聚乙二醇-6(4wt.%)、月桂酰肌氨酸钠(1wt.%)、清爽薄荷香精(1wt.%)、羧甲基纤维素(0.75wt.%)、卡拉胶(0.5wt.%)、糖精钠(0.28wt.%)、ci 16035(0.005wt.%)、溶菌酶(理论添加量为800u/g);对照样7为不含溶菌酶的对应产品。
56.样品8:本公司市售冷酸灵海盐柠檬牙膏,批号:2023102325032。
57.(2)检测过程
58.(2.1)样品的前处理:
59.漱口水:根据样品中酶的含量,用0.5m ph 6.5的pbs作适当稀释即可。
60.牙膏:称取5g牙膏样品,加入0.5m ph 6.5的pbs 15ml,搅拌置于25℃振荡器上振荡分散,制成悬浊液备用。
61.(2.2)染色底物(活性底物)制备
62.将溶壁微球菌接种于营养肉汤培养基,37℃振荡培养16h,3000rpm离心10min,获得沉淀,冷冻干燥获得冻干菌粉;按照每克菌粉加0.5g活性艳红k-2bp、1.25m naoh 10ml作染色反应,25℃轻微振荡染色24h。离心收集染色菌体,加入双蒸水,作4000r/min离心10min,反复多次洗涤,至上清取样od
550
nm值检测不再变化为止。之后加入0.5m pbs,稀释菌浓度到1.75-3wt.%,4℃保存备用。
63.终止液:将5wt.%吐温80溶液与0.4m盐酸溶液按1:4混合,即为终止液,现配现用。
64.(2.3)标准曲线的绘制
65.将溶菌酶(阿拉丁,cas 12650-88-3,≥20000u/mg)作0、2.5、5、7.5、10、12.5、25、50μg/ml梯度稀释(对应酶活度:0、50、100、150、200、250、500和1000u/ml),向96孔平底聚苯乙烯酶标板中加入50μl溶菌酶标准溶液,再加入100μl上述染色底物(活性底物,浓度2wt.%),置于37℃摇床中反应至反应完全(14h可保证反应完全),加入160μl终止液,将全部反应液转入0.5ml ependorf管中离心沉淀(4000r/min,10min),吸取160μl(称为标准品检测液)作od
550
检测,每个梯度作5个重复,根据反应结果绘制标准曲线,对数据作回归方程分析,标准曲线见图1。其回归方程为:y=0.0007761x 0.06364,r2=0.9904。溶菌酶标准品在50-1000u/ml范围内线性关系良好,检出限为8.90u/ml。图1也同时展示了标准品检测液的照片。
66.(2.4)样品检测
67.向96孔平底聚苯乙烯酶标板中加入50μl上述待检样品,再加入100μl 2wt.%的活性底物,置于37℃摇床中反应至反应完全(14h可保证反应完全),加入160μl终止液,将全部反应液转入0.5ml ependorf管中4000r/min,离心10min,吸取160μl(称为待检样品检测液)作od
550
检测。
68.设50μl pbs空白反应对照,250u/ml溶菌酶标品作阳性对照,用于观察实验是否存在系统误差。如果待测样品没有颜色,则只需要将测得的od值代入标准曲线计算酶活值。待检样品如有颜色,则需要作待检样品颜色消除对照。最终结果为待检样品实测od值减去样品颜色对照od值,再将矫正过的od值代入标准曲线计算获得酶活值。根据标准曲线计算待检样品中溶菌酶的含量,计算结果。例如,样品1和样品7,都有添加红色颜料,颜色消除对照为带有相同浓度的颜料水溶液,采用颜色消除对照为吸光光度法检测经常采用的降低测量误差的常规手段。
69.对样品1-8的检测结果参见表1,实验结果说明本技术方案可以实现牙膏和漱口水等口腔清洁用品的溶菌酶酶活检测,检测结果与样品的理论酶活接近。实验照片详见图2,展示了待检样品检测液的情况,从上至下依次为样品1-8,各3个重复。可见采用本法,检测值与真实值较为接近,检测准确度高。
70.表1:检测结果
[0071][0072]
实施例3:离心参数研究
[0073]
准备空白反应对照和阳性对照,具体如下:
[0074]
空白反应对照:取50μl pbs,再加入100μl 2wt.%的活性底物(制备方法参见实施例2),置于37℃摇床中反应4h,加入160μl终止液(制备方法参见实施例2),将全部反应液转入0.5ml ependorf管中离心沉淀(参数选择参见表2),吸取160μl(称为空白检测液)作od
550
检测。
[0075]
阳性对照:取50μl 250u/ml溶菌酶标品,再加入100μl 2wt.%的活性底物(制备方法参见实施例2),置于37℃摇床中反应12h,加入160μl终止液(制备方法参见实施例2),将全部反应液转入0.5ml ependorf管中离心沉淀(参数选择参见表2),吸取160μl(称为阳性检测液)作od
550
检测。实验结果参见表2,可见离心转速为3000-4000r/min、离心时间为10-15min为最适的参数条件。
[0076]
表2:反应结束后离心转速及时间确定
[0077][0078]
实施例4:牙膏样品的前处理方式对比结果
[0079]
分别取5g牙膏样品(样品5、6、7、8),加入0.5m ph 6.5的pbs 15ml,搅拌置于25℃振荡器上振荡分散,一组制成悬浊液备用,另一组采用6000r/min离心10min,取上清液备用,处理后按照上述的实验方法(实施例2)对其溶菌酶含量进行检测,结果见表3。表3中每组测试重复3次,表中数据为3次重复的平均值,对同样样品的“离心取上清”和“混悬液”两种处理方式的实验结果进行t检验,p>0.1,无显著差异。结果表明,无论是否经过离心,对样品中的溶菌酶检测结果无影响,因此在使用本方法对牙膏进行检测时,将样品进行充分分散即可,前处理简单。即,本技术方案非常方便易行,不用对样品进行特别的处理。
[0080]
表3:牙膏的不同前处理方式对溶菌酶活性测定的影响
[0081][0082]
实施例5:样品及标准酶与不同浓度底物反应结果
[0083]
选取5个不同浓度(3.25wt.%、3wt.%、2wt.%、1.75wt.%、1wt.%)的底物,以漱口水样品1和2,牙膏样品6和7,以及250u/ml(标品1)和600u/ml(标品2)的标准酶溶液为实验样品,进行最佳底物浓度验证(测试方法参见实施例2),结果见表4。表4中每种样品每个底物浓度的测试重复3次,表中数据为3次重复的平均值,*表示该实验结果与同样品的1.75wt.%-3wt.%的实验结果存在显著差异(t检验)。当底物浓度过低时(<1.75wt.%),具有高浓度酶活性的样品(样品7)不能完全反应,因此得到的值比理论值偏低;当底物浓度过高时(>3wt.%),由于口腔护理用品的样品中的非溶菌酶成分与菌体发生不同程度的聚集,加快了菌体的沉淀,使得反应不完全,导致结果偏低,由此进一步说明最佳的底物浓度范围为1.75-3wt.%。
[0084]
表4:不同浓度底物对样品酶活测定的影响
[0085][0086]
实施例6:样品与底物的反应时间
[0087]
在适宜的底物浓度范围内,为对反应时间进行验证,分别在样品2和6的配方基础上,对酶的浓度进行调整,设置成以下四个特殊酶活浓度的漱口水和牙膏样品:
[0088]
(1)含酶漱口水配方b1:水(余量)、甘油(10wt.%)、泊洛沙姆(1wt.%)、清爽薄荷香精(0.3wt.%)、硝酸钾(0.5wt.%)、氢化蓖麻油(0.5wt.%)、三氯半乳糖(0.01wt.%)、溶菌酶(理论添加50u/ml),对照样为不含溶菌酶的对应产品;
[0089]
(2)含酶漱口水配方b2:水(余量)、甘油(10wt.%)、泊洛沙姆(1wt.%)、清爽薄荷香精(0.3wt.%)、硝酸钾(0.5wt.%)、氢化蓖麻油(0.5wt.%)、三氯半乳糖(0.01wt.%)、溶菌酶(理论添加1000u/ml),对照样为不含溶菌酶的对应产品;
[0090]
(3)含酶牙膏配方b1:水(余量)、山梨醇(23wt.%)、水合硅石(20.5wt.%)、聚乙二醇-6(4wt.%)、月桂酰肌氨酸钠(1wt.%)、清爽薄荷香精(1wt.%)、羧甲基纤维素(0.75wt.%)、卡拉胶(0.5wt.%)、糖精钠(0.3wt.%)、溶菌酶(理论添加量为50u/g),对照样为不含溶菌酶的对应产品;
[0091]
(4)含酶牙膏配方b2:水(余量)、山梨醇(23wt.%)、水合硅石(20.5wt.%)、聚乙二醇-6(4wt.%)、月桂酰肌氨酸钠(1wt.%)、清爽薄荷香精(1wt.%)、羧甲基纤维素(0.75wt.%)、卡拉胶(0.5wt.%)、糖精钠(0.3wt.%)、溶菌酶(理论添加量为1000u/g),对照样为不含溶菌酶的对应产品;
[0092]
按照实施例2的实验方法将样品和底物置于37℃摇床反应,每间隔2h进行酶活测定,结果如图3,含有较低浓度的样品含酶漱口水配方b1和含酶牙膏配方b1,与底物反应4h后结果趋于稳定,而含有较高酶浓度的样品含酶漱口水配方b2和含酶牙膏配方b2,与底物反应14h开始趋于稳定,因此,在50-1000u/ml的线性浓度范围内,最佳的反应时间控制在4-14h为最佳。
[0093]
对比例1
[0094]
对比例1的实施方式借鉴抗生素生物效价的原理,采用纸片琼脂平板扩散法对以上8个样品(样品1-8)中的溶菌酶活性进行检测。
[0095]
1.琼脂平板的制备:用一定量灭菌的去离子水将试验菌斜面培养的溶壁微球菌的菌苔洗下,浓度调至约106cfu/ml,冷藏备用。将灭菌融化的市售lb琼脂,冷却至55℃左右,按1%体积比加入试验菌悬浮液,迅速摇匀,倾注平板,使其均匀摊布,凝固为琼脂厚度约为1mm的试验菌平板。
[0096]
2.点样:在直径6mm,厚度约1mm的小纸片上,准确注入10μl不同浓度的标准酶溶液和以上样品的上清液,每个浓度各3个纸片,用pbs溶液作阴性对照。置于37℃培养箱中,正置培养18-24h,观察结果,用游标卡尺测量溶菌圈的大小,并记录。
[0097]
3.标准曲线的绘制:以抑菌圈直径的平均值为横坐标,酶浓度(换算成酶活力对
数)为纵坐标,绘制标准曲线,结果见下表5和图4。
[0098]
表5:纸片琼脂平板法测定不同浓度标准酶溶液所得抑菌圈数据
[0099][0100]
表6展示了8种样品的测测试结果,实验结果表明,采用琼脂平板法测定溶菌酶的活力,由于其原理是通过溶菌酶溶解藤黄微球菌的细胞壁致细菌死亡形成溶菌圈,受产品本身抑菌性能的影响,如样品3、4、5和8,均因产品中的抑菌成分造成结果不准确。由于绝大多数的口腔护理产品都含有香精、防腐剂、抑菌剂等抑菌成分,故该方法不适用于口腔护理产品中溶菌酶活性的鉴别。另外,有最新标准《qbt 5601-2021口腔清洁护理用品牙膏和口腔清洁护理液中溶菌酶抗菌活性的测定》发布,解决了产品抑菌性能对溶菌酶活性的干扰,但是其只能对溶菌酶进行定性检测,且打孔方法繁琐,操作复杂。
[0101]
表6:琼脂平板法测定样品的酶活度数据
[0102][0103]
对比例2
[0104]
本对比例的实施方式按照《溶菌酶活性检测方法gb/t 30990-2014》对以上8个实施样品中的溶菌酶活性进行检测。
[0105]
1.反应底物的制备
[0106]
a.菌株扩大培养:以无菌操作方式,挑取适量菌体至lb琼脂平板中划线纯化,在(37
±
1)℃培养箱中培养24h,并观察单菌落形态。选取湿润、凸起、边缘光滑,呈黄色的菌落,于lb琼脂平板中再次划线纯化,在(37
±
1)℃培养箱中培养24h。平板于4℃保存,一个月内使用。挑取二次划线纯化的lb琼脂平板中单菌落于50ml液体lb培养基中混匀,于(37
±
1)℃恒温摇床中,110r/min摇菌18h后于4℃保存,用时恢复至室温,一周内使用。取500μl菌液至50ml液体lb培养基中混匀,于(37
±
1)℃恒温摇床中,110r/min摇菌18h后用于制备菌悬液。
[0107]
b.菌悬液的制备:将上述菌液离心(12000g,5min)收集菌体,采用磷酸盐缓冲液(6.2)洗涤菌体至无培养基状态。开机,调节波长至450nm,于(25
±
1)℃室温预热,将一定量
菌体悬浮于磷酸盐缓冲液中,调节菌体浓度,使450nm处吸光度值为1.300。
[0108]
2.测定
[0109]
a.样品前处理:对于含酶或不含酶的牙膏样品,称取5g牙膏样品,加入0.5m ph 6.5的pbs 15ml,搅拌充分分散,置于25℃振荡器上振荡分散3小时左右,离心,取上清,备用。对于漱口水样品,根据样品中酶的含量,用0.5m ph 6.5的pbs作适当稀释即可。
[0110]
b.检测:于(25
±
1)℃的室温或恒温水浴锅中,于反应管中加入2.5ml菌悬液,加入0.5ml样品溶液,反应1min时记录450nm处的读数a1,反应2min时记录450nm处的读数a2。通过如下公式换算得出对应酶活性。每个样品做两个平行。
[0111]
计算公式:i=丨a
1-a2丨/0.001
×ew
[0112]
式中:i为酶活性;丨a
1-a2丨为450nm处每分钟吸光度的变化;ew为0.5ml检测用酶液中含有原始酶液的质量(mg或g)或体积(ml);0.001为以每分钟使450nm处吸光度值下降0.001为一个活性单位。
[0113]
测试结果参见表7,实验结果表明,采用比浊法测定溶菌酶的含量,虽然单个样品的测定速度较快,但是受环境温度以及时间控制的影响,造成结果的相对标准偏差较大,测量准确度低;标准建议测量时每分钟吸光度变化范围在0.03-0.08之间,若不在此范围需要调整试样的浓度,因此,对于未知含量的样品,测量时需要摸索稀释浓度;另外,多样品测量时所用的溶液和菌体量大,牙膏等实验样品必须通过离心进行前处理,因此,此方法不利于开展大批量样品的溶菌酶活性检测。
[0114]
表7:比浊法测定样品溶菌酶含量结果
[0115][0116]
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。