1.本发明属于生物医学领域,具体涉及一种基于荧光素酶的新冠病毒棘突蛋白和人血管紧张素酶互作检测细胞模型及应用。
背景技术:
2.新型冠状病毒通过病毒包膜上棘突蛋白(s蛋白)(rbd)与人血管紧张素转化酶2(ace2)结合进而侵染细胞,达到传播的目的。因此rbd和ace2的相互作用就成为了筛选抑制新型冠状病毒传播的药物靶点。
3.目前针对于ace2和rbd相互作用为药物靶点的药物筛选方法有:(1)等温滴定量热法(itc)和表面等离子体共振(spr)。这些方法存在的问题是无法进行大规模高通量筛选。(2)荧光共振能量转移(fret)、饱和转移差(std)nmr、免疫共沉淀和微尺度热电泳法。这些方法存在的问题是在实验过程中,确定实验条件有些难度,实行起来不是很方便。(3)alphalisa法。该方法存在的问题是易受环境氧的干扰。
技术实现要素:
4.本发明的主要目的在于提供一种基于荧光素酶的新冠病毒棘突蛋白和人血管紧张素酶互作检测细胞模型及应用。本发明采用的是nanobit荧光素酶互补原理,在ace2蛋白的氨基端和rbd羧基端分别接入荧光素大小亚基,两者互补得到有功能的可催化荧光底物发光的功能性复合物。利用该方法检测蛋白抑制剂活性具有灵敏,快捷,信号强、可逆、干扰小、检测方便和成本可控等优点。
5.一种基于荧光素酶的新冠病毒棘突蛋白和人血管紧张素酶互作检测细胞模型,所述细胞模型的构建方法为:
6.通过将荧光素酶小亚基(smbit)连接到rbd羧基端得到rbd-smbit标签蛋白,将荧光素酶大亚基(lgbit)连接到ace2氨基端得到lgbit-ace2标签蛋白;将含编码表达标签蛋白的质粒直接转染hek293细胞,标签蛋白通过信号肽引导,使之跨膜分泌到培养基中,再从从细胞培养基中利用其中的组氨酸标签进行纯化。
7.进一步的,所述rbd-smbit标签蛋白的氨基酸序列如seq id no.1所示。
8.进一步的,所述lgbit-ace2标签蛋白的氨基酸序列如seq id no.2所示。
9.所述细胞模型在新冠病毒rbd和ace2相互作用抑制剂的高通量筛选中的应用,具体包括以下步骤:
10.1)含有荧光素酶亚基的rbd-smbit和lgbit-ace2标签蛋白底物中荧光素酶活性的滴定;将纯化的rbd-smbit和lgbit-ace2标签蛋白按照1:2不同的浓度梯度连续稀释到384孔板中,根据其活性确定具体实验时所用的稀释浓度;
11.2)利用自动分液器将稀释好的rbd-smbit标签蛋白加入384孔板中,每孔加10μl;
12.3)稀释待筛选化合物至50μm,加入5μl/孔50mm的化合物到步骤2)的384孔板中,室
温下孵育30分钟,让化合物充分结合rbd-smbit标签蛋白;
13.4)在步骤3)经过孵育后的384孔板中加入稀释好的lgbit-ace2标签蛋白,每孔加10μl,混匀离心收集,室温反应30分钟;
14.5)加入25μl荧光底物,混匀离心收集,室温平衡10分钟读板。
15.进一步的,所述步骤1)具体的做法是rbd-smbit标签蛋白按坐标横向稀释,lgbit-ace2标签蛋白按纵向稀释。稀释的体积各为10μl。稀释混匀好后,加入20μl荧光底物检测荧光素酶的活性。
16.有益效果
17.1本发明采用了nanobit荧光素酶互补的检测技术,该技术的优势在于具有更准确的ppi生物模型,小蛋白标签,对目的蛋白构像干扰小。灵敏度更高,有明亮的信号,降低背景,提高了灵敏度。互补作用可逆,能够精确分析蛋白的结合和解离。检测更简单,普通发光检测仪即可检测,无需特定滤光片或进样器,试剂稳定性高。可调整放大实验通量,适合96孔,384孔,1536孔板高通量检测,可用于药物筛选。
18.2本发明检测方法简单,经济,有一定的普遍适应性。大多数小实验室都可以进行类似操作,完成小批量的蛋白互作检测以及抑制剂活性分析。本发明可以微量化,用作高通量筛选。微量化后,所用试剂的量进一步减少,大大降低实验成本。
附图说明
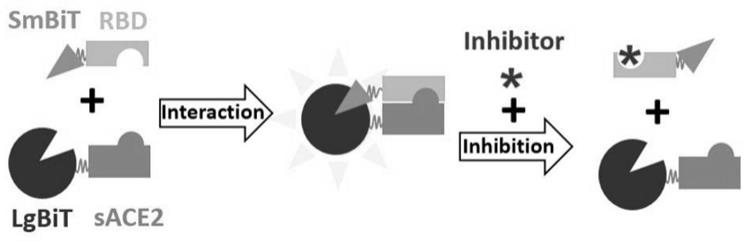
19.图1为nanobit酶学互补方法检测蛋白抑制剂活性原理图。
20.图2为rbd与smbit的标记位置。
21.图3为ace2与lgbit的标记位置。
22.图4为含有荧光素酶的底物中荧光素酶活性的滴定结果。
23.图5为新冠病毒rbd和ace2抑制剂的高通量筛选流程图。
具体实施方式
24.下面详细描述本发明的实施方式,所述实施方式的示例在附图中示出。下面通过参考附图描述的实施方式是示例性的,仅用于解释本发明,而不能解释为对本发明的限制。
25.本发明的一种基于荧光素酶的新冠病毒棘突蛋白和人血管紧张素酶互作检测细胞模型用于验证和筛选小分子化合物可否阻断ace2与rbd相互作用,判断其是否可以阻断病毒与宿主细胞受体的识别与结合。
26.smbit和lgbit之间的亲和力比较低,不易互相结合,只有当rbd和ace2结合时,才能将smbit和lgbit带到一起,互补形成功能复合体,使荧光素酶具备活性,催化底物发荧光。当有理想的小分子化合物阻断rbd和ace2相互作用时,荧光素酶亚基无法结合形成完整荧光素酶,无法催化底物产生荧光,这样就能筛选出小分子化合物。具体设计原理如图1所示。本专利将荧光素酶smbit连接到rbd羧基端;而不是氨基端。将荧光素酶lgbit连接到ace2氨基端;而不是羧基端。在特定的位置接入荧光素酶,是保证rbd和ace2能够继续相互作用的关键。具体的氨基酸位置,请见图2和图3。
27.实施例1生产rbd-smbit和lgbit-ace2标签蛋白。
28.将含编码表达标签蛋白的质粒直接转染hek293细胞,标签蛋白通过信号肽引导,
使之跨膜分泌到培养基中,再从从细胞培养基中利用其中的组氨酸标签进行纯化。本专利设计的蛋白表达纯化简单易行,成本可控;表达的蛋白结构稳定便于储存使用。
29.所述rbd-smbit标签蛋白的氨基酸序列如seq id no.1所示;其中xaa为省略的ace2的部分氨基酸。
30.所述lgbit-ace2标签蛋白的氨基酸序列如seq id no.2所示;其中xaa为省略的rbd的部分氨基酸。
31.实施例2含有荧光素酶亚基的rbd-smbit和lgbit-ace2标签蛋白底物中荧光素酶活性的滴定。
32.将纯化的rbd-smbit和lgbit-ace2标签蛋白按照1:2不同的浓度梯度连续稀释到384孔板中。具体的做法是rbd-smbit标签蛋白按坐标横向稀释,lgbit-ace2标签蛋白按纵向稀释。稀释的体积各为10μl。稀释混匀好后,加入20μl荧光底物检测荧光素酶的活性。根据其活性确定具体实验时所用的稀释浓度。不同批次的产物,在稀释4倍之后,可以得到稳定强烈的实验信号。在筛选实验中,我们一般使用的浓度范围为荧光读值100000单位为宜。结果如图4所示。
33.实施例3新冠病毒rbd和ace2相互作用抑制剂的高通量筛选。
34.具体方法如图5所示。1)利用自动分液器将稀释好的rbd-smbit标签蛋白加入384孔板中,每孔加10μl;
35.2)稀释待筛选化合物至50μm,加入5μl/孔50mm的化合物到步骤1)的384孔板中,室温下孵育30分钟,让化合物充分结合rbd-smbit标签蛋白;
36.3)在步骤2)经过孵育后的384孔板中加入稀释好的lgbit-ace2标签蛋白,每孔加10μl,混匀离心收集,室温反应30分钟;
37.4)加入25μl荧光底物,混匀离心收集,室温平衡10分钟读板。在384孔板上,a2-d2是阳性对照(内含没有标记的rbd,可与lgbit-ace2竞争。n23-o23是阴性对照(内含0.5%dmso)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。