1.本公开涉及类器官体外培养及分析技术领域,具体涉及一种利用机械拉伸诱导肠类器官生长的类器官培养方法。
背景技术:
2.类器官是利用干细胞的自组织潜能和记忆潜能体外构建的多细胞三维培养物,可以在细胞的类型、组织结构和功能方面模拟其相应的体内器官。近年来,类器官培养技术飞速发展,已报道成功培养的类器官有肠、肝脏、胃、胰腺、肺、视网膜、大脑、垂体、肾脏、子宫、前列腺、睾丸、内耳、乳腺等类器官,以及各种肿瘤组织类器官。体外培养的类器官在组织创伤修复和器官再生中展现出巨大潜力,也成为组织工程和再生医学发展的重要方向。
3.世界上首例类器官-小肠类器官的培养体系是由荷兰科学家hansclever建立的。用基质胶matrigel裹挟原代小肠隐窝或lgr5肠成体干细胞,在体外成功建立了具有肠结构特征的三维培养物,其包含肠上皮所有的细胞类群,保留了“陷窝-绒毛”形态结构,可以在体外长期维持,是研究肠上皮稳态的重要工具。
4.小肠作为重要的消化器官,其表面的粘膜层在正常发挥生理功能的情况下会受到多种力学因素的影响。例如:肠腔内相对较硬的食糜对肠道带来的压力、拉伸和剪切力,肠粘膜肠绒毛有节奏的运动会带来循环应力,此外,肠壁内部的肌肉通过收缩和舒张使得肠蠕动从而引起上皮细胞有节律的拉伸形变。除了直接影响肠生理功能的发挥,力学因素还作用于肠上皮生长发育和形态发生。例如,力学因素在肠道发育中扮演重要角色,肠道回转、绒毛形成以及肠道干细胞定位都与力学作用直接相关。
5.现行的肠类器官培养体系是单纯依赖生物因素(基质胶、生长因子和培养基)的静态三维培养系统,忽略了机械力等物理因素的作用,虽然培养出的类器官在一定程度上能够在细胞构成和组织结构上概括其对应器官的特征,但是相较于在体内动态复杂的生化物理环境中生长发育的组织器官而言,类器官和其对应器官仍存在较大差距,无法全面有效的模拟体内生理状态,因而有必要通过引入机械力因素完善肠类器官培养系统。
技术实现要素:
6.本公开旨在提供一种利用机械力诱导肠类器官生长的类器官培养方法。
7.为达到上述目的,本公开提供了一种利用机械拉伸诱导肠类器官生长的类器官培养方法,包括:
8.步骤s1:将细胞与基质胶混合均匀并锚定于培养类器官的培养装置内;
9.步骤s2:加入完全培养基,在类器官培养至刚刚形成隐窝时对类器官开始进行机械拉伸,直至类器官培养成熟。
10.上述方案中,步骤s1中所述细胞为人源或动物来源的肠原代隐窝,或为肠类器官传代过程中被机械打散的碎片,或为通过酶解、分选得到的肠lgr5-egfp单细胞。
11.上述方案中,步骤s2中所述完全培养基包括advanced dmem/f12, b27,glutamax,
n-acetylcystene,以及生长因子r-spondin1,noggin和 egf。
12.上述方案中,步骤s1中所述细胞为人源的肠原代隐窝时,所述完全培养基还需加入gastrin,nicotinamide,a83-01,prostaglandin e2和 sb202190;或者步骤s1中所述细胞为通过酶解、分选得到的肠lgr5-egfp 单细胞时,所述完全培养基还包括小分子chir99021和valproic acid。
13.上述方案中,步骤s1中所述的类器官培养装置采用可拉伸材料底膜,用于配合机械拉伸的加载。
14.上述方案中,步骤s2中所述在类器官培养至刚刚形成隐窝时对类器官开始进行机械拉伸,是在类器官培养至刚刚“出芽”的状态时对类器官开始进行机械拉伸,其中对于小鼠原代隐窝需要培养2-3天,对于类器官传代需要培养1-2天,对于lgr5单细胞需要培养6-7天。
15.上述方案中,所述机械拉伸是以气体压力或伺服电机作为驱动元件的拉伸装置来实现单轴、双轴和周向拉伸。
16.上述方案中,步骤s2中所述加入完全培养基,在类器官培养至刚刚形成隐窝时,还包括将完全培养基替换为不包含r-spondin1的培养基,然后再继续执行所述对类器官开始进行机械拉伸,直至类器官培养成熟。
17.上述方案中,所述不包含r-spondin1的培养基包括:advanceddmem/f12,b27,glutamax,n-acetylcystene,以及生长因子noggin和 egf。
18.上述方案中,在步骤s1中所述细胞为人源的肠原代隐窝时,所述不包含r-spondin1的培养基还需加入gastrin,nicotinamide,a83-01, prostaglandin e2和sb202190;或者在步骤s1中所述细胞为通过酶解、分选得到的肠lgr5-egfp单细胞时,所述不包含r-spondin1的培养基还包括小分子chir99021和valproic acid。
19.上述方案中,步骤s2中所述类器官培养成熟后,还包括:收集机械拉伸加载条件下培养的类器官,以静态培养的类器官作为对照,对拉伸加载条件下培养的类器官的干性相关基因表达水平进行测定,对拉伸加载条件下培养的类器官的细胞增殖情况进行测定,以及对拉伸加载条件下培养的类器官的干性相关蛋白表达情况进行测定。
20.从上述技术方案可以看出,本公开的有益效果:
21.1、本公开提供的利用机械拉伸诱导肠类器官生长的类器官培养方法,创新性的将机械拉伸引入肠类器官培养体系,建立了有机械力参与的类器官动态培养体系,解决了类器官静态培养忽略力学因素的问题,克服了传统类器官静态培养的缺点,挖掘了力学因素在类器官培养中的巨大价值。
22.2、本公开提供的利用机械拉伸诱导肠类器官生长的类器官培养方法,应用机械拉伸诱导肠类器官生长和肠干细胞干性增强,提高了肠类器官的培养效率,有助于体外培养获得大尺寸、高成熟度的类器官,为类器官应用于再生生物领域、推动类器官再生生物学研究具有重要意义。
23.3、本公开提供的利用机械拉伸诱导肠类器官生长的类器官培养方法,采用机械拉伸诱导类器官干性增强,该力学效应可部分替代生长因子 r-spondin1的生物学效应,并据此对培养基做了去除r-spondin1的优化,有效降低了肠类器官的培养成本,是对传统类器官静态培养体系的优化和提升。
附图说明
24.本公开的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
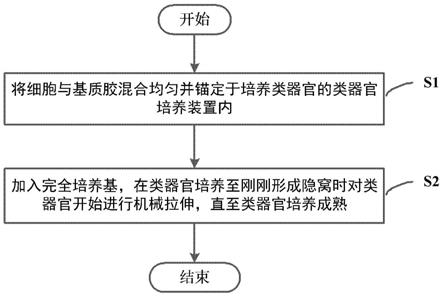
25.图1是依照本公开实施例的利用机械拉伸诱导肠类器官生长的类器官培养方法的流程图。
26.图2是依照本公开实施例的肠类器官机械拉伸加载示意图,其中上图为俯视图,下图为侧视截面图;
27.图3显示了机械拉伸加载力学参数,包括波形、振幅和频率。
28.图4是采用图2所示的机械拉伸加载方式培养的类器官,通过倒置显微镜明场观察得到的图像,其中左图做为对照是静态培养的类器官,右图是接受机械拉伸刺激的类器官。
29.图5是利用实时荧光定量pcr对干性相关基因进行检测,结果显示机械拉伸组比静态培养组的干性相关基因表达量均有上调。
30.图6是对ki67的免疫组化染色,相对静态培养的类器官,机械拉伸加载组的细胞增殖更加旺盛。
31.图7是对mmp7的免疫组化染色。相对静态培养的类器官,机械拉伸加载组的阳性细胞比率更高。
32.图8是对sox9的免疫组化染色。相对静态培养的类器官,机械拉伸加载组的阳性细胞比率更高。
33.图9是对olfm4的免疫组化染色。相对静态培养的类器官,机械拉伸加载组干性相关蛋白的积累更多。
34.图10是用去除r-spondin1的培养基培养的肠类器官,其中左图是静态培养的类器官,右图是接受机械拉伸刺激的类器官,可以明显看到拉伸组类器官的尺寸显著大于静态培养组。
35.图11是对用完全培养基培养的肠类器官和用去除r-spondin1的培养基培养的肠类器官进行实时荧光定量检测。lgr5,axin2,sox9和olfm4 是干性相关基因,也是wnt信号通路的靶基因。定量pcr结果显示,由于撤掉r-spondin1,静态培养组lgr5,axin2,sox9和olfm4的转录水平显著下降,机械拉伸激活了wnt通路,有效挽救去除r-spondin1导致 lgr5,axin2,sox9和olfm4表达下调。
具体实施方式
36.为使本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本公开进一步详细说明。
37.本公开提供了一种利用机械拉伸诱导肠类器官生长的类器官培养方法。该方法首先将包含有原代或传代肠干细胞的基质胶锚定在类器官培养装置内,加入完全培养基培养,培养至刚刚分裂出隐窝的状态时,将其转移至拉力装置,启动真空泵,通过周期性拉伸类器官培养装置橡胶底带动胶条形变,进而对类器官进行机械拉伸;最后收集类器官,并对其从组织、细胞水平和分子水平进行评价。其中,在对机械拉伸加载条件下培养的类器官进行评价时,主要是评价机械拉伸对肠类器官干性影响,以及力学效应替代生长因子的生物学效应。
38.如图1所述,图1是依照本公开实施例的利用机械拉伸诱导肠类器官生长的类器官培养方法的流程图,该方法包括以下步骤:
39.步骤s1:将细胞与基质胶混合均匀并锚定于培养类器官的类二器官培养装置内;
40.步骤s2:加入完全培养基,在类器官培养至刚刚形成隐窝时对类器官开始进行机械拉伸,直至类器官培养成熟。
41.在本公开实施例中,步骤s1中所述细胞为人源或动物来源的肠原代隐窝,或为肠类器官传代过程中被机械打散的碎片,或为通过酶解、分选得到的肠lgr5-egfp单细胞。所述基质胶为matrigel和i型胶原按照适当比例均匀混合的凝胶,既能稳定形成3d结构支撑类器官生长,又保持了良好的韧性以配合周期性拉伸。可选地,所述适当比例为体积比1:1。
42.在本公开实施例中,步骤s1包括:以人源或动物来源的肠原代隐窝,或肠类器官传代过程中被机械打散的碎片,或通过酶解、分选得到的肠 lgr5-egfp单细胞,与基质胶混合均匀并塑造成线性胶条锚定于类器官培养装置内。
43.具体而言,以小鼠的肠原代隐窝培养类器官,取6-8周雄性c57bl/6 小鼠的肠,用眼科剪纵向剖开,再用预冷的无钙、镁离子磷酸盐缓冲溶液清洗去除肠道中的食糜。将肠绒毛面朝上铺开,用灭菌的手术刀轻轻刮除绒毛并清洗干净,随后分割成长度约0.5厘米的组织碎片,用包涵 5mm edta的磷酸缓冲液4℃消化半小时。反复清洗消化完成的肠组织碎片,用剪掉尖端的1ml移液器枪头反复吹打至隐窝释放,随后用70μm孔径的细胞过滤器去除大块组织,收集滤出液,以150g转速离心1分钟,最后去除上清液,用基质胶重悬隐窝沉淀,混合均匀放置于4℃冰盒待用。
44.以肠类器官传代过程中被机械打散的碎片培养类器官,用移液枪或注射器吹打类器官-磷酸盐缓冲溶液悬液,使隐窝类似结构从小肠类器官中释放,然后以150g转速离心5分钟,去除上清液,用基质胶重悬隐窝沉淀,混合均匀放置于4℃冰盒待用。
45.以肠lgr5-egfp单细胞培养类器官,lgr5-egfp单细胞可以来自于 lgr5-egfp-ires-creert2小鼠肠组织,也可以来自于以该种工具小鼠分离培养的肠类器官。用tryple把小鼠肠组织或类器官解离成单细胞,流式分选出携带gfp标签的lgr5细胞,用基质胶混合均匀放置于4℃冰盒待用。
46.在步骤s1中,可借助真空泵将孔板的橡胶底膜贴附在凹槽模具上,把基质胶和细胞的混合物点进孔板凹槽内,37℃孵育半小时,释放真空泵,即塑造成线性胶条。孔板为6孔板,底部为可拉伸橡胶底膜,孔内直径两端有两个尼龙抓手,可用于锚定线性胶条。
47.在本公开实施例中,步骤s2中所述完全培养基包括advanceddmem/f12,b27,glutamax,n-acetylcystene,以及生长因子r-spondin1, noggin和egf。其中,在步骤s1中所述细胞为人源的肠原代隐窝时,所述完全培养基还需加入gastrin,nicotinamide,a83-01,prostaglandin e2 和sb202190;在步骤s1中所述细胞为通过酶解、分选得到的肠lgr5-egfp 单细胞时,所述完全培养基还包括小分子chir99021和valproic acid。
48.在本公开实施例中,所述类器官培养装置采用橡胶底孔板,所述橡胶底孔板的底部为可拉伸材料底膜,用于配合机械拉伸的加载。其中,所述可拉伸材料底膜中的可拉伸材料可以采用橡胶或pdms等。
49.在本公开实施例中,步骤s2中所述在类器官培养至刚刚形成隐窝时对类器官开始进行机械拉伸,是在类器官培养至刚刚“出芽”的状态时开始对类器官开始进行机械拉伸,
其中对于小鼠原代隐窝需要培养2-3天,对于类器官传代需要培养1-2天,对于lgr5单细胞需要培养6-7天。
50.在本公开实施例中,所述机械拉伸是以气体压力或伺服电机作为驱动元件的拉伸装置来实现单轴、双轴和周向拉伸。
51.在本公开实施例中,步骤s2中所述机械拉伸可以是以气体压力作为驱动元件的拉伸装置来实现单轴、双轴和周向拉伸,也可以是以伺服电机作为驱动元件的拉伸装置来实现单轴拉伸或等轴正交拉伸,具体地:
52.在所述机械拉伸是以气体压力作为驱动元件的拉伸装置来实现单轴、双轴和周向拉伸时,具体包括:以气体压力作为驱动元,使用弹性薄膜作为拉伸单元,气体压力施加至弹性薄膜使其发生膨胀,产生单轴、双轴和周向形变,从而对黏附在薄膜表面的细胞进行单轴、双轴和周向拉伸;其中,气体压力的施加参数为:频率控制在1hz以内,可选地频率为0.2hz;拉伸应变控制在15%以内,可选地振幅为8%应变。另外,为了保证力的周期性加载为平缓变化,施力波形可选为正弦曲线。
53.在所述机械拉伸是以伺服电机作为驱动元件的拉伸装置来实现单轴拉伸时,具体包括:单轴拉伸单元采用伺服电机作为驱动源,丝杠螺母作为传动部件通过联轴器与伺服电机联接;伺服电机运行拉动安装在丝杠螺母上的弹性细胞培养池共同运动,其中运动位移系根据伺服电机的步长、丝杠的螺距计算得到。
54.在所述机械拉伸是以伺服电机作为驱动元件的拉伸装置来实现等轴正交拉伸时,具体包括:双轴拉伸是在单轴拉伸的状态上,在垂直方向上添加另一单轴拉伸状态,形成平面内正交的双轴拉伸状态;其中双轴拉伸系通过调整正交的两个方向上的拉伸应变水平,来实现耦合应变矢量方向的动态调整。
55.进一步地,在施力过程结束后,用镊子把包含类器官的胶条从橡胶底孔板中取出、储存在trizol或多聚甲醛中,用于后续样本分析。
56.在本公开一个实施例中,步骤s2中所述类器官培养成熟后,还包括:评价机械拉伸对肠类器官干性影响,具体包括:
57.收集机械拉伸加载条件下培养的类器官,以静态培养的类器官作为对照,对拉伸加载条件下培养的类器官的干性相关基因表达水平进行测定,对拉伸加载条件下培养的类器官的细胞增殖情况进行测定,以及对拉伸加载条件下培养的类器官的干性相关蛋白表达情况进行测定。
58.在上述实施例中,所述对机械拉伸加载条件下培养的类器官的干性相关基因表达水平进行测定包括:提取类器官样品的总rna并反转录合成 cdna,以合成的cdna为模板,利用实时荧光定量pcr检测干性相关基因的mrna表达水平,或通过转录组测序了解基因组的整体变化趋势。
59.在上述实施例中,干性相关基因包括lgr5,olfm4,misi,ascl2。用到的时时荧光pcr引物序列有:lgr5正向5
’‑
cgtaggcaacccttctc ttatc-3’和反向5
’‑
gcaccattcaaagtcagtgttc-3’;olfm4正向 5
’‑
ctgggtggcacctttgaata-3’和反向5
’‑
agtctcggaagtgg gaataga-3’;misi正向5
’‑
gatgggaccttcatggtttct-3’和反向 5
’‑
ccctttgctttcctggtatct-3’;ascl2正向5
’‑
gtgcctgtaga gtacattcgg-3’和反向5
’‑
aggtgtgcttccatgctc-3’。
60.在上述实施例中,所述对机械拉伸加载条件下培养的类器官的细胞增殖情况进行测定,以及对拉伸加载条件下培养的类器官的干性相关蛋白表达情况进行测定,包括:利用免疫组化或免疫荧光的方法检测类器官细胞增殖情况或干性相关蛋白水平;首先需要收集类器官样本,经过固定、脱水,二甲苯透明化,浸蜡,石蜡包埋,制成石蜡切片;组织切片经过脱蜡、复水、抗原表位修复、灭内源性过氧化物酶、封闭;最后选择适当的一抗孵育,随后二抗孵育,最后显色封片。
61.具体而言,所述对机械拉伸加载条件下培养的类器官的细胞增殖情况进行测定,包括:固定于多聚甲醛的肠类器官经过脱水,二甲苯透明化,浸蜡,石蜡包埋,制成石蜡切片;组织切片经过脱蜡、复水、抗原表位修复、灭内源性过氧化物酶、封闭后分别孵育抗小鼠ki67,mmp7和sox9 的抗体,hrp标记二抗,最后dab显色后封片拍照,完成针对上述三个蛋白的免疫组化染色。
62.所述对机械拉伸加载条件下培养的类器官的干性相关蛋白表达情况进行测定,包括:依照上述对拉伸条件下培养的类器官的细胞增殖情况进行测定的操作流程,将类器官样本制成石蜡切片,并对olfm4进行免疫组化染色。
63.在本公开的另一个实施例中,本公开还提供了一种利用力学效应替代生长因子r-spondin1生物学效应的肠类器官培养方法,该方法是步骤s2 中所述加入完全培养基,在类器官培养至刚刚形成隐窝时,将完全培养基替换为不包含r-spondin1的培养基,然后再继续执行所述对类器官开始进行机械拉伸,直至类器官培养成熟。
64.在该实施例中,所述不包含r-spondin1的培养基包括:advanceddmem/f12,b27,glutamax,n-acetylcystene,以及两种生长因子noggin 和egf。
65.在该实施例中,在步骤s1中所述细胞为人源的肠原代隐窝时,所述不包含r-spondin1的培养基还需加入gastrin,nicotinamide,a83-01, prostaglandin e2和sb202190。在步骤s1中所述细胞为通过酶解、分选得到的肠lgr5-egfp单细胞时,所述不包含r-spondin1的培养基还包括小分子chir99021和valproic acid。
66.在上述实施例中,步骤s2中所述类器官培养成熟后,还包括:收集拉伸加载下培养的类器官,以静态培养的类器官作为对照,对拉伸加载条件下培养的类器官的干性相关基因表达水平进行测定,对拉伸加载条件下培养的类器官的细胞增殖情况进行测定,以及对拉伸加载条件下培养的类器官的干性相关蛋白表达情况进行测定。
67.在上述实施例中,对拉伸培养的类器官的干性相关基因表达水平进行测定,包括:提取类器官样品的总rna并进行转录组测序或实时荧光定量pcr分析来检测基因水平的变化。
68.在上述实施例中,对机械拉伸加载条件下培养的类器官的细胞增殖情况进行测定,以及对拉伸加载条件下培养的类器官的干性相关蛋白表达情况进行测定,包括:通过免疫组化或免疫荧光的方法检测类器官细胞增殖情况或干性相关蛋白水平;首先需要收集类器官样本,经过固定、脱水,二甲苯透明化,浸蜡,石蜡包埋,制成石蜡切片;组织切片经过脱蜡、复水、抗原表位修复、灭内源性过氧化物酶、封闭;最后选择适当的一抗孵育,随后二抗孵育,最后显色封片。
69.具体而言,本公开还提供了一种利用力学效应替代生长因子r-spondin1生物学效应的肠类器官培养方法,包括以下步骤:
70.(1)以小鼠的肠原代隐窝,或肠类器官传代过程中被机械打散的碎片,或通过酶解、分选得到的肠lgr5-egfp单细胞,与基质胶混合均匀并塑造成线性胶条锚定于橡胶底孔板内;
71.(2)加入完全培养基培养至类器官刚要“出芽”,即刚刚形成隐窝;
72.(3)将孔板转移至拉力装置之前,将完全培养基替换成不含 r-spondin1的培养基,随后启动真空泵,通过周期性拉伸孔板橡胶底带动胶条形变,进而对埋于基质胶当中的类器官持续进行周期性拉伸;
73.(4)收集培养成熟的类器官,从整体形态上初步对比拉伸培养或静态培养的类器官,并将类器官样本溶解在trizol中或固定在多聚甲醛溶液中用于后续的检测和评价。
74.(5)检测机械拉伸对wnt信号通路的作用,收集用完全培养基和用不含r-spondin1的培养基培养的肠类器官样本,提取rna并反转录,利用实时荧光定量pcr检测wnt通路靶基因的转录水平。wnt通路靶基因包括lgr5,axin2,sox9,olfm4等。通过比较不同培养条件下靶基因的转录水平来评价机械拉伸加载对wnt通路的激活效应。
75.在上述实施例中,本公开提出了机械拉伸激活了wnt信号通路,诱导肠类器官干细胞干性增强,该力学效应可部分替代wnt通路激活剂 r-spondin1的生物学效应,并据此对机械拉伸诱导的类器官培养体系的培养基做了减少或去除r-spondin1的优化。
76.以下结合附图和实施例对本公开进行详细说明。
77.实施例1
78.本实施例提供了一种为鼠小肠类器官原代培养加载循环机械拉伸的方法,具体包括以下步骤:
79.1.取6-8周雄性c57bl/6小鼠的小肠,用眼科剪纵向剖开,再用预冷的无钙、镁离子磷酸盐缓冲溶液清洗去除肠道中的食糜。将肠绒毛面朝上铺开,用灭菌的手术刀轻轻刮除绒毛并清洗干净,随后分割成长度约0.5 厘米的组织碎片,用包涵5mm edta的磷酸缓冲液4℃消化半小时。反复清洗消化完成的肠组织碎片,用剪掉尖端的1ml移液器枪头反复吹打至隐窝释放,随后用70μm孔径的细胞过滤器去除大块组织,收集滤出液,以150g转速离心2分钟,撇去上清,得到的少量沉淀物即小鼠小肠隐窝。
80.2.matrigel(corning)和i型胶原(collagen i)按照体积比1∶1均匀混合,再用该混合凝胶重悬隐窝,在冰上缓慢吸打均匀,并塑造成线性胶条锚定于橡胶底孔板内。加入完全培养基,放置于37℃培养箱静态培养三天。培养基由advanced dmem/f12,b27,glutamax,n-acetylcystene,以及生长因子r-spondin1,noggin和egf组成;对于人源类器官还需加入gastrin,nicotinamide,a83-01,prostaglandin e2和sb202190。。
81.3.经过三天的静态培养,原代类器官刚刚长到“出芽”状态,将孔板转移至力学加载装置上,施加8%的机械应变,施力频率0.2hz,施力波形为正弦曲线。如图2和图3所示,图2展示了进行机械拉伸的方式,图 3展示了施力的频率、振幅和波形。
82.4.在机械拉伸的刺激下培养三天后收集类器官,通过倒置显微镜名场初步观察静态培养组和机械拉伸加载组在形态上的差距,如图4所示,相比静态培养的类器官,拉伸组类器官具有更大尺寸,说明机械拉伸诱导肠类器官生长。
83.实施例2
84.本实施例提供了一种评价机械拉伸对肠类器官干细胞干性影响的检测方法,具体
包括以下步骤:
85.1.收集机械拉伸加载条件下培养的类器官,同时以静态培养的类器官做为对照,分别溶解在trizol中,提取总rna,并反转录合成cdna。以合成的cdna为模板,利用实时荧光定量pcr检测干性相关基因lgr5, olfm4,misi,ascl2的mrna表达水平。如图5所示,相比静态培养组,干性相关基因lgr5,olfm4,misi,ascl2在拉伸组中都有显著的上调表达。
86.2.收集机械拉伸加载条件下培养的类器官,同时以静态培养的类器官做为对照,分别利用多聚甲醛对类器官进行固定;随后经过脱水,二甲苯透明化,浸蜡,石蜡包埋,制成石蜡切片;组织切片经过脱蜡、复水、抗原表位修复、灭内源性过氧化物酶、封闭后分别孵育抗小鼠ki67,mmp7 和sox9的抗体,hrp标记二抗,最后dab显色后封片拍照,完成针对上述三个蛋白的免疫组化染色。图6是对ki67的免疫组化染色,结果显示拉伸组相比对照组包含了更高比例的阳性细胞数,表明机械拉伸诱导类器官细胞增殖。图7是对潘氏细胞标记物mmp7的免疫组化染色,潘氏细胞与lgr5肠干细胞间隔排列,因此拉伸组潘氏细胞比例的升高暗示了lgr5 肠干细胞数量增多的可能性。图8是对干细胞标记物sox9的免疫组化染色,其中拉伸组阳性细胞数的比例显著高于静态培养组,表明机械拉伸诱导了干细胞的增殖。
87.3.此外,依照上述免疫组化的操作流程,对干性相关蛋白olfm4进行分析测定。如图9所示,机械拉伸加载组中olfm4蛋白量显著高于对照组。
88.该实施例通过检测干性相关基因的mrna转录水平,细胞增殖尤其是干细胞增殖情况,以及测定干性相关蛋白的表达量,证明机械拉伸诱导了肠类器官干细胞增殖和干性增强。
89.实施例3
90.本公开还提供了利用力学效应替代生长因子r-spondin1的肠类器官原代培养方法,具体包括以下步骤:
91.1.取6-8周雄性c57bl/6小鼠的小肠,用眼科剪纵向剖开,再用预冷的无钙、镁离子磷酸盐缓冲溶液清洗去除肠道中的食糜。将肠绒毛面朝上铺开,用灭菌的手术刀轻轻刮除绒毛并清洗干净,随后分割成长度约0.5 厘米的组织碎片,用包涵5mm edta的磷酸缓冲液4℃消化半小时。反复清洗消化完成的肠组织碎片,用剪掉尖端的1ml移液器枪头反复吹打至隐窝释放,随后用70μm孔径的细胞过滤器去除大块组织,收集滤出液,以150g转速离心2分钟,撇去上清,得到的少量沉淀物即小鼠小肠隐窝。
92.2.matrigel(corning)和i型胶原(collagen i)按照体积比1∶1均匀混合,再用该混合凝胶重悬隐窝,在冰上缓慢吸打均匀,并塑造成线性胶条锚定于橡胶底孔板内。加入完全培养基,放置于37℃培养箱静态培养三天。培养基由advanced dmem/f12,b27,glutamax,n-acetylcystene,以及生长因子r-spondin1,noggin和egf组成;对于人源类器官还需加入gastrin,nicotinamide,a83-01,prostaglandin e2和sb202190。
93.3.经过三天的静态培养,原代类器官刚刚长到“出芽”状态,此刻将完全培养基替换成不含r-spondin1的培养基,随后将孔板转移至拉力装置上,施加8%的机械应变,施力频率0.2hz,施力波形为正弦曲线。如图2和图3所示,图2展示了施加机械拉伸的方式,图3展示了施力的频率、振幅和波形。
94.4.在机械拉伸的刺激下培养三天后收集类器官,通过倒置显微镜明场初步观察静态培养组和拉伸组在形态上的差距,如图10所示,相比静态培养的类器官,拉伸组类器官尺
寸显著大于静态培养组。
95.5.收集的类器官样本溶解在trizol,经过总rna提取和反转录,利用实时荧光定量pcr检测lgr5,axin2,sox9和olfm4的转录水平。如图11所示,由于撤掉r-spondin1,静态培养组lgr5,axin2,sox9和olfm4 的转录水平显著下降,机械拉伸的加载有效挽救了这种下降趋势,甚至追平了完全培养基培养的拉伸组的转录水平。lgr5,axin2,sox9和olfm4 是干性相关基因,也是wnt信号通路的靶基因。
96.实验结果表明,机械拉伸加载类器官培养体系,激活了wnt信号通路,诱导肠类器官干细胞干性增强,其力学效应从某种程度上能够取代 r-spondin1的生物学效应。
97.在本说明书的描述中,参考术语“实施例”、“一个实施例”、“另一个实施例”、或“某些实施例”等的描述意指结合所述实施例或示例描述的具体特征、结构、材料或者特点包含于本公开的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
98.申请人声明,本公开通过上述实施例来说明本公开提供的机械力诱导肠类器官生长的培养方法,但本公开并不局限于上述工艺步骤,即不意味着本公开必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本公开的任何改进,对本公开所选用原料的等效替换及辅助成分的添加、施力具体方式的选择等,均落在本公开的保护范围和公开范围之内。
99.此外,本说明书所阐述的实验技术细节,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本公开可实施的限定条件,故应用此方法培养小鼠肠类器官之外的其他类型的类器官,如各种人源类器官和肿瘤类器官,并达到诱导类器官生长的目的下,均应仍落在本公开所揭示的技术内容能涵盖的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。