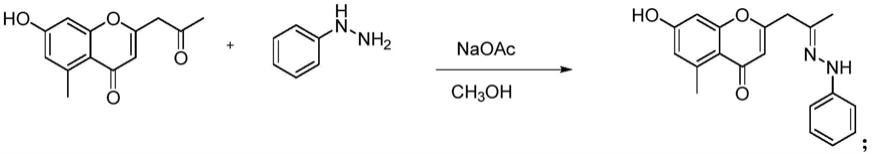
检测h7亚型高低致病性禽流感病毒的特异性引物和探针及试剂盒
技术领域
1.本发明属于rt-pcr检测试剂盒技术领域。
背景技术:
2.禽流感(avian influenza,ai)是由正粘病毒科、流感病毒属a型流感病毒(avian influenza virus,aiv)引起的禽类(家禽或野禽,及部分哺乳动物)的动物传染病。禽流感病毒为单股负链rna,多形态的囊膜病毒。aiv基因组分为8个节段,根据病毒囊膜表面的血凝素(ha)和神经氨酸酶(na)两个糖蛋白抗原性不同,禽流感病毒分为多个血清亚型,其中rna片段4编码血凝素(ha),它是aiv基因组中变异率最大的一个片段,不同亚型病毒以及同一亚型不同毒株之间均有很大差异。其中,高致病禽流感(hpai)主要是h5亚型、h7亚型、h9亚型,在危害级别上hpai属于我国一类动物疫病,oie法定报告的动物疫病。
3.至今为止,从禽类体内已经分离到上千种毒力各异的毒株,不同亚型毒株对宿主的致病力差异显著,另外,禽流感病毒除了可以感染禽类外,部分亚型也能感染人,如在2013年春,我国华东地区先后发生不明原因重症肺炎病例,经病原体分离鉴定为h7n9亚型 aiv,但该病毒对家禽表现低致病性。2016年10月,h7n9第5次流行时,h7n9亚型发生了突变,对家禽表现高致病性,高致病性禽流感可引起鸡群100%死亡。但在同一个亚型中病原突变并分别表现出高致病与低致病,在禽流感中并不多见。
4.基于此,需要建立一种特异性好、敏感性高、准确可靠、快速简便的高低致病性禽流感病毒检测方法,确定高致病性或低致病性,对保障养禽业的健康发展意义重大,同时对人类健康同样具有积极的意义。
技术实现要素:
5.针对目前现有技术存在的问题,本发明目的在于提供一种检测h7亚型高低致病性禽流感病毒的特异性引物和探针,同时提供包含上述特异性引物和探针的试剂盒是本发明的另一发明目的。
6.基于上述目的,本发明采取以下技术方案:一种检测h7亚型高低致病性禽流感病毒的特异性引物和探针,所述特异性引物为h7-f和h7-r,h7-f的序列信息:5
’‑
graaatgtccragatatgtta-3’,h7-r的序列信息:5
’‑
attagkccttcccatccatt-3’;探针为h7-m和h7-w,h7-m的序列信息:5
′‑
aaacggattgcga-3
′
,h7-w的序列信息:5
′‑
tggtgcyatagcdggtttcattg-3
′
。
7.h7-m的5
′
端进行报告荧光染料fam标记,3
′
端进行荧光淬灭基团mgb标记,h7-w的5
′
端进行报告荧光染料vic标记,3
′
端进行荧光淬灭基团bhq1标记。
8.一种检测h7亚型高低致病性禽流感病毒的试剂盒,所述试剂盒包括上述特异性引物和探针。
9.所述试剂盒还包括反转录试剂、扩增试剂、ddh2o、模板。
10.引物h7-f和h7-r浓度均为50μm,探针h7-m和h7-w浓度均为20μm。
11.试剂盒包括反转录试剂0.2-0.4μl、扩增试剂8-10μl、特异性引物:50μm h7-f和h7-r各0.1-0.3μl、探针:20μm h7-m和h7-w各0.3-0.5μl,模板1-3μl,加入ddh2o至20μl,模板为阳性对照、阴性对照中的一种或两种。
12.反转录试剂为e-mix,扩增试剂为2
×
hieff unicon
®ꢀ
taqman mulitiplex qpcr master mix。
13.试剂盒的荧光rt-pcr反应扩增条件:第一阶段,反转录:42℃,15 min;第二阶段,预变性:95℃,30s;第三阶段,pcr扩增:94℃,10s; 60℃,20s ,40个循环,每次循环第三阶段60℃扩增后采集荧光信号,选择荧光通道fam和vic。
14.与现有技术相比,本发明具有以下有益效果:1)发明人针对当前流行的h7亚型的禽流感病毒的ha基因,在ha基因的ha1和ha2水解位点区域4个氨基酸插入且存在不同插入序列,针对该特点,在该区域附近选择靶序列,并筛选设计可兼顾高致病和低致病两种毒株的共用引物,同时加入简并碱基以涵盖不同的变异序列,由华大基因生物公司进行序列测定,测序结果与设计毒株序列完全一致;2)本发明通过扩增条件优化,体系配比调试,特异性和灵敏度试验,建立了禽流感病毒h7亚型高低致病性双重荧光rt-pcr检测试剂盒,该试剂盒单次试验可检测多种,提高工作效率、特异性好、重复性好、操作简便、速度快,通过计算机和分析软件实现qpcr扩增、产物检测和定量分析一体化,最低检出限为10 copies/μl,在检测aiv-h7亚型高致病与低致病鉴别只需54min,缩短检测时间,提高检测效率,可以用于禽的拭子、血液、血清、血浆、组织中的高低致病性h7亚型禽流感病毒检测。
附图说明
15.图1为本发明试剂盒重组质粒peasy-t1-h7-m灵敏度测试曲线;图2为本发明试剂盒重组质粒peasy-t1-h7-w灵敏度测试曲线;图3为本发明试剂盒特异性测试曲线。
具体实施方式
16.下面结合具体实施方式和附图对本发明作进一步说明。
17.实施例1构建特异性引物和探针(taqman探针)及高低致病性h7亚型禽流感病毒基因重组质粒根据2016年10月后的第5次h7n9流行突变毒株与突变前毒株,在ha基因的ha1和ha2水解位点区域4个氨基酸插入且存在不同插入序列,针对该特点,在该区域附近选择靶序列,并筛选设计可兼顾两种毒株的共用引物,同时加入简并碱基以涵盖不同的变异序列。选择的引物分别标记为h7-f和h7-r,taqman探针为h7-m和h7-w。
18.h7-f的序列信息:5
’‑
graaatgtccragatatgtta-3’,seq id no:3h7-r的序列信息:5
’‑
attagkccttcccatccatt-3’,seq id no:4;
taqman探针为h7-m和h7-w,h7-m的序列信息:5
′‑
fam-aaacggattgcga-3
′‑
mgb,seq id no:5,h7-w的序列信息:5
′‑
vic-tggtgcyatagcdggtttcattg-3
′‑
bhq-1,seq id no:6。
19.参考2016年10月后的第5次h7n9流行突变毒株与突变前毒株,在ha1和ha2基因水解位点区域的突变序列,筛选特异性保守区域,设计h7-f和h7-r为共用上下游引物,并以高致病h7和低致病h7毒株核酸为模板,rt-pcr反转录-扩增ha基因;pcr扩增的反应体系为20μl,其中:反转录试剂e mix 0.2μl、扩增试剂2
×
hieff unicon
ꢀ®ꢀ
taqman mulitiplex qpcr master mix 10μl,合成引物h7-f(50μm)和h7-r(50μm)各0.1μl,ddh2o 7.6μl,rt-pcr扩增的反应程序为42℃ 15 min;95℃ 30s;94℃10s60℃20s ,40个循环。胶回收目的基因,分别连接peasy-t1载体,5μl体系;目的基因4μl,peasy-t1 vector 1μll,25℃连接10分钟;连接产物转化入大肠杆菌感受态细胞;挑取单菌落进行pcr检测,由华大基因生物公司进行序列测定,测序结果与设计毒株序列完全一致。
20.其中:反转录试剂e mix,购自北京全式金生物技术有限公司,扩增试剂2
×
hieff unicon
ꢀ®ꢀ
taqman mulitiplex qpcr master mix,购自上海翊圣生物科技有限公司。下述提及的试剂与本实施例相同。
21.实施例2 检测h7亚型高低致病性禽流感病毒的双重荧光rt-pcr试剂盒分别以高致病h7和低致病h7的ha基因为靶基因,设计特异性引物h7-f和h7-r,以及taqman探针h7-m(高致病)、h7-w(低致病),h7-m探针的5
′
端标记报告荧光染料为fam,3
′
端标记荧光淬灭基团为mgb,h7-w探针的5
′
端标记报告荧光染料为vic,3
′
端标记荧光淬灭基团为bhq1,并发送华大基因合成,其中特异性引物分别标记为h7-f和h7-r,taqman探针为h7-m和h7-w。
22.h7-f的序列信息:5
’‑
graaatgtccragatatgtta-3’,seq id no:3h7-r的序列信息:5
’‑
attagkccttcccatccatt-3’,seq id no:4;taqman探针为h7-m和h7-w,h7-m的序列信息:5
′‑
fam-aaacggattgcga-3
′‑
mgb,seq id no:5,h7-w的序列信息:5
′‑
vic-tggtgcyatagcdggtttcattg-3
′‑
bhq-1,seq id no:6。
23.制备检测h7亚型高低致病性禽流感病毒的试剂盒,包括以下步骤:1)将实施例1测序结果正确的peasy-t1-h7-m和peasy-t1-h7-w菌株扩大培养,提取质粒,按浓度1:1混合,并以其为阳性对照进行荧光pcr扩增;2)双重荧光rt-pcr反应体系建立,每管20μl:包括反转录试剂e
‑ꢀ
mix0.4μl、扩增试剂2
×
hieffunicon
®ꢀ
taqman mulitiplex qpcr master mix10μl、特异性引物:50μm h7-f和h7-r各0.2μl、taqman探针:20μm h7-m和h7-w各0.4μl,模板(阳性对照)2μl,加入ddh2o至20μl,反应条件:第一阶段,反转录:42℃,15 min;第二阶段,预变性:95℃,30s;第三阶段,pcr扩增:94℃,10s; 60℃,20s ,40个循环,每次循环第三阶段60℃扩增后采集荧光信号,选择荧光通道fam和vic。
24.其中:阳性对照为等浓度1:1混合的peasy-t1-h7-m和peasy-t1-h7-w重组质粒;所述阴性对照为无核酸水。
25.试剂盒反应体系:反转录试剂e
‑ꢀ
mix 0.4μl、扩增试剂2
×
hieff unicon
®ꢀ
taqman mulitiplex qpcr master mix 10μl、特异性引物:50μm h7-f和h7-r各0.2μl、
taqman探针:20μm h7-m和h7-w各0.4μl,模板2μl,加入ddh2o至20μl,模板为阳性对照、阴性对照或待检样品。
26.结果判定:待检样品fam和vic通道荧光信号均有指数型增加,且ct值均≤38.0,则判断为高致病h7阳性;待检样品vic通道荧光信号有指数型增加,且ct值≤38.0,则判断为低致病h7阳性;待检样品无扩增曲线或者ct值》38.0,则判断为阴性。
27.实施例3试剂盒灵敏度、特异性测试3.1试剂盒灵敏度测试用紫外吸收法测重组质粒peasy-t1-h7-m和peasy-t1-h7-w的浓度,按照1:1浓度比例调整混合至1*106copies/μl,用ddh2o对阳性质粒进行10倍倍比稀释,稀释范围为10-1
~10-5
,分别作为模板进行rt-pcr检测。按试剂盒的反应体系配制试剂和设置反应程序。如图1和2所示。其中,图1为试剂盒重组质粒peasy-t1-h7-m(高致病性h7亚型禽流感)灵敏度测试曲线,图中扩增曲线1-6对应质粒浓度分别为1*105copies/μl、1*104copies/μl、1*103copies/μl、1*102copies/μl、10 copies/μl、阴性对照。图2为试剂盒重组质粒peasy-t1-h7-w(低致病性h7亚型禽流感)灵敏度测试曲线,图中扩增曲线1-6对应质粒浓度分别为1*105copies/μl、1*104copies/μl、1*103copies/μl、1*102copies/μl、10 copies/μl、阴性对照。
28.由图1和2得知,本发明试剂盒的最低检出限为10 copies/μl。
29.试剂盒特异性测试提取禽流感h5亚型病毒核酸、禽流感h9亚型病毒核酸、新城疫病毒核酸、禽传染性支气管炎病毒核酸,分别为模板进行rt-pcr检测,按试剂盒体系配制试剂和设置反应程序。如图3所示,其中,曲线1为以高致病性h7亚型禽流感为模板的曲线,曲线2是以低致病性h7亚型禽流感为模板的曲线,曲线3为阴性曲线,是以禽流感h5亚型病毒核酸、禽流感h9亚型病毒核酸、新城疫病毒核酸、禽传染性支气管炎病毒核酸及阴性对照(曲线重合)为模板的曲线。
30.由图3得知,对禽流感h5亚型病毒核酸、禽流感h9亚型病毒核酸、新城疫病毒核酸、禽传染性支气管炎病毒核酸的检测结果均为阴性,说明本发明试剂盒特异性良好。
31.上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此类技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
技术领域
1.本发明属于rt-pcr检测试剂盒技术领域。
背景技术:
2.禽流感(avian influenza,ai)是由正粘病毒科、流感病毒属a型流感病毒(avian influenza virus,aiv)引起的禽类(家禽或野禽,及部分哺乳动物)的动物传染病。禽流感病毒为单股负链rna,多形态的囊膜病毒。aiv基因组分为8个节段,根据病毒囊膜表面的血凝素(ha)和神经氨酸酶(na)两个糖蛋白抗原性不同,禽流感病毒分为多个血清亚型,其中rna片段4编码血凝素(ha),它是aiv基因组中变异率最大的一个片段,不同亚型病毒以及同一亚型不同毒株之间均有很大差异。其中,高致病禽流感(hpai)主要是h5亚型、h7亚型、h9亚型,在危害级别上hpai属于我国一类动物疫病,oie法定报告的动物疫病。
3.至今为止,从禽类体内已经分离到上千种毒力各异的毒株,不同亚型毒株对宿主的致病力差异显著,另外,禽流感病毒除了可以感染禽类外,部分亚型也能感染人,如在2013年春,我国华东地区先后发生不明原因重症肺炎病例,经病原体分离鉴定为h7n9亚型 aiv,但该病毒对家禽表现低致病性。2016年10月,h7n9第5次流行时,h7n9亚型发生了突变,对家禽表现高致病性,高致病性禽流感可引起鸡群100%死亡。但在同一个亚型中病原突变并分别表现出高致病与低致病,在禽流感中并不多见。
4.基于此,需要建立一种特异性好、敏感性高、准确可靠、快速简便的高低致病性禽流感病毒检测方法,确定高致病性或低致病性,对保障养禽业的健康发展意义重大,同时对人类健康同样具有积极的意义。
技术实现要素:
5.针对目前现有技术存在的问题,本发明目的在于提供一种检测h7亚型高低致病性禽流感病毒的特异性引物和探针,同时提供包含上述特异性引物和探针的试剂盒是本发明的另一发明目的。
6.基于上述目的,本发明采取以下技术方案:一种检测h7亚型高低致病性禽流感病毒的特异性引物和探针,所述特异性引物为h7-f和h7-r,h7-f的序列信息:5
’‑
graaatgtccragatatgtta-3’,h7-r的序列信息:5
’‑
attagkccttcccatccatt-3’;探针为h7-m和h7-w,h7-m的序列信息:5
′‑
aaacggattgcga-3
′
,h7-w的序列信息:5
′‑
tggtgcyatagcdggtttcattg-3
′
。
7.h7-m的5
′
端进行报告荧光染料fam标记,3
′
端进行荧光淬灭基团mgb标记,h7-w的5
′
端进行报告荧光染料vic标记,3
′
端进行荧光淬灭基团bhq1标记。
8.一种检测h7亚型高低致病性禽流感病毒的试剂盒,所述试剂盒包括上述特异性引物和探针。
9.所述试剂盒还包括反转录试剂、扩增试剂、ddh2o、模板。
10.引物h7-f和h7-r浓度均为50μm,探针h7-m和h7-w浓度均为20μm。
11.试剂盒包括反转录试剂0.2-0.4μl、扩增试剂8-10μl、特异性引物:50μm h7-f和h7-r各0.1-0.3μl、探针:20μm h7-m和h7-w各0.3-0.5μl,模板1-3μl,加入ddh2o至20μl,模板为阳性对照、阴性对照中的一种或两种。
12.反转录试剂为e-mix,扩增试剂为2
×
hieff unicon
®ꢀ
taqman mulitiplex qpcr master mix。
13.试剂盒的荧光rt-pcr反应扩增条件:第一阶段,反转录:42℃,15 min;第二阶段,预变性:95℃,30s;第三阶段,pcr扩增:94℃,10s; 60℃,20s ,40个循环,每次循环第三阶段60℃扩增后采集荧光信号,选择荧光通道fam和vic。
14.与现有技术相比,本发明具有以下有益效果:1)发明人针对当前流行的h7亚型的禽流感病毒的ha基因,在ha基因的ha1和ha2水解位点区域4个氨基酸插入且存在不同插入序列,针对该特点,在该区域附近选择靶序列,并筛选设计可兼顾高致病和低致病两种毒株的共用引物,同时加入简并碱基以涵盖不同的变异序列,由华大基因生物公司进行序列测定,测序结果与设计毒株序列完全一致;2)本发明通过扩增条件优化,体系配比调试,特异性和灵敏度试验,建立了禽流感病毒h7亚型高低致病性双重荧光rt-pcr检测试剂盒,该试剂盒单次试验可检测多种,提高工作效率、特异性好、重复性好、操作简便、速度快,通过计算机和分析软件实现qpcr扩增、产物检测和定量分析一体化,最低检出限为10 copies/μl,在检测aiv-h7亚型高致病与低致病鉴别只需54min,缩短检测时间,提高检测效率,可以用于禽的拭子、血液、血清、血浆、组织中的高低致病性h7亚型禽流感病毒检测。
附图说明
15.图1为本发明试剂盒重组质粒peasy-t1-h7-m灵敏度测试曲线;图2为本发明试剂盒重组质粒peasy-t1-h7-w灵敏度测试曲线;图3为本发明试剂盒特异性测试曲线。
具体实施方式
16.下面结合具体实施方式和附图对本发明作进一步说明。
17.实施例1构建特异性引物和探针(taqman探针)及高低致病性h7亚型禽流感病毒基因重组质粒根据2016年10月后的第5次h7n9流行突变毒株与突变前毒株,在ha基因的ha1和ha2水解位点区域4个氨基酸插入且存在不同插入序列,针对该特点,在该区域附近选择靶序列,并筛选设计可兼顾两种毒株的共用引物,同时加入简并碱基以涵盖不同的变异序列。选择的引物分别标记为h7-f和h7-r,taqman探针为h7-m和h7-w。
18.h7-f的序列信息:5
’‑
graaatgtccragatatgtta-3’,seq id no:3h7-r的序列信息:5
’‑
attagkccttcccatccatt-3’,seq id no:4;
taqman探针为h7-m和h7-w,h7-m的序列信息:5
′‑
fam-aaacggattgcga-3
′‑
mgb,seq id no:5,h7-w的序列信息:5
′‑
vic-tggtgcyatagcdggtttcattg-3
′‑
bhq-1,seq id no:6。
19.参考2016年10月后的第5次h7n9流行突变毒株与突变前毒株,在ha1和ha2基因水解位点区域的突变序列,筛选特异性保守区域,设计h7-f和h7-r为共用上下游引物,并以高致病h7和低致病h7毒株核酸为模板,rt-pcr反转录-扩增ha基因;pcr扩增的反应体系为20μl,其中:反转录试剂e mix 0.2μl、扩增试剂2
×
hieff unicon
ꢀ®ꢀ
taqman mulitiplex qpcr master mix 10μl,合成引物h7-f(50μm)和h7-r(50μm)各0.1μl,ddh2o 7.6μl,rt-pcr扩增的反应程序为42℃ 15 min;95℃ 30s;94℃10s60℃20s ,40个循环。胶回收目的基因,分别连接peasy-t1载体,5μl体系;目的基因4μl,peasy-t1 vector 1μll,25℃连接10分钟;连接产物转化入大肠杆菌感受态细胞;挑取单菌落进行pcr检测,由华大基因生物公司进行序列测定,测序结果与设计毒株序列完全一致。
20.其中:反转录试剂e mix,购自北京全式金生物技术有限公司,扩增试剂2
×
hieff unicon
ꢀ®ꢀ
taqman mulitiplex qpcr master mix,购自上海翊圣生物科技有限公司。下述提及的试剂与本实施例相同。
21.实施例2 检测h7亚型高低致病性禽流感病毒的双重荧光rt-pcr试剂盒分别以高致病h7和低致病h7的ha基因为靶基因,设计特异性引物h7-f和h7-r,以及taqman探针h7-m(高致病)、h7-w(低致病),h7-m探针的5
′
端标记报告荧光染料为fam,3
′
端标记荧光淬灭基团为mgb,h7-w探针的5
′
端标记报告荧光染料为vic,3
′
端标记荧光淬灭基团为bhq1,并发送华大基因合成,其中特异性引物分别标记为h7-f和h7-r,taqman探针为h7-m和h7-w。
22.h7-f的序列信息:5
’‑
graaatgtccragatatgtta-3’,seq id no:3h7-r的序列信息:5
’‑
attagkccttcccatccatt-3’,seq id no:4;taqman探针为h7-m和h7-w,h7-m的序列信息:5
′‑
fam-aaacggattgcga-3
′‑
mgb,seq id no:5,h7-w的序列信息:5
′‑
vic-tggtgcyatagcdggtttcattg-3
′‑
bhq-1,seq id no:6。
23.制备检测h7亚型高低致病性禽流感病毒的试剂盒,包括以下步骤:1)将实施例1测序结果正确的peasy-t1-h7-m和peasy-t1-h7-w菌株扩大培养,提取质粒,按浓度1:1混合,并以其为阳性对照进行荧光pcr扩增;2)双重荧光rt-pcr反应体系建立,每管20μl:包括反转录试剂e
‑ꢀ
mix0.4μl、扩增试剂2
×
hieffunicon
®ꢀ
taqman mulitiplex qpcr master mix10μl、特异性引物:50μm h7-f和h7-r各0.2μl、taqman探针:20μm h7-m和h7-w各0.4μl,模板(阳性对照)2μl,加入ddh2o至20μl,反应条件:第一阶段,反转录:42℃,15 min;第二阶段,预变性:95℃,30s;第三阶段,pcr扩增:94℃,10s; 60℃,20s ,40个循环,每次循环第三阶段60℃扩增后采集荧光信号,选择荧光通道fam和vic。
24.其中:阳性对照为等浓度1:1混合的peasy-t1-h7-m和peasy-t1-h7-w重组质粒;所述阴性对照为无核酸水。
25.试剂盒反应体系:反转录试剂e
‑ꢀ
mix 0.4μl、扩增试剂2
×
hieff unicon
®ꢀ
taqman mulitiplex qpcr master mix 10μl、特异性引物:50μm h7-f和h7-r各0.2μl、
taqman探针:20μm h7-m和h7-w各0.4μl,模板2μl,加入ddh2o至20μl,模板为阳性对照、阴性对照或待检样品。
26.结果判定:待检样品fam和vic通道荧光信号均有指数型增加,且ct值均≤38.0,则判断为高致病h7阳性;待检样品vic通道荧光信号有指数型增加,且ct值≤38.0,则判断为低致病h7阳性;待检样品无扩增曲线或者ct值》38.0,则判断为阴性。
27.实施例3试剂盒灵敏度、特异性测试3.1试剂盒灵敏度测试用紫外吸收法测重组质粒peasy-t1-h7-m和peasy-t1-h7-w的浓度,按照1:1浓度比例调整混合至1*106copies/μl,用ddh2o对阳性质粒进行10倍倍比稀释,稀释范围为10-1
~10-5
,分别作为模板进行rt-pcr检测。按试剂盒的反应体系配制试剂和设置反应程序。如图1和2所示。其中,图1为试剂盒重组质粒peasy-t1-h7-m(高致病性h7亚型禽流感)灵敏度测试曲线,图中扩增曲线1-6对应质粒浓度分别为1*105copies/μl、1*104copies/μl、1*103copies/μl、1*102copies/μl、10 copies/μl、阴性对照。图2为试剂盒重组质粒peasy-t1-h7-w(低致病性h7亚型禽流感)灵敏度测试曲线,图中扩增曲线1-6对应质粒浓度分别为1*105copies/μl、1*104copies/μl、1*103copies/μl、1*102copies/μl、10 copies/μl、阴性对照。
28.由图1和2得知,本发明试剂盒的最低检出限为10 copies/μl。
29.试剂盒特异性测试提取禽流感h5亚型病毒核酸、禽流感h9亚型病毒核酸、新城疫病毒核酸、禽传染性支气管炎病毒核酸,分别为模板进行rt-pcr检测,按试剂盒体系配制试剂和设置反应程序。如图3所示,其中,曲线1为以高致病性h7亚型禽流感为模板的曲线,曲线2是以低致病性h7亚型禽流感为模板的曲线,曲线3为阴性曲线,是以禽流感h5亚型病毒核酸、禽流感h9亚型病毒核酸、新城疫病毒核酸、禽传染性支气管炎病毒核酸及阴性对照(曲线重合)为模板的曲线。
30.由图3得知,对禽流感h5亚型病毒核酸、禽流感h9亚型病毒核酸、新城疫病毒核酸、禽传染性支气管炎病毒核酸的检测结果均为阴性,说明本发明试剂盒特异性良好。
31.上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此类技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。