一种检测sf9细胞dna含量的方法
技术领域
1.本发明属于dna检测领域。
背景技术:
2.源于草地贪夜蛾蛹(spodoptera frugiperda)卵巢组织的sf9细胞对杆状病毒高度敏感,被作为bac-to-bac昆虫杆状病毒表达系统中最为常用的宿主细胞。因其生长快,大小均一、易于操作,适于转染、生产高滴度病毒以及高效表达人源化重组蛋白,且抗机械剪切,能在无血清培养基的搅拌反应器中生长等诸多优势,而被广泛的用于基因蛋白工程产品的基础研究和应用开发。
3.疫苗研究中,已有数十种病毒抗原蛋白在sf9细胞中表达获得,包括猪圆环病毒、禽流感病毒、伪狂犬病病毒、兔出血症病毒等,其中猪圆环病毒2型(pcv2)基因工程亚单位疫苗的商品化制备,已取得良好经济效益。
4.生物制品中宿主细胞dna残留是评判产品合格与否的关键性指标,残留的宿主细胞dna作为制品中潜在致癌性和免疫原性杂质,需严加控制和监测,以确保制品的纯度和安全性。由于外源dna宿主dna属微量杂质,测定时干扰因素多,如何对其进行灵敏、快速、准确的检测是研究人员亟需解决的问题。
技术实现要素:
5.本发明要解决的问题是:提供一种可检测sf9细胞dna的方法。
6.本发明的技术方案如下:
7.一种用于检测sf9细胞dna残留的pcr引物对,所述引物采用genbank登录号为mn385596.1的核苷酸序列设计特异性引物。
8.如前述的引物对,所述引物对序列如seq id no.1~2所示。
9.一种用于检测sf9细胞dna残留的反应体系,所述反应体系为实时荧光定量pcr反应体系,包含前述引物对。
10.如前述的反应体系,所述反应体系还包括taq酶和dna模板。
11.一种用于检测sf9细胞dna残留的方法,所述方法为实时荧光定量pcr检测方法,包括使用前述的引物进行序列扩增的步骤。
12.如前述的方法,其特征在于:
13.所述实时荧光定量pcr法使用前述的反应体系进行反应。
14.如前述的方法,所述实时荧光定量pcr的反应程序为:95℃预变性5s;95℃变性5s,60℃退火20s,72℃延伸10s,40个循环;溶解曲线:95℃10s,65℃ 60s,97℃ 1s。
15.如前述的方法,还包括:荧光定量pcr检测已知浓度的sf9细胞dna标准品的荧光信号,绘制标准曲线;根据所获得的标准曲线,计算得到待检样品中sf9细胞dna量。
16.如前述的方法,所述方法的检测样品为sf9细胞参与生产的蛋白或代谢产物产品;
17.优选地,所述产品为蛋白药物、重组疫苗或单克隆抗体。
18.一种用于检测sf9细胞dna残留的试剂盒,所述试剂盒包括taq酶、引物对、标准品、阴性质控品;所述引物对为采用genebank登录号为mn385596.1的核苷酸序列设计的特异性引物;所述阴性质控品为无核酸酶水。
19.如前述的试剂盒,所述引物对为seq id no.1~2所示的pcr引物对。
20.本发明具有如下有益效果:
21.1)专属性好。对sf9细胞基因组扩增无杂峰,对人源细胞、小鼠源细胞和水均无扩增。
22.2)线性范围较大,线性良好,扩增效率高。标准曲线相关系数r2大于0.99,基因组dna含量线性范围为2000pg/μl-0.2pg/μl。
23.3)准确度高,精密度良好。对不同含量的sf9细胞基因组dna进行检测,其检测值与理论值的偏差<15%,rsd<15%。
24.4)灵敏度高。本发明最低可稳定检出0.02pg/μl sf9细胞基因组dna,最低可准确定量0.2pg/μl的sf9细胞基因组dna。
25.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
26.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
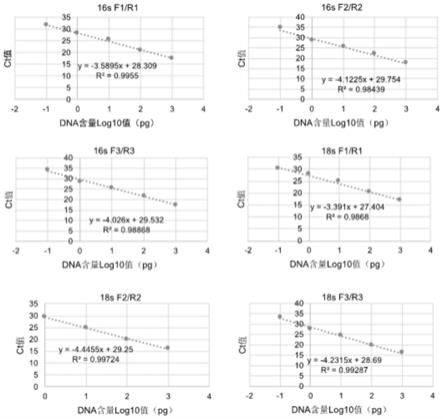
27.图1:不同引物对的扩增标准曲线(标曲)。
28.图2:16s f1/r1引物专属性结果;a,荧光信号强度变化;b,熔解曲线。
29.图3:16s f1/r1引物在dna含量100000-1pg范围内的标准曲线。
具体实施方式
30.为了更清楚地理解本发明,现参照以下实施例及附图进一步描述本发明。实施例仅用于解释而不以任何方式限制本发明。
31.实施例中未注明具体条件的实验方法为所属领域熟知的常规方法和常规条件,或按照制造商建议的条件;实施例中所用到的各种化学试剂均可以商购获得,所用引物委托合成。
32.实施例1本发明的sf9昆虫宿主细胞dna残留检测方法
33.1材料与方法
34.1.1材料
35.1.1.1供试品
36.sf9昆虫细胞表达系统表达得到的重组蛋白疫苗。
37.1.1.2标准基因组dna
38.sf9细胞经扩大培养后,采用按血液/细胞/组织基因组dna提取试剂盒说明书提取dna,经nanodrop2000紫外分光光度计测定dna浓度和纯度,纯度a260/a280约1.80
39.1.1.3主要试剂和仪器
40.血液/细胞/组织基因组dna提取试剂盒(dp304-03,北京天根生化科技有限公司产品),premix ex taqtmⅱ(tli rnaseh plus)(rr820q,takara),常温离心机(legend micro17,thermo),冷冻离心机(fresco17,thermo),nanodrop2000紫外分光光度计(nd2000c,thermo fisher scientific),pcr仪(96,roche)
41.1.1.4引物合成
42.引物按如下序列合成:
[0043][0044][0045]
1.2qpcr检测
[0046]
1.2.1取100μl的供试品,以已知浓度的标准sf9基因组dna进行平行试验,不足200μl用重悬缓冲液补齐200μl。按血液/细胞/组织基因组dna提取试剂盒说明书,提取供试品的dna和已知浓度sf9基因组dna平行实验组的dna,50μl经50℃预热的灭菌水洗脱,洗脱后
液体重复洗脱一次。
[0047]
1.2.2回收的标准sf9基因组dna经nanodrop2000紫外分光光度计测定,计算dna提取回收率以用于后续计算。
[0048]
1.2.3标准sf9基因组dna经无菌h2o进行10倍稀释,获得不同浓度梯度稀释品。
[0049]
1.2.4以供试品加标样品中提取的dna和不同浓度梯度的标准sf9基因组dna为模板,按照real time pcr反应体系,进行real time pcr反应。real time pcr反应体系(15μl):premix ex taq ii(2
×
),7.5μl;16srrna pcr forward primer(10μm),1μl;16s rrna pcr reverse primer(10μm),1μl;模板dna,5μl;灭菌蒸馏水,0.5μl。pcr扩增标准程序:95℃预变性5s;95℃变性5s,60℃退火20s,72℃延伸10s,40个循环。溶解曲线:95℃10s,65℃ 60s,97℃ 1s。
[0050]
1.3数据分析
[0051]
1.3.1程序运行完毕后,利用sf9 dna含量(log10)作为横坐标,对应的ct值作为纵坐标,绘制标准曲线,r2>0.99。
[0052]
1.3.2将测定的ct值带入标准曲线,计算sf9细胞dna含量。
[0053]
1.4方法学验证
[0054]
1.4.1专属性
[0055]
利用实时荧光定量pcr,扩增sf9细胞基因组dna(100pg/5μl),tf-1人源细胞和raw 264.7小鼠源细胞基因组dna(100pg/5μl),同时等体积h2o为阴性对照,扩增曲线谱进行比较。
[0056]
1.4.2线性与范围
[0057]
100ng的sf9细胞基因组dna,经10倍梯度稀释,重复测定3次。以读取的ct值为y轴,以已知基因组dna浓度的log10值为x轴绘制标准曲线,获得标准方程,相关系数,分析检测方法的ct与10倍倍比稀释的标准基因组dna的线性关系,r2值≥99%。计算rsd(相对标准差),应≤20%。并计算理论浓度与测定浓度相对偏差,应≤20%。
[0058]
1.4.3准确度
[0059]
400pg,300pg,200pg的sf9细胞基因组dna,进行实时荧光定量pcr检测,根据获得的标准曲线及相应样品ct值,计算dna含量。计算检测值的偏差,应≤20%。
[0060]
1.4.4精密度
[0061]
1.4.4.1重复精密度
[0062]
取2组sf9 dna样品(dna含量分别为10000pg和1000pg),相同实验人员独立进行6次试验,计算样品检测值的rsd。
[0063]
1.4.4.2中间精密度
[0064]
取2组sf9 dna样品,不同实验人员在不同时间分别进行3次试验,每个时间进行3次重复测定。
[0065]
1.4.5定量限和检测限
[0066]
1pg,0.1pg,0.01pg的sf9基因组dna,重组测定8次,计算rsd,分析定量限和检测限。
[0067]
1.4.6供试品中昆虫宿主细胞dna含量测定
[0068]
选取供试品,分别进行高(100000pg)、中(10000pg)、低(1000pg)含量的sf9细胞
dna加标检测,重组测定3次,计算每加标样品的回收率和rsd。
[0069]
2结果
[0070]
2.1引物线性和扩增效率比较
[0071]
用sybr green染料法qpcr实验验证设计合成的6对引物,比较线性和扩增效率,发现16s f2/r2,16s f3/r3和18s f1/r1的标曲r2小于99%,16s f2/r2,16s f3/r3,18s f2/r2和18s f3/r3的扩增效率较低,而16s f1/r1引物标曲r2大于99%,扩增效率高,整体实验效果最佳(图1)。
[0072]
后续结果均为使用16s f1/r1引物扩增的结果。
[0073]
2.2专属性
[0074]
分别对sf9细胞基因组dna(100pg/5μl),tf-1人源细胞和raw 264.7小鼠源细胞基因组dna(100pg/5μl),同时等体积h2o进行扩增。结果显示,sf9细胞基因组呈现明显扩增,无明显杂峰出现;tf-1人源细胞和raw 264.7小鼠源细胞基因组dna(100pg/5μl),h2o无扩增(图2,a为荧光信号强度变化,b为熔解曲线)。
[0075]
结果表明,本发明的方法专属性好。
[0076]
2.3线性与范围
[0077]
对100000pg-0.01pg的sf9细胞基因组进行扩增,重复测定3次,绘制标准曲线,计算相对偏差和变异系数。结果表明10000-1pg dna标准曲线r2=99.962%(图3),且符合相对偏差和变异系数均≤20%的要求(表1),因此本法线性范围为10000-1pg。
[0078]
表1测定sf9细胞dna线性范围
[0079][0080]
实时荧光定量pcr检测结果显示,检测400pg、300pg、200pg的sf9细胞基因组dna,检测值与理论值的偏差<20%,rsd<20%(表2)。
[0081]
表2准确度测定
[0082][0083]
2.5精密度
[0084]
2.5.1重复精密度
[0085]
10000pg,1000pg的sf9基因组dna作为模板,进行扩增,经6次重复检测,rsd均<10%,表明重复精密度良好(表3)。
[0086]
表3重读精密度测定
[0087][0088]
2.5.2中间精密度
[0089]
在不同时间进行3次独立重复试验,rsd均<30%,表明中间精密度良好(表4)。
[0090]
表4中间精密度测定
[0091][0092]
2.5定量限和检测限
[0093]
对1pg,0.1pg,0.01pg的sf9基因组dna进行多次检测,计算显示1pg样品rsd及偏差<20%。0.1pg样品rsd较大(21.28456%),但8次重复测定全部检出。0.01pg样品8次重复检测中有3次未检出(表5)。因此,定量限定为1pg,检测限定为0.1pg。
[0094]
表5检测限和定量限检测
[0095][0096]
2.6供试品中sf9宿主细胞dna含量测定
[0097]
选取供试品,分别进行高(100000pg)、中(10000pg)、低(1000pg)含量的sf9细胞
dna加标检测,重组测定3次,分析每加标样品的回收率在50%-150%,rsd≤30%(表6)。
[0098]
表6生产样品高、中、低浓度加标回收率
[0099][0100]
综上,本发明的检测方法具有:专属性好,线性范围大,线性良好,扩增效率高,准确度高,精密度良好,灵敏度高等优点,十分适用于sf9细胞dna残留的检测。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
