cdk激酶抑制剂、其制备方法、药物组合物和应用
技术领域
1.本发明涉及一种cdk激酶抑制剂、其制备方法、药物组合物和应用。
背景技术:
2.周期蛋白依赖性激酶(cdks)是相对较小的蛋白质,分子量在34到40千道尔顿之间,它基本只包含激酶结构域。cdk捆绑着称为周期蛋白的调节蛋白。在没有周期蛋白的情况下,cdk几乎没有激酶活性;只有周期蛋白-cdk复合物才是有活性的激酶。cdks对其底物的丝氨酸/苏氨酸残基进行磷酸化,因此属于丝氨酸/苏氨酸激酶类(david o.morgan,《细胞周期:控制原则》。伦敦:新科学出版社(new science press),第1版,(2007))。
3.周期蛋白依赖性激酶(cdk)家族的成员在细胞增殖中发挥关键的调节作用。目前有20种已知的哺乳动物cdks。尽管cdk7-13和cdk18与转录有关,只有cdk1、cdk2、cdk4和cdk6表现出与细胞周期的明显关联。作为哺乳动物cdk中的独特cdks,cdk7增强了激酶活性,可调控细胞周期和转录。在胞质溶胶中,cdk7作为异源三聚体复合物存在,并且被认为起到cdk1/2活化激酶(cak)的作用,对于完全催化的cdk活性和细胞周期进展,需要cdk7对cdk1/2中的保守残基进行磷酸化(desai等,《分子细胞生物学》(mol.cell biol.)15,345-350(1995))。
4.cdk家族中的cdk7已被证明与多种恶性肿瘤的发生、发展有密切关系,cdk7抑制剂可能用于多种恶性肿瘤的治疗。
技术实现要素:
5.本发明所要解决的技术问题是为了克服现有技术中已有的cdk7激酶抑制剂少,而提供了一种与现有技术不同的cdk激酶抑制剂、其制备方法、药物组合物和应用。本发明化合物用作cdk激酶抑制剂具有较好的抑制活性。
6.本发明主要是通过以下技术方案解决上述技术问题的。
7.本发明提供了一种如式i-a所示的化合物,其顺反异构体或其药学上可接受的盐,
[0008][0009]
其中,r1和r2独立地为c
1-c6烷基、一个或多个卤素取代的c
1-c6烷基(当卤素为多个时,所述的卤素相同或不同)、c
3-c6环烷基或-nr
1-1r1-2
;
[0010]r1-1
和r
1-2
独立地为h或5-8元杂环烷基,所述的5-8元杂环烷基中的杂原子为n、s和o中一种或多种,个数为1个、2个或3个(当杂原子个数为2个或3个时,杂原子种类可相同或
不同);
[0011]
x为n或cr3,r3为氢或卤素;
[0012]
y为n或o;
[0013]
r4为h或c
1-c6烷基;
[0014]
n为1或2;
[0015]
na为1或2;
[0016]
z为n或ch;
[0017]
l为nh或不存在(即z与碳基直接相连);
[0018]
r5为h或卤素;
[0019]
r6和r7独立地为h、c
1-c6烷基、一个或多个r
6-1
取代的c
1-c6烷基(当r
6-1
为多个时,所述的r
6-1
相同或不同)、5-8元杂环烷基或一个或多个r
6-2
取代的5-8元杂环烷基(当r
6-2
为多个时,所述的r
6-2
相同或不同),所述的5-8元杂环烷基、和、一个或多个r
6-2
取代的5-8元杂环烷基中的杂原子独立地为n、s和o中一种或多种,个数为1个、2个或3个(当杂原子个数为2个或3个时,杂原子种类可相同或不同);
[0020]r6-1
为-nr
6-1-1r6-1-2
;
[0021]r6-1-1
和r
6-1-2
独立地为h或c
1-c6烷基,
[0022]
或者,r
6-1-1
和r
6-1-2
与其相连的n一起形成5-8元杂环烷基或、一个或多个c
1-c6烷基取代的5-8元杂环烷基;所述的5-8元杂环烷基和一个或多个c
1-c6烷基取代的5-8元杂环烷基中的杂原子独立地为n、s和o中一种或多种,个数为1个、2个或3个(当杂原子个数为2个或3个时,杂原子种类可相同或不同);
[0023]r6-2
为c
1-c6烷基;
[0024]
当n为2时,x为n;
[0025]
用*标记的碳原子为r构型手性碳、s构型手性碳或非手性碳。
[0026]
在本发明一实施方案中,当r1为c
1-c6烷基时,所述的c
1-c6烷基为c
1-c4烷基,优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,进一步优选为异丙基或叔丁基,例如异丙基。
[0027]
在本发明一实施方案中,当r1为一个或多个卤素取代的c
1-c6烷基,所述的卤素为氟、氯、溴或碘;所述的c
1-c6烷基优选为c
1-c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基。
[0028]
在本发明一实施方案中,当r1为c
3-c6环烷基时,所述的c
3-c6环烷基为环丙烷基、环丁基、环戊基或环己基,例如环丙烷基。
[0029]
在本发明一实施方案中,当r2为c
1-c6烷基时,所述的c
1-c6烷基为c
1-c4烷基,优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,进一步优选为甲基。
[0030]
在本发明一实施方案中,当r2为一个或多个卤素取代的c
1-c6烷基,所述的卤素为氟、氯、溴或碘;所述的c
1-c6烷基优选为c
1-c4烷基,进一步优选为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基。
[0031]
在本发明一实施方案中,当r
1-1
和r
1-2
独立地为5-8元杂环烷基时,所述的5-8元杂环烷基为5-6元杂环烷基,杂原子为o,个数为1个;优选为吡喃基,例如
[0032]
在本发明一实施方案中,当r2为-nr
1-1r1-2
时,r
1-1
和r
1-2
一个为h,另一个为5-8元杂环烷基。所述的-nr
1-1r1-2
优选为
[0033]
在本发明一实施方案中,当r3为卤素时,所述的卤素为氟、氯、溴或碘。
[0034]
在本发明一实施方案中,当r4为c
1-c6烷基时,所述的c
1-c6烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0035]
在本发明一实施方案中,当r5为卤素时,所述的卤素为氟、氯、溴或碘,例如氟。
[0036]
在本发明一实施方案中,当r6和r7独立地为c
1-c6烷基、或、一个或多个r
6-1
取代的c
1-c6烷基时,所述的c
1-c6烷基和所述的一个或多个r
6-1
取代的c
1-c6烷基中c
1-c6烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0037]
在本发明一实施方案中,当r
6-1-1
和r
6-1-2
独立地为c
1-c6烷基时,所述c
1-c6烷基独立地为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0038]
在本发明一实施方案中,当r
6-1-1
和r
6-1-2
与其相连的n一起形成5-8元杂环烷基时,所述的5-8元杂环烷基为5-6元杂环烷基,杂原子为n和/或o,个数为2个;优选为吗啉基,例如
[0039]
在本发明一实施方案中,当r
6-1-1
和r
6-1-2
与其相连的n一起形成一个或多个c
1-c6烷基取代的5-8元杂环烷时,所述的5-8元杂环烷基为5-6元杂环烷基,杂原子为n,个数为1或2个;优选为哌嗪基。
[0040]
在本发明一实施方案中,当r
6-1-1
和r
6-1-2
与其相连的n一起形成一个或多个c
1-c6烷基取代的5-8元杂环烷基时,所述的c
1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0041]
在本发明一实施方案中,当r
6-1-1
和r
6-1-2
与其相连的n一起形成一个或多个c
1-c6烷基取代的5-8元杂环烷基时,所述的一个或多个c
1-c6烷基取代的5-8元杂环烷基为甲基取代的哌嗪基,例如
[0042]
在本发明一实施方案中,当r6和r7独立地为一个或多个r
6-1
取代的c
1-c6烷基时,所述的一个或多个r
6-1
取代的c
1-c6烷基为
[0043]
在本发明一实施方案中,当所述的r6和r7独立地为5-8元杂环烷基或一个或多个r
6-2
取代的5-8元杂环烷基时,所述的5-8元杂环烷基和所述的一个或多个r
6-2
取代的5-8元杂环烷基中的5-8元杂环烷基独立地为5-6元杂环烷基,杂原子为n,个数为2个,例如吡咯烷基。
[0044]
在本发明一实施方案中,当r
6-2
为c
1-c6烷基时,所述的c
1-c6烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
[0045]
在本发明一实施方案中,当所述的r6和r7独立地为一个或多个r
6-2
取代的5-8元杂
环烷基时,所述的一个或多个r
6-2
取代的5-8元杂环烷基为甲基取代的吡咯烷基,例如
[0046]
在本发明一实施方案中,为为
[0047]
在本发明一实施方案中,r1为c
1-c6烷基。
[0048]
在本发明一实施方案中,r1为c
1-c6烷基(例如乙基、异丙基或叔丁基)或c
3-c6环烷基(例如环丙基)。
[0049]
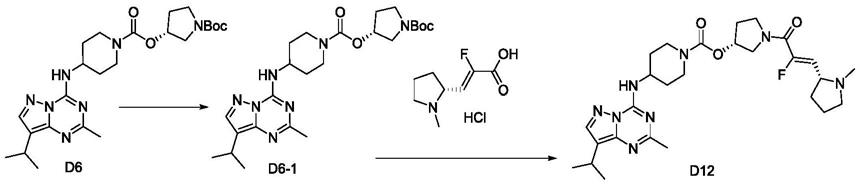
在本发明一实施方案中,r2为c
1-c6烷基。
[0050]
在本发明一实施方案中,r2为c
1-c6烷基(例如甲基)或-nr
1-1r1-2
(例如)。
[0051]
在本发明一实施方案中,r3为氢。
[0052]
在本发明一实施方案中,na为1。
[0053]
在本发明一实施方案中,y为o。
[0054]
在本发明一实施方案中,z为n,l为不存在;或,z为ch,l为nh。
[0055]
在本发明一实施方案中,r6和r7独立地为h或、一个或多个r
6-1
取代的c
1-c6烷基;r
6-1
为-nr
6-1-1r6-1-2
;r
6-1-1
和r
6-1-2
独立地为c
1-c6烷基,或者,r
6-1-1
和r
6-1-2
与其相连的n一起形成5-8元杂环烷基或、一个或多个c
1-c6烷基取代的5-8元杂环烷基。
[0056]
在本发明一实施方案中,所述的如式i-a所示的化合物为如式i-a1或i-a2所示的化合物,
[0057][0058]
在本发明一实施方案中,所述的如式i-a1所示的化合物中:
[0059]
r1和r2独立地为c
1-c6烷基;
[0060]
y为o;
[0061]
n为2;
[0062]
na为1;
[0063]
z为n;
[0064]
l为不存在;
[0065]
r6和r7独立地为一个或多个r
6-1
取代的c
1-c6烷基;
[0066]r6-1
为-nr
6-1-1r6-1-2
;
[0067]r6-1-1
和r
6-1-2
独立地为c
1-c6烷基。
[0068]
在本发明一实施方案中,所述的如式i-a2所示的化合物中:
[0069]
r1为c
1-c6烷基;
[0070]
r2为c
1-c6烷基或-nr
1-1r1-2
;
[0071]
x为n或ch;
[0072]
y为o;
[0073]
z为n;
[0074]
l为不存在;
[0075]
r5为h;
[0076]
r6和r7独立地为h、c
1-c6烷基、或、一个或多个r
6-1
取代的c
1-c6烷基;
[0077]r6-1
为-nr
6-1-1r6-1-2
;
[0078]r6-1-1
和r
6-1-2
独立地为c
1-c6烷基。
[0079]
在本发明一实施方案中,所述的如式i-a所示的化合物为所述的如式i所示的化合物,其顺反异构体或其药学上可接受的盐,
[0080][0081]
其中,
[0082]
r1和r2独立地为c
1-c6烷基、或一个或多个卤素取代的c
1-c6烷基(当卤素为多个时,所述的卤素相同或不同);
[0083]
x为n或cr3,r3为氢或卤素;
[0084]
n为1或2;
[0085]
用*标记的碳原子为r构型手性碳、s构型手性碳或非手性碳;
[0086]
当n为2时,x为n。
[0087]
在本发明一实施方案中,所述的如式i所示的化合物为如式i-1所示的化合物,
[0088][0089]
其中,r1和r2独立地为c
1-c6烷基、或一个或多个卤素取代的c
1-c6烷基;用*标记的
碳原子为r构型手性碳、s构型手性碳或非手性碳。
[0090]
在本发明一实施方案中,所述的如式i-1所示的化合物中,用*标记的碳原子为r构型手性碳或s构型手性碳。
[0091]
在本发明一实施方案中,所述的如式i所示的化合物为如式i-2所示的化合物,
[0092][0093]
其中,r1和r2独立地为c
1-c6烷基、或一个或多个卤素取代的c
1-c6烷基;
[0094]
x为n或cr3,r3为氢或卤素。
[0095]
在本发明一实施方案中,所述的如式i-a所示的化合物为
[0096]
[0097][0098]
本发明还提供了一种所述的i-a所示的化合物的制备方法,其包括以下步骤:溶剂中,将如式ii-a所示的化合物和如式iii-a所示的化合物在碱和缩合剂的作用下进行如下所示的缩合反应,得到所述的如式i-a所示的化合物即可,
[0099][0100]
其中,r8为卤素(例如氯或溴)或羟基;r1、r2、x、y、r4、z、l、n、r5、na、r6、r7和用*标记的碳原子同前所述。
[0101]
所述的缩合反应中,所述的溶剂可为本领域该类反应常规的溶剂,本发明特别优选为腈类溶剂(例如乙腈)。
[0102]
所述的缩合反应中,所述的如式ii-a所示的化合物在所述溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.01~0.5mol/l,进一步优选为0.05~0.15mol/l(例如0.09mol/l)。
[0103]
所述的缩合反应中,所述的如式iii-a所示的化合物与所述的如式ii-a所示的化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1~3:1,进一步优选为1.1:1~1.5:1(例如1.3:1)。
[0104]
所述的缩合反应中,所述的碱可为本领域该类反应常规的碱,本发明特别优选为有机碱,进一步优选为n,n-二异丙基乙胺。
[0105]
所述的缩合反应中,所述的碱与所述的如式ii-a所示的化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为10:1~30:1,进一步优选为15:1~25:1(例如21:1)。
[0106]
所述的缩合反应中,所述的缩合剂可为本领域该类反应常规的缩合剂,本发明特别优选为1-正丙基磷酸酐。
[0107]
所述的缩合反应中,所述的缩合剂与所述的如式ii-a所示的化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1~3:1,进一步优选为1.2:1~2:1(例如1.5:1)。
[0108]
所述的缩合反应中,所述的缩合反应的反应温度可为本领域该类反应常规的反应温度,本发明特别优选为室温。
[0109]
所述的缩合反应中,所述的缩合反应的反应时间可为本领域该类反应常规的反应时间,本发明特别优选为8~20小时,进一步优选为10~14小时(例如12小时)。
[0110]
所述的缩合反应中,所述的缩合反应结束后还可进一步包括后处理步骤。所述的后处理步骤可为将反应液浓缩,分相萃取,有机相浓缩和纯化。所述的分相萃取所使用的试剂可为二氯甲烷和10%碳酸钠水溶液。所述的纯化的方式可为硅胶柱纯化。所述的硅胶柱纯化所使用的洗脱液可为二氯甲烷/甲醇/三乙胺(体积比可为20:1:0.5)。
[0111]
在本发明一实施方案中,所述的i-a所示的化合物的制备方法为所述的如式i所示的化合物的制备方法。所述的如式i所示的化合物的制备方法包括以下步骤:溶剂中,将如式ii所示的化合物和如式iii所示的化合物在碱和缩合剂的作用下进行如下所示的缩合反应,得到所述的如式i所示的化合物即可,
[0112][0113]
其中,r1、r2、x、n和用*标记的碳原子同前所述。
[0114]
所述的缩合反应的中,所述的溶剂可为本领域该类反应常规的溶剂,本发明特别优选为腈类溶剂(例如乙腈)。
[0115]
所述的缩合反应中,所述的如式ii所示的化合物在所述溶剂中的摩尔浓度可为本领域该类反应常规的摩尔浓度,本发明特别优选为0.01~0.5mol/l,进一步优选为0.05~0.15mol/l(例如0.09mol/l)。
[0116]
所述的缩合反应中,所述的如式iii所示的化合物与所述的如式ii所示的化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1~3:1,进一步优选为1.1:1~1.5:1(例如1.3:1)。
[0117]
所述的缩合反应中,所述的碱可为本领域该类反应常规的碱,本发明特别优选为有机碱,进一步优选为n,n-二异丙基乙胺。
[0118]
所述的缩合反应中,所述的碱与所述的如式ii所示的化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为10:1~30:1,进一步优选为15:1~25:1(例如21:1)。
[0119]
所述的缩合反应中,所述的缩合剂可为本领域该类反应常规的缩合剂,本发明特别优选为1-正丙基磷酸酐。
[0120]
所述的缩合反应中,所述的缩合剂与所述的如式ii所示的化合物的摩尔比可为本领域该类反应常规的摩尔比,本发明特别优选为1:1~3:1,进一步优选为1.2:1~2:1(例如1.5:1)。
[0121]
所述的缩合反应中,所述的缩合反应的反应温度可为本领域该类反应常规的反应温度,本发明特别优选为室温。
[0122]
所述的缩合反应中,所述的缩合反应的反应时间可为本领域该类反应常规的反应时间,本发明特别优选为8~20小时,进一步优选为10~14小时(例如12小时)。
[0123]
所述的缩合反应中,所述的缩合反应结束后还可进一步包括后处理步骤。所述的后处理步骤可为将反应液浓缩,分相萃取,有机相浓缩和纯化。所述的分相萃取所使用的试剂可为二氯甲烷和10%碳酸钠水溶液。所述的纯化的方式可为硅胶柱纯化。所述的硅胶柱纯化所使用的洗脱液可为二氯甲烷/甲醇/三乙胺(体积比可为20:1:0.5)。
[0124]
本发明还提供了一种药物组合物,其包括所述的如式i-a所示的化合物、其顺反异构体或其药学上可接受的盐,以及药学上可接受的辅料。
[0125]
在本发明一实施方案中,所述的药物组合物,其包括所述的如式i所示的化合物、其顺反异构体或其药学上可接受的盐,以及药学上可接受的辅料。
[0126]
本发明还提供了一种所述的如式i-a所示的化合物、其顺反异构体或其药学上可接受的盐、或所述的药物组合物在制备cdk激酶抑制剂中的应用。
[0127]
在本发明一实施方案中,所述的cdk激酶抑制剂为cdk7激酶抑制剂。
[0128]
在本发明一实施方案中,所述的如式i所示的化合物、其顺反异构体或其药学上可接受的盐、或所述的药物组合物在制备cdk激酶抑制剂中的应用。
[0129]
本发明还提供了一种所述的i-a所示的化合物、其顺反异构体或其药学上可接受的盐、或所述的药物组合物在制备预防和/或治疗与cdk相关疾病的药物中的应用。
[0130]
在本发明一实施方案中,所述的如式i所示的化合物、其顺反异构体或其药学上可接受的盐、或所述的药物组合物在制备预防和/或治疗与cdk相关疾病的药物中的应用。
[0131]
在本发明一实施方案中,所述的与cdk相关疾病为与cdk7相关疾病,优选为肿瘤,例如肺腺癌、肺癌或乳腺癌。
[0132]
本发明还提供了一种如式ii-a所示的化合物,
[0133][0134]
r1、r2、x、y、r4、z、l、n、na和用*标记的碳原子同前所述。
[0135]
在本发明一实施方案中,所述的如式ii-a所示的化合物为如式ii所示的化合物,
[0136][0137]
其中,r1、r2、x、n和用*标记的碳原子同前所述。
[0138]
在本发明一实施方案中,所述的如式ii-a所示的化合物为
[0139]
[0140][0141]
本发明还提供了一种如式iv-a1或iv-a2所示的化合物,
[0142][0143]
r1、r2、x、y、r4、z、n、na和用*标记的碳原子同前所述。
[0144]
在本发明一实施方案中,所述的如式iv-a1为如式iv的化合物,
[0145][0146]
其中,r1、r2、x、n和用*标记的碳原子同前所述。
[0147]
在本发明一实施方案中,所述的如式iv-a1或iv-a2所示的化合物为
[0148][0149]
本发明中,室温是指10~30℃。
[0150]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0151]
药学上可接受的盐可以是与药学上可接受的酸形成的酸加成盐。药学上可接受的盐的酸的实例包括无机酸,如硝酸、硼酸、盐酸、氢溴酸、硫酸、和磷酸;以及有机酸,如草酸、顺丁烯二酸、丁二酸、以及柠檬酸。本发明的化合物的盐的非限制性实例包括但不限于盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、2-羟基乙磺酸盐、磷酸盐、磷酸氢盐、乙酸盐、己二酸盐、藻酸盐、天冬氨酸盐、苯甲酸盐、硫酸氢盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、二葡糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、甲酸盐、丁二酸盐、反丁烯二酸盐、顺丁烯二酸盐、抗坏血酸盐、羟乙基磺酸盐、水杨酸盐、甲磺酸盐、均三甲苯磺酸盐、萘磺酸盐、烟酸盐、2-萘磺酸盐、草酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、苦味酸盐、特戊酸盐、丙酸盐、三氯乙酸盐、三氟乙酸盐、磷酸盐、谷氨酸盐、碳酸氢盐、对甲苯磺酸盐、十一烷酸盐、乳酸盐、柠檬酸盐、酒石酸盐、葡萄糖酸盐、甲磺酸盐、乙二磺酸盐、苯磺酸盐、以及对甲苯磺酸盐。
[0152]
药学上可接受的辅料的选择因施用途径和作用特点而异,通常是填充剂、稀释剂、粘合剂、润湿剂、崩解剂、润滑剂、乳化剂或助悬剂。
[0153]
术语“卤素”是指氟、氯、溴或碘。
[0154]
术语“烷基”是指具有指定的碳原子数(例如c1~c6)的直链或支链烷基。烷基包括但不限于甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正
庚基、正辛基等。
[0155]
术语“环烷基”是指具有指定的碳原子数(例如c3~c6)的、仅由碳原子组成的、饱和的单环环状基团。环烷基包括但不限于环丙基、环丁基、环戊基、环己基等。
[0156]
术语“杂环烷基”是指具有指定环原子数(例如5~8元)的、指定杂原子数(例如1个、2个或3个)的、指定杂原子种类(n、o和s中的一种或多种)的环状基团,其为单环、桥环或螺环,且每一个环均为饱和的。杂环烷基包括但不限于氮杂环丁烷基、四氢吡咯基、四氢呋喃基、吗啉基、哌啶基等。
[0157]
结构片段中的是指该结构片段通过该位点与分子中的其他片段连接。例如,是指环己基。
[0158]
术语“多个”是指2个、3个或3个。
[0159]
本发明所用试剂和原料均市售可得。
[0160]
本发明的积极进步效果在于:本发明的化合物具有较佳的cdk7抑制活性、细胞活性和抑制肿瘤生长的活性。
具体实施方式
[0161]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0162]
下述制备例和实施例中,缩写解释:
[0163]
lda:二异丙基氨基锂;r.t:室温;dmso:二甲基亚砜;hoac:醋酸;etoh:乙醇;dcm:二氯甲烷;mtbe:甲基叔丁基醚;acn:乙腈;dipea:n,n-二异丙基乙胺;mcpba:间氯过氧苯甲酸;t3p:1-正丙基磷酸酐;chloroform:氯仿;mgmebr:甲基溴化镁;boc:叔丁基氧羰基。
[0164]
室温是指10~30℃。
[0165]
制备例1
[0166][0167]
异戊腈(化合物1,25g,330mmol)缓慢滴加到-78℃的lda四氢呋喃溶液(1.3m,300ml)。滴加完成后溶液继续搅拌20分钟,然后在-78℃缓慢加入甲酸乙酯(化合物2,30ml,377mmol)的四氢呋喃溶液(100ml),总共滴加时间控制在40分钟.反应液在-78℃继续搅拌45分钟,然后缓慢升温到室温,继续搅拌18小时。反应用水(50ml)淬灭,用盐酸水溶液(4n)调节ph至3左右,然后用乙酸乙酯(100ml)来萃取,有机相用无水硫酸钠来干燥,然后过滤浓缩,残余物用正庚烷打浆,悬浊液过滤,滤饼干燥,给出产品2-甲酰基-3-甲基丁腈(化合物3,23g,84%)。1h nmr(400mhz,dmso-d6)δ9.72(s,1h),3.26(m,1h),2.55(m,1h),1.20(d,j=6.9hz,3h),1.04(d,j=6.9hz,3h)。
[0168][0169]
2-甲酰基-3-甲基丁腈(化合物3,9.97g,90mmol),水合肼(5.68ml,117mmol)以及醋酸(9.02ml,158mmol)溶解在乙醇(250ml)中,整个溶液加热85℃并反应20小时。之后冷却到室温,然后浓缩。浓缩物用饱和碳酸钠溶液稀释,条件ph至8左右,然后用二氯甲烷萃取(3
×
100ml)。有机相用饱和食盐水洗涤,然后用无水硫酸镁干燥,过滤浓缩干燥得到产品化合物4。1h nmr(400mhz,cdcl3)δ7.12(d,j=0.7hz,1h),2.69(pd,j=6.9,0.7hz,1h),1.21(s,3h),1.19(s,3h)。
[0170][0171]
化合物a1(5.8g,1.1eq)在0℃缓慢滴加到化合物4(5g,1eq)的二氯甲烷溶液。滴加完成后,反应液缓慢升至室温并继续搅拌10小时。反应呈现悬浊液,然后浓缩,残留物用mtbe(30ml)打浆,然后过滤干燥得到产品化合物a2(4g,40%)lcms:[m h]
257.0。
[0172]
化合物a2溶解到乙腈acn(100ml),然后加入碳酸钾(5.4g,2.5eq),反应体系升温到70℃并继续搅拌4小时。冷却至室温后,反应液浓缩,然后用盐酸水溶液(1n)调节ph至3左右。悬浊液过滤,固体用水洗,然后干燥得到产品化合物a3(3g,92%);lcms:[m h]
211.0。
[0173][0174]
化合物a3(1g,1eq)的乙醇(20ml)悬浊液,于0℃加入氢氧化钠水溶液(2m,5ml,2eq),搅拌15分钟,然后加入mei(0.85g,1.3eq)。整个悬浊液在室温下继续搅拌4小时,然后浓缩除掉大部分溶剂,残留物用水稀释,然后于0℃加入盐酸水溶液hcl(2n,10ml)。悬浊液过滤,固体干燥得到产物化合物a4(1g,94%).1h nmr(400mhz,dmso-d6)δ7.92(s,1h),3.02(p,j=6.9hz,1h),2.55(s,3h),1.27(s,3h),1.26(s,3h).lcms:[m h]
225.0。
[0175][0176]
密封管中加入化合物a4(1g,4.46mmol)的pocl3(6ml,15eq)悬浊液,于0℃加入dipea(1.5ml,2eq),反应液然后升温至100℃。搅拌4小时后,反应冷却至室温,然后浓缩,残留物用冰水稀释,悬浊液然后过滤,固体用水冲洗,然后干燥得到产物化合物a5。lcms:[m h]
242.97。
[0177][0178]
在a5(3.05g,12.5mmol,1eq)以及1-boc-4-氨基哌啶(2.5g,12.5mmol,1eq)的乙腈(80ml)混合液中,于0℃加入dipea(4.4ml,2eq),反应升温至室温并继续搅拌2小时,浓缩除去乙腈,残留物用水稀释,悬浊液过滤干燥得到产物d1。lcms:[m h]
407.2。
[0179]
上步产物溶于二氯甲烷(100ml),然后加入mcpba(5.4g,33mmol,2.6eq),整个悬浊液在室温下继续搅拌12小时。然后过滤,滤液用氢氧化钠水溶液(2n)洗涤,有机相继续用水洗涤,然后饱和食盐水洗涤,最后用无水硫酸钠干燥,过滤浓缩得到产品d3(5g,91%)。
[0180]1h nmr(400mhz,氯仿-d)δ7.95(s,1h),6.72(d,j=8.4hz,1h),4.52
–
4.34(m,1h),4.23
–
4.02(m,2h),3.36(s,3h),3.24(hept,j=7.1hz,1h),2.99(t,j=12.5hz,2h),2.21
–
2.07(m,2h),1.58(qd,j=12.2,11.7,4.6hz,2h),1.48(s,9h),1.35(d,j=6.9hz,6h)。lcms:[m h]
439.1。
[0181][0182]
d3(4g,9.13mmol)的四氢呋喃(100ml)溶液中于室温下缓慢加入mgmebr(1m,27ml,3eq),然后继续搅拌2小时,待反应完成后,用水淬灭(3eq)。混合液浓缩,残渣用二氯甲烷/水分相萃取,有机相用碳酸钠干燥,然后浓缩,硅胶柱分离纯化,洗脱液乙酸乙酯/正庚烷(2:1),得到产物d4(3.4g,99%)。
[0183]1h nmr(400mhz,氯仿-d)δ7.80(s,1h),6.31(d,j=8.3hz,1h),4.38
–
4.22(m,1h),4.22
–
4.03(m,2h),3.22(hept,j=6.9hz,1h),2.98(t,j=12.5hz,2h),2.53(s,3h),2.09(dd,j=12.7,3.7hz,2h),1.55(td,j=12.0,4.3hz,2h),1.48(s,9h),1.32(d,j=6.9hz,6h)。lcms:[m h]
375.2。
[0184][0185]
d4(3.4g,9mmol)的二氯甲烷(50ml)溶液中加入盐酸异丙醇溶液(5m,6ml),继续在室温下搅拌2小时。浓缩干燥,残渣用二氯甲烷/10%碳酸钠水溶液分相萃取,有机相浓缩得到产物d5(2.4g,99%)。
[0186]1h nmr(400mhz,氯仿-d)δ7.80(s,1h),6.35(d,j=8.4hz,1h),4.32
–
4.16(m,1h),3.29
–
3.11(m,3h),2.90
–
2.78(m,2h),2.53(s,3h),2.17
–
2.11(m,2h),1.60(tt,j=11.2,5.7hz,2h),1.32(d,j=6.9hz,6h)。lcms:[m h]
275.2。
[0187][0188]
在三碳酰氯(0.16g,0.4eq)的甲苯溶液(10ml)中,于0℃加入吡啶(0.07ml,1eq),继续搅拌10分钟,然后加入化合物5(0.25g,1.34mmol,1eq)的二氯甲烷(3ml)溶液,缓慢升至室温,继续搅拌12小时,所得悬浊液过滤,保留含有化合物6滤液并做下一步反应。
[0189]
将上述含有化合物6的溶液,于室温下加入到d5(0.3g,0.8eq)和三乙胺(0.3ml)的二氯甲烷(20ml)溶液中,搅拌1小时,反应液浓缩,残渣用硅胶柱分离纯化[洗脱液二氯甲烷/乙酸乙酯(2:1)],得到化合物d6(0.45g,86%)。
[0190]1h nmr(400mhz,氯仿-d)δ7.80(s,1h),6.32(d,j=8.2hz,1h),5.25(s,1h),4.36
–
3.97(m,3h),3.60
–
3.39(m,4h),3.22(hept,j=7.0hz,1h),3.04(s,2h),2.53(s,3h),2.19
–
2.02(m,4h),1.46(s,11h),1.32(d,j=6.9hz,6h)。lcms:[m h]
488.3。
[0191]
制备例2
[0192][0193]
参照制备例1制备d6的方法,合成化合物d8。
[0194]1h nmr(400mhz,氯仿-d)δ7.81(s,1h),6.36(d,j=8.2hz,1h),5.11(tt,j=6.7,4.2hz,1h),4.24(ddd,j=10.1,6.7,1.1hz,2h),4.19
–
4.11(m,2h),3.92(dd,j=10.2,4.2hz,2h),3.23(h,j=6.9hz,1h),3.17
–
2.96(m,2h),2.53(s,3h),2.14(dd,j=13.1,3.7hz,2h),1.57(qd,j=11.7,4.4hz,2h),1.45(s,9h),1.32(d,j=6.9hz,6h)。lcms:[m h]
474.3。
[0195]
制备例3
[0196][0197]
参照制备例1制备d6的方法,合成化合物d9。
[0198]1h nmr(400mhz,氯仿-d)δ7.80(s,1h),6.31(d,j=8.2hz,1h),5.25(s,1h),4.36
–
4.02(m,3h),3.58
–
3.41(m,4h),3.22(hept,j=6.9hz,1h),3.02(d,j=13.6hz,2h),2.53(s,3h),2.09(d,j=17.0hz,4h),1.47(s,11h),1.32(d,j=6.9hz,6h)。
[0199]
制备例4
[0200][0201]
f1(2.5g,20mmol)和f2(3.9g,1.5eq)在乙酸中(10ml),反应液在90℃下搅拌20小时,然后冷却至室温,所得悬浊液过滤,用叔甲基丁基醚冲洗,干燥得到产品f3(3.4g,89%)。
[0202]1h nmr(400mhz,dmso-d6)δ7.77(s,1h),5.52(s,1h),3.07(h,j=6.9hz,1h),2.31(s,3h),1.22(d,j=6.9hz,6h)。lcms:[m h]
192.1。
[0203][0204]
原料f3(3g,15.7mmol)于三氯氧膦(15ml,10eq),在0℃下加入dipea(5.5ml,2eq),然后在100℃中继续搅拌4小时,冷却至室温,浓缩,残渣用冰水洗脱,悬浊液过滤,干燥得到产物f4。lcms:[m h]
210.0。
[0205][0206]
化合物f4(3.1,14.8mmol,1eq)以及氨化合物(3.3g,1.1eq)于乙腈(80ml)的溶液中,于0℃加入dipea(4.4ml,2eq)。然后反应在室温下搅拌2小时,浓缩,用水稀释,悬浊液过滤,干燥得到产品f5(5g,90%).
[0207]1h nmr(400mhz,氯仿-d)δ7.82(s,1h),6.12(d,j=8.2hz,1h),5.78(s,1h),4.10(d,j=12.7hz,2h),3.64(dddd,j=14.4,10.4,8.1,4.0hz,1h),3.31(hept,j=6.9hz,1h),3.00(t,j=12.3hz,2h),2.52(s,3h),2.18
–
2.00(m,2h),1.58(dtd,j=13.1,11.0,4.3hz,2h),1.48(s,9h),1.34(d,j=6.9hz,6h)。lcms:[m h]
374.2。
[0208][0209]
化合物f5(4g,10.7mmol)的二氯甲烷(50ml)溶液中加入盐酸异丙醇(5m,10ml),继续在室温下搅拌2小时。浓缩干燥,残渣用二氯甲烷/碳酸钠(10%水溶液)分相萃取,有机相浓缩得到产物f6(2.8g,98%).
[0210]1h nmr(400mhz,氯仿-d)δ7.82(s,1h),6.13(d,j=8.2hz,1h),3.59(dddd,j=14.5,10.4,8.2,4.1hz,1h),3.30(hept,j=6.9hz,1h),3.19(dt,j=12.8,3.9hz,2h),2.78(ddd,j=13.0,11.1,2.6hz,2h),2.51(s,3h),2.12(dt,j=13.3,3.6hz,2h),1.56(dtd,j=12.8,10.8,3.9hz,2h),1.34(d,j=6.9hz,6h)。lcms:[m h]
274.2。
[0211][0212]
参照制备例1方法,合成化合物f9。
[0213]1h nmr(400mhz,氯仿-d)δ7.82(s,1h),6.14(d,j=8.2hz,1h),5.79(s,1h),5.14
–
5.08(m,1h),4.28
–
4.22(m,2h),4.17
–
4.11(m,2h),3.92(dd,j=10.3,4.2hz,2h),3.75
–
3.61(m,1h),3.31(hept,j=7.0hz,1h),3.09(s,2h),2.53(s,3h),2.22
–
2.08(m,2h),1.60(ddd,j=14.7,10.7,4.0hz,2h),1.45(s,9h),1.34(d,j=6.9hz,6h)。lcms:[m h]
473.3。
[0214]
实施例1
[0215][0216]
d6(0.13g,0.27mmol)的二氯甲烷(3ml)溶液中加入盐酸异丙醇(5m,0.5ml),反应在室温下搅拌2小时,浓缩得到粗品d6-1直接用于下一步反应。d6-1:lcms:[m h] 388.3。
[0217]
上述粗品溶于乙腈(3ml)/dipea(0.5ml),然后加入化合物7(50mg,1.3eq),t3p(0.15g,1.5eq),加入dipea(0.5ml),反应液于室温下继续搅拌12小时,浓缩,残渣用二氯甲烷/碳酸钠(10%水溶液)分相萃取,有机相浓缩,硅胶柱分离,洗脱液二氯甲烷/甲醇/三乙胺(20:1:0.5)得到产品d7(80mg,60%)。
[0218]1h nmr(400mhz,dmso-d6)δ8.20(s,1h),6.79
–
6.63(m,2h),5.23
–
5.14(m,1h),4.42
–
4.33(m,1h),3.95
–
3.81(m,4h),3.72
–
3.56(m,2h),3.54
–
3.35(m,1h),3.28(p,j=
6.7hz,1h),3.09
–
2.84(m,4h),2.72(dd,j=4.9,1.6hz,6h),2.54(s,3h),2.25
–
2.01(m,2h),1.83(d,j=12.3hz,2h),1.67(dddd,j=18.7,11.7,7.4,4.2hz,2h),1.26(d,j=6.8hz,6h)。lcms:[m h]
499.3。
[0219]
实施例2
[0220][0221]
参照实施例1制备d7的方法,合成化合物d10。
[0222]
d9-1:lcms:[m h]
388.2。
[0223]
d10:1h nmr(400mhz,dmso-d6)δ8.18(s,1h),6.79
–
6.62(m,2h),5.19(ddt,j=22.2,5.2,2.8hz,1h),4.38
–
4.34(m,1h),3.88
–
3.76(m,4h),3.71
–
3.35(m,4h),3.24(h,j=6.8hz,1h),3.09
–
2.82(m,3h),2.72(dd,j=5.0,1.7hz,6h),2.52(s,3h),2.24
–
2.00(m,2h),1.83(d,j=12.3hz,2h),1.68(tq,j=12.3,7.5,5.7hz,2h),1.26(d,j=6.9hz,6h)。lcms:[m h]
499.3。
[0224]
实施例3
[0225][0226]
参照实施例1制备d7的方法,合成化合物d11。
[0227]
d8-1:lcms:[m h]
374.2。
[0228]
d11:1h nmr(400mhz,dmso-d6)δ8.16(s,1h),6.66(dt,j=15.4,7.0hz,1h),6.43(d,j=15.4hz,1h),5.11(tt,j=6.8,4.1hz,1h),4.56(dd,j=9.9,6.9hz,1h),4.39
–
4.33(m,1h),4.26(dd,j=11.4,6.8hz,1h),4.20
–
4.16(m,1h),4.05(d,j=7.1hz,3h),3.89
–
3.81(m,3h),3.23(p,j=6.9hz,1h),3.10
–
2.83(m,2h),2.71(d,j=4.9hz,6h),2.50(s,3h),1.85(t,j=8.0hz,2h),1.70(d,j=12.6hz,2h),1.26(d,j=6.9hz,6h)。lcms:[m h]
485.3。
[0229]
实施例4
[0230][0231]
参照实施例1制备d7的方法,以f9为原料,合成化合物f10。
[0232]
f9-1:lcms:[m h]
373.2。
[0233]
f10:1h nmr(400mhz,dmso-d6)δ8.31(s,1h),6.75
–
6.59(m,2h),6.53
–
6.34(m,1h),5.12(tt,j=6.8,4.1hz,1h),4.68
–
4.49(m,1h),4.32
–
4.08(m,4h),3.91
–
3.77(m,6h),3.46
–
3.39(m,1h),3.03(qd,j=7.5,5.6hz,1h),2.71(d,j=4.8hz,6h),2.62(s,3h),1.91
–
1.82(m,2h),1.77(s,2h),1.27(d,j=6.9hz,6h)。lcms:[m h]
484.3。
[0234]
实施例5
[0235][0236]
三碳酰氯(0.26g,0.4eq)的甲苯(10ml)溶液中于0℃加入吡啶(0.18ml,1eq),搅拌10分钟后缓慢加入氨基-3-羟基哌啶(0.44g,1eq)的二氯甲烷(3ml)溶液,逐渐恢复到室温搅拌2小时。过滤后,保留滤液为下一步使用。
[0237]
上述溶液于室温下缓慢的加入到相应游离胺(0.5g,0.8eq)及三乙胺(0.76ml)的二氯甲烷(20ml)溶液。室温反应1小时候,浓缩,硅胶柱分离,洗脱液二氯甲烷-乙酸乙酯(2:1)得到固体产物17c-3(0.9g,95%).
[0238]
上述17c-3(0.9g)的乙酸乙酯(5ml)溶液中加入盐酸-乙酸乙酯溶液(2m,4ml),并在室温下搅拌3小时。悬浊液过滤,滤饼干燥后得到白色产物17c-4.lcms:[m h]
402.2;c
20h31
n7o2[0239]1h nmr(400mhz,dmso-d6)δ8.48(s,1h),7.98(s,1h),4.61(tt,j=8.5,4.0hz,1h),4.27(s,1h),4.03(dt,j=13.8,3.6hz,2h),3.20(q,j=7.1hz,1h),3.13
–
2.80(m,6h),2.39(s,3h),1.87
–
1.58(m,7h),1.41(dtd,j=12.6,9.1,3.8hz,2h),1.27(d,j=7.0hz,6h).
[0240][0241]
参照合成化合物17-71;
[0242]
lcms:[m h]
513.3;c
26h40
n8o3[0243]1h nmr(400mhz,dmso-d6)δ8.47(d,j=8.5hz,1h),7.98(s,1h),6.60(d,j=2.7hz,2h),4.81(dd,j=7.7,3.9hz,1h),4.27(s,1h),4.05(d,j=13.3hz,2h),3.69(d,j=10.0hz,2h),3.22(q,j=7.0hz,1h),3.12
–
2.85(m,5h),2.39(s,3h),2.16(s,7h),1.84(d,j=12.4hz,4h),1.73
–
1.44(m,4h),1.27(d,j=7.
[0244]
实施例6中间体cp2-11合成
[0245][0246]
参照合成化合物a2合成。cp-2:lcms:[m h]
255.0561.
[0247][0248]
参照合成化合物a3合成。cp-3:lcms:[m h]
209.0506.
[0249][0250]
参照合成化合物a4合成。cp-4:lcms:[m h]
223.0443.
[0251][0252]
参照合成化合物a5合成。cp-5:lcms:[m h]
241.0057.
[0253][0254]
参照合成化合物d1合成。cp-6:lcms:[m h]
405.1374.
[0255][0256]
参照合成化合物d3合成。cp-7:lcms:[m h]
437.1976.
[0257][0258]
参照合成化合物d4合成。cp-8:lcms:[m h]
373.1788.
[0259][0260]
参照合成化合物d5合成。cp-9:lcms:[m h]
273.1736.
[0261][0262]
参照合成化合物d8合成。cp-10:c23h33n7o4;lcms:[m h]
472.2164.
[0263]1h nmr(400mhz,dmso-d6)δ8.54(d,j=8.6hz,1h),7.87(s,1h),5.02(tt,j=6.7,4.0hz,1h),4.27(ttd,j=11.2,8.4,7.9,4.2hz,1h),4.14(s,2h),4.08
–
3.94(m,3h),3.58(s,1h),3.12
–
2.78(m,2h),2.39(s,3h),1.85(tdd,j=11.5,7.2,4.3hz,3h),1.66(s,2h),1.38(s,9h),0.92
–
0.81(m,2h),0.81
–
0.69(m,2h).
[0264][0265]
参照合成化合物d8-1合成。cp-11:lcms:[m h]
372.2324.
[0266]
实施例7
[0267][0268]
参照合成化合物d11合成。17-86:c24h34n8o3;lcms:[m h]
483.3055.
[0269]1h nmr(400mhz,dmso-d6)δ8.54(d,j=8.5hz,1h),7.87(s,1h),6.67
–
6.53(m,1h),6.20
–
6.01(m,1h),5.09(tt,j=6.9,4.0hz,1h),4.60
–
4.45(m,1h),4.34
–
4.17(m,2h),4.17
–
3.94(m,3h),3.83(dd,j=11.4,4.0hz,1h),3.09
–
2.94(m,4h),2.39(s,3h),2.14(d,j=1.6hz,6h),1.85(ddd,j=14.6,8.9,3.7hz,3h),1.66(s,2h),0.92
–
0.82(m,2h),0.79
–
0.69(m,2h).
[0270]
实施例8中间体tbp-1至11合成
[0271][0272]
参照合成化合物4合成。tbp-1:lcms:[m h]
140.1108
[0273][0274]
参照合成化合物a2合成。tbp-2:lcms:[m h]
271.1536.
[0275][0276]
参照合成化合物a3合成。tbp-3:lcms:[m h]
225.0321.
[0277][0278]
参照合成化合物a4合成。tbp-4:lcms:[m h]
239.0962.
[0279][0280]
参照合成化合物a5合成。tbp-5:lcms:[m h]
257.061.
[0281][0282]
参照合成化合物d1合成。tbp-6:lcms:[m h]
421.218.
[0283][0284]
参照合成化合物d3合成。tbp-7:c20h32n6o4s;lcms:[m h]
453.2274。
[0285]1h nmr(400mhz,dmso-d6)δ9.44(d,j=8.4hz,1h),8.23(s,1h),4.29(dtt,j=11.7,7.7,4.3hz,1h),4.13
–
3.87(m,2h),3.37(d,j=5.9hz,5h),1.84(dd,j=12.9,3.8hz,2h),1.67(qd,j=12.6,4.4hz,2h),1.42(d,j=3.0hz,18h).
[0286][0287]
参照合成化合物d4合成。tbp-8:lcms:[m h]
389.2596.
[0288][0289]
参照合成化合物d5合成。tbp-9:lcms:[m h]
289.2111.
[0290][0291]
参照合成化合物d8
[0292]
tbp-10:lcms:[m h]
488.2685
[0293][0294]
参照合成化合物d8-1合成。tbp-11:c19h29n7o2;lcms:[m h]
388.2033.
[0295]1h nmr(400mhz,dmso-d6)δ8.91(s,1h),8.66(d,j=15.9hz,1h),8.46(d,j=8.6hz,1h),7.86(s,1h),5.12
–
4.94(m,1h),4.28
–
4.11(m,3h),3.96
–
3.86(m,3h),2.90(dt,j=49.9,12.9hz,2h),2.32(s,3h),1.83
–
1.71(m,2h),1.58(d,j=12.2hz,2h),1.29(s,9h).
[0296]
实施例9
[0297][0298]
参照合成化合物d11合成。17-87:c25h38n8o3;lcms:[m h]
499.2964.
[0299]1h nmr(400mhz,dmso-d6)δ8.59(d,j=8.7hz,1h),7.99(s,1h),6.71
–
6.58(m,1h),6.16(dt,j=15.4,1.7hz,1h),5.14(tt,j=6.9,4.0hz,1h),4.56(d,j=8.3hz,1h),4.39
–
4.24(m,2h),4.22
–
4.03(m,3h),3.89(dd,j=11.3,4.0hz,1h),3.14
–
3.01(m,4h),2.46(s,3h),2.20(s,6h),1.89(d,j=12.4hz,2h),1.72(s,2h),1.44(s,9h).
[0300]
实施例10
[0301]
[0302]
参照合成化合物d7合成。
[0303]1h nmr(400mhz,氯仿-d)δ7.80(s,1h),6.35(d,j=8.3hz,1h),5.96(dt,j=35.5,9.0hz,1h),5.32(q,j=5.1,3.7hz,1h),4.38
–
4.01(m,3h),3.93
–
3.59(m,4h),3.24
–
3.04(m,4h),2.53(s,3h),2.29(s,3h),2.23
–
2.02(m,6h),1.93
–
1.78(m,5h),1.67
–
1.51(m,3h),1.32(d,j=6.9hz,6h).
[0304]
lcms:[m h]
543.3;
[0305]
实施例11
[0306][0307]
参照合成化合物d7合成。
[0308]1h nmr(400mhz,氯仿-d)δ7.80(s,1h),6.46
–
6.28(m,1h),5.95(dd,j=35.5,9.2hz,1h),5.38
–
5.26(m,1h),4.39
–
3.98(m,3h),3.93
–
3.60(m,4h),3.27
–
3.03(m,5h),2.53(s,3h),2.29(s,3h),2.23
–
2.00(m,6h),1.96
–
1.78(m,6h),1.70
–
1.53(m,3h),1.32(d,j=6.9hz,6h).
[0309]
lcms:[m h]
543.3;
[0310]
实施例12
[0311][0312]
参照合成化合物d7的合成。
[0313]1h nmr(400mhz,氯仿-d)δ7.81(s,1h),6.33(d,j=8.2hz,1h),6.03(dd,j=35.6,9.3hz,1h),5.21(tt,j=6.7,4.2hz,1h),4.71(d,j=5.4hz,1h),4.48
–
4.26(m,3h),4.25
–
4.04(m,3h),3.29
–
2.96(m,5h),2.53(s,3h),2.30(s,3h),2.15(dd,j=12.8,3.6hz,2h),2.06
–
1.80(m,5h),1.70
–
1.53(m,3h),1.32(d,j=7.0hz,6h).
[0314]
lcms:[m h]
529.3.
[0315]
实施例13中间体9-11的合成
[0316][0317]
溴化物5(5克,85%)在乙腈(4ml)的溶液中加入碳酸钾(5.8g,1.5eq),然后加入吗啉(2.7ml,1.1eq).在30℃下搅拌2h.冷却到室温,过滤浓缩,硅胶柱纯化,洗脱液(4:1正庚烷-乙酸乙酯)得到液体产物8(4.4g,83%).
[0318]1h nmr(400mhz,氯仿-d)δ6.94(dt,j=15.7,6.1hz,1h),6.01(dt,j=15.8,1.6hz,1h),3.74(s,3h),3.74
–
3.69(m,4h),3.13(dd,j=6.1,1.7hz,2h),2.46(dd,j=5.6,3.7hz,4h).
[0319]
在上述甲酯产物(4.4g,23.7mmol)的四氢呋喃(10ml)/水(5ml)的溶液中加入氢氧化钠(2.4g,2.5eq),混合物在室温下搅拌4h.反应液浓缩后,残留液体用甲基叔丁基萃取,保留水相并调节ph至2左右。然后浓缩至干,残渣用甲醇提取,过滤,浓缩至干,得到白色产物9。
[0320][0321]
溴化物5(5克,85%)在乙腈(4ml)的溶液中加入碳酸钾(5.8g,1.5eq),然后加入1-甲基哌嗪(3.4ml,1.1eq).在30℃下搅拌2h.冷却到室温,过滤浓缩,硅胶柱纯化,洗脱液(4:1正庚烷-乙酸乙酯)得到固体产物10(3g,58%).
[0322]1h nmr(400mhz,氯仿-d)δ6.96(dt,j=15.7,6.2hz,1h),6.00(dt,j=15.7,1.6hz,1h),3.74(s,3h),3.14(dd,j=6.2,1.7hz,2h),2.54(d,j=70.6hz,8h),2.29(s,3h).
[0323]
在上述甲酯产物(3g,16.2mmol)的四氢呋喃(10ml)/水(5ml)的溶液中加入氢氧化钠(1.6g,2.5eq),混合物在室温下搅拌4h.反应液浓缩后,残留液体用甲基叔丁基萃取,保留水相并调节ph至2左右。然后浓缩至干,残渣用甲醇提取,过滤,浓缩至干,得到白色产物11。
[0324]
实施例14
[0325][0326]
游离胺化合物d8-1(100mg,0.269mmol)在乙腈(4ml)的溶液中加入二异丙基乙胺(0.5ml),然后加入2-氟丙烯酸(37mg,1.5eq),丙基磷酸酐(0.26g,1.5eq).反应液在室温下搅拌20小时,浓缩后,残留液体用二氯甲烷-10%碳酸钠溶液萃取分相,取有机相,浓缩后硅胶柱纯化,洗脱液二氯甲烷-乙酸乙酯(2:1),得到白色产物17-70.lcms:[m h]
446.2;c
21h28
fn7o3[0327]1h nmr(400mhz,dmso-d6)δ8.51(d,j=8.6hz,1h),7.99(s,1h),5.49(dd,j=48.4,3.6hz,1h),5.31(dd,j=16.6,3.6hz,1h),5.11(ddd,j=10.9,6.8,4.1hz,1h),4.67(s,1h),4.40
–
4.20(m,3h),4.19
–
3.85(m,3h),3.16
–
2.81(m,3h),2.40(s,3h),1.85(d,j=11.3hz,2h),1.68(s,2h),1.27(d,j=6.9hz,6h).
[0328]
实施例15
[0329][0330]
参照合成化合物17-70:
[0331]
lcms:[m h]
527.3;c
26h38
n8o4[0332]1h nmr(400mhz,dmso-d6)δ8.48(d,j=8.5hz,1h),7.98(s,1h),6.62
–
6.55(m,1h),6.12(dt,j=15.4,1.6hz,1h),5.09(tt,j=6.9,4.0hz,1h),4.52(t,j=8.4hz,1h),4.34
–
4.01(m,5h),3.87
–
3.79(m,1h),3.57(q,j=4.1,3.6hz,6h),3.10
–
3.05(m,3h),2.40(s,3h),2.35(t,j=4.7hz,4h),1.85(d,j=11.7hz,2h),1.67(d,j=12.3hz,2h),1.27(d,j=6.9hz,6h).
[0333]
实施例16
[0334][0335]
参照合成化合物17-71
[0336]
lcms:[m h]
540.3;c
27h41
n9o3[0337]1h nmr(400mhz,dmso-d6)δ8.48(d,j=8.6hz,1h),7.98(s,1h),6.57(dt,j=15.4,6.2hz,1h),6.17
–
6.06(m,1h),5.08(tq,j=6.6,3.3,2.5hz,1h),4.48(dt,j=24.4,8.5hz,1h),4.34
–
4.00(m,6h),3.83(d,j=13.0hz,1h),3.62(s,8h),3.07(ddd,j=6.9,4.5,3.0hz,3h),2.39(s,3h),2.21
–
2.17(m,4h),1.85(d,j=12.6hz,2h),1.67(d,j=12.1hz,2h),1.27(d,j=6.9hz,6h).
[0338]
实施例17
[0339][0340]
游离胺d8-1(100mg,0.269mmol)在二氯甲烷(3ml)/二异丙基乙胺(0.15ml)的溶液中加入丙烯酰氯(25mg,1eq).反应在室温下搅拌30min.浓缩后直接硅胶柱分离纯化,洗脱液二氯甲烷-乙酸乙酯-三乙胺(1:1:0.05)得到白色固体17-73.
[0341]
lcms:[m h] 428.2;c21h29n7o3
[0342]
1h nmr(400mhz,dmso-d6)δ8.48(d,j=8.6hz,1h),7.98(s,1h),6.31(dd,j=17.0,10.3hz,1h),6.11(dd,j=17.0,2.2hz,1h),5.69(dd,j=10.3,2.2hz,1h),5.10(tt,j=6.9,4.0hz,1h),4.54(t,j=8.4hz,1h),4.33
–
4.13(m,3h),4.08
–
4.01(m,2h),3.95
–
3.77(m,1h),3.15
–
2.83(m,3h),2.40(s,3h),1.92
–
1.79(m,2h),1.67(d,j=12.3hz,2h),1.27(d,j=6.9hz,6h).
[0343]
实施例18
[0344][0345]
参照合成化合物17-73
[0346]
lcms:[m h] 456.2;c23h33n7o3
[0347]
1h nmr(400mhz,dmso-d6)δ8.47(d,j=8.6hz,1h),7.98(s,1h),6.89
–
6.68(m,1h),6.09(dd,j=16.7,2.4hz,1h),5.67(dd,j=10.5,2.4hz,1h),4.82(tt,j=7.5,3.8hz,1h),4.39
–
4.19(m,1h),4.05(d,j=13.2hz,2h),3.71(ddd,j=13.5,7.6,3.9hz,2h),3.49(s,2h),3.07(p,j=6.9hz,1h),3.01
–
2.86(m,2h),2.39(s,3h),1.84(d,j=12.4hz,4h),1.73
–
1.49(m,4h),1.27(d,j=6.9hz,6h).
[0348]
实施例19
[0349][0350]
参照合成化合物17c-3得到化合物17c-7(0.16g,75%).lcms:[m h] 488.4.
[0351]
参照合成化合物17c-3得到化合物17c-8.lcms:[m h] 388.2.
[0352][0353]
参照合成化合物17-71;
[0354]
lcms:[m h] 499.3;c25h38n8o3
[0355]
1h nmr(400mhz,dmso-d6)δ8.48(t,j=8.2hz,1h),7.98(s,1h),6.69
–
6.50(m,1h),6.19
–
5.98(m,1h),4.25(dt,j=31.5,10.0hz,3h),4.08
–
3.84(m,3h),3.16
–
2.88(m,5h),2.40(d,j=2.9hz,3h),2.15(d,j=4.7hz,6h),1.81(t,j=15.4hz,2h),1.63(s,4h),1.27(d,j=6.9hz,6h),1.07
–
0.90(m,2h).
[0356]
实施例20
[0357][0358]
1-boc-3-氨基-3-甲基吖啶(85mg,1eq.)的二氯甲烷(3ml)/二异丙基乙胺(0.4ml)溶液中加入羰基二咪唑(78mg,1.05eq.),反应在室温下搅拌2小时,然后加入哌啶胺衍生物(0.13g,1eq.)并在室温下搅拌2小时。反应结束后直接硅胶柱纯化分离,洗脱液二氯甲烷-乙酸乙酯(1:1),得到白色固体17c-5(0.2g).
[0359]
17c-5(0.2g)的二氯甲烷dcm(5ml)溶液中加入三氟乙酸(1ml),反应室温下搅拌3小时。浓缩后,残渣用二氯甲烷-10%碳酸钠溶液萃取分相,取有机相,有机相用无水碳酸钠干燥,过滤浓缩后得到产物17c-6。lcms:[m h] 387.2
[0360][0361]
参照合成化合物17-71;
[0362]
lcms:[m h] 498.3;c25h39n9o2
[0363]
1h nmr(400mhz,dmso-d6)δ8.43(d,j=8.5hz,1h),7.98(d,j=5.0hz,1h),7.89(t,j=6.3hz,1h),6.56(dt,j=15.5,6.0hz,1h),6.15(dt,j=15.4,1.6hz,1h),4.19(d,j=8.8hz,1h),4.15(d,j=8.1hz,1h),3.98(dd,j=19.3,9.7hz,1h),3.80(t,j=9.8hz,3h),3.26(dd,j=13.3,6.7hz,1h),3.13
–
2.98(m,3h),2.97
–
2.83(m,4h),2.39(s,3h),2.09(s,6h),1.88
–
1.57(m,5h),1.27(d,j=6.9hz,6h).
[0364]
实施例21
[0365][0366]
参照合成化合物17c-5得到化合物17c-11(0.2g).lcms:[m h] 473.2
[0367]
参照合成化合物17c-6得到化合物17c-12(0.12g).lcms:[m h] 373.2
[0368][0369]
参照合成化合物17-71;
[0370]
lcms:[m h] 484.3;c24h37n9o2
[0371]
1h nmr(400mhz,dmso-d6)δ8.49(dd,j=8.6,4.7hz,1h),8.06(t,j=6.0hz,1h),7.99(d,j=2.4hz,1h),6.57(ddt,j=15.4,9.1,6.2hz,1h),6.15
–
6.02(m,1h),4.25(q,j=9.1,7.3hz,2h),3.99(qd,j=6.4,4.2hz,2h),3.84(t,j=14.4hz,2h),3.30
–
3.20(m,1h),3.14
–
2.72(m,6h),2.39(s,3h),2.13(d,j=9.1hz,6h),1.85
–
1.54(m,4h),1.27(d,j=
6.9hz,6h).
[0372]
实施例22
[0373][0374]
参照合成化合物17c-5得到化合物17c-13(0.2g).lcms:[m h] 488.3
[0375]
参照合成化合物17c-6得到化合物17c-14(0.12g).lcms:[m h] 388.2
[0376][0377]
参照合成化合物17-73
[0378]
lcms:[m h] 442.2
[0379]
c22h31n7o3
[0380]
1h nmr(400mhz,dmso-d6)δ8.52(d,j=8.6hz,1h),8.39(d,j=7.9hz,1h),7.99(s,1h),6.32
–
6.01(m,2h),5.60(dd,j=9.7,2.6hz,1h),4.63(p,j=7.4hz,1h),4.40
–
4.17(m,1h),4.08
–
3.93(m,3h),3.21
–
2.76(m,3h),2.40(d,j=1.1hz,5h),1.98(dt,j=11.9,8.2hz,2h),1.84(d,j=12.0hz,2h),1.76
–
1.57(m,2h),1.27(d,j=6.9hz,6h).
[0381]
实施例23
[0382][0383]
甲基砜d3(0.5g,1.14mmol)以及4-氨基四氢吡喃(0.12g,1.1eq)的异丙醇(3ml)溶液中加入二异丙基乙胺(0.6ml,3eq),混合物在90℃下于密封管中搅拌18小时。浓缩后得到粗品产物,直接用于下一步。ga1,lcms:[m h] 460.319
[0384]
参照合成化合物d5:ga2,lcms:[m h] 360.2298
[0385]
ga3:参照合成化合物d8
[0386]
ga3,lcms:[m h] 559.2604
[0387]
ga4,参照合成化合物d8-1
[0388]
ga4,c22h34n8o3;lcms:[m h] 459.3708
[0389]
1h nmr(400mhz,dmso-d6)δ8.13(d,j=70.6hz,1h),7.69(s,1h),6.96(d,j=
45.4hz,1h),5.05(p,j=6.3hz,1h),4.25
–
3.98(m,3h),3.88(ddt,j=15.8,11.9,5.3hz,3h),3.69(dd,j=9.4,6.8hz,1h),3.51(t,j=7.8hz,2h),3.40(m,j=2.0hz,3h),3.07
–
2.67(m,4h),1.84(d,j=13.6hz,4h),1.74
–
1.57(m,2h),1.49(tq,j=11.9,5.5,4.5hz,2h),1.22(d,j=7.1hz,6h).
[0390][0391]
17-83:参照合成化合物17-73
[0392]
c25h36n8o4;lcms:[m h] 513.2823
[0393]
1h nmr(400mhz,dmso-d6)δ8.14(d,j=68.8hz,1h),7.69(s,1h),7.06
–
6.82(m,1h),6.32(dd,j=17.0,10.3hz,1h),6.11(dd,j=17.0,2.2hz,1h),5.69(dd,j=10.3,2.2hz,1h),5.09(tt,j=7.0,4.0hz,1h),4.54(t,j=8.4hz,1h),4.32
–
3.97(m,5h),3.87(td,j=10.5,9.0,4.4hz,4h),3.37(d,j=4.5hz,2h),2.90(h,j=6.7hz,3h),1.97
–
1.74(m,4h),1.65(s,2h),1.57
–
1.42(m,2h),1.22(d,j=7.0hz,6h).
[0394]
17-82:参照合成化合物d11
[0395]
c28h43n9o4;lcms:[m h] 570.3378
[0396]
1h nmr(400mhz,dmso-d6)δ8.20(d,j=68.5hz,1h),7.75(s,1h),7.02(d,j=44.9hz,1h),6.65(dt,j=15.3,6.2hz,1h),6.16(dd,j=15.4,1.8hz,1h),5.14(tt,j=6.9,4.0hz,1h),4.58(t,j=8.5hz,1h),4.35
–
4.03(m,5h),3.93(tdt,j=15.4,11.9,5.3hz,4h),3.43(td,j=11.6,2.1hz,4h),3.14
–
3.03(m,3h),2.20(s,6h),1.90(d,j=12.9hz,4h),1.71(s,2h),1.62
–
1.49(m,2h),1.29(d,j=7.0hz,6h).
[0397]
效果实施例1 cdk7抑制活性
[0398]
cdk7抑制活性的测试方法参照wo2015058140。
[0399]
使用商业可获得的cdk7(eurofins,cat.no,14-476m,lot.no.wae0003)、ctd3 peptide(gl biochem,cat.no.346885,lot.p160205-sy346885)、atp(sigma,cat.no.a7699-1g,cas no.987-65-5)、dmso(sigma,cat.no.d2650,lot.no.474382)、edta(sigma,cat.no.e5134,cas no.60-00-4)等试剂,测定化合物在200nm和10nm浓度对cdk7的抑制率。结果如表1所示。
[0400]
表1
[0401][0402]
对照化合物x为us20190144456实施例1化合物
[0403]
对照化合物y为us20190144456实施例3化合物
[0404]
效果实施例2 cdk1,2,4,6,9抑制活性
[0405]
cdk1,2,4,6,9抑制活性的测试方法参照us2019144456a1。
[0406]
使用商业可获得的cdk1(millipore,cat.no 14-450m,lot.no 25729u)、cdk4(carna,cat.no 04-105,lot.no 14cbs-0306p)、cdk6(carna,cat.no 04-107,lot.no 15cbs-0744c)、cdk9(millipore,cat.no 14-685m,lot.nowab0200)、cdk2(eurofins,
cat.no 14-448m,lot.no d7nn039u-g)、peptide fam-p18(gl biochem,cat.no.114204,lot.no.p080319-xy114202)、peptide fam-p8(gl biochem,cat.no.112396,lot.no.p080327-xy112396)、ctd3 peptide(gl biochem,cat.no.sy346885,lot.no.p160205-sy346885)、atp(sigma,cat.no.a7699-1g,cas no.987-65-5)、dmso(sigma,cat.no.d2650,lot.no.474382)、edta(sigma,cat.no.e5134,cas no.60-00-4)、96-well plate(corning,cat.no.3365,lot.no.22008026)、384-well plate(corning,cat.no.3573,lot.no.12608008)等试剂,测定化合物在1000nm和100nm浓度对cdk1,2,4,6,9的抑制率。结果如表2所示。
[0407]
表2
[0408][0409][0410]
试验中采用的对照化合物x为us20190144456实施例1化合物。
[0411]
效果实施例3 cck8法检测受试物对各细胞体外增殖活性的影响
[0412]
取对数生长期细胞进行实验。细胞经消化、计数、制成1
×
105个/ml的细胞悬液,接种于96孔板中(100μl/孔),置于37℃,5%co2培养箱中培养24小时;每孔加入含相应浓度的受试物,同时设立阴性对照组及空白组,每组3复孔;将板置于培养箱中培养72h后,显微镜下观察各组细胞形态,每孔加入10μl cck8溶液,在细胞培养箱内继续孵育4小时,450nm下测定吸光值,并计算增殖抑制率,结果如表3所示。
[0413]
表3
[0414][0415]
试验中采用的对照化合物x为us20190144456实施例1化合物。
[0416]
效果实施例4化合物对裸鼠异种移植肿瘤生长的影响
[0417]
试验中采用的对照化合物x为us20190144456实施例1化合物。
[0418]
取生长旺盛期的肿瘤,在无菌条件下,肿瘤细胞接种balb/c裸小鼠右侧腋窝皮下,细胞接种量为5
×
106。裸小鼠移植瘤用游标卡尺测量移植瘤直径,待肿瘤生长至100mm3左右时挑选生长状态良好且肿瘤大小均一性较好荷瘤裸鼠分组给药。给药结束后脱颈处死裸鼠,手术剥取瘤块称重,抗肿瘤活性的评价指标为抑瘤率(%),计算公式为:抑瘤率(%)=(模型组瘤重-给药组瘤重/模型组瘤重*100%)表4化合物对人肺腺癌细胞nci-h1299裸鼠异种移植肿瘤生长的影响(mean
±
sd,n=8)
[0419]
组别剂量起始动物数终末动物数瘤重(g)抑瘤率(%)模型组10ml/kg生理盐水881.220
±
0.069-对照化合物x20mg/kg880.634
±
0.062
**
53.4化合物f1020mg/kg880.501
±
0.034
**
68.4化合物d1120mg/kg880.420
±
0.037
**
70.1
[0420]
与模型组比较,
*
p《0.05,
**
p《0.01。
[0421]
根据上述数据可知,三种化合物对人肺腺癌细胞nci-h1299裸鼠异种移植瘤生长有一定的抑制作用。对nci-h1299异种移植瘤荷瘤裸鼠抗肿瘤活性从强到弱顺序为:化合物d11>化合物f10>对照化合物x。
[0422]
表5化合物对人肺癌细胞a549裸鼠异种移植肿瘤生长的影响(mean
±
sd,n=8)
[0423]
组别剂量起始动物数终末动物数瘤重(g)抑瘤率(%)模型组10ml/kg生理盐水881.197
±
0.058-对照化合物x20mg/kg880.652
±
0.071
**
55.7化合物f1020mg/kg880.537
±
0.047
**
64.9化合物d1120mg/kg880.488
±
0.069
**
68.0
[0424]
与模型组比较,
*
p《0.05,
**
p《0.01。
[0425]
根据上述数据可知,三种化合物对人肺癌细胞a549裸鼠异种移植瘤生长有一定的抑制作用。对人肺癌细胞a549异种移植瘤荷瘤裸鼠抗肿瘤活性从强到弱顺序为:化合物d11>化合物f10>对照化合物x。
[0426]
表6化合物对人乳腺癌细胞mda-mb-468裸鼠异种移植肿瘤生长的影响(mean
±
sd,n=8)
[0427]
组别剂量起始动物数终末动物数瘤重(g)抑瘤率(%)
模型组10ml/kg生理盐水881.606
±
0.078-对照化合物x20mg/kg880.702
±
0.054
*
52.6化合物f1020mg/kg880.611
±
0.066
**
66.3化合物d1120mg/kg880.509
±
0.059
**
62.9
[0428]
与模型组比较,
*
p《0.05,
**
p《0.01。
[0429]
根据上述数据可知,三种化合物对人乳腺癌细胞mda-mb-468裸鼠异种移植瘤生长均有一定的抑制作用。对人乳腺癌细胞mda-mb-468异种移植瘤荷瘤裸鼠抗肿瘤活性从强到弱顺序为:化合物f10>化合物d11>对照化合物x。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。