1.本披露涉及使用布鲁顿酪氨酸激酶(bruton’s tyrosine kinase(btk))抑制剂治疗舍格伦综合征(syndrome)的方法。
背景技术:
2.舍格伦综合征(sjs)是病因不明的全身性自身免疫性疾病,其特征是淋巴样浸润和外分泌腺的逐步破坏(brito
‑
zer
ó
n p.等人,(2016)treating the underlying pathophysiology of primary syndrome:recent advances and future prospects[治疗原发性舍格伦综合征的潜在病理生理:最近进展和未来展望].drugs[药物]第1601
‑
1623页)。
[0003]
尽管该病主要影响泪腺和唾液腺,但炎症过程可以靶向任何器官,约有15%的患者表现出严重腺外表现(baldini c.等人(2014)primarysyndrome as a multi
‑
organ disease:impact of the serological profile on the clinical presentation of the disease in a large cohort of italian patients[作为多器官疾病的原发性舍格伦综合征:大群组意大利患者中血清学特征对疾病临床表现的影响].rheumatology(oxford)[风湿病学(牛津)]第839
‑
44页)。临床表现最常见的主要特征是唾液和泪腺的外分泌病变,表现为口腔和眼睛干燥。但是,症状可能非常多样化,范围超出干燥,还包括影响几乎所有患者的肌肉骨骼疼痛和疲劳,至重度、腺外和全身性受累(特征为上皮周淋巴细胞浸润和免疫复合物沉积)。sjs发生的潜在机制是外分泌腺上皮的破坏导致自身反应性b细胞和t细胞(brito
‑
zer
ó
n p.等人,(2016)treating the underlying pathophysiology of primary syndrome:recent advances and future prospects[治疗原发性舍格伦综合征的潜在病理生理:最近进展和未来展望].drugs.[药物]第1601
‑
1623页)。自身抗体(尤其是针对ro/ssa的抗体)的高流行率甚至在很早的阶段就表明自身反应性b细胞参与了sjs的发病机理(nocturne g.等人,(2018)b cells in the pathogenesis of primarysyndrome[原发性舍格伦综合征发病机理中的b细胞].nat rev rheumatol[自然
·
风湿病学综述]第133
‑
145页)。
[0004]
所述b细胞病理还导致恶性转化的风险增加,5%的sjs患者的b细胞淋巴瘤终生风险增加了10倍(baldini c.等人,(2014)primarysyndrome as a multi
‑
organ disease:impact of the serological profile on the clinical presentation of the disease in a large cohort of italian patients[作为多器官疾病的原发性舍格伦综合征:大队列意大利患者中血清学特征对疾病临床表现的影响].rheumatology[风湿病学](牛津)第839
‑
44页)。据估计,sjs的患病率为每1000人0.3至1人(qin b.等人(2015)epidemiology of primarysyndrome:a systematic review and meta
‑
analysis[原发性舍格伦综合征的流行病学:系统回顾和荟萃分析].ann.rheum.dis.[风湿
性疾病年鉴]第1983
‑
9页)并且是仅次于类风湿关节炎的全身性自身免疫性疾病。所述疾病主要影响女性,女性/男性比率为9:1,并且可在任何年龄发生。sjs中症状的主要影响是对生活质量和生产力的严重影响,通常是由与所述疾病相关的致残性疲劳引起的(mariette x.等人(2018)primarysyndrome[原发性舍格伦综合征].n.engl.j.med.[新英格兰医学杂志]第931
‑
939页)。还存在许多潜在的重度全身性并发症,包括关节炎、皮肤血管炎、周围神经病变、肾小球肾炎、间质性肾炎、胆源性胆管炎、阻塞性细支气管炎及其他,涉及多器官系统,并且影响20%
‑
40%的患者(seror r.等人(2014)outcome measures for primarysyndrome:a comprehensive review[原发性舍格伦综合征的结果量度:全面综述].j.autoimmun.[自身免疫杂志]第51
‑
6页)。
[0005]
舍格伦综合征的临床特性可分为医学上可评价的表现和患者症状表现。目前,没有单一的评估工具可以捕获sjs的这两类临床表现的疾病活动度。因此,“欧洲抗风湿病联盟(eular)舍格伦综合征(ss)患者报告指数(esspri)”和eular ss疾病活动度指数(essdai)被广泛接受并且经过验证,以测量sjs的症状和全身性表现(franceschini f.等人,(2017),bmc medicine[bmc医学],15:69)。
[0006]
就目前的治疗前景而言,尚无国际认可的sjs全身性疗法。就口眼干燥而言,对sjs患者的治疗仅限于对症护理。类固醇和典型的dmard大多无效,并且尚无药物干预能够有效对抗严重的致残性疲劳。缺乏有效的治疗选择突显了评价这种高度衰竭性疾病的新治疗方法的需要。由于b细胞自身反应的模式在某种程度上类似于全身性红斑狼疮和类风湿性关节炎,最近,评价了使用抗cd20单克隆抗体(mab)利妥昔单抗的b细胞耗竭疗法的sjs的腺体和腺外表现以及取得不同程度的成功的淋巴瘤治疗。但是,该方法目前尚未被批准为sjs的治疗方法。利妥昔单抗功效不足可能与受影响组织中b细胞的不完全耗竭有关(brito
‑
zer
ó
n p等人(2016)treating the underlying pathophysiology of primary syndrome:recent advances and future prospects[治疗原发性舍格伦综合征的潜在病理生理:最近进展和未来展望].drugs.[药物]第1601
‑
1623页)。
[0007]
尽管有对sjs的现有治疗,但在为sjs受试者提供新的治疗选择上仍有很大的医学需求。
技术实现要素:
[0008]
本发明的目的是提供治疗受试者的舍格伦综合征疾病的新方法,所述方法包括向所述需要这种治疗的受试者施用治疗有效量的ni
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(ni
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺,或其药学上可接受的盐。
[0009]
因此,本文披露了治疗舍格伦综合征(sjs)的方法,所述方法包括向需要这种治疗的受试者施用日剂量约0.5mg至约600mg,优选地日剂量约10mg至约200mg,或更优选地约10mg至约100mg剂量的ni
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(ni
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺,或其药学上可接受的盐。
[0010]
还披露了ni
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(ni
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺;或其药学上可接受的盐,用于在治疗sjs中使用,其
中将ni
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(ni
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐以约0.5mg至约600mg的日剂量,优选地约10mg至约200mg的日剂量,以及最优选地约10mg至约100mg的日剂量施用。
附图说明
[0011]
图1:单个递增剂量0.5mg至600mg后化合物(i)的血液浓度
‑
时间过程
[0012]
图2:多个递增剂量10mg至400mg q.d.给药后化合物(i)的血液浓度
‑
时间过程
[0013]
图3:多个递增剂量100mg b.i.d.至200mg b.i.d.后化合物(i)的血液浓度
‑
时间过程
[0014]
图4:单个口服剂量60mg具有式(i)的化合物后观察到的食物效果
[0015]
图5:单剂量的具有式(i)的化合物后外周血中btk占有率的算术平均(sd)百分比
[0016]
图6:在多个递增剂量的具有式(i)的化合物的第12天,对嗜碱性粒细胞活化的抑制百分比相对于具有式(i)的化合物的每日总剂量
[0017]
图7:多个递增剂量的皮肤针刺试验中风团大小减小
具体实施方式
[0018]
布鲁顿酪氨酸激酶(btk)是细胞质酪氨酸激酶,并且是tec激酶家族的成员。btk在适应性和先天性免疫系统的细胞,包括b细胞、巨噬细胞、嗜碱性粒细胞、肥大细胞和血小板中表达。btk对于通过fcε受体(对于ige为fcεr1)和活化fcγ受体(对于igg为fcγr)以及b细胞抗原受体(bcr)进行信号传导都是必不可少的。btk抑制已被证明是治疗b细胞恶性肿瘤的有效概念。共价btk抑制剂依鲁替尼阿卡替尼和赞布替尼被批准用于治疗某些b细胞恶性肿瘤(thompson pa等人,(2018)bruton's tyrosine kinase inhibitors:first and second generation agents for patients with chronic lymphocytic leukemia(cll)[布鲁顿酪氨酸激酶抑制剂:用于慢性淋巴细胞型白血病患者的第一代和第二代药剂].expert opin investig drugs[实验性药物专家意见]第31
‑
42页)。在临床前和临床研究中,btk抑制已显示出对b细胞自身免疫的有希望的功效(tan sl.等人,(2013)targeting the syk
‑
btk axis for the treatment of immunological and hematological disorders:recent progress and therapeutic perspectives[靶向syk
‑
btk轴以治疗免疫学和血液学疾病:最近进展和治疗前景].pharmacol.ther.[药理学和治疗学]第294
‑
309页;whang j.a.等人(2014)bruton's tyrosine kinase inhibitors for the treatment of rheumatoid arthritis[布鲁顿酪氨酸激酶抑制剂用于治疗类风湿性关节炎].drug discov.today[当今药物发现]第1200
‑
4页;satterthwaite a.b.(2017)bruton's tyrosine kinase,a component of b cell signaling pathways,has multiple roles in the pathogenesis of lupus[b细胞信号传导途径成分布鲁顿酪氨酸激酶在红斑狼疮的发病机理中具有多种作用].front immunol[免疫学前沿]第1986页;rip j.等人,(2018)the role of bruton's tyrosine kinase in immune cell signaling and systemic autoimmunity[布鲁顿酪氨酸激酶在免疫细胞信号传导和全身性自身免疫中的作用].crit.rev.immunol.[免疫学评论]第17
‑
62页)。因此,
抑制btk是治疗各种自身免疫和慢性炎性疾病的有吸引力的治疗概念,这些疾病包括类风湿性关节炎、多发性硬化症、全身性红斑狼疮、慢性荨麻疹、特应性皮炎、哮喘和原发性舍格伦综合征(tan sl,liao c,lucas mc等人(2013)targeting the syk
‑
btk axis for the treatment of immunological and hematological disorders:recent progress and therapeutic perspectives[靶向syk
‑
btk轴以治疗免疫学和血液学疾病:最近进展和治疗前景].pharmacol.ther.[药理学和治疗学]第294
‑
309页;whang ja,chang by(2014)bruton's tyrosine kinase inhibitors for the treatment of rheumatoid arthritis[布鲁顿酪氨酸激酶抑制剂用于治疗类风湿性关节炎].drug discov.today[当今药物发现]第1200
‑
4页)。
[0019]
此外,在相当比例的sjs患者中显示循环b细胞中的btk水平升高,者与较高的血清类风湿因子(rf)水平相关(corneth obj等人(2017)enhanced bruton's tyrosine kinase activity in peripheral blood blymphocytes from patients with autoimmune disease[来自自身免疫疾病患者的外周血b淋巴细胞中增强的布鲁顿酪氨酸激酶活性].p.第1313
‑
1324页)。
[0020]
n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐是btk抑制剂,在本文中称为具有式(i)的化合物:
[0021]
或其药学上可接受的盐。
[0022]
所述化合物在2015年6月4日提交的wo 2015/079417(代理人案卷号pat056021
‑
wo
‑
pct)申请中描述。该化合物是布鲁顿酪氨酸激酶(btk)的选择性、有效、不可逆的共价抑制剂,并且可用于btk介导的疾病或障碍。
[0023]
于是,我们现已设计出用化合物n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐治疗sjs患者的给药方案。
[0024]
定义:
[0025]
出于解释本说明书的目的,将应用下面的定义,并且在适宜的情况下,以单数形式使用的术语还包括复数形式,并且反之亦然。
[0026]
如本文使用的短语“药学上可接受的”是指在合理医学判断范围内的那些化合物、材料、组合物和/或剂型,这些是适合用于与人类和动物组织接触使用而没有过多的毒性、刺激、过敏反应或其他问题或并发症,与合理的益处/风险比相称。
[0027]
本文给出的任何化学式还旨在表示所述化合物的未标记的形式以及同位素标记的形式。同位素标记的化合物具有由本文给出的式表示的结构,除了一个或多个原子被具
有所选原子质量或质量数的原子代替。可以掺入本披露的化合物中的同位素包括例如氢、碳、氮、氧、氟、碘和氯的同位素,如3h、
11
c、
13
c、
14
c、
15
n、
18
f和
36
cl。因此,应理解,本披露包括掺入任何前述同位素(包括例如放射性同位素(诸如3h和
14
c))中一种或多种的化合物或其中存在非放射性同位素(诸如2h和
13
c)的那些。此类同位素标记的化合物可用于代谢研究(用
14
c)、反应动力学研究(例如用2h或3h)、检测或成像技术(例如正电子发射断层扫描(pet)或单光子发射计算机断层扫描(spect),包括药物或底物组织分布测定),或用于患者的放射治疗。特别地,
18
f或标记的化合物对于pet或spect研究可能是特别期望的。同位素标记的化合物通常可以通过本领域技术人员已知的常规技术,例如使用适当的同位素标记的试剂代替未标记的先前使用的试剂来制备。
[0028]
如本文所用的术语“药物组合物”是指通过使用或混合或组合一种以上活性成分得到的产品。应当理解,本文所用的药物组合物包括活性成分的固定和非固定组合。术语“固定组合”是指将活性成分,例如具有式(i)的化合物或其药学上可接受的盐以及一种或多种组合伴侣,作为单一实体或剂型同时施用于患者。在这种情况下,所述术语是指一个单位剂型(例如胶囊、片剂或小袋)中的固定剂量组合。术语“非固定组合”或“套装试剂盒(kit of parts)”均表示所述活性成分,例如本披露的化合物和一种或多种组合伴侣和/或一种或多种助剂,作为单独实体同时、同步或无特定时间限制地顺序施用或独立地共同施用于患者,其中这种施用在患者体内提供了两种化合物的治疗有效水平,尤其是在这些时间间隔允许组合伴侣显示出协作作用(例如累加或协同作用)的有效剂量的情况下。术语“非固定组合”也适用于混合物疗法,例如三种或更多种活性成分的施用。因此,术语“非固定组合”特别定义了在本文中描述的化合物可以彼此独立地(即同时或在不同时间点)给药的意义上的施用、使用、组合物或配制品。应当理解的是,术语“非固定组合”也包括单一药剂与一种或多种固定组合产品一起使用,其中每种独立配制品具有不同量的所述活性成分。应当进一步理解,本文所述的组合产品以及术语“非固定组合”涵盖活性成分(包括本文所述的化合物),其中所述组合伴侣以完全分开、也独立于彼此销售的药物剂型或药物配制品施用。在包装(如传单等)或提供给医师和/或医务人员的其他信息中提供或可能提供使用所述非固定组合的使用说明。然后可以同时或按时间顺序交错施用所述独立配制品或所述配制品、产品或组合物的各部分,即套装试剂盒的各个部分可以分别在不同的时间点施用和/或套装试剂盒的任何部分以相同或不同的时间间隔施用。特别地,所选择的给药时间间隔使得组合使用所述部分对所治疗的疾病的效果大于/超过单独使用具有式(i)的化合物所获得的效果;因此,本文所述药物组合中使用的化合物具有联合活性。可以改变或调节具有式(i)的化合物的总量与要作为药物组合施用的第二种药剂的比率,以便更好地满足要治疗的特定患者亚群的需要或单个患者的需要,这些需要可能是由于,例如患者的年龄、性别、体重等。
[0029]
如本文所用,术语“共同施用”或“组合施用”等意在涵盖将本文所述的一种或多种化合物与所选择的组合伴侣一起施用于对其有需要的单个受试者(例如患者或受试者),并且旨在包括其中所述化合物不一定通过相同的施用途径施用和/或同时施用的治疗方案。
[0030]
术语“药物组合物”在本文中被定义为是指含有至少一种待施用于温血动物(例如哺乳动物或人)的活性成分或治疗剂的混合物(例如溶液或乳液),以预防或治疗影响所述温血动物的特定疾病或病症。
[0031]
本披露的术语“治疗有效量”的化合物(即,具有式(i)的化合物或其药学上可接受的盐)是指本披露的化合物会引起受试者(受试患者)的生物学或医学反应,例如,受试者(受试患者)酶或蛋白质活性的降低或抑制,或改善症状,缓解病症,减慢或延缓疾病进展或预防疾病等的量。化合物、药物组合物或其组合的治疗有效剂量取决于所述患者的物种、体重、年龄、性别和个体状况,所治疗的障碍或疾病或其严重性。具有普通技能的医师、临床医生或兽医可以容易地确定预防、治疗障碍或疾病或抑制所述障碍或疾病的进展所必需的每种活性成分的有效量。
[0032]
剂量的频率可以根据所使用的化合物和待治疗或预防的具体病症而变化。通常,使用足以提供有效疗法的最小剂量是优选的。通常可以使用适合于正在治疗或预防的病症的测定来监测患者的治疗有效性,所述测定将是本领域普通技术人员所熟悉的。
[0033]
如本文所用,术语“载体”或“药学上可接受的载体”包括任何及所有溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如抗细菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、黏合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料等及其组合,如本领域技术人员可了解的(参见例如,remington'spharmaceutical sciences[雷明顿氏药物科学],第18版,mack printing company[马克出版公司],1990,第1289
‑
1329页)。除非任何常规载体与活性成分不相容,否则考虑将其用于治疗或药物组合物中。
[0034]
如本文所用,术语“受试者”是指动物。典型地,所述动物是哺乳动物。受试者还指例如灵长类动物(例如人,男性或女性)、牛、绵羊、山羊、马、狗、猫、兔、大鼠、小鼠、鱼、鸟等。在某些实施例中,受试者是灵长类动物。在优选的实施例中,该受试者是人。当指人时,术语“受试者”与“患者”可互换使用。
[0035]
如本文所用,如果受试者将在生物学上、在医学上或在生活质量上从治疗中获益,则所述受试者是“需要”这种治疗的。
[0036]
如本文所用,短语“患者群体”用于意指一组患者。
[0037]
术语“包含”涵盖“包括”以及“由
……
组成”,例如,“包含”x的组合物可以仅由x组成或可以包括其他物质,例如x y。
[0038]
与数值x相关的术语“约”意指例如 /
‑
10%。当在数值范围或数字列表前使用时,术语“约”适用于系列中的每个数字,例如,短语“约1
‑
5”应被解释为“约1
‑
约5”,或例如,短语“约1、2、3、4”应被解释为“约1、约2、约3、约4等”。
[0039]
术语“治疗(treatment或treat)”在本文中被定义为将根据本披露的化合物(具有式(i)的化合物,或其药学上可接受的盐,或包含所述化合物的药物组合物)应用或施用于受试者或来自受试者的分离的组织或细胞系,其中所述受试者患有特定的疾病(例如sjs),具有与所述疾病(例如sjs)相关的症状或向所述疾病(例如sjs)发展的倾向(如果适用),其中治疗的目的是治愈(如果适用)所述疾病,延迟所述疾病的发作,降低其严重性,减缓、改善疾病的一种或多种症状,改善所述疾病,减少或改善任何与疾病相关的症状或向疾病发展的倾向。术语“治疗”包括治疗怀疑患有疾病的患者以及患病或已诊断患有疾病或医学病症的患者,并且包括抑制临床复发。
[0040]
如本文所用,关于患者的“选择(selecting)”和“被选(selected)”用于意指基于(由于)具有预定标准的特定患者,特定患者是从更大的患者组中特别选择的。类似地,“选择性治疗”是指向患有特定疾病的患者提供治疗,其中所述患者是基于具有预定标准的特
定患者从较大的患者组中特别选择的。类似地,“选择性施用”是指向患者施用药物,所述患者是基于(由于)具有预定标准的特定患者向从较大的患者组中特别选择的。通过“选择”、“选择性治疗”和“选择性施用”,意味着基于患者的个人病史(例如,先前的治疗干预,例如先前用生物制剂治疗),生物学特征(例如,特定的遗传标记),和/或表现(例如,不满足特定的诊断标准)向患者递送个性化疗法,而不是仅仅基于患者在较大组中的成员资格而递送标准治疗方案。参考如本文所用的治疗方法,选择不是指对具有特定标准的患者的偶然治疗,而是指基于具有特定标准的患者对患者进行治疗的有意选择。因此,选择性治疗/施用不同于标准治疗/施用,标准治疗/施用向具有特定疾病的所有患者递送特定药物,而不考虑这些患者的个人病史、疾病表现和/或生物学特征。在一些实施例中,基于患有sjs选择患者进行治疗。
[0041]
具体实施方式:
[0042]
舍格伦综合征和根据本发明的治疗的有效性
[0043]
所披露的btk抑制剂,即具有式(i)的化合物,或其药学上可接受的盐,可以在体外、离体使用,或掺入药物组合物中并在体内施用以治疗sjs患者(例如人类患者)。
[0044]
可以使用各种已知的方法和工具评估舍格伦综合征治疗的有效性,这些方法和工具可测量舍格伦综合征的状态和/或舍格伦综合征的临床反应。一些实例包括,例如,eular舍格伦综合征疾病活动指数(essdai)、医师全面评估量表(phga)、eular舍格伦综合征患者报告指数(esspri)、慢性病治疗功能评估
‑
疲劳量表(facit
‑
疲劳)和eq5d。
[0045]
疗效
[0046]
与主要和次要目标相关的临床功效测量如下概述。
[0047]
eular舍格伦综合征疾病活动指数(essdai)
[0048]
essdai是针对舍格伦综合征的经过验证的疾病结果量度,且被应用于研究受试者(seror r等人(2015)validation of eular primarysyndrome disease activity(essdai)and patient indexes(esspri)[eular原发性舍格伦综合征疾病活动(essdai)和患者指数(esspri)的验证].ann.rheum.dis.[风湿性疾病年鉴]第859
‑
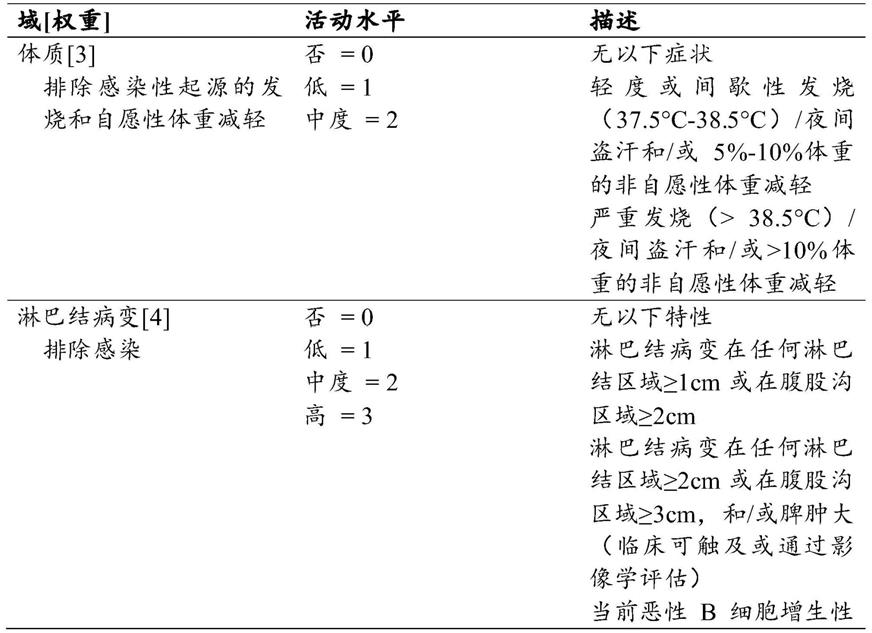
66页)。所述仪器包含有助于疾病活动的12个器官特异性域。对于每个域,根据其严重程度将疾病活动的特性按3或4个水平评分。然后将这些评分以加权方式在12个域中求和,以提供总评分。所述域(权重)如下:体质(3)、淋巴结病变(4)、腺体(2)、关节(2)、皮肤(3)、肺(5)、肾(5)、肌肉(6)、pns(5)、cns(5)、血液学(2)和生物学(1)。最高可能评分为123。
[0049]
在我们的研究中,要计算essdai,必须在每个安排的时间点(从筛选访视到研究结束)单独评估所有12个器官域。将域评估输入到表(由中心供应商提供)中,并通过软件计算essdai评分。
[0050]
对于未在方案中列为强制性测试,但可能需要用来估计essdai的评估,包括放射线照相、高分辨率计算机断层扫描(hrct)、肺功能测试(dlco,fvc)、估计的肾小球滤过率(egfr)、肌电图(emg)、肌肉(或任何其他)活检,由研究人员决定是否根据所述患者的体征和症状进行评估,以提供正确的essdai读数。表1中总结了eular舍格伦综合征疾病指数(essdai)、域和条目定义以及权重:
[0051]
[0052]
[0053]
[0054]
[0055]
[0056][0057]
医师全面评估量表(phga)
[0058]
研究人员使用医师全面评估量表通过100mm vas对患者的疾病活动度从“无疾病活动”(0)到“最大疾病活动”(100)范围进行评级。
[0059]
为了增强客观性,医师在对特定患者进行自己的评估时,不得知道所述特定患者报告的结果评估。因此,必须在查看对所述患者疾病总体活动度评分的全面评估之前进行评估。
[0060]
eular舍格伦综合征患者报告指数(esspri)
[0061]
esspri是针对舍格伦综合征的既定疾病结果量度(seror r等人(2011)eularsyndrome patient reported index(esspri):development of a consensus patient index for primarysyndrome[eular舍格伦综合征患者报告指数(esspri):原发性舍格伦综合征患者共识指数的建立].ann.rheum.dis.[风湿性疾病年鉴]第968
‑
72页)。它由干燥、疼痛和疲劳三个域组成。针对三个域中的每个域,受试者可以以单一的0
‑
10数字量表评估他们所经历的症状的严重程度。esspri评分定义为来自三个量表的评分的平均值:(干燥 疼痛 疲劳)/3。
[0062]
facit
‑
疲劳
[0063]
慢性病治疗功能评估
‑
疲劳量表(facit
‑
f v4)是一个简短的、易于操作的13项目工具,可用来测量个体在过去一周的日常活动中的疲劳程度。疲劳程度以5分李克特量表(0=一点都不,1=一点,2=稍微,3=相当,4=非常)进行测量(webster k等人(2003)the functional assessment of chronic illness therapy(facit)measurement system:properties,applications,and interpretation[慢性病治疗功能评估(facit)测量体系:
性质、应用与解释].health qual life outcomes[健康和生活质量结果]第79页)。
[0064]
eq5d
[0065]
eq
‑
5d是测量健康相关生活质量的标准化工具。
[0066]
eq
‑
5d由描述体系和eq vas量表组成。
[0067]
描述体系包括五个维度:行动能力、自我照顾能力、日常活动、疼痛/不适和焦虑/抑郁。可以将其用作反映患者自己判断的健康结果的定量量度。这五个维度上的评分可以呈现为健康状况,也可以转换为反映与其他健康状况相比具有优选性的单个汇总指数数字(效用)。
[0068]
eq vas在垂直视觉模拟量表上记录患者的自我评估健康状况,其中0代表
‘
最糟糕的可想象健康状态’,而100代表
‘
最佳的可想象健康状态’。
[0069]
功效评估的适当性
[0070]
这项研究中的功效量度主要基于测量器官特异性疾病标准的essdai(eular ss疾病活动指数),以及测量患者主观疾病影响的esspri(欧洲抗风湿病联盟[eular]舍格伦综合征[ss]患者报告指数)。这两种工具均被广泛接受和验证,分别是sjs的全身和症状表现的金标准量度。essdai是全身性疾病活动指数,在12个差异化加权域(生物学、血液学、关节、腺体、皮肤、体质、淋巴结病变、肾脏、肺、pns、cns和肌肉)中的每一个域中,将疾病活动度分为3
‑
4个水平。综合加权评分提供了对疾病活动度的准确评估,并且对变化具有良好的敏感性,正如已在多个群组研究中所验证的(seror r等人(2015)validation of eular primarysyndrome disease activity(essdai)and patient indexes(esspri)[eular原发性舍格伦综合征疾病活动度(essdai)和患者指数(esspri)的验证].ann.rheum.dis.[风湿性疾病年鉴]第859
‑
66页)。另一方面,所述esspri工具是患者报告的前2周期间以0
‑
10视觉模拟量表评价的干燥、肢体疼痛和疲劳症状的综合评分(seror r等人(2011)eular
′
ssyndrome patient reported index(esspri):development of a consensus patient index for primarysyndrome[eular舍格伦综合征患者报告指数(esspri):原发性舍格伦综合征患者共识指数的建立].ann.rheum.dis.[风湿性疾病年鉴]第968
‑
72页)。患者报告的评分对疾病活动度变化的敏感性较差,而据报道,在可用的工具中,esspri具有显著更佳的敏感性。最近的一项前瞻性研究报告,全身评分与患者评分之间的相关性较差,这表明这两个指数评价了疾病活动度的互补成分,因此强调了评价两个参数以准确评估疾病活动度及其变化的重要性(seror r等人(2015)validation of eular primarysyndrome disease activity(essdai)and patient indexes(esspri)[eular原发性舍格伦综合征疾病活动度(essdai)和患者指数(esspri)的验证].ann.rheum.dis.[风湿性疾病年鉴]第859
‑
66页)。
[0071]
药物组合物
[0072]
当与药学上可接受的载体组合时,btk抑制剂,即具有式(i)的化合物,或其药学上可接受的盐,可以用作药物组合物。除了具有式(i)的化合物外,这种组合物还可以包含载体、各种稀释剂、填充剂、盐、缓冲剂、稳定剂、增溶剂和本领域已知的其他材料。所述载体的特征取决于施用途径。用于在所披露的方法中使用的药物组合物还可以含有用于治疗特定靶向障碍的其他治疗剂。例如,药物组合物还可以包括抗炎剂或止痒剂。这样的另外的因子
和/或药剂可包括在药物组合物中以与本文描述的具有式(i)的化合物产生协同效应,或最小化由本文描述的具有式(i)的化合物引起的副作用。在优选的实施例中,用于所披露的方法的药物组合物包含剂量为10mg、20mg、25mg、50mg或约100mg的具有式(i)的化合物。
[0073]
用于经口施用的合适的组合物包括有效量的呈片剂、锭剂、水性或油性悬浮液、可分散的粉末或颗粒、乳液、硬或软胶囊、或糖浆或酏剂形式的本发明的化合物。旨在用于经口用途的组合物是根据本领域中已知用于制造药物组合物的任何方法制备且此类组合物可含有选自由以下组成的组的一种或多种药剂:甜味剂、调味剂、着色剂和防腐剂,以提供药学上精致且可口的制剂。片剂可以含有与适用于制造片剂的非毒性、药学上可接受的赋形剂混合的活性成分。这些赋形剂是(例如)惰性稀释剂,如碳酸钙、碳酸钠、乳糖、磷酸钙或磷酸钠;制粒剂及崩解剂,例如,玉米淀粉或海藻酸;粘合剂,例如,淀粉、明胶或阿拉伯胶;以及润滑剂,例如硬脂酸镁、硬脂酸或滑石粉。所述片剂是未包衣的,或者通过已知技术进行包衣以延迟在胃肠道中的崩解和吸收,从而在较长的时间段内提供持久的作用。例如,可以采用时间延迟材料,如甘油单硬脂酸酯或甘油二硬脂酸酯。用于口服用途的配制品可以呈现为硬明胶胶囊,其中活性成分是与惰性固体稀释剂(例如,碳酸钙、磷酸钙或高岭土)混合,或呈现为软明胶胶囊,其中活性成分是与水或油介质(例如,花生油、液体石蜡或橄榄油)混合。
[0074]
用于在所披露的方法中使用的药物组合物可以按常规方式制备。在一个实施例中,所述药物组合物提供用于口服施用。例如,所述药物组合物是包含活性成分及以下项的片剂或明胶胶囊:
[0075]
a)稀释剂,例如乳糖、右旋糖、蔗糖、甘露糖醇、山梨糖醇、纤维素和/或甘氨酸;
[0076]
b)润滑剂,例如二氧化硅、滑石、硬酯酸、其镁盐或钙盐和/或聚乙二醇;就片剂而言还包含
[0077]
c)粘结剂,例如硅酸镁铝、淀粉糊、明胶、黄芪胶、甲基纤维素、羧甲基纤维素钠和/或聚乙烯基吡咯烷酮;如果希望
[0078]
d)崩解剂,例如淀粉、琼脂、海藻酸或其钠盐,或泡腾混合物;和/或
[0079]
e)吸附剂、着色剂、风味剂和甜味剂。
[0080]
片剂可以根据本领域已知的方法进行薄膜包衣或肠溶包衣。
[0081]
组合:
[0082]
在实践本披露的一些治疗方法或用途中,将治疗有效量的具有式(i)的化合物或其药学上可接受的盐施用于患者,例如哺乳动物(例如人)。虽然可以理解,所披露的方法使用具有式(i)的化合物或其药学上可接受的盐提供了对舍格伦综合征患者的治疗,但是该疗法不一定是单一疗法。实际上,如果选择患者用具有式(i)的化合物治疗,则所述具有式(i)的化合物或其药学上可接受盐可以根据本披露的方法单独或与用于治疗舍格伦综合征患者的其他药剂和疗法组合施用,例如与至少一种另外的舍格伦综合征药剂组合施用。当与一种或多种另外的sjs药剂共同施用时,具有式(i)的化合物或其药学上可接受的盐可以与其他药剂同时施用或顺序施用。如果顺序施用,则主治医师决定将具有式(i)的化合物或其药学上可接受盐与其他药剂组合施用的适当顺序和用于共同递送的适当剂量。
[0083]
在治疗sjs期间,各种疗法可以与所披露的具有式(i)的化合物或其药学上可接受盐有益地组合。此类疗法包括类固醇(皮质类固醇,如泼尼松或等效物);dmards,例如羟氯
喹(plaquenil)、甲氨蝶呤(trexall)、柳氮磺吡啶(azulfidine)、米诺环素(minocin)或来氟米特(arava));或b细胞耗竭药物,如利妥昔单抗。
[0084]
技术人员将能够辨别与所披露的具有式(i)的化合物或其药学上可接受的盐共同递送的上述sjs药剂的合适剂量。
[0085]
本发明的试剂盒
[0086]
本披露还涵盖用于治疗sjs的试剂盒。这种试剂盒包含btk抑制剂,例如n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药物组合物。另外,此类试剂盒可包含使用说明书。
[0087]
在一个实施例中,所述试剂盒包含两种或更多种单独的药物组合物,其中至少一种包含具有式(i)的化合物或其药学上可接受的盐。在一个实施例中,药盒包含用于分开保留所述组合物的装置,如容器、分开的瓶子、或分开的箔包。这种药盒的实例是泡罩包装,如典型地用于包装片剂、胶囊剂等。
[0088]
本发明药盒可以用于施用不同剂型(例如,口服和肠胃外),用于以不同剂量间隔施用分开的组合物或用于相对彼此滴定单独组合物。为了有助于顺应性,本发明药盒典型地包含施用说明书。
[0089]
在本发明的组合疗法中,所述具有式(i)的化合物或其药学上可接受的盐和另一种sjs药剂(如本文所定义)可以由相同或不同的制造商生产和/或配制。此外,所述具有式(i)的化合物或其药学上可接受的盐和另一种sjs药剂可合并到组合疗法中:(i)在向医师发放所述组合产品(例如,在包含具有式(i)的化合物或其药学上可接受的盐和另一种sjs药剂的试剂盒的情况下)之前进行;(ii)在施用前不久由医师本人(或在医师指导下)进行;(iii)在患者本身中,例如在顺序施用具有式(i)的化合物或其药学上可接受的盐和其他sjs药剂的过程中。
[0090]
其他实施例
[0091]
将具有式(i)的化合物或其药学上可接受的盐以每天约10mg至约200mg的剂量方便地施用于患者(优选地口服施用)。
[0092]
将具有式(i)的化合物或其药学上可接受的盐以每天约10mg至约200mg的日剂量方便地施用于患者(优选地口服施用)。
[0093]
在一些实施例中,将所述具有式(i)的化合物或其药学上可接受的盐以约10mg至约100mg的日剂量施用。
[0094]
在其他实施例中,将所述具有式(i)的化合物或其药学上可接受的盐以约100mg的日剂量施用。
[0095]
在其他实施例中,将所述具有式(i)的化合物或其药学上可接受的盐以约50mg的日剂量施用。
[0096]
在其他实施例中,将所述具有式(i)的化合物或其药学上可接受的盐以约35mg的日剂量施用。
[0097]
在其他实施例中,将所述具有式(i)的化合物或其药学上可接受的盐以约25mg的日剂量施用。
[0098]
在其他实施例中,将所述具有式(i)的化合物或其药学上可接受的盐以约20mg的日剂量施用。
[0099]
在一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约10mg、约35mg、约50mg或约100mg的剂量每天施用一次。
[0100]
在另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约10mg、约25mg、约50mg或约100mg的剂量每天施用两次。
[0101]
应当理解,某些患者可能需要剂量递增,例如展示出反应不足的舍格伦综合征患者(例如,如通过本文披露的任何舍格伦综合征评分系统所测量的。还应理解,某些患者,例如对具有式(i)的化合物或其药学上可接受的盐治疗展示出不良事件或不良反应的舍格伦综合征患者,也可能需要降低剂量。因此,具有式(i)的化合物或其药学上可接受的盐的剂量可以小于约10mg、约20mg、约25mg、约50mg或约100mg。
[0102]
给药时间通常从具有式(i)的化合物或其药学上可接受的盐的第一个剂量的当天(也称为“基线”)起测量。给药时间通常从具有式(i)的化合物或其药学上可接受的盐的第一个剂量的当天(也称为“基线”)起测量。
[0103]
但是,医疗保健提供者通常使用不同的命名约定来确定给药时间表。为了澄清,如本文所披露的,给药的第一天称为第1天。然而,本领域技术人员将理解,所述命名规则仅为统一使用并且不应被解释为限制性的,即,每日给药是提供每日剂量的具有式(i)的化合物或其药学上可接受盐,且医师可将特定的一天称为“第0天”或“第1天”。
[0104]
本文披露了治疗舍格伦综合征(sjs)的方法,所述方法包括向有需要的患者施用具有式(i)的化合物或其药学上可接受的盐,其中所述剂量为约10mg至约200mg。
[0105]
本文还披露了治疗舍格伦综合征(sjs)的方法,所述方法包括向有需要的患者施用具有式(i)的化合物或其药学上可接受的盐,其中所述日剂量为约10mg至约200mg。
[0106]
本文还披露了用于治疗sjs的具有式(i)的化合物或其药学上可接受的盐,其中所述化合物的日剂量为约10mg
‑
约200mg。
[0107]
在所披露的方法、用途和试剂盒的一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约10mg至约100mg的日剂量施用。
[0108]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约10mg、约20mg、约25mg、约35mg、约50mg、约100mg或约200mg的日剂量施用。
[0109]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约100mg的日剂量施用。
[0110]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约50mg的日剂量施用。
[0111]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约35mg的日剂量施用。
[0112]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约25mg的日剂量施用。
[0113]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约20mg的日剂量施用。
[0114]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约10mg、约35mg、约50mg或约100mg的剂量每天施用一次。
[0115]
在所披露的方法、用途和试剂盒的另一个实施例中,将具有式(i)的化合物或其药学上可接受的盐以约10mg、约25mg、约50mg或约100mg的剂量每天施用两次。
[0116]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者患有中度至重度sjs。患有中度至重度sjs的患者定义为在用具有式(i)的化合物或其药学上可接受的盐治疗之前,其来自8个定义的域(生物学、血液学、关节、皮肤、腺体、淋巴结病变、肾脏、体质)的essdai评分(基于表1所示的加权评分)≥5(即至少5分)并且esspri评分为至少5分。
[0117]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者是成年人。
[0118]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现患者和/或医师报告的结果(即,esspri、facit
‑
f、eq
‑
5d、phga)中的至少一个与基线相比发生变化。
[0119]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现esspri评分与基线相比发生变化。
[0120]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现esspri评分下降。
[0121]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现esspri评分下降至少一分,优选地至少2分。
[0122]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现esspri评分下降。在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现esspri评分下降至少15%、至少25%、至少35%、至少50%或至少60%。所述esspri评分的下降如下计算:
[0123][0124]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现essdai评分下降。
[0125]
在所披露的方法、用途和试剂盒的又另一个实施例中,所述患者在治疗的第12周或第24周实现essdai评分下降至少3分。
[0126]
在所披露的方法、用途和试剂盒的另一个实施例中,所述患者在治疗的第12周或第24周实现essdai评分与基线相比发生变化。
[0127]
在所披露的方法、用途和试剂盒的优选的实施例中,患者是成年人。在所披露的方法、用途和试剂盒的一些实施例中,患者是青少年。
[0128]
进一步列举的实施例
[0129]
1.一种治疗舍格伦综合征(sjs)的方法,所述方法包括向有需要的受试者施用约10mg至约200mg日剂量的n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐。
[0130]
2.根据实施例1所述的方法,其中n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐的日剂量为约10mg至约100mg。
[0131]
3.根据实施例1所述的方法,其中n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧
基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐的日剂量为约100mg。
[0132]
4.根据实施例1所述的方法,其中n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐的日剂量为约50mg。
[0133]
5.根据实施例1所述的方法,其中n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐的日剂量为约35mg。
[0134]
5.根据实施例1所述的方法,其中n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐的日剂量为约25mg。
[0135]
7.根据实施例1所述的方法,其中n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐的日剂量为约20mg。
[0136]
8.根据实施例1所述的方法,其中将n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐以约10mg、约35mg、约50mg或约100mg的剂量每天施用一次。
[0137]
9.根据实施例1所述的方法,其中将n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐以约10mg、约25mg、约50mg或约100mg的剂量每天施用两次。
[0138]
10.根据上述实施例中任一项所述的方法,其中所述受试者患有中度至重度sjs。
[0139]
11.根据实施例1
‑
10中任一项所述的方法,其中根据以下标准中的至少一项来选择所述受试者:
[0140]
a)在用具有式(i)的化合物或其药学上可接受的盐治疗之前,所述受试者的esspri评分≥5;
[0141]
b)在用具有式(i)的化合物或其药学上可接受的盐治疗之前,所述受试者的来自生物学、血液学、关节、皮肤、腺体、淋巴结病变、肾脏和体质的8个特定域的基于加权评分的essdai≥5。
[0142]
12.根据上述实施例中任一项所述的方法,其中所述受试者是成年人。
[0143]
13.根据前述实施例中任一项所述的方法,其中所述受试者在治疗的第12周或第24周实现以下至少一项:
[0144]
a)所述esspri评分的下降;和/或
[0145]
b)所述essdai评分的下降。
[0146]
14.根据上述实施例中任一项所述的方法,其中所述受试者在所述治疗完成后第5周实现如通过esspri或essdai所测量的持续反应。
[0147]
15.根据上述实施例中任一项所述的方法,其中将n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐配置于药物配制品中,其中所述药物配制品进一步包含药学上可接受的载体。
[0148]
16.根据实施例1
‑
15中任一项所述的方法,其中n
‑
(3
‑
(6
‑
氨基
‑5‑
(2
‑
(n
‑
甲基丙烯
酰胺基)乙氧基)嘧啶
‑4‑
基)
‑5‑
氟
‑2‑
甲基苯基)
‑4‑
环丙基
‑2‑
氟苯甲酰胺或其药学上可接受的盐的t
max
为约0.5
‑
3小时。
[0149]
本披露的一个或多个实施例的细节陈述于上文所附的说明书中。现在描述优选方法和材料,但类似或等效于本文所述的任何方法和材料也可以用于本披露的实践或测试。根据说明书并且根据权利要求书,本披露的其他特征、目标和优点将是清楚的。在本说明书和随附权利要求书中,单数形式包括复数指代物,除非上下文另外明确地说明。除非另外定义,否则本文所用的全部技术和科学术语具有与本披露所属领域的普通技术人员通常所理解的相同的意义。在本说明书中引证的所有专利以及公开文件通过引用并入。提供以下实例以便更充分地说明本披露的优选实施例。这些实例决不应被解释为限制如由所附权利要求书限定的披露的主题的范围。
[0150]
缩写
[0151]
ae
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
不良事件
[0152]
auc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
曲线下面积
[0153]
aucinf
ꢀꢀꢀꢀꢀꢀ
从时间零点到无穷远的血浆(或血清或血液)浓度
‑
时间曲线下的面积(质量x时间/体积)
[0154][0155]
auclast
ꢀꢀꢀꢀꢀ
从时间零点到最后可量化浓度的时间的血浆(或血清或血液)浓度
‑
时间曲线下的面积(质量x时间/体积)
[0156][0157]
aucτ
ꢀꢀꢀꢀꢀꢀꢀꢀ
从时间零点到给药间隔τ结束时的血浆(或血清或血液)浓度
‑
时间曲线下的面积(质量x时间/体积)
[0158][0159]
bcr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
b细胞受体
[0160]
bid或b.i.d. 每天两次(拉丁语:“bis in die”)
[0161]
bmi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
体质指数
[0162]
btk
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
布鲁顿酪氨酸激酶
[0163]
cbc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
全血细胞计数
[0164]
cm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
厘米
[0165]
cl/f
ꢀꢀꢀꢀꢀꢀꢀꢀ
血浆(或血清或血液)的表观系统性(或全身)清除率(质量/体积)
[0166][0167]
cns
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
中枢神经系统
[0168]
cv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
变异系数
[0169]
dmard
ꢀꢀꢀꢀꢀꢀꢀ
改善疾病的抗风湿药
[0170]
ecg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
心电图
[0171]
egfr
ꢀꢀꢀꢀꢀꢀꢀꢀ
估计肾小球滤过率
[0172]
elisa
ꢀꢀꢀꢀꢀꢀꢀ
酶联免疫吸附测定
[0173]
emg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
肌电图
[0174]
eq
‑
5d
ꢀꢀꢀꢀꢀꢀꢀ
euroqual 5维度(用于测量与健康相关的生活质量的标准工具)
[0175][0176]
essdai
ꢀꢀꢀꢀꢀꢀ
eular舍格伦综合征疾病活动指数
[0177]
esspri
ꢀꢀꢀꢀꢀꢀ
eular舍格伦综合征患者报告指数
[0178]
eular
ꢀꢀꢀꢀꢀꢀꢀ
欧洲抗风湿病联盟
[0179]
facit
‑
f
ꢀꢀꢀꢀꢀ
慢性病治疗功能评估
‑
疲劳
[0180]
fih
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
首次人体
[0181]
h
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时
[0182]
hrct
ꢀꢀꢀꢀꢀꢀꢀꢀ
高分辨率计算机断层扫描
[0183]
i.v.
ꢀꢀꢀꢀꢀꢀꢀꢀ
静脉内
[0184]
ia
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
期中分析
[0185]
inr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
国际标准化比率
[0186]
kg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
千克
[0187]
lc
‑
ms/ms
ꢀꢀꢀꢀ
液相色谱/质谱
‑
质谱
[0188]
mab
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
单克隆抗体
[0189]
mcp
‑
mod
ꢀꢀꢀꢀꢀ
多重比较程序
‑
建模
[0190]
mmrm
ꢀꢀꢀꢀꢀꢀꢀꢀ
混合效应模型重复测量
[0191]
mrt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
平均滞留时间
[0192]
noac
ꢀꢀꢀꢀꢀꢀꢀꢀ
新型口服抗凝剂
[0193]
nsaid
ꢀꢀꢀꢀꢀꢀꢀ
非甾体类抗炎药
[0194]
pd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
药效动力学
[0195]
phga
ꢀꢀꢀꢀꢀꢀꢀꢀ
医师全面评估量表
[0196]
pk
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
药代动力学
[0197]
pns
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
周围神经系统
[0198]
pt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
凝血酶原时间
[0199]
ptt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
部分凝血活酶时间
[0200]
qd或q.d.
ꢀꢀꢀꢀ
每日一次(拉丁语“quaque die”)
[0201]
qtcf
ꢀꢀꢀꢀꢀꢀꢀꢀ
通过fridericia公式校正的qt间隔
[0202]
racc
ꢀꢀꢀꢀꢀꢀꢀꢀ
药物累积率
[0203]
sae
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
严重不良事件
[0204]
sjs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
舍格伦综合征
[0205]
som
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
现场操作手册
[0206]
spt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
皮肤针刺试验
[0207]
ss
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
安全性集
[0208]
tec
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
酪氨酸蛋白激酶
[0209]
vz/f
ꢀꢀꢀꢀꢀꢀꢀꢀ
施用后在终末消除阶段的表观分布体积(体积)
[0210]
实例1:临床前研究
[0211]
实例1a:btk占有率和临床前pk/pd关系
[0212]
不可逆btk抑制剂像化合物(i)的体内pd效应取决于所述抑制剂对btk的共价占有的程度和持续时间。在离体免疫测定中测量用具有式(i)的化合物(也称为化合物(i))治疗
后的btk占有率。在体外用共价生物素化的btk探针孵育后测定未占有的btk蛋白质的比例,因为化合物(i)和探针以互斥的方式与btk结合。在选定组织的裂解物中测定未占有的btk以及总的btk相对蛋白水平,并将未占有的btk的水平归一化为同一样品中的总btk蛋白质水平。
[0213]
在雌性大鼠中,单个口服剂量3mg/kg的化合物(i)会导致脾脏btk的完全占有,而1mg/kg的剂量会导致76%
‑
81%的占有率,而0.3mg/kg的单剂量后仅达到30%的部分占有率。血液中btk的占有率达到与脾脏中观察到的一致的水平。根据实验数据,很明显,在1
‑
3mg/kg的低口服剂量下化合物(i)的短暂全身性暴露足以在多个组织中实现btk的完全占有。1mg/kg剂量后,化合物(i)的血液暴露在给药后0.5小时达到49.1nm,在给药后5小时达到5.6nm。这种极低且短暂的全身性暴露与不可逆抑制剂典型的pk/pd模型一致。
[0214]
在化合物(i)的单个口服剂量后确定大鼠和小鼠中脾脏、血液、淋巴结和肺脏的btk占有的持续时间。在大鼠中,血液中的btk占有的半衰期较长,约为87小时。大鼠脾脏中估计的btk占有半衰期明显短于血液中,仅约5小时。不同的周转率可能反映了这样的事实,即与脾脏相比,外周血中表达btk的b细胞和单核细胞处于静止状态,并且在代谢上相对不活跃。以前已有报道在血液中更长的btk占有持续时间(advani等人2013,j clin onc[临床肿瘤学杂志];31(1):88
‑
94)。分析的所有其他组织(肺和淋巴结)显示出与脾脏相似的btk周转率和占有半衰期。
[0215]
由于皮肤中表达btk的细胞水平太低而无法进行占有率测量,因此在肥大细胞fcγriii介导的炎症的逆转被动阿尔图斯(rpa)模型中评估了单剂量后皮肤中pd效应的持续时间。在该模型中,在引起阿瑟氏反应之前2小时给药化合物(i)时,皮肤肿胀的抑制作用最大。在化合物(i)给药后45小时或更晚触发阿瑟氏反应时,该作用逐渐减弱并达到基线。这表明皮肤中的btk占有显示出与如脾脏、肺部和淋巴结相似的时间过程。
[0216]
在这些临床前药理学研究中,btk占有率和各自的药理学读数显示出很强的相关性。因此,btk占有率是适合用于临床研究的pd生物标记物,并且因此被用于1期临床研究。
[0217]
实例2:1期临床试验
[0218]
进行了首次人体研究,以评估在健康志愿者和特应性体质志愿者中每天一次(qd)或每天两次(bid)口服施用单个或多个剂量化合物(i)的安全性和耐受性、药代动力学(pk)和药效动力学(pd),以支持化合物(i)在自身免疫性疾病中的进一步临床开发。这项研究还探讨了食物摄入的效应。
[0219]
在多达168名健康志愿者(hv)中进行的首次人体研究,其中64名(在第2部分和第4部分中)具有无症状的特应性体质。
[0220]
·
第1部分是10个群组的双盲(对受试者和研究者设盲,对申办方不设盲)、安慰剂对照的单个递增剂量(sad)递增研究(n=80)
[0221]
·
第2部分是双盲(对受试者和研究者设盲,对申办方不设盲)、安慰剂对照的多个递增剂量(mad)(12天共13剂)研究,在6个群组的无症状特应性体质的健康志愿者中采用每天给药一次(n=48)
[0222]
·
第3部分是在12个hv中的单剂量开放标签交叉食物效应研究
[0223]
·
第4部分是双盲(对受试者和研究者设盲,对申办方不设盲)、安慰剂对照的多剂量(12天25剂)研究,在2个群组的无症状特应性体质的健康志愿者中采用每天给药两次(n
=16)
[0224]
sad部分(第1部分)具有十个剂量水平,且mad部分(第2部分和第4部分)由八个剂量水平组成(第2部分中6个群组使用每日一次给药,第4部分中2个群组使用每日两次给药)。将八名受试者随机分到各群组,在sad和mad部分中分别比率以6:2(活性:安慰剂)接受化合物(i)或匹配的安慰剂。在开始研究的mad部分之前,应评价sad部分中最高约4倍于估计药理活性剂量(pad)的剂量,前提是在此之前sad部分没有出现安全性信号。第2部分(mad qd方案)和第4部分(多剂量bid方案)中使用的化合物(i)的每日总剂量未超过所探讨的最高sad剂量水平。此外,第4部分的日总剂量不超过第2部分的日总剂量。
[0225]
在第1部分(sad)中,首次施用的哨兵给药按如下所述的每个剂量水平进行。前两个受试者在第一天给药(一人用活性药物,一人用安慰剂)。在48小时的观察期后,对所述群组的其余6名受试者(5名使用活性药物,1名使用安慰剂)进行了给药。
[0226]
所有研究部分均使用标准安全性监测。包括了对潜在的皮肤擦伤事件的专门评估。最后一次给药后长达96小时内的所有生命体征、体格检查和受试者病史、ecg、不良事件和实验室安全性参数(血液化学、血液学和尿液分析)以及最后一次给药后的48小时内的先前剂量组(如果有)的pk数据,应以盲法在剂量递增之前对每个群组进行审查。在完成每个剂量水平后,提供了报告的不良事件、临床安全性实验室参数、qtc和心率的汇总安全性报告。
[0227]
在第1、第2和第4部分中,每个受试者都参加了28天的筛选期(第
‑
29到
‑
2天)、基线期、治疗期和包括研究结束评价的随访期。
[0228]
在第1部分中,受试者在第
‑
2天或第
‑
1天进入研究中心进行基线安全性评估并确认资格。符合条件的受试者在第1天的禁食条件下接受了单剂量的化合物(i)或安慰剂。他们从第
‑
1天到第5天早上(最后一次药物施用后96小时)在指定地点居住。
[0229]
在第2部分和第4部分中,受试者在第
‑
2或
‑
1天入院接受基线安全性评估并确认资格。符合资格的受试者在第1天的禁食条件下接受了第一剂化合物(i),并在禁食条件下继续服用研究药物直至第12天(包括第12天)。受试者从第
‑
2或
‑
1天开始直到第16天早上(等于接受最后一剂化合物(i)后96小时)在指定地点居住。在第2部分和第4部分中,分别每天一次和每天两次给予所述研究药物(详细信息可在评估时间表中找到)。
[0230]
第3部分是开放标签、随机、双向交叉、单剂量研究,用于评估食物效应。在第3部分中,每位受试者参加了28天的筛选期(
‑
29至
‑
2天)、2个基线期(第
‑
1天)和2个治疗期,各自由第1天单剂量施用和随后直到第5天的安全性和pk评估组成。治疗期2分别包括第22天和第40天的随访访视和研究结束评价。两个治疗期之间由至少18天( /
‑
1天)的洗脱期隔开。
[0231]
一个或多个主要目标
[0232][0233]
入选标准:
[0234]
1.年龄在18至65岁(含)之间的男性和女性健康受试者,通过既往病史、体格检查、生命体征、心电图和筛选时的实验室检查确定身体状况良好。根据这些特定研究部分的资格,具有特应性体质的健康受试者参加了第2部分或第4部分。特应性健康志愿者在筛选时对于已知的过敏原的皮肤针刺试验必须为阳性(特应性体质),但临床上无症状,不需要任何全身性药物治疗。
[0235]
2.要求受试者体重至少50kg,体质指数(bmi)在18
‑
30kg/m2(含)的范围内。bmi=体重(kg)/[身高(m)]2。
[0236]
3.在筛选和首个基线时,在受试者静坐至少3分钟后以坐姿评估以及站立3分钟后再次(需要时)评估生命体征(体温、收缩压和舒张压及脉搏率)。坐姿生命体征必须在以下范围内(含):
[0237]
·
口腔体温在35.0℃至37.5℃之间
[0238]
·
收缩压为90mm hg至139mm hg
[0239]
·
舒张压为50mm hg至89mm hg
[0240]
·
脉搏率为50bpm至90bpm
[0241]
关键排除标准
[0242]
1.对任何所述研究药物或相似化学类别的药物具有过敏史。
[0243]
2.临床上显著的ecg异常史,或筛选和/或治疗前的以下任何ecg异常:
[0244]
·
pr间隔>200毫秒
[0245]
·
qrs波群>120毫秒
[0246]
·
qtcf>450毫秒(男性)
[0247]
·
qtcf>460毫秒(女性)
[0248]
3.筛选或首个基线时血红蛋白水平低于12.0g/dl。
[0249]
4.筛选或首个基线时血小板计数超出正常范围(低于150x 109/l或高于450x 109)。
[0250]
5.在筛选和/或基线时,任何标准凝血测试(包括凝血酶原时间(pt)、部分凝血活酶时间(ptt)或国际标准化比率(inr))中的任何临床上显著的异常。
[0251]
6.有血栓或血栓栓塞事件的历史或存在血栓或血栓栓塞事件,或血栓或血栓栓塞事件的风险增加。
[0252]
施用的治疗
[0253]
第1部分(sad)
[0254]
受试者被分配至以下10个群组中的一个。在每个群组中,将8名受试者以总体6:2的比率随机分配接受化合物(i)或匹配的安慰剂。将第一个子群组以1:1的比率随机分配为一名受试者使用化合物(i),另一名受试者使用匹配的安慰剂。在最初给药的2名受试者的48小时观察期后给药的其余6名受试者/群组,按5:1的比率随机分配。
[0255]
·
群组1:单个口服剂量0.5mg的化合物(i)或匹配的安慰剂
[0256]
·
群组2:单个口服剂量1.5mg的化合物(i)或匹配的安慰剂
[0257]
·
群组3:单个口服剂量5mg的化合物(i)或匹配的安慰剂
[0258]
·
群组4:单个口服剂量15mg的化合物(i)或匹配的安慰剂
[0259]
·
群组5:单个口服剂量30mg的化合物(i)或匹配的安慰剂
[0260]
·
群组6:单个口服剂量60mg的化合物(i)或匹配的安慰剂
[0261]
·
群组7:单个口服剂量100mg的化合物(i)或匹配的安慰剂
[0262]
·
群组8:单个口服剂量200mg的化合物(i)或匹配的安慰剂
[0263]
·
群组9:单个口服剂量400mg的化合物(i)或匹配的安慰剂
[0264]
·
群组10:单个口服剂量600mg的化合物(i)或匹配的安慰剂
[0265]
第2部分(mad,qd方案)
[0266]
受试者被分配至以下6个群组中的一个。在每个群组中,将8名受试者以6:2的比率随机分配接受化合物(i)或匹配的安慰剂。
[0267]
·
群组1:多个口服剂量10mg的化合物(i)或匹配的安慰剂
[0268]
·
群组2:多个口服剂量25mg的化合物(i)或匹配的安慰剂
[0269]
·
群组3:多个口服剂量50mg的化合物(i)或匹配的安慰剂
[0270]
·
群组4:多个口服剂量100mg的化合物(i)或匹配的安慰剂
[0271]
·
群组5:多个口服剂量400mg的化合物(i)或匹配的安慰剂
[0272]
·
群组6:多个口服剂量最多600mg的化合物(i)或匹配的安慰剂
[0273]
第3部分(食物效应)
[0274]
以1:1的比率将受试者随机分配至2种治疗顺序之一:
[0275][0276]
第4部分(mad,bid方案)
[0277]
受试者被分配至以下群组中的一个。在每个群组中,将8名受试者以6:2的比率随机分配接受化合物(i)或匹配的安慰剂。
[0278]
·
群组1:bid方案中多个口服剂量100mg的化合物(i)或匹配的安慰剂
[0279]
·
群组2:bid方案中多个口服剂量200mg的化合物(i)或匹配的安慰剂
[0280]
药代动力学数据
[0281]
生物分析方法:
[0282]
在所有剂量水平下在所有受试者中从血液中获得药代动力学样品,并进行评价。没有对来自安慰剂组受试者的样品进行分析。在研究中定义的时间点收集来自受试者的pk评估样品。通过验证的lc
‑
ms/ms方法测定血液中的化合物(i)浓度。
[0283]
单个递增剂量0.5mg
‑
600mg药代动力学:
[0284]
单个递增剂量后化合物(i)的平均血药浓度
‑
时间变化过程如图1所示。
[0285]
在所有剂量下,化合物(i)随时间迅速吸收,达到约1
‑
1.5小时的cmax。在大多数受试者中,吸收阶段的特征在于单个明显的吸收峰。药物处置展示双指数下降。大多数药物在初始分配阶段就被消除,这表明在达到全身组织平衡之前可能会发生大量药物清除。直到给药后12小时才达到表观的终末消除阶段,并且仅在接受100mg及以上剂量的受试者中可测量。可测量的终末半衰期为4小时(100mg)至18小时(600mg),导致循环中的平均滞留时间(mrt)为1小时至5小时(mrt≈t1/2/ln2)。分配阶段显示出约1h的主要剂量依赖性t1/2。在sad群组中,单剂量施用(cl/f)后口服血液清除的几何平均值在250至506l/h的范围内,在所有群组中估计为383l/h。
[0286]
多个口服剂量代动力学
[0287]
图2显示了多个递增剂量10mg
‑
400mg后化合物(i)的平均血药浓度
‑
时间过程。
[0288]
在各群组中,口服给药后稳态时的几何平均表观清除率(clss/f,第12天mad,q.d.)在246l/h至414l/h之间。通常,与第1天相比,在稳态下观察到更低的清除率,但在100mg及以上的剂量下,这种差异几乎消失了(表2
‑
1(第1天)和表2
‑
2(第12天))。此行为的原因可能是共价靶标(btk)结合有助于化合物(i)的初始清除。这一效应在第1天最为显著,因为在连续的几天中,谷中的剩余靶标占有率会降低靶标结合清除率的部分贡献(clss/f)。自然地,当谷中的靶标占有率接近完成时,该差异随剂量的增加而减小。因此,与第1天相比,第12天的药物暴露(auc、cmax)更高,如(受试者内)药物累积率(racc)所示,其范围为5(低剂量)至1.2(高剂量)剂量,并且auc通常高于cmax,证实可能涉及对全身清除的影响。
[0289]
表2
‑
1:多个递增剂量10
‑
600mg q.d.给药时化合物(i)的pk参数汇总
[0290][0291][0292]
表2
‑
2:
[0293]
[0294][0295]
[0296]
统计量为平均值
±
sd(cv%)
[0297]
中位数(min
‑
max)[n]
[0298]
cv%=变异系数(%)=sd/平均值*100
[0299]
对于tmax和t1/2,仅显示中位数(min
‑
max)[n]
[0300]
通常,最后一次给药后24小时的血液浓度通常低于1ng/ml,除了一些剂量为100mg或更高的受试者,这表明化合物(i)在两个连续剂量中几乎被完全洗脱。后者也表明在几个剂量内即达到稳态。
[0301]
由于组织中btk的周转率更高,因此对b.i.d.给药也进行了研究。图3显示了每日两次多个递增剂量100mg和200mg后获得的平均血药浓度时间曲线。与其他群组的结果一致,观察到b.i.d.方案后的剂量的快速吸收,tmax约为1h。观察到的auc的累积因子(racc)达到1.5(100mg)和2.0(200mg),cmax的累积因子达到约1.65(两个剂量)。在第12天观察到aucτ的剂量成比例增加,而仅发现cmax的略微增加(1.33倍)。总之,化合物(i)的b.i.d给药提供了在给药间隔期间解决组织中更快的靶标重新合成而不会损害总体pk曲线和解决对大剂量q.d治疗的需求的选择。
[0302]
食物效应:结果部分3:
[0303]
下表2
‑
3中汇总的食物效应群组的pk数据显示如cmax降低1.25倍所表明的更低的吸收速率和auc0
‑
24升高1.4倍所指示的更完全的总体吸收。最重要的是,平均tmax从1小时(禁食)变为>3小时(进食)。
[0304]
(图4)
[0305]
表2
‑
3pk参数汇总:单剂量60mg后化合物(i)的食物效应
[0306][0307]
cv(变异系数)(%)=sd/平均值*100
[0308]
药效动力学
[0309]
药效动力学(pd)的特征在于评估靶标的占有率和远端途径抑制作用。人全血中btk占有率的测量结果(以游离btk与总btk的比率得出)作为治疗靶标占用的直接标记物。
[0310]
在具有式(i)的化合物的各临床前模型间已经确定了btk占有率、剂量、全身性化合物暴露以及对复杂体内途径的功效与疾病读数之间的关系。(例如实例1)
[0311]
具有式(i)的化合物是btk的不可逆抑制剂,确定了btk占有的程度和持续时间。化合物(i)的pd效应是通过在两种单独的测定中,在meso scale diagnostics(msd)平台上通
过酶联免疫吸附测定(elisa)测量全血中的游离btk(未结合)和总btk来评估的。
[0312]
剂量与药效动力学之间的关系以人体血液中btk的占有率测量结果(以游离btk与总btk的比率得出)为特征,这是治疗靶标占用的直接标记物。确定了0.5至400mg范围的单个递增剂量、10mg至400mg范围的q.d.多个递增剂量和100mg至200mg范围的b.i.d.多个递增剂量的btk占有率。
[0313]
具有式(i)的化合物在外周血btk占有的程度和持续时间上均展现出明显的剂量依赖性增加。通常在给药后0.5小时即可观察到峰值靶标占有,这表明相对于峰值药物暴露,药物起效迅速,没有相关的滞后现象。从其与btk的共价结合能力得出的结论是,靶标占有率远远超过了其从全身循环中处置的能力,这表明存在非平衡的pk
‑
pd关系。因此,得出结论,btk占有的持续时间取决于btk的从头合成速率。
[0314]
与较低剂量群组(0.5
‑
1.5mg)不同,单剂量15mg及以上的化合物(i)在几乎所有受试者中均建立了接近100%的峰值靶标占有率,并在24小时内保持在80%以上。尽管在15mg下受试者之间反应差异很大,但30mg及更高剂量下在所有受试者中具有持续(>24h)和接近完全(>90%)的占有率,受试者之间的差异性明显降低。将btk蛋白库刷新至给药前水平的时间约为10天,对应于中位周转时间t1/2约为48小时(图5)。
[0315]
在多个剂量化合物(i)后,10mg化合物(i)q.d已经使第12天给药前的btk占有率实现>96%。
[0316]
另外,对嗜碱性粒细胞活化的离体抑制(通过cd63和cd203c的表面表达监测)被用作远端机制性生物标记物,以测试化合物(i)的下游pd效应。为了确定化合物(i)对嗜碱性粒细胞活化的pd效应,用抗ige离体刺激全血。由流式细胞术通过cd63 和cd203 嗜碱性粒细胞的百分比评价脱粒。
[0317]
在单个递增剂量的化合物(i)之后,数据表明fcεr1介导的嗜碱性粒细胞活化的剂量依赖性抑制。如通过cd63所测量的,离体血液嗜碱性粒细胞活化在60mg剂量下几乎完全被抑制(>89%),而在较高剂量下给药24h后达到接近100%的抑制。相比之下,单剂量化合物(i)后24小时cd203c的最大抑制作用(约50%抑制)仅在200mg化合物(i)上实现。
[0318]
在第12天,q.d.或b.i.d.施用具有式(i)的化合物的mad后8h,化合物(i)的最低测试剂量(10mg qd)已经导致对cd63上调的>90%的抑制,并且化合物(i)的剂量≥50mg q.d.时cd63的谷值水平抑制为>90%(图6)。在第12天cd203c活化的最大谷值抑制持续高于单剂量化合物(i)后的情况,并且仅在b.i.d.施用100mg和200mg化合物(i)时实现。
[0319]
在首次人体研究的mad研究部分中,通过皮肤针刺试验(spt)评价了化合物(i)抑制定义的过敏原反应的能力。spt在给药前(筛选、基线和第1天给药前)以及首个剂量后(第1天)和每天一次给药11天之后(第12天)的不同时间点进行。
[0320]
与离体嗜碱性粒细胞活化的抑制相似,在多个递增剂量群组中,可以明显看出对风团直径的剂量依赖性影响,这由与基线相比给药后的平均风团大小减小所指示(图7)。所述影响在约100mg化合物(i)q.d.时开始趋于平稳。
[0321]
剂量选择的理由/结论
[0322]
健康志愿者在1期临床研究中已暴露于化合物(i),剂量范围为0.5mg至600mg,单剂量给予或者每天一天或两次给予最多18天。化合物(i)具有良好的耐受性,并且没有与化合物(i)摄入有关的严重或重度不良事件。在所述临床研究中,观察到的不良事件(ae)似乎
不是剂量依赖性的,大多数是单发事件,并且通常性质较轻。因此,临床安全性信息支持为该2b期研究选择的剂量。
[0323]
本发明的剂量水平推导自健康志愿者中的以下分析(btk占有率、嗜碱性粒细胞活化的抑制(由cd63和cd203c上调监测));以及对无症状特异性健康志愿者中的皮肤针刺试验(spt)的影响——皮肤中肥大细胞和嗜碱性粒细胞抑制作用的代用分析。
[0324]
在上述临床试验中,q.d.施用10mg的化合物(i)导致血液中btk几乎完全占有,cd63上调减少>90%(在稳定状态下施用化合物(i)后8小时),并且对spt中的风团大小的抑制作用最小。因此,10mg的化合物(i)q.d.对应于生物活性的开始。在100mg的具有式(i)的化合物时,spt中的风团大小的平均减小开始趋于平稳。因此,100mg的所述化合物对应于化合物(i)的最大效应。q.d.中等剂量的三十五mg化合物(i)非常适合准确地描述q.d.化合物(i)的剂量反应曲线。
[0325]
具有式(i)的化合物通过共价结合抑制btk。当血液中btk的占有>24小时(h)时,组织中btk的快速周转(例如,啮齿动物脾脏中给出大约5小时)可能需要b.i.d.施用化合物(i)以达到最大功效。分别地,10mg、25mg和100mg b.i.d.的化合物(i)的剂量准确地描述了化合物(i)每天两次给予时的剂量反应曲线。
[0326]
人类中的安全性
[0327]
为了分析不良反应,将来自所有sad和mad群组的安慰剂受试者(每个群组2个)以及按sad和mad部分分开的受试者合并为一个安慰剂组(sad为n=20,mad为n=16),以与每个单一化合物(i)剂量组(各自n=6)和总化合物(i)组(sad为n=60,mad为n=48)进行比较。对于sad和mad群体,安慰剂组和活性组之间的人口统计学数据没有明显的主要差异。在健康志愿者中进行fih研究的安全性评估并未显示出在剂量达600mg时存在重大安全隐患。
[0328]
实例3:中度至重度sjs患者的功效和安全性数据
[0329]
对具有式(i)的化合物进行了2期研究,旨在确定安全性和功效并表征具有中等至重度sjs的受试者中的具有式(i)的化合物的剂量反应,以便进一步开发所述化合物用于治疗这种病。
[0330]
方案汇总
[0331]
[0332]
[0333]
[0334][0335]
目标和终点
[0336]
表2
‑
4目标和相关终点
[0337]
[0338][0339]
研究设计
[0340]
这是一项适应性2期随机、双盲、安慰剂对照、多中心、整合剂量范围研究,旨在评价在患有中度至重度舍格伦综合征(sjs)的患者中多剂量的具有式(i)的化合物的安全性和功效。在这项研究中,中度至重度sjs的定义为根据acr/eular标准的舍格伦综合征,并且essdai至少为5(12个域中的8个域)且esspri至少为5。如果研究受试者接受了基础疾病的某些伴随治疗,并且仍然符合进入标准,他们将继续接受这种治疗,前提是在研究结束前保持稳定。
[0341]
该研究由两个部分组成。在本研究的第1部分中,在两种不同的给药方案中测试得出的最高生物活性单剂量(100mg具有式(i)的化合物或其药学上可接受的盐):每日一次给药(qd)或每日两次给药(bid),并与安慰剂组进行比较。共有约72名受试者被平均随机分配到这3个治疗组,预期样本量为每组24名受试者。在第2部分中,将选择的给药方案(qd或bid)扩展到更低的剂量,以评估该给药方案在得出的最低剂量(10mg具有式(i)的化合物)和最高剂量(100mg具有式(i)的化合物)剂量之间的安全性和剂量反应。这得到了4个治疗组;安慰剂加三种剂量水平的具有式(i)的化合物(100mg bid/qd,25mg bid或35mg qd和10mg bid/qd)。预计总共约有180名受试者被平均随机分配到这4个治疗组,从而导致样本量为每组45名受试者。
[0342]
每位个体研究受试者首先要接受长达6周的筛选期、24周的治疗持续时间和在结束研究访视之前最后一次研究治疗施用后30天的随访期。研究中每个受试者的总持续时间(包括筛选期)长达35周。
[0343]
在整个治疗期持续期间(24周),无论选择哪种给药方案,受试者都要接受每天两次的具有式(i)的化合物或安慰剂给药,以便在整个研究过程中保持设盲状态。
[0344]
安全性评估包括体格检查、ecg、生命体征、标准临床实验室评价(血液学、血液化学、尿液分析)以及不良事件和严重不良事件监测。
[0345]
筛选
[0346]
签署知情同意书后,受试者接受essdai和esspri评估并完成安全性和其他评估以评价资格。由于交通安排原因,如果研究者认为合适,则在6周的筛选期内的不同日期进行评估。筛选失败的受试者可以有一次机会参加再次筛选。如果受试者被确认为符合参加研究的资格,还向受试者提供可穿戴设备以及有关如何使用可穿戴设备的指导(如果他们已
选择使用可穿戴设备)。
[0347]
基线
[0348]
符合资格的受试者将在第1天返回进行基线访视。由于交通安排原因,受试者可以在研究中心过夜,但这不会被视为住院。在随机分配之前确认资格,所需的基线评估应在第1天给药之前完成。如果研究中心出于时间安排目的而优选,则一些基线评估在第1天的前一天晚上进行。
[0349]
研究治疗
[0350]
所述研究药物以带有适当盲注标签的瓶子提供。这些瓶子中装有含10mg或25mg或50mg活性物质(具有式(i)的化合物)或匹配的安慰剂的胶囊。每个剂量(2粒胶囊)与水一起吞下,并且应空腹服用。在早晚给药之间,应保持约12小时(10至14小时)的给药间隔。研究治疗的存储和管理要求的详细信息以及受试者编号、研究治疗分配和服用的说明在som中进行了概述。
[0351]
治疗组(arm/group)
[0352]
在第1部分中,受试者在第1天以1:1:1的比率分配给以下3个治疗组之一
[0353]
·
具有式(i)的化合物,100mg每日两次
[0354]
·
具有式(i)的化合物,100mg qd
[0355]
·
安慰剂
[0356]
第2部分的给药时间表和剂量范围基于ia的数据。在第2部分中,受试者在第1天以1:1:1:1的比率分配给以下4个治疗组之一
[0357]
·
具有式(i)的化合物,100mg bid或qd
[0358]
·
具有式(i)的化合物,35mg qd或25mg bid
[0359]
·
具有式(i)的化合物,10mg bid或qd
[0360]
·
安慰剂
[0361]
受试者每次给药时服用2粒胶囊。这两个部分的所有受试者都有早晚剂量(每次2粒胶囊)。
[0362]
在第1天、第29天(第4周)、第57天(第8周)、第85周(第12周)、第113天(第16周)、第141天(第20周)和第169天(第24周),受试者在研究中心接受具有式(i)的化合物或安慰剂的早晨剂量。其他早晨剂量和所有晚上剂量通常由参加试验的受试者在家中服用。所有受试者在安排的研究中心访视期间每4周接受一次具有式(i)的化合物或安慰剂胶囊的相应供应。
[0363]
每个研究部分将受试者随机分配到各个治疗组。除日本外,随机分配按照基线essdai(基于加权评分<或≥10)分层。为日本和其他参与国的受试者生成分别的随机分配数字,以确保日本受试者在研究的所有治疗组中均匀分布。在第1天(第1周)、第29天(第4周)、第57天(第8周)、第85周(第12周)、第113天(第16周)、第141天(第20周)和第169天(第24周),受试者在研究中心接受具有式(i)的化合物或安慰剂的早晨剂量。然后向受试者提供研究药物,并且受试者可返回家中继续他们的日常给药方案(自我施用)。
[0364]
在第4周和第24周访视时,受试者还接受给药后安全性和pk评估。受试者大约每4周返回一次研究中心,在第2周结束(第15天)时参加附加的访视。在研究访视中,受试者接受essdai和esspri评估以及其他量表/问卷、安全性和各种pk、pd和生物标记物样品收集,
如评估时间表中所指示。
[0365]
要求受试者每周完成日志以记录其sjs症状和治疗的施用。
[0366]
在第2部分结束时完成24周治疗(第169天,第24周访视结束)后评估研究的主要终点。中期分析评价12周治疗后的功效和安全性,作为第1部分中24周治疗结果的替代。
[0367]
剂量/方案的基本原理和治疗持续时间
[0368]
第1部分的剂量/方案
[0369]
基于预测的血液(b细胞封闭)和组织中的btk占有率以及嗜碱性粒细胞(ib)中cd63上调的抑制(实例2中的结果),这项研究计划的最高剂量(100mgbid或qd)已显示出具有式(i)的化合物的最大效应。因此,可以推断该剂量可在包括淋巴组织在内的组织中提供针对sjs的最大的临床效应。在第1阶段,已在人类志愿者中测试了按单次和多次给药的高达600mg的剂量以及按每天两次给药的200mg的剂量,并证明是安全的。
[0370]
在第1部分中,在qd和bid方案中测试得出可提供最大效应的剂量(100mg),并与安慰剂进行了比较。由于具有式(i)的化合物与细胞内btk的结合的共价性质,治疗功效的持续时间取决于btk分子的周转率。模拟模型表明,在稳态下,含有100mg具有式(i)的化合物的qd方案在给药后24小时(以及紧接在下一次给药之前)平均提供83%的btk占有率,而采用相同单剂量100mg的bid方案在24小时具有96%的平均btk占有率。
[0371]
此外,对于每个给药期的约90%,在稳态下70%btk抑制被认为适合最佳临床功效。因此,在本研究的第1部分中测试的qd和bid方案的100mg化合物(i)的给药方案均可提供功效。
[0372]
第2部分的剂量/方案
[0373]
第2部分将评估所选的10mg至100mg之间剂量的给药方案的完整剂量范围。在具有式(i)的化合物的首次人体研究中,q.d.施用10mg具有式(i)的化合物导致血液中btk几乎完全占有并且cd63上调减少>80%,但是在皮肤针刺试验(spt)中仅最小限度地抑制了风团大小。因此得出结论:10mg具有式(i)的化合物q.d.将对应于组织中药效动力学活性的生物学活性的开始。作为中间剂量,35mg qd的具有式(i)的化合物或25mg bid的日剂量被认为分别准确地描述了具有式(i)的化合物qd或bid的完整剂量反应曲线。双盲治疗期持续长达24周将为具有式(i)的化合物提供持续的安全性和功效数据。
[0374]
对照药物(安慰剂)选择的理由
[0375]
比较治疗是安慰剂,在24周试验期间,提供由使用具有式(i)的化合物或其药学上可接受的盐治疗的受试者产生的潜在ae和其他安全性数据以及临床功效和pd数据的客观证据。由于尚无批准的sjs全身性治疗药物,因此使用安慰剂是合理的。当前针对sjs患者的护理标准仅限于对粘膜体征和症状(干燥)的对症护理,并且类固醇和常规dmard常常无效。没有药物干预措施针对与sjs相关的严重的致残性疲劳是有效的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。