和5’ccuaguuuaauaaagauuca3’中的一个或更多个基本上互补的互补区域。
12.在一些实施方案中,rna分子包含单链(single stranded,ss)rna或双链(double stranded,ds)rna。
13.在一些实施方案中,rna分子包括包含有义链和反义链的dsrna,其中反义链包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的互补区域。
14.在一些实施方案中,rna分子在长度上包含15至25个碱基对。
15.在一些实施方案中,互补区域与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’中的至少10、11、12或13个连续核苷酸互补。例如,互补区域可与guuuaauaaagauuucaccaaguuucacgcaaa或uggacccuaguuuaauaaagauucaccaag的10至30个连续核苷酸的区段(例如,guuuaauaaagauucaccaaguuucacgcaaa或uggacccuaguuuaauaaagauucaccaag`的10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个连续核苷酸的区段)互补。
16.在一些实施方案中,互补区域含有不超过3个与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的错配。
17.在一些实施方案中,互补区域与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’完全互补。
18.在一些实施方案中,dsrna是平末端的。
19.在一些实施方案中,dsrna包含至少一个单链核苷酸突出端。
20.在一些实施方案中,dsrna包含天然存在的核苷酸。
21.在一些实施方案中,dsrna包含至少一个经修饰核苷酸。
22.在一些实施方案中,经修饰核苷酸包括2
’‑
o
‑
甲基修饰的核苷酸、包含5
’‑
硫代磷酸酯基团的核苷酸或与胆固醇基衍生物或十二烷酸双癸酰胺基团连接的末端核苷酸。
23.在一些实施方案中,经修饰核苷酸包括2
’‑
脱氧
‑2’‑
氟修饰的核苷酸、2
’‑
脱氧
‑
修饰的核苷酸、锁核苷酸、无碱基核苷酸、2
’‑
氨基
‑
修饰的核苷酸、2
’‑
烷基
‑
修饰的核苷酸、吗啉代核苷酸、氨基磷酸酯或包含非天然碱基的核苷酸。
24.在一些实施方案中,dsrna包含至少一个2
’‑
o
‑
甲基修饰的核苷酸和至少一个包含5’硫代磷酸酯基团的核苷酸。
25.在一些实施方案中,dsrna是至少75%经化学修饰的。在一些实施方案中,dsrna是至少80%经化学修饰的。在一些实施方案中,dsrna是完全经化学修饰的。
26.在一些实施方案中,dsrna包含胆固醇部分。
27.在一些实施方案中,所述rna分子包含5’端、3’端并对靶标具有互补性,其中:(1)所述rna分子包含交替的2
’‑
甲氧基
‑
核糖核苷酸和2
’‑
氟
‑
核糖核苷酸;(2)从5’端起第2位和第14位处的核苷酸不是2
’‑
甲氧基核糖核苷酸;(3)核苷酸通过磷酸二酯或硫代磷酸酯连接而相连;以及(4)从3’端起第1
‑
2至1
‑
7位处的核苷酸通过硫代磷酸酯连接而与相邻核苷酸相连。
28.在一些实施方案中,dsrna具有5’端、3’端且与靶标互补,并且包含第一寡核苷酸和第二寡核苷酸,其中:(1)所述第一寡核苷酸包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本e互补的序列;(2)所述第一寡核苷酸
的一部分与所述第二寡核苷酸的一部分互补;(3)所述第二寡核苷酸包含交替的2
’‑
甲氧基
‑
核糖核苷酸和2
’‑
氟
‑
核糖核苷酸;(4)从所述第二寡核苷酸的3’端起第2位和第14位处的核苷酸为2
’‑
甲氧基
‑
核糖核苷酸;以及(5)所述第二寡核苷酸的核苷酸通过磷酸二酯或硫代磷酸酯连接而相连。
29.在一些实施方案中,rna分子包含5’端、3’端并对靶标具有互补性,其中:(1)所述rna分子包含三个连续2
’‑
氟
‑
核糖核苷酸的区域;(2)从5’端起第2位和第14位处的核苷酸不是2
’‑
甲氧基
‑
核糖核苷酸;(3)核苷酸通过磷酸二酯或硫代磷酸酯连接而相连;(4)从3’端起1
‑
2至1
‑
7位处的核苷酸通过硫代磷酸酯连接而与相邻核苷酸相连;以及(5)从5’端起1
‑
2位处的核苷酸通过硫代磷酸酯连接而彼此相连。
30.在一些实施方案中,dsrna具有5’端、3’端且与靶标互补,并且包含第一寡核苷酸和第二寡核苷酸,其中:(1)所述第一寡核苷酸包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的序列;(2)所述第一寡核苷酸的一部分与所述第二寡核苷酸的一部分互补;(3)所述第二寡核苷酸包含三个连续2
’‑
甲氧基
‑
核糖核苷酸的区域;(4)从所述第二寡核苷酸的3’端起第2位和第14位处的核苷酸为2
’‑
甲氧基
‑
核糖核苷酸;以及(5)所述第二寡核苷酸的核苷酸通过磷酸二酯或硫代磷酸酯连接而相连。
31.在一些实施方案中,所述第二寡核苷酸在所述第二寡核苷酸的3’端处与疏水分子相连。
32.在一些实施方案中,所述第二寡核苷酸和所述疏水分子之间的连接包括聚乙二醇或三乙二醇。
33.在一些实施方案中,从所述第二寡核苷酸3’端起的第1和2位处的核苷酸通过硫代磷酸酯连接而与相邻核苷酸相连。
34.在一些实施方案中,从第二寡核苷酸3’端起的第1和2位处的核苷酸以及从第二寡核苷酸5’端起的第1和2位处的核苷酸通过硫代磷酸酯连接与相邻核糖核苷酸相连。
35.在一个方面中,本公开内容提供了用于抑制载脂蛋白e(apoe)基因在生物体中的表达的药物组合物,所述药物组合物包含上述dsrna以及可药用载体。
36.在一些实施方案中,所述dsrna将所述apoe基因的表达抑制至少50%。在一些实施方案中,所述dsrna将所述apoe基因的表达抑制至少90%。
37.在一个方面中,本公开内容提供了用于抑制细胞中apoe基因表达的方法,所述方法包括:(a)将上述双链核糖核酸(dsrna)引入所述细胞中,以及(b)将步骤(a)中所产生的细胞维持足以获得所述apoe基因的mrna转录物的降解的时间,从而抑制所述apoe基因在所述细胞中的表达。
38.在一个方面中,本公开内容提供了治疗或管理神经退行性疾病的方法,所述方法包括向需要这样的治疗或管理的患者施用治疗有效量的上述dsrna。
39.在一些实施方案中,将dsrna施用于所述患者的脑。在一些实施方案中,将所述dsrna局部施用到脑或脊髓液,例如通过脑室内(intracerebroventricular,icv)注射施用。在另一些实施方案中,静脉施用所述dsrna并且所述dsrna能够穿过血脑屏障(blood brain barrier,bbb)以递送至脑。
40.在一些实施方案中,施用所述dsrna引起海马体中apoe基因mrna减少。在一些实施
uggacccuaguuuaauaaagauucaccaag3’基本上互补的互补区域,以及
62.所述两个或更多个核酸通过包括接头、间隔子或分支点的一个或更多个部分彼此连接。
63.在一些实施方案中,每种核酸独立地包含互补区域,该互补区域与5’gauucaccaaguuua3’、5’caaguuucacgcaaa3’和5’ccuaguuuaauaaagauuca3’中的一个或更多个基本上互补。
64.在一些实施方案中,每个核酸在长度上包含15至25个碱基对。
65.在一些实施方案中,每个核酸包含单链(ss)rna或双链(ds)rna。
66.在一些实施方案中,每个核酸包含含有有义链和反义链的dsrna,其中,每条反义链独立地包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的互补区域。
67.在一些实施方案中,每个互补区域独立地与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’中的至少10、11、12或13个连续核苷酸互补。
68.在一些实施方案中,每个互补区域独立地含有不超过3个与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的错配。
69.在一些实施方案中,每个互补区域与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’完全互补。
70.在一些实施方案中,每个dsrna独立地包含至少一个经修饰核苷酸。
71.在一些实施方案中,经修饰核苷酸包括2
’‑
o
‑
甲基修饰的核苷酸、包含5
’‑
硫代磷酸酯基团的核苷酸或与胆固醇基衍生物或十二烷酸双癸酰胺基团连接的末端核苷酸。
72.在一些实施方案中,经修饰核苷酸包括2
’‑
脱氧
‑2’‑
氟修饰的核苷酸、2
’‑
脱氧
‑
修饰的核苷酸、锁核苷酸、无碱基核苷酸、2
’‑
氨基
‑
修饰的核苷酸、2
’‑
烷基
‑
修饰的核苷酸、吗啉代核苷酸、氨基磷酸酯或包含非天然碱基的核苷酸。
73.在一些实施方案中,所述两个或更多个核酸中的每个是包含5’端、3’端并对靶标具有互补性的rna分子,其中:
74.(1)所述rna分子包含交替的2
’‑
甲氧基
‑
核糖核苷酸和2
’‑
氟
‑
核糖核苷酸;
75.(2)从5’端起第2位和第14位处的核苷酸不是2
’‑
甲氧基核糖核苷酸;
76.(3)核苷酸通过磷酸二酯或硫代磷酸酯连接而相连;以及
77.(4)从3’端起第1
‑
2至1
‑
7位处的核苷酸通过硫代磷酸酯连接而与相邻核苷酸相连。
78.在一些实施方案中,每个核酸是具有5’端、3’端且与靶标互补的dsrna,并且包含第一寡核苷酸和第二寡核苷酸,其中:
79.(1)所述第一寡核苷酸包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的序列;
80.(2)所述第一寡核苷酸的一部分与所述第二寡核苷酸的一部分互补;
81.(3)所述第二寡核苷酸包含交替的2
’‑
甲氧基
‑
核糖核苷酸和2
’‑
氟
‑
核糖核苷酸;
82.(4)从所述第二寡核苷酸的3’端起第2位和第14位处的核苷酸为2
’‑
甲氧基
‑
核糖核苷酸;以及
83.(5)所述第二寡核苷酸的核苷酸通过磷酸二酯或硫代磷酸酯连接而相连。
84.在一些实施方案中,所述两个或更多个核酸中的每个包含rna分子,其中所述rna分子含有5’端、3’端并对靶标具有互补性,其中:
85.(1)所述rna分子包含三个连续2
’‑
氟
‑
核糖核苷酸的区域;
86.(2)从5’端起第2位和第14位处的核苷酸不是2
’‑
甲氧基
‑
核糖核苷酸;
87.(3)核苷酸通过磷酸二酯或硫代磷酸酯连接而相连;
88.(4)从3’端起1
‑
2至1
‑
7位处的核苷酸通过硫代磷酸酯连接而与相邻核苷酸相连;以及
89.(5)从5’端起1
‑
2位处的核苷酸通过硫代磷酸酯连接而彼此相连。
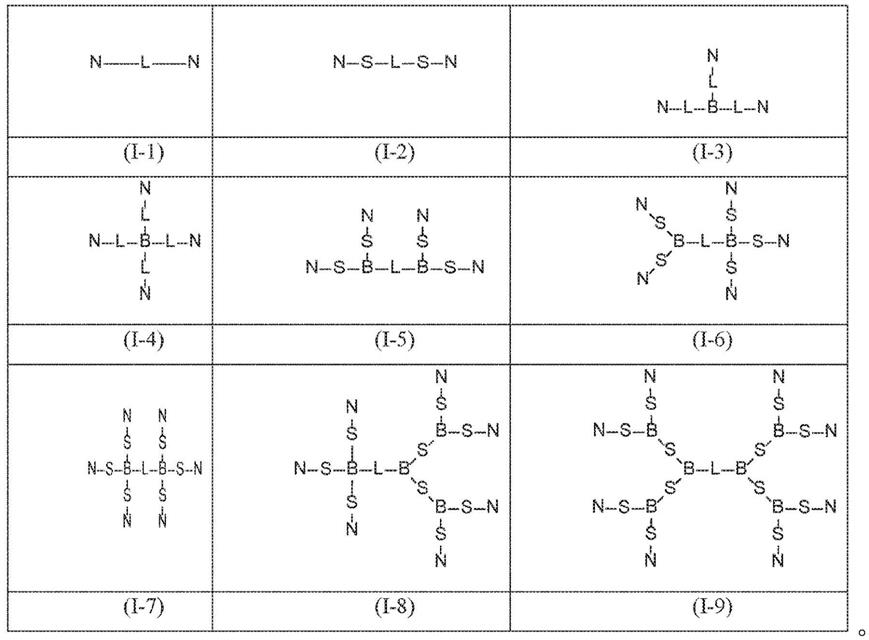
90.在一个方面中,本公开内容提供了式(i)化合物:
[0091][0092]
l包含乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑或其组合,其中式(i)任选地还包含一个或更多个分支点b和一个或更多个间隔子s,其中:
[0093]
b在每次出现时独立地是多价有机物物质或其衍生物;
[0094]
s在每次出现时独立地包含乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑或其组合;
[0095]
n包含双链核酸,例如在长度上包含15至35个碱基(例如在长度上包含15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35个碱基)的双链核酸,其中所述双链核酸包含有义链和反义链,其中所述反义链包含与5’guuuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的互补区域,
[0096]
所述有义链和所述反义链各自独立地包含一个或更多个化学修饰;以及
[0097]
n是2、3、4、5、6、7或8。
[0098]
在一些实施方案中,化合物具有选自式(i
‑
1)至(i
‑
9)的结构:
[0099][0100]
在一个实施方案中,反义链包含选自以下的5’端基团r:
[0101]
[0102][0103]
在一些实施方案中,化合物具有式(ii)的结构:
[0104][0105]
其中:
[0106]
x在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;
[0107]
y在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;
[0108]
‑
代表磷酸二酯核苷间连接;
[0109]
=代表硫代磷酸酯核苷间连接;以及
[0110]
‑‑‑
在每次出现时分别代表碱基配对相互作用或错配。
[0111]
在一些实施方案中,化合物具有式(iii)的结构:
[0112][0113]
其中:
[0114]
x在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;
[0115]
x在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸;
[0116]
y在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;以及
[0117]
y在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸。
[0118]
在一些实施方案中,化合物具有式(iv)的结构:
[0119][0120]
其中:
[0121]
x在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;
[0122]
y在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;
[0123]
‑
代表磷酸二酯核苷间连接;
[0124]
=代表硫代磷酸酯核苷间连接;以及
[0125]
‑‑‑
在每次出现时分别代表碱基配对相互作用或错配。
[0126]
在一些实施方案中,化合物具有式(v)的结构:
[0127][0128]
其中:
[0129]
x在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;
[0130]
x在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸;
[0131]
y在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;以及
[0132]
y在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸。
[0133]
在一些实施方案中,部分l是结构l1:
[0134][0135]
在一些实施方案中,当l是结构l1时,r是r3且n是2。
[0136]
在一些实施方案中,l是结构l2:
[0137][0138]
在一些实施方案中,当l是结构l2时,r是r3且n是2。
[0139]
在一个方面中,本公开内容提供了具有式(vi)结构的用于治疗性核酸的递送系统:
[0140][0141]
其中:
[0142]
l包含乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑或其组合,其中式(vi)任选地还包含一个或更多个分支点b和一个或更多个间隔子s,其中:
[0143]
b在每次出现时独立地是多价有机物物质或其衍生物;
[0144]
s在每次出现时独立地包含乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑或其组合;
[0145]
每个cna独立地是包含一个或更多个化学修饰的载体核酸;
[0146]
每个cna独立地包含5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’中的至少15个连续核苷酸;以及
[0147]
n是2、3、4、5、6、7或8。
[0148]
在一些实施方案中,每个cna独立地包含5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的15至25个连续核苷酸(例如,15、16、17、18、19、20、21、22、23、24或25个连续核苷酸)。
[0149]
在一些实施方案中,每个cna独立地包含5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的15至21个连续核苷酸(例如,15、16、17、18、19、20或21个连续核苷酸)。
[0150]
在一些实施方案中,每个cna包含5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的15个连续核苷酸。在一些实施方案中,每个可包含5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的16个连续核苷酸。
[0151]
在一些实施方案中,递送系统具有选自式(vi
‑
1)至(vi
‑
9)的结构:
[0152][0153]
在一些实施方案中,每个cna独立地包含经化学修饰的核苷酸。
[0154]
在一些实施方案中,所述递送系统还包含n个治疗性核酸(nucleicacid,na),其中每个na与至少一个cna杂交。
[0155]
在一些实施方案中,每个na独立地包含至少16个连续核苷酸。在一些实施方案中,每个na独立地包含16至30个连续核苷酸(例如,16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个连续核苷酸)。在一些实施方案中,每个na独立地包含18至24个连续核苷酸(例如,18、19、20、21、22、23或24个连续核苷酸)。
[0156]
在一些实施方案中,每个na独立地包含16至21个连续核苷酸。
[0157]
在一些实施方案中,每个na包含20个连续核苷酸。在一些实施方案中,每个na包含21个连续核苷酸。
[0158]
在一些实施方案中,每个cna包含5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的15个连续核苷酸,并且每个na包含20个连续核苷酸。
[0159]
在一些实施方案中,每个cna包含5’guuuaauaaacauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’的16个连续核苷酸,并且每个na包含21个连续核苷酸。
[0160]
在一些实施方案中,每个na包含至少2个核苷酸的未配对突出端。突出端的核苷酸可通过硫代磷酸酯连接而相连。
[0161]
在一些实施方案中,每个na独立地选自:dna、sirna、antagomir、mirna、间隔聚体(gapmer)、混合聚体(mixmer)和向导rna。
[0162]
在一个方面中,本公开内容提供了用于抑制载脂蛋白e(apoe)基因在生物体中的
表达的药物组合物,所述药物组合物包含上文化合物或系统之一以及可药用载体。
[0163]
在一些实施方案中,所述化合物或所述系统将所述apoe基因的表达抑制至少50%。
[0164]
在一些实施方案中,所述化合物或所述系统将所述apoe基因表达抑制至少90%。
[0165]
在一个方面中,本公开内容提供了用于抑制细胞中apoe基因表达的方法,所述方法包括:
[0166]
(a)将以上化合物或系统之一引入所述细胞中,以及
[0167]
(b)将步骤(a)中所产生的细胞维持足以获得所述apoe基因的mrna转录物的降解的时间,从而抑制所述apoe基因在所述细胞中的表达。
[0168]
在一个方面中,本公开内容提供了治疗或管理神经退行性疾病的方法,所述方法包括向需要这样的治疗或管理的患者施用治疗有效量的上述化合物或系统之一。
[0169]
在一些实施方案中,将所述化合物或所述系统施用于所述患者的脑。
[0170]
在一些实施方案中,将所述dsrna施用于所述患者的脑。在一些实施方案中,将所述dsrna局部施用到脑或脊髓液,例如通过脑室内(icv)注射施用。在另一些实施方案中,静脉施用所述dsrna并且所述dsrna能够穿过血脑屏障(bbb)以递送至脑。
[0171]
在一些实施方案中,施用所述化合物或所述系统引起海马体中4poe基因mrna减少。
[0172]
在一些实施方案中,施用所述化合物或所述系统引起脊髓中apoe基因mrna减少。
[0173]
在一些实施方案中,dsrna将所述apoe基因的表达抑制至少50%。
[0174]
在一些实施方案中,dsrna将所述apoe基因的表达抑制至少90%。
[0175]
在一个方面中,提供了分支寡核苷酸化合物,其包含两个或更多个核酸,例如每个核酸在长度上均包含15至40个碱基(例如,长度为15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个碱基)的两个或更多个核酸,其中每个核酸包含与apoe mrna基本上互补的互补区域,其中所述两个核酸彼此共价连接(例如通过包括接头、间隔子或分支点的一个或更多个部分共价连接)。
[0176]
在一些实施方案中,每个核酸独立地包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的互补区域。
[0177]
在一些实施方案中,每个核酸独立地包含与5’gauucaccaaguuua3’、5’caaguuucacgcaaa3’和5’ccuaguuuaauaaagauuca3’中的一个或更多个基本上互补的互补区域。
[0178]
在一些实施方案中,每个核酸独立地包含单链(ss)rna或双链(ds)rna。
[0179]
在一些实施方案中,每个核酸独立地包含反义分子或间隔聚体分子。
[0180]
在一个方面中,提供了治疗或管理淀粉样物质相关疾病的方法,所述方法包括向被诊断为患有所述疾病或者有发生所述疾病之风险的患者施用治疗有效量的以上化合物或系统之一。
[0181]
在一些实施方案中,所述疾病选自阿尔茨海默病、脑淀粉样血管病、轻度认知损害、中度认知损害及其组合。
[0182]
在一些实施方案中,将所述化合物或所述系统施用于患者的脑,例如通过脑室内注射施用。
[0183]
在一个非限制性实施方案中,所述化合物或所述系统的施用抑制、延迟、预防或降低认知衰退。在另一非限制性实施方案中,所述化合物或所述系统的施用抑制、延迟、预防或降低β淀粉样斑块的形成。在一个示例性实施方案中,所述化合物或所述系统的施用抑制、延迟、预防或降低神经退行性变。
[0184]
在另一个方面中,提供了治疗或管理阿尔茨海默病的方法,所述方法包括向被诊断为患有所述疾病或者有发生所述疾病之风险的患者施用治疗有效量的包含两个或更多个核酸的分支寡核苷酸化合物,所述两个或更多个核酸例如两个或更多个各自在长度上包含15至40个碱基(例如,长度为15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个碱基)的核酸,其中每个核酸包含与apoemrna基本上互补的互补区域,其中所述两个核酸彼此共价连接(例如通过一个或更多个包括接头、间隔子或分支点的一部分共价连接)。
[0185]
在一些实施方案中,分支寡核苷酸化合物中的每个核酸独立地包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的互补区域。在另一个实施方案中,分支寡核苷酸中的每个核酸独立地包含与5’gauucaccaaguuua3’、5’caaguuucacgcaaa3’和5’ccuaguuuaauaaagauuca3’中的一个或更多个基本上互补的互补区域。
[0186]
在一些实施方案中,每个核酸包含单链(ss)rna或双链(ds)rna。
[0187]
在另一个实施方案中,每个核酸包含反义分子或间隔聚体分子。
[0188]
在一些实施方案中,将分支寡核苷酸施用于患者的脑,例如通过脑室内注射施用。
[0189]
在一个非限制性实施方案中,分支寡核苷酸的施用抑制、延迟、预防或降低认知衰退。在另一个非限制性实施方案中,化合物或系统的施用抑制、延迟、预防或降低β淀粉样斑块的形成。在一个示例性实施方案中,分支寡核苷酸的施用抑制、延迟、预防或降低神经退行性变。
附图说明
[0190]
通过以下结合附图对说明性实施方案的详细描述,将更全面地理解本发明的前述和其他特征和优势。本专利或申请文件包含至少一幅彩色附图。在提出请求并支付必要的费用后,官方将提供带有彩色附图的本专利或专利申请公开的副本。
[0191]
图1a至1c举例说明了在基于mrna和蛋白质二者的小鼠细胞模型中显示出沉默的新靶向序列的鉴定。
[0192]
图1a描绘了鉴定靶向小鼠原代星形胶质细胞中的apoe的命中序列的筛选。
[0193]
图1b描绘了小鼠原代星形胶质细胞中来自初级筛选的命中序列的剂量响应曲线。
[0194]
图1c描绘了显示出小鼠原代星形胶质细胞中蛋白质沉默的剂量响应。
[0195]
图2a至2b说明了在基于mrna的人细胞模型中显示出mrna沉默的新靶向序列的鉴定。
[0196]
图2a描绘了鉴定hepg2细胞中靶向apoe的命中序列的筛选。
[0197]
图2b描绘了hepg2细胞中来自初级筛选的命中序列的剂量响应曲线。
[0198]
图3a至3b说明了靶向apoe的寡核苷酸。
[0199]
图3a描绘了小鼠和人apoe基因中的靶向序列以及靶向这样的序列的寡核苷酸。
[0200]
图3b说明了对寡核苷酸的示例化学修饰。
[0201]
图4a至4c说明了注射cns
‑
sirna
apoe
之后1个月,整个小鼠脑中mrna和蛋白质表达的沉默。
[0202]
图4a说明了注射之后1个月脑的所有区域中的mrna沉默。
[0203]
图4b说明了注射之后1个月脑的所有区域中的蛋白质沉默。
[0204]
图4c是显示出整个脑中蛋白质沉默的western印迹。
[0205]
图5a至5b示出了在低剂量下cns
‑
sirna
apoe
沉默海马体中的apoe蛋白。
[0206]
图5a描绘了注射之后1个月海马体中蛋白质沉默的定量。
[0207]
图5b是显示出靶蛋白沉默的western印迹。
[0208]
图6a至6b示出了在低剂量下cns
‑
sirna
apoe
在整个脊髓中沉默。
[0209]
图6a是注射之后1个月脊髓中蛋白质沉默的定量。
[0210]
图6b是显示出与对照黏着斑蛋白(116kda)相比,靶apoe(37kda)蛋白沉默的western印迹。
[0211]
图7a至7b示出了在较低剂量下用cns
‑
sirna
apoe
来脑特异性地(非肝地)沉默apoe是可能的。
[0212]
图7a是注射之后1个月肝中蛋白质沉默的定量。
[0213]
图7b是显示出与对照黏着斑蛋白(116kda)相比,靶apoe(37kda)蛋白沉默的western印迹(proteinsimple)。
[0214]
图8a至8c示出了galnac
‑
sirna
apoe
沉默肝中的蛋白质表达,但对脑蛋白质没有作用。
[0215]
图8a是显示出肝中的apoe蛋白沉默vs.对照黏着斑蛋白的western印迹。
[0216]
图8b是显示出对脑中的蛋白质水平没有作用的western印迹。
[0217]
图8c是肝和脑中蛋白质沉默的定量。
[0218]
图9a至9b示出了降低肝apoe提高血清胆固醇,但仅沉默cns
‑
apoe不提高血清胆固醇。
[0219]
图9a描绘了沉默cns apoe之后总血清胆固醇的定量。
[0220]
图9b描绘了沉默全身性apoe之后总血清胆固醇的定量以及沉默全身性apoe之后ldl和hdl级分中胆固醇的定量。
[0221]
图10a至10b示出了cns和全身性apoe代表两个不同的蛋白质池。
[0222]
图10a说明了注射cns
‑
sirna
apoe
之后脑和肝中的蛋白质沉默。
[0223]
图10b说明了注射galnac
‑
sirna
apoe
之后脑(无)和肝中的沉默。
[0224]
图11示出了di
‑
hsirna的结构。黑色
‑2’‑
o
‑
甲基,灰色
‑2’‑
氟,红色破折号
‑
硫代磷酸酯键,接头
‑
四乙二醇。di
‑
hsirna是两个通过有义链3’端的接头连接的不对称的sirna。与较长的反义链杂交产生突出的单链完全硫代磷酸酯化区域,对组织分布、细胞摄取和效力至关重要。所呈现的结构利用了四种单体的teg接头。可在不影响效力的情况下修饰接头的化学特性。它可以通过长度、化学成分(全碳)、饱和度或化学靶向配体的添加进行调整。
[0225]
图12示出了二分支sirna的化学合成、纯化和质量控制。
[0226]
图13示出了通过图中描绘的方法产生的化合物的hplc和质量控制。通过质谱,三种主要产物被鉴定为具有teg(四乙二醇)接头、二分支寡聚体和vit
‑
d(钙化醇)缀合物的有
义链。所有产物通过hplc纯化并在体内独立测试。仅二分支寡聚体表现出前所未有的组织分布和效力的特征,表明分支结构对组织保留和分布至关重要。
[0227]
图14示出了确认二分支寡核苷酸质量的质谱。观察到的质量为11683,对应于通过teg接头通过3’端连接的两条有义链。
[0228]
图15a至图15b示出了使用替代化学路线合成分支寡核苷酸。图15a示出了单氨基磷酸酯接头方法,并且图15b示出了二磷酸接头方法。
[0229]
图16示出了示例性的亚酰胺接头、间隔子和分支部分。
[0230]
图17示出了寡核苷酸分支基序。双螺旋代表寡核苷酸。不同的接头、间隔子和分支点的组合允许产生广泛多样的分支hsirna结构。
[0231]
图18示出了结构上多样的分支寡核苷酸。
[0232]
图19示出了本发明的具有四个单链硫代磷酸酯区域的不对称化合物。
[0233]
图20a至图20c示出了通过退火三个寡核苷酸形成的本发明的分支寡核苷酸(图20a)。较长的连接的寡核苷酸可包含未经修饰的rna、dna或una形式的可裂解区域;(图20b)具有3’和5’连接的不对称分支寡核苷酸与前面描述的接头或间隔子连接。这可应用于有义链或反义链或者其组合的3’和5’端;(图20c)由三条不同的链构成的分支寡核苷酸。长双有义链可由3’亚磷酰胺和5’亚磷酰胺合成,以允许3
’‑3’
相邻或5
’‑5’
相邻端。
[0234]
图21示出了本发明的具有缀合生物活性部分的分支寡核苷酸。
[0235]
图22示出了硫代磷酸酯含量和立体选择性之间的关系。
[0236]
图23描绘了示例性的疏水部分。
[0237]
图24描绘了示例性的核苷酸间连接。
[0238]
图25描绘了示例性的核苷酸间骨架连接。
[0239]
图26描绘了示例性的糖修饰。
[0240]
图27说明了hsirna和完全代谢的(fully metabolized,fm)hsirna的结构。
[0241]
图28描绘了单链的完全修饰的寡核苷酸的化学多样性。单链寡核苷酸可由间隔聚体、混合聚体、mirna抑制剂、sso、pmo或pna组成。
[0242]
图29描绘了将疏水部分并入分支寡核苷酸结构的第一策略。
[0243]
图30描绘了将疏水部分并入分支寡核苷酸结构的第二策略
[0244]
图31描绘了将疏水部分并入分支寡核苷酸结构的第三策略。
[0245]
图32描绘了di
‑
sirna分子的示意图。黑色
‑2’‑
o
‑
甲基,灰色
‑2’‑
氟,红色破折号
‑
硫代磷酸酯键,接头与每个随从链3’端的末端核苷酸连接。交替核苷酸修饰的基序在有义靶向链的从5’端起的第1、11和15位处以及互补连接链的从5’端起的第5、16和18位处不同。
[0246]
图33说明了用于评价apoe沉默对神经退行性疾病作用的研究的实验设计。
[0247]
图34是说明注射之后2个月在阿尔茨海默病动物模型(app/psen1)中靶向apoe的sirna的mrna沉默作用的图。
[0248]
图35包括说明注射之后2个月在阿尔茨海默病动物模型(app/psen1)中靶向apoe的组织特异性sirna的作用的图。图35a:注射di
‑
sirna
apoe
之后2个月的mrna沉默。图35b:注射galnac
‑
sirna
apoe
之后2个月的mrna沉默。
[0249]
图36包括说明注射之后2个月在阿尔茨海默病动物模型中的组织特异性蛋白质沉默的图。图36a:注射di
‑
sirna
apoe
之后2个月的蛋白质沉默。图36b:注射galnac
‑
sirna
apoe
之
后2个月的蛋白质沉默。
[0250]
图37包括显示出icv或sc注射di
‑
sirna
ntc
、di
‑
sirna
apoe
、galnac
ntc
或galnac
apoe
之后海马体、皮质和肝中的apoe蛋白表达的原始western印迹。
[0251]
图38包括来自用di
‑
sirna
ntc
或di
‑
sirna
apoe
处理的小鼠的脑皮质切片的免疫荧光显微图像。
[0252]
图39包括报道如在用di
‑
sirna
apoe
和galnac
‑
sirna
apoe
处理的动物中测量的皮质斑块平均数量的图。图39a:与经di
‑
sirna
ntc
处理的小鼠相比,经di
‑
sirna
apoe
处理的小鼠中每只动物的皮质斑块平均数量。图39b:与经galnac
‑
sirna
ntc
处理的小鼠相比,经galnac
‑
sirna
apoe
处理的小鼠中每只动物的皮质斑块平均数量。
[0253]
图40a至图40c包括报道经di
‑
sirna
ntc
和di
‑
sirna
apoe
处理的小鼠之间的性别特异性分析结果的图。图40a:经di
‑
sirna
ntc
和di
‑
sirna
apoe
处理的小鼠的性别特异性分析。图40b和图40c:每只个体小鼠的每个切片中的斑块数量。
[0254]
图41是报道性别对通过di
‑
sirna
apoe
的沉默效力的影响的图。
[0255]
图42a至图42b示出了新di
‑
sirna apoe 1156沉默脑和脊髓中的apoe4。图42a:注射之后1个月海马体和肝中蛋白质沉默的定量。图42b:脊髓中蛋白质沉默的定量。
[0256]
图43说明了带有富含甲基取代模式的sirna。
[0257]
图44a至图44c说明了在基于mrna的人细胞模型中鉴定显示出mrna沉默的新靶向序列。图44a描绘了鉴定hepg2细胞中靶向apoe的命中序列的初级筛选。图44b说明了hepg2细胞中来自初级筛选的命中序列的有效性和效力。图44c描绘了hepg2细胞中来自初级筛选的命中序列的剂量响应曲线。
[0258]
图45说明了病理性淀粉样β
‑
42以皮克/毫克皮质组织为单位的测量结果。结果分别在雌性和雄性小鼠中测量。每种性别的左侧数据点对应于非靶向对照di
‑
sirna,右侧数据点对应于靶向apoe的di
‑
sirna。
[0259]
图46a至图46c说明了x
‑
34阳性斑块和app6e10/lamp1阳性斑块(图46c)的小鼠皮质染色(图46a)和相对定量(图46b)。对于图46a和图46b,结果分别在雌性和雄性小鼠中测量。每种性别的左侧数据点对应于非靶向对照di
‑
sirna,右侧数据点对应于靶向apoe的di
‑
sirna。对于图46c,将结果与galnac缀合的apoe sirna进行比较。
[0260]
图47说明了用靶向apoe的di
‑
sirna和靶向apoe的galnac缀合的sirna测量血清胆固醇(hdl和ldl水平)。
[0261]
图48a至图48b说明了注射di
‑
sirna apoe 1156之后4个月,3x
‑
tg
‑
ad小鼠模型的海马体和皮质中apoe蛋白水平的测量结果。
[0262]
图49a至图49b说明了注射di
‑
sirna apoe 1133之后1个月,3x
‑
tg
‑
ad小鼠模型的海马体和皮质中apoe蛋白水平的测量结果。
[0263]
图50说明了非人灵长类(non
‑
human primate,nhp)后皮质几个区域中sirna的积聚。向nhp的大池(cisterna magna)中注射25mg的di
‑
sirnaapoe 1133,并在注射之后2个月评估sirna积聚。
具体实施方式
[0264]
提供了新的apoe靶序列。还提供了新的干扰rna分子,例如sirna,其靶向本发明的
新apoe靶序列。
[0265]
除非另有说明,否则与本文所描述的细胞与组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白质与核酸化学和杂交学结合使用的命名法是本领域中公知并且常用的。除非另有说明,否则本文提供的方法和技术是根据常规方法来进行的,所述常规方法是本领域公知的且如在本说明书全篇所引用和论述的多种通用和更具体的参考文献中所描述的,除非另作指示。酶促反应和纯化技术是根据制造商的说明,如本领域通常所实现或如本文中所描述进行的。与本文中所描述的分析化学、合成有机化学以及医学化学和药物化学结合使用的命名法及本文中所描述的分析化学、合成有机化学以及医学化学和药物化学的实验室程序和技术是本领域中公知并且常用的。使用标准技术来进行化学合成、化学分析、药物制备、配制和递送以及患者的治疗。
[0266]
除非本文另作定义,否则本文使用的科学和技术术语具有本领域普通技术人员通常所理解的含义。在任何潜在歧义的情况下,本文提供的定义优先于任何字典或外在定义。除非上下文另外需要,否则没有数量词修饰的名词包括一个/种或更多个/种。除非另有说明,否则“或”的使用意指“和/或”。术语“包括”以及其他形式的使用不是限制性的。
[0267]
为了使本发明更容易理解,首先定义了某些术语。
[0268]
术语“核苷”是指与核糖或脱氧核糖共价连接的具有嘌呤或嘧啶碱基的分子。示例性核苷包括腺苷、鸟苷、胞苷、尿苷和胸苷。其他示例性核苷包括肌苷、1
‑
甲基肌苷、假尿苷、5,6
‑
二氢尿苷、核糖胸苷、2n
‑
甲基鸟苷和2,2n,n
‑
二甲基鸟苷(也称为“稀有”核苷)。术语“核苷酸”是指具有一个或更多个通过酯连接与糖部分连接的磷酸基团的核苷。示例性核苷酸包括核苷单磷酸、核苷二磷酸和核苷三磷酸。术语“多核苷酸”和“核酸分子”在本文中可互换使用,并指通过5’和3’碳原子之间的磷酸二酯或硫代磷酸酯连接而相连在一起的核苷酸的聚合物。
[0269]
术语“rna”或“rna分子”或“核糖核酸分子”是指核糖核苷酸的聚合物(例如,2、3、4、5、10、15、20、25、30或更多个核糖核苷酸)。术语“dna”或“dna分子”或“脱氧核糖核酸分子”是指脱氧核糖核苷酸的聚合物。可以天然地(例如,分别通过dna复制或dna转录)合成dna和rna。可以转录后修饰rna。也可以化学合成dna和rna。dna和rna可以是单链(即分别是ssrna和ssdna)或多链(例如双链,即分别是dsrna和dsdna)。“mrna”或“信使rna”是指定一个或更多个多肽链的氨基酸序列的单链rna。当核糖体与mrna结合时,这种信息在蛋白质合成期间被翻译。
[0270]
如本文所用,术语“小干扰rna”(“sirna”)(在本领域中也称为“短干扰rna”)指能够引导或介导rna干扰的包含约10至50个核苷酸(或核苷酸类似物)的rna(或rna类似物)。优选地,sirna包含约15至30个核苷酸或核苷酸类似物,更优选约16至25个核苷酸(或核苷酸类似物),甚至更优选约18至23个核苷酸(或核苷酸类似物),和甚至更优选约19至22个核苷酸(或核苷酸类似物)(例如,19、20、21或22个核苷酸或核苷酸类似物)。术语“短”sirna指包含约21个核苷酸(或核苷酸类似物),例如19、20、21或22个核苷酸的sirna。术语“长”sirna指包含约24至25个核苷酸,例如23、24、25或26个核苷酸的sirna。在某些情况下,短sirna可包含少于19个核苷酸,例如16、17或18个核苷酸,前提是较短的sirna保留介导rnai的能力。同样,在某些情况下,长sirna可包含超过26个核苷酸,前提是较长的sirna在没有进一步加工(例如酶加工)为短sirna的情况下保留介导rnai的能力。
[0271]
术语“核苷酸类似物”或“经改变核苷酸”或“经修饰核苷酸”是指非标准核苷酸,包括非天然存在的核糖核苷酸或脱氧核糖核苷酸。示例性核苷酸类似物在任意位置处被修饰以改变核苷酸的某些化学性质,但保留核苷酸类似物执行其预期功能的能力。可被衍生的核苷酸的位置的实例包括第5位,例如5
‑
(2
‑
氨基)丙基尿苷、5
‑
溴尿苷、5
‑
丙炔尿苷、5
‑
丙烯基尿苷等;第6位,例如6
‑
(2
‑
氨基)丙基尿苷;对于腺苷和/或鸟苷而言的第8位,例如8
‑
溴鸟苷、8
‑
氯鸟苷、8
‑
氟鸟苷等。核苷酸类似物还包括脱氮核苷酸,例如7
‑
脱氮腺苷;经o
‑
和n
‑
修饰的(例如烷基化的,例如n6
‑
甲基腺苷,或在其他情况下本领域已知的)核苷酸;以及其他杂环修饰的核苷酸类似物,例如herdewijn,antisense nucleic acid drug dev.,2000aug.10(4):297
‑
310中所述的那些。
[0272]
核苷酸类似物还可包含对核苷酸的糖部分的修饰。例如,2’oh
‑
基团可由选自h、or、r、f、cl、br、i、sh、sr、nh2、nhr、nr2或coor的基团取代,其中r为经取代或未经取代的c1‑
c6烷基、烯基、炔基、芳基等。其他可能的修饰包括在美国专利no.5,858,988和6,291,438中所述的那些。
[0273]
核苷酸的磷酸酯基团也可例如通过用硫(例如硫代磷酸酯)取代磷酸酯基团的一个或更多个氧来修饰,或通过进行其他允许核苷酸执行其预期功能的取代来修饰,所述功能例如在例如eckstein,antisense nucleic acid drug dev.2000apr.10(2):117
‑
21、rusckowski et al.antisense nucleic acid drug dev.2000oct.10(5):333
‑
45、stein,antisense nucleic acid drug dev.2001oct.11(5):317
‑
25、vorobjev et al.antisense nucleic acid drug dev.2001apr.11(2):77
‑
85和美国专利no.5,684,143中描述。上文提到的某些修饰(例如,磷酸酯基团修饰)优选地在体内或体外降低例如包含所述类似物的多核苷酸的水解速率。
[0274]
术语“寡核苷酸”是指核苷酸和/或核苷酸类似物的短聚合物。“rna类似物”是指与相应的未改变或未经修饰的rna相比,具有至少一个改变或经修饰核苷酸,但保留与相应的未改变或未经修饰的rna相同或相似的性质或功能的多核苷酸(例如,化学合成的多核苷酸)。如上文所讨论的,与具有磷酸二酯连接的rna分子相比,寡核苷酸可以用导致rna类似物水解速率较低的连接而相连。例如,类似物的核苷酸可包括亚甲基二醇、亚乙基二醇(ethylene diol)、氧甲基硫代、氧乙基硫代、氧羰基氧、二氨基磷酸酯、氨基磷酸酯和/或硫代磷酸酯连接。优选的rna类似物包括糖修饰和/或骨架修饰的核糖核苷酸和/或脱氧核糖核苷酸。这样的改变或修饰可进一步包括添加非核苷酸物质,例如添加至rna的末端或内部(在rna的一个或更多个核苷酸处)。rna类似物只需与天然rna充分相似,其具有介导rna干扰的能力。
[0275]
如本文所用,术语“rna干扰”(“rnai”)指rna的选择性胞内降解。rnai在细胞中天然存在以去除外源rna(例如,病毒rna)。天然rnai通过从游离dsrna上裂解的片段进行,这些片段将降解机制引导至其他类似的rna序列。或者,rnai可通过人工来引发,例如,以沉默靶基因的表达。
[0276]
具有“与靶mrna序列充分互补以指导靶标特异性rna干扰(rnai)”的链的rnai剂(例如rna沉默剂)意指该链具有足以通过rnai机制或过程触发对靶mrna的破坏的序列。
[0277]
如本文所用,术语“分离rna”(例如,“分离sirna”或“分离sirna前体”)指当通过重组技术产生时基本上不含其他细胞物质或培养基,或当化学合成时基本上不含化学前体或
其他化学物质的rna分子。
[0278]
如本文所用,术语“rna沉默”是指由rna分子介导的一组序列特异性调节机制(例如rna干扰(rnai)、转录基因沉默(transcriptional gene silencing,tgs)、转录后基因沉默(post
‑
transcriptional gene silencing,ptgs)、压抑(quelling)、共抑制和翻译抑制),其导致相应蛋白质编码基因表达的抑制或“沉默”。rna沉默已在许多类型的生物体,包括植物、动物和真菌中观察到。
[0279]
术语“区别性rna沉默”是指rna分子基本上抑制“第一”或“靶”多核苷酸序列的表达,而不基本上抑制“第二”或“非靶”多核苷酸序列的表达(例如,当两种多核苷酸序列存在于同一细胞中时)的能力。在某些实施方案中,靶多核苷酸序列对应于靶基因,而非靶多核苷酸序列对应于非靶基因。在另一些实施方案中,靶多核苷酸序列对应于靶等位基因,而非靶多核苷酸序列对应于非靶等位基因。在某些实施方案中,靶多核苷酸序列是编码靶基因调节区(例如启动子或增强子元件)的dna序列。在另一些实施方案中,靶多核苷酸序列是由靶基因编码的靶mrna。
[0280]
术语“体外”具有其领域公认的含义,例如涉及经纯化的试剂或提取物,例如细胞提取物。术语“体内”也具有其领域公认的含义,例如涉及活细胞,例如永生化细胞、原代细胞、细胞系和/或生物体中的细胞。
[0281]
如本文所用,术语“转基因”是指通过人工插入细胞中并成为从细胞发育而来的生物体的基因组的一部分的任何核酸分子。这样的转基因可包括与转基因生物体部分或全部异源(即外源)的基因,或者可代表与该生物体内源基因同源的基因。术语“转基因”还意指包含一个或更多个编码一个或更多个经改造rna前体的所选核酸序列(例如dna)的核酸分子,其将在转基因生物体(例如动物)中表达,与转基因动物部分或全部异源(即对于转基因动物外源),或与转基因动物的内源基因同源,但被设计为插入动物的基因组中与天然基因不同的位置处。转基因包括表达所选核酸序列所必需的一种或更多种启动子和任何其他dna(例如内含子),所有这些都与所选序列可操作地连接,并可包括增强子。
[0282]“参与”疾病或病症的基因包括其正常或异常表达或功能影响或者引起疾病或病症或者所述疾病或病症的至少一种症状的基因。
[0283]
如本文所使用的术语“功能获得性突变”是指基因中由所述基因编码的蛋白质(即突变蛋白质)获得通常与该蛋白质(即野生型蛋白质)不相关的功能导致或促成疾病或病症的任何突变。功能获得性突变可以是基因中引起所编码的蛋白质功能的改变的一个或更多个核苷酸的缺失、添加或替换。在一个实施方案中,功能获得性突变改变了突变蛋白质的功能或引起与其他蛋白质的相互作用。在另一个实施方案中,功能获得性突变例如通过经改变的突变蛋白与正常野生型蛋白质的相互作用引起所述正常野生型蛋白质的减少或去除。
[0284]
如本文所用,术语“靶基因”是其表达将被基本上抑制或“沉默”的基因。这种沉默可通过rna沉默,例如,通过裂解靶基因的mrna或靶基因的翻译抑制来实现。术语“非靶基因”是其表达不会被基本上沉默的基因。在一个实施方案中,靶基因和非靶基因的多核苷酸序列(例如,由靶基因和非靶基因编码的mrna)可以相差一个或更多个核苷酸。在另一个实施方案中,靶基因和非靶基因可在一个或更多个多态性(例如,单核苷酸多态性或snp)上不同。在另一个实施方案中,靶基因和非靶基因可共享少于100%的序列同一性。在另一个实施方案中,非靶基因可以是靶基因的同源物(例如直系同源物或旁系同源物)。
[0285]“靶等位基因”是其表达将被选择性抑制或“沉默”的等位基因(例如snp等位基因)。这种沉默可通过rna沉默,例如,通过sirna裂解靶基因或靶等位基因的mrna来实现。术语“非靶等位基因”是其表达不会被基本上沉默的等位基因。在某些实施方案中,靶等位基因和非靶等位基因可对应于同一靶基因。在另一些实施方案中,靶等位基因对应于靶基因或与靶基因相关,并且非靶等位基因对应于非靶基因或与非靶基因相关。在一个实施方案中,靶等位基因和非靶等位基因的多核苷酸序列可以相差一个或更多个核苷酸。在另一个实施方案中,靶等位基因和非靶等位基因可在一个或更多个等位基因多态性(例如,一个或更多个snp)上不同。在另一个实施方案中,靶等位基因和非靶等位基因可共享少于100%的序列同一性。
[0286]
本文使用的术语“多态性”是指当比较来自不同来源或对象(但来自同一生物体)的相同基因序列时鉴定或检测到的基因序列中的变异(例如,一个或更多个缺失、插入或替换)。例如,当比较来自不同对象的相同基因序列时,可以鉴定多态性。这样的多态性的鉴定在本领域是常规的,该其方法学与用于检测例如乳腺癌点突变的方法学相似。例如,可以从对象的淋巴细胞中提取的dna进行鉴定,随后使用对所述多态性区域的特异性引物扩增多态性区域。或者,当比较相同基因的两个等位基因时,可以鉴定多态性。在一些具体实施方案中,多态性为单核苷酸多态性(single nucleotide polymorphism,snp)。
[0287]
生物体内同一基因的两个等位基因之间的序列变异在本文中称为“等位基因多态性”。在某些实施方案中,等位基因多态性对应于snp等位基因。例如,等位基因多态性可包括snp的两个等位基因之间的单核苷酸变异。多态性可在编码区内的核苷酸处,但由于基因密码的简并性,编码的氨基酸序列没有变化。或者,多态性序列可在特定位置处编码不同的氨基酸,但氨基酸的变化不影响蛋白质功能。多态性区域也可以在基因的非编码区中发现。在一些示例性实施方案中,多态性在基因的编码区或基因的非翻译区(例如,5’utr或3’utr)中发现。
[0288]
如本文所用,术语“等位基因频率”是个体群体中单个基因座处等位基因(例如snp等位基因)的相对频率的量度(例如,比例或百分比)。例如,如果个体群体在其每个体细胞中携带特定染色体基因座(以及占据该基因座的基因)的n个基因座,则等位基因的等位基因频率是该等位基因在该群体内占据的基因座的分数或百分比。在一些具体实施方案中,等位基因(例如snp等位基因)的等位基因频率在样本群体中为至少10%(例如,至少15%、20%、25%、30%、35%、40%或更多)。
[0289]
如本文所用,术语“样本群体”是指包含统计上显著数量的个体的群体。例如,样本群体可包含50、75、100、200、500、1000或更多个个体。在一些具体实施方案中,样本群体可包含至少在常见疾病表型(例如,功能获得性病症)或突变(例如,功能获得性突变)上共享的个体。
[0290]
如本文所用,术语“杂合度”是指群体中在特定基因座处(例如,在snp处)杂合(例如,含有两种或更多种不同等位基因)的个体的分数。可使用本领域技术人员公知的方法计算样本群体的杂合度。
[0291]
如本文所使用的术语“多聚谷氨酰胺结构域”是指由与肽键连接的连续谷氨酰胺残基组成的蛋白质区段或结构域。在一个实施方案中,连续区包含至少5个谷氨酰胺残基。
[0292]
如本文所使用的术语“扩增多聚谷氨酰胺结构域”或“扩增多聚谷氨酰胺区段”是
指包含至少35个通过肽键连接的连续谷氨酰胺残基的蛋白质区段或结构域。如本文所述,无论患有多聚谷氨酰胺病症的对象是否显示出表现出症状,都可在对象中发现这样的扩增区段。
[0293]
如本文所使用的术语“三核苷酸重复”或“三核苷酸重复区”是指由特定三核苷酸序列的连续重复组成的核酸序列区段。在一个实施方案中,三核苷酸重复包括至少5个连续三核苷酸序列。示例性三核苷酸序列包括但不限于cag、cgg、gcc、gaa、ctg和/或cgg。
[0294]
如本文所使用的术语“三核苷酸重复疾病”是指以位于基因内的扩增三核苷酸重复区为特征的任何疾病或病症,扩增三核苷酸重复区是该疾病或病症的原因。三核苷酸重复疾病的实例包括但不限于脊髓
‑
小脑型共济失调12型脊髓
‑
小脑型共济失调8型、脆性x综合征、脆性xe精神发育迟缓、弗里德里希共济失调和强直性肌营养不良。根据本发明的用于治疗的示例性三核苷酸重复疾病是由基因(该基因编码引起该疾病或病症或者是该疾病或病症的起因的突变蛋白质)的编码区5’端处的扩增三核苷酸重复区所表征或引起的疾病。某些三核苷酸疾病,例如脆性x综合征,其中突变与编码区无关,可能不适合根据本发明的方法进行治疗,因为没有合适的通过rnai靶向的mrna。相反,例如弗里德里希共济失调的疾病可适合根据本发明的方法进行治疗,因为尽管致病突变不在编码区内(即,位于内含子内),但突变可能在例如mrna前体(例如,预剪接mrna前体)内。
[0295]“检查细胞或生物体中基因的功能”一词指检查或研究由此产生的表达、活性、功能或表型。
[0296]
如本文所用,术语“rna沉默剂”是指能够抑制或“沉默”靶基因表达的rna。在某些实施方案中,rna沉默剂能够通过转录后沉默机制阻止mrna分子的完全加工(例如,完全翻译和/或表达)。rna沉默剂包括小(<50b.p.)、非编码rna分子,例如包含成对链的rna双链体,以及可从中产生这样的小非编码rna的前体rna。示例性rna沉默剂包括sirna、mirna、sirna样双链体、反义寡核苷酸、间隔聚体分子和双功能寡核苷酸及其前体。在一个实施方案中,rna沉默剂能够诱导rna干扰。在另一个实施方案中,rna沉默剂能够介导翻译抑制。
[0297]
如本文所用,术语“稀有核苷酸”是指不常存在的天然存在的核苷酸,包括不常存在的天然存在的脱氧核糖核苷酸或核糖核苷酸,例如,不是鸟苷、腺苷、胞嘧啶或尿苷的天然存在的核糖核苷酸。稀有核苷酸的实例包括但不限于肌苷、1
‑
甲基肌苷、假尿苷、5,6
‑
二氢尿苷、核糖胸苷、2n
‑
甲基鸟苷和2,2n,n
‑
二甲基鸟苷。
[0298]
术语“经改造”,如在经改造rna前体或经改造核酸分子中,表示在自然界中未发现该前体或分子,因为该前体或分子的全部或部分核酸序列是由人创造或选择的。一旦被创造或选择,序列就可以被复制、翻译、转录或在其他情况下通过细胞内的机制进行加工。因此,由包含经改造核酸分子的转基因在细胞内产生的rna前体是经改造rna前体。
[0299]
本文使用的术语“微小rna”(“mirna”)在本领域中也称为“时序小rna”(“small temporal rna,strna”),其是指经遗传编码的(例如,被病毒、哺乳动物或植物基因组编码的)并且能够指导或介导rna沉默的小(10至50个核苷酸)rna。“mirna病症”是指以mirna的表达或活性异常为特征的疾病或病症。
[0300]
如本文所用,术语“双功能寡核苷酸”是指具有式t
‑
l
‑
μ的rna沉默剂,其中t为mrna靶向部分,l为连接部分,μ为mirna募集部分。如本文所用,术语“mrna靶向部分”或“靶向部分”是指双功能寡核苷酸的结构域、部分或区域,其具有足够的尺寸并与被选择或靶向用于
沉默的mrna的一部分或区域(即,该部分具有足以捕获靶mrna的序列)具有足够的互补性。如本文所用,术语“连接部分(linking moiety)”或“连接部分(linking portion)”是指共价结合或连接mrna的rna沉默剂的结构域、一部分或区域。
[0301]
如本文所用,术语rna沉默剂(例如,sirna或rna沉默剂)的“反义链”是指与被靶向以沉默的基因的mrna的约10至50个核苷酸(例如,约15至30、16至25、18至23或19至22个核苷酸)的片段基本上互补的链。反义链或第一链具有序列,该序列与期望靶mrna序列充分互补以指导靶特异性沉默,例如,互补性足以触发通过rnai机制或过程(rnai干扰)对期望靶mrna的破坏或者互补性足以触发期望靶mrna的翻译抑制。
[0302]
术语rna沉默剂(例如,sirna或rna沉默剂)的“有义链”或“第二链”是指与反义链或第一链互补的链。反义链和有义链也可称为第一链或第二链,第一链或第二链与靶序列具有互补性,并且相应的第二或第一链与所述第一或第二链具有互补性。mirna双链中间体或sirna样双链体包括与被靶向以沉默的基因的mrna的约10至50个核苷酸的片段具有充分互补性的mirna链和具有充分互补性以与所述mirna链形成双链体的mirna*链。
[0303]
如本文所用,术语“向导链”是指进入risc复合物并指导靶mrna裂解的rna沉默剂链,例如,sirna双链体的反义链或sirna序列。
[0304]
如本文所用,术语“不对称性”,如rna沉默剂的双链体区域(例如,shrna的茎)的不对称性,是指rna沉默剂末端之间(例如,在第一链或茎部分的末端核苷酸和相对的第二链或茎部分的末端核苷酸之间)的键强度或碱基配对强度的不等,使得双链体的一条链的5’端比互补链的5’端更频繁地处于瞬时未配对(例如单链)状态。这种结构差异决定了双链体的一条链优先并入risc复合物中。其5’端与互补链的配对不太紧密的链将优先被并入risc中并介导rnai。
[0305]
如本文所用,术语“键强度”或“碱基对强度”是指寡核苷酸双链体(例如sirna双链体)的相对链上的核苷酸对(或核苷酸类似物对)之间相互作用的强度,主要由于所述核苷酸(或核苷酸类似物)之间的氢键、范德华相互作用等。
[0306]
如本文所用,“5’端”,如在反义链的5’端中,是指5’端核苷酸,例如,在反义链5’端处的1至约5个核苷酸之间。如本文所用,“3’端”,如在有义链的3’端中,是指与互补反义链的5’端的核苷酸互补的区域,例如,介于1至约5个核苷酸之间的区域。
[0307]
如本文所用,术语“去稳定核苷酸”是指能够与第二核苷酸或核苷酸类似物形成碱基对,使得该碱基对的键强度低于常规碱基对(即沃森
‑
克里克碱基对)的第一核苷酸或核苷酸类似物。在某些实施方案中,去稳定核苷酸能够与第二核苷酸形成错配碱基对。在另一些实施方案中,去稳定核苷酸能够与第二核苷酸形成摆动碱基对。在另一些实施方案中,去稳定核苷酸能够与第二核苷酸形成模糊碱基对。
[0308]
如本文所用,术语“碱基对”是指寡核苷酸双链体(例如,由rna沉默剂链和靶mrna序列形成的双链体)的相对链上的核苷酸(或核苷酸类似物对)之间的相互作用,主要由于所述核苷酸(或核苷酸类似物)之间的氢键、范德华相互作用等。如本文所用,术语“键强度”或“碱基对强度”是指碱基对的强度。
[0309]
如本文所用,术语“错配碱基对”是指由非互补或非沃森
‑
克里克碱基对,例如,非正常互补g:c、a:t或a:u碱基对组成的碱基对。如本文所用术语“模糊碱基对”(也称为非歧视性碱基对(non
‑
discriminatory base pair))是指由通用核苷酸形成的碱基对。
[0310]
如本文所用,术语“通用核苷酸”(也称为“中性核苷酸”)包括具有在形成碱基对时不显著区分互补多核苷酸上的碱基的碱基(“通用碱基”或“中性碱基”)的那些核苷酸(例如某些去稳定核苷酸)。通用核苷酸主要是疏水性分子,由于堆积相互作用它们可有效地组装成反平行双链体核酸(例如,双链dna或rna)。通用核苷酸的碱基部分通常包含含氮芳香杂环部分。
[0311]
如本文所用,术语“充分互补性”或“互补性的充分程度”意指rna沉默剂具有足以分别结合期望的靶rna并触发靶mrna的rna沉默的序列(例如,在反义链、mrna靶向部分或mirna募集部分中)。
[0312]
如本文所用,术语“翻译抑制”是指对rna翻译的选择性抑制。天然翻译抑制通过从shrna前体裂解的mirna进行。rnai和翻译抑制二者均由risc介导。rnai和翻译抑制均是天然存在的或者可以由人工引发,例如,以沉默靶基因的表达。
[0313]
本发明的多种方法学包括涉及将值、水平、特性、特征、属性等与“合适对照”进行比较的步骤,在本文中可互换地称为“适当对照”。“合适对照”或“适当对照”是本领域普通技术人员熟悉的可用于比较目的的任何对照或标准。在一个实施方案中,如本文所述,“合适对照”或“适当对照”是在进行rnai方法学之前确定的值、水平、特性、特征、属性等。例如,在将本发明的rna沉默剂引入细胞或生物体中之前,可以确定转录速率、mrna水平、翻译速率、蛋白质水平、生物活性、细胞特征或属性、基因型、表型等。在另一个实施方案中,“合适对照”或“适当对照”是在表现出例如正常特征的细胞或生物体(例如,对照或正常细胞或生物体)中确定的值、水平、特性、特征、属性等。在另一个实施方案中,“合适对照”或“适当对照”是预限定的值、水平、特性、特征、属性等。
[0314]
除非另有定义,否则本文中使用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常理解的相同含义。尽管与本文中描述的方法和材料类似或等同的方法和材料可用于本发明的实践或测试中,但是下文描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献均通过引用整体并入本文。在冲突的情况下,以本说明书(包括定义)为准。另外,材料、方法和实例仅是举例说明性的并非意图进行限制。
[0315]
在以下小节中进一步详细描述本发明的多个方面。
[0316]
i.新的靶序列
[0317]
在某些示例性实施方案中,本发明的rna沉默剂能够靶向表1、2或7中所述的apoe mrna靶标。在某些示例性实施方案中,本发明的rna沉默剂能够靶向5’guuuaauaaagauucaccaaguuuccacgcaaa3’。在某些示例性实施方案中,本发明的rna沉默剂能够靶向靶序列5’gauucaccaaguuua3’和5’caaguuucacgcaa中的一个或更多个。在某些示例性实施方案中,本发明的rna沉默剂能够靶向5’uggacccuaguuuaauaaagauucaccaag3’。在某些示例性实施方案中,本发明的rna沉默剂能够靶向靶序列5’ccuaguuuaauaaagauuca3’。
[0318]
例如,可在ncbi维护的公众可获得的数据库中找到每个靶序列的基因组序列。
[0319]
ii.sirna设计
[0320]
在一些实施方案中,sirna设计如下。首先,选择靶基因(例如,apoe基因)的一部分,例如,表1、表2或表7中所示的一个或更多个靶序列。这些位点处的mrna裂解应消除相应蛋白质的翻译。有义链基于靶序列设计。(参见图3a)。优选地,该部分(和相应的有义链)包含约19至25个核苷酸,例如,19、20、21、22、23、24或25个核苷酸。更优选地,该部分(和相应
的有义链)包含21、22或23个核苷酸。然而,本领域技术人员将认识到,长度小于19个核苷酸或大于25个核苷酸的sirna也可以起到介导rnai的作用。因此,这样的长度的sirna也在本发明的范围内,前提是它们保留了介导rnai的能力。已证明较长的rnai剂可在某些哺乳动物细胞中引发可能是不期望的干扰素或pkr响应。优选地,本发明的rnai剂不引发pkr响应(即,具有足够短的长度)。然而,较长的rnai剂可例如在不能产生pkr响应的细胞类型中,或在pkr响应已被下调或通过替代手段抑制的情况下有用。
[0321]
有义链序列被设计为使得靶序列基本上在链的中间。在某些情况下,将靶序列移动到偏离中心位置可能降低通过sirna裂解的效率。如果检测到野生型mrna的关闭沉默(off
‑
silencing),则可能期望使用这样的组合物,即效率较低的组合物。
[0322]
反义链通常与有义链长度相同,并包含互补核苷酸。在一个实施方案中,链是完全互补的,即,当比对或退火时,链是平末端的。在另一个实施方案中,链包含比对或退火,以产生1
‑
、2
‑
、3
‑
、4
‑
、5
‑
、6
‑
或7
‑
核苷酸突出端,即,有义链的3’端的延伸比反义链的5’端长1、2、3、4、5、6或7个核苷酸,和/或反义链的3’端的延伸比有义链的5’端长1、2、3、4、5、6或7个核苷酸。突出端可包含与靶基因序列(或其互补序列)相对应的核苷酸(或由其组成)。或者,突出端可以包含脱氧核糖核苷酸(例如dt),或核苷酸类似物,或其他合适的非核苷酸物质(或者由其组成)。
[0323]
为了促进反义链进入risc(从而提高或改善靶标裂解和沉默的效率),有义链的5’端和反义链的3’端之间的碱基对强度可以改变,例如减少或降低,如美国专利no.7,459,547、7,772,203和7,732,593,标题为“methods and compositions for controlling efficacy of rna silencing”(2003年6月2日提交)和美国专利no.8,309,704、7,750,144、8,304,530、8,329,892和8,309,705,标题为“methods and compositions for enhancing the efficacy and specificity of rnai”(2003年6月2日提交)中详细描述的,其内容通过引用整体并入。在本发明这些方面的一个实施方案中,由于第一或反义链的5’端和第二或有义链的3’端之间的g:c碱基对少于第一或反义链的3’端和第二或有义链的5’端之间的g:c碱基对,因此碱基对强度较小。在另一个实施方案中,由于第一或反义链的5’端和第二或有义链的3’端之间至少有一个错配碱基对,因此碱基对强度较小。在某些示例性实施方案中,错配碱基对选自g:a、c:a、c:u、g:g、a:a、c:c和u:u。在另一个实施方案中,由于在第一或反义链的5’端和第二或有义链的3’端之间至少有一个摆动碱基对,例如g:u,因此碱基对强度较小。在另一个实施方案中,由于至少一个碱基对包含稀有核苷酸,例如肌苷(i),因此碱基对强度较小。在某些示例性实施方案中,碱基对选自i:a、i:u和i:c。在又一个实施方案中,由于至少一个碱基对包含经修饰核苷酸,因此碱基对强度较小。在某些示例性实施方案中,经修饰核苷酸选自2
‑
氨基
‑
g、2
‑
氨基
‑
a、2,6
‑
二氨基
‑
g和2,6
‑
二氨基
‑
a。
[0324]
下面详细描述适合于靶向图3所示的apoe靶序列的sirna的设计。sirna可根据以上示例性教导针对apoe基因中发现的任何其他靶序列设计。此外,该技术适用于靶向任何其他靶序列,例如,非致病性靶序列。
[0325]
为了验证sirna破坏mrna(例如apoe mrna)的有效性,sirna可与cdna(例如apoe cdna)在基于果蝇的体外mrna表达体系中孵育。在琼脂糖凝胶上通过放射自显影法检测到用
32
p放射性标记的新合成的mrna(例如apoe mrna)。经裂解mrna的存在表明mrna核酸酶活性。合适的对照包括省略sirna。或者,选择与所选的sirna具有相同核苷酸组成,但与适当
的靶基因没有显著的序列互补性的对照sirna。这样的阴性对照可通过随机干扰所选的sirna的核苷酸序列来设计;可进行同源性检索以确保阴性对照与适当基因组中的任何其他基因缺乏同源性。此外,可通过在序列中引入一个或更多个碱基错配来设计阴性对照sirna。选择导致最佳的mrna特异性和最大的mrna裂解的sirna
‑
mrna互补位点。
[0326]
iii.rnai剂
[0327]
本发明包括例如如上所述设计的sirna分子。本发明的sirna分子可以化学合成,或者可由dna模板在体外转录,或者由例如shrna在体内转录,或者通过使用重组人dicer酶将体外转录的dsrna模板裂解成介导rnai的20
‑
、21
‑
或23
‑
bp双链体rna的池。sirna分子可使用本领域已知的任何方法进行设计。
[0328]
在一个方面中,rnai剂可编码干扰核糖核酸(例如,如上文所述的shrna),而不是rnai剂作为干扰核糖核酸(例如,如上文所述的sirna或shrna)。换句话说,rnai剂可以是干扰核糖核酸的转录模板。因此,本发明的rnai剂还可包括小发夹rna(shrna)和经改造以表达shrna的表达构建体。shrna的转录起始于聚合酶iii(pol iii)启动子,并且被认为终止于4
‑5‑
胸腺嘧啶的转录终止位点的第2位。表达后,shrna被认为折叠成具有3’uu
‑
突出端的茎
‑
环结构;随后,这些shrna的末端被加工,将shrna转化为约21至23个核苷酸的sirna样分子(brummelkamp et al.,2002;lee et al.,2002,上文;miyagishi et al.,2002;paddison et al.,2002,上文;paul et al.,2002,上文;sui et al.,2002上文;yu et al,2002,上文。有关shrna设计和使用的更多信息可见于互联网上的以下地址处:katandin.cshl.org:9331/rnai/docs/bseri
‑
bamhi_strategy.pdf和katandin.cshl.org:9331/rnai/docs/web_version_of_pcr_strategy1.pdf)。
[0329]
本发明的表达构建体包括适合在适当表达体系中使用的任何构建体,并包括但不限于本领域已知的逆转录病毒载体、线性表达盒、质粒和病毒或病毒来源的载体。这样的表达构建体可包括一个或更多个可诱导启动子、rna pol iii启动子体系,例如u6 snrna启动子或h1 rna聚合酶iii启动子或本领域已知的其他启动子。构建体可包括一条或两条sirna链。表达两条链的表达构建体也可包括连接两条链的环结构,或每条链可从同一构建体内的不同启动子分别转录。每条链也可由不同的表达构建体转录。(tuschl,t.,2002,上文)。
[0330]
合成的sirna可通过本领域已知的方法(包括阳离子脂质体转染和电穿孔)递送到细胞中。为了获得对靶基因(例如,apoe基因)的较长期抑制并且为了在某些情况下促进递送,可由重组dna构建体在细胞内表达一种或更多种sirna。由重组dna构建体在细胞内表达sirna双链体以允许细胞中较长期的靶基因抑制的这样的方法是本领域已知的,包括哺乳动物pol iii启动子体系(例如,能够表达功能性双链sirna的h1或u6/snrna启动子体系(tuschl,t.,2002,上文);(bagella et al.,1998;lee et al.,2002,上文;miyagishi et al.,2002,上文;paul et al,2002,上文;yu et a1.,2002,上文;sui et a1.,2002,上文)。rna pol iii的转录终止发生在dna模板中四个连续t残基的运行时,提供了在特定序列处结束sirna转录的机制。sirna在5
’‑3’
和3
’‑5’
方向上与靶基因的序列互补,并且sirna的两条链可在同一构建体或不同的构建体中表达。发夹sirna由h1或u6 snrna启动子驱动并在细胞中表达,可抑制靶基因表达(bagella et al.,1998;lee et al,2002,上文;miyagishi et al.,2002,上文;paul et a1.,2002,上文;yu et al.,2002),上文;sui et al,2002,上文)。当与表达t7rna聚合酶的载体共转染到细胞中时,含有t7启动子控制下的sirna序列的
构建体也产生功能性sirna(jacque et al.,2002,上文)。单个构建体可包含编码sirna的多个序列,例如编码apoe的基因、靶向相同基因或多个基因的多个区域,并且可例如由不同的poliii启动子位点驱动。
[0331]
动物细胞表达一系列约22个核苷酸的非编码rna,称为微小rna(mirna),其可在动物发育期间在转录后水平或翻译水平上调节基因表达。mirna的一个普遍特征是其全部从约70个核苷酸的前体rna茎
‑
环上切离,可能是通过dicer(iii型rna酶)或其同源物切离。通过用与靶mrna互补的序列替换mirna前体的茎序列,表达经改造前体的载体构建体可用于产生sirna,以引发针对哺乳动物细胞中特定mrna靶标的rnai。(zeng et al,2002,上文)。当通过含有聚合酶iii启动子的dna载体表达时,微小rna设计的发夹可沉默基因表达(mcmanus et al,2002,上文)。在没有sirna介导的基因沉默的情况下,靶向多态性的微小rna也可用于阻断突变蛋白质的翻译。这样的应用可用于例如经设计的sirna引起野生型蛋白质的脱靶沉默的情况。
[0332]
病毒介导的递送机制也可用于通过表达sirna诱导靶基因的特异性沉默,例如,通过在rna pol ii启动子转录控制下产生含有sirna的重组腺病毒(xia et al,2002,上文)。通过这些重组腺病毒感染hela细胞允许降低内源性靶基因表达。将重组腺病毒载体注射到表达sirna靶基因的转基因小鼠中导致体内靶基因表达降低。同上。在动物模型中,全胚胎电穿孔可有效地向植入后的小鼠胚胎中有效地递送合成的sirna(calegari et al,2002)。在成年小鼠中,可以通过“高压”递送技术(通过尾静脉向动物快速注射(在5秒内)大体积的含有sirna的溶液)来实现sirna的有效递送(liu et al,1999,上文;mccaffrey et al,2002,上文;lewis et al,2002。纳米颗粒和脂质体也可用于将sirna递送到动物中。在某些示例性实施方案中,重组腺相关病毒(raav)及其相关载体可用于将一种或更多种sirna递送到细胞,例如神经细胞(例如脑细胞)中(美国专利申请2014/0296486、2010/0186103、2008/0269149、2006/0078542和2005/0220766)。
[0333]
本发明的核酸组合物包括本领域已知的未经修饰的sirna和经修饰的sirna二者,例如交联的sirna衍生物或具有连接的非核苷酸部分(例如与其3’或5’端连接)的衍生物。与相应的sirna相比,以这种方式修饰sirna衍生物可提高所得sirna衍生物的细胞摄取或增强其细胞靶向活性,可用于追踪细胞中的sirna衍生物,或与相应的sirna相比提高sirna衍生物的稳定性。
[0334]
如本文所述,将经改造rna前体引入细胞或整个生物体中将导致产生期望的sirna分子。这样的sirna分子将接下来与rnai途径的内源性蛋白质组分缔合并靶向特定的mrna序列进行裂解和破坏。以这种方式,由经改造rna前体产生的sirna所靶向的mrna将从细胞或生物体中耗尽,导致细胞或生物体中由该mrna编码的蛋白质浓度降低。rna前体通常是单独编码dsrna的一条链或编码rna发夹环结构的整个核苷酸序列的核酸分子。
[0335]
本发明的核酸组合物可以是非缀合的,或者可以与另外的部分(例如纳米颗粒)缀合以增强组合物的特性,例如药动学参数,例如吸收、效力、生物利用度和/或半衰期。缀合可通过本领域已知的方法实现,例如使用lambert et al.,drug deliv.rev.:47(1),99
‑
112(2001)(描述了装载到聚氰基丙烯酸烷基酯(paca)纳米颗粒上的核酸);fattal et al.,j.control release 53(1
‑
3):137
‑
43(1998)(描述了与纳米颗粒结合的核酸);schwab et al.,ann.oncol.5suppl.4:55
‑
8(1994)(描述了与嵌入剂、疏水基团、聚阳离子或paca纳
端起1至7位处的核苷酸通过硫代磷酸酯连接而与相邻核苷酸相连。
[0346]
在第二方面中,本文提供了包含第一寡核苷酸和第二寡核苷酸的双链、经化学修饰的核酸,其中:(1)第一寡核苷酸是本文所述的寡核苷酸(例如,包含图3a的靶序列之一);(2)第一寡核苷酸的一部分与第二寡核苷酸的一部分互补;(3)第二寡核苷酸包含交替的2
’‑
甲氧基
‑
核糖核苷酸和2
’‑
氟
‑
核糖核苷酸;(4)从第二寡核苷酸的3’端起的第2和14位处的核苷酸为2
’‑
甲氧基
‑
核糖核苷酸,以及(5)第二寡核苷酸的核苷酸通过磷酸二酯或硫代磷酸酯连接而相连。
[0347]
在第三方面中,本文提供了具有以下结构的寡核苷酸:
[0348]
x
‑
a(
‑
l
‑
b
‑
l
‑
a)j(
‑
s
‑
b
‑
s
‑
a)r(
‑
s
‑
b)t
‑
or
[0349]
其中:x是5’磷酸酯基团,a在每次出现时独立地是2
’‑
甲氧基
‑
核糖核苷酸;b在每次出现时独立地是2
’‑
氟
‑
核糖核苷酸;l在每次出现时独立地是磷酸二酯或硫代磷酸酯接头;s是硫代磷酸酯接头;以及r选自氢和加帽基团(例如,酰基,例如乙酰基);j是4、5、6或7,r是2或3;以及t是0或1。
[0350]
在第四方面中,本文提供了包含第一寡核苷酸和第二寡核苷酸的双链、经化学修饰的核酸,其中:(1)第一寡核苷酸选自第三方面的寡核苷酸,(2)第一寡核苷酸的一部分与第二寡核苷酸的一部分互补;以及(3)第二寡核苷酸具有以下结构:
[0351]
c
‑
l
‑
b(
‑
s
‑
a
‑
s
‑
b)m’(
‑
p
‑
a
‑
p
‑
b)n’(
‑
p
‑
a
‑
s
‑
b)q’(
‑
s
‑
a)r’(
‑
s
‑
b)t
’‑
or
[0352]
其中:c是疏水分子;a在每次出现时独立地是2
’‑
甲氧基
‑
核糖核苷酸;b在每次出现时独立地是2
’‑
氟
‑
核糖核苷酸;l是包含一个或更多个选自以下的部分的接头:乙二醇的0至4个重复单元、磷酸二酯和硫代磷酸酯;s是硫代磷酸酯接头;p是磷酸二酯接头;r选自氢和加帽基团(例如,酰基,例如乙酰基);m’是0或1;n’是4、5或6;q’是0或1;r’是0或1;以及t’是0或1。
[0353]
a)抗apoe sirna分子的设计
[0354]
本发明的sirna分子是由有义链和互补反义链组成的双链体,反义链与apoe mrna具有足够的互补性以介导rnai。优选地,sirna分子具有约10至50或更多个核苷酸的长度,即,每条链包含10至50个核苷酸(或核苷酸类似物)。更优选地,sirna分子在每条链中具有约15至30个核苷酸的长度,例如15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸的长度,其中一条链与靶区域充分互补。优选地,比对链以使链末端至少有1个、2个或3个碱基未比对(即,在相反的链中没有互补碱基),以使当链退火时双链体的一端或两端出现1个、2个或3个残基的突出端。优选地,sirna分子具有约10至50或更多个核苷酸的长度,即,每条链包含10至50个核苷酸(或核苷酸类似物)。更优选地,sirna分子在每条链中具有约15至30个核苷酸的长度,例如15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸的长度,其中一条链与靶序列基本上互补,另一条链与第一链相同或基本相同。
[0355]
通常来说,sirna可通过使用本领域已知的任何方法来设计,例如,通过使用以下方案:
[0356]
1.sirna应对靶序列,例如,图3a所示的靶序列具有特异性。在一个实施方案中,在野生型apoe等位基因中发现靶序列。在另一个实施方案中,在突变apoe等位基因和野生型apoe等位基因二者中均发现靶序列。在另一个实施方案中,在野生型apoe等位基因中发现靶序列。第一链应与靶序列互补,并且另一条链与第一链基本上互补。(对于示例性的有义
和反义链,参见图3。)示例性的靶序列从靶基因的5’非翻译区(5
’‑
utr)选择。这些位点处的mrna裂解应消除相应apoe蛋白的翻译。来自apoe基因其他区域的靶序列也适用于靶向。基于靶序列设计了有义链。此外,g/c含量较低(35至55%)的sirna可能比g/c含量高于55%的sirna更具活性。因此,在一个实施方案中,本发明包括具有35至55%g/c含量的核酸分子。
[0357]
2.sirna的有义链是基于所选的靶位点的序列设计的。优选地,有义链包括约19至25个核苷酸,例如,19、20、21、22、23、24或25个核苷酸。更优选地,有义链包括21、22或23个核苷酸。然而,本领域技术人员将认识到,长度小于19个核苷酸或大于25个核苷酸的sirna也可以起到介导rnai的作用。因此,这样的长度的sirna也在本发明的范围内,前提是它们保留介导rnai的能力。已证明较长的rna沉默剂可在某些哺乳动物细胞中引发可能是不期望的干扰素或蛋白激酶r(pkr)响应。优选地,本发明的rna沉默剂不引发pkr响应(即,具有足够短的长度)。然而,更长的rna沉默剂可能是有用的,例如,在不能产生pkr响应的细胞类型中,或在pkr响应已被下调或通过替代手段抑制的情况下。
[0358]
本发明的sirna分子与靶序列具有足够的互补性,使得sirna可以介导rnai。通常来说,优选含有与靶基因的靶序列部分充分相同以影响risc介导的靶基因裂解的核苷酸序列的sirna。因此,在优选实施方案中,sirna的有义链被设计为具有与靶标的一部分充分相同的序列。例如,有义链可与靶位点具有100%同一性。但是,100%同一性是不需要的。优选有义链和靶rna序列之间大于80%的同一性,例如,80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或甚至100%的同一性。本发明的优点是能够容忍某些序列变异以提高rnai的效率和特异性。在一个实施方案中,有义链具有4、3、2、1或0个与靶区域错配的核苷酸,并且另一链与第一链相同或基本上相同,所述靶区域例如野生型和突变等位基因之间至少有一个碱基对不同的靶区域,例如,包含功能获得性突变的靶区域。此外,具有1或2个核苷酸的小插入或缺失的sirna序列也可有效地介导rna。或者,具有核苷酸类似物替换或插入的sirna序列可对抑制有效。
[0359]
序列同一性可通过本领域已知的序列比较和比对算法来确定。为了确定两个核酸序列(或者两个氨基酸序列)的百分比同一性,对序列进行用于最佳比较目的的比对(例如,可在第一序列或第二序列中引入空位(gap)用于最佳比对)。然后,比较相应核苷酸(或氨基酸)位置处的核苷酸(或氨基酸残基)。当第一序列中的位置被与第二序列中的相应位置相同的残基占据时,则分子在该位置处是相同的。两个序列之间的同一性百分比是序列共享的相同位置数的函数(即,%同源性=相同位置数/位置总数
×
100),任选地对引入的空位数和/或引入的空位长度进行罚分。
[0360]
两个序列之间的序列比较和同一性百分比的确定可使用数学算法来完成。在一个实施方案中,在经比对序列具有充分的同一性的某些部分上产生比对,而不是在具有低同一性程度的部分上产生比对(即,局部比对)。用于序列比较的局部比对算法的一个优选、非限制性实例是karlin和altschul(1990)proc.natl.acad.sci.usa 87:2264
‑
68的算法,如karlin和altschul(1993)proc.natl.acad.sci.usa 90:5873
‑
77中进行修改。这样的算法被并入altschul,et al.(1990)j.mol.biol.215:403
‑
10的blast程序(2.0版)中。
[0361]
在另一个实施方案中,通过引入适当的空位来优化比对,并在比对的序列的长度上确定同一性百分比(即,空位比对)。出于比较目的,可以如altschul et al.(1997)
nucleic acids res.25(17):3389
‑
3402中所述使用空位blast(gapped blast)以获得有空位的比对。在另一个实施方案中,通过引入适当的空位来优化比对,并且在比对的序列的整个长度上确定百分比同一性(即,全局比对)。用于序列全局比较的数学算法的一个优选、非限制性实例是myers和miller,cabios(1989)的算法。这样的算法被编入align程序(版本2.0),该程序是gcg序列比对软件包的一部分。当利用align程序比较氨基酸序列时,可以使用pam120权重残基表,空位长度罚分12和空位罚分4。
[0362]
3.sirna的反义或向导链通常与有义链长度相同,并包括互补核苷酸。在一个实施方案中,向导链和有义链是完全互补的,即,当比对或退火时,链是平末端的。在另一个实施方案中,sirna链可以以使得具有1至7(例如,2、3、4、5、6或7)或1至4(例如,2、3或4)个核苷酸的3’突出端的方式配对。突出端可以包含与靶基因序列(或其互补序列)相对应的核苷酸(或由其组成)。或者,突出端可以包含脱氧核糖核苷酸(例如dt),或核苷酸类似物,或其他合适的非核苷酸物质(或者由其组成)。因此,在另一个实施方案中,核酸分子可具有2个核苷酸(例如tt)的3’突出端。突出端核苷酸可以是rna或dna。如上所述,期望选择其中突变体:野生型错配为嘌呤:嘌呤错配的靶区域。
[0363]
4.使用本领域已知的任何方法,将潜在靶标与适当的基因组数据库(人、小鼠、大鼠等)进行比较,并从考虑中排除与其他编码序列具有显著同源性的任何靶序列。用于这样的序列同源性检索的一种这样的方法称为blast,其可在美国国家生物技术信息中心网站处获得。
[0364]
5.选择一种或更多种符合评价标准的序列。
[0365]
关于sirna设计和使用的其他一般信息,可在the max
‑
plank
‑
institut fur biophysikalische chemie网站处的%irna使用者指南”中找到。
[0366]
或者,sirna可功能性定义为能够与靶序列杂交的核苷酸序列(或寡核苷酸序列)(例如,400mm nacl,40mm pipes ph 6.4,1mm edta,50℃或70℃杂交12至16小时;随后洗涤)。另外的优选杂交条件包括在70℃下在1
×
ssc中或在50℃下在1
×
ssc、50%甲酰胺中杂交,随后在70℃下在0.3
×
ssc中洗涤;或者在70℃下在4
×
ssc中或在50℃下在4
×
ssc、50%甲酰胺中杂交,随后在67℃下在1
×
ssc中洗涤。预计长度小于50个碱基对的杂交体的杂交温度应比杂交体的解链温度(t
m
)低5至10℃,其中t
m
根据以下等式确定。对于长度小于18个碱基对的杂交体,t
m
(℃)=2(#a t碱基) 4(#g c碱基)。对于长度在18至49个碱基对之间的杂交体,t
m
(℃)=81.5 16.6(log 10[na ]) 0.41(%g c)
‑
(600/n),其中n是杂交体中的碱基数,[na ]是杂交缓冲液中钠离子的浓度([na
]对于1
×
ssc=0.165m)。多核苷酸杂交严格条件的其他实例在sambrook,j.,e.f.fritsch,和t.maniatis,1989,molecular cloning:a laboratory manual,cold spring harbor laboratory press,cold spring harbor,n.y.,第9和11章,以及current protocols in molecular biology,1995,f.m.ausubel et al,eds.,john wiley&sons,inc.,第2.10和6.3
‑
6.4节中提供,通过引用并入本文。
[0367]
阴性对照sirna应具有与所选的sirna相同的核苷酸组成,但与适当的基因组没有显著的序列互补性。可通过随机扰乱所选的sirna的核苷酸序列来设计这样的阴性对照。可进行同源性检索以确保阴性对照与适当基因组中任何其他基因缺乏同源性。此外,可以通过在序列中引入一个或更多个碱基错配来设计阴性对照sirna。
[0368]
6.为了验证sirna破坏靶mrna(例如野生型或突变apoe mrna)的有效性,sirna可与靶cdna(例如apoe cdna)在基于果蝇的体外mrna表达体系中孵育。在琼脂糖凝胶上通过放射自显影法检测到用
32
p放射性标记的新合成的靶mrna(例如apoe mrna)。裂解的靶mrna的存在表明mrna核酸酶活性。合适的对照包括省略sirna和使用非靶cdna。或者,选择与所选的sirna具有相同核苷酸组成,但与适当的靶基因没有显著的序列互补性的对照sirna。这样的阴性对照可以通过随机干扰所选的sirna的核苷酸序列来设计。可以进行同源性检索以确保阴性对照与适当基因组中的任何其他基因缺乏同源性。此外,可以通过在序列中引入一个或更多个碱基错配来设计阴性对照sirna。
[0369]
抗apoe sirna可被设计为靶向上文所述的任何靶序列。所述sirna包含与靶序列充分互补的反义链,以介导靶序列的沉默。在某些实施方案中,rna沉默剂为sirna。
[0370]
在某些实施方案中,sirna包含含有图3a所示序列的有义链和包含图3a所示序列的反义链。
[0371]
选择了导致最佳的mrna特异性和最大的mrna裂解的sirna
‑
mrna互补位点。
[0372]
b)sirna样分子
[0373]
本发明的sirna样分子具有与apoe mrna靶序列“充分互补”的序列(即,具有具有这样的序列的链)以通过rnai或翻译抑制来指导基因沉默。sirna样分子的设计方式与sirna分子相同,但有义链和靶rna之间的序列同一性程度接近于mirna与其靶标之间观察到的序列同一性程度。一般来说,随着mirna序列与相应靶基因序列之间的序列同一性程度降低,通过翻译抑制而不是rnai来介导转录后基因沉默的趋势升高。因此,在一个替代实施方案中,在期望通过靶基因的翻译抑制实现转录后基因沉默的情况下,mirna序列与靶基因序列具有部分互补性。在某些实施方案中,mirna序列与分散在靶mrna内(例如在靶mrna的3
’‑
utr内)的一个或更多个短序列(互补位点)具有部分互补性(hutvagner和zamore,science,2002;zeng et al.,mol cell,2002;zeng et al.,rna,2003;doench et al,genes&dev.,2003)。由于翻译抑制的机制是协同的,因此在某些实施方案中可靶向多个互补位点(例如,2、3、4、5或6个)。
[0374]
sirna样双链体介导rnai或翻译抑制的能力可通过靶基因序列和互补位点处的沉默剂核苷酸序列之间不相同的核苷酸的分布来预测。在一个实施方案中,在期望通过翻译抑制来沉默基因的情况下,互补位点的中心部分存在至少一个不相同的核苷酸,使得由mirna向导链和靶mrna形成的双链体含有中心“凸起”(doench j g et al.,genes&dev.,2003)。在另一个实施方案中,引入2、3、4、5或6个连续或不连续的不相同核苷酸。可选择不相同核苷酸以使其形成摆动碱基对(例如,g:u)或错配碱基对(g:a、c:a、c:u、g:g、a:a、c:c、u:u)。在另一优选实施方案中,“凸起”集中在从mirna分子5’端起的核苷酸第12和13位处。
[0375]
c)短发夹rna(shrna)分子
[0376]
在某些具体实施方案中,本发明提供了能够以增强的选择性介导apoe靶序列的rna沉默的shrna。与sirna相反,shrna模拟微小rna(mirna)的天然前体,并进入基因沉默途径的顶端。因此,shrna被认为可通过连通(feed through)整个天然基因沉默途径而更有效地介导基因沉默。
[0377]
mirna是约22个核苷酸的非编码rna,其可在植物和动物发育的过程中在转录后水平或翻译水平调节基因表达。mirna的一个普遍特征是其全部从约70个核苷酸的前体rna
茎
‑
环(称为pre
‑
mirna)上切离,可能是通过dicer(iii型rna酶)或其同源物切离。天然存在的mirna前体(pre
‑
mirna)具有形成双链体茎的单链,包括通常互补的两个部分和连接茎的两个部分的环。在典型的pre
‑
mirna中,茎包括一个或更多个凸起,例如,在茎的一部分中形成单核苷酸“环”的额外核苷酸,和/或在茎的两部分相互杂交中形成空位的一个或更多个未配对核苷酸。本发明的短发夹rna或经改造rna前体是基于这些天然存在的pre
‑
mirna但经改造以递送期望的rna沉默剂(例如,本发明的sirna)的人工构建体。通过用与靶mrna互补的序列替换pre
‑
mirna的茎序列形成shrna。shrna通过细胞的整个基因沉默途径进行加工,从而有效地介导rna干扰。
[0378]
shrna分子的必需元件包括第一部分和第二部分,其具有足够的互补性以退火或杂交以形成双链体或双链的茎部分。这两部分不必完全或完美互补。第一和第二“茎”部分通过具有对于与shrna的其他部分退火或杂交而言具有不充分的序列互补性的序列的一部分连接。该前一部分在shrna分子中称为“环”部分。加工shrna分子以产生sirna。shrna还可包括一个或更多个凸起,即在茎的一部分中形成小核苷酸“环”的额外核苷酸,例如一个、两个或三个核苷酸环。茎部分可以是相同的长度,或者一部分可以包括例如1至5个核苷酸的突出端。突出端核苷酸可包括,例如,尿嘧啶(u),例如,全部是u。这样的u特别由标志着转录的终止的编码shrna的dna中的胸腺嘧啶(t)编码。
[0379]
在本发明的shrna(或经改造前体rna)中,双链体茎的一部分是与apoe靶序列互补(或反义)的核酸序列。优选地,shrna的茎部分的一条链与靶rna(例如,mrna)序列充分互补(例如,反义),以通过rna干扰(rnai)介导所述靶rna的降解或裂解。因此,经改造rna前体包括具有两个部分的双链体茎和连接两个茎部分的环。反义部分可在茎的5’或3’端。shrna的茎部分的长度优选约15至约50个核苷酸。优选地,两个茎部分的长度为约18或19至约21、22、23、24、25、30、35、37、38、39或40或者更多个核苷酸。在一些优选实施方案中,茎部分的长度应为21个核苷酸或更长。当用于哺乳动物细胞中时,茎部分的长度应小于约30个核苷酸,以避免引发非特异性响应,如干扰素途径。在非哺乳动物细胞中,茎的长度可超过30个核苷酸。事实上,茎可包括与靶mrna互补的更大的一部分(直至并包括整个mrna)。事实上,茎部分可包括与靶mrna互补的更大的一部分(直至并包括整个mrna)。
[0380]
双链体茎的两部分必须充分互补以杂交形成双链体茎。因此,这两个部分可以是但不必是完全或完美互补的。此外,两个茎部分可具有相同的长度,或者一个部分可包括1、2、3或4个核苷酸的突出端。突出端核苷酸可包括例如尿嘧啶(u),例如全部是u。shrna或经改造rna前体中的环可通过修饰环序列来增加或减少成对核苷酸的数量,或者通过用四环或其他环序列替换全部或部分环序列从而不同于天然pre
‑
mirna序列。因此,shrna或经改造rna前体中的环可以是长度为2、3、4、5、6、7、8、9或更多个核苷酸,例如长度为15或20或更多个核苷酸。
[0381]
通过修饰环序列来增加或减少成对核苷酸的数量,或用四环或其他环序列替换全部或部分环序列,shrna或经改造rna前体中的环可不同于天然的pre
‑
mirna序列。因此,shrna中的环部分的长度可为约2至约20个核苷酸,即长度为约2、3、4、5、6、7、8、9或更多个核苷酸,例如,长度为15或20或更多个核苷酸。优选的环由“四环”序列组成或包含“四环”序列。示例性四环序列包括但不限于序列gnra,其中n为任意核苷酸,r为嘌呤核苷酸、gggg和uuuu。
[0382]
在某些实施方案中,本发明的shrna包括上文所述的期望的sirna分子的序列。在另一些实施方案中,shrna的反义部分的序列基本上可如上所述设计或一般通过从靶rna(例如,apoe mrna)内,例如,从翻译起始的上游或下游100至200或300个核苷酸的区域选择18、19、20、21个核苷酸或更长的序列来设计。通常来说,序列可从包括5’utr(非翻译区)、编码序列或3’utr的靶rna(例如mrna)的任何部分中选择。该序列可任选地地紧跟在含有两个相邻aa核苷酸的靶基因区域之后。核苷酸序列的最后两个核苷酸可选择为uu。该21个左右的核苷酸序列用于在shrna中形成双链体茎的一部分。该序列可替代,例如,酶促地替代野生型pre
‑
mirna序列的茎部分,或包含在合成的完整序列中。例如,可以合成编码整个茎
‑
环经改造的rna前体,或仅编码待插入前体的双链体茎中的部分的dna寡核苷酸,并使用限制性内切酶构建经改造rna前体构建体,例如,从野生型pre
‑
mirna构建。
[0383]
经改造rna前体在双链体茎中包括期望在体内产生的sirna或sirna样双链体的21至22个左右的核苷酸序列。因此,经改造rna前体的茎部分包括对应于其表达将被降低或抑制的基因的外显子部分的序列的至少18或19个核苷酸对。选择茎的该区域侧翼的两个3’核苷酸,以便最大化地从经改造rna前体产生sirna,并最大限度地提高所得sirna在靶向相应mrna以在体内和体外通过rnai进行翻译抑制或破坏的效力。
[0384]
在某些实施方案中,本发明的shrna包括mirna序列,任选经末端修饰的mirna序列,以增强进入risc的能力。mirna序列可与任何天然存在的mirna序列相似或相同(参见例如the mirna registry;griffiths
‑
jones s,nuc.acids res.,2004)。迄今为止,已经鉴定了1000多个天然mirna,它们一起被认为包含了基因组中所有预测的基因的约1%。许多天然mirna在pre
‑
mrna的内含子中聚簇在一起,可使用基于同源性的检索(pasquinelli et al.,2000;lagos
‑
quintana et al.,2001;lau et al.,2001;lee和ambros,2001)或预测候选mirna基因形成pri
‑
mrna茎环结构的能力的计算机算法(例如mirscan,mirseeker)在计算机中进行鉴定(grad et al.,mol.cell.,2003;lim et al.,genes dev.,2003;lim et al.,science,2003;lai e c et al,genome bio.,2003)。在线注册提供了所有已发表的mirna序列的可检索数据库(sanger研究所网站上的mirna注册;griffiths
‑
jones s,nuc.acids res.,2004)。例如,天然mirna包括lin
‑
4、let
‑
7、mir
‑
10、mirr
‑
15、mir
‑
16、mir
‑
168、mir
‑
175、mir
‑
196,及其同源物,以及来自人和某些模式生物体(包括如国际pct公开no.wo 03/029459中所述的果蝇(drosophila melanogaster)、秀丽隐杆线虫(caenorhabditis elegans)、斑马鱼、拟南芥(arabidopsis thalania)、小家鼠(mus musculus)以及褐家鼠(rattus norvegicus))的其他天然mirna。
[0385]
天然存在的mirna在体内由内源性基因表达,并通过dicer或其他rna酶从发夹或茎
‑
环前体(pre
‑
mirna或pri
‑
mirna)加工而成(lagos
‑
quintana et al.,science,2001;lau et a1.,science,2001;lee和ambros,science,2001;lagos
‑
quintana et al.,curr.biol.,2002;mourelatos et al.,genes dev.,2002;reinhart et al.,science,2002;ambros et al.,curr.biol.,2003;brennecke et al.,2003;lagos
‑
quintana et al.,rna,2003;lim et al.,genes dev,2003,lim et al.,science,2003)。mirna可在体内以双链的双链体的形式瞬时存在,但risc复合物只利用一条链来指导基因沉默。某些mirna,例如植物mirna,与其靶mrna具有完美或接近完美的互补性,因此指向裂解靶mrna。其他mirna与其靶mrna的互补性并不完美,因此指向靶mrna的翻译抑制。mirna与其靶mrna
之间的互补程度被认为决定了其作用机制。例如,mirna与其靶mrna之间完美或近乎完美的互补性预示着裂解机制(yekta et al.,science,2004),而非完美的互补性预示着翻译抑制机制。在一些具体实施方案中,mirna序列是天然存在的mirna序列,其异常表达或活性与mirna病症相关。
[0386]
d)双功能寡核苷酸系链
[0387]
在另一些实施方案中,本发明的rna沉默剂包括用于mirna胞间募集的双功能寡核苷酸系链。动物细胞表达一系列mirna,即可在转录后水平或翻译水平上调节基因表达的约22个核苷酸的非编码rna。通过结合与risc结合的mirna并将其募集到靶mrna,双功能寡核苷酸系链可抑制参与例如动脉硬化过程的基因的表达。与现有技术相比,寡核苷酸系链的使用提供了抑制特定基因表达的几个优势。首先,本文所述的方法允许内源性分子(通常大量存在)mirna来介导rna沉默。因此,本文所述的方法无需引入外源分子(例如sirna)来介导rna沉默。第二,可使rna沉默剂,特别是连接部分(例如,寡核苷酸,例如2
’‑
o
‑
甲基寡核苷酸)稳定并抵抗核酸酶活性。因此,本发明的系链可被设计用于直接递送,避免了间接递送(例如经病毒)经设计用于在细胞内制造期望的药剂的前体分子或质粒的需要。第三,系链及其各自的部分可被设计以符合特定的mrna位点和特定的mirna。这些设计可以是细胞特异性的和基因产物特异性的。第四,本文所公开的方法保持mrna完整,允许本领域技术人员利用细胞自身的机制在短脉冲中阻断蛋白质合成。因此,这些rna沉默方法具有高度可调节性。
[0388]
本发明的双功能寡核苷酸系链(“系链”)被设计成将mirna(例如,内源性细胞mirna)募集到靶mirna以诱导目标基因的调节。在一些优选实施方案中,系链具有式t
‑
l
‑
μ,其中t为mrna靶向部分,l为连接部分,μ为mirna募集部分。任意一个或更多个部分可为双链的。然而,优选地,每个部分为单链。
[0389]
系链内的部分可如式t
‑
l
‑
μ所示排列或连接(在5’至3’方向上)(即,靶向部分的3’端与连接部分的5’端连接,并且连接部分的3’端与mirna募集部分的5’端连接)。或者,这些部分可如下在系链中排列或连接:μ
‑
t
‑
l(即,mirna募集部分的3’端与连接部分的5’端连接,并且连接部分的3’端与靶向部分的5’端连接)。
[0390]
如上所述,mrna靶向部分能够捕获特定的靶mrna。根据本发明,靶mrna的表达是不期望的,因此mrna的翻译抑制是期望的。mrna靶向部分应具有足够的尺寸以有效结合靶mrna。靶向部分的长度将有很大差异,部分取决于靶mrna的长度以及靶mrna与靶向部分之间的互补程度。在多个实施方案中,靶向部分的长度小于约200、100、50、30、25、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5个核苷酸。在一个具体的实施方案中,靶向部分的长度为约15至约25个核苷酸。
[0391]
如上所述,mirna募集部分能够与mirna结合。根据本发明,mirna可以是能够抑制靶mrna的任何mirna。据报道,哺乳动物具有超过250种内源性mirna(lagos
‑
quintana et al.(2002)current biol.12:735
‑
739;lagos
‑
quintana et al.(2001)science 294:858
‑
862;和lim et al.(2003)science 299:1540)。在多个实施方案中,mirna可以是本领域认可的任何mirna。
[0392]
连接部分是能够连接靶向部分以保持靶向部分的活性的任意药剂。连接部分优选为包含足够数量的核苷酸以使靶向剂可与其各自的靶标充分相互作用的寡核苷酸部分。连
接部分与细胞mrna或mirna序列几乎没有或没有序列同源性。示例性连接部分包括一个或更多个2
’‑
o
‑
甲基核苷酸,例如,2
’‑
β
‑
甲基腺苷、2
’‑
o
‑
甲基胸苷、2
’‑
o
‑
甲基鸟苷或2
’‑
o
‑
甲基尿苷。
[0393]
e)基因沉默寡核苷酸
[0394]
在某些示例性实施方案中,可使用基于寡核苷酸的化合物调节基因表达(即,apoe基因表达),所述化合物包含两个或更多个单链反义寡核苷酸,其通过其5’端连接而允许存在两个或更多个可及的3’端,以有效抑制或降低apoe基因表达。这样的连接的寡核苷酸也称为基因沉默寡核苷酸(gene silencing oligonucleotide,gso)。(参见例如转让给idera pharmaceuticals,inc.的us 8,431,544,出于所有目的通过引用将其整体并入本文。)
[0395]
gso的5’端的连接独立于其他寡核苷酸连接,并可直接通过5’、3’或2’羟基基团,或间接通过非核苷酸接头或核苷,其利用核苷的2’或3’羟基位置。连接还可利用5’端核苷酸的功能化糖或核碱基。
[0396]
gso可包含两个通过磷酸二酯、硫代磷酸酯或非核苷接头在其5
’‑5’
端处缀合的相同或不同的序列。这样的化合物可包含15至27个核苷酸,这些核苷酸与用于基因产物反义下调的目的mrna靶标的特定部分互补。包含相同序列的gso可通过沃森
‑
克里克氢键相互作用与特定mrna结合并抑制蛋白质表达。包含不同序列的gso能够与一个或更多个mrna靶标的两个或更多个不同区域结合并抑制蛋白质表达。这样的化合物由与靶mrna互补的异核苷酸(heteronucleotide)序列构成,并通过沃森
‑
克里克氢键形成稳定的双链体结构。在某些条件下,含有两个游离3’端(5
’‑5’‑
连接反义)的gso可比含有单个游离3
’‑
端或无游离3
’‑
端的gso更高效地抑制基因表达。
[0397]
在一些实施方案中,非核苷酸接头为甘油或式ho
‑‑
(ch2)
o
‑‑
ch(oh)
‑‑
(ch2)
p
‑‑
oh的甘油同系物,其中o和p独立地为1至约6、1至约4或1至约3的整数。在另一些实施方案中,非核苷酸接头为1,3
‑
二氨基
‑2‑
羟基丙烷的衍生物。一些这样的衍生物具有式ho
‑‑
(ch2)m
‑‑
c(o)nh
‑‑
ch2‑‑
ch(oh)
‑‑
ch2‑‑
nhc(o)
‑‑
(ch2)
m
‑‑
oh,其中m是0至约10、0至约6、2至约6或2至约4的整数。
[0398]
一些非核苷酸接头允许连接两个以上的gso组分。例如,非核苷酸接头甘油具有三个羟基基团,gso组分可与其共价连接。因此,本发明的一些基于寡核苷酸的化合物包含两个或更多个与核苷酸或非核苷酸的接头连接的寡核苷酸。根据本发明的这样的寡核苷酸被称为“支链的”。
[0399]
在某些实施方案中,gso的长度为至少14个核苷酸。在某些示例性实施方案中,gso的长度为15至40个核苷酸或20至30个核苷酸。因此,gso的组分寡核苷酸的长度可独立地为14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个核苷酸。
[0400]
这些寡核苷酸可通过本领域认可的方法,例如可手动或通过自动合成装置进行的氨基磷酸酯或h
‑
膦酸酯化学反应来制备。这些寡核苷酸也可通过多种方式进行修饰,而不损害其与mrna杂交的能力。这样的修饰可包括寡核苷酸的至少一个核苷酸间连接,其为烷基膦酸酯、硫代磷酸酯、二硫代磷酸酯、甲基膦酸酯、磷酸酯、烷基硫代膦酸酯、氨基磷酸酯、氨基甲酸酯、碳酸酯、磷酸羟基、acetamidate或羧甲基酯或它们的组合,以及一个核苷酸的5’端和另一个核苷酸的3’端之间的其他核苷酸间连接,其中5’核苷酸磷酸二酯连接已被任
端之间的g:c碱基对。在另一个实施方案中,本发明的rna沉默剂的不对称性可被增强,使得在第一或反义链的5’端和有义链部分的3’端之间存在至少一个错配的碱基对。优选地,错配碱基对选自g:a、c:a、c:u、g:g、a:a、c:c和u:u。在另一个实施方案中,本发明的rna沉默剂的不对称性可被增强,使得在第一或反义链的5’端和有义链部分的3’端之间存在至少一个摆动碱基对,例如,g:u。在另一个实施方案中,本发明的rna沉默剂的不对称性可被增强,使得至少有一个碱基对包含稀有核苷酸,例如肌苷(i)。优选地,所述碱基对选自i:a、i:u和i:c。在又一个实施方案中,本发明的rna沉默剂的不对称性可被增强,使得至少有一个碱基对包含经修饰核苷酸。在一些优选实施方案中,经修饰核苷酸选自2
‑
氨基
‑
g、2
‑
氨基
‑
a、2,6
‑
二氨基
‑
g和2,6
‑
二氨基
‑
a。
[0410]
3)具有增强的稳定性的rna沉默剂
[0411]
可对本发明的rna沉默剂进行修饰,以提高用于细胞培养的血清或生长介质的稳定性。为了增强稳定性,可稳定3
’‑
残基以抵抗降解,例如,它们可被选择以使它们由嘌呤核苷酸,特别是腺苷或鸟苷核苷酸组成。或者,通过用经修饰的类似物替换嘧啶核苷酸,例如用2
’‑
脱氧胸苷替换尿苷是允许的,并且不影响rna干扰的效率。
[0412]
在一个方面中,本发明的特征在于包含第一和第二链的rna沉默剂,其中第二链和/或第一链通过用经修饰核苷酸替换内部核苷酸来修饰,使得与相应的未经修饰的rna沉默剂相比增强了体内稳定性。如本文所定义,“内部”核苷酸是存在于除核酸分子、多核苷酸或寡核苷酸的5’端或3’端以外的任何位置处的核苷酸。内部核苷酸可在单链的分子内,也可在双链体或双链的分子的链内。在一个实施方案中,有义链和/或反义链通过至少一个内部核苷酸的替换进行修饰。在另一个实施方案中,通过替换至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或更多个内部核苷酸来修饰有义链和/或反义链。在另一个实施方案中,通过替换至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多内部核苷酸来修饰有义链和/或反义链。在又一个实施方案中,通过替换所有内部核苷酸来修饰有义链和/或反义链。
[0413]
在一个方面中,本发明的特征在于至少80%经化学修饰的rna沉默剂。在本发明的一个优选实施方案中,rna沉默剂可完全经化学修饰,即100%的核苷酸经化学修饰。
[0414]
在本发明的一个优选实施方案中,rna沉默剂可含有至少一个经修饰核苷酸类似物。核苷酸类似物可位于靶特异性沉默活性(例如,rnai介导活性或翻译抑制活性)未受到实质性影响的位置处,例如,在sirna分子的5’端和/或3’端处的区域中。特别地,可通过引入经修饰核苷酸类似物来稳定末端。
[0415]
示例性核苷酸类似物包括糖和/或骨架修饰的核糖核苷酸(即,包括对磷酸
‑
糖骨架的修饰)。例如,可将天然rna的磷酸二酯连接修饰为包括氮或硫杂原子中的至少一个。在一些示例性的经骨架修饰的核糖核苷酸中,与相邻核糖核苷酸连接的磷酸酯基团被经修饰基团(例如硫代磷酸酯基团)取代。在一些示例性的糖修饰的核糖核苷酸中,2’oh基团由选自h、or、r、卤素、sh、sr、nh2、nhr、nr2或on的基团取代,其中r为c1‑
c6烷基、烯基或炔基,并且卤素为f、cl、br或i。
[0416]
在一些具体实施方案中,修饰为2
’‑
氟、2
’‑
氨基和/或2
’‑
硫代修饰。特别优选的修饰包括2
’‑
氟
‑
胞苷、2
’‑
氟
‑
尿苷、2
’‑
氟
‑
腺苷、2
’‑
氟
‑
鸟苷、2
’‑
氨基
‑
胞苷、2
’‑
氨基
‑
尿苷、
2
’‑
氨基
‑
腺苷、2
’‑
氨基
‑
鸟苷、2,6
‑
二氨基嘌呤、4
‑
硫代
‑
尿苷和/或5
‑
氨基
‑
烯丙基
‑
尿苷。在一个具体实施方案中,2
’‑
氟
‑
核糖核苷酸为所有的尿苷和胞苷。其他示例性修饰包括5
‑
溴
‑
尿苷、5
‑
碘
‑
尿苷、5
‑
甲基
‑
胞苷、核糖
‑
胸苷、2
‑
氨基嘌呤、2
’‑
氨基
‑
丁酰基
‑
芘
‑
尿苷、5
‑
氟
‑
胞苷和5
‑
氟
‑
尿苷。2
’‑
脱氧
‑
核苷酸和2
’‑
ome核苷酸也可用于本发明的经修饰的rna沉默剂部分内。另外的经修饰残基包括脱氧
‑
无碱基、肌苷、n3
‑
甲基
‑
尿苷、n6,n6
‑
二甲基
‑
腺苷、假尿苷、嘌呤核糖核苷和三氮唑核苷。在一个特别优选的实施方案中,2’部分为甲基基团,使得连接部分是2
’‑
o
‑
甲基寡核苷酸。
[0417]
在一个示例性实施方案中,本发明的rna沉默剂包含锁核酸(lna)。lna包含抵抗核酸酶活性(高度稳定)并具有对mrna的单核苷酸识别的糖修饰的核苷酸(elmen et al.,nucleic acids res.,(2005),33(1):439
‑
447;braasch et al.(2003)biochemistry 42:7967
‑
7975,petersen et al.(2003)trends biotechnol 21:74
‑
81)。这些分子具有2
’‑
o,4
’‑
c
‑
乙烯
‑
桥联的核酸,其具有可能的例如2
’‑
脱氧
‑2”‑
氟尿苷的修饰。此外,lna通过将糖部分限制在3
’‑
endo构象中,从而预组织核苷酸进行碱基配对并将寡核苷酸的解链温度提高多达10℃/碱基,来提高寡核苷酸的特异性。
[0418]
在另一个示例性实施方案中,本发明的rna沉默剂包含肽核酸(pna)。pna包含经修饰核苷酸,其中核苷酸的糖
‑
磷酸部分被中性2
‑
氨基乙基甘氨酸部分取代,该部分能够形成对核酸酶消化具有高度抗性,并赋予分子以提高的结合特异性的聚酰胺骨架(nielsen,et al.,science,(2001),254:1497
‑
1500)。
[0419]
还优选碱基经修饰的核糖核苷酸,即含有至少一个非天然存在的核碱基而不是天然存在的核碱基的核糖核苷酸。碱基可被修饰以阻断腺苷脱氨酶的活性。示例性经修饰核糖核苷酸包括但不限于在5
‑
位被修饰的尿苷或胞苷,例如5
‑
(2
‑
氨基)丙基尿苷、5
‑
溴尿苷;在8位被修饰的腺苷和鸟苷,例如8
‑
溴鸟苷;脱氮核苷酸,例如7
‑
脱氮
‑
腺苷;o
‑
和n
‑
烷基化核苷酸,例如n6
‑
甲基腺苷是合适的。应注意,以上修饰可以组合。
[0420]
在另一些实施方案中,交联可用于改变rna沉默剂的药动学,例如,增加体内半衰期。因此,本发明包括具有两条互补核酸链的rna沉默剂,其中该两条链是交联的。本发明还包括与另外的部分(例如,非核酸部分,例如肽)、有机化合物(例如,染料)等缀合或未缀合(例如,在其3’端处)的rna沉默剂。以这种方式修饰sirna衍生物与相应的sirna相比可提高细胞摄取或增强所得sirna衍生物的细胞靶向活性,可用于追踪细胞中的sirna衍生物,或与相应的sirna相比提高sirna衍生物的稳定性。
[0421]
其他示例性修饰包括:(a)2’修饰,例如,对在有义或反义链中(但特别是在有义链上)的u提供2’ome部分,或在3’突出端中,例如在3’端处(3’端意指分子的3’原子或最3’的部分,例如如上下文所示,最3’的p或第2’位)提供2’ome部分;(b)在磷酸酯骨架中对骨架进行修饰,例如用s替换0,例如对u或a或者二者提供硫代磷酸酯修饰,尤其是在反义链上;例如用s替换o;(c)用c5氨基接头替换u;(d)用g替换a(序列变化优选位于有义链而不是反义链上);以及(d)在第2’、6’、7’或8’位处修饰。一些示例性实施方案是其中一个或更多个这些修饰存在于有义链上而非反义链上的实施方案,或其中反义链具有较少这样的修饰的实施方案。然而,其他示例性修饰包括在3’突出端中(例如在3’端处)使用甲基化p;2’修饰的组合,例如提供2’o me部分和骨架修饰,例如用s替换o,例如提供硫代磷酸酯修饰,或在3’突出端中(例如在3’端处)使用甲基化p;用3’烷基修饰;在3’突出端中(例如在3’端处)用无
碱基吡咯烷酮进行修饰;用萘普生、布洛芬或其他抑制3’端处降解的部分进行修饰。
[0422]
4)增强细胞摄取的修饰
[0423]
在另一些实施方案中,rna沉默剂可用化学部分进行修饰,例如,以增强其被靶细胞(例如,神经元细胞)的细胞摄取。因此,本发明包括与另外的部分(例如,非核酸部分,例如肽)、有机化合物(例如,染料)等缀合或未缀合(例如,在其3’端处)的rna沉默剂。缀合可以通过本领域已知的方法实现,例如使用lambert et al.,drug deliv.rev.:47(1),99
‑
112(2001)(描述了负载到聚氰基丙烯酸烷基酯(paca)纳米颗粒上的核酸);fattal et al.,j.control release 53(1
‑
3):137
‑
43(1998)(描述了与纳米颗粒结合的核酸);schwab et al.,ann.oncol.5 suppl.4:55
‑
8(1994)(描述了与嵌入剂、疏水基团、聚阳离子或paca纳米颗粒连接的核酸);以及godard et al,eur.j.biochem.232(2):404
‑
10(1995)(描述了与纳米颗粒连接的核酸)的方法。
[0424]
在一个具体实施方案中,本发明的rna沉默剂与亲脂性部分缀合。在一个实施方案中,亲脂性部分是包含阳离子基团的配体。在另一个实施方案中,亲脂性部分与sirna的一条或两条链连接。在一些示例性实施方案中,亲脂性部分与sirna的有义链的一个末端连接。在另一个示例性实施方案中,亲脂性部分与有义链的3’端连接。在某些实施方案中,亲脂性部分选自胆固醇、维生素e、维生素k、维生素a、叶酸或阳离子染料(例如cy3)。在一个示例性实施方案中,亲脂性部分为胆固醇。其他亲脂性部分包括胆酸、金刚烷乙酸、1
‑
芘丁酸、双氢睾酮、1,3
‑
双
‑
o(十六烷基)甘油、香叶基氧己基基团、十六烷基甘油、冰片、薄荷醇、1,3
‑
丙二醇、十七烷基基团、棕榈酸、肉豆蔻酸、o3
‑
(油酰基)石胆酸、o3
‑
(油酰基)胆烯酸、二甲氧基三苯甲基或吩嗪。
[0425]
5)系链配体
[0426]
其他实体可被系链至本发明的rna沉默剂。例如,配体被系链至rna沉默剂以提高稳定性、与靶核酸的杂交热力学、对特定组织或细胞类型的靶向,或提高细胞通透性,例如,通过内吞依赖或非依赖机制。配体和相关的修饰也可提高序列特异性,从而降低脱靶靶向。系链配体可包括一个或更多个可作为嵌入剂发挥作用的经修饰的碱基或糖。它们优选位于内部区域,例如rna沉默剂/靶双链体的凸起中。嵌入剂可以是芳族化合物,例如多环芳族或杂环芳族化合物。多环嵌入剂可具有堆叠能力,并可包括具有2、3或4个稠环的体系。本文所述的通用碱基可包含在配体上。在一个实施方案中,配体可包括通过裂解靶核酸而有助于靶基因抑制的裂解基团。例如,裂解基团可以是博莱霉素(bleomycin)(例如,博莱霉素
‑
a5、博莱霉素
‑
a2或博莱霉素
‑
b2)、芘、菲罗啉(例如,o
‑
菲罗啉)、聚胺、三肽(例如,lys
‑
tyr
‑
lys三肽)或金属离子螯合基团。金属离子螯合基团可包括例如lu(iii)或eu(iii)大环复合物、zn(ii)2,9
‑
二甲基菲罗啉衍生物、cu(ii)三联吡啶或吖啶,其可通过游离金属离子(例如lu(iii))促进凸起位点处靶rna的选择性裂解。在一些实施方案中,肽配体可与rna沉默剂系链以促进靶rna的裂解,例如在凸起区域处。例如,1,8
‑
二甲基
‑
1,3,6,8,10,13
‑
六氮杂环十四烷(环拉胺)可与肽缀合(例如通过氨基酸衍生物)以促进靶rna裂解。系链配体可以是可使rna沉默剂具有提高的杂交特性或提高的序列特异性的氨基糖苷配体。示例性氨基糖苷包括糖基化聚赖氨酸、半乳糖化聚赖氨酸、新霉素b、妥布霉素(tobramycin)、卡那霉素a(kanamycin a)和氨基糖苷类的吖啶缀合物,例如neo
‑
n
‑
吖啶、neo
‑
s
‑
吖啶、neo
‑
c
‑
吖啶、tobra
‑
n
‑
吖啶和kanaa
‑
n
‑
吖啶。使用吖啶类似物可提高序列特异性。例如,新霉素b对rna的
亲和力与对dna的亲和力相比较高,但序列特异性较低。吖啶类似物,neo
‑5‑
吖啶对hiv rev响应元件(rev
‑
response element,rre)具有更高的亲和力。在一些实施方案中,氨基糖苷配体的胍类似物(胍基糖苷)与rna沉默剂系链。在胍基糖苷中,氨基酸上的胺基团被胍基交换。胍类似物的连接可增强rna沉默剂的细胞通透性。系链配体可以是可增强细胞对寡核苷酸剂的摄取的聚精氨酸肽、类肽或肽模拟物。
[0427]
示例性配体通过间插系链直接或间接地与配体缀合的载体偶联(优选共价偶联)。在一些示例性实施方案中,配体通过间插系链与载体连接。在一些示例性实施方案中,配体改变其所并入的rna沉默剂的分布、靶向或使用期(lifetime)。在一些示例性实施方案中,配体提供对所选靶标(例如,分子、细胞或细胞类型、区室,例如,细胞或器官区室、组织、器官或身体的区域)的增强的亲和力,例如与没有这样的配体的种类相比。
[0428]
示例性配体可提高转运、杂交和特异性性质,并且还可提高所得天然或经修饰的rna沉默剂或者包含本文所述单体和/或天然或经修饰的核糖核苷酸的任意组合的聚合物分子的核酸酶抗性。配体通常可包括治疗性修饰物,例如用于增强摄取;诊断化合物或报道基团,例如用于监测分布;交联剂;赋予核酸酶抗性的部分;以及天然或不常见的碱基。一般性的实例包括亲脂类(lipophile)、脂质、类固醇(例如熊果醇、hecigenin、薯蓣皂苷元(diosgenin))、萜类(例如三萜类,例如菝葜皂苷元(sarsapogenin)、无羁萜(friedelin)、表木栓醇衍生的石胆酸)、维生素(例如叶酸、维生素a、生物素、吡哆醛)、碳水化合物、蛋白质、蛋白质结合剂、整合素靶向分子、聚阳离子、肽、聚胺和肽模拟物。配体可包括天然存在的物质(例如,人血清白蛋白(human serum albumin,hsa)、低密度脂蛋白(low
‑
density lipoprotein,ldl)或球蛋白);碳水化合物(例如,葡聚糖、短梗霉聚糖、壳多糖、壳聚糖、菊糖、环糊精或透明质酸);氨基酸,或脂质。配体也可以是重组分子或合成分子,例如合成聚合物,例如合成聚氨基酸。聚氨基酸的实例包括聚氨基酸为聚赖氨酸(polylysine,pll)、聚l
‑
天冬氨酸、聚l
‑
谷氨酸、苯乙烯
‑
马来酸酐共聚物、聚(l
‑
丙交酯
‑
共
‑
乙交酯)共聚物、二乙烯基醚
‑
马来酸酐共聚物、n
‑
(2
‑
羟丙基)甲基丙烯酰胺共聚物(hmpa)、聚乙二醇(polyethylene glycol,peg)、聚乙烯醇(polyvinyl alcohol,pva)、聚氨酯、聚(2
‑
乙基丙烯酸)、n
‑
异丙基丙烯酰胺聚合物或聚膦嗪(polyphosphazine)。聚胺的实例包括:聚乙烯亚胺、聚赖氨酸(pll)、精胺、亚精胺、聚胺、假肽
‑
聚胺、肽模拟物聚胺、树状体聚胺、精氨酸、脒、鱼精蛋白、阳离子脂质、阳离子卟啉、聚胺的季盐或α螺旋肽。
[0429]
配体还可包括与特定细胞类型,例如肾细胞结合的靶向基团,例如细胞或组织靶向剂,例如凝集素、糖蛋白、脂质或蛋白质,例如抗体。靶向基团可以是促甲状腺激素、促黑素、凝集素、糖蛋白、表面活性剂蛋白a、黏蛋白碳水化合物、多价乳糖、多价半乳糖、n
‑
乙酰基
‑
半乳糖胺、n
‑
乙酰基
‑
葡糖胺、多价甘露糖、多价岩藻糖、糖基化聚氨基酸、多价半乳糖、转铁蛋白、双磷酸盐/酯、聚谷氨酸、聚天冬氨酸、脂质、胆固醇、类固醇、胆汁酸、叶酸、维生素b12、生物素或者rgd肽或rgd肽模拟物。配体的其他实例包括染料、嵌入剂(例如吖啶和经取代的吖啶)、交联剂(例如补骨脂素、丝裂霉素c)、卟啉(tppc4、德卟啉(texaphyrin)、sapphyrin)、多环芳烃(例如吩嗪、二氢吩嗪、菲罗啉、芘)、lys
‑
tyr
‑
lys三肽、氨基糖苷、胍氨基糖苷、人工核酸内切酶(例如edta)、亲脂性分子,例如胆固醇(及其硫代类似物)、胆酸、胆烷酸、石胆酸、金刚烷乙酸、1
‑
芘丁酸、双氢睾酮、甘油(例如酯(例如单、双或三脂肪酸酯,例如c
10
、c
11
、c
12
、c
13
、c
14
、c
15
、c
16
、c
17
、c
18
、c
19
或c
20
脂肪酸)及其醚,例如c
10
、c
11
、c
12
、c
13
、c
14
、
c
15
、c
16
、c
17
、c
18
、c
19
或c
20
烷基;例如1,3
‑
双
‑
o(十六烷基)甘油、1,3
‑
双
‑
o(十八烷基)甘油)、香叶基氧己基、十六烷基甘油、冰片、薄荷醇、1,3
‑
丙二醇、十七烷基基团、棕榈酸、硬脂酸(例如二硬脂酸甘油酯)、油酸、肉豆蔻酸、o3
‑
(油酰基)石胆酸、o3
‑
(油酰基)胆烯酸、二甲氧基三苯甲基或吩嗪)和肽缀合物(例如触足肽(antennapedia peptide)、tat肽),烷基化剂、磷酸盐/酯、氨基、巯基、peg(例如peg
‑
40k)、mpeg、[mpeg]2、聚氨基、烷基、经取代的烷基、放射性标记的标志物、酶、半抗原(例如生物素)、转运/吸收促进剂(例如阿司匹林、萘普生、维生素e、叶酸)、合成核糖核酸酶(例如,咪唑、双咪唑、组胺、咪唑簇、吖啶
‑
咪唑缀合物、四氮杂大环的eu
3
复合物)、二硝基苯基、hrp或ap。
[0430]
配体可以是蛋白质(例如糖蛋白),或肽(例如对共配体具有特定亲和力的分子),或抗体(例如与特定细胞类型(例如癌细胞、内皮细胞或骨细胞)结合的抗体)。配体还可包括激素和激素受体。它们还可包括非肽物质,例如脂质、凝集素、碳水化合物、维生素、辅助因子、多价乳糖、多价半乳糖、n
‑
乙酰基
‑
半乳糖胺、n
‑
乙酰基
‑
葡糖胺多价甘露糖或多价岩藻糖。配体可以是例如脂多糖、p38map激酶激活剂或nf
‑
kb激活剂。
[0431]
配体可以是可例如通过扰乱细胞的细胞骨架,例如通过扰乱细胞的微管、微丝和/或中间丝来提高rna沉默剂进入细胞的摄取的物质,例如药物。药物可以是,例如,紫杉醇、长春新碱、长春花碱、细胞松弛素、诺考达唑(nocodazole),japlakinolide、拉春库林a(latrunculin a)、鬼笔环肽(phalloidin)、swinholide a、indanocine或myoservin。例如,配体可通过激活炎症响应来提高rna沉默剂进入细胞的摄取。具有这样的作用的示例性配体包括肿瘤坏死因子α(tnf
□
)、白介素
‑
1β或γ干扰素。在一个方面中,配体是脂质或基于脂质的分子。这样的脂质或基于脂质的分子优选结合血清蛋白,例如人血清白蛋白(hsa)。结合hsa的配体允许缀合物分布到靶组织,例如,身体的非肾靶组织。例如,靶组织可以是肝,包括肝实质细胞。可结合hsa的其他分子也可用作配体。例如,可使用萘普生或阿司匹林。脂质或基于脂质的配体可(a)提高对缀合物降解抗性、(b)提高靶向或转运进入靶细胞或细胞膜,和/或(c)可用于调节与血清蛋白(例如hsa)的结合。基于脂质的配体可用于调节(例如控制)缀合物与靶组织的结合。例如,与hsa结合强度较高的脂质或基于脂质的配体不太可能靶向肾,因此不太可能从体内清除。与hsa结合强度较低的脂质或基于脂质的配体可用于将缀合物靶向肾。在一个优选实施方案中,基于脂质的配体结合hsa。基于脂质的配体可具有足够亲和力地结合hsa,以使缀合物优选地分布到非肾组织。然而,优选的是亲和力不应太强以致hsa
‑
配体结合不能逆转。在另一个优选实施方案中,基于脂质的配体与hsa弱结合或根本不结合,以使缀合物优选地分布到肾。也可用靶向肾细胞的其他部分代替或补充基于脂质的配体。
[0432]
在另一个方面中,配体是由靶细胞(例如增殖细胞)摄取的部分(例如维生素)。它们特别可用于治疗以不期望的细胞增殖(例如恶性或非恶性类型的细胞增殖,例如癌细胞的细胞增殖)为特征的病症。示例性维生素包括维生素a、e和k。其他示例性维生素包括b族维生素,例如叶酸、b12、核黄素、生物素、吡哆醛或癌细胞吸收的其他维生素或营养素。还包括hsa和低密度脂蛋白(ldl)。
[0433]
在另一个方面中,配体是细胞渗透剂,优选螺旋细胞渗透剂。优选地,该药剂是两亲性的。一种示例性药剂是肽,例如tat肽或触足肽。如果该药剂是肽,则其可以是修饰的,包括肽基模拟物、反演体、非肽或假肽连接以及d
‑
氨基酸的使用。螺旋剂优选为α螺旋剂,其
优选具有亲脂相和疏脂相。
[0434]
配体可以是肽或肽模拟物。肽模拟物(在本文中也称为寡肽模拟物)是能够折叠成类似于天然肽的限定的三维结构的分子。肽和肽模拟物与寡核苷酸剂的连接可影响rna沉默剂的药动学分布,例如通过增强细胞识别和吸收来影响。肽或肽模拟物部分可为约5至50个氨基酸长,例如约5、10、15、20、25、30、35、40、45或50个氨基酸长。肽或肽模拟物可以是,例如,细胞渗透肽、阳离子肽、两亲性肽或疏水肽(例如,主要由tyr、trp或phe组成)。肽部分可以是树状体肽、限制性肽或交联肽。肽部分可以是l
‑
肽或d
‑
肽。在另一种替代方案中,肽部分可包括疏水膜转位序列(membrane translocation sequence,mts)。肽或肽模拟物可由dna的随机序列编码,例如从噬菌体展示文库或一珠一化合物(one
‑
bead
‑
one
‑
compound,oboc)组合文库(lam et al.,nature354:82
‑
84,1991)中鉴定的肽。在一些示例性实施方案中,通过并入的单体单元与rna沉默剂系链的肽或肽模拟物是细胞靶向肽,例如精氨酸
‑
甘氨酸
‑
天冬氨酸(rgd)
‑
肽,或rgd模拟物。肽部分的长度范围从约5个氨基酸至约40个氨基酸。肽部分可具有结构修饰,例如以提高稳定性或指导构象特性。可以使用以下描述的任何结构修饰。
[0435]
vi.分支寡核苷酸
[0436]
如上文所公开的两种或更多种rna沉默剂,例如寡核苷酸构建体,例如抗apoe sirna,可通过一个或更多个独立地选自接头、间隔子和分支点的部分相互连接,以形成分支寡核苷酸rna沉默剂。图11说明了用于递送两个sirna的示例性二分支di
‑
sirna支架。在一些代表性实施方案中,分支寡核苷酸的核酸各自包含反义链(或其一部分),其中反义链与杂合单核苷酸多态性具有足够的互补性,以介导rna介导的沉默机制(例如rnai)。在另一些实施方案中,提供了第二类分支寡核苷酸,其特征在于核酸包含用于沉默apoe反义转录物的有义链(或其一部分),其中有义链与反义转录物具有足够的互补性以介导rna介导的沉默机制。在另一些实施方案中,提供了第三类分支寡核苷酸,其包含两种类型的核酸,即,包含反义链(或其一部分)的第一寡核苷酸和包含有义链(或其一部分)的第二寡核苷酸。
[0437]
在一些示例性实施方案中,分支寡核苷酸可具有通过接头连接的2至8个rna沉默剂。接头可为疏水性的。在一些实施方案中,本技术的分支寡核苷酸具有2至3个寡核苷酸。在一些实施方案中,寡核苷酸独立地具有显著的化学稳定性(例如,至少40%的组成性碱基是经化学修饰的)。在一个示例性实施方案中,寡核苷酸具有完全的化学稳定性(即,所有组成性碱基均是经化学修饰的)。在一些实施方案中,分支寡核苷酸包含一个或更多个单链硫代磷酸酯化尾,每个独立地具有2至20个核苷酸。在一个非限制性实施方案中,每个单链尾具有8至10个核苷酸。
[0438]
在某些实施方案中,分支寡核苷酸具有三个特性:(1)分支结构,(2)完全的代谢稳定,和(3)包含硫代磷酸酯接头的单链尾的存在。在一个具体实施方案中,分支寡核苷酸具有2或3个分支。认为支链结构的总尺寸增加促进摄取增加。此外,在不受特定活性理论约束的情况下,多个相邻分支(例如,2或3个)被认为允许各分支协同作用,从而显著增强内化、转运和释放的速率。
[0439]
分支寡核苷酸在多种结构多样的实施方案中提供。例如,如图17所示,在一些实施方案中,连接在分支点处的核酸为单链的或双链的,并由mirna抑制剂、间隔聚体、混合聚体、sso、pmo或pna组成。可在其3’或5’端处连接这些单链。sirna和单链寡核苷酸的组合也
ccuaguuuaauaaagauuuca3’中的一个或更多个的链。有义链和反义链可各自独立地包含一个或更多个化学修饰。
[0451]
在一些实施方案中,式(i)化合物具有选自表3的式(i
‑
1)至(i
‑
9)的结构。
[0452]
表3
[0453][0454]
在一个实施方案中,式(i)化合物为式(i
‑
1)。在另一个实施方案中,式(i)化合物为式(i
‑
2)。在另一个实施方案中,式(i)化合物为式(i
‑
3)。在另一个实施方案中,式(i)化合物为式(i
‑
4)。在另一个实施方案中,式(i)化合物为式(i
‑
5)。在另一个实施方案中,式(i)化合物为式(i
‑
6)。在另一个实施方案中,式(i)化合物为式(i
‑
7)。在另一个实施方案中,式(i)化合物为式(i
‑
8)。在另一个实施方案中,式(i)化合物为式(i
‑
9)。
[0455]
在式(i)化合物的一个实施方案中,每个接头独立地选自乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑及其组合,其中接头的任意碳原子或氧原子任选地被氮原子取代、带有羟基取代基、或带有氧代取代基。在式(i)化合物的一个实施方案中,每个接头是乙二醇链。在另一个实施方案中,每个接头是烷基链。在式(i)化合物的另一个实施方案中,每个接头是肽。在式(i)化合物的另一个实施方案中,每个接头是rna。在式(i)化合物的另一个实施方案中,每个接头是dna。在式(i)化合物的另一个实施方案中,每个接头是磷酸酯。在另一个实施方案中,每个接头是膦酸酯。在式(i)化合物的另一个实施方案中,每个接头是氨基磷酸酯。在式(i)化合物的另一个实施方案中,每个接头是酯。在式(i)化合物的另一个实施方案中,每个接头是酰胺。在式(i)化合物的另一个实施方案中,每个接头是三唑。在式(i)化合物的另一个实施方案中,每个接头是选自图17的式的结构。
[0456]
在式(i)化合物的一个实施方案中,b是多价有机物物质。在式(i)化合物的另一个
实施方案中,b是多价有机物物质的衍生物。在式(i)化合物的一个实施方案中,b是三醇衍生物或四醇衍生物。在另一个实施方案中,b是三羧酸衍生物或四羧酸衍生物。在另一个实施方案中,b是胺衍生物。在另一个实施方案中,b是三胺衍生物或四胺衍生物。在另一个实施方案中,b是氨基酸衍生物。在式(i)化合物的另一个实施方案中,b选自图16的式。
[0457]
多价有机物物质是包含碳和三价或更高价(即,三个或更多个与例如如上所限定的s、l或n的部分的连接点)的部分。多价有机物物质的非限制性实例包括三醇(例如甘油、间苯三酚等)、四醇(例如核糖、季戊四醇、1,2,3,5
‑
四羟基苯等)、三羧酸(例如柠檬酸、1,3,5
‑
环己烷三羧酸、均苯三甲酸等)、四羧酸(例如,乙二胺四乙酸、均苯四甲酸等)、叔胺(例如,三炔丙基胺、三乙醇胺等)、三胺(例如,二乙烯三胺等)、四胺以及包含羟基、硫醇、氨基和/或羧基部分的组合的物质(例如,氨基酸,例如赖氨酸、丝氨酸、半胱氨酸等)。
[0458]
在式(i)化合物的一个实施方案中,每个核酸均包含一个或更多个经化学修饰的核苷酸。在式(i)化合物的一个实施方案中,每个核酸均由经化学修饰的核苷酸组成。在式(i)化合物的某些实施方案中,每个核酸的>95%、>90%、>85%、>80%、>75%、>70%、>65%、>60%、>55%或>50%包含经化学修饰的核苷酸。
[0459]
在一些实施方案中,每条反义链独立地包含选自表4的基团的5’端基团r。
[0460]
表4
[0461][0462]
在一个实施方案中,r是r1。在另一个实施方案中,r是r2。在另一个实施方案中,r是r3。在另一个实施方案中,r是r4。在另一个实施方案中,r是r5。在另一个实施方案中,r是r6。在另一个实施方案中,r是r7。在另一个实施方案中,r是r8。
[0463]
式(ii)的结构
[0464]
在一些实施方案中,式(i)化合物具有下式(ii)的结构:
[0465][0466]
其中,x在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;y在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;
‑
代表磷酸二酯核苷间连接;=代表硫代磷酸酯核苷间连接;以及
‑‑‑
在每次出现时分别代表碱基配对相互作用或错配。
[0467]
在某些实施方案中,式(ii)的结构不包含错配。在一个实施方案中,式(ii)的结构包含1个错配。在另一个实施方案中,式(ii)化合物包含2个错配。在另一个实施方案中,式(ii)化合物包含3个错配。在另一个实施方案中,式(ii)化合物包含4个错配。在一些实施方案中,每个核酸由经化学修饰的核苷酸组成。
[0468]
在某些实施方案中,式(ii)结构的x的>95%、>90%、>85%、>80%、>75%、>70%、>65%、>60%、>55%或>50%为经化学修饰的核苷酸。在另一些实施方案中,式(ii)结构的x的>95%、>90%、>85%、>80%、>75%、>70%、>65%、>60%、>55%或>50%为经化学修饰的核苷酸。
[0469]
式(iii)的结构
[0470]
在一些实施方案中,式(i)化合物具有下式(iii)的结构;
[0471][0472]
其中,x在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;x在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸;y在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;以及y在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸。
[0473]
在一些实施方案中,x选自2
’‑
脱氧
‑2’‑
氟修饰的腺苷、鸟苷、尿苷或胞苷。在一些实施方案中,x选自2
’‑
o
‑
甲基修饰的腺苷、鸟苷、尿苷或胞苷。在一些实施方案中,y选自2
’‑
脱氧
‑2’‑
氟修饰的腺苷、鸟苷、尿苷或胞苷。在一些实施方案中,y选自2
’‑
o
‑
甲基修饰的腺苷、鸟苷、尿苷或胞苷。
[0474]
在某些实施方案中,式(iii)的结构不包含错配。在一个实施方案中,式(iii)的结构包含1个错配。在另一个实施方案中,式(iii)化合物包含2个错配。在另一个实施方案中,式(iii)化合物包含3个错配。在另一个实施方案中,式(iii)化合物包含4个错配。
[0475]
式(iv)的结构
[0476]
在一些实施方案中,式(i)化合物具有下式(iv)的结构:
[0477][0478]
其中,x在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;y在每次出现时独立地选自腺苷、鸟苷、尿苷、胞苷,及其经化学修饰的衍生物;
‑
代表磷酸二酯核苷间连接;=代表硫代磷酸酯核苷间连接;以及
‑‑‑
在每次出现时分别代表碱基配对相互作用或错配。
[0479]
在某些实施方案中,式(iv)的结构不包含错配。在一个实施方案中,式(iv)的结构包含1个错配。在另一个实施方案中,式(iv)化合物包含2个错配。在另一个实施方案中,式(iv)化合物包含3个错配。在另一个实施方案中,式(iv)化合物包含4个错配。在一些实施方案中,每个核酸均由经化学修饰的核苷酸组成。
[0480]
在某些实施方案中,式(iv)结构的x的>95%、>90%、>85%、>80%、>75%、>70%、>65%、>60%、>55%或>50%为经化学修饰的核苷酸。在另一些实施方案中,式(iv)结构的x的>95%、>90%、>85%、>80%、>75%、>70%、>65%、>60%、>55%或>50%为经化学修饰的核苷酸。
[0481]
式(v)的结构
[0482]
在一些实施方案中,式(i)化合物具有下式(v)的结构:
[0483][0484]
其中,x在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;x在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸;y在每次出现时独立地是包含2
’‑
脱氧
‑2’‑
氟修饰的核苷酸;以及y在每次出现时独立地是包含2
’‑
o
‑
甲基修饰的核苷酸。
[0485]
在某些实施方案中,x选自2
’‑
脱氧
‑2’‑
氟修饰的腺苷、鸟苷、尿苷或胞苷。在一些实施方案中,x选自2
’‑
o
‑
甲基修饰的腺苷、鸟苷、尿苷或胞苷。在一些实施方案中,y选自2
’‑
脱氧
‑2’‑
氟修饰的腺苷、鸟苷、尿苷或胞苷。在一些实施方案中,y选自2
’‑
o
‑
甲基修饰的腺苷、鸟苷、尿苷或胞苷。
[0486]
在某些实施方案中,式(v)的结构不包含错配。在一个实施方案中,式(v)的结构包含1个错配。在另一个实施方案中,式(v)化合物包含2个错配。在另一个实施方案中,式(v)化合物包含3个错配。在另一个实施方案中,式(v)化合物包含4个错配。
[0487]
可变接头
[0488]
在式(i)化合物的一个实施方案中,l具有l1的结构:
[0489][0490]
在l1的一个实施方案中,r是r3且n是2。
[0491]
在式(ii)结构的一个实施方案中,l具有l1的结构。在式(iii)结构的一个实施方案中,l具有l1的结构。在式(iv)结构的一个实施方案中,l具有l1的结构。在式(v)结构的一个实施方案中,l具有l1的结构。在式(vi)结构的一个实施方案中,l具有l1的结构。在式(vi)结构的一个实施方案中,l具有l1的结构。
[0492]
在式(i)化合物的一个实施方案中,l具有l2的结构:
[0493][0494]
在l2的一个实施方案中,r是r3且n是2。在式(ii)结构的一个实施方案中,l具有l2的结构。在式(iii)结构的一个实施方案中,l具有l2的结构。在式(iv)结构的一个实施方案中,l具有l2的结构。在式(v)结构的一个实施方案中,l具有l2的结构。在式(vi)结构的一个实施方案中,l具有l2的结构。在式(vi)结构的一个实施方案中,l具有l2的结构。
[0495]
递送系统
[0496]
在第三方面中,本文提供了用于具有下式(vi)的结构的治疗性核酸的递送系统:
[0497][0498]
其中l选自乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑及其组合,其中式(vi)任选地还包含一个或更多个分支点b和一个或更多个间隔子s,其中b在每次出现时独立地是多价有机物物质或其衍生物;s在每次出现时独立地选自乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑及其组合;每个cna独立地是包含一个或更多个化学修饰的载体核酸;以及n是2、3、4、5、6、7或8。
[0499]
在递送系统的一个实施方案中,l是乙二醇链。在递送系统的另一个实施方案中,l是烷基链。在递送系统的另一个实施方案中,l是肽。在递送系统的另一个实施方案中,l是rna。在递送系统的另一个实施方案中,l是dna。在递送系统的另一个实施方案中,l是磷酸酯。在递送系统的另一个实施方案中,l是膦酸酯。在递送系统的另一个实施方案中,l是氨基磷酸酯。在递送系统的另一个实施方案中,l是酯。在递送系统的另一个实施方案中,l是酰胺。在递送系统的另一个实施方案中,l是三唑。
[0500]
在递送系统的一个实施方案中,s是乙二醇链。在另一个实施方案中,s是烷基链。在递送系统的另一个实施方案中,s是肽。在另一个实施方案中,s是rna。在递送系统的另一个实施方案中,s是dna。在递送系统的另一个实施方案中,s是磷酸酯。在递送系统的另一个实施方案中,s是膦酸酯。在递送系统的另一个实施方案中,s是氨基磷酸酯。在递送系统的
另一个实施方案中,s是酯。在另一个实施方案中,s是酰胺。在另一个实施方案中,s是三唑。
[0501]
在递送系统的一个实施方案中,n是2。在递送系统的另一个实施方案中,n是3。在递送系统的另一个实施方案中,n是4,在递送系统的另一个实施方案中,n是5。在递送系统的另一个实施方案中,n是6。在递送系统的另一个实施方案中,n是7。在递送系统的另一个实施方案中,n是8。
[0502]
在某些实施方案中,每个cna包含>95%、>90%、>85%、>80%、>75%、>70%、>65%、>60%、>55%或>50%的经化学修饰的核苷酸。
[0503]
在一些实施方案中,式(vi)化合物具有选自表5的式(vi
‑
1)至(vi
‑
9)的结构:
[0504]
表5
[0505][0506]
在一些实施方案中,式(vi)化合物为式(vi
‑
1)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
2)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
3)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
4)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
5)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
6)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
7)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
8)结构。在一些实施方案中,式(vi)化合物为式(vi
‑
9)结构。
[0507]
在一些实施方案中,式(vi)(包括,例如式(vi
‑
1)至(vi
‑
9))的化合物,每个cna独立地包含至少15个连续核苷酸。在一些实施方案中,每个cna独立地由经化学修饰的核苷酸组成。
[0508]
在一些实施方案中,递送系统还包含n个治疗性核酸(na),其中每个na包含与5’guuuaauaaagauucaccaaguuucacgcaaa3’或5’uggacccuaguuuaauaaagauucaccaag3’基本上互补的互补区域。在另一些实施方案中,na包括能够靶向靶序列5’gauucaccaaguuua3’、5’caaguuucacgcaa3’和5’ccuaguuuaauaaagauuca3’中的一个或更多个的链。
[0509]
此外,每个na均与至少一个cna杂交。在一个实施方案中,递送系统包含2个na。在另一个实施方案中,递送系统包含3个na。在另一个实施方案中,递送系统包含4个na。在另一个实施方案中,递送系统包含5个na。在另一个实施方案中,递送系统包含6个na。在另一个实施方案中,递送系统包含7个na。在另一个实施方案中,递送系统包含8个na。
[0510]
在一些实施方案中,每个na独立地包含至少16个连续核苷酸。在一些实施方案中,每个na独立地包含16至20个连续核苷酸。在一些实施方案中,每个na独立地包含16个连续核苷酸。在另一个实施方案中,每个na独立地包含17个连续核苷酸。在另一个实施方案中,每个na独立地包含18个连续核苷酸。在另一个实施方案中,每个na独立地包含19个连续核苷酸。在另一个实施方案中,每个na独立地包含20个连续核苷酸。
[0511]
在一些实施方案中,每个na包含至少2个核苷酸的未配对突出端。在另一个实施方案中,每个na包含至少3个核苷酸的未配对突出端。在另一个实施方案中,每个na包含至少4个核苷酸的未配对突出端。在另一个实施方案中,每个na包含至少5个核苷酸的未配对突出端。在另一个实施方案中,每个na包含至少6个核苷酸的未配对突出端。在一些实施方案中,突出端的核苷酸通过硫代磷酸酯连接来连接。
[0512]
在一些实施方案中,每个na独立地选自:dna、sirna、antagomir、mirna、间隔聚体、混合聚体或向导rna。在一个实施方案中,每个na独立地为dna。在另一个实施方案中,每个na独立地为sirna。在另一个实施方案中,每个na独立地为antagomir。在另一个实施方案中,每个na独立地为mirna。在另一个实施方案中,每个na独立地为间隔聚体。在另一个实施方案中,每个na独立地为混合聚体。在另一个实施方案中,每个na独立地为向导rna。在一些实施方案中,每个na相同。在一些实施方案中,每个na不相同。
[0513]
在一些实施方案中,还包含n个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。在一个实施方案中,还包含2个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。在另一个实施方案中,还包含3个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。在一个实施方案中,还包含4个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。在一个实施方案中,还包含5个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。在一个实施方案中,还包含6个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。在一个实施方案中,还包含7个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。在一个实施方案中,还包含8个治疗性核酸(na)的递送系统具有选自本文所述的式(i)、(ii)、(iii)、(iv)、(v)、(vi)及其实施方案的结构。
[0514]
在一个实施方案中,还包含结构l1或l2的接头的递送系统具有选自式(i)、(ii)、(iii)、(iv)、(v)、(vi)的结构,其中r是r3且n是2。在另一个实施方案中,还包含结构l1的接
头的递送系统具有选自式(i)、(ii)、(iii)、(iv)、(v)、(vi)的结构,其中r是r3且n是2。在另一个实施方案中,还包含结构l2的接头的递送系统具有选自式(i)、(ii)、(iii)、(iv)、(v)、(vi)的结构,其中r是r3且n是2。
[0515]
在递送系统的一个实施方案中,递送靶标选自:脑、肝、皮肤、肾、脾、胰腺、结肠、脂肪、肺、肌肉和胸腺。在一个实施方案中,递送的靶标是脑。在另一个实施方案中,递送的靶标是脑的纹状体。在另一个实施方案中,递送的靶标是脑的皮质。在另一个实施方案中,递送的靶标是脑的纹状体。在一个实施方案中,递送的靶标是肝。在一个实施方案中,递送的靶标是皮肤。在一个实施方案中,递送的靶标是肾。在一个实施方案中,递送的靶标是脾。在一个实施方案中,递送的靶标是胰腺。在一个实施方案中,递送的靶标是结肠。在一个实施方案中,递送的靶标是脂肪。在一个实施方案中,递送的靶标是肺。在一个实施方案中,递送的靶标是肌肉。在一个实施方案中,递送的靶标是胸腺。在一个实施方案中,递送的靶标是脊髓。
[0516]
在某些实施方案中,本发明的化合物的特征在于以下特性:(1)两个或更多个分支寡核苷酸,例如,其中3’和5’端的数量不相等,(2)基本上化学稳定,例如,其中40%以上、最佳100%的寡核苷酸经化学修饰(例如,无rna和任选的无dna);以及(3)含有至少3个、最佳为5至20个硫代磷酸酯键的硫代磷酸酯化单寡核苷酸。
[0517]
应理解,本公开内容中描述的方法不限于本文中公开的特定的方法和实验条件,因为这些方法和条件可以改变。还应理解,本文中使用的术语仅出于描述具体实施方案的目的,并不旨在是限制性的。
[0518]
此外,除非另有说明,否则本文所述的实验使用本领域技术范围内的常规分子技术和细胞生物学及免疫学的技术。这样的技术为本领域技术人员所公知,并在文献中进行了充分解释。参见,例如ausubel,et al.,ed.,current protocols in molecular biology,john wiley&sons,inc.,ny(1987
‑
2008),包括所有附录;mr green和j.sambrook和harlow等的molecular cloning:a laboratory manual(第四版);antibodies:a laboratory manual,第14章,cold spring harbor laboratory,cold spring harbor(2013,第二版)。
[0519]
引入核酸、载体和宿主细胞的方法
[0520]
本发明的rna沉默剂可以直接引入到细胞(例如,神经细胞)中(即,细胞内);或者细胞外地引入腔、胞间隙空间、生物体的循环系统、经口引入,或者可以通过在含有核酸的溶液中洗浴细胞或生物体来引入。血管循环或血管外循环、血液或淋巴系统以及脑脊液是可以引入核酸的部位。
[0521]
可以使用本领域已知的核酸递送方法引入本发明的rna沉默剂,包括注射包含核酸的溶液,用核酸覆盖的颗粒轰击,将细胞或组织浸润在核酸的溶液中,或者在核酸的存在下对细胞膜进行电穿孔。可以使用本领域已知向细胞引入核酸的其他方法,例如脂质介导的载体转运、化学物质介导的转运和阳离子脂质体转染例如磷酸钙等。核酸可以与表现一种或更多种以下活性的其他组分一起引入:增强细胞对核酸的摄取或以其他方式增强对靶基因的抑制。
[0522]
引入核酸的物理方法包括注射包含rna的溶液,用rna覆盖的颗粒轰击,将细胞或组织浸润在rna的溶液中,或者在rna的存在下对细胞膜进行电穿孔。包装到病毒颗粒中的
病毒构建体可以实现将表达构建体有效引入到细胞中和转录由表达构建体编码的rna二者。可以使用本领域已知的用于向细胞引入核酸的其他方法,例如脂质介导的载体转运、化学物质介导的转运,例如磷酸钙等。因此,rna可以与表现一种或更多种以下活性的组分一起引入:增强细胞对rna的摄取、抑制单链退火、稳定单链或以其他方式增强对靶基因的抑制。
[0523]
rna可以直接引入到细胞中(即,细胞内);或者细胞外地引入腔、组织间隙空间、生物体的循环系统、经口引入,或者可以通过在含有rna的溶液中洗浴细胞或生物体来引入。血管循环或血管外循环、血液或淋巴系统以及脑脊液是rna可能被引入的位点。
[0524]
具有靶基因的细胞可以是来自生殖系的或体细胞、全能性或多能性、分裂或不分裂、实质或上皮、永生化或转化的等。细胞可以是干细胞或分化的细胞。分化的细胞类型包括脂肪细胞、成纤维细胞、肌细胞、心肌细胞、内皮细胞、神经细胞、神经胶质细胞、血细胞、巨核细胞、淋巴细胞、巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、白细胞、粒细胞、角质形成细胞、软骨细胞、成骨细胞、破骨细胞、肝细胞以及内分泌腺细胞或外分泌腺细胞。
[0525]
取决于具体的靶基因和所递送的双链rna物质的剂量,该过程可使靶基因部分或完全丧失功能。至少50%、60%、70%、80%、90%、95%或99%或更多的靶向的细胞中的基因表达降低或丧失是示例性的。“基因表达的抑制”是指来自靶基因的蛋白质和/或mrna产物水平的不存在(或可观察到的降低)。特异性是指抑制靶基因而对细胞的其他基因无明显影响的能力。可通过对细胞或生物体的外在特性的检查(如下面的实施例所示)或者通过生物化学技术(例如rna溶液杂交、核酸酶保护、northern杂交、逆转录、使用微阵列的基因表达监测、抗体结合、酶联免疫吸附测定(enzyme linked immunosorbent assay,elisa)、western印迹、放射免疫测定(radioimmunoassay,ria)、其他免疫测定和荧光激活细胞分析(fluorescence activated cell analysis,facs))来确认抑制的结果。
[0526]
对于在细胞系或整个生物体中的rna介导的抑制,可通过使用报道分子或易于测定其蛋白质产物的耐药性基因来方便地测定基因表达。这样的报告基因包括乙酰羟基酸合酶(acetohydroxyacid synthase,ahas)、碱性磷酸酶(alkaline phosphatase,ap)、β半乳糖苷酶(lacz)、β葡萄糖醛酸苷酶(gus)、氯霉素乙酰转移酶(chloramphenicol acetyltransferase,cat)、绿色荧光蛋白(green fluorescent protein,gfp)、辣根过氧化物酶(horseradish peroxidase,hrp)、萤光素酶(luc)、胭脂碱合酶(nopalinesynthase,nos)、章鱼碱合酶(octopine synthase,ocs),及其衍生物。可获得多种可选择的标志物,其赋予了对氨苄西林、博来霉素、氯霉素、庆大霉素、潮霉素、卡那霉素、林可霉素、甲氨蝶呤、膦丝菌素、嘌呤霉素和四环素的抗性。取决于测定,基因表达量的定量允许人们确定抑制程度,与未根据本发明处理的细胞相比,该抑制程度大于10%、33%、50%、90%、95%或99%。较低剂量的注射物质和施用rnai剂后的较长时间可导致较小部分的细胞(例如,至少10%、20%、50%、75%、90%或95%的靶向的细胞)中的抑制。细胞中基因表达的定量可在靶mrna的积累水平或在靶蛋白的翻译水平上显示出类似的抑制的量。例如,可通过评估细胞中基因产物的量来确定抑制效率;可使用具有用于抑制性双链rna的区域之外的核苷酸序列的杂交探针来检测mrna,或者可使用针对该区域的多肽序列而培育的抗体来检测经翻译的多肽。
[0527]
rna的引入量可允许每个细胞递送至少一份拷贝。较高剂量(例如,每个细胞至少5、10、100、500或1000份拷贝)的物质可产生更有效的抑制;较低剂量也可用于特定应用。
[0528]
在一个示例性方面中,针对本发明的rnai剂(例如,靶向apoe靶序列的sirna)特异性降解细胞中,特别是神经元(例如纹状体或皮质神经元克隆系和/或初级神经元)中的突变mrna(例如,apoe mrna和/或apoe蛋白的产生)的能力而测试了其效力。同样适用于基于细胞的验证测定的是其他容易地可转染的细胞,例如hela细胞或cos细胞。细胞用人野生型或突变cdna(例如,人野生型或突变apoe cdna)转染。对标准sirna、经修饰的sirna或能够从u
‑
环mrna产生sirna的载体进行共转染。测量了靶mrna(例如apoe mrna)和/或靶蛋白(例如apoe蛋白)的选择性减少。可将靶mrna或蛋白质的减少与不存在rnai剂或存在不靶向apoe mrna的rnai剂时的靶mrna或蛋白质的水平进行比较。可出于比较目的测定外源性引入的mrna或蛋白质(或内源性mrna或蛋白质)。当利用神经元细胞(已知其对标准转染技术有一定抗性)时,可期望通过被动摄取引入rnai剂(例如sirna)。
[0529]
重组腺相关病毒和载体
[0530]
在某些示例性实施方案中,重组腺相关病毒(raav)及其相关载体可用于将一种或更多种sirna递送至细胞中,例如神经细胞(例如脑细胞)中。aav能够感染许多不同的细胞类型,尽管感染效率因血清型而异,血清型是由衣壳蛋白的序列决定的。已鉴定了几种天然aav血清型,其中血清型1至9是重组aav最常见的血清型。aav
‑
2是研究最充分和公开最多的血清型。aav
‑
dj体系包括血清型aav
‑
dj和aav
‑
dj/8。这些血清型是通过对多个aav血清型进行dna混编(dna shuffling),以产生具有在多种细胞和组织中具有提高的体外(aav
‑
dj)和体内(aav
‑
dj/8)转导效率的杂交衣壳的aav而产生的。
[0531]
在一些具体实施方案中,可通过血管内递送重组腺相关病毒7(raav7)、raav9和raav10或其他合适的raav来实现广泛的中枢神经系统(cns)递送(zhang et al(2011)mol ther.19(8):1440
‑
8.doi:10.1038/mt.2011.98.epub 2011may24)。raav及其相关载体在本领域中是公知的,并在美国专利申请2014/0296486、2010/0186103、2008/0269149、2006/0078542和2005/0220766中进行了描述,出于所有目的,其各自通过引用整体并入本文。
[0532]
可根据本领域已知的任何适当方法以组合物形式将raav递送至对象。raav可悬浮在生理学相容的载体中(即,以组合物形式),并可施用于对象,即宿主动物,例如人、小鼠、大鼠、猫、狗、绵羊、兔、马、牛、山羊、猪、豚鼠、仓鼠、鸡、火鸡、非人灵长类(例如猕猴)等。在某些实施方案中,宿主动物是非人宿主动物。
[0533]
向哺乳动物对象递送一种或更多种raav可通过例如肌内注射或施用到哺乳动物对象的血流中来进行。向血流中施用可通过向静脉、动脉或任何其他血管导管中注射来进行。在某些实施方案中,通过隔离肢体灌注(isolated limb perfusion)(外科手术领域中公知的技术)将一种或更多种raav施用到血流中,该方法基本上使技术人员能够在施用raav病毒粒子之前将肢体与体循环隔离。熟练技术人员也可采用美国专利no.6,177,403中所述的隔离肢体灌注技术的变化形式将病毒粒子施用到隔离肢体的脉管系统,以潜在地增强向肌肉细胞或组织内的转导。此外,在某些情况下,可期望将病毒粒子递送到对象的中枢神经系统(cns)。“cns”意指脊椎动物脑和脊髓的所有细胞和组织。因此,该术语包括但不限于神经元细胞、神经胶质细胞、星形胶质细胞、脑脊液(cerebrospinal fluid,csf)、胞间隙、骨、软骨等。可通过注射到例如心室区域(ventricular region)将重组aav直接递送至
cns或脑,以及使用针、导管或相关装置,使用本领域已知的神经外科技术,例如通过立体定向注射将其直接递送至纹状体(例如纹状体尾核或壳核)、脊髓和神经肌肉接头、或小脑小叶(参见,例如stein et al.,j virol 73:3424
‑
3429,1999;davidson et al.,pnas 97:3428
‑
3432,2000;davidson et al.,nat.genet.3:219
‑
223,1993;以及alisky和davidson,hum.gene ther.11:2315
‑
2329,2000)。
[0534]
本发明的组合物可包含单独的raav,或raav与一种或更多种其他病毒(例如,编码具有一种或更多种不同转基因的第二raav)的组合。在某些实施方案中,组合物包含1、2、3、4、5、6、7、8、9、10或更多种不同的raav,每种raav具有一种或更多种不同的转基因。
[0535]
raav的有效量是足以靶向感染动物、靶向期望组织的量。在一些实施方案中,raav的有效量是足以产生稳定的体细胞转基因动物模型的量。有效量将主要取决于例如对象的物种、年龄、体重、健康和待靶向的组织的因素,因此可能因动物和组织而异。例如,一种或更多种raav的有效量的范围通常为约1ml至约100ml的含有约109至10
16
基因组拷贝的溶液。在一些情况下,约10
11
至10
12
raav基因组拷贝的剂量是适当的。在某些实施方案中,10
12
raav基因组拷贝有效靶向心脏、肝和胰腺组织。在一些情况下,通过raav的多剂量产生稳定的转基因动物。
[0536]
在一些实施方案中,配制raav组合物以降低组合物中aav颗粒的聚集,特别是在存在高raav浓度(例如,约10
13
基因组拷贝/ml或更高)的情况下。降低raav聚集的方法在本领域是公知的,包括例如添加表面活性剂、ph调节、盐浓度调节等(参见例如,wright et al(2005)molecular therapy 12:171
‑
178,其内容通过引用并入本文。)
[0537]“重组aav(raav)载体”最少包含转基因及其调节序列,以及5’和3’aav反向末端重复(inverted terminal repeat,itr)。将这种重组aav载体包装成衣壳蛋白并递送至所选的靶细胞。在一些实施方案中,转基因是与载体序列异源的核酸序列,其编码作为目标的多肽、蛋白质、功能性rna分子(例如,sirna)或其他基因产物。核酸编码序列以允许在靶组织细胞中转基因转录、翻译和/或表达的方式与调节组分有效连接。
[0538]
载体的aav序列通常包含顺式作用的5’和3’反向末端重复(itr)序列(参见例如,b.j.carter,在
″
handbook of parvoviruses
″
,ed.,p.tijsser,crc press,pp.155168(1990)中)。itr序列的长度通常为约145个碱基对。在某些实施方案中,在分子中基本上使用编码itr的整个序列,尽管允许对这些序列进行一些程度的轻微修饰。修饰这些itr序列的能力在本领域技术内。(参见例如sambrook et al,
″
molecular cloning.a laboratory manual
″
,第2版,cold spring harbor laboratory,new york(1989);以及k.fisher et al.,j virol,70:520532(1996)的文本)。本发明中采用的这样的分子的实例为含有转基因的“顺式作用”的质粒,其中所选的转基因序列和相关调节元件侧翼为5’和3’aav itr序列。可从包括本文进一步描述的哺乳动物aav类型的任何已知aav获得aav itr序列。
[0539]
viii.治疗方法
[0540]
在一个方面中,本发明提供了治疗处于全部或部分由胆固醇转运异常引起的疾病或病症风险中(或易感于全部或部分由胆固醇转运异常引起的疾病或病症)的对象的预防性和治疗性两种方法。在一个实施方案中,疾病或病症使得中枢神经系统(cns)中的apoe水平已被发现可预测神经退行性变的进展。在另一个实施方案中,疾病或病症为聚谷氨酰胺病症。在一个优选的实施方案中,其中cns中apoe降低的疾病或病症降低了在神经退行性疾
病例如ad和als中所见的临床表现。
[0541]
本文所用的“治疗”被定义为向患者应用或施用治疗剂(例如,rna剂或载体或者编码它们的转基因),或者向患者的分离组织或细胞系应用或施用治疗剂,所述患者患有疾病或病症、具有疾病或病症的症状或者对疾病或病症的倾向,目的是护理、治愈、缓解、减轻、改变、补救、改良、提高或影响所述疾病或病症、疾病或病症的症状或者对疾病的倾向。
[0542]
在一个方面中,本发明提供了用于通过向对象施用治疗剂(例如,rnai剂或载体或者编码它们的转基因)来预防对象中上述疾病或病症的方法。例如,可通过本文所述的任意或组合的诊断或预后测定来鉴定处在该疾病风险中的对象。可在疾病或病症的特征性症状表现之前施用预防性剂,以使疾病或病症被预防或作为替选地延迟其进展。
[0543]
本发明的另一个方面涉及治疗性地(即改变疾病或病症的症状的出现)对对象进行治疗的方法。在一个示例性实施方案中,本发明的调节方法涉及将表达apoe的cns细胞与对基因内的靶序列(例如,seq id no:1、2或3)具有特异性的治疗剂(例如,rnai剂或载体或者编码它们的转基因)接触,使得实现对该基因的序列特异性干扰。这些方法可在体外(例如,通过用药剂培养细胞)或作为替选地在体内(例如,通过向对象施用药剂)进行。
[0544]
关于预防性和治疗性的两种治疗方法,可以基于从药物基因组学领域获得的知识特别定制或修改这样的治疗方法。本文所用的“药物基因组学”是指将基因组学技术,例如基因测序、统计遗传学和基因表达分析应用于临床开发中和市场上的药物。更具体地,该术语是指研究患者的基因如何决定他或她对药物的响应(例如,患者的“药物响应表型”或“药物响应基因型”)。因此,本发明的另一个方面提供了根据个体的药物响应基因型,使用本发明的靶基因分子或靶基因调节剂来定制个体的预防性或治疗性治疗的方法。药物基因组学允许临床医生或内科医生针对对于将从治疗中获益最多的患者的预防性或治疗性治疗,并避免对会经历与药物相关的毒性副作用的患者的治疗。
[0545]
治疗剂可在适当的动物模型中进行测试。例如,如本文所述的rnai剂(或表达载体或编码其的转基因)可在动物模型中用于确定使用所述药剂治疗的效力、毒性或副作用。或者,可在动物模型中使用治疗剂来确定这样的药剂的作用机制。例如,可在动物模型中使用药剂来确定用这样的药剂治疗的效力、毒性或副作用。或者,可在动物模型中使用药剂来确定这样的药剂的作用机制。
[0546]
可将含有本发明rna沉默剂的药物组合物施用于被诊断为患有神经退行性疾病或处于发展神经退行性疾病风险中的任何患者。在一个实施方案中,患者被诊断为患有神经性病症,并且患者在其他方面总体健康良好。例如,患者未患绝症,并且患者在诊断后可至少活2、3、5年或更多年。患者可在诊断后立即接受治疗,或可延迟治疗直到患者经历更令人虚弱的症状,例如帕金森病患者的运动波动和动力障碍。在另一个实施方案中,患者尚未到达疾病的晚期。
[0547]
在该方面的一些实施方案中,预防性和治疗性方法旨在治疗或管理神经退行性疾病或病症,其中cns中apoe的降低降低了异常淀粉样物质积聚。在一个非限制性实例中,rna沉默剂是向被诊断为患有淀粉样物质相关的神经退行性疾病或病症,例如阿尔茨海默病、脑淀粉样血管病或轻度至中度认知损害或者处在发生所述神经退行性疾病或病症的风险中的患者施用的如本文第vi和vii节所述的分支寡核苷酸。患者可在诊断后、疾病的不同阶段时接受治疗,或在遗传特征、家族史或者使患者处于神经退行性疾病或病症风险的其他
因素的情况下作为预防性措施。可通过有效治疗的指示指标,例如症状(例如在治疗开始后检测到的认知衰退、脑中的β
‑
淀粉样斑块的形成和神经退行性变)的抑制、延迟、预防或减轻的程度来建立和监测成功的剂量量和计划表。
[0548]
在一个实施方案中,患者被诊断为患有阿尔茨海默病或处在患阿尔茨海默病的风险中,并且患者在其他方面健康状况良好。治疗是通过施用di
‑
sirna
apoe
,即包含两个长度分别在15和35个碱基之间的核酸的分支寡核苷酸进行。每个核酸具有与apoe mrna的一部分(例如表1、表2或表7中所示的一种或更多种靶序列)基本上互补的互补区域。两个核酸通过例如接头、间隔子或分支点相互连接。每个核酸可独立地为单链(ss)rna或双链(ds)rna。例如,每个核酸都可独立地是反义分子或间隔聚体。
[0549]
经修饰以增强摄取进入神经细胞的rna沉默剂可以以下的单位剂量施用:每kg体重小于约1.4mg,或者每kg体重小于10、5、2、1、0.5、0.1、0.05、0.01、0.005、0.001、0.0005、0.0001、0.00005或0.00001mg,以及每kg体重小于200纳摩尔的rna剂(例如,约4.4
×
10
16
个拷贝),或每kg体重小于1500、750、300、150、75、15、7.5、1.5、0.75、0.15、0.075、0.015、0.0075、0.0015、0.00075、0.00015纳摩尔rna沉默剂。例如,单位剂量可通过注射(例如,静脉内或肌内、鞘内或直接注射到脑中)、吸入剂量或局部应用施用。特别优选的剂量小于2、1或0.1mg/kg体重。
[0550]
将rna沉默剂直接递送至器官(例如,直接递送至脑)的剂量可为近似约0.00001mg至约3mg/器官,或优选约0.0001至0.001mg/器官、约0.03至3.0mg/器官、约0.1至3.0mg/眼或约0.3至3.0mg/器官。在另一个实施方案中,剂量可为近似约10mg至约50mg/器官,或优选约20mg至约30mg/器官。剂量可以是有效治疗或预防神经退行性疾病或病症(例如ad或als)的量。在一个实施方案中,单位剂量的施用频率低于每天一次,例如低于每2、4、8或30天一次。在另一个实施方案中,单位剂量不以一定频率施用(例如,不以常规频率施用)。例如,单位剂量可单次施用。在一个实施方案中,有效剂量与其他传统治疗方式一起施用。
[0551]
在一个实施方案中,向对象施用初始剂量和一个或更多个维持剂量的rna沉默剂。维持剂量通常低于初始剂量,例如,是初始剂量的一半。维持方案可包括用每天0.01μg/kg体重至10mg/kg体重的剂量治疗对象,例如用每天10、1、0.1、0.01、0.001或0.00001mg/kg体重的剂量治疗对象。维持剂量优选每5、10或30天施用不超过一次。此外,治疗方案可持续一段时间,该时间段将根据特定疾病的性质、其严重程度和患者的总体状况而变化。在一些优选的实施方案中,剂量可每天递送不超过一次,例如每24、36、48小时或更多小时不超过一次,例如每5或8天不超过一次。治疗后,可监测患者状况的变化和疾病状态症状的缓解。如果患者对当前剂量水平没有显著响应,则可提高化合物的剂量,或者如果观察到疾病状态的症状缓解,如果疾病状态消融,或者如果观察到不期望的副作用,则可降低剂量。
[0552]
如所期望或在特定情况下认为合适,有效剂量可以以单一剂量或者以两次或更多次剂量施用。如果期望促进重复或频繁输注,则可建议植入递送装置,例如泵、半永久性支架(如静脉内、腹膜内、脑池内或囊内)或贮存器。在一个实施方案中,药物组合物包含多种rna沉默剂物质。在另一个实施方案中,rna沉默剂物质具有相对于天然存在的靶序列而言与另一物质不重叠且不相邻的序列。在另一个实施方案中,多种rna沉默剂物质对不同的天然存在的靶基因是特异性的。在另一个实施方案中,rna沉默剂是等位基因特异性的。在另一个实施方案中,多种rna沉默剂物质靶向两个或更多个靶序列(例如,两个、三个、四个、五
个、六个或更多个靶序列)。
[0553]
在成功治疗后,可期望使患者经受维持治疗以预防疾病状态的复发,其中本发明化合物以0.01μg/kg体重至100g/kg体重的维持剂量施用(参见美国专利no.6,107,094)。
[0554]
rna沉默剂组合物的浓度是足以在人中有效地治疗或预防病症或调节生理状况的量。所施用的rna沉默剂的浓度或量将取决于对于所施用的药剂和方法(例如经鼻、颊或经肺施用)所确定的参数。例如,经鼻制剂倾向于需要某些成分的低得多的浓度,以避免刺激或灼伤鼻腔通道。有时需要将经口制剂稀释至多10至100倍以提供合适的经鼻制剂。
[0555]
某些因素可影响有效治疗对象所需的剂量,包括但不限于疾病或病症的严重程度、先前的治疗、对象的一般健康状况和/或年龄、以及存在的其他疾病。此外,用治疗有效量的rna沉默剂治疗对象可包括单一治疗,或者优选地可包括一系列治疗。还应理解,用于治疗的rna沉默剂的有效剂量可在特定治疗过程中提高或降低。剂量的变化可由本文中所述的诊断测定的结果产生并通过该结果而变得明显。例如,可在施用rna沉默剂组合物后监测对象。基于来自监测的信息,可施用另外量的rna沉默剂组合物。
[0556]
剂量取决于待治疗的疾病状况的严重程度和响应性,治疗过程持续数天至数月,或直至实现治愈或实现疾病状态的减轻。可根据患者体内药物积聚的测量值来计算最佳给药方案。普通技术人员可容易地确定最佳剂量、给药方法和重复率。最佳剂量可根据各化合物的相对效力而变化,并且通常可基于发现在体外和体内动物模型中有效的ec50进行估计。在一些实施方案中,动物模型包括表达人基因,例如产生靶rna(例如在神经细胞中表达的rna)的基因的转基因动物。转基因动物可缺乏相应的内源性rna。在另一个实施方案中,用于测试的组合物包括至少在内部区域与在动物模型中的靶rna和人中的靶rna之间保守的序列互补的rna沉默剂。
[0557]
ix.药物组合物和施用方法
[0558]
本发明涉及上述药剂用于下文所述的预防性和/或治疗性治疗的用途。因此,可将本发明的调节剂(例如rnai剂)并入适于施用的药物组合物中。这样的组合物通常包含核酸分子、蛋白质、抗体或凋节化合物和可药用载体。本文中使用的语言“可药用载体”旨在包括与药物施用相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂等。这样的介质和药剂用于药物活性物质的用途是本领域公知的。除非任何常规介质或药剂与所属活性化合物不相容,否则均可考虑用于所述组合物中。还可向所述组合物中并入补充的活性化合物。
[0559]
本发明的药物组合物配制成与其预定施用途径相容。施用途径的一些实例包括:肠胃外(例如,静脉内、皮内、皮下、腹膜内、肌内、经口(例如吸入)、经皮(表面)和经黏膜)施用。在某些示例性实施方案中,本发明的药物组合物通过包括但不限于纹状体内(is)施用、脑室内(icv)施用和鞘内(it)施用(例如,通过泵、输液等)的施用途径递送至脑脊液(csf)。用于肠胃外、皮内或皮下施用的溶液剂或混悬剂可包含以下组分:无菌稀释剂例如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂例如苄醇或对羟基苯甲酸甲酯;抗氧化剂例如抗坏血酸或亚硫酸氢钠;螯合剂例如乙二胺四乙酸;缓冲剂例如乙酸盐、柠檬酸盐或磷酸盐和用于调节张度(tonicity)的药剂例如氯化钠或右旋糖(dextrose)。可通过酸或碱,例如盐酸或氢氧化钠调节ph。肠胃外制剂可封装在安瓿、一次性注射器或者由玻璃或塑料制成的多剂量瓶(multiple dose vial)中。
[0560]
适于可注射使用的药物组合物包括无菌水溶液(在水溶性时)或分散体,以及用于即时制备无菌可注射溶液或分散体的无菌粉末。对于静脉内、is、icv和/或it施用,合适的载体包括生理盐水、抑菌水、cremophor el
tm
(basf,parsippany,n.j.)或磷酸缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的并且在存在易注射性(easy syringability)的程度上应是流体。其在制备和储存条件下必须是稳定的,并且必须被保护以免于微生物(例如细菌和真菌)的污染行为。载体可以是溶剂或分散介质,其包括例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)以及其合适的混合物。例如,通过使用例如卵磷脂的涂层,通过在分散体的情况下维持所需的粒径和通过使用表面活性剂可以维持合适的流动性。防止微生物的作用可通过多种抗细菌剂和抗真菌剂,例如,对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在许多情况下,将优选在组合物中包含等张剂,例如糖、多元醇(例如甘露醇、山梨醇)、氯化钠。可注射组合物的延长吸收可通过在所述组合物中包含延迟吸收的物质(例如单硬脂酸铝和明胶)来实现。
[0561]
无菌可注射溶液可通过将所需量的活性化合物与以上列举的成分中的一种或组合(根据需要)一起并入合适的溶剂中,然后过滤灭菌来制备。通常来说,分散体通过将活性化合物并入到无菌载剂中来制备,所述无菌载剂包含基础分散介质和来自上面列举的那些的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其产生活性成分加来自经预先无菌过滤的溶液的任何另外的期望成分的粉末。
[0562]
经口组合物通常包括惰性稀释剂或可食用载体。可将它们封装在明胶胶囊中或压缩成片剂。出于经口治疗性施用的目的,可对活性化合物引入赋形剂并以片剂、锭剂或胶囊剂的形式使用。还可使用流体载体制备经口组合物以用作漱口剂,其中流体载体中的化合物经口应用并漱口并吐出或吞咽。可包括药物相容性黏合剂和/或辅料物质作为组合物的一部分。片剂、丸剂、胶囊、锭剂等可含有以下成分中的任一种或相似性质的化合物:黏合剂,例如微晶纤维素、西黄蓍胶(gum tragacanth)或明胶;赋形剂,例如淀粉或乳糖;崩解剂,例如藻酸、primogel或玉米淀粉;润滑剂,例如硬脂酸镁或sterotes;助流剂,例如胶体二氧化硅;甜味剂,例如蔗糖或糖精;或者矫味剂,例如薄荷、水杨酸甲酯或橙矫味剂。
[0563]
对于通过吸入施用,化合物以气溶胶喷雾剂的形式从含有合适的推进剂,例如例如二氧化碳的气体或雾化器的受压力容器或者分配器中递送。
[0564]
全身性施用也可以是通过经黏膜或经皮的方式。对于经黏膜或经皮施用,适合于待渗透的屏障的渗透剂用于制剂。这样的渗透剂通常是本领域中已知的,并且例如对于经黏膜施用,包括洗涤剂、胆盐和夫西地酸(fusidicacid)衍生物。经黏膜施用可通过使用鼻喷雾剂或栓剂来完成。对于经皮施用,活性化合物被配制成软膏剂、药膏、凝胶剂或乳霜,如本领域通常所知。
[0565]
所述化合物也可制备为栓剂(例如,使用传统栓剂基质,例如可可脂和其他甘油酯)或保留灌肠的形式用于直肠递送。
[0566]
也可使用本领域已知的方法通过转染或感染来施用rna沉默剂,所述方法包括但不限于mccaffrey et al.(2002),nature,418(6893),38
‑
9(流体动力转染);xia et al.(2002),nature biotechnol.,20(10),1006
‑
10(病毒介导的递送);或putnam(1996),am.j.health syst.pharm.53(2),151
‑
160,erratum at am.j.health syst.pharm.53(3),
325(1996)中描述的方法。
[0567]
也可通过任何适合于施用核酸剂的方法施用rna沉默剂,例如dna疫苗。这些方法包括基因枪法、生物注射器法和皮肤贴剂法以及无针方法,例如美国专利no.6,194,389中所公开的微粒dna疫苗技术,以及如美国专利no.6,168,587中所公开的使用粉末形式疫苗的哺乳动物经皮无针疫苗接种。此外,除其他外,鼻内施用是可能的,如hamajima et al.(1998),clin immunol immunopathol,88(2),205
‑
10所述。也可使用脂质体(例如,如美国专利no.6,472,375所述)和微胶囊。也可使用生物可降解的可靶向微粒递送系统(例如,如美国专利no.6,471,996所述)。
[0568]
在一个实施方案中,活性化合物用载体制备,所述载体将保护化合物免于从体内迅速消除,例如控制释放制剂,包括植入物和微囊化递送系统。可使用生物可降解、生物相容性聚合物,例如乙烯
‑
乙酸乙烯共聚物、聚酐、聚乙醇酸、胶原、聚正酯和聚乳酸。用于制备这样的制剂的方法对于本领域技术人员来说是明显的。这些材料也可以从alza corporation和nova pharmaceuticals,inc.商购。脂质体混悬剂(包括用针对病毒抗原的单克隆抗体靶向受感染的细胞的脂质体)也可以用作可药用载体。这些可以根据本领域技术人员已知的方法(如美国专利no.4,522,811中所述的)来制备。
[0569]
为了易于施用和剂量均匀性,以剂量单位形式配制经口或肠胃外组合物是特别有利的。本文中使用的剂量单位形式是指适合作为用于待治疗对象的单位剂量的物理分散单元;每个单元包含经计算与所需药用载体联合产生期望治疗效果的预定量活性化合物。本发明的剂量单位形式的规格由以下决定并且直接取决于此:活性化合物的独特特征和待实现的特定治疗效果,以及复配这样的活性化合物的领域中针对个体治疗的固有限制。
[0570]
这样的化合物的毒性和治疗效力可以通过细胞培养物或实验动物中的标准药物程序来确定,例如用于确定ld50(对50%群体致死的剂量)和ed50(在50%群体中治疗有效的剂量)。毒性与治疗效果之间的剂量比率是治疗指数并且其可以以比率ld50/ed50表示。表现出大治疗指数的化合物是优选的。虽然可使用表现出毒性副作用的化合物,但应注意设计将这样的化合物靶向至受影响组织的部位的递送系统以使对未感染细胞的潜在损害最小化并且从而降低副作用。
[0571]
从细胞培养测定和动物研究中获得的数据可用于配制用于人的一定范围的剂量。这样的化合物的剂量优选地位于包括ed50且几乎没有毒性或没有毒性的循环浓度范围内。剂量可以在该范围内变化,这取决于所用的剂量形式和所用的施用途径。对于本发明的方法中使用的任何化合物,可从细胞培养测定初步估计治疗有效剂量。可在动物模型中配制剂量,以实现包括如在细胞培养中确定的ec50(即,实现半最大响应的测试化合物浓度)的循环血浆浓度范围。这样的信息可用于更准确地确定人体中的可用剂量。可例如通过高效液相色谱来测量血浆中的水平。
[0572]
药物组合物可与任选的施用说明书一起包含在容器、包装或分配器中。
[0573]
如本文所定义,rna沉默剂的治疗有效量(即,有效剂量)取决于所选的rna沉默剂。例如,如果选择编码shrna的质粒,则可施用约1μg至1000mg范围内的单剂量;在一些实施方案中,可施用10、30、100或1000μg。在一些实施方案中,可施用1至5g组合物。该组合物可以以每天一次或更多次至每周一次或更多次(包括每隔一天一次)施用。技术人员将认识到,某些因素可影响有效治疗对象所需的剂量和时机,包括但不限于疾病或病症的严重程度、
先前的治疗、对象的一般健康状况和/或年龄、以及存在的其他疾病。此外,用治疗有效量的蛋白质、多肽或抗体治疗对象可包括单一治疗,或者优选地可包括一系列治疗。
[0574]
可将本发明的核酸分子插入表达构建体,例如,病毒载体、逆转录病毒载体、表达盒或质粒病毒载体中,例如,使用本领域已知的方法,包括但不限于上文xia et al,(2002)中所述的方法。可通过例如吸入、经口、静脉内注射、局部施用(参见美国专利no.5,328,470)或通过立体定向注射(参见例如chen et al.(1994),proc.natl.acad.sci.usa,91,3054
‑
3057)将表达构建体递送至对象。递送载体的药物制剂可包括可接受的稀释剂中的载体,或可包含其中嵌入递送载剂的缓释基质。或者,当完整的递送载体可以从重组细胞完整地产生(例如逆转录病毒载体),药物制剂可包括产生基因递送系统的一种或更多种细胞。
[0575]
本发明的核酸分子还可包括小发夹rna(shrna)和经改造以表达shrna的表达构建体。shrna的转录起始于聚合酶iii(pol iii)启动子,并且被认为终止于4
‑5‑
胸腺嘧啶的转录终止位点的第2位。表达后,shrna被认为折叠成具有3’uu突出端的茎
‑
环结构;随后,加工这些shrna的末端,将shrna转化为约21个核苷酸的sirna样分子。brummelkamp et al.(2002),science,296,550
‑
553;lee et al,(2002).上文;miyagishi和taira(2002),nature biotechnol.,20,497
‑
500;paddison et al.(2002),上文;paul(2002),上文;sui(2002)上文;yu et al.(2002),上文。
[0576]
表达构建体可以是适合在适当表达体系中使用的任何构建体,并且包括但不限于逆转录病毒载体、线性表达盒、质粒和病毒或病毒来源的载体,如本领域所知。这样的表达构建体可包括一个或更多个可诱导启动子、rna pol iii启动子体系(例如u6 snrna启动子或h1 rna聚合酶iii启动子)或本领域已知的其他启动子。这些结构可包括一条或两条sirna链。表达两条链的表达构建体还可包括连接两条链的环结构,或者可从同一构建体中的不同启动子分别转录每条链。也可以从不同的表达构建体转录每条链,tuschl(2002),上文。
[0577]
在某些示例性实施方案中,可通过多种途径将包含本发明rna沉默剂的组合物递送至对象的神经系统。示例性的途径包括鞘内、经实质(例如,在脑中)、经鼻和经眼递送。也可以全身性递送组合物,例如通过静脉内注射、皮下注射或肌内注射,其对于将rna沉默剂递送到外周神经元特别有用。优选的递送途径是直接进入脑,例如进入脑室或脑下丘脑,或者进入脑外侧或背侧区域。可将用于神经细胞递送的rna沉默剂并入适于施用的药物组合物中。
[0578]
例如,组合物可包括一种或更多种rna沉默剂和可药用载体。本发明的药物组合物可以以多种方式施用,这取决于期望局部治疗还是全身治疗以及取决于待治疗的区域。可经表面(包括经眼、鼻内、经皮)、经口或肠胃外进行施用。肠胃外施用包括静脉内滴注、皮下、腹膜内或肌内注射、鞘内或室内(例如脑室内)施用。在某些示例性实施方案中,使用本文所述的多种合适组合物和方法穿过血脑屏障(bbb)递送本发明的rna沉默剂。
[0579]“递送途径”可取决于患者的病症。例如,可对被诊断患有神经退行性疾病的对象施用直接进入脑(例如,进入苍白球或基底神经节的纹状体,并靠近纹状体的中型多棘神经元)的本发明的抗apoe rna沉默剂。除了本发明的rna沉默剂外,还可以对患者施用第二治疗,例如姑息性治疗和/或疾病特异性治疗。例如,二级治疗可以是症状性的(例如用于缓解症状)、神经保护性的(例如用于减缓或停止疾病进展)或恢复性的(例如用于逆转疾病进
程)。其他治疗包括心理治疗、物理治疗、言语治疗、交流和记忆辅助、社会支持服务和饮食建议。
[0580]
可以将rna沉默剂递送至脑的神经细胞。可以使用不需要组合物穿过血脑屏障的通道的递送方法。例如,含有rna沉默剂的药物组合物可通过直接注射到含有受疾病影响的细胞的区域来递送给患者。例如,可以通过直接注射到脑中来递送药物组合物。可以通过立体定向注射到脑的特定区域中(例如,黑质、皮质、海马体、纹状体或苍白球)来注射。可将rna沉默剂递送至中枢神经系统的多个区域中(例如,递送至脑的多个区域和/或递送至脊髓)。可将rna沉默剂递送至脑的扩散区域(例如,扩散递送至脑皮质)。
[0581]
在一个实施方案中,可通过具有一端植入到组织(例如,脑,例如,脑的黑质、皮质、海马体、纹状体或苍白球)中的套管或其他递送装置递送rna沉默剂。套管可与rna沉默剂的贮存器连接。可通过泵,例如渗透泵或微型泵,例如alzet泵(durect,cupertino,ca)调节流量或递送。在一个实施方案中,将泵和贮存器植入远离组织的区域中,例如,腹部中,并且通过从泵或贮存器通向释放位点的导管实现递送。例如,美国专利no.6,093,180和5,814,014中描述了用于递送至脑的装置。
[0582]
可进一步修饰本发明的rna沉默剂以使其能够穿过血脑屏障。例如,可将rna沉默剂与使该剂能够穿过屏障的分子缀合。可通过任何期望的方法施用这样的经修饰的rna沉默剂,例如通过室内或肌内注射施用,或通过肺部递送施用。
[0583]
在某些实施方案中,使用外泌体来递送本发明的rna沉默剂。在全身性注射之后,外泌体可以穿过bbb,并将sirna、反义寡核苷酸、化学治疗剂和蛋白质特异性地递送至神经元(参见alvarez
‑
erviti l,seow y,yin h,betts c,lakhal s,wood mj.(2011).delivery of sirna to the mouse brain by systemic injection of targeted exosomes.nat biotechnol.2011 apr;29(4):341
‑
5.doi:10.1038/nbt.1807;el
‑
andaloussi s,lee y,lakhal
‑
littleton s,li j,seow y,gardiner c,aivarez
‑
erviti l,sargent il,wood mj.(2011).exosome
‑
mediated delivery of sirna in vitro and in vivo.nat protoc.2012 dec;7(12):2112
‑
26.doi:10.1038/nprot.2012.131;el andaloussi s,mager i,breakefield xo,wood mj.(2013).extracellular vesicles:biology and emerging therapeutic opportunities.nat rev drug discov.2013may;12(5):347
‑
57.doi:10.1038/nrd3978;el andaloussi s,lakhal s,i,wood mj.(2013).exosomes for targeted sirna delivery across biological barriers.adv drug deliv rev.2013mar;65(3):391
‑
7.doi:10.1016/j.addr.2012.08.008)。
[0584]
在某些实施方案中,使用一种或更多种亲脂性分子以允许将本发明的rna沉默剂递送穿过bbb(alvarez
‑
ervit(2011))。然后,rna沉默剂将被激活,例如,通过酶降解亲脂性伪装物将药物释放为其活性形式而激活。
[0585]
在某些实施方案中,可使用一种或更多种受体介导的透化化合物来提高bbb的通透性以允许递送本发明的rna沉默剂。这些药物通过提高血液中的渗透压使内皮细胞之间的紧密连接放松,暂时提高bbb的通透性((e1
‑
andaloussi(2012))。通过使紧密连接放松,可以进行正常的rna沉默剂静脉内注射。
[0586]
在某些实施方案中,使用基于纳米颗粒的递送系统来将本发明的rna沉默剂递送穿过bbb。如本文所用,“纳米颗粒”是指已作为药物或基因载体被广泛研究的通常为固体、
生物可降解的胶体体系的聚合纳米颗粒(s.p.egusquiaguirre,m.igartua,r.m.hernandez和j.l.pedraz,“nanoparticle delivery systems for cancer therapy:advances in clinical and preclinical research,”clinical and translational oncology,vol.14,no.2,pp.83
‑
93,2012)。聚合纳米颗粒分为两个主要的类别,天然聚合物和合成聚合物。用于sirna递送的天然聚合物包括但不限于环糊精、壳聚糖和atellocollagen(y.wang,z.li,y.han,l h.liang和a.ji,nanoparticle
‑
based delivery system for application of sirna in vivo,”current drug metabolism,vol.11,no.2,pp.182
‑
196,2010)。合成聚合物包括但不限于已被深入研究的聚乙烯亚胺(pei)、聚(dl
‑
丙交酯
‑
co
‑
乙交酯)(plga)和树状体(x.yuan,s.naguib和z.wu,“recent advances of sirna delivery by nanoparticles,”expert opinion on drug delivery,vol.8,no.4,pp.521
‑
536,2011)。对于纳米颗粒和其他合适的递送系统的综述,参见jong
‑
min lee,tae
‑
jong yoon和young
‑
seok cho,“recent developments in nanoparticle
‑
based sirna delivery for cancer therapy,”biomed research international,vol.2013,article id 782041,10页,2013.doi:10.1155/2013/782041(其通过引用整体并入。)
[0587]
本发明的rna沉默剂可以经眼施用,例如治疗视网膜病症,例如视网膜病变。例如,药物组合物可以应用于眼或附近组织的表面,例如眼睑内部。它们可表面应用,例如通过喷雾、以滴剂形式、作为洗眼液或软膏剂应用。可通过本领域已知的眼部递送系统,例如敷贴器或滴眼器递送软膏剂或可滴液体剂。这样的组合物可包括拟黏液剂(mucomimetics),例如透明质酸、硫酸软骨素、羟丙基甲基纤维素或聚(乙烯醇);防腐剂,例如山梨酸、edta或苄基氯化铬;以及通常量的稀释剂和/或载体。药物组合物也可施用到眼的内部,并可通过可将其引入所选区域或结构的针或其他递送装置引入。包含rna沉默剂的组合物也可通过眼贴剂应用。
[0588]
一般而言,可通过任何合适的方法施用本发明的rna沉默剂。如本文所用,表面施用可指将rna沉默剂直接施用于身体的任意表面,包括眼、黏膜、体腔表面或任何内表面。用于表面施用的制剂可包括透皮贴剂、软膏剂、洗剂、乳膏剂、凝胶剂、滴剂、喷雾剂和液体剂。常规的药用载体,水性、粉末或油性基质,增稠剂等可以是必需的或期望的。表面施用也可被用作选择性地将rna沉默剂递送至对象的表皮或真皮,或者其特定层,或其下的组织的手段。
[0589]
用于鞘内或室内(例如脑室内)施用的组合物可包括无菌水溶液,其也可含有缓冲剂、稀释剂和其他合适的添加剂。用于鞘内或室内施用的组合物优选不包括转染试剂或另外的亲脂性部分,所述亲脂性部分包括但不限于例如与rna沉默剂连接的亲脂性部分。
[0590]
用于肠胃外施用的制剂可包括无菌水性溶液,其中也可含有缓冲剂、稀释剂和其他合适的添加剂。室内注射可通过例如附接至储器的室内导管来促进。对于静脉内使用,应控制溶质的总浓度以使制剂等张。
[0591]
本发明的rna沉默剂可通过肺部递送施用于对象。肺部递送组合物可通过吸入分散剂来递送,使得分散剂中的组合物可到达肺,在这里其可通过肺泡区直接被吸收到血液循环中。对于全身性递送和局部递送二者,肺部递送均可有效治疗肺的疾病。在一个实施方案中,通过肺部递送施用的rna沉默剂经修饰使得其能够穿过血脑屏障。
[0592]
肺部递送可以通过不同的方法实现,包括使用基于雾化、气溶胶化、胶束和干粉的
制剂。可通过液体雾化器、基于气溶胶的吸入器和干粉分散装置来实现递送。定剂量装置是优选的。使用雾化器或吸入器的好处之一是,由于设备是独立的,因此使污染的可能性最小化。例如,干粉分散装置递送容易配制成干粉的药物。rna沉默剂组合物可单独或与合适的粉末载体组合作为冻干或喷雾干燥的粉末稳定储存。用于吸入的组合物的递送可通过可包括计时器、剂量计数器、时间测量装置或时间指示器的给药计时元件进行调节,当并入到装置中时,能够在气溶胶药物施用期间对患者进行剂量跟踪、顺应性监测和/或剂量触发。
[0593]
可用作载体的药用赋形剂的类型包括:稳定剂例如人血清白蛋白(hsa)、填充剂例如碳水化合物、氨基酸和多肽;ph调节剂或缓冲剂;盐例如氯化钠;等。这些载体可以是结晶或无定形形式,或者可以是二者的混合物。
[0594]
特别有价值的填充剂包括相容性碳水化合物、多肽、氨基酸或其组合。合适的碳水化合物包括:单糖,例如半乳糖、d
‑
甘露糖、山梨糖等;二糖,例如乳糖、海藻糖等;环糊精,例如2
‑
羟基丙基
‑
β
‑
环糊精;以及多糖,例如棉子糖、麦芽糖糊精、右旋糖酐等;糖醇,例如甘露醇、木糖醇等。碳水化合物的优选组包括乳糖、海藻糖、棉子糖、麦芽糖糊精和甘露醇。合适的多肽包括阿司帕坦。氨基酸包括丙氨酸和甘氨酸,其中优选甘氨酸。
[0595]
合适的ph调节剂或缓冲剂包括由有机酸和碱制备的有机盐,例如柠檬酸钠、抗坏血酸钠等;柠檬酸钠是优选的。
[0596]
本发明的rna沉默剂可通过经口和经鼻递送施用。例如,通过这些膜施用的药物起效迅速,提供治疗性血浆水平,避免肝代谢的首过效应,并避免药物暴露于不利的胃肠(gastrointestinal,gi)环境。其他优点包括易于接近膜位点,从而使药物易于应用、定位和去除。在一个实施方案中,经口或经鼻递送施用的rna沉默剂经修饰以能够穿过血脑屏障。
[0597]
在一个实施方案中,包括rna沉默剂的组合物的单位剂量或测量的剂量由植入的装置分配。装置可包含监测对象内参数的传感器。例如,装置可包含泵(例如渗透泵)以及任选的相关电子器件。
[0598]
rna沉默剂可被包装在病毒天然衣壳或化学或酶法产生的人工衣壳或来源于此的结构中。
[0599]
x.试剂盒
[0600]
在某些其他方面中,本发明提供了包括含有rna沉默剂(例如,双链rna沉默剂或srna剂)的药物制剂的合适容器的试剂盒,(例如,前体,例如,可加工成srna剂的较大rna沉默试剂,或编码rna沉默剂(例如,双链rna沉默试剂或srna剂,或其前体)的dna)。在某些实施方案中,可在一个容器中提供药物制剂的单独的组分。或者,可期望在两个或更多个容器中分别提供药物制剂的组分,例如,一个容器用于rna沉默剂制剂,至少另一个容器用于载体化合物。试剂盒可被包装在多种不同的配置中,例如在一个盒子中的一个或更多个容器。可以例如,根据随试剂盒提供的说明组合不同的成分。可根据本文所述的方法组合成分,例如,以制备和施用药物组合物。试剂盒还可包括递送装置。
[0601]
对于本领域技术人员将明显的是,在不脱离本文公开的实施方案的范围的情况下,可以使用适当的等同物对本文所述的方法进行其他适当的修改和改编。现在已经详细描述了某些实施方案,通过参考以下实施例将更清楚地理解这些实施方案,所述实施例被包括在内仅出于举例说明的目的而不旨在限制。
[0602]
实施例
[0603]
实施例1.超功能性apoe靶向序列的体外鉴定
[0604]
1.1鉴定引起mrna和蛋白质的剂量依赖性降低的靶向小鼠apoe的sirna
[0605]
将小鼠apoe基因作为靶标用于mrna敲低。在体外,与未经处理的对照细胞相比,在原代小鼠星形胶质细胞中开发并筛选了一组靶向小鼠apoe基因的胆固醇缀合的sirna。在1.5μm浓度下对每种sirna进行测试,并用quantigene基因表达测定(thermofisher,waltham,ma)在72小时的时间点时评价mrna。图1a报道了筛选结果。
[0606]
如图1b所示,获得了筛选中鉴定的命中化合物(hit compound)的剂量
‑
响应曲线和ic50值,并基于其高效力和高效性选择了1134和1203进行进一步研究。图1c说明了1134的剂量响应,示出了1周之后用proteinsimple(san jose,ca)蛋白质定量测定评价的小鼠原代星形胶质细胞中的蛋白质沉默。下表1描述了两个靶标1134和1203。
[0607]
表1
‑
小鼠apoe mrna靶标、反义链和有义链。
[0608][0609]
1.2鉴定引起mrna和蛋白质的剂量依赖性降低的靶向人apoe的sirna
[0610]
将人apoe基因作为靶标用于mrna敲低。在体外,与未经处理的对照细胞相比,在人hepg2细胞中开发并筛选了一组靶向人apoe基因的sirna。在1.5μm浓度下对每种sirna进行测试,并用quantigene基因表达测定(thermofisher,waltham,ma)在72小时的时间点时评价mrna。图2a报道了筛选结果,并基于其高效力和高效性选择了1156和1163进行进一步研究。然后,如图2b所示,从筛选中获得了命中化合物的剂量
‑
响应曲线和ic50值。下表2描述了两个靶标1156和1163。
[0611]
表2
‑
人apoe mrna靶标、反义链和有义链。
[0612][0613][0614]
人apoe基因的第二次筛选,这次是用带有图43所示富含甲基的化学模式的sirna,通过测试基因的多个靶区域进行。图44a报道了筛选结果,并根据其高效力和高效性选择了
64、1125、1129、1133、1139和1143进行进一步研究,如图44b所示。然后,如图44c所示,从筛选中获得命中化合物的剂量
‑
响应曲线和ic50值(第一行,从左至右:64、1129、1139;第二行,从左至右:1125、1133、1143)。下表7描述了靶序列。
[0615]
表7
‑
第二次筛选,人apoe mrna靶向区域、靶向序列、反义链和有义链。
[0616][0617]
1.3 apoe靶向序列(小鼠和人)
[0618]
图3a是说明在小鼠和人apoe基因中鉴定的靶向序列以及靶向这样的序列的寡核苷酸的反义和有义序列的表。如图3b所示,寡核苷酸序列可用于多种化学修饰(p2、p3、p2g、p3g)的情况下和与不同的化学缀合物(如galnac、cns
‑
sirna、胆固醇)使用。寡核苷酸也可用于反义寡核苷酸基因沉默的情况下。
[0619]
实施例2.在小鼠中组织特异性apoe靶向sirna的体内效力
[0620]
2.1注射之后1个月,cns
‑
sirna
apoe
沉默整个小鼠脑的mrna和蛋白质表达
[0621]
通过icv注射向第一组野生型小鼠注射475μg剂量的di
‑
sirna
apoe
。对第二对照组注射磷酸盐缓冲盐水(pbs),对第三对照组注射di
‑
sirna
ntc
(非靶向对照)。每组包括六只小鼠。注射之后一个月,用quantigene在脑的所有区域中评价mrna沉默(图4a),用proteinsimple评价蛋白质沉默(图4b)。还用western印迹评价整个脑的蛋白质沉默(图
4c)。
[0622]
可以看出,靶向apoe的新sirna序列显示出高效的体内mrna和蛋白质沉默。使用寡核苷酸沉默apoe的先前报道使用了表明icv注射之后约50%的靶mrna和蛋白质沉默的序列。不受任何特定理论的束缚,鉴于沉默程度较低,使用先前序列得出的许多结论可能是无效的。相反,新序列在研究apoe在神经退行性变中的作用方面提供了显著优势。
[0623]
2.2 cns
‑
sirna
apoe
在低剂量下沉默海马体中的apoe蛋白
[0624]
对各组野生型小鼠分别施用475、237.5和118.75μg剂量的di
‑
sirna
apoe
。每组包括3只小鼠。注射之后一个月,对海马体中的蛋白质沉默进行定量,并与注射pbs或ntc的对照小鼠进行比较。如图5a的图和图5b的western印迹所示,靶向apoe的新sirna在较低剂量下显示出体内蛋白质沉默。使用寡核苷酸沉默apoe的先前报道使用了表明以约400μg的剂量icv注射寡核苷酸之后约50%的靶mrna和蛋白质沉默的序列。
[0625]
2.3 cns
‑
sirna
apoe
在低剂量下沉默整个脊髓的apoe
[0626]
图6a是注射之后1个月时脊髓中蛋白质沉默的定量。di
‑
sirna
apoe
剂量:237.5和118.75μg。图6b是显示出与对照黏着斑蛋白(116kda)相比,靶apoe(37kda)蛋白质沉默的western印迹(proteinsimple)。icv注射之后,apoe 1134沉默了脊髓所有区域(颈、胸、腰)的蛋白质表达。在脊髓中没有显示出apoe的先前沉默。沉默脊髓apoe的能力对于治疗脊髓相关的神经退行性病症包括肌萎缩侧索硬化(als)有许多意义。
[0627]
2.4可用cns
‑
sirna
apoe
在较低剂量下脑特异性(非肝)地沉默apoe
[0628]
图7a是注射之后1个月时肝中蛋白质沉默的定量。di
‑
sirna
apoe
剂量:475、237.5和118.75μg。图7b是显示出与对照黏着斑蛋白(116kda)相比,靶apoe(37kda)蛋白质沉默的western印迹(proteinsimple)。icv注射cns
‑
apoe的剂量响应显示出,475μg之后肝蛋白表达降低,但237.5μg或118.75μg之后没有降低。结合注射237.5μg和118.75μg之后在脑和脊髓中的沉默数据,该数据进一步表明sirna实现了对apoe的cns特异性沉默。此外,该数据还表明,两个apoe池(cns和全身)并不相互影响。残留的肝表达显示没有补充被沉默的cns(脑或脊髓)apoe。
[0629]
2.5 galnac
‑
sirna
apoe
在肝中沉默蛋白质表达,但不影响脑蛋白质
[0630]
合成了将sirna定向到肝细胞肝细胞的galnac缀合物,并通过皮下注射以10mg/kg的量施用于wt小鼠。注射galnac
‑
sirna
apoe
之后1个月,对肝和海马体中的蛋白质沉默进行定量。图8a是显示出与对照黏着斑蛋白相比,在肝中apoe蛋白沉默的western印迹(proteinsimple)。图8b为显示出对脑中的蛋白质水平没有影响的western印迹(proteinsimple)。图8c是肝和脑中蛋白质沉默的定量。可以看出,galnac
‑
sirna
apoe
缀合物可以高效地沉默肝apoe表达,但对脑apoe表达没有影响。不受任何特定理论的束缚,显示即使在全身性沉默后,脑中产生的apoe也不会穿过血脑屏障并补充全身性apoe池。
[0631]
2.6降低肝apoe升高了血清胆固醇,但仅沉默cns
‑
apoe不升高血清胆固醇
[0632]
沉默apoe作为对阿尔茨海默病的治疗的主要问题是它可能对全身性胆固醇代谢产生的潜在影响。遗传性地去除apoe的小鼠产生高全身性胆固醇和主动脉粥样硬化。显示出cns中apoe的组织特异性调节不引起血清胆固醇升高,而全身性调节引起胆固醇,特别是ldl的显著升高。先前未显示出apoe沉默对胆固醇影响的这种区分水平。图9a描绘了沉默cns apoe之后总血清胆固醇的定量。图9b描绘了沉默全身性apoe之后总血清胆固醇的定
量,和在沉默全身性apoe之后ldl和hdl级分中的胆固醇的定量。
[0633]
2.7 cns和全身性apoe代表两个不同的蛋白质池
[0634]
将本技术的apoe序列与组织特异性化学缀合物结合使用提供了存在两个不同的apoe池(即cns apoe和全身性apoe)的证据。不受任何特定理论的束缚,数据表明两个apoe池不相互作用,不影响彼此的表达,也不穿过血脑屏障。这导致假设一个apoe池(cns或全身)可能影响神经病理学的进展,而另一个池可能很少到没有影响。图10a说明了注射cns
‑
sirna
apoe
之后脑和肝中的蛋白质沉默。图10b说明了注射galnac
‑
sirna
apoe
之后脑(无)和肝中的沉默。
[0635]
实施例3.di
‑
sirna和维生素d缀合的hsirna的化学合成
[0636]
体外和体内效力评价中使用的di
‑
sirna如下合成。如图12所示,使三甘醇与丙烯腈反应以引入受保护的胺官能团。然后添加作为甲苯磺酰化丙酮缩甘油的分支点,随后还原腈以生成伯胺,然后再将其通过氨基甲酸酯接头与维生素d(钙化醇)连接。然后将缩酮水解以释放在伯羟基处被二甲氧基三苯甲基(dmtr)保护基团选择性保护的顺式二醇,随后用琥珀酸酐进行琥珀酰化。所得部分与固体支持物连接,碎后进行固相寡核苷酸合成和脱保护,得到所示的三种产物:vitd、加帽的接头和di
‑
sirna。然后如实施例6中所述分析合成产物。
[0637]
实施例4.替代合成路线1
[0638]
如图15a所示,单氨基磷酸酯接头方法涉及以下步骤:单叠氮化物四乙二醇具有作为甲苯磺酰化丙酮缩甘油添加的分支点。然后去除缩酮以释放在伯羟基处被二甲氧基三苯甲基(dmtr)保护基团选择性保护的顺式二醇,随后通过三苯基膦将叠氮化物还原为伯胺,伯胺立即受到单甲氧基三苯甲基(mmtr)保护基团的保护。剩余羟基用琥珀酸酐进行琥珀酰化并与固体支持物(lcaa cpg)偶联。寡核苷酸合成和脱保护提供了一种主要产物,具有磷酸酯和氨基磷酸酯连接的di
‑
sirna。本实施例强调了仅产生磷酸酯和氨基磷酸酯接头的替代和直接合成路线。
[0639]
实施例5.替代合成路线2
[0640]
为了产生含二磷酸酯的部分,开发了第二种替代合成方法。如图15b所示,二磷酸酯接头方法包括以下步骤:从丙酮缩甘油修饰的四乙二醇开始,去除缩酮,并用二甲氧基三苯甲基(dmtr)选择性地保护两个伯羟基。剩余的羟基用甲硅烷基保护的1
‑
溴乙醇延长长度。tbdms被去除,琥珀酰化并与固体支持物连接。随后进行固相寡核苷酸合成和脱保护,产生具有含有二磷酸酯的接头的di
‑
sirna。
[0641]
实施例6.di
‑
sirna和维生素d缀合的hsirna化学合成的质量控制
[0642]
hplc
[0643]
为了评估di
‑
sirna和维生素d缀合的hsirna的化学合成的质量,使用分析hplc鉴定和量化合成的产物。鉴定了三种主要产物:用三乙二醇(teg)接头加帽的sirna有义链、di
‑
sirna和维生素d缀合的sirna有义链(图13)。通过hplc分离每种产物并用于后续实验。合成的三种主要产物的化学结构在图13中显示出。hplc的条件包括:15分钟内5%至80%b,缓冲液a(0.1m teaa 5%acn),缓冲液b(100%acn)。
[0644]
质谱
[0645]
通过质谱进行进一步质量控制,确认了di
‑
sirna复合物的特性。观察到产物的质
量为11683m/z,对应于通过teg接头在3’端处连接的两条sirna有义链(图14)。在该具体实施例中,设计sirna有义链以靶向亨廷顿基因(htt)。实施例5中概述的化学合成方法成功产生了靶向亨廷顿基因的二分支sirna复合物的期望产物。lc
‑
ms条件包括:7分钟内0至100%b,0.6ml/分钟。缓冲液a(25mm hfip,20%meoh中15mm dba),缓冲液b(具有20%缓冲液a的meoh)。
[0646]
实施例7.在分支寡核苷酸结构中并入疏水部分:策略1
[0647]
在一个实施例中,具有可被2
‑
氰基乙氧基
‑
双(n,n
‑
二异丙基氨基)磷化氢(或任何其他合适的磷酸化试剂)磷酸化的未保护羟基基团(或胺)的短疏水性亚烷基或烷烃(hy)用于产生相应的亲脂性亚磷酰胺。可使用常规寡核苷酸合成条件将这些亲脂性亚磷酰胺添加到分支寡核苷酸的末端位置。该策略在图29中描绘。
[0648]
实施例8.在分支寡核苷酸结构中并入疏水部分:策略2
[0649]
在另一个实施例中,具有可被2
‑
氰基乙氧基
‑
双(n,n
‑
二异丙基氨基)磷化氢(或任何其他合适的磷酸化试剂)磷酸化的带或不带正电荷的未保护羟基基团(或胺)的短/小芳族平面分子(hy)用于产生相应的芳族疏水亚磷酰胺。芳族部分可带正电荷。可以使用常规寡核苷酸合成条件将这些亲脂性亚磷酰胺添加到分支寡核苷酸的末端位置。该策略在图30中描绘。
[0650]
实施例9.在分支寡核苷酸结构中并入疏水部分:策略3
[0651]
为了引入生物相关的疏水部分,通过在固体支持物或溶液中(这里描述了后者)的连续肽合成制备了短亲脂肽。短(1
‑
10)氨基酸链也可以包含带正电或极性的氨基酸部分,因为任何正电荷都会减少寡核苷酸的总净电荷,从而提高疏水性。一旦制备了适当长度的肽,应使用乙酸酐或另外的短脂肪酸将其加帽,以提高疏水性并遮盖游离胺。然后去除羰基保护基团以允许3
‑
氨基丙烷
‑1‑
醇偶联,从而允许游离羟基(或胺)磷酸化。然后可以使用常规寡核苷酸合成条件将该氨基酸亚磷酰胺添加到分支寡核苷酸的末端5’位置。该策略在图31中描绘。
[0652]
实施例10.在神经退行性变中沉默apoe
[0653]
表6列出了许多模拟一系列阿尔茨海默病相关病理学的转基因小鼠模型。虽然模型都没有完全复制人的疾病,但这些模型对β
‑
淀粉样蛋白毒性的病理生理学做出了重要的贡献:
[0654]
表6
[0655][0656][0657]
为了评价apoe沉默对神经退行性疾病的影响,在8周龄时通过icv向app/psen1小鼠注射di
‑
sirna
apoe
或di
‑
sirna
ntc
(每组n=5只雌性和5只雄性)。在8周龄时对第二组(每组n=7)皮下注射了galnac
apoe
和galnac
ntc
。在4月龄时,在注射之后2个月对动物实施安乐死。在di
‑
sirna
ntc
雌性组中观察到4例死亡,在di
‑
sirna
apoe
雌性组中观察到一例死亡,在di
‑
sirna
ntc
雄性组中观察到一例死亡,和在di
‑
sirna
apoe
雄性组中观察到一例死亡。galnac
ntc
组中观察到3例死亡,galnac
apoe
组有1例死亡。所有死亡都是由于动物模型病理学的天然原因造成的,并且发生在注射之后至少1个月。
[0658]
图34是报道注射之后2个月app/psen1 ad小鼠(n=2至5只雌性和5只雄性/组;237μg/次注射)的脑的所有区域中mrna沉默的图。在脑的所有区域中也观察到了高效的沉默。这些结果表明,本技术的核酸在研究apoe在神经退行性变中的作用方面提供了显著优势。如图35的图所示,在icv注射后2个月,靶向脑(di
‑
sirna
apoe
)或肝(galnac
‑
sirna
apoe
)apoe的新sirna在靶组织中显示出高效和靶向特异性的mrna沉默。还观察到高效和靶向特异性的蛋白质沉默(图36)。图37的原始western印迹示出了在icv或sc注射di
‑
sirna
ntc
、di
‑
sirna
apoe
、galnac
ntc
或galnac
apoe
之后,海马体、皮质和肝中的apoe蛋白表达。
[0659]
与ntc对照组相比,代表apoe蛋白的第二条带的缺失表明高效的沉默。综上所述,证据显示出在阿尔茨海默病的app/psen1模型中存在两种不同的apoe池,cns apoe和全身性apoe。数据表明,这两个apoe池不相互作用,不影响彼此的表达,也不穿过血脑屏障。该数据支持这样的假设:一个apoe池(cns或全身)可能影响神经病理学的进展,而另一个池可能很少影响至没有影响。
[0660]
使用具有抗app 6e10和抗lampl抗体的标准免疫荧光方案对厚度为40μm的脑皮质
组织切片(每只动物4片)进行染色。在leica显微镜上获得平铺图像(10
×
)。如图38所示,与用di
‑
sirna
ntc
治疗的动物相比,在经di
‑
sirna
apoe
处理的动物中观察到β
‑
淀粉样物质和lamp1阳性斑块的视觉减少。如在图39的图中可以看到的,这种减少是统计学显著的。
[0661]
由于雌性小鼠表型的历史性的和观察到的恶化,在经di
‑
sirna
ntc
和di
‑
sirna
apoe
处理的小鼠之间进行了性别特异性分析。如图40所报道,在雄性组和雌性组二者之间观察到显著差异;然而,雌性小鼠的差异显示更为剧烈。图41中报道的数据也显示出性别对沉默效力没有影响。
[0662]
使用寡核苷酸沉默人apoe的先前报道使用表明了在约400ug的icv注射之后约50%的靶mrna和蛋白质沉默的序列。相对的,在注射237μg靶向人apoe(e3和e4)的新di
‑
sirna
apoe
1156之后1个月,在海马体(图42a)和脊髓(图42b)中发现约80%至90%的蛋白质沉默。
[0663]
进行另外的皮质染色以证明在施用di
‑
sirna
apoe
1156后神经病理学的降低。在雌性和雄性小鼠中测量了病理性淀粉样β
‑
42,并观察到淀粉样β
‑
42含量降低(图45)。此外,使用x
‑
34染色对小鼠皮质中的蛋白质聚集体进行成像。与对照相比,用di
‑
sirna
apoe
也观察到x
‑
34阳性斑块减少(图46a和图46b)。当比较小鼠皮质中app6e10和lamp1阳性斑块的数量时,观察到galnac缀合的apoe sirna没有作用,表明di
‑
sirna
apoe
形式对于降低神经病理学很重要(图46c)。
[0664]
为了证明di
‑
sirna
apoe
不影响血清胆固醇,将di
‑
sirna
apoe
注射到app/psen1小鼠模型中,并与galnac缀合的apoe sirna进行比较。通过双侧icv以237μg注射di
‑
sirna
apoe
。注射之后2个月,测定ldl和hdl水平。这些结果与以10mg/kg皮下注射的galnac缀合的sirna进行比较。如图47所示,di
‑
sirna
apoe
不影响hdl或ldl水平,而沉默肝中的apoe(通过galnac缀合)导致ldl水平升高。
[0665]
在为期4个月的研究中,在阿尔茨海默病的三重转基因小鼠模型(3
×
tg
‑
ad)中进一步测试了di
‑
sirna
apoe
1156的效力,以证明apoe在中枢神经系统中长期沉默。对3
×
tg
‑
ad小鼠注射237μg的di
‑
sirna
apoe
,并在注射之后4个月测量apoe蛋白水平。如图48a和图48b所示,即使在注射之后4个月后,di
‑
sirna
apoe
仍高效抑制海马体和皮质中的apoe。
[0666]
如图43所示,在富含2
’‑
o
‑
甲基的模式中测试了另外的apoe靶标。如上所述对小鼠注射di
‑
sirna
apoe
1133,并在注射之后1个月测定apoe蛋白水平。如图49a和图49b所示,di
‑
sirna
apoe
1133高效抑制海马体和皮质中的apoe。
[0667]
为了进一步证明本发明的apoe sirna的效力,将25mg di
‑
sirna
apoe
1133注射到非人灵长类动物(nhp)的大池中。在注射之后2个月,在后皮质和小脑的几个区域中测量了di
‑
sirna
apoe
1133向导链的积聚。如图50所示,取样的组织中积聚了高水平的sirna,平均积聚为20μg sirna/克组织。
[0668]
通过引用并入
[0669]
出于任何目的,本技术中可能引用的所有引用的参考(包括参考文献、专利、专利申请和网站)的内容均在此通过引用整体并入本文,其中引用的参考文献也是如此。除非另有说明,否则本公开内容将采用本领域公知的免疫学、分子生物学和细胞生物学的常规技术。
[0670]
本公开内容还通过引用将分子生物学和药物递送领域中公知的技术整体并入。这
些技术包括但不限于以下出版物中描述的技术:
[0671]
atwell et al.j.molbiol.1997,270:26
‑
35;
[0672]
ausubel et al.(eds.),current protocols in molecular biology,john wiley &sons,ny(1993);
[0673]
ausubel,f.m.et al.eds.,short protocols in molecular biology(4th ed.1999)john wiley&sons,ny.(isbn 0
‑
471
‑
32938
‑
x);
[0674]
controlled drug bioavailability,drug product design and performance,smolen and ball(eds.),wiley,new york(1984);
[0675]
giege,r.and ducruix,a.barrett,crystallization of nucleic acids and proteins,a practical approach,2nd ea.,pp.20 1
‑
16,oxford university press,new york,new york,(1999);
[0676]
goodson,in medical applications of controlled release,vol.2,pp.115
‑
138(1984);
[0677]
hammerling,et al.,in:monoclonal antibodies and t
‑
cell hybridomas 563
‑
681(elsevier,n.y.,1981;
[0678]
harlow et al.,antibodies:a laboratory manual,(cold spring harbor laboratory press,2nd ed.1988);
[0679]
kabat et al.,sequences of proteins of immunological interest(national institutes of health,bethesda,md.(1987)and(1991);
[0680]
kabat,e.a.,et al.(1991)sequences of proteins of immunological inierest,fifth edition,u.s.department of health and human serviees,nih publieation no.91
‑
3242;
[0681]
kontermann and dubel eds.,antibody engineering(2001)springer
‑
verlag.new york.790pp.(isbn 3
‑
540
‑
41354
‑
5).
[0682]
kriegler,gene transfer and expression,a laboratory manual,stockton press,ny(1990);
[0683]
lu and weiner eds.,cloning and expression vectors for gene function analysis(2001)biot echniques press.westborough,ma.298pp.(isbn 1
‑
881299
‑
21
‑
x).
[0684]
medical applications of controlled release,langer and wise(eds.),crc pres.,boca raton,fla.(1974);
[0685]
old,r.w.&s.b.primrose,principles of gene manipulation:an introduction to genetic fngineering(3d ed.1985)blackwell scientific publications,boston.studies in microbiology;v.2:409pp.(isbn 0
‑
632
‑
01318
‑
4).
[0686]
sambrook,j.et al.eds.,molecular cloning:a laboratory manual(2d ed.1989)cold spring harbor laboratory press,ny.vols.1
‑
3.(isbn 0
‑
87969
‑
309
‑
6).
[0687]
sustained and controlled release drug delivery systems,j.r.robinson,ed.,marcel dekker,inc.,new york,1978
[0688]
winnacker,e.l.fromgenes to clones:introduction to gene technology(1987)vch publishers,ny(translated by horst ibelgaufts).634pp.(isbn 0
‑
89573
‑
614
‑
4),
[0689]
等同物
[0690]
在不脱离本发明的精神或基本特征的情况下,本公开内容可以以其他特定形式实施。因此,前述实施方案在所有方面中都应被认为是举例说明性的,而不是对本公开内容进行限制。因此,本公开内容的范围由所附权利要求书而不是由前述描述来指示,并且因此在权利要求书的等同的含义和范围内的所有改变都旨在包含在其中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。