蛋白质cgtase作为环糊精糖基转移酶的应用
技术领域
1.本发明属于生物技术领域,具体涉及蛋白质cgtase作为环糊精糖基转移酶的应用。
背景技术:
2.环糊精(cyclodextrin,cd)是由环糊精糖基转移酶(cyclodextrin glucano-transferase,简称cgtases)与淀粉产生环化作用而生成的由六个及以上的葡萄糖单元通过α-(1,4)糖苷键连接而成的一类环状低聚化合物。较为常见的是α-环糊精(α-cyclodextrin,α-cd)、β-环糊精(β-cyclodextrin,β-cd)和γ-环糊精(γ-cyclodextrin,γ-cd),分别由6个、7个和8个葡萄糖单元分子构成,这三种环糊精是工业上应用范围最广泛的三种环糊精。
3.环糊精主要通过环糊精糖基转移酶催化淀粉生成。生成的产物是主要是α-cd、β-cd和γ-cd三种混合物,产物专一性差。不同来源的cgtases生成的三种产物比例不同,根据生成主要环糊精的种类,将cgtases分为α-cgtases、β-cgtases、γ-cgtases。目前对于β-cgtases的催化机理以及产物专一性的研究比较深入,但是对于α-cgtases和γ-cgtases的研究较少。目前,对cgtases研究方向主要是两个方面:一是从自然资源中寻找催化效果更好或专一性更高的α-cgtases和γ-cgtases野生型酶;二是对现有的α-cgtases和γ-cgtases通过定点突变、易错pcr等技术进行基因定向改造从而获得专一性提高的酶。
4.α-cd是由6个葡萄糖分子以α-1,4-糖苷键连接而成的环状寡聚糖。具有外部亲水、内部疏水的中空筒型结构,这种结构使环糊精能与特定大小、形状的疏水性客体分子形成稳定的包合物从而改变被包容物质的溶解度、挥发性及化学反应性能等理化性质,正是由于这种特殊的空腔结构使得环糊精在医药、食品、化妆品和环境保护等领域具有广泛的应用。α-cd有以下应用前景:(1)将水不溶性或溶解度低的化合物制成水溶解度高的包封化合物;(2)使包封的化合物具有良好的稳定性(如保色、保香、耐热、耐酸、耐水解、抗氧化、防挥发等);(3)去除异味作用(吸附食品中气味和苦味);(4)除去食品中不需要的成分(如咖啡因、胆固醇等);(5)具有乳化、发泡作用,可作乳化剂和发泡剂;(6)使液体状、油状、挥发性物料固化。目前,由于尚未发现有高转化活力和高产物专一性高的α-cgtase,使得α-cd产品的成本和价格比β-cd高出很多,限制了其在工业上的应用。
5.β-cd是由7个葡萄糖分子以α-1,4-糖苷键连接而成的环状寡聚糖。主体构型像个中间有空洞,两端不封闭的筒。在空洞结构中,其中葡萄糖c2位和c3位的仲羟基位于圆筒外侧上边缘,葡萄糖c6位伯羟基位于圆筒的外侧下边缘,这些羟基共同构成环糊精的亲水性表面,所以外部具有亲水性;而圆筒内部则是通过位于c3和c5上的非极性的氢原子和醚键中的氧原子共同构成环糊精的疏水性空腔,所以内部空腔具有疏水性。因为这个特殊的圆筒结构,β-cd可与许多无机、有机分子结合成主客体包合物,并能改变被包合物的化学和物理性质,具有保护、稳定、增溶客体分子和选择性定向分子的特性,因而在食品、环境、医药、化妆用品、化学检测等方面都有广泛的应用,由于β-cd的溶解度低,制备相对简单,已经实
现产业化规模应用,价格比α-cd和γ-cd便宜很多。
6.γ-cd跟β-cd相比具有更大的空腔,包含客体分子范围更广,能包含β-cd不能包裹的大分子物质。γ-cd具有比β-cd更好的水溶性,室温25℃时γ-cd溶解度为23.3%,而α-cd溶解度为13%,β-cd溶解度则只有1.88%。γ-cd同时安全性高,可以被人体内的唾液淀粉酶和胰异淀粉酶迅速且基本上完全消化,因此γ-cd在人体小肠内可以迅速的降解和吸收,但α-cd和β-cd则不能。γ-cd应用前景比β-cd更为广阔,但目前没有专一性较高的γ-cgtase,导致目前生产规模较小,价格高,限制了γ-cd的生产和应用。
7.γ-cd内腔最大,具有更广泛的包埋客体分子的能力,并且还有较高的水溶性和安全无毒性,使其在食品、生物医药和化妆品等领域具有很大的应用前景。因此,定向改造出具有高特异性的γ-cgtase具有重要研究意义。
技术实现要素:
8.本发明的目的为提供新的环糊精糖基转移酶。
9.本发明首先保护蛋白质,可为如下a1)或a2):
10.a1)从n端至c端依次包括区段1-区段3;
11.区段1的氨基酸序列如seq id no:1自n端起第1至247位所示;
12.区段2为1个氨基酸残基;
13.区段3的氨基酸序列如seq id no:1自n端起第249至699位所示;
14.a2)在a1)所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质。
15.所述区段2中,氨基酸可为脯氨酸、谷氨酸、甘氨酸、天冬酰胺、甲硫氨酸、丙氨酸、精氨酸、赖氨酸、亮氨酸、缬氨酸、异亮氨酸、丝氨酸、苏氨酸、天冬氨酸或谷氨酰胺。
16.为了使蛋白质便于纯化和检测,可在蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
17.表1.标签的序列
18.标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedl
19.上述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
20.编码所述蛋白质的核酸分子也属于本发明的保护范围。
21.编码所述蛋白质的核酸分子可为c1)-c15)中的任一种:
22.c1)编码区或核苷酸序列是seq id no:2所示的dna分子;
23.c2)编码区或核苷酸序列是dna分子2;dna分子2是将seq id no:2自5’末端起第742-744位核苷酸替换为cga得到的;
24.c3)编码区或核苷酸序列是dna分子3;dna分子3是将seq id no:2自5’末端起第742-744位核苷酸替换为aaa得到的;
25.c4)编码区或核苷酸序列是dna分子4;dna分子4是将seq id no:2自5’末端起第
742-744位核苷酸替换为ctt得到的;
26.c5)编码区或核苷酸序列是dna分子5;dna分子5是将seq id no:2自5’末端起第742-744位核苷酸替换为gtg得到的;
27.c6)编码区或核苷酸序列是dna分子6;dna分子6是将seq id no:2自5’末端起第742-744位核苷酸替换为att得到的;
28.c7)编码区或核苷酸序列是dna分子7;dna分子7是将seq id no:2自5’末端起第742-744位核苷酸替换为aat得到的;
29.c8)编码区或核苷酸序列是dna分子8;dna分子8是将seq id no:2自5’末端起第742-744位核苷酸替换为tca得到的;
30.c9)编码区或核苷酸序列是dna分子9;dna分子9是将seq id no:2自5’末端起第742-744位核苷酸替换为aca得到的;
31.c10)编码区或核苷酸序列是dna分子10;dna分子10是将seq id no:2自5’末端起第742-744位核苷酸替换为gga得到的;
32.c11)编码区或核苷酸序列是dna分子11;dna分子11是将seq id no:2自5’末端起第742-744位核苷酸替换为gaa得到的;
33.c12)编码区或核苷酸序列是dna分子12;dna分子12是将seq id no:2自5’末端起第742-744位核苷酸替换为atg得到的;
34.c13)编码区或核苷酸序列是dna分子13;dna分子13是将seq id no:2自5’末端起第742-744位核苷酸替换为gac得到的;
35.c14)编码区或核苷酸序列是dna分子14;dna分子14是将seq id no:2自5’末端起第742-744位核苷酸替换为ccc得到的;
36.c15)编码区或核苷酸序列是dna分子15;dna分子15是将seq id no:2自5’末端起第742-744位核苷酸替换为caa得到的。
37.其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
38.其中,seq id no:2由2097个核苷酸组成,seq id no:2所示的核苷酸编码seq id no:1所示的氨基酸序列。
39.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明编码所述蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的所述蛋白质的核苷酸序列75%或者更高同一性的核苷酸,只要编码所述蛋白质,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
40.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码seq id no:1所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
41.上述任一所述蛋白质命名为蛋白质cgtase。
42.编码所述蛋白质cgtase的核酸分子具体可为编码所述蛋白质cgtase的基因,命名为cgtase基因。
43.含有上述任一所述核酸分子的表达盒、重组载体或重组微生物也属于本发明的保护范围。
44.所述重组载体可为将编码所述蛋白质cgtase的基因插入出发质粒,得到的重组质粒。
45.所述出发质粒可为表达载体或克隆载体。所述表达载体可为载体pet-32a( )。
46.所述重组载体具体可为重组质粒2—重组质粒16。
47.重组质粒2—重组质粒16可为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段分别替换为双链dna分子2、双链dna分子3、双链dna分子4、双链dna分子5、双链dna分子6、双链dna分子7、双链dna分子8、双链dna分子9、双链dna分子10、双链dna分子11、双链dna分子12、双链dna分子13、双链dna分子14、双链dna分子15和双链dna分子16,得到的重组质粒。
48.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为cga,得到双链dna分子2。
49.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为aaa,得到双链dna分子3。
50.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为ctt,得到双链dna分子4。
51.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gtg,得到双链dna分子5。
52.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为att,得到双链dna分子6。
53.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为aat,得到双链dna分子7。
54.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为tca,得到双链dna分子8。
55.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为aca,得到双链dna分子9。
56.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gga,得到双链dna分子10。
57.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gaa,得到双链dna分子11。
58.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为atg,得到双链dna分子12。
59.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gac,得到双链dna分子13。
60.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为ccc,得到双链dna分子14。
61.将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为caa,得到双链dna分子15。
62.双链dna分子16的核苷酸序列如seq id no:2所示。
63.所述重组微生物可为将所述重组载体导入出发微生物得到的重组菌。
64.所述出发微生物可为大肠杆菌。所述大肠杆菌具体可为大肠杆菌bl21(de3)。
65.所述重组微生物具体可为将重组质粒2—重组质粒16分别导入大肠杆菌bl21(de3),得到的重组大肠杆菌。
66.本发明还保护上述任一所述蛋白质cgtase或上述任一所述核酸分子的应用,可为d1)-d6)中的至少一种:
67.d1)作为环糊精糖基转移酶的应用;
68.d2)制备环糊精糖基转移酶中的应用;
69.d3)生产环糊精中的应用;
70.d4)制备用于生产环糊精的产品中的应用;
71.d5)降解淀粉;
72.d6)制备用于降解淀粉的产品中的应用。
73.上述应用中,所述d1)或d2)中,环糊精糖基转移酶可为α-cgtase、β-cgtase和/或γ-cgtase。
74.上述应用中,所述d3)或d4)中,环糊精可为α-cd、β-cd和/或γ-cd。所述生产环糊精是以淀粉为底物。所述淀粉可为可溶性淀粉。
75.本发明还保护一种生产环糊精的方法,为采用上述任一所述蛋白质cgtase降解淀粉,从而获得环糊精。
76.上述方法中,所述环糊精可为α-cd、β-cd和/或γ-cd。
77.上述方法中,所述淀粉可为可溶性淀粉。
78.本发明还保护一种制备环糊精糖基转移酶(即上述任一所述蛋白质cgtase)的方法,包括如下步骤:
79.(1)发酵培养上述任一所述重组微生物,得到发酵液;
80.(2)从所述发酵液中分离环糊精糖基转移酶(即上述任一所述蛋白质cgtase)。
81.上述方法中,所述环糊精糖基转移酶可为α-cgtase、β-cgtase和/或γ-cgtase。
82.上述方法中,所述重组微生物可为将所述重组质粒2—所述重组质粒16分别导入大肠杆菌bl21(de3),得到的重组大肠杆菌。
83.上述方法中,所述“发酵培养上述任一所述重组微生物,得到发酵液”具体可为将重组大肠杆菌接种至发酵培养基,35-39℃(如35-37℃、37-39℃、35℃、37℃或39℃)、160-260rpm(如160-220rpm、220-260rpm、160rpm、220rpm或260rpm)振荡培养,得到od
600nm
值为0.6-0.8(如0.6-0.7、0.7-0.8、0.6、0.7或0.8)的培养菌液1;向培养菌液1中加入iptg,得到培养体系;该培养体系中,iptg的浓度具体可为0.01mm;取培养体系,14-18℃(如14-16℃、16-18℃、14℃、16℃或18℃)、160-260rpm(如160-220rpm、220-260rpm、160rpm、220rpm或260rpm)振荡培养80h以上(如96h),得到发酵液。
84.上述方法中,所述“从所述发酵液中分离环糊精糖基转移酶”具体可为将发酵液8000rpm离心15min,收集上清液。上清液中即含有环糊精糖基转移酶。
85.实验证明,蛋白质cgtase具有环糊精糖基转移酶活性(特别是γ-cgtase),可降解淀粉。本发明详细研究了蛋白质cgtase第248位氨基酸对于环糊精糖基转移酶催化专一性
的影响,对γ-cgtase的催化机理研究以及提高γ-cd专一性具有重要价值。本发明具有重要的应用价值。
附图说明
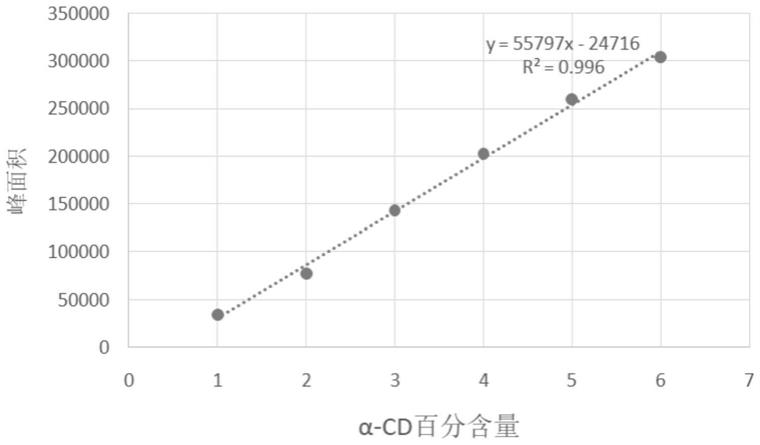
86.图1为α-cd标准曲线。
87.图2为β-cd标准曲线。
88.图3为γ-cd标准曲线。
具体实施方式
89.以下的实施例便于更好地理解本发明,但并不限定本发明。
90.下述实施例中的实验方法,如无特殊说明,均为常规方法。
91.下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂公司购买得到的。
92.以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
93.可溶性淀粉为浙江菱湖淀粉厂的产品。载体pet-32a( )为novagen公司的产品。大肠杆菌bl21(de3)为北京全式金生物技术有限公司的产品,产品目录号为cd601-01。
94.α-cd标准品、β-cd标准品和γ-cd标准品均为大连美仑生物公司的产品,产品目录号依次为mb3077、mb1895和mb5536。
95.tb培养基:向适量蒸馏水中加入胰蛋白胨12g、酵母提取膏24g和甘油4ml,然后用蒸馏水定容至1l,121℃高压灭菌15min即可。
96.实施例1、蛋白质cgtase1及其15个突变蛋白的发现
97.一、cgtase1基因的发现
98.人工合成seq id no:2所示的cgtase1基因。
99.cgtase1基因编码seq id no:1所示的蛋白质cgtase1。
100.二、突变蛋白的获得
101.本发明的发明人对蛋白质cgtase1第248位进行饱和突变,得到包括缺失突变在内的15个突变蛋白。具体如下:
102.(1)将seq id no:2自5’末端起第742-744位核苷酸(gca)缺失,得到双链dna分子1。双链dna分子1编码的蛋白命名为蛋白1。
103.即蛋白质cgtase1第248位的丙氨酸缺失后,得到蛋白1。
104.(2)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为cga,得到双链dna分子2。双链dna分子2编码的蛋白命名为蛋白2。
105.与蛋白质cgtase1相比,蛋白2的唯一不同在于将第248位的丙氨酸替换为精氨酸。
106.(3)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为aaa,得到双链dna分子3。双链dna分子3编码的蛋白命名为蛋白3。
107.与蛋白质cgtase1相比,蛋白3的唯一不同在于将第248位的丙氨酸替换为赖氨酸。
108.(4)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为ctt,得到双链dna分子4。双链dna分子4编码的蛋白命名为蛋白4。
109.与蛋白质cgtase1相比,蛋白4的唯一不同在于将第248位的丙氨酸替换为亮氨酸。
110.(5)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gtg,得到双链dna分子5。双链dna分子5编码的蛋白命名为蛋白5。
111.与蛋白质cgtase1相比,蛋白5的唯一不同在于将第248位的丙氨酸替换为缬氨酸。
112.(6)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为att,得到双链dna分子6。双链dna分子6编码的蛋白命名为蛋白6。
113.与蛋白质cgtase1相比,蛋白6的唯一不同在于将第248位的丙氨酸替换为异亮氨酸。
114.(7)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为aat,得到双链dna分子7。双链dna分子7编码的蛋白命名为蛋白7。
115.与蛋白质cgtase1相比,蛋白7的唯一不同在于将第248位的丙氨酸替换为天冬酰胺。
116.(8)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为tca,得到双链dna分子8。双链dna分子8编码的蛋白命名为蛋白8。
117.与蛋白质cgtase1相比,蛋白8的唯一不同在于将第248位的丙氨酸替换为丝氨酸。
118.(9)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为aca,得到双链dna分子9。双链dna分子9编码的蛋白命名为蛋白9。
119.与蛋白质cgtase1相比,蛋白9的唯一不同在于将第248位的丙氨酸替换为苏氨酸。
120.(10)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gga,得到双链dna分子10。双链dna分子10编码的蛋白命名为蛋白10。
121.与蛋白质cgtase1相比,蛋白10的唯一不同在于将第248位的丙氨酸替换为甘氨酸。
122.(11)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gaa,得到双链dna分子11。双链dna分子11编码的蛋白命名为蛋白11。
123.与蛋白质cgtase1相比,蛋白11的唯一不同在于将第248位的丙氨酸替换为谷氨酸。
124.(12)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为atg,得到双链dna分子12。双链dna分子12编码的蛋白命名为蛋白12。
125.与蛋白质cgtase1相比,蛋白12的唯一不同在于将第248位的丙氨酸替换为甲硫氨酸。
126.(13)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为gac,得到双链dna分子13。双链dna分子13编码的蛋白命名为蛋白13。
127.与蛋白质cgtase1相比,蛋白13的唯一不同在于将第248位的丙氨酸替换为天冬氨酸。
128.(14)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为ccc,得到双链dna分子14。双链dna分子14编码的蛋白命名为蛋白14。
129.与蛋白质cgtase1相比,蛋白14的唯一不同在于将第248位的丙氨酸替换为脯氨酸。
130.(15)将seq id no:2自5’末端起第742-744位核苷酸(gca)替换为caa,得到双链dna分子15。双链dna分子15编码的蛋白命名为蛋白15。
131.与蛋白质cgtase1相比,蛋白15的唯一不同在于将第248位的丙氨酸替换为谷氨酰胺。
132.实施例2、蛋白质cgtase1及其突变蛋白作为环糊精糖基转移酶在生成α-cd、β-cd和γ-cd中的应用
133.一、重组质粒1—重组质粒16的构建
134.1、人工合成实施例1中步骤二的双链dna分子1—双链dna分子15和seq id no:2所示的双链dna分子(命名为双链dna分子16)。
135.2、以双链dna分子1为模板,采用引物s2:5
’-
cgcggatccatgattcgaaggctttc-3’(下划线为限制性内切酶bamhi的识别序列)和引物a3:5'-cggctcgagttgattgtaattcacttc-3’(下划线为限制性内切酶xhoi的识别序列)组成的引物对进行pcr扩增,得到约2000bp的pcr扩增产物。
136.3、用限制性内切酶bamhi和xhoi酶切步骤2得到的pcr扩增产物,得到酶切产物。
137.4、用限制性内切酶bamhi和xhoi酶切载体pet-32a( ),回收约5800bp载体骨架。
138.5、将步骤3得到的酶切产物和步骤4得到的载体骨架进行连接,得到重组质粒1。
139.将重组质粒1进行测序。测序结果表明,重组质粒1为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子1,得到的重组质粒。
140.按照上述步骤2-5,将双链dna分子1分别替换为双链dna分子2、双链dna分子3、双链dna分子4、双链dna分子5、双链dna分子6、双链dna分子7、双链dna分子8、双链dna分子9、双链dna分子10、双链dna分子11、双链dna分子12、双链dna分子13、双链dna分子14、双链dna分子15和双链dna分子16,其他步骤均不变,依次得到重组质粒2—重组质粒16。
141.将重组质粒2—重组质粒16分别进行测序。测序结果表明,重组质粒2为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子2,得到的重组质粒;重组质粒3为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子3,得到的重组质粒;重组质粒4为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子4,得到的重组质粒;重组质粒5为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子5,得到的重组质粒;重组质粒6为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子6,得到的重组质粒;重组质粒7为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子7,得到的重组质粒;重组质粒8为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子8,得到的重组质粒;重组质粒9为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子9,得到的重组质粒;重组质粒10为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子10,得到的重组质粒;重组质粒11为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子11,得到的重组质粒;重组质粒12为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子12,得到的重组质粒;重组质粒13为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子13,得到的重组质粒;重组质粒14为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子14,得到的重组质粒;重组质粒15为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小
片段替换为双链dna分子15,得到的重组质粒;重组质粒16为将载体pet-32a( )的限制性内切酶bamhi和xhoi之间的dna小片段替换为双链dna分子16,得到的重组质粒。
142.重组质粒1表达蛋白1。重组质粒2表达蛋白2。重组质粒3表达蛋白3。重组质粒4表达蛋白4。重组质粒5表达蛋白5。重组质粒6表达蛋白6。重组质粒7表达蛋白7。重组质粒8表达蛋白8。重组质粒9表达蛋白9。重组质粒10表达蛋白10。重组质粒11表达蛋白11。重组质粒12表达蛋白12。重组质粒13表达蛋白13。重组质粒14表达蛋白14。重组质粒15表达蛋白15。重组质粒16表达蛋白16。
143.二、蛋白的表达
144.1、将重组质粒1导入大肠杆菌bl21(de3),得到重组大肠杆菌1。
145.2、完成步骤1后,将重组大肠杆菌1接种至tb培养基,37℃、220rpm振荡培养,得到od600
nm
值为0.6-0.8的培养菌液1。
146.3、完成步骤2后,向培养菌液1中加入iptg,得到培养体系;该培养体系中,iptg的浓度为0.01mm。
147.4、完成步骤3后,取培养体系,16℃、220rpm振荡培养96h,得到培养菌液2。
148.5、完成步骤3后,取培养菌液2,4℃、8000rpm离心15min,收集上清液1。
149.按照上述步骤,将重组质粒1分别替换为重组质粒2、重组质粒3、重组质粒4、重组质粒5、重组质粒6、重组质粒7、重组质粒8、重组质粒9、重组质粒10、重组质粒11、重组质粒12、重组质粒13、重组质粒14、重组质粒15和重组质粒16,其他步骤均不变,依次得到上清液2—上清液16。
150.上清液1—上清液16中依次含有蛋白1—蛋白16。
151.三、酶活鉴定及产物分析
152.环状糊精葡糖基转移酶活力定义为:环状糊精葡糖基转移酶在40℃条件下,每分钟催化淀粉减少10%吸光度所需要的酶量为1u。
153.1、酶活测定
154.待测酶液分别为上清液1—上清液16。
155.(1)取试管,加入0.4ml浓度为0.25g/100ml的可溶性淀粉水溶液,40℃水浴15min;之后加入0.1ml待测酶液,混匀后,40℃水浴10min;最后加入1.5ml 0.1mol/l hcl水溶液。
156.(2)完成步骤(1)后,加入3ml 0.1mol/l i2液(溶剂为水)和5ml蒸馏水,混匀,检测在700nm处的吸光值,即获得实验组的吸光值b。
157.(3)取试管,加入0.4ml浓度为0.25g/100ml的可溶性淀粉水溶液,40℃水浴15min;之后加入1.5ml 0.1mol/l hcl水溶液,再加入0.1ml待测酶液,混匀后,40℃水浴10min。
158.(4)完成步骤(3)后,加入3ml 0.1mol/l i2液(溶剂为水)和5ml蒸馏水,混匀,检测在700nm处的吸光值,即获得对照组的吸光值a。
159.(5)按下述公式计算待测酶液的环状糊精葡糖基转移酶活力:
160.待测酶液的环状糊精葡糖基转移酶活力(u/ml)=(对照组的吸光值a-实验组的吸光值b)/对照组的吸光值a
×
100
×
稀释倍数
161.2、产物分析
162.hplc分析的参数如下:waters600 hplc色谱仪,waters手动进样器,色谱柱lichrosorb nh2(4.6mm
×
150mm),waters2414示差检测器,流动相由73体积份乙腈和27体
积份水组成,流速1ml/min,柱温40℃。
163.(1)取不同浓度α-cd标准品、β-cd标准品和γ-cd标准品的混合溶液,进行hplc分析。
164.以α-cd百分含量为横坐标,峰面积为纵坐标,绘制α-cd标准曲线。α-cd的百分含量=α-cd的浓度
÷
(α-cd的浓度 β-cd的浓度 γ-cd的浓度)
×
100%。
165.以β-cd百分含量为横坐标,峰面积为纵坐标,绘制β-cd标准曲线。β-cd的百分含量=β-cd的浓度
÷
(α-cd的含量 β-cd的浓度 γ-cd的浓度)
×
100%。
166.以γ-cd百分含量为横坐标,峰面积为纵坐标,绘制γ-cd标准曲线。γ-cd的百分含量=γ-cd的浓度
÷
(α-cd的含量 β-cd的浓度 γ-cd的浓度)
×
100%。
167.结果如下:
168.α-cd标准品的出峰时间为7.5min。α-cd标准曲线见图1,标准曲线方程为y=55797x-24716,r2=0.996,x代表α-cd的百分含量(g/100ml),y代表峰面积。
169.β-cd标准品的出峰时间为8.6min。β-cd标准曲线见图2,标准曲线方程为y=53669x-16163,r2=0.993,x代表β-cd的百分含量(g/100ml),y代表峰面积。
170.γ-cd标准品的出峰时间为10.0min。γ-cd标准曲线见图3,标准曲线方程为y=48919x-20061,r2=0.996,x代表γ-cd的百分含量(g/100ml),y代表峰面积。
171.(2)取浓度为2g/100ml的可溶性淀粉水溶液,煮沸10min,自然冷却,得到处理的可溶性淀粉水溶液。
172.(3)完成步骤(2)后,取ep管,加入2ml处理的可溶性淀粉水溶液和待测酶液,之后用蒸馏水定容至4ml,得到反应体系。待测酶液的加入量为400u/g可溶性淀粉。
173.待测酶液分别为上清液1—上清液16。
174.(4)完成步骤(3)后,取反应体系,40℃水浴静置24h;之后煮沸10min,12000rpm离心10min,收集上清液;最后用0.45μm超滤膜过滤,获得滤液。
175.(5)取20μl滤液,进行hplc分析。之后根据步骤(1)获得的α-cd标准曲线、β-cd标准曲线和γ-cd标准曲线,获得滤液中α-cd的百分含量、β-cd的百分含量和γ-cd的百分含量。
176.结果如下:
177.待测酶液为上清液1时,没有检测到α-cd、β-cd和γ-cd的生成;
178.待测酶液为上清液2时,滤液中α-cd的百分含量为1.95%,β-cd的百分含量为37.9%,γ-cd的百分含量为60.15%;
179.待测酶液为上清液3时,滤液中α-cd的百分含量为3.09%,β-cd的百分含量为42.95%,γ-cd的百分含量为53.95%;
180.待测酶液为上清液4时,滤液中α-cd的百分含量为12.2%,β-cd的百分含量为43.4%,γ-cd的百分含量为44.3%;
181.待测酶液为上清液5时,滤液中α-cd的百分含量为6.52%,β-cd的百分含量为45.2%,γ-cd的百分含量为48.3%;
182.待测酶液为上清液6时,滤液中α-cd的百分含量为2.2%,β-cd的百分含量为50.3%,γ-cd的百分含量为47.5%;
183.待测酶液为上清液7时,滤液中α-cd的百分含量为11.1%,β-cd的百分含量为18.7%,γ-cd的百分含量为70.2%;
184.待测酶液为上清液8时,滤液中α-cd的百分含量为25.1%,β-cd的百分含量为35.8%,γ-cd的百分含量为39.1%;
185.待测酶液为上清液9时,滤液中α-cd的百分含量为28.4%,β-cd的百分含量为36.7%,γ-cd的百分含量为34.9%;
186.待测酶液为上清液10时,滤液中α-cd的百分含量为6.7%,β-cd的百分含量为28.8%,γ-cd的百分含量为64.5%;
187.待测酶液为上清液11时,滤液中α-cd的百分含量为2.2%,β-cd的百分含量为23.4%,γ-cd的百分含量为75.4%;
188.待测酶液为上清液12时,滤液中α-cd的百分含量为4.2%,β-cd的百分含量为33.2%,γ-cd的百分含量为62.6%;
189.待测酶液为上清液13时,滤液中α-cd的百分含量为10.1%,β-cd的百分含量为47.2%,γ-cd的百分含量为42.7%;
190.待测酶液为上清液14时,滤液中α-cd的百分含量为2.7%,β-cd的百分含量为25.6%,γ-cd的百分含量为71.7%;
191.待测酶液为上清液15时,滤液中α-cd的百分含量为2.8%,β-cd的百分含量为42.0%,γ-cd的百分含量为55.2%;
192.待测酶液为上清液16时,滤液中α-cd的百分含量为2.2%,β-cd的百分含量为38.6%,γ-cd的百分含量为59.2%。
193.由此可见,蛋白2—蛋白16均可以将可溶性淀粉降解为α-cd、β-cd和γ-cd。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。