一种基于多重pcr飞行时间质谱的幽门螺杆菌耐药位点的检测方法、引物对与试剂盒
技术领域
1.本发明涉及生物检测技术领域,尤其是涉及一种基于多重pcr飞行时间质谱的幽门螺杆菌耐药位点的检测方法、引物对与试剂盒。
背景技术:
2.核酸质谱分析系统整合了pcr技术、芯片技术和飞行时间质谱技术,可实现高通量、高灵敏度、高精准度核酸序列分析。该技术平台目前得到了广泛的应用,包括基因分型、甲基化分析、微生物检测与分型和拷贝数变异检测等。
3.核酸质谱的技术特点与优势包括:1)通量高:一次可同时上两张96 孔芯片,单个反应孔可检测多达40个位点;2)灵活性大:使用配套引物设计软件可自行开发新的检测panel;芯片可分批次使用,同一张芯片可同时检测不同panel;3)对于ngs来说检测周期短:检测流程从dna到数据产出仅需8~10个小时。4)超高准确度:通过单碱基延伸直接检测碱基质量,引物无需特殊标记,不存在荧光和杂交错配干扰;5)样本兼容性强:需要dna量小,扩增子片段小(80~120bp)可以检测各种类型的标本。
4.虽然核酸质谱平台在应用上有很大的优势,但相对于荧光定量pcr平台来说,实验流程复杂,检测周期较长。一般包括三个热循环仪(pcr仪) 上机步骤:1)多重pcr反应,2)去磷酸化反应和3)单碱基延伸反应。在每一个上机步骤之后都有开盖操作,这样大大增加了气溶胶污染的可能。而且三步反应操作增加了反应检测时间。因此,有必要提出一种新的方法以解决核酸质谱复杂操作流程的问题,从而缩短检测周期。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种基于多重pcr飞行时间质谱的幽门螺杆菌耐药位点的检测方法、引物对与试剂盒,以解决现有技术中存在的核酸质谱操作复杂,检测周期长等技术问题。
7.本发明提供的技术方案如下:
8.在一个方面,本发明提供了一种基于多重pcr飞行时间质谱的幽门螺杆菌耐药位点的检测方法,所述方法包括:针对耐药位点设计含有type iis 类限制性内切酶识别序列的引物对进行pcr扩增反应,用所述type iis类限制性内切酶对扩增产物进行酶切,将获得的目标片段进行质谱检测。
9.目前,多数的检测手段主要是通过荧光定量pcr检测,然而可同时检测多个耐药位点的核酸质谱方案,检测过程中需多次开盖,易产生气溶胶污染等现象。本发明pcr后直接酶切,近似一步法即可检测幽门螺旋杆菌是否感染,且是否克拉霉素耐药。在pcr反应之后,采用type iis类限制性(如fok i)进行酶切处理,产生目标片段范围在15
‑
30nt的核苷酸序列,直接进行质谱仪上机分析,避开了传统核酸质谱的去磷酸化和单碱基延伸操作步骤,减
少了开盖步骤,最大程度地减少了气溶胶污染等问题,同时也缩短了检测时间,提高了检测效率。
10.由于核酸质谱技术最佳检测分子量范围有一定局限性,一般在 4000
‑
9000道尔顿之间(对于核苷酸而言,长度在15
‑
30nt之间)。一步反应产生带有目标变异位点的长度在15
‑
30nt之间的片段在技术上实现具有一定难度,直接通过pcr片段不能产生这么短的片段。而pcr之后采用常规限制性内切酶酶切的方案,虽然可以实现短片段的产生,然而在变异位点附近,往往很难找到合适的限制性内切酶识别序列。如果在设计引物时,引入限制性内切酶位点,又会涉及到酶切之后目标片段过大的问题,同样很难得到目标片段在15
‑
30nt之间的片段,因此不能成为一种通用的设计方案,很难实现多重靶标的检测。
11.本发明采用的策略为采用typeiis型限制性内切酶来实现检测步骤的缩短,减少了气溶胶污染的可能性,同时缩短检测时间。type iis类限制性内切酶的典型特点是切割序列与识别序列不同,切割序列往往在远离识别序列。以fok i内切酶为例,识别序列为ggatg(top链5
′
端)和cctac (bottom链3
′
端),而切割序列分别在top链5
′
端识别序列后面的第9个碱基之后,及bottom链3
′
端识别序列后面的第13个碱基。如果在引物序列的两端都引入fok i内切酶位点的识别序列,两端的切割位置都向中间区域靠近,很容易产生15
‑
30nt的小片段。fok i内切酶的优势是,其识别序列只有5个碱基,相对于常规限制性内切酶的6个碱基识别序列而言,很容易找到匹配度好的碱基序列(3
‑
5个碱基匹配可算是匹配性好),即使没有匹配的碱基,也可以直接在引物的5
′
端引入完整的fok i识别序列,而切割后留在中间区域的序列也能够满足15
‑
30nt范围内,因此有很大的空间可以自由设计引物,因此可以作为一种通用的设计方案,实现多重靶标的检测。
12.在一个实施方案中,所述引物对的正向引物和反向引物中均含有typeiis类限制性内切酶识别序列。
13.在一个实施方案中,所述type iis类限制性内切酶为fok i内切酶。
14.在一个实施方案中,在进行所述质谱检测前,还包括对酶切产物进行纯化处理;优选地,所述纯化处理包括树脂脱盐纯化。对酶切产物进行纯化处理可以降低对检测结果的干扰,提高分辨率。
15.在一个实施方案中,所述质谱检测包括将纯化后的产物采用基质辅助激光解析电离飞行时间质谱系统进行分子量检测。根据分子量的差异确定样品的基因型,确定待测样本是否发生某位点耐药突变。
16.在一个具体的实施方案中,本发明的检测方法包括:
17.(a)pcr反应:对待测样本中的核酸进行pcr扩增,获得待测样本中靶序列扩增产物;
18.(b)内切酶酶切反应:通过fok i内切酶,把目的片段产物内切为3 段;
19.(c)树脂脱盐:纯化延伸反应产物,吸附体系中的na
、k
;
20.(d)质谱检测:将纯化后产物采用基质辅助激光解析电离飞行时间质谱(maldi
‑
tof
‑
mass)系统进行分子量检测,根据分子量标记确定待测样本是否发生耐药突变,则可判型类别,软件自动处理报告判型结果。
21.在一个实施方案中,先95℃,10分钟对mix中pcr酶进行热启动,随后做pcr循环扩增。反应条件为95℃变性30秒,56℃退火30秒,72℃延伸1分钟,共45个循环;最终72℃延伸5
分钟,完成后恒温于4℃。
22.在优选的方案中,在每次反应中加入阴性对照,所述阴性对照为正常人的血液dna。
23.在一个实施方案中,所述检测方法中,用于幽门螺杆菌耐药位点检测的引物对由序列如seq id no.1至seq id no.2所示的引物组成。
24.在本发明中,所述检测方法为非疾病诊断目的的方法。本发明的方法也可以用于幽门螺杆菌耐药基因的分型检测。
25.在另一个方面,本发明还提供了一种用于幽门螺杆菌耐药位点检测的引物对,所述引物对由序列如seq id no.1至seq id no.2所示的引物组成。本发明保护所述引物对在用于制备用于检测幽门螺旋杆菌耐药位点的试剂盒中的用途。本发明针对幽门螺旋杆菌克拉霉素耐药位点23s设计了特异性位点引物,选择特异性保守序列,设计pcr引物。本发明的引物可采用常规的多核苷酸合成方法合成,纯化方式为epage。
26.在另一个方面,本发明还提供了一种用于幽门螺旋杆菌耐药位点检测的试剂盒,所述试剂盒包括前述的引物对。
27.在一个实施方案中,所述试剂盒还含有pcr预混液,所述pcr预混液包括热启动taq酶、dntps和mg
2
中的一种或多种。在一个实施方案中,所述试剂盒还含有foki内切酶。
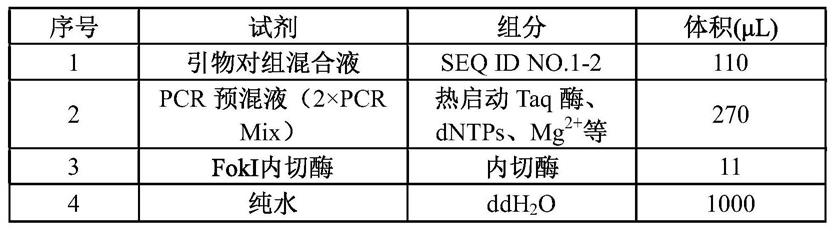
28.在一个具体的实施方案中,所述试剂盒中各组分的含量如下表所示:
[0029][0030]
有益效果:
[0031]
与现有检测幽门螺旋杆菌耐药的其她技术或同类技术相比,本发明技术方案检测过程避免开盖气溶胶污染、具有检测时间短的优势(缩短上机步骤,只有一步pcr仪上机步骤),同时,不需要荧光标记、不需要洗涤、反应在微量体系中进行、样本上样量很少(浓度大于1ng/μl均可检出)等优势,使得试剂耗材成本与检测pcr重数成反比。
[0032]
首轮pcr扩增区域为55
‑
90bp的基因型特异性片段,第二轮采用内切酶把目的片段内切为3段,直接检测其分子量的差异。同时,该特异性片段扩增设计技术会彻底排除pcr产物污染和同源序列探针错配引起的假阳性问题,为检测幽门螺旋杆菌提供了可靠的实验方法。
[0033]
本发明方法能够在同一个检测孔中同时检测幽门螺杆菌23s基因的 a2142g、a2143g、a2143c突变位点。
[0034]
本发明方法进行top链和bottom链同时检测,得到两个分子量指标,双重确认;减少了非特异信号造成的检阳性结果。
[0035]
本发明通过大量的筛选和深入的研究,最终获得了适用于飞行时间质谱检测的一步法引物组合,人工创建assay文件,使得飞行时间质谱检测幽门螺旋杆菌耐药位点基本零
污染成为可能,缩短检测时间至少4个小时,从而极大地提高了检测效率,显著地降低了检测成本。
附图说明
[0036]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0037]
图1为foki内切酶识别序列与切割序列示意图;
[0038]
图2为对幽门螺杆菌a2142g和a2143g耐药突变位点设计示意图;
[0039]
图3为foki酶切后片段分布示意图;
[0040]
图4为检测幽门螺旋杆菌阴性样本的总体核酸质谱图(图中线条上方的文字从左到右分别是:23s
‑
u
‑
1、y、23s
‑
d
‑
1、y、23s
‑
d
‑
2、23s
‑
u
‑
2、cc、ct、tt、aa、ag、gg、23s
‑
d
‑
3a、23s
‑
u
‑
3a、y、y;每个标记前“uep.”);
[0041]
图5为top链5’端(23s
‑
d
‑
1)核酸质谱图;
[0042]
图6为top链中间区(23s
‑
d
‑
2)野生型核酸质谱图;
[0043]
图7为top链3’端(23s
‑
d
‑
3a)核酸质谱图;
[0044]
图8为bottom链5’端(23s
‑
u
‑
1)核酸质谱图;
[0045]
图9为bottom链中间区(23s
‑
u
‑
2)野生型核酸质谱图;
[0046]
图10为bottom链3’端(23s
‑
u
‑
3a)核酸质谱图;
[0047]
图11为top链中间区(23s
‑
d
‑
2)a2143g核酸质谱图;
[0048]
图12为bottom链中间区(23s
‑
u
‑
2)a2143g核酸质谱图;
[0049]
图13为对比例2中对照引物对1的核酸质谱图;
[0050]
图14为对比例2中对照引物对2的核酸质谱图。
具体实施方式
[0051]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0052]
应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件例如美国 sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件进行。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0053]
实施例1.检测幽门螺旋杆菌克拉霉素耐药位点
[0054]
1.待测样本:荧光定量检测已知阳性粪便样本、阴性粪便样本。
[0055]
2.本发明提供的可同时检测/或鉴定幽门螺旋杆菌克拉霉素耐药位点的方法包括如下步骤:
[0056]
(1)引物设计与筛选
[0057]
设计原理:幽门螺杆菌23s基因的a2142g,a2143g,a2143c突变均能够引起幽门螺杆菌对克拉霉素的耐药,这些突变占到克拉霉素耐药的 90%以上。因此临床上如果能够诊断这些突变,则能够实现对克拉霉素的耐药菌进行检测,在治疗时就能够避开使用克拉霉素方案,从而避免幽门螺杆菌(helicobacter pylori,hp)根除治疗失败的情况发生。
[0058]
针对常见幽门螺旋杆菌克拉霉素耐药位点,设计特异性位点引物(选择特异性保守序列,设计pcr引物);采用type iis类限制性内切酶,这类内切酶的典型特点是切割序列与识别序列不同,切割序列往往在远离识别序列的位置。
[0059]
以fok i内切酶为例,识别序列为ggatg(top链5
′
端)和cctac (bottom链3
′
端),而切割序列分别在top链5
′
端识别序列后面的第9个碱基之后,及bottom链3
′
端识别序列后面的第13个碱基。如图2所示,在上下游引物均引入fok i酶切位点识别序列,识别位点均在5
′
端,保证了 3
′
端匹配20个碱基,不会引起引物特异性差的问题。
[0060]
如图3所示,引物设计后,经fok i酶切之后的片段会分成6个部分,其中top链3个部分,分别为5
′
端20nt,中间区23nt和,3
′
端26nt;bottom 链的5
′
端21nt,中间区23nt和,3
′
端25nt。
[0061]
fok i酶切之后的片段的分子量分布如下表1:
[0062]
表1.fok i酶切后片段的分子量分布
[0063][0064]
具体说明如下:
[0065]
(1)其中中间区是用于区分目标区域的分子量。
[0066]
(2)计算分子量时,需考虑5
′
端和3
′
末端是否有磷酸分子情况。
[0067]
(3)a2142g与a2143g的分子量相同,但由于这两种突变都是耐药型突变,因此该检测方法能够区分野生型与耐药型。
[0068]
(4)在核酸质谱检测过程中,激光的激发作用使得双链分开,因此双链不影响检测结果。
[0069]
本发明所设计的引物序列如下:
[0070]
正向引物
‑‑
seq id no.1(23s
‑
fok i
‑
f):
[0071]
5'
‑
aggtgaggatgcctcctacccgcggcaagac
‑3’
[0072]
反向引物
‑‑
seq id no.2(23s
‑
fok i
‑
r):
[0073]5’‑
agtgctaggatgtagtaaaggtccacggggtct
‑3’
[0074]
(2)pcr扩增获得待测样本中靶序列扩增产物
[0075]
样本选取:选择荧光定量结果分别为克拉霉素耐药的阳性样本和阴性样本。
[0076]
pcr反应体系配制见表2。
[0077]
表2
[0078]
试剂最终浓度体积1
×
(μl)1mm pcr primer mix0.2mm1.002
×
pcr mix1unit2.50dna template(0.5
‑
2ng/μl)
‑
1.50rnase
‑
free watern/a0.50total
‑
5.00
[0079]
pcr反应程序:先95℃,10分钟对mix中pcr酶进行热启动,随后做pcr循环扩增。反应条件为95℃变性30秒,56℃退火30秒,72℃延伸 1分钟,共45个循环;最终72℃延伸5分钟,完成后恒温于4℃。
[0080]
(3)内切酶酶切反应
[0081]
通过fok i内切酶,把目的片段产物内切为3段。酶切反应体系配制见表3。
[0082]
表3
[0083]
试剂最终浓度体积1
×
(μl)restriction enzyme0.4unit1.00dna(步骤2中pcr产物)
‑
2.5010
×
ne buffer1
×
2.50rnase
‑
free water
‑
19.00total50μl25.00
[0084]
反应条件为37℃,60分钟,完成后恒温于4℃。
[0085]
(4)采用树脂脱盐纯化延伸反应产物
[0086]
(5)基质辅助激光解析电离飞行时间质谱检测
[0087]
将酶切后的产物采用基质辅助激光解析电离飞行时间质谱系统进行分子量检测,根据分子量标记确定待测样本是否发生某位点突变。
[0088]
(6)分析质谱图
[0089]
如图4中,横坐标为分子量,纵坐标为峰强度。图中纵行虚线同色为该基因型酶切
后的3段目的片段的分子量位置;如果被检测样本在pcr后酶切,中间一段23s
‑
u
‑
2或23s
‑
d
‑
2会出现右侧不同分型,即右侧的同色虚线表示不同分型产物分子量位置。用type4.1软件阅读谱图,自动分析和报告结果,导出数据。数据解释为,每一个片段分子量在质谱图不同的质量处有相应的分子量峰,若各“位点”都可判型,分析结果报告为阳性。阳性结果分为四种判读情况:a、结果可靠;b、中度可靠;c、一般可靠;d、低度可靠。前三种视为反应有效,第四种需要人工辅助判断,观察峰强度是否高于噪音峰强度;若不起峰,则判断为可疑感染或阴性结果。对可疑感染样本,在必要时可作重复性验证试验。
[0090]
(7)结果
[0091]
在检测无克拉霉素耐药时,图谱可见附图中图5至图10;在检测到有克拉霉素耐药时,其中23s
‑
u
‑
2或23s
‑
d
‑
2图谱可见图11和图12。
[0092]
结论:本发明能够检测是否感染幽门螺旋杆菌以及克拉霉素耐药情况。检测效率高、准确率高。
[0093]
实施例2.特异性测定
[0094]
以大肠杆菌、金黄色葡萄球菌、空肠弯曲菌、白色念珠菌、屎肠球菌、肺炎链球菌、甲型副伤寒沙门氏菌和人基因组dna核酸为模板,经本发明飞行时间质谱hp检测试剂盒检测,结果未出现假阳性结果,表明本发明试剂盒具有良好特异性。
[0095]
实施例3.临床样本检测
[0096]
利用本发明所建立的鉴定幽门螺旋杆菌耐药位点的方法,对100例幽门螺旋杆菌阳性患者的核酸样本进行检测,采用市售单重荧光定量pcr检测试剂盒进行验证。
[0097]
结果显示:
[0098]
100例阳性样本中,单重荧光定量pcr和本发明的飞行时间质谱hp 检测方法均检出100例阳性,阳性检出率为100%。其中,鉴别出克拉霉素耐药39例,与荧光定量pcr检测试剂盒结果一致。
[0099]
实施例4.assay文件的优化
[0100]
本发明通过多次实验优化了assay文件。主要考虑以下三点:
[0101]
1)考虑3
′
端酶切后可能携带磷酸,可以把各个片段的分子量产物设计为加磷酸与不加磷酸的分子量;结果表明23s
‑
u
‑
3a与23s
‑
d
‑
3a是正确的,如图7和图10。
[0102]
2)ag与ga、ct与tc,分子量一样,各分别去掉ga、tc。优化过程如下表4。
[0103]
表4
[0104]
welltermsnp_iduep_diruep_massext1_callext1_massw1iplex23s
‑
u
‑
1f6118a6180w1iplex23s
‑
u
‑
3af7865.2a7927.2w1iplex23s
‑
u
‑
3f7552a7614w1iplex23s
‑
d
‑
1f6574.2a6636.2w1iplex23s
‑
d
‑
3af7668a7730w1iplex23s
‑
d
‑
3f7354.8a7416.8w1iplex23s
‑
u
‑2‑
aaf7077.6a7139.6w1iplex23s
‑
u
‑2‑
agf7093.6a7155.6w1iplex23s
‑
u
‑2‑
ggf7109.6a7171.6
w1iplex23s
‑
d
‑2‑
ttf6973.6a7035.6w1iplex23s
‑
d
‑2‑
ctf6958.6a7020.6w1iplex23s
‑
d
‑2‑
ccf6943.6a7005.6
[0105]
3)23s
‑
u
‑
2或23s
‑
d
‑
2的简洁优化至一起,且人工创造“假的”分子量。使得各分段产物的分子量及各型别产物之间的分子量差异大于16da。确定assay文件数据如下表5。
[0106]
表5
[0107][0108]
对比例1
[0109]
本发明通过大量的实验,人工设计大量的引物,再对其进行优化选择并验证,最终确定了可以用于飞行时间质谱检测的扩增引物序列及其组合。以下展示了部分效果不理想的引物。
[0110]
对照引物对1:
[0111]
f
‑
1:gtgaaattgtagtggaggtg(seq id no.3)
[0112]
r
‑
1:ttcccattagcagtgctaag(seq id no.4)
[0113]
对照引物对2:
[0114]
f
‑
2:gctgtctcaaccagagattc(seq id no.5)
[0115]
r
‑
2:cgcatgatattcccattagc(seq id no.6)
[0116]
按照实施例1相同的方法,先用单重pcr扩增然后内切酶酶切,再对 pcr产物进行质谱检测,单重检测结果发现对照引物对1和对照引物对2 组合检测能够正常工作,然而无法通过质谱检测获得阳性结果(如图13和 14所示)。
[0117]
本发明引物对(seq id no.1和seq id no.2)能够在检测体系中正常工作(如图4所示)。
[0118]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。