1.本发明涉及微生物技术领域,具体涉及一种灵芝突变菌株及其诱变和筛选方法。
背景技术:
2.灵芝是担子菌门伞菌纲多孔菌目灵芝科灵芝属真菌。汉代《神农本草经》认为,灵芝能够益心气、安精魂、补肝益气、坚筋骨,具有很高的药用价值。灵芝中含有多种化学成分,如多糖、三萜、核苷、蛋白质、脂肪酸等,其中多糖被认为是灵芝的主要活性成分之一。现代研究证明,灵芝多糖具有抗肿瘤、增强免疫力、抗衰老等多种生物活性。
3.因此,本次通过诱变技术获得的灵芝突变菌株在发酵中生产的多糖取得了显著的进步。
技术实现要素:
4.鉴于现有技术中的上述缺陷或不足,期望提供一种灵芝突变菌株及其诱变和筛选方法。
5.根据本技术实施例提供的技术方案,一种灵芝突变菌株,灵芝 ganoderma lucidum sbl
‑
lz
‑
kjyb
‑
5,其保藏编号为cgmcc no.23055。
6.一种灵芝突变菌株的应用,其应用为所述灵芝突变菌株发酵生产胞外粗多糖和胞外多糖,所述灵芝突变菌株在常规灵芝发酵培养基马铃薯葡萄糖肉汤培养基液体发酵10天,其胞外粗多糖的含量在3.10g/l
ꢀ‑
3.56g/l,比出发菌株提高了49%
‑
52.79%。所述灵芝突变菌株在常规灵芝发酵培养基马铃薯葡萄糖肉汤培养基液体发酵10天,其胞外多糖的含量达18g/l
‑
20.77g/l,比出发菌株提高了55%
‑
59.52%。本灵芝突变菌株属于灵芝属的一个突变品种,该品种已于2021年07月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编:100101),分类地位为灵芝属赤灵芝(ganoderma lucidum)种,保藏编号为cgmcc no.23055。
7.一种灵芝突变菌株的诱变包括以下步骤:
8.1)地面模拟诱变
9.a菌株准备:
10.将出发菌株菌落大小为0.2cm*0.2cm接种于pda平板培养基上,于 25
‑
35℃进行培养,当菌落在平板上的直径超过3cm后待用;
11.b地面模拟空间诱变试验:
12.对平板上的菌株进行以下三组结合的诱变试验:
13.模拟飞行器飞行时的振动试验:将直径超过3cm的菌株平板固定在双振动台上,在0
‑
400kn下振动1h,其中前0.5小时为低频正弦振动试验,后0.5小时为随机振动试验;
14.真空低能粒子辐照试验:将直径超过3cm的菌株平板放入空间低能综合辐照实验设备中,在10
‑3‑
10
‑6pa真空度下辐照30min
‑
180min后回收,辐射剂量为1
×
10
14
ev
‑4×
10
14
ev;
15.重力加速度试验:选取4g的重力加速度,进行超重试验30min;
16.c培养:
17.在无菌条件下取地面模拟空间诱变样品进行培养,步骤如下:在无菌条件下取培养面积为0.2cm*0.2cm的模拟空间诱变样品,用5毫升无菌水洗脱菌体到无菌离心管中,用移液器吸打均匀菌体洗脱液,取0.5 毫升该菌液到4.5毫升无菌水中,吸打均匀,以此类推,做倍比稀释,取10
‑
4和10
‑
5稀释液涂布到含有固体培养基的平板上,每块平板上涂 50微升
‑
250微升稀释菌液,每个稀释梯度涂多块平板,待菌液被培养基吸收后于培养箱中25℃
‑
35℃倒置培养5天
‑
20天后,选取生长迅速、单菌落大的菌株继续培养、保存,进行下一步筛选试验;
18.2)地面模拟诱变后的菌株筛选
19.a在pda固体培养基中加入高浓度的代谢中产物β
‑
葡聚糖,组成筛选培养基,制备方法为:称取马铃薯葡萄糖琼脂培养基粉(pda)39g、β
‑
葡聚糖50
‑
150g用蒸馏水定容至1l,自然ph,121℃灭菌30min,倒入无菌培养皿中冷却凝固成固体培养基;
20.b将筛选培养基灭菌并倒在平板中,冷凝后制得筛选平板;
21.c将经地面模拟空间诱变过的菌株均匀涂布、划线、点种中的其中一种方式接种在筛选平板上;
22.d将接种好的平板放置于霉菌培养箱中,25
‑
35℃恒温培养3
‑
10天,依照生长速度、菌落大小两项指标,筛选生长较快、菌落形态变化较大的菌株作为备选菌株,待有返回式飞行器时实施空间诱变试验,
23.筛选出的菌株经过3
‑
10代的传代工作,将菌株接种在pda斜面培养基上,4℃冰箱保存,待发射计划确定后,再进行复壮,进行空间诱变;
24.3)空间诱变试验
25.所述空间诱变是将地面模拟诱变中筛选出的菌株转移到搭载管中,置于太空舱内,然后将太空舱送入空间诱变环境,所述空间环境为:微重力10
‑3‑
10
‑6g,发射和回收阶段的振动为0
‑
400kn;太空舱内辐射剂量 0.1mgy
‑
0.9mgy。
26.所述的空间诱变试验方法为:
27.a空间诱变
28.将从地面模拟实验中挑选出的生长更迅速的变异菌株接种在固体培养基上,将接完种的斜面放入培养箱中,25~35℃条件下培养3
‑
7天,以便于进行空间诱变试验;
29.在无菌条件下,刮取一块培养好的斜面加入2ml搭载小管中,封口膜封口,再将搭载小管装入溶剂30
‑
50ml的搭载大管中,将搭载大管交给发射基地有关人员,安装在神舟十一号飞船上,随飞船进行空间诱变试验,此搭载管放入“神舟十一号”飞船中,在太空中随飞船飞行33 天后回收;
30.b回收搭载管
31.在无菌条件下取培养面积为0.2cm*0.2cm的搭载回收样品,用5毫升无菌水洗脱菌体到无菌离心管中,用移液器吸打均匀菌体洗脱液,取 0.5毫升该菌液到4.5毫升无菌水中,吸打均匀,以此类推,做倍比稀释,取10
‑4和10
‑5倍的稀释液涂布到平板培养基,每块平板上涂50
‑
250 微升稀释菌液,每个稀释梯度涂多块平板,待菌液被培养基吸收后于培养箱中25
‑
35℃倒置培养3
‑
10天;
32.4)空间诱变后的菌株筛选
33.挑选经空间诱变后生长迅速的单菌落,划线法接种于预先制备好的筛选平板上,将接种好的平板于霉菌培养箱中,25
‑
35℃恒温培养3
‑
10 天,将平板上生长速度快的单菌落挑出。
34.本发明中,pdb培养基的制备方法为:称取马铃薯葡萄糖肉汤培养基35克,加入1000ml蒸馏水中,自然ph,摇匀,121℃高压灭菌30分钟,备用。
35.本发明中,将菌株在平板pda培养基上进行活化,于25
‑
35℃培养 5
–
10d,待菌丝体长满平板之后,挑取约4mm2大小的菌块接入250mlpdb培养基中,于120r/min
‑
200r/min,25℃
‑
35℃摇床培养5d
–
10d 后,收集发酵液测量菌丝体生物量、胞外粗多糖含量和胞外多糖的含量。
36.本发明中,出发菌株灵芝菌(ganoderma lucidum)sbl
‑
lz
‑
6(实验室编号)为发明人自然采集所得,初始菌株经培养与野生菌株相比,就有较高的菌丝体生物量和产胞外粗多糖及胞外多糖的能力,但仍然没有达到十分理想的状态。
37.本发明中,本发明将出发菌株——灵芝(ganoderma lucidum) sbl
‑
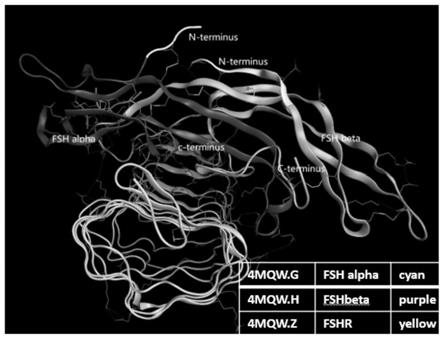
lz
‑
6在地面经过地面模拟空间诱变试验后,回收诱变材料,利用筛选培养基平板从回收样品中筛选得到多株生长速度更快的菌株(实验室编号sbl
‑
lz
‑
mnyb9——sbl
‑
lz
‑
mnyb21),再利用神舟十一号进行空间诱变,对诱变材料回收后,经过筛选并最终通过发酵法确定了一株能产生更多菌丝体、胞外粗多糖及胞外多糖的菌株——灵芝(ganodermalucidum)sbl
‑
lz
‑
kjyb
‑
5进行了保藏,达到了本发明的目的。
38.综上所述,本技术的有益效果:
39.(1)灵芝菌落为圆形,菌丝浓密、整齐,白色,长势快,干燥,易挑取。该菌株的生理生化特点为:生长温度范围比出发菌株更广,耐高温,45℃仍可生长,最适生长温度为28
‑
32℃;液体培养的最适转速 180rpm;自然ph,耐盐度比诱变前的菌株变强,在含有1%nacl的pda 培养基中仍然生长良好。
40.(2)本发明采用地面模拟和空间诱变的相结合的方法作为灵芝菌新的诱变手段具有诱变有益突变率高的显著特点;
41.(3)本发明筛选方法基于微生物代谢途径中代谢产物反馈抑制原理,将高浓度代谢终产物β
‑
葡聚糖加入到pda培养平板中,在这样平板中生长状况良好的菌株,通常都是生长更快速、代谢效率更高的菌株,因此只要挑出在这种平板上生长良好的单菌落,一般就是生产上需要的菌株,因此这是一种高效、简便的优良菌株平板筛选方法;
42.(4)本发明方法实现了高产菌株的单独培养平板筛选,和传统筛选方法比较,降低了工作量数倍以上,并大大降低了筛选的盲目性。
43.(4)本发明方法操作过程简单,所需试剂和材料均为实验室常见的普通试剂。
附图说明
44.通过阅读参照以下附图所作的对非限制性实施例所作的详细描述,本技术的其它特征、目的和优点将会变得更明显:
45.图1为诱变前后菌株在1%nacl pda平板上的生长状况;
46.图2为差异蛋白亚细胞定位柱状图;
47.图中标号:
具体实施方式
48.下面结合附图和实施例对本技术作进一步的详细说明。可以理解的是,此处所描述的具体实施例仅仅用于解释相关发明,而非对该发明的限定。另外还需要说明的是,为了便于描述,附图中仅示出了与发明相关的部分。
49.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本技术。
50.实施例1
51.(1)地面模拟空间诱变试验
52.1)菌株准备
53.将出发菌株灵芝菌(ganoderma lucidum)sbl
‑
lz
‑
kjyb
‑
5(实验室编号)接种在含有pda培养基的平板上进行培养,当菌株直径超过3cm 准备进行地面模拟空间诱变试验。pda培养基的平板制作方式如下:1) 称取马铃薯葡萄糖琼脂培养基粉(pda)39g用蒸馏水定容至1l,自然p h,121℃灭菌30min,倒入无菌培养皿中冷却凝固成固体培养基;2)每个平皿倒培养基20
‑
30ml,33
‑
37℃培养24小时无菌可以使用;4)将出发菌株接种后,在30℃恒温培养5天。
54.2)对平板上的菌株顺序进行下列诱变试验:
55.真空低能粒子诱变:将培养好的灵芝菌株平板(φ9cm)放入空间低能综合辐照实验设备中进行真空低能粒子辐照试验,在10
‑5pa真空度下辐照120分钟后回收,辐射剂量为2.6
×
10
14
ev。
56.模拟飞行器飞行时的振动试验:将培养好的灵芝菌株平板(φ9cm) 固定在400kn双振动台上,试验1h,开始0.5小时为低频正弦振动试验,后0.5小时为随机振动试验。本试验模拟飞行器发射和返回时所受振动的情况。
57.重力加速度试验:将培养好的菌株装入10ml离心管中,选取4g的重力加速度,进行超重试验30min。
58.3)培养
59.回收诱变材料。在无菌条件下取培养面积约0.2cm*0.2cm的模拟空间诱变样品,用5毫升无菌水洗脱菌体到无菌离心管中,用移液器吸打均匀菌体洗脱液,取0.5毫升该菌液到4.5毫升无菌水中,吸打均匀,以此类推,做倍比稀释。取10
‑
4和10
‑
5稀释液涂布到pda培养基平板上(此平板的制作方式与步骤(1)菌株准备中的pda固体培养基的平板的制作方式相同),每块平板上涂100微升稀释菌液,每个稀释梯度涂多块平板。待菌液被培养基吸收后于培养箱中30℃倒置培养5天。选取生长迅速、单菌落大的菌株继续培养、保存,进行下一步筛选试验。
60.4)筛选
61.①
筛选平板的制作
62.a称取马铃薯葡萄糖琼脂培养基粉(pda)39g、β
‑
葡聚糖100g用蒸馏水定容至1l,自然ph,121℃灭菌30min,倒入无菌培养皿中冷却凝固成固体培养基;
63.b取灭好菌的直径为90mm的培养皿,每个培养皿倒培养基30ml,32℃培养24小时,
选取无菌平板进入下一个工作环节,污染平板灭菌销毁。
64.②
接种
65.挑选经地面模拟空间诱变后生长迅速的单菌落,划线法接种于预先制备好的筛选平板上。
66.③
培养
67.将接种好的平板于霉菌培养箱中,30℃恒温培养5天。
68.④
菌落挑选
69.将平板上生长速度快的单菌落挑出。
70.(2)空间诱变
71.1)空间诱变。将从地面模拟实验中挑选出的生长更迅速(实验室编号sbl
‑
lz
‑
mn21)接种在固体培养基上,将接完种的斜面放入培养箱中, 30℃条件下培养3天,以便于进行空间诱变试验。在无菌条件下,刮取一块培养好的斜面加入2ml搭载小管中,封口膜封口,再将搭载小管装入溶剂30
‑
50ml的搭载大管中。将搭载大管交给发射基地有关人员,安装在神舟十一号飞船上,随飞船进行空间诱变试验。此搭载管放入“神舟十一号”飞船中,在太空中随飞船飞行33天后回收。
72.2)回收搭载管。在无菌条件下取培养面积为约0.2cm*0.2cm的搭载回收样品,用5毫升无菌水洗脱菌体到无菌离心管中,用移液器吸打均匀菌体洗脱液,取0.5毫升该菌液到4.5毫升无菌水中,吸打均匀,以此类推,做倍比稀释。取10
‑
4和10
‑
5倍的稀释液涂布到平板培养基,每块平板上涂50
‑
250微升稀释菌液,每个稀释梯度涂多块平板。待菌液被培养基吸收后于培养箱中30℃倒置培养5天。
73.3)筛选
74.①
称取马铃薯葡萄糖琼脂培养基粉(pda)39g、β
‑
葡聚糖50
‑
150g 用蒸馏水定容至1l,自然ph,121℃灭菌30min,倒入无菌培养皿中冷却凝固成固体培养基。取灭好菌的直径为90mm的培养皿,每个培养皿倒培养基30ml,37℃培养24小时,选取无菌平板进入下一个工作环节,污染平板灭菌销毁。挑选经空间诱变后生长迅速的单菌落,划线法接种于预先制备好的筛选平板上。
75.②
培养:将接种好的平板于霉菌培养箱中,30℃恒温培养5天。
76.③
菌落挑选:将平板上生长速度快的单菌落挑出。
77.4)发酵
78.配制马铃薯葡萄糖肉汤培养基(pdb培养基):称取马铃薯葡萄糖肉汤培养基35克,加入1000ml蒸馏水中,自然ph,摇匀,121℃高压灭菌30分钟,备用。
79.将菌株在平板pda培养基上进行活化,于30℃培养10d,挑取约 4mm2大小的菌块接入250ml pdb培养基中,于120r/min,28℃摇床培养10d。
80.5)测定
81.菌丝体生物量及胞外粗多糖含量测定:按照上述试验方法培养至相应天数后,收集发酵液于8 000r/min条件下离心20min,收集沉淀得到菌丝体,用蒸馏水冲洗3次,冷冻干燥后称重得菌丝体生物量。单位按照g/l计算。
82.发酵液离心之后取上清液,测量其体积,缓慢加入4倍体积的无水乙醇并搅拌均匀,置于4℃下静置醇沉12h,8000r/min离心20min,收集沉淀,以相同浓度乙醇洗涤沉淀2
次,沉淀部分加蒸馏水充分溶解,加热挥去乙醇,冷冻干燥得到胞外粗多糖的量。本诱变菌株与出发菌株的胞外粗多糖的测定结果如表1所示。
83.胞外多糖的含量测定:发酵液经醇沉后取一定量的上清液,采用苯酚硫酸法测定胞外多糖。单位按照g/l计算。本诱变菌株与出发菌株的胞外多糖的测定结果如表1所示。
84.6)结果
85.表1空间诱变对灵芝菌株菌丝体的生长和产胞外多糖含量的影响
[0086][0087]
实施例2
[0088]
(1)地面模拟空间诱变试验
[0089]
1)菌株准备
[0090]
将出发菌株灵芝菌(ganoderma lucidum)sbl
‑
lz
‑
6(实验室编号) 接种在含有pda培养基的平板上进行培养,当菌株直径超过3cm准备进行地面模拟空间诱变试验。pda培养基的平板制作方式如下:1)称取马铃薯葡萄糖琼脂培养基粉(pda)39g用蒸馏水定容至1l,自然ph,121℃灭菌30min,倒入无菌培养皿中冷却凝固成固体培养基;2)每个平皿倒培养基20
‑
30ml,33
‑
37℃培养24小时无菌可以使用;4)将出发菌株接种后,在30℃恒温培养5天。
[0091]
2)对平板上的菌株顺序进行下列诱变试验:
[0092]
真空低能粒子诱变:将培养好的灵芝菌株平板(φ9cm)放入空间低能综合辐照实验设备中进行真空低能粒子辐照试验,在10
‑5pa真空度下辐照120分钟后回收,辐射剂量为2.6
×
10
14
ev。
[0093]
模拟飞行器飞行时的振动试验:将培养好的灵芝菌株平板(φ9cm) 固定在400kn双振动台上,试验1h,开始0.5小时为低频正弦振动试验,后0.5小时为随机振动试验。本试验模拟飞行器发射和返回时所受振动的情况。
[0094]
重力加速度试验:将培养好的菌株装入10ml离心管中,选取4g的重力加速度,进行超重试验30min。
[0095]
3)培养
[0096]
回收诱变材料。在无菌条件下取培养面积约0.2cm*0.2cm的模拟空间诱变样品,用5毫升无菌水洗脱菌体到无菌离心管中,用移液器吸打均匀菌体洗脱液,取0.5毫升该菌液到4.5毫升无菌水中,吸打均匀,以此类推,做倍比稀释。取10
‑
4和10
‑
5稀释液涂布到pda培养基平板上(此平板的制作方式与步骤(1)菌株准备中的pda固体培养基的平板的制作方式
相同),每块平板上涂100微升稀释菌液,每个稀释梯度涂多块平板。待菌液被培养基吸收后于培养箱中30℃倒置培养5天。选取生长迅速、单菌落大的菌株继续培养、保存,进行下一步筛选试验。
[0097]
4)筛选
[0098]
①
筛选平板的制作
[0099]
a称取马铃薯葡萄糖琼脂培养基粉(pda)39g、β
‑
葡聚糖100g用蒸馏水定容至1l,自然ph,121℃灭菌30min,倒入无菌培养皿中冷却凝固成固体培养基;
[0100]
b取灭好菌的直径为90mm的培养皿,每个培养皿倒培养基30ml,32℃培养24小时,选取无菌平板进入下一个工作环节,污染平板灭菌销毁。
[0101]
②
接种
[0102]
挑选经地面模拟空间诱变后生长迅速的单菌落,划线法接种于预先制备好的筛选平板上。
[0103]
③
培养
[0104]
将接种好的平板于霉菌培养箱中,30℃恒温培养5天。
[0105]
④
菌落挑选
[0106]
将平板上生长速度快的单菌落挑出。
[0107]
(2)空间诱变
[0108]
1)空间诱变。将从地面模拟实验中挑选出的生长更迅速、(实验室编号sbl
‑
lz
‑
mn21)接种在固体培养基上,将接完种的斜面放入培养箱中,30℃条件下培养3天,以便于进行空间诱变试验。在无菌条件下,刮取一块培养好的斜面加入2ml搭载小管中,封口膜封口,再将搭载小管装入溶剂30
‑
50ml的搭载大管中。将搭载大管交给发射基地有关人员,安装在神舟十一号飞船上,随飞船进行空间诱变试验。此搭载管放入“神舟十一号”飞船中,在太空中随飞船飞行33天后回收。
[0109]
2)回收搭载管。在无菌条件下取培养面积为约0.2cm*0.2cm的搭载回收样品,用5毫升无菌水洗脱菌体到无菌离心管中,用移液器吸打均匀菌体洗脱液,取0.5毫升该菌液到4.5毫升无菌水中,吸打均匀,以此类推,做倍比稀释。取10
‑
4和10
‑
5倍的稀释液涂布到平板培养基,每块平板上涂50
‑
250微升稀释菌液,每个稀释梯度涂多块平板。待菌液被培养基吸收后于培养箱中30℃倒置培养5天。
[0110]
3)筛选
[0111]
①
称取马铃薯葡萄糖琼脂培养基粉(pda)39g、β
‑
葡聚糖50
‑
150g 用蒸馏水定容至1l,自然ph,121℃灭菌30min,倒入无菌培养皿中冷却凝固成固体培养基。取灭好菌的直径为90mm的培养皿,每个培养皿倒培养基30ml,37℃培养24小时,选取无菌平板进入下一个工作环节,污染平板灭菌销毁。挑选经空间诱变后生长迅速的单菌落,划线法接种于预先制备好的筛选平板上。
[0112]
②
培养:将接种好的平板于霉菌培养箱中,30℃恒温培养5天。
[0113]
③
菌落挑选:将平板上生长速度快的单菌落挑出。
[0114]
4)发酵
[0115]
配制马铃薯葡萄糖肉汤培养基(pdb培养基):称取马铃薯葡萄糖肉汤培养基35克,加入1000ml蒸馏水中,自然ph,摇匀,121℃高压灭菌30分钟,备用。
[0116]
将菌株在平板pda培养基上进行活化,于30℃培养10d,挑取约4mm2大小的菌块接入250ml pdb培养基中,于180r/min,30℃摇床培养10d。
[0117]
5)测定
[0118]
菌丝体生物量及胞外粗多糖含量测定:按照上述试验方法培养至相应天数后,收集发酵液于8000r/min条件下离心20min,收集沉淀得到菌丝体,用蒸馏水冲洗3次,冷冻干燥后称重得菌丝体生物量。单位按照g/l计算。
[0119]
发酵液离心之后取上清液,测量其体积,缓慢加入4倍体积的无水乙醇并搅拌均匀,置于4℃下静置醇沉12h,8000r/min离心20min,收集沉淀,以相同浓度乙醇洗涤沉淀2次,沉淀部分加蒸馏水充分溶解,加热挥去乙醇,冷冻干燥得到胞外粗多糖的量。本诱变菌株与出发菌株的胞外粗多糖的测定结果如表2所示。
[0120]
胞外多糖的含量测定:发酵液经醇沉后取一定量的上清液,采用苯酚硫酸法测定胞外多糖。单位按照g/l计算。本诱变菌株与出发菌株的胞外多糖的测定结果如表2所示。
[0121]
6)结果
[0122]
表2空间诱变对灵芝菌株菌丝体的生长和产胞外多糖含量的影响
[0123][0124]
从试验结果可以看出,灵芝菌株产菌丝体和胞外多糖的量不仅与菌株有关系,同时也与培养方法也有很大的关系。同时,也可以看出,诱变菌株在生产胞外粗多糖和胞外多糖的效果比出发菌株更显著。
[0125]
诱变菌株的抗盐试验
[0126]
如图1所示,分别取诱变前后,经培养灵芝大小约0.2cm*0.2cm的菌落接种于含有1%nacl的pda平板培养基上,于30℃培养5d。诱变后的菌株在1%盐度的平板上明显比出发菌株生长得更致密,菌丝含量更丰富。
[0127]
诱变菌株的遗传学研究
[0128]
为了进一步确定诱变菌株的遗传特性,采用同位素标记相对和绝对定量(itraq)技术对模拟空间诱变处理前后的灵芝菌株蛋白进行定量蛋白质组学分析和采用lc
‑
ms/ms技术进行非靶向代谢组学分析。
[0129]
(1)蛋白组学研究
[0130]
如图2所示,在蛋白组学的分析中一共有14893条肽段和3783个蛋白被鉴定到,差异蛋白982个,其中490个蛋白表达上调,492个蛋白表达下调。其中位于细胞质的蛋白268
个,线粒体的224,胞外195 个,细胞核174个,质膜54个,细胞质和细胞核均有的34个,细胞骨架26个、细胞质和细粒体均有的5个、过氧物酶体2个。
[0131]
(2)代谢组学研究
[0132]
如表3所示,代谢组学分析结果显示与生长显著相关的肌苷、吲哚
ꢀ‑3‑
乙酸、生物素显著上调,而茉莉酸下调,与戊糖磷酸途径相关的核糖醇上调。蛋白组学和代谢组学的结果从机理上解释了诱变菌株生长加快、胞外粗多糖含量升高的原因。
[0133]
表3
[0134][0135][0136]
以上描述仅为本技术的较佳实施例以及对所运用技术原理等方案的说明。同时,本技术中所涉及的发明范围,并不限于上述技术特征的特定组合而成的技术方案,同时也应涵盖在不脱离所述发明构思的情况下,由上述技术特征或其等同特征进行任意组合而形成的其它技术方案。例如上述特征与本技术中公开的(但不限于)具有类似功能的技术特征进行互相替换而形成的技术方案。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。