1.本发明涉及肽及其应用。具体而言,本发明涉及具有向硬癌中包含的癌相关成纤维细胞和间充质干细胞的至少其中一种细胞的高度的聚集性的肽、编码所述肽的核酸、含有所述肽的肽
‑
药物缀合物、含有所述肽
‑
药物缀合物的药物组合物、含有所述肽的标记肽、含有所述标记肽的成像组合物、以及具有所述核酸的肽
‑
药物缀合物表达载体和具有所述核酸的标记肽表达载体。本技术基于2019年3月26日于日本提交的特愿2019
‑
057966号发明专利申请而主张优先权,在此援引其内容。
背景技术:
2.在已经进入超高龄化社会的日本,目前,恶性新生物占据主要死因的首位,每2个成人中就有1位罹患。在该等恶性肿瘤中,对现有的抗癌剂呈现抗药性、作为难治癌症被人们迫切希望解决的是“硬癌(scirrhous carcinoma)”。根据肿瘤组织的病理图像,胰腺癌、胃癌、大肠癌、乳腺癌的亚型等被认为是呈现该预后不良的硬癌的典型。
3.硬癌至今仍在临床医学中被公认为难以治疗、生存率最低的难治类型的癌。在日本,每年有约18000人被诊断出胰腺癌,约45000人被诊断出胃癌(其中10%为硬癌),死于胰腺癌者每年有19000人以上,硬性胃癌的5年存活率为约10%以上20%以下,属于预后不良。据(日本)全国胰腺癌登记调查报告(1999年度)显示,胰腺癌能够成功切除的病例数为总病例数的39%,其5年存活率为13%,现状非常严峻。即,即便放眼世界,硬癌也可谓是在当前医疗中亟待解决的高恶性度肿瘤。
4.硬癌治疗困难的原因之一可举出为,胰腺癌和胃癌在当前的临床技术上难以做到早期发现,大多数的病例在发现时已经发展为不适于手术或者形成了转移病灶的进展病例。治疗困难的另一原因是,硬癌具有治疗学上的抗药性。关于抗药性,可以举出如下情况,即,高度发育后的纤维性的癌间质成为了对抗癌剂渗透、放射治疗的物理屏障。此外,由于该丰富的癌间质引起与癌细胞之间的生物学上的相互反应,促进癌细胞的生长、浸润和转移,因此硬癌在体内的进展快速,呈现生物学上的高恶性度。该癌间质的主要构成成分一般认为是癌相关成纤维细胞(cancer
‑
associated fibroblast,即caf),根据截至目前的研究,已知caf的重要来源(细胞起源)至少一部分是混入于癌组织的间充质干细胞(mesencymal stem cell,即msc)。另外,在胰腺癌等中,包围癌细胞周围的丰富的间质部分中的血管的发育不成熟,无法充分期待抗癌剂经由血管在肿瘤组织内的扩散效应(enhanced permeation and retention,即epr效应),因此施药的治疗效果较弱,该发育变厚的癌间质的控制成为了同类型的癌的重大待解决课题。
5.在将肽用作生物材料的医疗领域的动向中,tat、穿膜肽(penetratin)、聚精氨酸(poly
‑
arginin)等的细胞膜穿透性(细胞吸收性)肽受到关注。但是这些肽不区分正常细胞或正常组织与肿瘤细胞或肿瘤组织,广泛且非选择性地被吸收。因此,由于会引起严重的副作用,难以应用于要求靶向选择性递送药物的、以实体癌为代表的患者恶性肿瘤的治疗dds(drug delivery system,药物传递系统)工具。尤其是,在世界性的实验体系中普遍使用的
tat等的细胞膜穿透性(细胞吸收性)肽,其在肝脏引起聚集的性质已为人所知(例如参考非专利文献1)。
6.对此,环状rgd(cyclic rgd)是唯一已被医药化的肽。环状rgd以已被报告在构成新生血管或已有血管的血管内皮细胞(及一部分肿瘤细胞)中高表达的α
v
β3整合素为靶点,在增加血管穿透性方面有其作用点,可期待由epr效应(经由血管的物质扩散效应)的增强带来的药剂递送效果。因此,不是以单独使用环状rgd的方式,而是以与其他药物同时配合使用的方式,作为成像剂、dds剂应用(例如参考专利文献1)。但是,环状rgd对癌细胞本身的渗透性和作用非常低,只是以经由血管的药剂扩散效应为主,是非常受制于肿瘤组织的结构(血管的发育和分布)的系统。鉴于这些原因,在以通过直接杀伤癌细胞本身而进行的抗癌治疗为目的的情况下,无法期待足够的效果。
7.为解决上述课题,迄今为止发明人们开发了直接作用于胰腺癌细胞或胰腺癌组织,通过高度转变的被吸收性而直接作用于肿瘤的肽(例如参考专利文献2)。
8.但是,尚未开发出把被正常细胞和正常组织吸收限制在最小程度,同时发挥在大量的caf增殖的硬癌组织中高度转变的被吸收性的短链肽。现有技术文献
9.专利文献专利文献1:日本发明专利公报第5721140号专利文献2:国际公布第2017/086090号
10.非专利文献非专利文献1:vives e.,et al.,a truncated hiv
‑
1tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus,j.biol.chem.,272,16010
‑
16017,1997。
技术实现要素:
发明要解决的技术课题
11.本发明是鉴于以上情况而作出的,提供一种选择性地聚集于caf的新的肽、编码所述肽的核酸、含有所述肽的肽
‑
药物缀合物、含有所述肽
‑
药物缀合物的药物组合物、含有所述肽的标记肽、含有所述标记肽的成像组合物、以及具有所述核酸的肽
‑
药物缀合物表达载体和具有所述核酸的标记肽表达载体。解决课题的技术手段
12.为达成上述目的,发明人进行反复的锐意研究,终于鉴定出一种肽,其具有高度转变的被间充质干细胞吸收的特性,其中前述间充质干细胞迁移至癌组织并在肿瘤内分化为caf,发明人发现该肽被正常细胞和正常组织吸收的特性被抑制,并对在肿瘤组织内从msc分化而来的caf选择性地发挥高度聚集性。
13.即,本发明包括以下的方式。本发明的第一方式所涉及的肽,由如下的通式(i)所示的氨基酸序列组成。
14.(式1)x
11
–
(y
11
–
x
12
)
n11
(i)。
15.(通式(i)中,x
11
为由以下(a)或(b)的氨基酸序列组成的肽残基:
(a)seq id no:1~4中任一个所示的氨基酸序列,(b)在seq id no:1~4中任一个所示的氨基酸序列中缺失、取代或添加1个或2个氨基酸而得的氨基酸序列;y
11
为由氨基酸数量为1以上10以下的氨基酸残基组成的肽接头,所述氨基酸残基各自独立地为甘氨酸残基、脯氨酸残基、丝氨酸残基、半胱氨酸残基或赖氨酸残基。x
12
为由所述(a)或所述(b)的氨基酸序列组成的肽残基、或者它们的逆向
‑
反转型肽(retro
‑
inverso peptide)残基。n11为0以上9以下的整数。)
16.所述y
11
也可以为由氨基酸数量为1以上10以下的甘氨酸残基组成的肽接头。所述n11也可以为1以上4以下的整数。所述x
11
和所述x
12
也可以为由相同的氨基酸序列组成的肽残基。上述第一方式所涉及的肽也可以由seq id no:5所示的氨基酸序列组成。
17.本发明的第二方式所涉及的核酸,编码上述第一方式所涉及的肽。
18.本发明的第三方式所涉及的肽
‑
药物缀合物,含有上述第一方式所涉及的肽和生理活性物质。
19.本发明的第四方式所涉及的药物组合物,含有上述第三方式所涉及的肽
‑
药物缀合物。上述第四方式所涉及的药物组合物可以用于治疗硬癌。所述生理活性物质可以是抗癌剂。
20.本发明的第五方式所涉及的标记肽含有上述第一方式所涉及的肽和标记物质。所述标记物质可以是生物素、亲和素、链霉亲和素、稳定同位素、放射性同位素或者荧光物质。
21.本发明的第六方式所涉及的成像组合物含有上述第五方式所涉及的标记肽。上述第六方式所涉及的成像组合物可以用于硬癌。上述第六方式所涉及的成像组合物可以用于诊断硬癌。
22.本发明的第七方式所涉及的肽
‑
药物缀合物表达载体,具有上述第二方式所涉及的核酸、和编码生理活性物质的核酸。
23.本发明的第八方式所涉及的标记肽表达载体,具有上述第二方式所涉及的核酸、和编码标记物质的核酸。
24.此外,本发明的其他方式如下。
25.(1)由以下通式(i)所示的氨基酸序列组成的肽:(式2)x
11
–
(y
11
–
x
12
)
n11
ꢀꢀ
(i)
26.(在通式(i)中,x
11
为由以下的(a)或(b)的氨基酸序列组成的肽残基:(a)seq id no:1~4中任一个所示的氨基酸序列,(b)在seq id no:1~4中任一个所示的氨基酸序列中缺失、取代或添加1个或2个氨基酸而得的氨基酸序列;y
11
为由氨基酸数量为1以上10以下的氨基酸残基组成的肽接头,所述氨基酸残基各自独立地为甘氨酸残基、脯氨酸残基、丝氨酸残基、半胱氨酸残基或赖氨酸残基。
x
12
为由所述(a)或所述(b)的氨基酸序列组成的肽残基、或者它们的逆向
‑
反转型肽(retro
‑
inverso peptide)残基。n11为0以上9以下的整数。)
27.(2)根据(1)中记载的肽,其中所述y
11
为由氨基酸数量为1以上10以下的甘氨酸残基组成的肽接头。(3)根据(1)或(2)中记载的肽,其中所述n11为1以上4以下的整数。(4)根据(1)至(3)中任一项记载的肽,其中所述x
11
和所述x
12
为由相同的氨基酸序列组成的肽残基。(5)根据(1)至(4)中任一项记载的肽,其由seq id no:5所示的氨基酸序列组成。(6)一种核酸,其编码(1)至(5)中任一项记载的肽。(7)一种肽
‑
药物缀合物,其含有(1)至(5)中任一项记载的肽和生理活性物质。(8)一种药物组合物,其含有(7)中记载的肽
‑
药物缀合物。(9)根据(8)中记载的药物组合物,其用于治疗硬癌。(10)根据(8)或(9)中记载的药物组合物,其中,所述生理活性物质是抗癌剂。(11)一种标记肽,其含有(1)至(5)中任一项记载的肽和标记物质。(12)根据(11)中记载的标记肽,所述标记物质为生物素、亲和素、链霉亲和素、稳定同位素、放射性同位素或者荧光物质。(13)一种成像组合物,其含有(11)或(12)中记载的标记肽。(14)根据(13)中记载的成像组合物,其用于硬癌。(15)根据(13)或(14)中记载的成像组合物,其用于诊断硬癌。(16)一种肽
‑
药物缀合物表达载体,具有(6)中记载的核酸、和编码生理活性物质的核酸。(17)一种标记肽表达载体,其具有(6)中记载的核酸、和编码标记物质的核酸。
28.发明的效果根据上述方式的肽,能够提供选择性地聚集于caf的新的肽。
附图说明
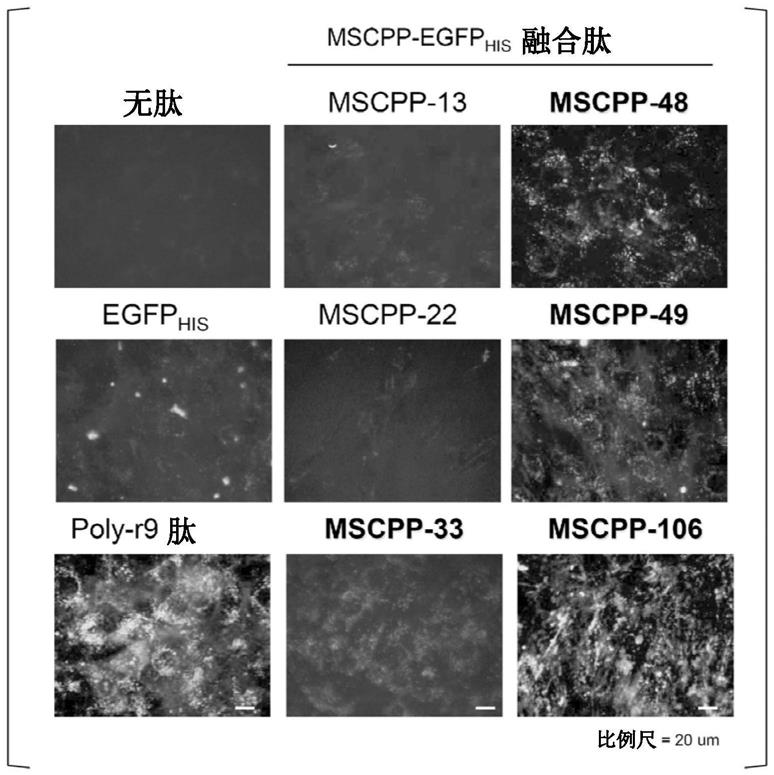
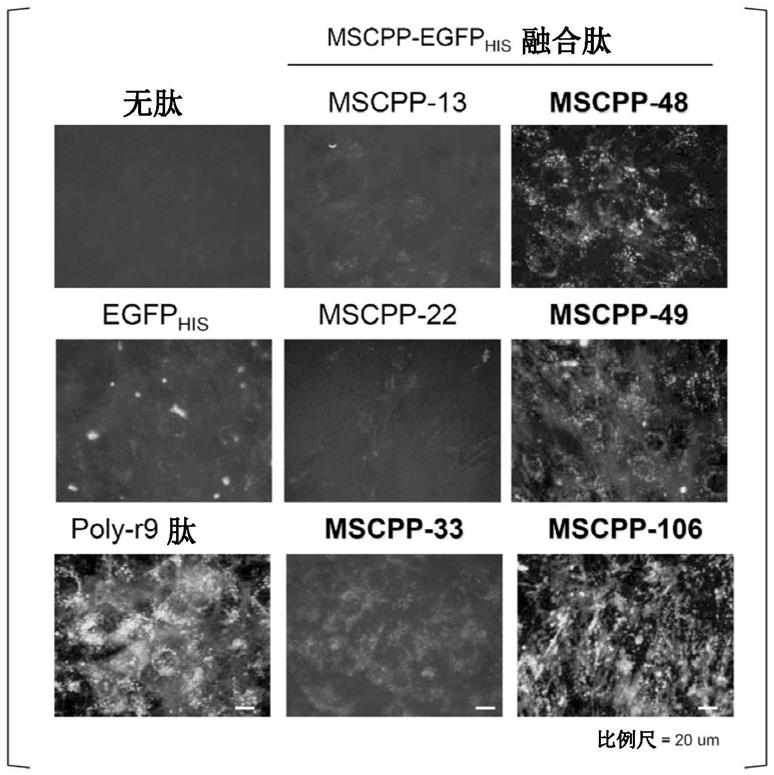
29.图1是实施例1中添加了各肽的人间充质干细胞(hmsc)的荧光图像。比例尺为20μm。图2是实施例2中添加了各肽的各细胞的荧光图像(左)、以及荧光图像和相差显微镜图像叠合后的图像(右)。比例尺为50μm。图3是实施例3中添加了fitc
‑
mscpp106的各细胞的荧光图像和相差显微镜图像。比例尺为50μm。图4是对实施例4中的各肽的降解抗性进行比较的图。图5a是实施例5中的添加了[fam]
‑
tandem mscpp106的bxpc3细胞和hmsc的共培养物的相差显微镜图像和荧光图像。图5b是实施例5中的添加了[fam]
‑
tandem mscpp106的capan
‑
2细胞和hmsc的共培养物的相差显微镜图像和荧光图像。图6是实施例6中的添加了[fam]
‑
tandem mscpp106的hmsc的相差显微镜图像和荧
光图像。图7a是实施例7中的硬癌模型小鼠的全身图像。图7b是从实施例7中的硬癌模型小鼠摘出的各组织和各肿瘤组织的明视野图像(左)和荧光图像(右)。图7c是从实施例7中的硬癌模型小鼠摘出的各肿瘤组织的苏木精
‑
伊红(he)染色图像、明视野图像和荧光图像。图8a是实施例8中的小鼠的皮下肿瘤的he染色图像。图8b是实施例8中的小鼠的皮下肿瘤使用抗人fapα抗体和抗人αsma抗体后的荧光免疫染色图像。图8c是实施例8中的小鼠的皮下肿瘤的相差显微镜图像和荧光图像。图9a是实施例9中的小鼠的皮下肿瘤的he染色图像。图9b是实施例9中的施用了各肽的小鼠的皮下肿瘤的荧光图像。图9c是实施例9中的施用了[fam]
‑
tandem mscpp106的小鼠的皮下肿瘤的荧光图像。图9d是实施例9中的小鼠的皮下肿瘤使用抗人cd73抗体后的荧光免疫染色图像。图9e是实施例9中的小鼠的皮下肿瘤使用抗pd
‑
l1抗体、抗pd
‑
l2抗体和抗smaα抗体后的荧光免疫染色图像。图10a是实施例10中的腹腔肿瘤的he染色图像。图10b是实施例10中的腹腔肿瘤的荧光图像。
具体实施方式
[0030]
【具有向caf的聚集性的肽】本实施方式的肽,由以下的通式(i)所示的氨基酸序列组成。
[0031]
(式3)x
11
–
(y
11
–
x
12
)
n11
ꢀꢀ
(i)
[0032]
(在通式(i)中,x
11
为由以下(a)或(b)的氨基酸序列(以下有时称为“氨基酸序列(i)”)组成的肽残基:(a)seq id no:1~4中任一个所示的氨基酸序列,(b)在seq id no:1~4中任一个所示的氨基酸序列中缺失、取代或添加1个或2个氨基酸而得的氨基酸序列;y
11
为氨基酸数量为1以上10以下的氨基酸残基组成的肽接头,所述氨基酸残基各自独立地为甘氨酸残基、脯氨酸残基、丝氨酸残基、半胱氨酸残基或赖氨酸残基。x
12
为由所述(a)或所述(b)的氨基酸序列组成的肽残基、或者它们的逆向
‑
反转型肽(retro
‑
inverso peptide)残基。n11为0以上9以下的整数。)
[0033]
作为硬癌的一种的胰腺癌组织,由癌细胞形成的浸润性细胞巢、和发育变厚的间质构成,若去除该间质,则肿瘤瓦解。因此,人们在考虑以癌间质为靶标的治疗。发明人着眼于癌间质中包含的癌相关成纤维细胞(caf),如后面叙述的实施例所示,鉴定出对已知在癌组织内分化为caf的间充质干细胞(msc)具有聚集性的肽,发现该肽抑制被正常细胞和正常
组织的吸收,并选择性地聚集于硬癌组织中的caf,从而完成了本发明。
[0034]
在本说明书中,“硬癌”是指呈现出以恶性肿瘤中可见的成纤维细胞为主要成分的间质细胞很丰富的组织形态的癌的一种,在具有丰富的间质的背景下,癌细胞弥漫性地浸润。也称为硬癌(hard cancer)。作为硬癌,具体例如可列举浸润性胰腺导管癌、胃低分化腺癌、乳腺浸润性导管癌、弥漫性浸润性大肠癌等。作为caf发育明显的癌,例如有硬癌,caf是在人活体中产生的所有癌的组织中,不论其多寡必然含有的细胞成分。因此,本实施方式的肽虽然主要着眼于对硬癌的适用,但实际上是对全部的癌都能够普遍适用的肽。
[0035]
在本说明书中,“向caf的高度的聚集性”是指,与体内的正常组织和其他系统的恶性肿瘤细胞相比,被caf或癌间质内高度吸收而聚集的性质。另外,如后述的实施例所示,本实施方式的肽也被作为caf的细胞起源的msc高度吸收而聚集。因此,本实施方式的肽可谓是被caf、msc以及含有这两者的间质内高度吸收而聚集的肽。
[0036]
<氨基酸序列(i)>氨基酸序列(i)是以下的通式(i)所示的序列。
[0037]
(式4)x
11
–
(y
11
–
x
12
)
n11
ꢀꢀ
(i)
[0038]
(x
11
)通式(i)中,x
11
为由以下(a)或(b)的氨基酸序列组成的肽残基:(a)seq id no:1~4中任一个所示的氨基酸序列,(b)在seq id no:1~4中任一个所示的氨基酸序列中缺失、取代或添加1个或2个氨基酸而得的氨基酸序列。
[0039]
上述(a)中的seq id no:1、2、3或4所示的氨基酸序列为以下的氨基酸序列:kcaelfrhl(seq id no:1)wpplqrwrn(seq id no:2)rthpvwsrt(seq id no:3)rrwmqwpwh(seq id no:4)
[0040]
通式(i)中,x
11
也可以是,作为与由上述(a)的氨基酸序列组成的肽残基在功能上等同的肽残基,而为由下述(b)的氨基酸序列所组成的肽残基:(b)在seq id no:1~4中任一个所示的氨基酸序列中缺失、取代或添加1个或2个氨基酸而得的氨基酸序列。
[0041]
此外,在本说明书中,“取代”是指以具有化学上相同的侧链的其他氨基酸残基来取代。具有化学上相同的侧链的氨基酸残基的群组,在以本实施方式的制造方法得到的多肽所属的技术领域中是公知的。例如在酸性氨基酸(天冬氨酸和谷氨酸)、碱性氨基酸(赖氨酸、精氨酸和组氨酸)、中性氨基酸中,能够以带有烃链的氨基酸(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸和脯氨酸)、带有羟基的氨基酸(丝氨酸和苏氨酸)、含硫的氨基酸(半胱氨酸和甲硫氨酸)、带有酰胺基的氨基酸(天冬酰胺和谷氨酰胺)、带有亚氨基的氨基酸(脯氨酸)、带有芳香族基团的氨基酸(苯丙氨酸、酪氨酸和色氨酸)等进行分类。作为通常可能发生的氨基酸的取代,例如可举出:丙氨酸/丝氨酸、缬氨酸/异亮氨酸、天冬氨酸/谷氨酸、苏
氨酸/丝氨酸、丙氨酸/甘氨酸、丙氨酸/苏氨酸、丝氨酸/天冬酰胺、丙氨酸/缬氨酸、丝氨酸/甘氨酸、酪氨酸/苯丙氨酸、丙氨酸/脯氨酸、赖氨酸/精氨酸、天冬氨酸/天冬酰胺、亮氨酸/异亮氨酸、亮氨酸/缬氨酸、丙氨酸/谷氨酸、天冬氨酸/甘氨酸等。
[0042]
更具体而言,例如,在seq id no:1所示的氨基酸序列中,可以设想,n端起第1位的赖氨酸取代为甘氨酸、丙氨酸、精氨酸、组氨酸、丝氨酸或苏氨酸,c端起第1位的亮氨酸取代为甘氨酸、丙氨酸、异亮氨酸、脯氨酸或缬氨酸等。
[0043]
另外,由上述(a)或上述(b)的氨基酸序列组成的肽残基也可以是由l
‑
氨基酸、d
‑
氨基酸或者它们的组合组成的。其中,x
11
优选为由l
‑
氨基酸组成的肽残基。l
‑
氨基酸是天然存在的氨基酸,d
‑
氨基酸是l
‑
氨基酸残基的手性翻转了的氨基酸。另外,为了提高向含有caf或msc的癌间质的高度的聚集性,或者使其他的物理性质最优化,构成由上述(a)或上述(b)的氨基酸序列组成的肽残基的氨基酸残基,也可以是经过甲基化、添加糖链等化学修饰的。
[0044]
(x
12
)通式(i)中,x
12
为由上述(a)或上述(b)的氨基酸序列组成的肽残基,或者它们的逆向
‑
反转型肽残基。在本说明书中,“逆向
‑
反转型肽残基”是指:氨基酸序列翻转,且由对映体氨基酸残基进行了取代的肽残基。
[0045]
其中,从进一步提高向含有caf或msc的癌间质的高度的聚集性的角度考虑,优选x
12
为由与x
11
相同的氨基酸序列组成的肽残基。或者,从在体内发挥更优异的降解抗性的角度考虑,优选x
12
为x
11
的逆向
‑
反转型肽残基。
[0046]
(y
11
)通式(i)中,y
11
为氨基酸数量为1以上10以下的氨基酸残基组成的肽接头。y
11
中的氨基酸数量为1以上5以下,优选1以上3以下,更优选为1。其中,y
11
优选为由氨基酸数量为1以上10以下的氨基酸残基组成的肽接头,所述氨基酸残基优选各自独立地为甘氨酸残基、半胱氨酸残基或赖氨酸残基;更优选为由氨基酸数量为1的氨基酸残基组成的肽接头,所述氨基酸残基为甘氨酸残基、半胱氨酸残基或赖氨酸残基。构成y
11
的所述氨基酸残基为半胱氨酸残基或赖氨酸残基的情况下,能够经由半胱氨酸残基的巯基(
‑
sh)或赖氨酸残基的侧链,通过共价键使后述的目的物质与本实施方式的肽结合起来。
[0047]
(n11)通式(i)中,n11为0以上9以下的整数,优选为0以上8以下的整数,更优选为0以上6以下的整数,进一步优选为1以上4以下的整数,尤其优选为1以上3以下的整数,最优选为1以上2以下的整数。n11为2以上的情况下,多个地存在的y
11
和x
12
可以分别相同,也可以不同,从容易合成的角度考虑,优选为相同。
[0048]
在本实施方式的肽中,作为优选的氨基酸序列(i),具体例如可举出上述seq id no:1~4中任一个所示的氨基酸序列、以下的seq id no:5或6所示的氨基酸序列等。此外,这些氨基酸序列仅仅是氨基酸序列(i)的一个示例,优选的氨基酸序列(i)不限定于这些。seq id no:6所示的氨基酸序列中,n端起第2位和第12位的“mc”表示甲基化半胱氨酸残基。
[0049]
kcaelfrhl
‑
g
‑
kcaelfrhl(seq id no:5)kmcaelfrhl
‑
g
‑
kmcaelfrhl(seq id no:6)
[0050]
其中,如后述的实施例中所示那样,n端起第2位和第12位的半胱氨酸残基对于向caf的聚集性而言是重要的,所以,作为本实施方式的肽,优选为由seq id no:5所示的氨基酸序列组成的肽。
[0051]
<肽的制造方法>本实施方式的肽可以通过化学合成法制造,或者也可以通过生物法制造。作为化学合成法,例如可以举出肽固相合成法(boc固相合成法、fmoc固相合成法等)等。作为生物法,例如可以举出使用基于具有编码上述肽的核酸的表达载体的无细胞肽合成体系、活细胞肽合成体系的方法等。关于无细胞肽合成体系和活细胞肽合成体系,将在后面具体描述。
[0052]
<核酸>本实施方式的核酸是编码上述实施方式所涉及的肽的核酸。
[0053]
根据本实施方式的核酸,能够得到具有向含有caf或msc的癌间质的高度聚集性的肽。
[0054]
作为编码上述肽的核酸,例如可以举出:由seq id no:7~11中任一个所示的碱基序列组成的核酸,或者,与seq id no:7~11中任一个所示的碱基序列具有80%以上、例如85%以上、例如90%以上、例如95%以上的同一性的、且包括所有的编码成为如下的肽的构成成分的各氨基酸的组合的碱基序列的核酸等,其中,所述肽为具有向含有caf或msc的癌间质的高度的聚集性的肽。seq id no:7所示的碱基序列是编码由上述的seq id no:1所示的氨基酸序列组成的肽的核酸的碱基序列。seq id no:8所示的碱基序列是编码由上述的seq id no:2所示的氨基酸序列组成的肽的核酸的碱基序列。seq id no:9所示的碱基序列是编码由上述的seq id no:3所示的氨基酸序列组成的肽的核酸的碱基序列。seq id no:10所示的碱基序列是编码由上述的seq id no:4所示的氨基酸序列组成的肽的核酸的碱基序列。seq id no:11所示的碱基序列是编码由上述的seq id no:5所示的氨基酸序列组成的肽的核酸的碱基序列。
[0055]
在此,对象碱基序列相对于基准碱基序列的序列同一性,例如能够按如下方式求出。首先,将基准碱基序列和对象碱基序列对齐。其中,各碱基序列中也可以包括缺口,使得序列同一性为最大。接着,在基准碱基序列和对象碱基序列中计算出一致的碱基的碱基数,根据下式求出序列同一性。
[0056]
【序列同一性(%)】=【一致的碱基数】/【对象碱基序列的碱基总数】
×
100
[0057]
本实施方式的核酸,也可以是包含在载体(vector)中的形式。作为载体,优选为蛋白质表达载体。作为表达载体,没有特别限定,例如可以使用来源于大肠杆菌的质粒、来源于枯草杆菌的质粒、来源于酵母的质粒、噬菌体、病毒载体、以及对它们进行改性后的载体等。作为来源于大肠杆菌的质粒,例如可以举出pbr322、pbr325、puc12、puc13等。作为来源于枯草杆菌的质粒,例如可以举出pub110、ptp5、pc194等。作为来源于酵母的质粒,例如可以举出psh19、psh15等。作为噬菌体,例如可以举出λ噬菌体等。作为成为病毒载体的来源的病毒,例如可以举出腺病毒、腺相关病毒、慢病毒、牛痘病毒、杆状病毒、逆转录病毒、肝炎病毒等。
[0058]
在上述表达载体中,作为上述肽表达用的启动子没有特别限定,可以是以动物细
胞为宿主的表达用的启动子,也可以是以植物细胞为宿主的表达用的启动子,还可以是以昆虫细胞为宿主的表达用的启动子。作为以动物细胞为宿主的表达用的启动子,例如可举出ef1α启动子、srα启动子、sv40启动子、ltr启动子、cmv(巨细胞病毒)启动子、hsv
‑
tk启动子、cag启动子等。作为以植物细胞为宿主的表达用的启动子,可举出花椰菜花叶病毒(camv)的35s启动子、ref(rubber elongation factor,即橡胶延伸因子)启动子等。作为以昆虫细胞为宿主的表达用的启动子,例如可举出多角体蛋白启动子、p10启动子等。这些启动子可以根据表达上述肽的宿主的种类而适当进行选择。
[0059]
上述表达载体也可以进一步具有多克隆位点、增强子、剪接信号、多聚a添加信号、选择标志、复制起点等。
[0060]
在上述表达载体中,优选在编码上述肽的核酸的上游或下游添加编码绿色荧光蛋白(green fluorescent protein,即gfp)和谷胱甘肽
‑
s
‑
转移酶(gst)等的填充蛋白(stuffer protein)(该蛋白质本身的毒性低,或不发挥固有的功能)的核酸或单独的目的基因。由此,能够更高效地生成上述肽与填充蛋白进行了融合的形式的融合蛋白。此外,在组装进带有细胞外蛋白分泌信号的表达载体的情况下,能够在培养液中生成添加了上述肽的氨基酸序列的形式的融合蛋白并进行回收。此外,在为细胞内表达型载体的情况下,也能够生成同样的添加了肽的融合蛋白。
[0061]
通过使用具有本实施方式的核酸的表达载体和适当的宿主细胞,能够使上述肽表达。
[0062]
<修饰物质>本实施方式的肽也可以是以后述的目的物质之外的修饰物质进行了修饰的形态。作为修饰物质,例如可举出糖链、聚乙二醇(peg)等。此外,作为修饰物质,也可以使用例如脂质体、病毒、树枝状聚合物、抗体(免疫球蛋白)、外泌体、聚合物胶束等。即,本实施方式的肽能够以与脂质体、病毒、外泌体、聚合物胶束的表达结合的形式,或者以在树枝状聚合物的侧链部分结合1个或2个以上的多个上述的肽的形式,或者以抗体(免疫球蛋白)与上述肽结合的形式使用。
[0063]
作为树枝状聚合物,例如可举出聚(酰胺胺)(pamam)树枝状聚合物、聚丙烯亚胺树枝状聚合物、聚酰亚胺树枝状聚合物、聚苯醚树枝状聚合物、聚亚苯基树枝状聚合物等。通过使用这些树枝状聚合物,能够将上述肽数十至一百数十个一次性地递送到caf或癌间质内。
[0064]
此外,本实施方式的肽被上述物质修饰,从而目的物质(例如生理活性物质、标记物质)容易简便且高效地被caf或癌间质内吸收。例如可以通过直接或经由接头将修饰物质和上述肽物理地或化学地结合,从而制备经修饰物质修饰的上述肽(以下有时简称为“修饰肽”)。作为具体的结合方式,例如可以举出配位键、共价键、氢键、疏水相互作用、物理吸附等,可以采用任何公知的键、接头和结合方式。此外,修饰物质的结合位置可以是上述肽的n端或c端中的任一端。此外,在上述肽含有赖氨酸残基的情况下,也可以将修饰物质结合在该赖氨酸残基的侧链部位。
[0065]
<目的物质>作为成为对象的目的物质,可以根据用途适当选择,例如,在用于caf或癌间质的成像的情况下,如后述,可以将标记物质作为目的物质使用。又例如,在用于硬癌的治疗用
途的情况下,如后述,可以将生理活性物质(特别是抗癌剂)作为目的物质使用。本实施方式的肽能够将这些目的物质以单独一种的方式递送,也能够将两种以上组合递送。目的物质可以直接或经由接头而与上述肽物理地或化学地结合。作为具体的结合方式,例如可举出配位键、共价键、氢键、疏水相互作用、物理吸附等,可以采用任何的公知的键、接头和结合方式。此外,目的物质与本实施方式的肽的结合位置可以根据需要适当选择。进而,即使在没有物理地或化学地结合的情况下,利用立体结构而使一方制约另一方的活动从而处于能够共同活动的状态的情形,在本实施方式中也属于被结合了的状态。
[0066]
在目的物质为蛋白质的情况下,包括目的物质和上述肽的融合蛋白可以通过例如如下的方法制备。首先,用含有编码融合蛋白的核酸的表达载体,对宿主进行转化。接着,对该宿主进行培养,使融合蛋白表达。培养基的组分、培养的温度、时间、诱导物质的添加等的条件,可以由本领域技术人员按照公知的方法,以使转化体生长、融合蛋白高效地产生的方式确定。此外,例如,将抗生素抗性基因作为选择标志而组装进表达载体的情况下,通过向培养基加入抗生素,能够对转化体进行选择。接着,通过合适的方法将宿主表达的融合蛋白进行纯化,从而得到融合蛋白。
[0067]
作为宿主,只要是能够使含有编码融合蛋白的核酸的表达载体表达的活细胞,就不作特别限制,例如可举出中国仓鼠卵巢(cho)细胞等的哺乳类细胞系、病毒(例如腺病毒、腺相关病毒、慢病毒、牛痘病毒、杆状病毒、逆转录病毒、肝炎病毒等的病毒等)或细菌(例如大肠杆菌等)等的微生物、酵母细胞、昆虫细胞、植物细胞等活细胞。
[0068]
接下来对含有本实施方式的肽的肽
‑
药物缀合物(pdc)、药物组合物、标记肽以及成像组合物的详细情况进行说明。
[0069]
【肽
‑
药物缀合物(pdc)】本实施方式的pdc含有上述肽和生理活性物质。
[0070]
根据本实施方式的pdc,能够选择性地治疗癌(尤其是硬癌)。
[0071]
在本说明书中,作为“生理活性物质”,只要是对人癌症的治疗有效的,即无特别限定,例如可举出抗癌剂等的药剂、核酸、具有抑制细胞增殖或杀伤细胞的效果的蛋白质、可与癌细胞特异结合的抗体或其抗体片段、适配体等。
[0072]
例如,使接头等中介物质或氨基酸序列作为间隔区而介于中间,使上述抗体或其抗体片段结合于上述肽的n端或c端,或者,使上述肽结合于上述抗体或其抗体片段的fc域的某一个部位或多个部位,由此能够形成抗体
‑
肽复合体。该抗体
‑
肽复合体除了结合至抗体识别的细胞膜表面抗原,同时还能够结合至上述肽识别的细胞膜表面受体,由此,能够增强向目标细胞(在本实施方式中为caf)的递送功能。此外,在上述抗体或其抗体片段为能够对细胞内抗原起反应的单链抗体(scfv;single
‑
chain antibody)的情况下,通过制备在编码scfv的核酸上添加了编码上述肽的序列的表达载体,能够制成具有向目标细胞(本实施方式中为caf)递送的功能的单链抗体。
[0073]
作为“生理活性物质”,优选的是作为抗癌剂的细胞毒性药物或分子靶向药物。相比于被正常细胞或正常组织进行的吸收,上述肽转变为被caf或癌间质高度吸收,因此,当制成以现有的作为抗癌剂而在使用的细胞毒性药物为生理活性物质的pdc的情况下,能够将该细胞毒性药物高效地递送至构成硬癌的癌细胞或癌间质。
[0074]
本实施方式的pdc也可以还含有具有向硬癌的癌细胞或癌组织的高度的聚集性的
肽。通过含有具有向硬癌的癌细胞或癌组织的高度的聚集性的肽,例如在与具有抗癌作用的生理活性物质一起施用的情况下,能够清除构成硬癌的癌细胞和癌间质这两者,得到协同治疗效果。作为具有向硬癌的癌细胞或癌组织的高度的聚集性的肽,例如可以举出具有向胰腺癌细胞或胰腺癌组织的高度的聚集性的肽,即专利文献2中记载的肽等。具有向硬癌的癌细胞或癌组织的高度的聚集性的肽,也可以以上述修饰物质加以修饰。
[0075]
生理活性物质与上述肽优选形成缀合物而结合。此处所谓“缀合物”,是表示两种以上的物质能够同时活动的状态,也包括其物质之间通过共价结合而结合、通过离子结合而静电结合、或者不存在这些结合但通过立体结构而使一方限制另一方的活动从而处于能够共同活动的状态。例如,将生理活性物质封入用上述肽修饰于表面的脂质体、病毒、外泌体、聚合物胶束等之中的情形,也属于形成了“缀合物”。其中,为了抑制在到达其作用部位之前生理活性物质就分离,优选生理活性物质与上述肽的结合由共价结合组成。另外,也可以是,上述具有向硬癌的癌细胞或癌组织的高度的聚集性的肽,其也与生理活性物质、或者与上述肽和生理活性物质形成缀合物。
[0076]
作为生理活性物质与上述肽的共价结合的形成方法,具体而言,例如可举出在具有或导入了
‑
oh、
‑
sh、
‑
co2h、
‑
nh2、
‑
so3h或
‑
po2h等的官能团的上述肽的任意部位,使其直接地或经由接头与生理活性物质进行偶联反应的方法等。更具体而言,例如,把sh基(巯基)导入至肽中,将马来酰亚胺基(maleimide group)导入至生理活性物质中,之后,使肽的sh基与生理活性物质的马来酰亚胺基结合,由此能够使肽与生理活性物质结合。
[0077]
作为接头,只要是能够保持生理活性物质和上述肽的功能,能够与上述肽一起穿透细胞膜的接头,就没有特别限制。作为接头,具体而言,例如可以举出其长度通常为1个残基以上5个残基以下、优选为大约1个残基以上3个残基以下的肽链、同等长度的聚乙二醇(peg)链等。
[0078]
作为构成使用于上述肽与生理活性物质的缀合物的肽接头的氨基酸残基,优选无电荷、小分子的肽接头,例如甘氨酸残基。优选在接头序列的端部、最好是在两端部设置用于对进行结合的两个域(生理活性物质和上述肽)赋予旋转自由度的序列。具体而言,为了赋予旋转自由度,优选含有甘氨酸(g)、作为接头含有脯氨酸(p)的序列,进一步具体而言,由甘氨酸残基和脯氨酸残基组成的序列,例如由甘氨酸(g)
‑
脯氨酸(p)
‑
甘氨酸(g)组成的序列尤其优选。通过这样的构成,两个域的功能都能够发挥。或者,从易于形成共价结合的角度,接头序列的端部优选含有半胱氨酸(c)或赖氨酸(k)。经由半胱氨酸残基的巯基(
‑
sh)或赖氨酸残基的侧链,能够使生理活性物质结合于上述肽。
[0079]
在生理活性物质为蛋白质的情况下,将该生理活性物质与上述肽制成为缀合物时,也可以制成融合蛋白的形式。作为赋予上述肽的位置,无特别限定,不过优选上述肽被呈递于蛋白质的外侧,且对融合后的蛋白质的活性、功能的影响低的方式,优选在作为生理活性物质的蛋白质的n端或c端融合。融合的蛋白质的种类不作特别限定,不过分子量过于大的药物会妨碍通过细胞膜,所以分子量可以取例如大约500,000以下,可以取大约30,000以下。
[0080]
作为生理活性物质而被使用的蛋白质,也可以是抗体。这种抗体可以通过使小鼠等啮齿类动物以来源于癌(尤其是硬癌)的肽等为抗原进行免疫而制得。另外,例如可以通过噬菌体库的筛选而制得。抗体也可以是抗体片段,作为抗体片段,可举出fv、fab、scfv等。
[0081]
作为目前用作生理活性物质的核酸,例如可举出sirna、mirna、antisense、或者代偿它们的功能的人造核酸。
[0082]
所谓目前用作生理活性物质的适配体,是具有对caf或癌间质的特异结合能力的物质。作为适配体,可举出核酸适配体、肽适配体等。对caf或癌间质具有特异结合能力的核酸适配体,例如可以通过指数富集的配体系统进化(systematic evolution of ligand by exponential enrichment,即selex)法等进行选别。此外,具有对caf或癌间质的特异结合能力的肽适配体,例如可以通过使用酵母的双杂交(two
‑
hybrid)法等进行选别。
[0083]
此外,在本实施方式的pdc中,上述肽可以是被如上述的修饰物质修饰了的,还可以进一步具备标记物质。
[0084]
【药物组合物】本实施方式的药物组合物含有上述pdc。
[0085]
根据本实施方式的药物组合物,能够以在浸润性胰腺导管癌、胃低分化腺癌等中大量发育的癌间质为靶标选择性地治疗硬癌。
[0086]
<组成成分>本实施方式的药物组合物含有治疗上为有效量的上述pdc、和药学上可接受的载体(carrier)或稀释剂。药学上可接受的载体或稀释剂,可举出例如赋形剂、增量剂、崩解剂、稳定剂、防腐剂、缓冲剂、乳化剂、芳香剂、着色剂、甜味剂、增稠剂、矫味剂、助溶剂等。通过使用这些载体或稀释剂的一种以上,能够配制出注射剂、液剂、胶囊剂、混悬剂、乳剂或糖浆剂等形态的药物组合物。
[0087]
此外,作为载体,也可以使用胶体分散体系。胶体分散体系可期待提高上述肽或pdc的体内稳定性的效果、提高上述肽或pdc向caf或癌间质转移的能力的效果。作为胶体分散体系,可举出聚乙二醇、高分子复合体、高分子凝聚体、纳米胶囊、微球、珠、水包油类乳化剂、胶束、混合胶束、包含脂质体的脂质,优选具有能够将上述肽或pdc高效地递送至caf或癌间质的效果的脂质体、人工膜小泡。
[0088]
作为本实施方式的药物组合物中的制剂化的例子,可举出根据需要而采用了糖衣的片剂、胶囊剂、酏剂、微囊剂等口服制剂。或者,可以举出以与水或其它的药学上可接受的液体组成的无菌性溶液、或者混悬液剂的注射剂的形式非口服地使用的制剂。进一步地,可举出:与药学上可接受的载体或稀释剂,具体而言,与媒介物(例如无菌水、生理盐水、植物油)、乳化剂、混悬剂、表面活性剂、稳定剂、香味剂、赋形剂、防腐剂、粘结剂等适当地组合,通过普遍允许的制药实施方式中所要求的单位用量形态进行混合从而制剂化的制剂。
[0089]
作为能够混合于片剂或胶囊剂中的载体或稀释剂,例如使用粘结剂、赋形剂、膨松剂、润滑剂、甜味剂、香味剂等。作为粘结剂,可举出明胶、玉米淀粉、黄蓍胶、阿拉伯胶等。作为赋形剂,例如可举出结晶纤维素。作为膨松剂,例如可举出玉米淀粉、明胶、海藻酸等。作为润滑剂,例如可举出硬脂酸镁等。作为甜味剂,例如可举出蔗糖、乳糖、糖精等。作为香味剂,例如可举出薄荷精油、白珠树油、樱桃香精等。分装单位形态为胶囊的情况下,上述材料中还可以含有油脂之类的液态载体。
[0090]
用于注射的无菌组合物,可以使用注射用蒸馏水之类的媒介物按照通常的制剂实
施方式来配制。作为注射用的水溶液媒介物,例如可举出含有生理盐水、葡萄糖和其它的辅助药物的等渗溶液等,也可以与适当的溶解助剂、非离子型表面活性剂等配合使用。作为其它的辅助药物,例如可举出d
‑
山梨醇、d
‑
甘露糖、d
‑
甘露糖醇、氯化钠等。作为溶解助剂,例如可举出醇。作为醇,例如可举出乙醇、多元醇等。作为多元醇,例如可举出丙二醇、聚乙二醇等。作为非离子型表面活性剂,例如可举出聚山梨醇酯80(注册商标)、hc0
‑
50等。
[0091]
作为注射用的非水溶液媒介物,可举出芝麻油、大豆油等,与作为溶解助剂的苯甲酸苄酯、苯甲醇配合使用。此外,注射用的油性液体也可以进一步调配有缓冲剂、镇痛剂、稳定剂、防氧化剂等。作为缓冲剂,例如可举出磷酸盐缓冲液、乙酸钠缓冲液等。作为镇痛剂,例如可举出盐酸普鲁卡因等。作为稳定剂,例如可举出苯甲醇、苯酚等。制备好的注射液通常填充进合适的安瓿中。
[0092]
在为注射剂的情况下,可以制备为上述那样的水性或非水性的溶液剂、混悬剂或乳浊剂。这样的注射剂的无菌化可以通过使用过滤器实施的过滤杀菌、杀菌剂等的配合而进行。注射剂可以制造为使用时配制的形态。即,可以通过冷冻干燥法等制成无菌的固体组合物,在使用前溶解于注射用蒸馏水或其它的媒介物而使用。
[0093]
<施用量>本实施方式的药物组合物,考虑pdc中含有的生理活性物质的种类、被检动物(包括人或非人动物在内的各种哺乳动物、优选为人)的年龄、性别、体重、症状、治疗方法、施用方法、处理时间等而进行适当调整。例如,在通过注射剂将本实施方式的药物组合物进行静脉内(intravenous:i.v.)注射的情况下,对被检动物(优选为人),在一次的施用中,例如每1kg体重可以施用大约0.1mg以上1000mg以下的量的pdc。
[0094]
作为施用形态,例如可举出动脉内注射、静脉内注射、皮下注射、鼻腔内的、腹腔内的、经支气管的、肌内的、经皮的或者经口的在本领域技术人员中公知的方法,优选静脉内注射或腹腔内施用。
[0095]
<治疗方法>在一个实施方式中,本发明提供含有用于癌(尤其是硬癌)的治疗或预防的上述pdc的药物组合物。上述pdc中含有的上述肽能够使药剂聚集于caf或msc,因此对硬癌的效果最受期待,不过也能够适用于含有caf的各种癌。
[0096]
此外,在一个实施方式中,本发明提供含有在治疗上为有效量的上述pdc、以及药学上可接受的载体或稀释剂的药物组合物。
[0097]
此外,在一个实施方式中,本发明提供上述pdc在制造用于治疗或预防癌(尤其是硬癌)的药物组合物中的用途。
[0098]
此外,在一个实施方式中,本发明提供癌(尤其是硬癌)的治疗方法或预防方法,其包括向需要治疗的患者施用有效量的上述pdc。
[0099]
【标记肽】本实施方式的标记肽含有上述肽和标记物质。
[0100]
作为标记物质,例如可举出生物素、链霉亲和素、稳定同位素、放射性同位素、荧光物质、用于正电子发射断层显像(positron emission tomography,即pet)的核素、用于单
光子发射计算机断层显像(single photo emission computed tomography,即spect)的核素、核磁共振成像法(magnetic resonance imaging,即mri)造影剂、计算机断层显像法(computed tomography,即ct)造影剂、磁性体等。此外,在标记物质为蛋白质的情况下,也可以使用编码它们的核酸。其中,优选稳定同位素、放射性同位素或荧光物质。通过具备上述标记物质,能够简便且高灵敏度地确认目的物质是否已被递送至含有caf或msc的癌间质。
[0101]
作为稳定同位素,例如可举出
13
c(碳13)、
15
n(氮15)、2h(氢2)、
17
o(氧17)、
18
o(氧18)等。作为放射性同位素,例如可举出3h(氢3)、
14
c(碳14)、
13
n(氮13)、
18
f(氟18)、
32
p(磷32)、
33
p(磷33)、
35
s(硫35)、
67
cu(铜67)、
99m
tc(锝99m)、
123
i(碘123)、
131
i(碘131)、
133
xe(氙133)、
201
ti(铊201)、
67
ga(镓67)等。在标记物质为稳定同位素或放射性同位素的情况下,也可以使用稳定同位素标记氨基酸或放射性同位素标记氨基酸来制备上述肽。作为用稳定同位素或放射性同位素标记的氨基酸,只要是属于20种氨基酸(丙氨酸、精氨酸、天冬氨酸、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、酪氨酸、缬氨酸、色氨酸、半胱氨酸、天冬酰胺、谷氨酰胺)的、且是包含在上述肽中的氨基酸,就不作特别限定。此外,氨基酸可以是l型也可以是d型,可以根据需要适当选择。
[0102]
在标记物质为稳定同位素或放射性同位素的情况下,也可以使用稳定同位素标记氨基酸或放射性同位素标记氨基酸来制备上述标记肽。即,在本实施方式的标记肽中,“含有上述肽和标记物质”这一表述,包括了由稳定同位素标记氨基酸或放射性同位素标记氨基酸构成的上述肽的形态。
[0103]
作为以稳定同位素或放射性同位素标记的氨基酸,只要是属于20种氨基酸(丙氨酸、精氨酸、天冬氨酸、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、酪氨酸、缬氨酸、色氨酸、半胱氨酸、天冬酰胺、谷氨酰胺)的、且是包含在上述肽中的氨基酸,就不作特别限定。此外,氨基酸可以是l型也可以是d型,可以根据需要适当选择。
[0104]
作为使用稳定同位素标记氨基酸或放射性同位素标记氨基酸的、本实施方式的标记肽的制备方法,可以通过使含有编码上述肽的核酸的载体在存在稳定同位素标记氨基酸或放射性同位素标记氨基酸的体系中表达从而制备。作为存在稳定同位素标记氨基酸或放射性同位素标记氨基酸的体系,例如可举出存在稳定同位素标记氨基酸或放射性同位素标记氨基酸的无细胞肽合成体系、活细胞肽合成体系等。即,通过在无细胞肽合成体系中以稳定同位素标记氨基酸或放射性同位素标记氨基酸、以及没有被稳定同位素标记的氨基酸或没有被放射性同位素标记的氨基酸作为材料来合成肽,或者在活细胞合成体系中,在稳定同位素标记氨基酸或放射性同位素标记氨基酸的存在下,培养用含有编码上述肽的核酸的载体进行了转化的细胞,从而能够从含有编码上述肽的核酸的载体制备以稳定同位素标记或以放射性同位素标记的上述肽。
[0105]
作为使用无细胞肽合成体系的、本实施方式的标记肽的制备方法,可以通过使用含有编码上述肽的核酸的载体和上述稳定同位素标记氨基酸或放射性同位素标记氨基酸,和以稳定同位素标记的或以放射性同位素标记的上述肽的合成所必需的、没有被稳定同位素标记的氨基酸或没有被放射性同位素标记的氨基酸,以及用于无细胞肽合成的细胞提取液、能量源(atp、gtp、磷酸肌酸等含有高能磷酸键的物质)等来实施。温度、时间等反应条件
可以根据需要选择最适宜的条件,例如温度可以选为20摄氏度以上40摄氏度以下,优选23摄氏度以上37摄氏度以下。此外,反应时间可以选为1小时以上24小时以下,优选10小时以上20小时以下。
[0106]
在本说明书中,“用于无细胞肽合成的细胞提取液”是指来源于植物细胞、动物细胞、真菌细胞、细菌细胞的提取液,其含有核糖体、trna等参与蛋白质合成的翻译系统、或者转录系统和翻译系统所需的成分。具体可举出:大肠杆菌、小麦胚芽、兔网织红细胞、小鼠l细胞、艾氏腹水癌细胞、hela细胞、cho细胞、出芽酵母等的细胞提取液。这些细胞提取液的制备,例如可以按照pratt,j.m.et al.,transcription and translation
‑
apractical approach(1984),pp.179
‑
209中记载的方法,用弗氏压碎器、玻璃微珠、超声波破碎装置等进行破碎处理,加入含有用于使蛋白质成分和核糖体变得可溶的数种盐的缓冲液进行均质化,通过离心分离使不溶成分沉淀,从而制得。
[0107]
此外,使用无细胞肽合成体系而得到的以稳定同位素标记的或以放射性同位素标记的上述肽的表达,例如可以适当使用具备小麦胚芽提取液的premium expression试剂盒(cellfree sciences co.,ltd.公司制造)、具备大肠杆菌提取液的rts 100、e.coli hy试剂盒(roche applied science公司制造)、无细胞quick(大阳日酸公司制造)等市售的试剂盒来进行。所表达的以稳定同位素标记的或以放射性同位素标记的上述肽为不溶性肽的情况下,可利用盐酸胍、尿素等蛋白质变性剂适当地使之可溶。以稳定同位素标记的或以放射性同位素标记的上述肽,进一步地可以通过利用基于差速离心法、蔗糖密度梯度离心法等的分级处理、亲和柱、离子交换色谱等实施的纯化处理而制备。
[0108]
作为使用活细胞肽合成体系而得到的、本实施方式的标记肽的制备方法,可以通过如下方式实施:将含有编码上述肽的核酸导入活细胞中,对于这样的活细胞,在含有营养成分和抗生素等、上述稳定同位素标记氨基酸或放射性同位素标记氨基酸、稳定同位素标记肽或放射性同位素标记肽的合成所需的没有被稳定同位素标记的氨基酸或没有被放射性同位素标记的氨基酸等的培养液中培养。其中,作为活细胞,只要是能够使含有编码上述肽的核酸的载体表达的活细胞,就没有特别限定,例如可举出中国仓鼠卵巢(cho)细胞等哺乳类细胞株、大肠杆菌、酵母细胞、昆虫细胞、植物细胞等活细胞,如果从简便性和性价比方面考虑,则优选大肠杆菌。含有编码上述肽的核酸的载体的表达可以通过如下方式实现:以基因重组技术,组装被设计为能够在各个活细胞中进行表达的表达载体,将这样的表达载体导入活细胞。此外,含有编码上述肽的核酸的载体,可以以适合于所使用的活细胞的方法导入到活细胞,例如可举出电穿孔法、热激法、磷酸钙法、脂质体转染法、deae葡聚糖法、显微注射法、粒子枪、使用病毒的方法,以及使用fugene(注册商标)6transfection reagent(roche holding ag公司制造)、lipofectamine 2000reagent(invitrogen corporation公司制造)、lipofectamine ltx reagent(invitrogen corporation公司制造)、lipofectamine 3000reagent(invitrogen corporation公司制造)等市售的转染试剂的方法等。
[0109]
通过活细胞合成体系而使之表达的以稳定同位素标记或以放射性同位素标记的上述肽,可以通过对含有以稳定同位素标记或以放射性同位素标记的上述肽的活细胞进行破碎处理、提取处理而制得。作为破碎处理,例如可举出使用冻融法、弗氏压碎器、玻璃微珠、匀浆器、超声波破碎装置等的物理性破碎处理等。另外,作为提取处理,例如可举出使用
盐酸胍、尿素等蛋白质变性剂进行的提取处理等。以稳定同位素标记或以放射性同位素标记的上述肽,可以进一步通过利用基于差速离心法、蔗糖密度梯度离心法等进行的分级处理、亲和柱、离子交换色谱等实施的纯化处理而制备。
[0110]
作为荧光物质,例如可举出公知的量子点、吲哚菁绿、5
‑
氨基乙酰丙酸(5
‑
ala,代谢产物原卟啉ix<pp ix>)、近红外荧光染料(near
‑
infrared<nir>dyes)(例如cy505、cy7、alexafluoro等)、其他的公知荧光染料(例如gfp、fitc<fluorescein>、fam、tamra等)等。在荧光物质为蛋白质的情况下,不使用稳定同位素标记氨基酸或放射性同位素标记氨基酸,通过以上述无细胞肽合成体系或活细胞肽合成体系来制备含有编码荧光物质的核酸和编码上述肽的核酸的载体,即可制得以荧光物质标记的肽。
[0111]
作为pet用的核素、spect用的核素,优选地,例如可举出
11
c(碳11)、
13
n(氮13)、
15
o(氧15)、
18
f(氟18)、
66
ga(镓66)、
67
ga(镓67)、
68
ga(镓68)、
60
cu(铜60)、
61
cu(铜61)、
62
cu(铜62)、
67
cu(铜67)、
64
cu(铜64)、
48
v(钒48)、tc
‑
99m(锝99m)、
241
am(镅241)、
55
co(钴55)、
57
co(钴57)、
153
gd(钆153)、
111
in(铟111)、
133
ba(钡133)、
82
rb(铷82)、
139
ce(铈139)、te
‑
123m(碲123m)、
137
cs(铯137)、
86
y(钇86)、
90
y(钇90)、
185/187
re(铼185/187)、
186/188
re(铼186/188)、
125
i(碘125)、或者它们的络合物、或它们的组合等。以pet用的核素或spect用的核素标记的上述肽,通过在上述无细胞肽合成体系或上述活细胞肽合成体系中制备含有编码上述肽的核酸的载体即可制得。
[0112]
作为mri造影剂、ct造影剂和磁性体,例如可举出钆、gd
‑
dtpa、gd
‑
dtpa
‑
bma、gd
‑
hp
‑
do3a、碘、铁、氧化铁、铬、或者它们的络合物或其螯合物等。关于mri造影剂、ct造影剂或磁性体标记的上述肽,使mri造影剂、ct造影剂或磁性体与上述肽之间直接或经由接头而物理地或化学地结合而制备即可。作为具体的结合方式,例如可以举出配位键、共价键、氢键、疏水相互作用、物理吸附等,可以采用任何公知的键、接头和结合方式。
[0113]
<用于对癌间质进行成像的方法>本实施方式的方法为用于对含有caf或msc的癌间质进行成像的方法,是使用上述标记肽而实施的方法。
[0114]
此外,本实施方式的成像组合物含有上述标记肽。即,本实施方式的成像组合物能够作为含有caf或msc的癌间质的成像剂使用。
[0115]
根据本实施方式的方法和成像组合物,能够简便、高灵敏度且选择性地检测含有caf或msc的癌间质。
[0116]
<组成成分>本实施方式的成像组合物,除含有上述标记肽外,根据需要,可以还含有药学上可接受的载体或稀释剂。作为药学上可接受的载体或稀释剂,可举出上述药物组合物中举例的成分中通常用于成像组合物的公知的成分。
[0117]
本实施方式的方法和成像组合物,除使用上述标记肽外,也可以还配合使用具有向以硬癌为主的多种癌的癌细胞或癌组织的高度的聚集性的肽。通过配合使用具有向以硬癌为主的多种癌的癌细胞或癌组织的高度的聚集性的肽,例如能够一次性对构成硬癌的癌细胞和癌间质这两者进行成像。具有向以硬癌为主的多种癌的癌细胞或癌组织的高度的聚集性的肽,也可以是经修饰物质修饰过的。在具有向以硬癌为主的多种癌的癌细胞或癌组织的高度的聚集性的肽具备标记物质的情况下,该标记物质优选是与具有向caf的高度的
聚集性的肽的标记物质为互不相同的种类的标记物质。通过使用不同种类的标记物质,能够区分癌细胞和caf而同时进行成像。
[0118]
例如,在将上述标记肽添加于caf的情况下,上述标记肽的添加量优选为培养液中1μm以上10μm以下。此外,添加后,在15分钟以上3小时以下之后,评价是否有吸收和聚集于caf内。
[0119]
此外,在例如通过注射剂将具备荧光物质作为标记物质的上述标记肽进行静脉内(intravenous,即i.v.)注射的情况下,对被检动物(优选为人),在一次的施用中,例如每1kg体重可以施用大约0.1mg以上1000mg以下的量的标记肽,优选施用3mg以上1000mg以下的量的标记肽,更优选施用3mg以上20mg以下的量的标记肽,进一步优选施用5mg以上15mg以下的量的标记肽。
[0120]
此外,在例如通过注射剂将具备稳定同位素、pet用的核素或spect用的核素作为标记物质的上述标记肽进行静脉内(intravenous,即i.v.)注射的情况下,根据与所使用的稳定同位素、pet用的核素或spect用的核素的种类相应的放射线量确定施用量即可。
[0121]
在本实施方式的方法中,作为上述标记肽的检测方法,例如可举出pet、spect、ct、mri、内窥镜进行的检测、用荧光检测器进行的检测等。
[0122]
本实施方式的方法和成像组合物,能够用于硬癌或伴随硬癌而发生的疾病的诊断、病理分析、治疗或治疗效果诊断。实施例
[0123]
以下通过实施例对本发明进行说明,本发明不限于以下的实施例。
[0124]
(实施例1)(具有对人间充质干细胞的穿透性的肽的鉴定)使用自行制备、经由嘌呤霉素连接的作为表型的9氨基酸残基肽、和具有作为与之对应的基因型的mrna编码序列的蛋白质
‑
rna嵌合型随机肽库(in vitro virus library,即ivvl,体外病毒库),依据公知的ivv(in vitro virus,体外病毒)法,以人间充质干细胞(human mesenchymal stem cells,即hmsc)为吸收靶细胞,在培养体系中反复进行使其反应的循环,分离出81种对间充质干细胞具有穿透性的肽(mesenchymal stem cell penetrating peptide,即mscpp)。
[0125]
然后,制备所分离出的81种的各mscpp与egfp(激发波长:488nm,荧光波长:509nm)构成的融合肽(在融合肽c端具有由6个组氨酸残基组成的his标签)(mscpp
‑
egfp
his
)。就各mscpp
‑
egfp
his
对hmsc的穿透性进行评价。作为hmsc,使用已成为hmsc细胞系的ue6e7t
‑
3细胞。培养基使用的是含有10%fbs的rpmi1640培养基。将ue6e7t
‑
3细胞接种于96孔板中,添加含有各mscpp
‑
egfp
his
的培养基(每孔添加5μl的融合肽溶液/50μl的培养液),培养4小时。用荧光显微镜观察培养后的细胞。代表性的结果示于图1。在图1中,“egfp
his”是没有与mscpp肽融合的,在c端具有由6个组氨酸残基组成的his标签的egfp。“poly
‑
r9”(9个残基连续的d
‑
精氨酸)是目前通用的非选择性穿膜肽。
[0126]
表1名称序列(5'
→
3')seq id no:poly
‑
r9rrrrrrrrr12mscpp13rarvawdwi13
mscpp22wtrtqwplh14mscpp33wpplqrwrn2mscpp48rthpvwsrt3mscpp49rrwmqwpwh4mscpp106kcaelfrhl1
[0127]
由图1,确认到mscpp33、48、49和106这4种肽对来源于人骨髓的间充质干细胞(hmsc)的穿透性。在mscpp106中,观察到特别强的荧光。
[0128]
(实施例2)在实施例1中鉴定出的肽中,对于mscpp33、48、49和106这4种肽,以及作为阳性对照的poly
‑
r9、作为阴性对照的mscpp22,用fitc(fluorescein isothiocyanate,即异硫氰酸荧光素)(激发波长:495nm,荧光波长520nm)标记进行合成,并进行盐酸盐处理。这些均通过委托sigma
‑
aldrich japan(genosis事业部)合成而获得。以20%dmso来溶解mscpp33。mscpp48由于冻融后会产生沉淀,因此在使用前进行了超声处理。将mscpp49、mscpp106溶解于水中而使用。
[0129]
然后,确认各肽对作为来源于hmsc、正常人皮肤成纤维细胞(normal human dermal fibroblasts,即nhdf)和人胰腺癌的细胞系的bxpc3细胞的穿透性。hmsc使用的是以4
×
104个细胞/孔接种在24孔板中,并以msc培养基预先培养了24小时后的hmsc。nhdf和bxpc3细胞使用的是以4
×
104个细胞/孔接种在24孔板中,并以含有10%fbs的rpmi1640培养基预先培养了24小时后的nhdf和bxpc3细胞。将含有4μm的各肽的培养基(含有10%fbs的rpmi1640培养基)添加到各细胞,培养4小时。用hoechst33342(激发波长:352nm,荧光波长:461nm)对培养后的各细胞进行核染色,用相差显微镜、荧光显微镜观察。结果示于图2。图2中,左侧所示图像为fitc荧光图像,右侧所示图像为使荧光图像和相差显微镜图像叠合后的图像。
[0130]
由图2,mscpp33、48、49和106这4种中,确认到被hmsc高度吸收的特性和稳定的选择性吸收。与实施例1同样地,作为同时具备以下3点性质——即被hmsc高效吸收、且被胰腺癌细胞bxpc3低吸收、并且被nhdf吸收的特性低于被hmsc吸收的特性——的最适合的肽,可举出mscpp106。因此,在之后的试验中,使用mscpp106。
[0131]
(实施例3)(mscpp106被caf吸收的特性)使用在实施例2中制备的fitc
‑
mscpp106,在胰腺癌细胞和msc的共培养体系中确认caf对其的吸收。具体地,分别以4
×
104个细胞/孔将bxpc3细胞、hmsc(表达dsred2的细胞系)接种在24孔板中,自接种起4小时后,将培养基更换为含有10%fbs的rpmi培养基,培养60小时。bxpc3和hmsc的共培养物以各细胞1:1的比例、合计细胞数为4
×
104个细胞/孔(各细胞分别为2
×
104个细胞/孔)接种在24孔板中,自接种起4小时后,将培养基更换为含有10%fbs的rpmi培养基,培养60小时。对于hmsc,以4
×
104细胞/孔接种在24孔板中,自接种起4小时后,将培养基更换为msc培养基,培养60小时。培养后,将含有4μm的fitc
‑
mscpp106的培养基(含有10%fbs的rpmi1640培养基)添加至各细胞,培养4小时。用hoechst33342(激发波长:352nm,荧光波长:461nm)对培养后的各细胞进行核染色,用相差显微镜、荧光显微镜观察。结果示于图3。图3中,“叠合”(merge)是使fitc的荧光图像与dsred2的荧光图像叠
合后的图像,“相”(phase)是相差显微镜图像。在接下来的试验中,“相”(phase)同样是表示相差显微镜图像。
[0132]
由图3,fitc
‑
mscpp106对用含有10%fbs的rpmi1640培养基培养的hmsc和用msc培养基培养的hmsc均显示出被吸收的特性。进而,在bxpc3细胞和hmsc的混合培养物中,hmsc变化为细长的成纤维细胞的形状,提示了已经分化为caf的可能性。实验验明了fitic
‑
mscpp106在该bxpc3细胞和hmsc的混合培养物中也选择性地仅被hmsc吸收。此外,hmsc在与胰腺癌细胞共培养约48小时后,强表达作为caf的选择性细胞标志fapα(fibroblast activating proteinα,即成纤维细胞活化蛋白α),其在胎牛血清的存在下的培养中发生分化,确认到caf的免疫表型的表达(未图示)。
[0133]
(实施例4)(mscpp106的血浆降解抗性)对以下表2所示的mscpp106的单肽(single peptide)、串联肽(tandem peptide)和串联突变肽(tandem mutated peptide),评估其对人血浆的降解抗性。在表2中,“tandem mscpp106”(即:mscpp10 6串联肽)是由以甘氨酸残基为间隔区、mscpp106的氨基酸重复2次而成的序列组成的肽。“tandem mut mscpp106”(即:mscpp106串联突变肽)是由tandem mscpp106的氨基酸序列中半胱氨酸残基被甲基化(mc)后的序列组成的肽。
[0134]
表2名称序列(5'
→
3')seq id no:single mscpp106kcaelfrhl1tandem mscpp106kcaelfrhl
‑
g
‑
kcaelfrhl5tandem mut mscpp106kmcaelfrhl
‑
g
‑
kmcaelfrhl6
[0135]
将上述各种肽添加至50质量%的浓度的人血浆,按降解试验刚开始时(0分钟后)、5分钟后、10分钟后、20分钟后、30分钟后、60分钟后和120分钟后,在不同时间进行采样,通过maldi
‑
tofms(matrix assisted laser desorption/ionization
‑
time of flight mass spectrometry,即:基质辅助激光解吸电离飞行时间质谱)法对试样进行分析。计算出自试验开始起各取样时间点的未降解而被维持的肽的质量相对于试验开始时的肽的质量(100%)的比例,将其图表化(参考图4)。
[0136]
由图4确认到,与single mscpp106相比,tandem mscpp106和tandem mut mscpp106具有优异的降解抗性。根据该结果,在接下来的试验中使用tandem mscpp106。
[0137]
(实施例5)(在体外系统中[fam]
‑
tandem mscpp106被hmsc吸收的特性)向胰腺癌细胞和hmsc的共培养物添加tandem mscpp106,评估其被hmsc吸收的特性。作为tandem mscpp106,使用以羧基荧光素(carboxyfluorescein,即fam)对n端进行了标记的tandem mscpp106([fam]
‑
tandem mscpp106)。作为胰腺癌细胞,使用bxpc3细胞和作为人胰腺导管腺癌细胞系的capan
‑
2细胞。作为hmsc,使用表达dsred2的细胞系。具体而言,将各胰腺癌细胞和hmsc以1:1的比例、4
×
104个细胞/孔(各细胞分别为2
×
104个细胞/孔)接种在24孔板中,自接种起4小时后,将培养基更换为含有10%fbs的rpmi培养基,培养60小时。培养后,将含有4μm的[fam]
‑
tandem mscpp106的培养基(含有10%fbs的rpmi培养基)添
加至各共培养物,培养4小时。用hoechst33342(激发波长:352nm,荧光波长:461nm)对培养后的各细胞进行核染色,用相差显微镜、荧光显微镜(倍率:40倍)观察。结果示于图5a(bxpc3细胞和hmsc的共培养物)和图5b(capan
‑
2细胞和hmsc的共培养物)。在图5a和图5b中,“叠合”(merge)是使fam的荧光图像与dsred2的荧光图像叠合后的图像。
[0138]
由图5a和图5b,确认到[fam]
‑
tandem mscpp106在各胰腺癌细胞和hmsc的共培养物中没有被胰腺癌细胞吸收,选择性地仅被hmsc吸收。
[0139]
(实施例6)([fam]
‑
tandem mscpp106的细胞内定位)然后,确认[fam]
‑
tandem mscpp106的细胞内定位。具体而言,将hmsc以4
×
104个细胞/孔接种在24孔板中,自接种起4小时后,将培养基更换为含有10%fbs的rpmi1640培养基,培养60小时。培养后,将含有4μm的[fam]
‑
tandem mscpp106的培养基(含有10%fbs的rpmi1640培养基)添加至hmsc,培养24小时。培养后,用hoechst33342(激发波长:352nm,荧光波长:461nm)进行核染色,进一步地,用lysotracker red dnd
‑
99(“lysotracker”是注册商标)(溶酶体内容物标志,激发波长:555nm,荧光波长:584nm)将溶酶体染色,用相差显微镜、荧光显微镜(倍率:60倍)观察。结果示于图6。在图6中,“叠合”(merge)是使fam的荧光图像与lysotracker red dnd
‑
99(“lysotracker”是注册商标)的荧光图像叠合后的图像。
[0140]
由图6确认到,在施用后经24小时,tandem mscpp106的大部分主要位于细胞内的溶酶体内。进而,根据位于溶酶体内的肽的荧光以得到充分维持的状态被检测出的这一事实,显示了具有至少在24小时内对抗细胞内消化(degradation)的显著抗性。
[0141]
(实施例7)([fam]
‑
tandem mscpp106在体内系统中的选择性吸收特性)对作为硬癌的胰腺癌模型小鼠施用[fam]
‑
tandem mscpp106,确认小鼠的各种组织中的对[fam]
‑
tandem mscpp106的选择性吸收。作为具有形成丰富的癌间质的硬癌的硬性胰腺癌模型小鼠,按照参考文献1(saito k et al.,“stromal mesenchymal stem cells facilitate pancreatic cancer progression by regulating specific secretory molecules through mutual cellular interaction.”,journal of cancer,vol.9,no.16,p2916
‑
2929,2018.)中记载的方法准备。具体而言,在无病原体条件下对6周龄的nod/scid(clea japan inc,japan)进行饲养。将bxpc3细胞(1
×
105个细胞)与hmsc(1
×
105个细胞)的混合细胞分别注射到小鼠的皮下和小鼠腹腔内。自细胞注射起饲养6周,从而得到具有模仿人胰腺癌患者组织的丰富癌间质的硬性胰腺癌模型小鼠(参考图7a)。
[0142]
对所得到的硬癌模型小鼠静脉注射[fam]
‑
tandem mscpp106(200μg)。然后,通过施用了肽的小鼠的新鲜解剖标本进行组织分析,分析静脉注射起30分钟后的肽的体内动态。结果示于图7b~图7c。图7b是从硬癌模型小鼠摘出的各组织和肿瘤组织的明视野图像(左)和荧光图像(右)。在图7b中,“adb瘤”是腹腔肿瘤(abdominal tumor)的简写,是形成在腹腔内的肿瘤。“sc瘤”是皮下肿瘤(subcutaneous tumor)的简写。“肝转移”(liver meta)是肝转移瘤(liver metastatic tumor)的简写,是转移至肝脏的肿瘤。“肠系膜淋巴结转移”(mesenteric ln meta)是肠系膜淋巴结转移瘤(mesenteric lymph nodes metastatic tumor)的简写,是转移至肠系膜淋巴结的肿瘤。图7c是各肿瘤组织的苏木精
‑
伊红(he)染色图像、明视野图像和荧光图像。在图7c中,皮下肿瘤1和皮下肿瘤2为从同一解剖标本摘出的
肿瘤。
[0143]
由图7b~图7c,观察到[fam]
‑
tandem mscpp106被肿瘤组织内发育的癌间质(纤维性间质)部分强吸收。
[0144]
(实施例8)(在体内系统中[fam]
‑
tandem mscpp106被caf吸收的特性)然后,确认[fam]
‑
tandem mscpp106选择性地被癌间质的caf吸收。用与实施例7同样的方法,得到硬癌模型小鼠。然后,对得到的硬癌模型小鼠静脉注射[fam]
‑
tandem mscpp106(300μg)。然后,通过施用了肽的小鼠的新鲜解剖标本进行组织分析,分析静脉注射起30分钟后的肽的体内动态。结果示于图8a~图8c。图8a是皮下肿瘤的he染色图像(倍率:2倍、10倍、20倍和40倍)。图8b是皮下肿瘤使用抗人成纤维细胞活化蛋白α(fibroblast activation protein
‑
α,即fapα)抗体和抗人平滑肌肌动蛋白α(smooth muscle actin
‑
α,即smaα)抗体后的荧光免疫染色图像。在图8b中,“叠合”(merge)是指使使用了抗fapα抗体的荧光免疫染色图像与使用了抗smaα抗体的荧光免疫染色图像叠合后的图像。fapα和smaα作为caf阳性标志是已知的。此外,在下半部分的各个放大图像的中央位置存在的核高密度地聚集的块,是由癌细胞本身构成的癌细胞巢部分,癌间质是包围该癌细胞巢而在周围发育的成纤维细胞群的增殖带。图8c是皮下肿瘤的相差显微镜图像和荧光图像。上部两排是倍率为20倍的图像,下部两排是倍率为40倍的图像。“叠合”(merge)是指使各相差显微镜图像与各荧光图像叠合后的图像。
[0145]
由图8a,在组织学上确认到皮下肿瘤是含有丰富的癌间质的硬性的癌(硬癌)。由图8b确认到存在于癌间质的细胞是caf。由图8c确认到,来源于所施用的肽的荧光仅在处于癌细胞巢之间而发育的纤维性间质部分有发现,tandem mscpp106具有选择性地被癌间质的caf吸收的能力。
[0146]
(实施例9)(在体内系统中[fam]
‑
tandem mscpp106和[fam]
‑
tandem mut mscpp106被癌间质吸收的特性)接下来,为了验证mscpp106肽序列内半胱氨酸(位于n端起第2位)所具备的功能上的重要性,对[fam]
‑
tandem mscpp106和[fam]
‑
tandem mut mscpp106(n端以fam标记了的tandem mut mscpp106。以n端侧第2位的半胱氨酸的侧链
‑
sh基被甲基化了的突变体为构成序列)被癌间质吸收的能力进行比较。除了使用持续表达dsred2的克隆hmsc细胞这一点外,使用与实施例7同样的方法,得到硬胰腺癌模型小鼠。然后,对所得到的硬胰腺癌模型小鼠静脉注射[fam]
‑
tandem mscpp106或[fam]
‑
tandem mut mscpp106(各300μg)。然后,通过施用了肽的小鼠的新鲜解剖标本进行组织分析,分析静脉注射起60分钟后的肽的体内动态。结果示于图9a~图9e。图9a是作为施用模型的皮下移植瘤的he染色图像(倍率为2倍、10倍、20倍和40倍)。图9b是施用了[fam]
‑
tandem mscpp106或[fam]
‑
tandem mut mscpp106的小鼠的皮下肿瘤的荧光图像(倍率为4倍)。
[0147]
图9c是施用了tandem mscpp106的小鼠的皮下移植瘤的荧光图像(倍率为4倍、20倍和40倍)。在图9c中,左侧列是来源于与胰腺癌细胞bxpc3混合移植的hmsc的荧光(dsred2)的荧光图像,中间列是来源于静脉施用的肽(tdmscpp106)的荧光(fam)的荧光图像,右侧列是使dsred2的荧光图像与fam的荧光图像叠合后的图像(叠合图像)。图9c中,“ca”是癌(cancer)的简写,表示胰腺癌细胞巢部分。caf从聚集于癌间质的hmsc的边缘部分发育、增生。
[0148]
图9d是皮下肿瘤的使用抗人cd73抗体后的荧光免疫染色图像。当前,在癌的治疗研究领域,靶向癌间质的抗人cd73抗体药物的开发正在世界范围内推进。在图9d中,“ca”是癌的简写,表示癌细胞巢部分。“str.”是间质(stroma)的简写,表示癌间质。cd73是hmsc和caf的阳性标志(在msc、caf的一部分的细胞群中表达),作为用于检测癌组织中的间质处存在的caf的细胞标记而被普遍使用。
[0149]
图9e是小鼠移植模型皮下肿瘤的使用抗人pd
‑
l1抗体、抗人pd
‑
l2抗体和抗人smaα抗体后的荧光免疫染色图像(倍率为40倍和60倍)。在图9e中,“叠合”(merge)是使左侧的图像(使用抗人pd
‑
l1抗体或抗人pd
‑
l2抗体后的荧光免疫染色图像)与中间的图像(使用抗人smaα抗体后的荧光免疫染色图像)叠合后的图像。
[0150]
由图9a确认到,小鼠的皮下肿瘤呈现出间质细胞丰富、来源于bxpc3细胞的细胞成岛状地存在的组织形态。
[0151]
由图9b确认到,tandem mscpp106具有比tandem mut mscpp106更优异的被癌间质吸收的能力。因此,可认为,作为半胱氨酸的侧链的sh基有助于肽的环状化或聚合,大大增强肽被癌间质吸收的效率,提示了肽序列中的半胱氨酸残基的重要性。
[0152]
由图9c确认到,癌间质包括从施用的hmsc分化诱导出的来源于人细胞的caf(hcaf)、和从小鼠体内的msc分化诱导出的caf这两种,tandem mscpp106对于其中任一种caf而言都具有优异的被吸收的能力。此外,从图9d所示的抗人cd73特异抗体的染色图像也确认到,该小鼠移植肿瘤模型中的癌间质,是以从hmsc分化诱导出的hcaf作为混合存在的构成成分的。对图9c和图9d进行比较的结果是,tandem mscpp106显示了大幅超过抗cd73抗体的反应范围的被间质吸收的特性,预测在以癌间质为对象的情况下,tandem mscpp106具有大大优于抗cd73抗体的全面的靶向性能。
[0153]
由图9e确认到,在施用了bxpc3细胞和hmsc的小鼠的皮下胰腺癌模型肿瘤中,与人浸润性胰腺导管癌的胰腺癌组织的癌间质同样地,在一部分caf中显著表达pd
‑
l1和pd
‑
l2。即,发现不仅胰腺癌细胞本身,胰腺癌间质也是使用回避来自重要的活体防御机制即淋巴细胞类免疫细胞的攻击的机制的免疫抗性组织。如前面所述,胰腺癌组织在组织学上由癌细胞组成的浸润性细胞巢、和包围这种细胞巢而发育变厚的间质构成,若能驱除该具备多样的抗性的间质,则肿瘤将被削弱或瓦解。因此,构建以癌间质为靶标的手段,是驱除癌的非常重要的手段。故而,通过对硬癌模型小鼠施用使抗癌剂与tandem mscpp106等具有能被癌间质吸收的能力的肽结合而成的组合物,可期待实现基于广泛扫除caf的抗癌治疗的开发。进一步地,通过配合使用纳武单抗、派姆单抗等免疫检查点抑制剂,可期待更加巩固的对癌间质的驱除效果、以及同时驱除癌细胞与癌间质这两者而得到的协同的抗肿瘤效果的可能性。
[0154]
(实施例10)
(在体内系统中[fam]
‑
tandem mscpp106被硬性胃癌的癌间质吸收的特性)作为典型的硬癌的胃低分化硬腺癌,以肉眼分类被分类为4型胃癌,4型胃癌的5年生存率为大约4%以上16%以下,属于极度预后不良。所以,为了验证[fam]
‑
tandem mscpp106对在除胰腺癌以外的硬癌间质中发育的caf的适用性,制备了硬性胃癌小鼠移植模型,评价了被除胰腺癌以外的硬癌间质吸收的能力。除了使用作为人胃低分化腺癌的hsc58细胞代替bxpc3细胞、自注射细胞起饲养40日这两点之外,使用与实施例7同样的方法,得到硬性胃癌小鼠模型。hsc58细胞是低转移性人硬性胃癌细胞系。对得到的硬癌小鼠模型静脉注射[fam]
‑
tandem mscpp106(300μg),然后,通过施用了肽的小鼠新鲜解剖标本进行组织分析,分析对静脉注射起60分钟后的肽的体内吸收动态。结果示于图10a~图10b。图10a是腹腔肿瘤的he染色图像(倍率为10倍、20倍和40倍)。图10b是腹腔肿瘤的荧光图像(倍率为2倍、10倍和40倍)。左侧列的图像是来源于施用的肽的fam的荧光图像,中间列的图像是来源于混合移植的hmsc的dsred2的荧光图像,右侧列的图像是使fam的荧光图像与dsred2的荧光图像叠合后的图像(叠合图像)。
[0155]
由图10a确认到,腹腔移植肿瘤是在癌细胞巢之间含有丰富的间质的硬性的癌(硬癌),模仿了人的硬性胃癌组织。
[0156]
由图10b确认到,与胰腺癌的癌间质的情况下同样地,[fam]
‑
tandem mscpp106显示出也被胃硬癌的癌间质选择性地且高度地吸收。工业实用性
[0157]
根据本实施方式的肽,能够提供聚集于caf的一种新的肽。本实施方式的载体含有上述肽,能够将目的物质简便且高效地递送到含有caf或msc的癌间质。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。