抗pd
‑
l1双抗体及其用途
1.以ascii文本文件提交的序列表
2.以ascii文本文件后续提交的内容通过引用以其整体并入本文:序列表的计算机可读形式(crf)(文件名:792572000540seqlist.txt,记录日期:2018年12月25日,大小:35kb)。
发明领域
3.本发明涉及双抗体、成像剂和成像pd
‑
l1的方法以及治疗疾病或病况的方法。
4.发明背景
5.程序性死亡(pd)网络涉及至少五个相互作用的分子:pd
‑
1(程序性细胞死亡1)、两个pd
‑
1配体(pd
‑
l1和pd
‑
l2)以及pd
‑
l1的两个抑制性受体(pd
‑
1和cd80)。pd通路在调节在对感染的炎症反应中在外周组织中t细胞的活性方面和限制自身免疫方面的关键功能,似乎被肿瘤细胞和慢性病毒感染期间的病毒所劫持。pd
‑
l1在多种组织起源的许多新分离的人肿瘤中过表达(dong等nature medicine 2002;8:793
‑
800;romano等journal for immunotherapy of cancer 2015;3:15;hirano等cancer research 2005;65:1089
‑
1096)。pd
‑
l1的过表达与某些类型的人类癌症的进展和不良预后相关(wang等european journal of surgical oncology:the journal of the european society of surgical oncology and the british association of surgical oncology2015;41:450
‑
456;cierna等annals of oncology:official journal of the european society for medical oncology/esmo 2016;27:300
‑
305;gandini等critical reviews in oncology/hematology 2016;100:88
‑
98;thierauf等melanoma research 2015;25:503
‑
509;taube等clinical cancer research:an official journal of the american association for cancer research 2014;20:5064
‑
5074)。在慢性病毒感染期间,pd
‑
l1在许多组织中持续表达,而pd
‑
1在病毒特异性ctl中被上调(yao等trends in molecular medicine 2006;12:244
‑
246)。肿瘤
‑
或病毒
‑
诱导的pd
‑
l1可以利用多种机制促进对宿主免疫监视的规避,包括t细胞无能、凋亡、耗竭、il
‑
10产生、dc抑制以及treg诱导和表达(zou等nature reviews immunology 2008;8:467
‑
477)。
6.使用免疫组织化学(ihc)确定的pd
‑
l1表达水平,已被作为pd
‑
1/pd
‑
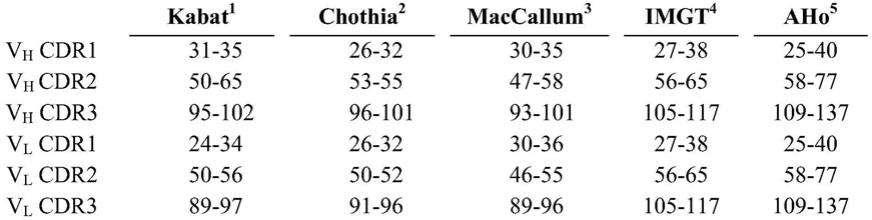
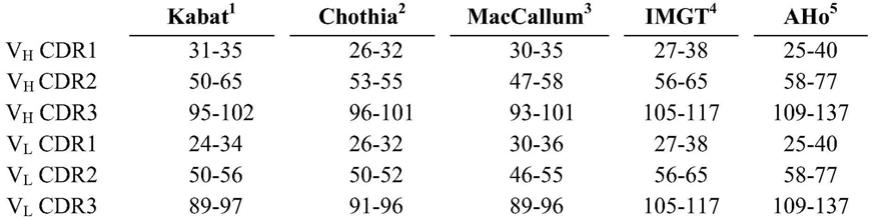
l1定向治疗临床试验中针对多种癌症类型的预测性生物标志物进行评估,所述多种癌症类型包括黑素瘤、肾细胞癌(rcc)、非小细胞肺癌(nsclc)、转移性结直肠癌(mcrc)和转移性去势抵抗性前列腺癌(mcrpc)。由ihc确定的pd
‑
l1水平较高的患者,似乎对pd
‑
1/pd
‑
l1定向治疗的反应更好。但是,pd
‑
l1阴性的黑素瘤患者仍然可以对抗pd
‑
1/pd
‑
l1疗法产生持久的应答,而pd
‑
l1阴性的nsclc患者的应答率却很低。
7.由ihc在人肿瘤样本中检测pd
‑
l1的准确性受多种因素影响。已使用多种用于ihc检测的pd
‑
l1抗体,包括28
‑
8、22c3、5h1,mih1和405.9a11。此外,在该领域正在开发多种专有的伴随诊断方法,如ventanasp142和ventana sp263测定。这些测定的比较性能特征尚不清楚。除了在肿瘤微环境中的异质pd
‑
l1表达的现有问题外,还缺乏在肿瘤样品中由ihc染
色的“阳性”pd
‑
l1的明确定义。根据染色的肿瘤细胞百分比,阳性结果的截止点范围可为>1%至>50%。此外,针对ihc检测抗体,pd
‑
l1具有有限的结合位点,因为它仅包含两个小的亲水区域,这使得经典地用于甲醛固定、石蜡包埋样本(ffpe)的免疫组织化学方法更为低效。由于在pd
‑
l1上缺乏结合位点,相比治疗性pd
‑
l1抗体,ihc抗体通常在结构独特的位点结合pd
‑
l1。
8.此外,pd
‑
l1仅在细胞膜上通过动态ifnγ表达或通过组成性癌基因激活表达时才具有生物学活性。致癌基因驱动的pd
‑
l1表达相比炎症驱动的pd
‑
l1表达,代表组织病理学和生物学上不同的实体。尽管后者集中发生在ifnγ介导的免疫攻击的部位,但癌基因驱动的pd
‑
l1表达是组成性和扩散性的。ifnγ诱导的pd
‑
l1表达代表动态生物标志物,并存在于活动性炎症的部位,以及活检样本代表了在空间和时间上肿瘤免疫微环境的快照。肿瘤代谢微环境中的其他因素(包括缺氧)可导致pd
‑
l1上调,并且依赖于通过hif1a的信号传导。较小的肿瘤活组织切片可能会错过相关的肿瘤
‑
免疫界面,或者活检可以在生物学相关pd
‑
l1过表达已经发生后才进行。pd
‑
l1本身在两个潜在的临床相关的免疫突触—肿瘤/t细胞界面,以及apc/t细胞界面处表达。对于肿瘤/t细胞界面,肿瘤/免疫界面的活检捕获是ihc在黑素瘤中检测pd
‑
l1的关键决定因素。在评估转移性黑素瘤患者的pd
‑
l1表达的研究中,有96%的pd
‑
l1
‑
过表达的黑素瘤有淋巴细胞浸润(til),而其余4%的pd
‑
l1
‑
过表达的黑色素瘤缺乏til,可能代表致癌基因驱动的pd
‑
l1表达。此外,22%的pd
‑
l1阴性样品与til相关,表明了肿瘤免疫干扰的替代机制。
9.大多数pd
‑
l1表达发生在肿瘤界面上,免疫细胞分泌ifnγ,导致了反直觉的假说,即pd
‑
l1的过表达可以是til成功杀死肿瘤的最初保护性反应,它会随时间变为协作性地进入免疫抑制性肿瘤环境。此外,针对pd
‑
l1检测的适合活检的部位选择仍然是个谜。尽管ffpe预处理的原发性肿瘤样品可以是最易获得的,这些样品却可能无法反映当前存在于给定患者中的总体免疫状态,尤其是如果已施用了临时治疗。在活检病变中缺乏pd
‑
l1表达可能无法反映全身免疫学状况,并且可能无法在依赖于pd
‑
l1信号传导的疾病的其他部位获得治疗的有益效果。综上所述,对准确的替代性pd
‑
l1检测试剂和方法的需求仍未得到满足。
10.本文提及的所有出版物、专利、专利申请和已公开专利申请的公开内容,均通过引用以其整体并入本文。
11.发明概述
12.本技术提供了抗pd
‑
l1双抗体、包含标记的抗pd
‑
l1双抗体的成像剂、制备成像剂(包括抗pd
‑
l1双抗体试剂)的方法,以及使用所述成像剂进行成像和诊断的方法。本技术还提供了通过向个体施用所述抗pd
‑
l1双抗体来治疗疾病或病症的方法。
13.本技术的一个方面提供了一种分离的抗pd
‑
l1双抗体,其包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中至多总共包含有约5个氨基酸取代;和b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约5个氨基酸
取代。在一些实施方案中,所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;并且所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。在一些实施方案中,a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成特异性结合pd
‑
l1的结合域。在一些实施方案中,所述第一多肽的v
h
和第二多肽的v
l
,以及第二多肽的v
h
和第一多肽的v
l
,各自形成特异性结合pd
‑
l的结合域。
14.本技术的另一个方面提供了包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),且其中a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成结合域,所述结合域与包含第二重链可变区(v
h
‑2)和第二轻链可变区(v
l
‑2)的抗pd
‑
l1抗体竞争性地特异性结合pd
‑
l1,其中:a)所述v
h
‑2包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;和b)所述v
l
‑2包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。
15.本技术的另一个方面提供了包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含hc
‑
cdr1、hc
‑
cdr2和hc
‑
cdr3,其分别包含具有如seq id no:22
‑
24中任一个所示序列的第二重链可变区(v
h
‑2)中的cdr1、cdr2和cdr3的氨基酸序列;和b)所述v
l
包含lc
‑
cdr1、lc
‑
cdr2和lc
‑
cdr3,其分别包含具有如seq id no:25
‑
27中任一个所示序列的第二轻链可变区(v
l
‑2)中的cdr1、cdr2和cdr3的氨基酸序列。
16.在根据上述任何双抗体的一些实施方案中,所述第一多肽和第二多肽通过共价键连接。在一些实施方案中,所述共价键包含第一多肽的v
h
与第二多肽的v
l
之间的共价键,和/或第一多肽的v
l
和第二多肽的v
h
之间的共价键。在一些实施方案中,所述共价键包含二硫键。在一些实施方案中,所述二硫键或至少两个二硫键中的一个由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸残基。
17.在根据上述任何双抗体的一些实施方案中,所述第一多肽和第二多肽通过两个或多个共价键连接。在一些实施方案中,所述两个或更多个共价键包含:a)第一多肽的v
h
和第二多肽的v
l
之间的第一共价键;b)第一多肽的v
h
和第二多肽的v
l
之间的第二共价键。在一些实施方案中,所述共价键包含二硫键。在一些实施方案中,所述两个或更多个共价键包含至少两个二硫键。在一些实施方案中,所述至少两个二硫键包含:a)第一多肽的v
h
和第二多肽的v
l
之间的第一二硫键;以及b)第一多肽的v
h
和第二多肽的v
l
之间的第二二硫键。在一些实施方案中,所述二硫键或至少两个二硫键中的一个由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸残基。
18.在根据上述任何双抗体的一些实施方案中,所述第一多肽和/或第二多肽中的v
h
包含根据kabat编号系统的g44c突变和/或q105c突变。
19.在根据上述任何双抗体的一些实施方案中,述第一多肽和/或第二多肽中的v
l
包含根据kabat编号系统的q100c突变和/或a43c突变。
20.在根据上述任何双抗体的一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且所述第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。
21.在根据上述任何双抗体的一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含q105c突变,并且其中所述第一多肽和第二多肽中的v
l
各自包含a43突变。
22.在根据上述任何双抗体的一些实施方案中,所述第一多肽的v
h
和v
l
通过肽接头彼此融合。在根据上述任何双抗体的一些实施方案中,所述第二多肽的v
h
和v
l
通过肽接头彼此融合。在一些实施方案中,所述肽接头具有约1
‑
30个氨基酸的长度。在一些实施方案中,所述肽接头含有seq id no:28
‑
34中任一个的氨基酸序列。
23.在根据上述任何双抗体的一些实施方案中,所述第一多肽或第二多肽还包含与所述多肽的n
‑
末端融合的信号肽。在一些实施方案中,所述信号肽含有seq id no:35的氨基酸序列。
24.在根据上述任何双抗体的一些实施方案中,所述第一和/或第二多肽的v
h
包含seq id no:22
‑
24中任一个的氨基酸序列。
25.在根据上述任何双抗体的一些实施方案中,所述第一和/或第二多肽的v
l
含有seq id no:25
‑
27中任一个的氨基酸序列。
26.在根据上述任何双抗体的一些实施方案中,所述第一多肽和/或第二多肽还包含标签。在一些实施方案中,所述标签融合到所述第一多肽和/或第二多肽的c
‑
末端。在一些实施方案中,所述标签包括his
‑
标签。在一些实施方案中,所述标签通过第二接头与所述多肽融合。在一些实施方案中,所述第二接头具有约4
‑
15个氨基酸的长度。在一些实施方案中,所述第二接头含有ggggs的氨基酸序列。
27.在根据上述任何双抗体的一些实施方案中,所述第一多肽和/或第二多肽包含seq id no:36
‑
43中任一个的氨基酸序列。
28.本技术的另一方面提供了药物组合物,其包含上述双抗体中的任一种和药学上可接受的载体。
29.本技术的另一方面提供了编码上述双抗体中任一种的多核苷酸(例如,单个多核苷酸或多个多肽)。
30.本技术的另一方面提供了核酸构建体,其包含上述多核苷酸中的任一种,任选地还包含与所述多核苷酸有效连接的启动子。
31.本技术的另一方面提供了包含上述核酸构建体中任一种的载体。
32.本技术的另一方面提供了分离的宿主细胞,其包含上述多核苷酸中的任一种、上述核酸构建体中的任一种,或上述载体中的任一种。
33.本技术的另一方面提供了培养基,其包含上述双抗体中的任一种、上述多核苷酸中的任一种、上述核酸构建体中的任一种、上述载体中的任一种,或上述宿主细胞中的任一种。
34.本技术的另一个方面提供了产生抗pd
‑
l1双抗体的方法,其包括:a)在有效表达双
抗体的条件下培养上述分离的宿主细胞中的任一种;b)从所述宿主细胞中获得表达的双抗体。
35.本技术的另一个方面提供了确定个体中pd
‑
l1分布的方法,其包括:a)向个体施用包含用标记试剂(如放射性核素)标记的上述双抗体中任一种的成像剂;以及b)使用非侵入性成像技术使个体中的成像剂成像。
36.本技术的另一个方面提供了诊断患有疾病或状况的个体的方法,其包括:a)使用上述确定个体中pd
‑
l1分布的方法中的任一种来确定个体中的pd
‑
l1分布;以及b)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或者如果在目标组织中未检测到成像剂的信号,则将个体诊断为pd
‑
l1阴性。
37.本技术的另一个方面提供了治疗患有疾病或病况的个体的方法,其包括:a)使用上述诊断个体的方法中的任一种来诊断个体;以及b)如果个体被诊断为pd
‑
l1阳性,则向个体施用有效量的靶向pd
‑
l1的治疗剂。
38.本技术的另一方面提供了治疗患有疾病或病况的个体的方法,其包括向个体施用有效量的上述双抗体中的任一种或上述药物组合物中的任一种。
39.本技术的另一方面提供了成像剂,其包含用放射性核素标记的上述双抗体中的任一种。
40.本技术的另一个方面提供了制备靶向pd
‑
l1的成像剂的方法,其包括:a)将标签与上述抗pd
‑
l1双抗体中任一种缀合,从而提供成像剂。在一些实施方案中,提供了一种制备靶向pd
‑
l1的成像剂的方法,其包括:a)将螯合化合物与上述双抗体中任一种缀合,以提供抗pd
‑
l1双抗体缀合物;b)将放射性核素与抗pd
‑
l1双抗体缀合物接触,从而提供成像剂。
41.本技术的另一个方面提供了试剂盒,包含:a)上述双抗体中任一种;以及b)螯合剂。在一些实施方案中,所述试剂盒还包含放射性核素。
42.本技术的另一个方面提供了确定个体中pd
‑
l1分布的方法,其包括:向个体施用有效量的成像剂,所述成像剂包含上述双抗体中的任一种和标记试剂;以及使用非侵入性成像技术使个体中的成像剂成像。在一些实施方案中,提供了确定个体中pd
‑
l1分布的方法,其包括:向个体施用有效量的双抗体试剂,所述双抗体试剂包含上述双抗体中的任一种和第一缀合部分;随后向个体施用有效量的放射性核素化合物,所述放射性核素化合物包含放射性核素和第二缀合部分;其中所述第一缀合部分和第二缀合部分在体内彼此缀合以提供成像剂;并且使用非侵入性成像技术使个体中的成像剂成像。在一些实施方案中,所述第一缀合部分和第二缀合部分各自包含点击化学对的成员,并且通过点击化学彼此缀合。
附图说明
43.图1显示了示例性抗pd
‑
l1 scfv的构建体设计的示意图。
44.图2显示了对应于所述示例性抗pd
‑
l1双抗体的单体形式的示意图。
45.图3a
‑
3b显示了
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
scfv的产率(图3a),以及纯化后scfv的放射化学纯度(图3b),如使用即时薄层电泳色谱法在硅胶上测量的。
46.图4a
‑
4b显示了
68
ga
‑
nota
‑
抗pd
‑
l1
‑
scfv与mc38或mc38
‑
b7h1细胞的结合,而未阻断未标记的抗pd
‑
l1 scfv(图4a),或阻断未标记的抗pd
‑
l1 scfv(图4b)。
47.图5a
‑
5b显示了注射
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
scfv后1小时(上图)或2小时(下图)小鼠
的肿瘤的体内成像结果,未阻断未标记的抗pd
‑
l1 scfv(图5a)或阻断未标记的抗pd
‑
l1
‑
scfv(图5b)。通过将mc38细胞和mc38
‑
b7h1细胞分别预施用到小鼠的左侧腹和右侧腹中来诱导肿瘤。
48.图6a
‑
6b显示了
68
ga
‑
nota
‑
抗pd
‑
l1双抗体的产率(图6a),以及纯化后双抗体的放射化学纯度(图6b),如使用即时薄层色谱法在硅胶上测量的。
49.图7a
‑
7b显示了
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
双抗体与mc38或mc38
‑
b7h1细胞的结合,没有阻断未标记的抗pd
‑
l1双抗体(图7a),或阻断未标记的抗pd
‑
l1双抗体(图7b)。
50.图8a
‑
8b显示了注射
68
ga
‑
nota
‑
抗pd
‑
l1
‑
双抗体后1小时(上图)或2小时(下图)小鼠的肿瘤的体内成像结果,未阻断未标记的1抗pd
‑
l1双抗体(图8a),以及阻断未标记的抗pd
‑
l1双抗体(图8b)。通过将mc38细胞和mc38
‑
b7h1细胞分别预施用到小鼠的左侧腹和右侧腹中来诱导肿瘤。
51.图9显示了注射
68
ga
‑
nota
‑
抗pd
‑
l1
‑
scfv或
68
ga
‑
nota
‑
抗pd
‑
l1
‑
双抗体后1小时的成像比较。
52.发明详述
53.本技术提供了抗pd
‑
l1双抗体、抗pd
‑
l1双抗体试剂、成像剂、检测个体中pd
‑
l1的方法和治疗疾病或病症的方法。本文所述的双抗体提供对靶向pd
‑
l1的高结合亲和力,并且当掺入成像剂中时,提供检测的高灵敏度以及有效靶向和渗透到靶组织中。可以通过施用有成像剂的个体的体内实时成像来确定pd
‑
l1的分布和表达水平。
54.本技术的一个方面提供了抗pd
‑
l1双抗体。在一些实施方案中,所述双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;以及b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。在一些实施方案中,所述第一多肽和第二多肽通过至少两个二硫键连接。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且其中所述第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。
55.本技术的另一方面提供了包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂。
56.本技术的另一方面提供了确定个体中pd
‑
l1分布的方法,其包括:a)向个体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;以及b)使用非侵入性成像技术使个体中的成像剂成像。本技术的另一个方面提供了诊断患有疾病或病况的个体的方法,其包括:a)使用上述方法确定个体中pd
‑
l1的分布;以及b)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或者如果在目标组织处未检测到成像剂的信号,则将个体诊断为pd
‑
l1阴性。
57.还提供了包含本文所述的成像剂和抗pd
‑
l1双抗体或双抗体试剂的组合物、试剂盒和制品、其制造方法,以及治疗患有疾病或病况(如癌症、传染病、自身免疫疾病或代谢疾病)的个体的方法。
58.i.定义
59.术语“抗体”以其最广泛的意义使用,并涵盖多种抗体结构,包括但不限于:单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)、全长抗体及其抗原结合片段,只要它们表现出所需的抗原结合活性。
[0060]“fv”是包含完整的抗原
‑
识别和
‑
结合位点的最小抗体片段。该片段由紧密且非共价结合的一个重链
‑
和一个轻链
‑
可变区结构域的二聚体组成。从这两个结构域的折叠中产生了六个高变环(每个重链和轻链有3个环),其为抗原结合提供了氨基酸残基,并赋予了对抗体的抗原结合特异性。但是,即使是单个可变结构域(或仅包含针对抗原具有特异性的三个cdr的fv的一半),也具有识别和结合抗原的能力,尽管其亲和力低于整个结合位点。
[0061]“单链fv”也缩写为“sfv”或“scfv”,是包含连接到单个多肽链中的v
h
和v
l
抗体结构域的抗体片段。在一些实施方案中,所述scfv多肽还包含v
h
和v
l
结构域之间的多肽接头,使scfv能够形成所需的结构以进行抗原结合。有关scfv的综述参见:pl
ü
ckthun in the pharmacology of monoclonal antibodies,vol.113,rosenburg and moore eds.,springer
‑
verlag,new york,pp.269
‑
315(1994)。
[0062]
本文所述的“双抗体(diabody/diabodies)”是指包含两个scfv多肽的复合物。在一些实施方案中,实现了v
h
和v
l
结构域的链间而非链内配对,产生双价片段,即具有两个抗原结合位点的片段。
[0063]
如本文所用,术语“cdr”或“互补决定区”意图表示在重链和轻链多肽的可变区内发现的非连续抗原结合位点。这些特定的区已描述于:kabat等,j.biol.chem.252:6609
‑
6616(1977);kabat等,美国卫生与公共服务部(u.s.dept.of health and human services),sequences of proteins of immunological interest”(1991);chothia等,j.mol.biol.196:901
‑
917(1987);al
‑
lazikani b.等,j.mol.biol.,273:927
‑
948(1997);maccallum等,j.mol.biol.262:732
‑
745(1996);abhinandan和martin,mol.immunol.,45:3832
‑
3839(2008);lefranc m.p.等,dev.comp.immunol.,27:55
‑
77(2003);以及honegger和pl
ü
ckthun,j.mol.biol.,309:657
‑
670(2001),其中定义包括彼此相互比较时氨基酸残基的重叠或子集。然而,应用任一定义指代抗体或移植抗体或其变体的cdr,意图在本文定义和使用的术语的范围内。作为比较,在下表1中列出了涵盖每个以上引用参考文献中定义的cdr的氨基酸残基。cdr预测算法和界面是现有技术中已知的,包括,例如,abhinandan和martin,mol.immunol.,45:3832
‑
3839(2008);ehrenmann f.等,nucleic acids res.,38:d301
‑
d307(2010);以及adolf
‑
bryfogle j.等,nucleic acids res.,43:d432
‑
d438(2015)。本段落中引用的参考文献的内容均通过引用以其整体并入本文以用于本发明,并可能包含在本文的一个或多个权利要求中。
[0064]
表1:cdr定义
[0065][0066]1残基编号按照上述kabat等人的命名法
[0067]2残基编号按照上述chothia等人的命名法
[0068]3残基编号按照上述maccallum等人的命名法
[0069]4残基编号按照上述lefranc等人的命名法
[0070]5残基编号按照上述honegger和pl
ü
ckthun的命名法
[0071]“kabat中的可变结构域残基编号”或“kabat中的氨基酸位置编号”的表述及其变型,是指用于上述kabat等人的抗体的汇编中的重链可变结构域或轻链可变结构域的编号系统。使用该编号系统,实际的线性氨基酸序列可包含更少或更多的氨基酸,其对应于可变结构域的fr或hvr的缩短或插入。例如,重链可变结构域可包括h2的残基52之后的单个氨基酸插入(按照kabat,残基52a)和重链fr残基82之后的插入残基(例如按照kabat,残基82a、82b和82c等)。可以通过在抗体序列的同源区与“标准”kabat编号序列进行比对,确定给定抗体的残基的kabat编号。
[0072]
除非另有说明,免疫球蛋白重链中的残基编号以上述kabat等人的eu指数为准。“kabat中的eu指数”是指人igg1 eu抗体的残基编号。
[0073]“框架”或“fr”残基是除本文定义的cdr残基以外的可变结构域残基。重链或轻链中的fr序列fr1、fr2、fr3和fr4由通用公式定义:fr1
‑
cdr1
‑
fr2
‑
cdr2
‑
fr3
‑
cdr3
‑
fr4。
[0074]
关于抗体或双抗体的术语“半合成”是指,具有一个或多个天然存在的序列,以及一个或多个非天然存在的(即,合成的)序列的抗体或双抗体。
[0075]
非人(例如,啮齿动物)抗体的“人源化”形式是嵌合抗体,其包含尽量少的源自非人抗体的序列。对于大部分而言,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体的高变区(hvr)的残基被来自非人物种的高变区(供体抗体)的残基替换,所述非人物种如具有所需的抗体特异性、亲和力和性能的小鼠、大鼠、兔或非人灵长类动物。在某些情况下,人免疫球蛋白的框架区(fr)残基被相应的非人残基替换。此外,人源化抗体可包含不存在于受体抗体或供体抗体的残基。做出这些修饰是为了进一步完善抗体性能。一般而言,人源化抗体将基本上包含所有可变结构域中的至少一个、以及通常两个,其中所有或几乎所有的高变环都对应于非人球蛋白的那些高变环,并且所有或基本上所有的fr都是人免疫球蛋白序列的fr。所述人源化抗体还会任选地包含至少一部分免疫球蛋白恒定区(fc),通常是人免疫球蛋白恒定区。更多详细信息,参见jones等,nature 321:522
‑
525(1986);riechmann等,nature 332:323
‑
329(1988);以及presta,curr.op.struct.biol.2:593
‑
596(1992)。
[0076]
关于本文确定的多肽和抗体序列的“百分比(%)氨基酸序列同一性”或“同源性”被定义为,在序列比对后,考虑任何保守取代作为序列同一性一部分,候选序列中与被比较的多肽中的氨基酸残基一致的氨基酸残基的百分比。例如,可以使用公开可用的计算机软件,如blast、blast
‑
2、align、megalign(dnastar)或muscle软件,可以以本领域技术范围内的多种方式实现用于确定百分比氨基酸序列同一性目的的比对。本领域熟练技术人员可以确定用于测量比对的适当参数,包括在整个待比较序列的全长上达到最大比对所需的任何算法。但是,本文出于此目的,使用序列比较计算机程序muscle生成%氨基酸序列同一性(edgar,r.c.,nucleic acids research 32(5):1792
‑
1797,2004;edgar,r.c.,bmc bioinformatics 5(1):113,2004)。
[0077]“同源的”是指两个多肽之间或两个核酸分子之间的序列相似性或序列同一性。当两个比较的序列的两个位置均被相同的碱基或氨基酸单体亚基占据时,例如,如果两个dna
分子各自中的一个位置均被腺嘌呤占据时,则所述分子在该位置是同源的。两个序列之间的同源性百分比是由两个序列共享的匹配或同源位置数除以比较的位置数再乘以100的函数。例如,如果两个序列中的10个位置中有6个匹配或同源,则所述两个序列的同源性为60%。举例来说,dna序列attgcc和tatggc共有50%同源性。一般而言,在将两个序列对齐时进行比较,以获得最大同源性。
[0078]
来自任何哺乳动物物种的抗体(免疫球蛋白)的“轻链”,可以根据其恒定结构域的氨基酸序列归类为两种明显不同的类型中的一种,称为κ和λ。
[0079]
如本文所用,术语“表位”是指与抗体或双抗体结合的抗原上特定的原子或氨基酸基团。如果两个抗体或抗体部分表现出对抗原的竞争性结合,则它们可以结合抗原内相同的表位。
[0080]
如本文所用,在等摩尔浓度的第一抗体存在时,当第一抗体抑制第二抗体的靶抗原结合至少约50%(如至少约55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%中任一个)时,第一抗体(如双抗体)与第二抗体(如双抗体)“竞争”结合靶抗原,或反之亦然。在pct公开wo 03/48731中描述了基于它们的交叉竞争“结合”抗体的高通量方法。
[0081]
如本文所用,术语“特异性结合”,“特异性识别”和“对
…
具有特异性”是指可测量和可再现的相互作用,如靶标与抗体(如双抗体)之间的结合,其在异质分子群(包括生物分子)存在下,确定靶标的存在。例如,特异性识别靶标(可以是表位)的抗体,是与与其他靶标的结合相比,以更高的亲和力、亲合力、更容易和/或更长的持续时间结合该目标的抗体(如双抗体)。在一些实施方案中,例如通过放射免疫测定法(ria),测得抗体与无关靶标的结合程度小于抗体与靶标结合程度的约10%。在一些实施方案中,所述特异性结合靶标的抗体的解离常数(k
d
)为:≤10
‑5m、≤10
‑6m、≤10
‑7m、≤10
‑8m、≤10
‑9m、≤10
‑
10
m、≤10
‑
11
m或≤10
‑
12
m。在一些实施方案中,所述抗体特异性结合来自不同物种的蛋白中保守的蛋白上的表位。在一些实施方案中,所述特异性结合可以包括但不要求排他性结合。抗体或抗原结合域的结合特异性,可以通过本领域已知的方法在实验上确定。此类方法包括但不限于:蛋白质印迹、elisa
‑
、ria
‑
、ecl
‑
、irma
‑
、eia
‑
、biacore
tm
测试和肽扫描。
[0082]“分离的”抗体(或构建体)是从其生产环境(例如天然或重组)的组分中鉴定、分离和/或回收的。优选地,分离的多肽与它的生产环境中的所有其他组分没有结合。
[0083]
编码本文所述的构建体或抗体(如双抗体)的“分离的”核酸分子,是经鉴定并与通常在其产生的环境中和其结合的至少一种污染物核酸分子分离的核酸分子。优选地,分离的核酸与所有与生产环境有关的组分没有结合。编码本文所述的多肽和抗体的分离的核酸分子的形式,不同于其在自然界发现的形式或环境。因此,分离的核酸分子不同于细胞中天然存在的编码本文所述的多肽和抗体的核酸。分离的核酸包括在通常包含核酸分子的细胞中所含的核酸分子,但该核酸分子存在于染色体外,或处在与天然染色体位置不同的染色体位置。
[0084]
当将核酸与另一个核酸序列置于功能关系中时,则该核酸被“可操作地连接”。例如,如果前序列或分泌前导序列的dna表达为参与多肽分泌的前蛋白,则该dna可操作地连接至所述多肽的dna。如果启动子或增强子影响编码序列的转录,则该启动子或增强子可操作地连接至该序列;或者,如果核糖体结合位点被定位以便进行翻译,则该核糖体结合位点可操作地连接至编码序列。一般而言,“可操作地连接”是指被连接的dna序列是连续的,并
且在分泌前导序列的情况下是连续的,以及在阅读阶段是连续的。但是,增强子不必是连续的。通过在方便的限制性位点进行连接来完成连接。如果不存在此类位点,则应按照常规做法使用合成的寡核苷酸适配体或接头。
[0085]
如本文所用,术语“载体”是指能够使与其连接的另一种核酸增殖的核酸分子。该术语包括作为自我复制核酸结构的载体,以及整合到其所引入的宿主细胞的基因组中的载体。某些载体能够指导与其可操作地连接的核酸的表达。本文将此类载体称为“表达载体”。
[0086]
如本文所用,术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞的过程。“转染的”或“转化的”或“转导的”细胞是用外源核酸转染、转化或转导的细胞。所述细胞包括原代的对象细胞及其子代。
[0087]
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并指引入外源核酸的细胞,包括此类细胞的子代。宿主细胞包括“转化株”和“转化细胞”,其包括原始转化细胞及由其衍生的子代,而与传代次数无关。子代与亲本细胞中的核酸含量可能不完全相同,但可能包含突变。在原始转化细胞中筛选或选择的具有相同功能或生物学活性的突变体子代也包括在内。
[0088]
如本文所用,“治疗(treatment/treating)”是一种获得有益或期望结果(包括临床结果)的方法。出于本发明的目的,有益或期望的临床结果包括但不限于以下一个或多个结果:减轻由疾病引起的一种或多种症状,减少疾病的程度,稳定疾病(例如,预防或延迟疾病的恶化),预防或延迟疾病的扩散(例如转移),预防或延迟疾病的复发,延缓或减慢疾病的进展,改善疾病状态,缓解疾病(部分或全部),减少治疗疾病所需的一种或多种其他药物的剂量,延迟疾病的进展,增加或改善生活质量,增加体重和/或延长生存期。“治疗”还包括减少癌症的病理后果(例如,肿瘤体积)。本发明的方法考虑了这些治疗方面中任一个或多个。
[0089]
术语“有效量”是指足以产生有益或期望的结果的试剂量。该术语还适用于通过本文所述的成像方法中的任一种提供图像以进行检测的剂量。具体剂量可能会基于以下一个或多个而变化:选择的特定试剂,要遵循的剂量方案,是否与其他化合物联合施用、施用时间、待成像的组织,以及携带它的物理递送系统。
[0090]
术语“受试者”、“个体”和“患者”在本文中可互换使用,指哺乳动物,包括但不限于:人类、牛、马、猫、犬、啮齿动物或灵长类动物。在一些实施方案中,所述个体是人类。
[0091]
应当理解,本文所述发明的实施方案包括“由...组成”和/或“基本上由...组成”的实施方案。
[0092]
本文提及的“约”值或参数,包括(并描述)针对该值或参数本身的变化。例如,涉及“约x”的描述,包括“x”的描述。
[0093]
如本文所用,提及“非”值或参数,通常是指和描述该值或参数“以外的”值。例如,不用于治疗x型癌症的方法,是指该方法用于治疗x型以外类型的癌症。
[0094]
如本文所用,术语“约x
‑
y”的含义与“约x至约y”相同。
[0095]
如本文所用,术语“约x、y或z”与“约x、约y或约z”具有相同的含义。
[0096]
如本文以及所附权利要求书中所用,除非上下文中另有明确规定,单数形式的“一个/种(a/an)”和/或“所述/该(the)”包括复数指称。
[0097]
如本文所用,“缀合”是指两个缀合部分的特定结合,其可以是共价的或非共价的。
[0098]
ii.抗pd
‑
l1
‑
双抗体
[0099]
本技术的一个方面提供了分离的抗pd
‑
l1双抗体和抗pd
‑
l1双抗体试剂。在一些实施方案中,所述双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1
‑
5中任一个的氨基酸序列的hc
‑
cdr1,含有seq id no:6
‑
10中任一个的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11
‑
13中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约3个氨基酸取代;以及b)所述v
l
包含:含有seq id no:14
‑
16中任一个的氨基酸序列的lc
‑
cdr1,含有seq id no:17
‑
19中任一个的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20
‑
21中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约3个氨基酸取代。在一些实施方案中,所述第一多肽和第二多肽通过至少两个二硫键连接。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且所述第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案中,a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成特异性结合pd
‑
l1的结合域。在一些实施方案中,所述第一多肽的v
h
和第二多肽的v
l
,以及第二多肽的v
h
和第一多肽的v
l
,各自形成特异性结合pd
‑
l1的结合域。
[0100]
在一些实施方案中,提供了包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1
‑
5中任一个的氨基酸序列的hc
‑
cdr1,含有seq id no:6
‑
10中任一个的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11
‑
13中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约5、4、3、2或1个氨基酸取代;以及b)所述v
l
包含:含有seq id no:14
‑
16中任一个的氨基酸序列的lc
‑
cdr1,含有seq id no:17
‑
19中任一个的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20
‑
21中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约5、4、3、2或1个氨基酸取代。在一些实施方案中,所述取代由保守取代组成(如表2中公开的那些)。在一些实施方案中,所述第一多肽和第二多肽通过至少两个二硫键连接。在一些实施方案中,所述至少两个二硫键由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸残基。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案中,所述第一多肽的v
h
和v
l
通过肽接头彼此融合。在一些实施方案中,所述第一多肽或第二多肽的v
h
和v
l
之间的肽接头具有约1
‑
30个氨基酸(如约1
‑
15个氨基酸,或约15
‑
30个氨基酸)的长度。在一些实施方案中,所述肽接头含有seq id no:28
‑
34中任一个的氨基酸序列。在一些实施方案中,所述第一多肽或第二多肽还包含与所述肽的n
‑
末端融合的信号肽(如含有seq id no:35的氨基酸序列的信号肽)。在一些实施方案中,所述v
h
含有seq id no:22
‑
24中任一个的氨基酸序列,或其变体,所述变体与seq id no:22
‑
24中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的
任一个)序列同一性。在一些实施方案中,所述v
l
含有seq id no:25
‑
27中任一个的氨基酸序列,或其变体,所述变体与seq id no:25
‑
27中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。在一些实施方案中,a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
h
,或d)第二多肽的v
h
和第一多肽的v
l
形成特异性结合pd
‑
l1的结合域。在一些实施方案中,所述第一多肽的v
h
和第二多肽的v
l
,以及第二多肽的v
h
和第一多肽的v
l
,各自形成特异性结合pd
‑
l1的结合域。
[0101]
在一些实施方案中,提供了包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约5、4、3、2或1个氨基酸取代;以及b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约5、4、3、2或1个氨基酸取代。在一些实施方案中,所述取代由保守取代组成(如表2中公开的)。在一些实施方案中,所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;并且所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。在一些实施方案中,所述第一多肽和第二多肽通过至少两个二硫键连接。在一些实施方案中,所述至少两个二硫键由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸残基。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案中,所述第一多肽的v
h
和v
l
通过肽接头彼此融合。在一些实施方案中,所述第一多肽或第二多肽的v
h
和v
l
之间的肽接头具有约1
‑
30个氨基酸(如约1
‑
15个氨基酸,或约15
‑
30个氨基酸)的长度。在一些实施方案中,所述肽接头含有seq id no:28
‑
34中任一个的氨基酸序列。在一些实施方案中,所述第一多肽或第二多肽还包含与所述肽的n
‑
末端融合的信号肽(如含有seq id no:35的氨基酸序列的信号肽)。在一些实施方案中,所述v
h
含有seq id no:22
‑
24中任一个的氨基酸序列,或其变体,所述变体与seq id no:22
‑
24中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。在一些实施方案中,所述v
l
含有seq id no:25
‑
27中任一个的氨基酸序列,或其变体,所述变体与seq id no:25
‑
27中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。在一些实施方案中,a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成特异性结合pd
‑
l1的结合域。在一些实施方案中,所述第一多肽的v
h
和第二多肽的v
l
,以及第二多肽的v
h
和第一多肽的v
l
,各自形成特异性结合pd
‑
l1的结合域。
[0102]
在一些实施方案中,提供了包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),并且其中a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成结合域,所述结合域与包含第二重链可变区(v
h
‑2)和第二轻链可变区(v
l
‑2)的抗pd
‑
l1抗体竞争性地特异性结合pd
‑
l1,其中:a)所述v
h
‑2包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;和b)所述v
l
‑2包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。在一些实施方案中,所述结合域由第一多肽的v
h
和v
l
或第二多肽的v
h
和v
l
形成。在一些实施方案中,所述结合域由第一多肽的v
h
和第二多肽的v
l
或第二多肽的v
h
和第一多肽的v
l
形成。在一些实施方案中,所述第一多肽和第二多肽通过至少两个二硫键连接。在一些实施方案中,所述至少两个二硫键由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸残基。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案中,所述第一多肽的v
h
和v
l
通过肽接头彼此融合。在一些实施方案中,所述第一多肽或第二多肽的v
h
和v
l
之间的肽接头具有约1
‑
30个氨基酸(如约1
‑
15个氨基酸,或约15
‑
30个氨基酸)的长度。在一些实施方案中,所述肽接头含有seq id no:28
‑
34中任一个的氨基酸序列。在一些实施方案中,所述第一多肽或第二多肽还包含与所述肽的n
‑
末端融合的信号肽(如含有seq id no:35的氨基酸序列的信号肽)。在一些实施方案中,所述v
h
含有seq id no:22
‑
24中任一个的氨基酸序列,或其变体,所述变体与seq id no:22
‑
24中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。在一些实施方案中,所述v
l
含有seq id no:25
‑
27中任一个的氨基酸序列,或其变体,所述变体与seq id no:25
‑
27中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。
[0103]
在一些实施方案中,提供了包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含hc
‑
cdr1、hc
‑
cdr2和hc
‑
cdr3,其分别包含具有如seq id no:22
‑
24中任一个所示序列的第二重链可变区(v
h
‑2)中的cdr1、cdr2和cdr3的氨基酸序列;以及b)所述v
l
包含lc
‑
cdr1、lc
‑
cdr2和lc
‑
cdr3,其分别包含具有如seq id no:25
‑
27中任一个所示序列的第二轻链可变区(v
l
‑2)中的cdr1、cdr2和cdr3的氨基酸序列。在一些实施方案中,所述第一多肽和第二多肽通过至少两个二硫键连接。在一些实施方案中,所述至少两个二硫键由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案
中,所述第一多肽的v
h
和v
l
通过肽接头彼此融合。在一些实施方案中,所述第一多肽或第二多肽的v
h
和v
l
之间的肽接头具有约1
‑
30个氨基酸(如约1
‑
15个氨基酸,或约15
‑
30个氨基酸)的长度。在一些实施方案中,所述肽接头含有seq id no:28
‑
34中任一个的氨基酸序列。在一些实施方案中,所述第一多肽或第二多肽还包含与所述肽的n
‑
末端融合的信号肽(如含有seq id no:35的氨基酸序列的信号肽)。在一些实施方案中,所述v
h
含有seq id no:22
‑
24中任一个的氨基酸序列,或其变体,所述变体与seq id no:22
‑
24中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。在一些实施方案中,所述v
l
含有seq id no:25
‑
27中任一个的氨基酸序列,或其变体,所述变体与seq id no:25
‑
27中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中任一个)序列同一性。在一些实施方案中,a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成特异性结合pd
‑
l1的结合域。在一些实施方案中,所述第一多肽的v
h
和第二多肽的v
l
,以及第二多肽的v
h
和第一多肽的v
l
,各自形成特异性结合pd
‑
l1的结合域。
[0104]
在一些实施方案中,本文所述的双抗体的第一多肽和第二多肽通过共价键连接。在一些实施方案中,所述共价键包括第一多肽的v
h
和第二多肽的v
l
之间的共价键,和/或第一多肽的v
l
和第二多肽的v
h
之间的共价键。在一些实施方案中,所述第一多肽和第二多肽通过两个或更多个共价键连接。在一些实施方案中,所述两个或更多个共价键包含:a)第一多肽的v
h
和第二多肽的v
l
之间的第一共价键;以及b)第一多肽的v
h
和第二多肽的v
l
之间的第二共价键。在一些实施方案中,所述共价键包含二硫键。在一些实施方案中,所述第一多肽和第二多肽通过至少两个二硫键连接。在一些实施方案中,所述至少两个二硫键包含:a)第一多肽的v
h
和第二多肽的v
l
之间的第一二硫键;和b)第一多肽的v
h
和第二多肽的v
l
之间的第二二硫键。在一些实施方案中,所述二硫键或至少两个二硫键之一由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸残基。
[0105]
在一些实施方案中,根据kabat编号系统,第一多肽和/或第二多肽中的v
h
包含g44c突变或q105c突变。在一些实施方案中,根据kabat编号系统,第一多肽和/或第二多肽中的v
l
包含q100c突变或a43c突变。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含q105c突变,其中第一多肽和第二多肽中的v
l
各自包含a43c突变。
[0106]
在一些实施方案中,所述第一多肽的v
h
和v
l
通过肽接头彼此融合。在一些实施方案中,所述第二多肽的v
h
和v
l
通过肽接头彼此融合。在一些实施方案中,所述第一多肽或第二多肽的v
h
和v
l
之间的肽接头具有约1
‑
30个氨基酸的长度。在一些实施方案中,所述肽接头的长度不超过约15个氨基酸(如不超过15、14、13、12、11、10或9个氨基酸)。在一些实施方案中,所述肽接头具有至少约15个氨基酸(如至少约15、18、20、22、25或27个氨基酸)的长度。在一些实施方案中,所述肽接头具有约1
‑
5、5
‑
10、10
‑
15、15
‑
20、20
‑
25、25
‑
30个氨基酸的长度。在一些实施方案中,所述肽接头具有约1
‑
15、2
‑
12、4
‑
10个氨基酸的长度。在一些实施方
案中,所述肽接头含有seq id no:28
‑
34中任一个的氨基酸序列。
[0107]
在一些实施方案中,所述第一多肽或第二多肽还包含与多肽的n
‑
末端融合的信号肽。在一些实施方案中,所述信号肽含有seq id no:35的氨基酸序列。
[0108]
在一些实施方案中,所述第一和/或第二多肽的v
h
含有seq id no:22
‑
24中任一个的氨基酸序列,或其变体,所述变体与seq id no:22
‑
24中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。
[0109]
在一些实施方案中,所述第一和/或第二多肽的v
l
含有seq id no:25
‑
27中任一个的氨基酸序列,或其变体,所述变体与seq id no:25
‑
27中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。
[0110]
在一些实施方案中,所述第一多肽和/或第二多肽还包含标签。在一些实施方案中,所述标签融合到第一多肽和/或第二多肽的c
‑
末端。在一些实施方案中,所述标签融合到第一多肽和/或第二多肽的n
‑
末端。在一些实施方案中,所述标签包括his
‑
标签。在一些实施方案中,所述标签通过第二接头与所述多肽融合。在一些实施方案中,所述第二接头具有约1
‑
30个氨基酸的长度,如约4
‑
15个氨基酸、约4
‑
10个氨基酸。在一些实施方案中,所述第二接头含有ggggs的氨基酸序列。
[0111]
在一些实施方案中,所述第一多肽和/或第二多肽包含seq id no:36
‑
43中任一个的氨基酸序列,或其变体,所述变体与seq id no:36
‑
43中任一个的氨基酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中的任一个)序列同一性。
[0112]
在一些实施方案中,所述双抗体在酸性ph是稳定的(例如,在低于约6.5、6.0、5.5或5.0的ph)。在一些实施方案中,所述双抗体具有约55
‑
70℃(如约55
‑
60℃、60
‑
65℃或65
‑
70℃中的任一个)的熔解温度(tm)。
[0113]
在一些实施方案中,所述双抗体是人源化的。
[0114]
a)取代、插入、删除和变体
[0115]
在一些实施方案中,提供了具有一个或多个氨基酸取代的抗pd
‑
l1双抗体变体。用于取代诱变的目标位点包括hvr(或cdr)和fr。示例性保守取代在表2中在“优选取代”的标题下显示。在表2中在“示例性取代”的标题下提供了更多实质性变化,并且如下文关于氨基酸侧链类别的进一步描述。可以将氨基酸取代引入目标双抗体中,并且针对所需活性筛选产品,例如,保留/改善的抗原结合、降低的免疫原性,或改善的adcc或cdc。
[0116]
表2:氨基酸取代
[0117]
原始残基residue示例性取代优选取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp,lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaalahis(h)asn;gln;lys;argarg
ile(i)leu;val;met;ala;phe;正亮氨leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)alaalaser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu
[0118]
氨基酸可根据常见的侧链性质分组:(1)疏水性:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr、asn、gln;(3)酸性:asp、glu;(4)碱性:his、lys、arg;(5)影响链方向的残基:gly、pro;以及(6)芳香族的:trp、tyr、phe。
[0119]
非保守取代会需要将这些类别之一的成员换成另一类别。
[0120]
一种类型的取代变体涉及替代亲本抗体(例如人源化双抗体)的一个或多个高变区残基。一般而言,选择用于进一步研究的所得变体,会在某些生物学特性(例如,增加亲和力、降低免疫原性)方面相比亲本抗体具有改变(例如,改进),和/或会基本上保留亲本抗体的某些生物学特性。示例性取代变体是亲和成熟抗体,其可以方便地生成,例如,使用基于噬菌体展示的亲和成熟技术,如本文所述的那些。简而言之,一个或多个hvr残基发生突变,该变体抗体显示在噬菌体上并筛选特定的生物活性(例如,结合亲和力)。
[0121]
可以在hvr中进行改变(例如取代),例如以提高双抗体亲和力。此类改变可以在hvr“热点”中进行,即由在体细胞成熟过程中经历高频突变的密码子编码的残基(参见,例如,chowdhury,methods mol.biol.207:179
‑
196(2008))和/或sdr(a
‑
cdr),测试所得变体v
h
或v
l
的结合亲和力。通过从二级文库中构建和重新选择的亲和力成熟,描述于例如hoogenboom等methods in molecular biology 178:1
‑
37(o’brien等,ed.,human press,totowa,nj,(2001))。在亲和成熟的一些实施方案中,通过多种方法(例如,易错pcr、链改组或寡核苷酸定向诱变)中任一种将多样性引入选择用于成熟的可变基因中。然后创建二级文库。然后筛选文库以鉴定具有所需亲和力的任何双抗体变体。另一种引入多样性的方法涉及hvr导向的方法,其中几个hvr残基(例如,一次4
‑
6个残基)被随机化。涉及抗原结合的hvr残基可以被具体鉴定,例如,使用丙氨酸扫描诱变或建模。尤其是通常靶向cdr
‑
h3和cdr
‑
l3。
[0122]
在一些实施方案中,一个或多个hvr内可能发生取代、插入或缺失,只要此类改变基本上不会降低抗体结合抗原的能力。例如,可以在hvr中进行基本上不会降低结合亲和力的保守性改变(例如,本文提供的保守性取代)。此类改变可能在hvr“热点”或cdr之外。
[0123]
一种用于鉴定可以靶向诱变的抗体的残基或区域的有用方法称为“丙氨酸扫描诱变”,其描述于cunningham and wells(1989)science,244:1081
‑
1085。在该方法中,残基或目标残基组(例如带电残基,如arg、asp、his、lys和glu)被鉴定,并被中性或带负电荷的氨基酸(例如丙氨酸或聚丙氨酸)替换,以确定抗体与抗原的相互作用是否受到影响。该方法
适用于本文所述的双抗体。可以在氨基酸位置引入进一步的取代,表明了对初始取代的功能敏感性。或者,或另外,抗原
‑
抗体复合物的晶体结构,以鉴定抗体和抗原之间的接触点。此类接触残基和相邻残基可以作为取代的候选物被靶向或消除。可以筛选变体以确定它们是否包含所需的特性。
[0124]
b)糖基化变体
[0125]
在一些实施方案中,所述双抗体被改变以增加或减少构建体被糖基化的程度。向双抗体添加或删除糖基化位点,可以方便地通过改变氨基酸序列来完成,从而创建或去除一个或多个糖基化位点。
[0126]
哺乳动物细胞产生的天然抗体通常包含分支的双触角寡糖(biantennary oligosaccharide),其通常通过n
‑
连接被附接到fc区的c
h2
结构域的asn297。参见,例如,wright等tibtech 15:26
‑
32(1997)。所述寡糖可包括多种碳水化合物,例如甘露糖、n
‑
乙酰葡糖胺(glcnac)、半乳糖和唾液酸,以及在双触角寡糖结构的“茎”中附接到glcnac的岩藻糖。在一些实施方案中,可以对双抗体中的寡糖进行修饰,以产生具有某些改进特性的抗体变体。
[0127]
在一些实施方案中,所述双抗体具有缺乏与fc区附接(直接或间接)的岩藻糖的碳水化合物结构。例如,此类抗体中岩藻糖的量可以是1%至80%、1%至65%、5%至65%、或20%至40%。如通过maldi
‑
tof质谱法所测量,岩藻糖的量是相对于附接到asn297的所有糖结构的总和(例如,复杂的、杂合和高的甘露糖结构),通过计算asn297处糖链内岩藻糖的平均量来确定的,例如,如wo2008/077546中所述。asn297是指位于fc区中大约297位的天冬酰胺残基(fc区残基的eu编号);然而,由于抗体中的微小序列变异,asn297也可以位于位置297的上游或下游约
±
3个氨基酸,即在位置294和300之间。这种岩藻糖基化变体可能已经改善了adcc功能。参见,例如,美国专利公开号us 2003/0157108(presta,l.);us 2004/0093621(kyowa hakko kogyo co.,ltd)。与“去岩藻糖基化”或“岩藻糖缺乏”抗体变体相关的出版物实例包括:us 2003/0157108;wo 2000/61739;wo 2001/29246;us 2003/0115614;us 2002/0164328;us 2004/0093621;us 2004/0132140;us 2004/0110704;us 2004/0110282;us 2004/0109865;wo 2003/085119;wo 2003/084570;wo 2005/035586;wo 2005/035778;wo 2005/053742;wo 2002/031140;okazaki等j.mol.biol.336:1239
‑
1249(2004);yamane
‑
ohnuki等biotech.bioeng.87:614(2004)。能够产生去岩藻糖基化抗体的细胞系的实例包括蛋白质岩藻糖基化缺陷的lec13 cho细胞(ripka等arch.biochem.biophys.249:533
‑
545(1986);美国专利申请us 2003/0157108 a1,presta,l;以及wo 2004/056312 a1,adams等,尤其是在实施例11中),以及敲除细胞系,如α
‑
1,6
‑
岩藻糖基转移酶基因、fut8、敲除cho细胞(参见,例如,y yamane
‑
ohnuki等biotech.bioeng.87:614(2004);kanda,y.等,biotechnol.bioeng.,94(4):680
‑
688(2006);以及wo2003/085107)。
[0128]
c)双抗体衍生物
[0129]
在一些实施方案中,本文所述的双抗体可进一步修饰以包含本领域已知且容易获得的其他非蛋白质部分。适用于衍生双抗体的部分包括但不限于水溶性聚合物。水溶性聚合物的非限制性实例,包括但不限于:聚乙二醇(peg)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚
‑
1,3
‑
二噁烷、聚
‑
1,3,6
‑
三噁烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物)和葡聚糖或聚(正乙烯基吡咯烷酮)聚乙二醇、
no:25
‑
27中任一个所示序列的第二轻链可变区(v
l
‑2)中的cdr1、cdr2和cdr3的氨基酸序列。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且所述第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案中,所述放射性核素选自:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述双抗体与螯合放射性核素的螯合化合物缀合。在一些实施方案中,所述螯合化合物是1,4,7
‑
三氮杂环壬烷
‑
1,4,7
‑
三乙酸(nota)、1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7,10
‑
四乙酸(dota)或其衍生物。在一些实施方案中,所述双抗体与来自非人类哺乳动物(例如小鼠、大鼠或猴子)的pd
‑
l1发生交叉反应。在一些实施方案中,所述双抗体是人源化的。
[0134]
在一些实施方案中,提供了包含与螯合放射性核素的螯合化合物缀合的抗pd
‑
l1双抗体(如本文所述双抗体中任一个)的成像剂。在一些实施方案中,提供了包含与螯合放射性核素的螯合化合物缀合的抗pd
‑
l1双抗体的成像剂,其中所述双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约5个氨基酸取代;以及b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约5个氨基酸取代。在一些实施方案中,提供了包含与螯合放射性核素的螯合化合物缀合的抗pd
‑
l1双抗体的成像剂,其中所述双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),且其中a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成结合域,所述结合域与包含第二重链可变区(v
h
‑2)和第二轻链可变区(v
l
‑2)的抗pd
‑
l1抗体竞争性地特异性结合pd
‑
l1,其中:a)所述v
h
‑2包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;以及b)所述v
l
‑2包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。在一些实施方案中,提供了包含与螯合放射性核素的螯合化合物缀合的抗pd
‑
l1双抗体的成像剂,其中所述双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含hc
‑
cdr1、hc
‑
cdr2和hc
‑
cdr3,其分别包含具有如seq id no:22
‑
24中任一个所示序列的第二重链可变区(v
h
‑2)中的cdr1、cdr2和cdr3的氨基酸序列;以及b)所述v
l
包含lc
‑
cdr1、lc
‑
cdr2和lc
‑
cdr3,其分别包含具有如seq id no:25
‑
27中任一个所示序列的第二轻链可变区(v
l
‑2)中的cdr1、cdr2和cdr3的氨基酸序列。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且所述第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述螯合化合物是nota、dota或其衍生物。在一些实施方案中,所述双抗体与来自非人类哺乳动物(例如小鼠、大鼠或猴子)的pd
‑
l1发生交叉反应。在一些实施方案中,所述双抗体是人源化的。
[0135]
考虑的双抗体包括但不限于:人源化双抗体、部分人源化双抗体、完全人源化双抗体、半合成双抗体和包含本文中讨论的重链和/或轻链cdr的双抗体,例如在“抗pd
‑
l1双抗体”部分中。
[0136]
在一些实施方案中,所述双抗体特异性识别来自人类的pd
‑
l1。在一些实施方案中,所述双抗体与来自两个或多个物种的pd
‑
l1发生交叉反应。所述双抗体与模型动物的交叉反应性和成像剂的人类设施临床研究。在一些实施方案中,所述双抗体与来自非人类动物(如哺乳动物)的pd
‑
l1发生交叉反应。在一些实施方案中,所述双抗体与来自啮齿动物(如小鼠或大鼠)的pd
‑
l1发生交叉反应。在一些实施方案中,所述双抗体与来自非人灵长类动物(如食蟹猴)的pd
‑
l1发生交叉反应。
[0137]
放射性核素
[0138]
本文所述的成像剂包括标记试剂。出于诊断目的,所述标记试剂可以是放射性核素、放射造影剂、顺磁性离子、金属、荧光标记、化学发光标记、超声造影剂和光敏剂。这样的诊断标记是公知的,并且可以使用任何这样的已知标记。
[0139]
在一些实施方案中,所述成像剂包含放射性核素。“放射性核素”通常被称为“放射性同位素”或“放射同位素”。可与本文所述的抗体部分附接的示例性放射性核素或稳定同位素,包括但不限于:
110
in、
111
in、
177
lu、
18
f、
52
fe、
62
cu、
64
cu、
67
cu、
67
ga、
68
ga、
86
y、
90
y、
89
zr、
94m
tc、
94
tc、
99m
tc、
120
i、
123
i、
124
i、
125
i、
131
i、
154
‑
158
gd、
32
p、
11
c、
13
n、
15
o、
186
re、
188
re、
51
mn、
52m
mn、
55
co、
72
as、
75
br、
76
br、
82m
rb、
83
sr或其他γ
‑
、β
‑
或正电子
‑
发射体。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。
[0140]
使用的顺磁性离子可包括:铬(iii)、锰(ii)、铁(iii)、铁(ii)、钴(ii)、镍(ii)、铜(ii)、钕(iii)、钐(iii)、镱(iii)、钆(iii)、钒(ii)、铽(iii)、镝(iii)、钬(iii)或铒(iii)。金属造影剂可包括:镧(iii)、金(iii)、铅(ii)或铋(iii)。不透射线的诊断剂可选自:化合物、钡化合物、镓化合物和铊化合物。多种荧光标记是本领域已知的,包括但不限于:异硫氰酸荧光素、若丹明、藻红蛋白、藻蓝蛋白、别藻蓝蛋白、邻苯二醛和荧光胺。使用的化学发光标记可包括:鲁米诺、异鲁米诺、芳香族吖啶酯、咪唑、吖啶盐或草酸酯。
[0141]
在过去的35年中,放射免疫检测(raid)已成为临床上有用的领域。在此期间,使用raid进行了近1000次临床试验,并得出了一些明确且重要的结果。即使在早期研究中,这种通过传统成像检测被视为“隐匿性”病变的技术的更大便利性也得到了认可,并且已经被研究反复确认,无论是抗体、肿瘤或放射性核素类型。
[0142]
许多放射性核素,如
68
ga、
99
tc、
64
cu和
18
f,都是很好的成像剂选择。它们通常具有非常适合安全成像的γ或β能量,并且价格低廉且易于获得,由发电机生产且无载体。它们的短半衰期(不到6小时)很容易导致其自身与抗体片段偶联以进行早期成像研究。
[0143]
在一些实施方案中,所述成像剂包含螯合放射性核素的螯合化合物。在一些实施方案中,所述螯合化合物螯合放射性金属。在一些实施方案中,所述螯合化合物螯合金属
18
f。在一些实施方案中,所述螯合化合物是亲水性螯合化合物,其可以结合金属离子并有助于确保体内快速清除。合适的螯合化合物可以针对其特定的金属结合特性来选择,并且通过已知的化学交联技术或通过使用具有侧链反应性基团的螯合剂(如双功能螯合化合物)进行的取代,可以仅在常规实验中进行。
[0144]
特别有用的金属螯合化合物组合,包括2
‑
苄基
‑
dtpa(二亚乙基三胺五乙酸)及其单甲基和环己基类似物与一般能量范围为60
‑
4,000kev的诊断同位素(如
125
i、
131
i、
123
i、
124
i、
62
cu、
64
cu、
18
f、
111
in、
67
ga、
68
ga、
99
tc、
94
tc、
11
c、
13
n、
15
o、
76
br)一起使用,进行放射成像。当与非放射性金属(如锰、铁和钆)复合时,相同的螯合化合物可用于mri。大环螯合化合物,如nota(1,4,7
‑
三氮杂环壬烷
‑
1,4,7
‑
三乙酸)、dota(1,4,7,10
‑
四氮杂环十二烷
‑
n,n',n”,n”'
‑
四乙酸)、teta(溴乙酰氨基
‑
苄基
‑
四乙胺四乙酸)和neta({4
‑
[2
‑
(双羧甲基
‑
氨基)
‑
乙基]
‑7‑
羧甲基
‑
[1,4,7]三唑烷
‑1‑
基}
‑
乙酸),可用于多种诊断放射性金属,如镓、钇和铜。通过根据目标金属定制环尺寸,可以使这样的金属螯合物非常稳定。普通技术人员会理解,通过改变附接到大环结构如nota的基团,不同金属和/或放射性核素的结合特性和亲和力可改变,而例如nota的这类衍生物或类似物因此可以设计为结合本文讨论的任何金属或放射性核素。
[0145]
dtpa和dota型螯合剂,其中配体包括硬碱螯合功能,如羧酸根或胺基团,最有效地螯合硬酸阳离子,尤其是第iia组和第iiia组金属阳离子。通过根据目标金属定制环尺寸,可以使这杨的金属螯合物非常稳定。其他环型螯合剂如大环聚醚对于稳定结合核素是有意义的。卟啉螯合剂可与多种金属配合物一起使用。一种以上的螯合剂可以与肽缀合以结合多种金属离子。螯合剂如美国专利号5,753,206中公开的那些,特别是缩氨基硫脲基乙醛酰基半胱氨酸(tscg
‑
cys)和缩氨基硫脲基乙酰基半胱氨酸(tsca
‑
cys)螯合剂有利地用于结合tc、re、bi的软酸阳离子,以及与软碱配体紧密结合的其他过渡金属、镧系元素和锕系元素。其他硬酸螯合剂如dota、teta等可以替代dtpa和/或tscgcys基团。
[0146]
在一些实施方案中,所述螯合化合物包含可与抗pd
‑
l1双抗体缀合的功能基团。在一些实施方案中,所述螯合化合物包含与抗pd
‑
l1双抗体中的伯胺(
‑
nh2)基团反应的官能团。伯胺存在于每条多肽链的n
‑
末端和赖氨酸(lys)氨基酸残基的侧链中。可与抗pd
‑
l1双抗体的伯胺(例如赖氨酸侧链)缀合的示例性官能团,包括但不限于:异硫氰酸酯、异氰酸酯、酰基叠氮化物、n
‑
羟基琥珀酸亚胺(nhs)酯、磺酰氯、醛、乙二醛、环氧化物、环氧乙烷、碳酸酯、芳基卤化物、亚胺酯、碳二亚胺、酸酐和氟苯基酯。大多数这些官能团通过酰化或烷基化与胺缀合。
[0147]
在一些实施方案中,所述螯合化合物包含与抗pd
‑
l1双抗体中的半胱氨酸侧链(即,巯基)反应的官能团。示例性巯基反应性基团,包括但不限于:卤代乙酰基、马来酰亚胺、氮丙啶、丙烯酰基、芳基化剂、乙烯基砜、吡啶基二硫化物、tnb
‑
硫醇和二硫化物还原剂。大多数这些基团通过烷基化(通常形成硫醚键)或二硫化物交换(形成二硫键)与巯基缀合。
[0148]
在一些实施方案中,所述螯合化合物是nota,包括nota衍生物。具有适合与抗体部分缀合的官能团的示例性nota化合物,例如,通过氨基酸侧链如赖氨酸和半胱氨酸,显示在图10中。在一些实施方案中,所述成像剂包含与抗pd
‑
l1双抗体缀合的nota。在一些实施方案中,所述nota化合物包含异硫氰酸酯(
‑
scn)基团。在一些实施方案中,所述nota化合物是p
‑
scn
‑
bn
‑
nota。在一些实施方案中,所述螯合化合物包含与抗pd
‑
l1双抗体中的赖氨酸残
基缀合的nota,并且nota螯合
68
ga。在一些实施方案中,所述nota化合物首先用放射性金属如
68
ga或
18
f
‑
金属标记,然后与抗pd
‑
l1双抗体缀合。
[0149]
抗pd
‑
l1双抗体试剂
[0150]
在一些实施方案中,提供了包含如第ii部分所述的抗pd
‑
l1双抗体的抗pd
‑
l1双抗体试剂。在一些实施方案中,所述抗pd
‑
l1双抗体还包含如下所述的第一缀合部分。
[0151]
缀合部分
[0152]
本技术的一个方面提供了可以掺入所述双抗体和/或标记试剂(例如,放射性核素)中的缀合部分。在一些实施方案中,掺入所述双抗体试剂中的缀合部分(例如,第一缀合部分)能够缀合到在体内掺入所述标记试剂(例如,放射性核素化合物)中的缀合部分(例如,第二缀合部分)。
[0153]
在一些实施方案中,所述第一缀合部分和第二缀合部分的缀合是非共价的。在一些实施方案中,所述第一缀合部分和第二缀合部分的缀合是共价的。
[0154]
在一些实施方案中,所述第一缀合部分和/或第二缀合部分各自包含彼此互补的核酸。在一些实施方案中,所述核酸是dna。在一些实施方案中,所述第一缀合部分和第二缀合部分通过dna
‑
dna杂交彼此缀合。
[0155]
在一些实施方案中,所述第一缀合部分和第二缀合部分通过两个缀合部分之间的共价键缀合。在一些实施方案中,所述第一缀合部分或第二缀合部分包含半胱氨酸残基、赖氨酸残基或酪氨酸残基。在一些实施方案中,所述第一缀合部分和第二缀合部分基于半胱氨酸残基的偶联(例如,通过二硫键)缀合。
[0156]
在一些实施方案中,所述第一缀合部分和第二缀合部分基于抗体
‑
药物缀合物缀合。
[0157]
点击化学
[0158]
在一些实施方案中,所述第一缀合部分和第二缀合部分各自包含点击化学对的成员,并且通过点击化学彼此缀合。本文描述的点击化学对是能够通过点击化学唯一地彼此反应的两个化学部分。
[0159]
在一些实施方案中,所述点击化学对选自下组:叠氮化物
‑
炔烃对、炔烃
‑
硝酮对、烯烃和四唑对以及异腈(例如异氰化物)和四嗪对。
[0160]
在一些实施方案中,所述点击化学基于叠氮化物
‑
炔烃huisgen环加成。在一些实施方案中,所述叠氮化物
‑
炔烃huisgen环加成是铜催化的。在一些实施方案中,所述叠氮化物
‑
炔烃huisgen环加成是无铜的。在一些实施方案中,所述缀合部分包含炔基的环状衍生物。在一些实施方案中,所述炔基的环状衍生物选自:环辛炔、二氟化环辛炔和二苯并环辛炔。在一些实施方案中,所述点击化学基于叠氮化物的应变促进的huisgen环加成。在一些实施方案中,所述点击化学基于应变烯烃的反应。
[0161]
在一些实施方案中,所述点击化学基于staudinger
‑
bertozzi连接,其中所述点击化学涉及叠氮化物和膦之间的偶联反应。
[0162]
在一些实施方案中,所述点击化学基于逆电子需求diels
‑
alder环加成,其中所述点击化学涉及应变烯烃和四嗪之间的偶联反应。在一些实施方案中,缀合部分包含或为反式环辛烯(tco)或四嗪(tz)。在一些实施方案中,所述第一缀合部分包含或为反式环辛烯(tco),而第二缀合部分包含或为四嗪(tz)。在一些实施方案中,所述第一缀合部分包含或
为tz,而第二缀合部分包含或为tco。在一些实施方案中,所述tz是6
‑
甲基取代的四嗪(6
‑
me四嗪)。在一些实施方案中,所述tz是6
‑
氢取代的四嗪(6
‑
h四嗪)。
[0163]
在一些实施方案中,所述缀合部分(例如,四嗪)还包含间隔区。在一些实施方案中,所述间隔区位于缀合部分和抗pd
‑
l1双抗体之间。在一些实施方案中,所述间隔区位于缀合部分和标记试剂之间。在一些实施方案中,所述间隔区是烷基间隔区。在一些实施方案中,所述间隔区是peg间隔区。在一些实施方案中,所述peg间隔区包含至少约1、2、3、4、5、6、7、8、9或10个乙二醇单元。在一些实施方案中,所述peg间隔区包含约1
‑
20、5
‑
15、8
‑
12或约10个乙二醇单元。
[0164]
iv.成像和治疗方法
[0165]
本技术的一个方面提供了使用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂确定个体中pd
‑
l1分布和/或表达水平的方法。
[0166]
在一些实施方案中,提供了确定个体中pd
‑
l1分布的方法,其包括:(a)向所述个体施用包含用放射性核素标记的抗pd
‑
l1双抗体(如本文所述的双抗体中的任一种)的成像剂;和(b)使用非侵入性成像技术使个体中的成像剂进行成像。在一些实施方案中,所述方法还包括基于所述个体的目标组织中的成像剂发出的信号,确定所述组织中pd
‑
l1的表达水平。在一些实施方案中,所述方法还包括通过用放射性核素标记抗pd
‑
l1双抗体来制备成像剂。在一些实施方案中,所述非侵入性成像技术包括单光子发射计算机断层扫描(spect)成像,或正电子发射断层扫描(pet)成像。在一些实施方案中,所述非侵入性成像技术还包括计算机断层扫描成像、磁共振成像、化学发光成像或电化学发光成像。在一些实施方案中,所述成像剂是经静脉内、腹膜内、肌内、皮下或口服施用的。在一些实施方案中,在施用成像剂后约10分钟至约24小时进行成像。在一些实施方案中,所述方法包括在一段时间内使个体成像。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述抗pd
‑
l1双抗体与螯合放射性核素的螯合化合物缀合。在一些实施方案中,所述螯合化合物是1,4,7
‑
三氮杂环壬烷
‑
1,4,7
‑
三乙酸(nota)、1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7,10
‑
四乙酸(dota)或其衍生物。在一些实施方案中,所述抗pd
‑
l1双抗体与来自非人类哺乳动物(例如小鼠、大鼠或猴子)的pd
‑
l1发生交叉反应。
[0167]
在一些实施方案中,提供了确定个体中pd
‑
l1分布的方法,其包括:(a)向个体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;(b)用非侵入性成像技术使个体中的成像剂成像,其中抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约5个氨基酸取代;以及b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约5个氨基酸取代。在一些实施方案中,提供了确定个体中pd
‑
l1分布的方法,其包括:(a)向个体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;以及(b)用非侵入性成像技术使个体中的成像剂成像,其中所述抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区
applications of radioisotopes,"在remington's pharmaceutical sciences,第18版,gennaro等(eds.),pp.624
‑
652(mack publishing co.,1990)中,以及brown,"clinical use of monoclonal antibodies,"在biotechnology and pharmacy227
‑
49,pezzuto等(eds.)(chapman&hall1993)中。在一些实施方案中,所述非侵入性成像技术使用发射正电子的放射性核素(pet同位素),如能量为约511kev,如
18
f、
68
ga、
64
cu和
124
i。可以通过公知的pet扫描技术对此类放射性核素进行成像。参见美国专利号6,953,567、9,884,131和国际专利申请公开号wo2016149188a1,以及kim hy.等,(2018)plos one 13(3):e0192821,其通过引用并入本文。
[0171]
在一些实施方案中,所述非侵入性成像技术包括单光子发射计算机断层扫描(spect)成像。在一些实施方案中,所述非侵入性成像技术包括正电子发射断层扫描(pet)成像。在一些实施方案中,所述spec或pet成像与一种或多种其他非侵入性成像方法结合,这些方法可基于或不基于来自成像剂的信号。例如,pet可以与计算机断层扫描(ct)成像、磁共振成像(mri)、化学发光成像或电化学发光成像结合。
[0172]
本文所述的成像方法适用于检测处于低、中或高表达水平的pd
‑
l1。在一些实施方案中,所述成像方法提供了有关pd
‑
l1的表达水平和分布的动态信息。在一些实施方案中,在可能对其他检测方法如免疫组织化学(ihc)法具有挑战性的情况下,所述成像方法能够检测pd
‑
l1。在一些实施方案中,例如,基于免疫组织化学(ihc)测定或其他测定,所述目标组织为pd
‑
l1阴性。可以用于检测pd
‑
l1存在或不存在的分子测定法,包括但不限于:基于聚合酶链反应(pcr)的测定、下一代测序(ngs)测定、杂交测定和elisa。在一些实施方案中,所述目标组织的pd
‑
l1表达水平较低。在一些实施方案中,所述目标组织仅在免疫细胞浸润时表达pd
‑
l1。
[0173]
可以使用任何合适的剂量和施用途径向个体施用成像剂。施用途径是根据已知的和公认的方法,如以合适的方式通过单次或多次推注或输注一段时间,例如经皮下、静脉内、腹膜内、肌内、动脉内、病灶内、关节内、肿瘤内或口服途径的注射或输注。确定适当的剂量或施用途径,完全在普通技术人员的技能范围内。动物实验为确定人类诊断应用的有效剂量提供了可靠的指导。可以按照以下文献中制定的原则进行有效剂量的种间缩放:mordenti,j.和chappell,w.“the use of interspecies scaling in toxicokinetics,”在toxicokinetics and new drug development,yacobi等,eds,pergamon press,new york 1989,pp.42
‑
46中。
[0174]
诊断和治疗
[0175]
本文所述方法可用于诊断,并作为伴随诊断方法用于治疗与异常免疫反应相关的多种疾病和病况。在一些实施方案中,所述疾病或病况与免疫缺陷有关。在一些实施方案中,所述疾病或病况是癌症、传染病、自身免疫疾病或代谢疾病。
[0176]
在一些实施方案中,提供了诊断患有疾病或病况的个体的方法,其包括:(a)使用本文所述的任一种确定pd
‑
l1的分布的方法确定所述个体中pd
‑
l1的分布;以及(b)如果在目标组织中检测到所述成像剂的信号,则将所述个体诊断为pd
‑
l1阳性;或者如果在目标组织中未检测到所述成像剂的信号,则将所述个体诊断为pd
‑
l1阴性。在一些实施方案中,所述疾病或病况是癌症、传染病、自身免疫疾病或代谢疾病。
[0177]
在一些实施方案中,提供了诊断患有疾病或病况的个体的方法,其包括:(a)向个
体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;(b)使用非侵入性成像技术使所述个体中的成像剂成像;(c)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或者如果未检测到成像剂的信号,则将个体诊断为pd
‑
l1阴性。在一些实施方案中,所述方法还包括基于通过所述个体的目标组织中的成像剂发出的信号,确定所述组织中pd
‑
l1的表达水平。在一些实施方案中,所述方法还包括通过用放射性核素标记抗pd
‑
l1双抗体来制备成像剂。在一些实施方案中,所述非侵入性成像技术包括单光子发射计算机断层扫描(spect)成像,或正电子发射断层扫描(pet)成像。在一些实施方案中,所述非侵入性成像技术还包括计算机断层扫描成像、磁共振成像、化学发光成像或电化学发光成像。在一些实施方案中,所述成像剂是经静脉内、腹膜内、肌内、皮下或口服施用的。在一些实施方案中,在施用成像剂后约10分钟至约24小时进行成像。在一些实施方案中,所述方法包括在一段时间内对个体进行成像。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述抗pd
‑
l1双抗体与螯合放射性核素的螯合化合物缀合。在一些实施方案中,所述螯合化合物是nota、dota或其衍生物。在一些实施方案中,所述抗pd
‑
l1双抗体与来自非人类哺乳动物(例如小鼠、大鼠或猴子)的pd
‑
l1交叉反应。在一些实施方案中,所述双抗体是人源化的。在一些实施方案中,所述疾病或病况是癌症、传染病、自身免疫疾病或代谢疾病。
[0178]
在一些实施方案中,提供了诊断患有疾病或病况的个体的方法,其包括:(a)向个体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;(b)使用非侵入性成像技术使个体中的成像剂成像;和(c)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或如果在目标组织处未检测到成像剂的信号,则将个体诊断为pd
‑
l1阴性;其中抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约5个氨基酸取代;以及b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约5个氨基酸取代。在一些实施方案中,提供了诊断患有疾病或病况的个体的方法,其包括:(a)向个体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;(b)使用非侵入性成像技术使个体中的成像剂成像;和(c)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或如果在目标组织处未检测到成像剂的信号,则将个体诊断为pd
‑
l1阴性;其中所述抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),且其中a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成结合域,所述结合域与包含第二重链可变区(v
h
‑2)和第二轻链可变区(v
l
‑2)的抗pd
‑
l1抗体竞争性地特异性结合pd
‑
l1,其中:a)所述v
h
‑2包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;以及b)所述v
l
‑2包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。在一些实
施方案中,提供了诊断患有疾病或病况的个体的方法,其包括:(a)向个体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;(b)使用非侵入性成像技术使个体中的成像剂成像;和(c)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或如果在目标组织处未检测到成像剂的信号,则将个体诊断为pd
‑
l1阴性;其中所述抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含hc
‑
cdr1、hc
‑
cdr2和hc
‑
cdr3,其分别包含具有如seq id no:22
‑
24中任一个所示序列的第二重链可变区(v
h
‑2)中的cdr1、cdr2和cdr3的氨基酸序列;以及b)所述v
l
包含lc
‑
cdr1、lc
‑
cdr2和lc
‑
cdr3,其分别包含具有如seq id no:25
‑
27中任一个所示序列的第二轻链可变区(v
l
‑2)中的cdr1、cdr2和cdr3的氨基酸序列。在一些实施方案中,所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且其中所述第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。
[0179]
在一些实施方案中,所述方法还包括基于通过所述个体的目标组织中的成像剂发出的信号,确定所述组织中pd
‑
l1的表达水平。在一些实施方案中,所述方法还包括通过用放射性核素标记双抗体来制备成像剂。在一些实施方案中,所述非侵入性成像技术包括单光子发射计算机断层扫描(spect)成像,或正电子发射断层扫描(pet)成像。在一些实施方案中,所述非侵入性成像技术还包括计算机断层扫描成像、磁共振成像、化学发光成像或电化学发光成像。在一些实施方案中,所述成像剂是经静脉内、腹膜内、肌内、皮下或口服施用的。在一些实施方案中,在施用成像剂后约10分钟至约24小时进行成像。在一些实施方案中,所述方法包括在一段时间内对个体进行成像。在一些实施方案中,所述抗pd
‑
l1双抗体是人源化的。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述抗pd
‑
l1双抗体与螯合放射性核素的螯合化合物缀合。在一些实施方案中,所述螯合化合物是nota、dota或其衍生物。在一些实施方案中,所述疾病或病况是癌症、传染病、自身免疫疾病或代谢疾病。
[0180]
本技术的一个方面提供了确定个体中pd
‑
l1分布和/或表达水平的方法,使用:a)有效量的抗pd
‑
l1双抗体试剂,其包含抗pd
‑
l1双抗体(如本文所述双抗体中任一种)和第一缀合部分;以及b)有效量的标记试剂(例如放射性核素化合物),其包含标记(例如放射性核素)和第二缀合部分,其中所述第一缀合部分和第二缀合部分在体内彼此缀合以提供成像剂。在一些实施方案中,所述方法还包括用非侵入性成像技术使个体中的成像剂成像。
[0181]
在一些实施方案中,提供了确定在个体中pd
‑
l1的分布的方法,其包括:a)向个体施用有效量的包含抗pd
‑
l1双抗体(如本文所述双抗体中任一种)和第一缀合部分的抗pd
‑
l1双抗体试剂;b)随后向个体施用有效量的包含放射性核素和第二缀合部分的放射性核素化合物,其中所述第一缀合部分和第二缀合部分在体内彼此缀合以提供成像剂;以及c)使用非侵入性成像技术使个体中的成像剂成像。在一些实施方案中,提供了确定个体中pd
‑
l1分布的方法,其包括向个体施用有效量的包含抗pd
‑
l1双抗体和第一缀合部分的抗pd
‑
l1双抗体剂,其中向个体施用有效量的包含放射性核素和第二缀合部分的放射性核素化合物,其中所述第一缀合部分和第二缀合部分在体内彼此缀合以提供成像剂。在一些实施方案中,提供了确定在已施用有效量的包含抗pd
‑
l1双抗体和第一缀合部分的抗pd
‑
l1双抗体试
剂的个体中的pd
‑
l1分布的方法,其包括向个体施用有效量的包含放射性核素和第二缀合部分的放射性核素化合物,其中所述第一缀合部分和第二缀合部分在体内彼此缀合以提供成像剂。
[0182]
在一些实施方案中,提供了确定在个体中pd
‑
l1的分布的方法,其包括:a)向个体施用有效量的包含抗pd
‑
l1双抗体和第一缀合部分的抗pd
‑
l1双抗体试剂;b)随后向个体施用有效量的包含放射性核素和第二缀合部分的放射性核素化合物,其中所述第一缀合部分和第二缀合部分在体内彼此缀合以提供成像剂;以及c)使用非侵入性成像技术使个体中的成像剂成像。在一些实施方案中,所述抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约5个氨基酸取代;以及b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中包含至多总共约5个氨基酸取代。在一些实施方案中,所述抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),且其中a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成结合域,所述结合域与包含第二重链可变区(v
h
‑2)和第二轻链可变区(v
l
‑2)的抗pd
‑
l1抗体竞争性地特异性结合pd
‑
l1,其中:a)所述v
h
‑2包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;以及b)所述v
l
‑2包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。在一些实施方案中,所述抗pd
‑
l1双抗体包含第一多肽和第二多肽,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含hc
‑
cdr1、hc
‑
cdr2和hc
‑
cdr3,其分别包含具有如seq id no:22
‑
24中任一个所示序列的第二重链可变区(v
h
‑2)中的cdr1、cdr2和cdr3的氨基酸序列;以及b)所述v
l
包含lc
‑
cdr1、lc
‑
cdr2和lc
‑
cdr3,其分别包含具有如seq id no:25
‑
27中任一个所示序列的第二轻链可变区(v
l
‑2)中的cdr1、cdr2和cdr3的氨基酸序列。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述第一缀合部分和第二缀合部分各自包含点击化学对的成员,并且通过点击化学彼此缀合。在一些实施方案中,所述第一缀合部分是反式环辛烯(tco),且所述第二缀合部分是四嗪(tz);或者所述第一缀合部分是tz,而所述第二缀合部分是tco。在一些实施方案中,所述放射性核素化合物在施用双抗体剂后立即施用。在一些实施方案中,在施用所述双抗体剂后约1小时至约100小时,施用所述放射性核素化合物。在一些实施方案中,所述放射性核素化合物和/或双抗体试剂包含螯合放射性核素的螯合化合物。在一些实施方案中,所述螯合化合物是1,4,7
‑
三氮杂环壬烷
‑
1,4,7
‑
三乙酸(nota)、1,4,7,10
‑
四氮杂环十二烷
‑
1,4,7,10
‑
四乙酸(dota)或其衍生物。在一些实施方案中,所述个体患有实体瘤、血液系统恶性肿瘤、传染病、自身免疫疾病或代谢疾病。
[0183]
治疗
[0184]
在一些实施方案中,提供了一种治疗患有疾病或病况的个体的方法,其包括:(a)使用本文所述的任何诊断方法来诊断个体;以及(b)如果个体被诊断为pd
‑
l1阳性,则向个体施用有效量的靶向pd
‑
l1或pd
‑
1的治疗剂。在一些实施方案中,所述治疗剂是pd
‑
l1或pd
‑
1的抑制剂。在一些实施方案中,所述治疗剂是特异性结合pd
‑
l1或pd
‑
1的放射性标记分子。在一些实施方案中,所述疾病或病况是癌症、传染病、自身免疫疾病或代谢疾病。在一些实施方案中,所述疾病或病况是膀胱、卵巢或前列腺疾病。
[0185]
在一些实施方案中,提供了一种治疗患有疾病或病况的个体的方法,其包括:(a)向个体施用包含用放射性核素标记的抗pd
‑
l1双抗体的成像剂;(b)使用非侵入性成像技术使个体中的成像剂成像;(c)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或者如果未检测到目标成像剂的信号,则将个体诊断为pd
‑
l1阴性;(d)如果个体被诊断为pd
‑
l1阳性,则向个体施用有效量的靶向pd
‑
l1或pd
‑
l1受体的治疗剂(例如,pd
‑
l1或pd
‑
1的抑制剂,或特异性结合pd
‑
l1或pd
‑
1的放射性标记分子)。在一些实施方案中,所述方法还包括基于通过所述个体的目标组织中的成像剂发出的信号,确定所述组织中pd
‑
l1的表达水平。在一些实施方案中,所述方法还包括通过用放射性核素标记pd
‑
l1来制备成像剂。在一些实施方案中,所述非侵入性成像技术包括单光子发射计算机断层扫描(spect)成像,或正电子发射断层扫描(pet)成像。在一些实施方案中,所述非侵入性成像技术还包括计算机断层扫描成像、磁共振成像、化学发光成像或电化学发光成像。在一些实施方案中,所述成像剂是经静脉内、腹膜内、肌内、皮下或口服施用的。在一些实施方案中,在施用成像剂后约10分钟至约24小时进行成像。在一些实施方案中,所述方法包括在一段时间内使个体成像。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述双抗体与螯合放射性核素的螯合化合物缀合。在一些实施方案中,所述螯合化合物是nota、dota或其衍生物。在一些实施方案中,所述抗pd
‑
l1双抗体与来自非人类哺乳动物(例如小鼠、大鼠或猴子)的pd
‑
l1交叉反应。在一些实施方案中,所述双抗体是人源化的。在一些实施方案中,所述疾病或病况是癌症、传染病、自身免疫疾病或代谢疾病。
[0186]
在一些实施方案中,所述个体患有癌症。所述癌症可包含非实体瘤(如血液肿瘤,例如白血病和淋巴瘤)或可包含实体瘤。可使用本文所述方法诊断的示例性癌症包括但不限于:癌、母细胞瘤和肉瘤,以及某些白血病或淋巴样细胞恶性肿瘤,可以是良性和恶性肿瘤,其中恶性肿瘤例如肉瘤、癌和黑素瘤。成人肿瘤/癌症和儿科肿瘤/癌症也包括在内。本文讨论的实体瘤或血液癌症包括但不限于:霍奇金淋巴瘤、非霍奇金淋巴瘤、肉瘤和癌如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、卡波西肉瘤、软组织肉瘤、子宫肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤(ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝瘤、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、威尔姆氏(wilm's)肿瘤、宫颈癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌和黑素瘤。
[0187]
根据美国联合癌症委员会(ajcc)分期小组的要求,本文所述方法适用于所有时期(包括i、ii、iii和iv期)的实体瘤或血液癌症。在一些实施方案中,所述实体瘤或血液癌症
hepatica)和大片吸虫(fasciola gigantica)、ffi朊病毒、丝虫目(filarioidea)总科、黄病毒(flaviviruses)、土拉弗朗西斯菌(francisella tularensis)、梭杆菌(fusobacterium)属、白地霉(geotrichum candidum)、肠贾第虫(giardia intestinalis)、颚口线虫种(gnathostoma spp)、gss朊病毒、瓜纳里多(guanarito)病毒、杜克雷嗜血杆菌(haemophilus ducreyi)、流感嗜血杆菌(haemophilus influenzae)、幽门螺杆菌(helicobacter pylori)、亨尼巴病毒(henipavirus)(hendra virus nipah virus,亨德拉病毒和尼帕病毒)、甲型肝炎病毒、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、丁型肝炎病毒、戊型肝炎病毒、单纯疱疹病毒1和2(hsv
‑
1和hsv
‑
2)、荚膜组织胞浆菌(histoplasma capsulatum)、hiv(人类免疫缺陷病毒)、威尼克外瓶霉(hortaea werneckii)、人博卡病毒(hbov)、人疱疹病毒6(hhv
‑
6)和人疱疹病毒7(hhv
‑
7)、人偏肺病毒(hmpv)、人乳头瘤病毒(hpv)、人副流感病毒(hpiv)、人t细胞白血病病毒1(htlv
‑
1)、日本脑炎病毒、jc病毒、胡宁(junin)病毒、卡波西肉瘤相关疱疹病毒(kshv)、金格杆菌(kingella kingae)、肉芽肿杆菌(klebsiella granulomatis)、克鲁(kuru)朊病毒、拉沙热(lassa)病毒、嗜肺军团菌(legionella pneumophila)、利什曼虫(leishmania)属、细螺旋体(leptospira)属、单核细胞增生性李斯特菌(listeria monocytogenes)、淋巴细胞性脉络膜脑膜炎病毒(lcmv)、马秋博(machupo)病毒、马拉色霉菌种(malassezia spp)、马尔堡(marburg)病毒、麻疹病毒、横川后殖吸虫(metagonimus yokagawai)、微孢子门(microsporidia phylum)、接触传染性软疣病毒(mcv)、腮腺炎病毒、麻风分枝杆菌(mycobacterium leprae)和麻风分枝杆菌新种(mycobacterium lepromatosis)、结核分枝杆菌(mycobacterium tuberculosis)、溃疡分枝杆菌(mycobacterium ulcerans)、肺炎支原体(mycoplasma pneumoniae)、福氏耐格原虫(naegleria fowleri)、美洲板口线虫(necator americanus)、淋病奈瑟氏球菌(neisseria gonorrhoeae)、脑膜炎奈瑟氏球菌(neisseria meningitidis)、星形诺卡氏菌(nocardia asteroides)、诺卡氏菌种(nocardia spp)、旋盘尾丝虫(onchocerca volvulus)、恙虫病东方体(orientia tsutsugamushi)、正粘病毒科(orthomyxoviridae)(流感)、巴西副球孢子菌(paracoccidioides brasiliensis)、并殖吸虫种(paragonimus spp)、肺吸虫(paragonimus westermani)、细小病毒b19、巴氏杆菌(pasteurella)属、疟原虫(plasmodium)属、杰氏肺囊虫(pneumocystis jirovecii)、脊髓灰质炎病毒、狂犬病毒、呼吸道合胞病毒(rsv)、鼻病毒(rhinovirus)、鼻病毒(rhinoviruses)、小蛛立克次氏体(rickettsia akari)、立克次氏体(rickettsia)属、普氏立克次氏体(rickettsia prowazekii)、立氏立克次氏体(rickettsia rickettsii)、斑疹伤寒立克次氏体(rickettsia typhi)、裂谷热(rift valley fever)病毒、轮状病毒、风疹病毒、沙比亚(sabia)病毒、沙门氏菌属、疥螨(sarcoptes scabiei)、sars冠状病毒、血吸虫(schistosoma)属、志贺氏菌(shigella)属、辛农布雷(sin nombre)病毒、汉坦病毒、申氏孢子丝菌(sporothrix schenckii)、葡萄球菌(staphylococcus)属、葡萄球菌属、无乳链球菌(streptococcus agalactiae)、肺炎链球菌(streptococcus pneumoniae)、化脓性链球菌(streptococcus pyogenes)、粪类圆线虫(strongyloides stercoralis)、绦虫(taenia)属、猪肉绦虫(taenia solium)、蜱传脑炎病毒(tbev)、犬弓蛔虫(toxocara canis)或猫弓蛔虫(toxocara cati)、刚地弓形虫(toxoplasma gondii)、梅毒螺旋体(treponema pallidum)、旋毛虫(trichinella spiralis)、阴道毛滴虫(trichomonas vaginalis)、毛癣
菌种(trichophyton spp)、毛首鞭虫(trichuris trichiura)、布鲁氏锥虫(trypanosoma brucei)、克鲁氏锥虫(trypanosoma cruzi)、解脲支原体(ureaplasma urealyticum)、水痘带状疱疹病毒(vzv)、水痘带状疱疹病毒(vzv)、大天花病毒或小天花病毒、vcjd朊病毒、委内瑞拉马脑炎病毒、霍乱弧菌、西尼罗河病毒、西方马脑炎病毒、班氏吴策线虫(wuchereria bancrofti)、黄热病毒、小肠结肠炎耶尔森氏菌(yersinia enterocolitica)、鼠疫耶尔森氏菌(yersinia pestis)和假结核耶尔森氏菌(yersinia pseudotuberculosis)。
[0192]
在一些实施方案中,所述个体患有自身免疫疾病。示例性的自身免疫疾病,包括但不限于:白塞氏病、全身性红斑狼疮、多发性硬化(全身性硬皮病和进行性全身性硬皮病)、硬皮病、多肌炎、皮肌炎、结节性动脉周围炎(结节性多动脉炎和显微镜下多血管炎)、主动脉炎综合征(大动脉炎)、恶性类风湿关节炎、类风湿关节炎、韦格纳(wegner's)肉芽肿、混合性结缔组织病、干燥综合征(sjogren syndrome)、成人型斯蒂尔(still’s)病、变应性肉芽肿性脉管炎、过敏性脉管炎、科根(cogan’s)综合征、rs3pe、颞动脉炎、风湿性多肌痛、纤维肌痛综合征、抗磷脂抗体综合征、嗜酸性筋膜炎、与igg4相关的疾病(例如,原发性硬化性胆管炎和自身免疫性胰腺炎)、格林
‑
巴利(guillain
‑
barre)综合征、重症肌无力、慢性萎缩性胃炎、自身免疫性肝炎、原发性胆汁性肝硬化,主动脉炎综合征、肺出血
‑
肾炎综合征(goodpasture’s syndrome)、快速进行性肾小球肾炎、巨幼细胞性贫血、自身免疫性溶血性贫血、自身免疫性中性粒细胞减少症、特发性血小板减少性紫癜、格雷夫斯(graves)病(甲状腺功能亢进症)、桥本氏(hashimoto's)甲状腺炎、自身免疫性肾上腺功能不全、原发性甲状腺功能减退症、特发性阿狄森氏病(慢性肾上腺功能不全)、i型糖尿病、慢性盘状红斑狼疮、局部硬皮病、银屑病、银屑病关节炎、天疱疮、类天疱疮、妊娠疱疹、线状iga大疱性皮肤病、后天性大疱性表皮松解、斑秃、白癜风、原田病、自身免疫性视神经病变、特发性精子缺乏症、复发性流产和炎性肠病(溃疡性结肠炎和克罗恩病)。
[0193]
在一些实施方案中,所述个体患有与异常免疫反应相关的代谢疾病。示例性代谢疾病,包括但不限于:炎性肠病、多发性硬化、牛皮癣、类风湿性关节炎和全身性红斑狼疮。
[0194]
v.制备方法
[0195]
制备成像剂的方法
[0196]
在一些实施方案中,提供了一种制备靶向pd
‑
l1的成像剂的方法。本文描述的成像剂可以通过如下文一般性描述的以及在实施例中更具体地描述的多个过程来制备。
[0197]
在一些实施方案中,提供了一种制备靶向pd
‑
l1的成像剂的方法,其包括:a)如本文所述将螯合化合物缀合至所述双抗体以提供抗pd
‑
l1双抗体缀合物;b)将放射性核素与抗pd
‑
l1双抗体缀合物接触,从而提供成像剂。在一些实施方案中,所述螯合化合物是nota、dota或其衍生物。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述螯合化合物与所述双抗体部分的赖氨酸缀合。在一些实施方案中,所述方法还包括从所述螯合化合物和/或放射性核素中分离成像剂。
[0198]
在一些实施方案中,提供了一种制备靶向pd
‑
l1的成像剂的方法,其包括:(a)将螯合化合物与抗pd
‑
l1双抗体(如本文所述双抗体中任一种)缀合以提供双抗体缀合物;(b)使放射性核素与所述双抗体缀合物接触,从而提供成像剂。在一些实施方案中,所述螯合化合
物是nota、dota或其衍生物。在一些实施方案中,所述方法包括将所述双抗体与所述螯合化合物在37℃下孵育。在一些实施方案中,所述孵育持续至少约20分钟、40分钟或60分钟。在一些实施方案中,所述放射性核素选自下组:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述螯合化合物与所述双抗体的赖氨酸缀合。在一些实施方案中,所述方法还包括从所述螯合化合物和/或放射性核素中分离成像剂。
[0199]
在一些实施方案中,提供了一种制备靶向pd
‑
l1的成像剂的方法,其包括:(a)将螯合化合物与放射性核素接触;(b)将螯合放射性核素的所述螯合化合物与本文所述抗pd
‑
l1双抗体中任一种缀合,从而提供成像剂。在一些实施方案中,所述螯合化合物是nota、dota或其衍生物。在一些实施方案中,所述放射性核素选自:
64
cu、
18
f、
67
ga、
68
ga、
111
in、
177
lu、
90
y、
89
zr、
61
cu、
62
cu、
67
cu、
19
f、
66
ga、
72
ga、
44
sc、
47
sc、
86
y、
88
y和
45
ti。在一些实施方案中,所述放射性核素为
68
ga。在一些实施方案中,所述螯合化合物与所述双抗体的赖氨酸缀合。在一些实施方案中,所述方法还包括从所述螯合化合物和/或放射性核素中分离成像剂。
[0200]
在一些实施方案中,提供了一种制备靶向pd
‑
l1的成像剂的方法,其包括:(a)将本文所述的抗pd
‑
l1双抗体缀合到p
‑
scn
‑
bn
‑
nota以提供抗pd
‑
l1双抗体缀合物;(b)将
68
ga与所述抗pd
‑
l1双抗体缀合物接触,从而提供成像剂。在一些实施方案中,所述方法包括在37℃将所述双抗体与p
‑
scn
‑
bn
‑
nota一起孵育。在一些实施方案中,所述孵育持续至少约20分钟、40分钟或60分钟。在一些实施方案中,所述双抗体缀合物通过使所述双抗体和p
‑
scn
‑
bn
‑
nota的混合物通过柱(例如,nap
‑
5柱)来分离。在一些实施方案中,通过使
68
ga与所述双抗体缀合物的混合物通过柱(例如,nap
‑
5柱)来分离成像剂。
[0201]
双抗体表达和产生
[0202]
本文所述的双抗体可以使用本领域任何已知的方法制备,包括下文和实施例中描述的那些。
[0203]
在一些实施方案中,提供了一种产生抗pd
‑
l1双抗体的方法,其包括:a)在有效表达所述双抗体的条件下培养如本文所述的分离的宿主细胞;b)从所述宿主细胞中获得表达的双抗体。在一些实施方案中,所述宿主细胞是cho细胞。
[0204]
核酸分子编码双抗体
[0205]
本技术进一步提供了分离的核酸分子,其包含编码本文所述的双抗体或双抗体一部分的多核苷酸。在一些实施方案中,核酸分子包含编码所述第一或第二多肽的重链可变区或轻链可变区的多核苷酸。在一些实施方案中,核酸分子包含编码本文所述双抗体的第一多肽和/或第二多肽的多核苷酸。在一些实施方案中,第一核酸分子包含编码本文所述抗pd
‑
l1双抗体的第一多肽的多核苷酸,并且第二核酸分子包含该相同双抗体的第二多核苷酸。
[0206]
在一些实施方案中,所述核酸分子还包含编码信号序列(如seq id no:35的信号序列)的多核苷酸。
[0207]
在一些实施方案中,所述核酸分子还包含编码标签(如his
‑
标签)的第二多核苷酸。
[0208]
在一些实施方案中,所述核酸分子包含seq id no:44、45、48
‑
51中任一个的核酸序列,或其变体,所述变体与seq id no:22
‑
24中任一个的核酸序列具有至少约80%(如至
少约80%、85%、90%、95%、96%、97%、98%或99%中任一个)序列同一性。
[0209]
核酸分子可以使用本领域常规的重组dna技术构建。在一些实施方案中,核酸分子是适合在选定宿主细胞中表达的表达载体。
[0210]
载体
[0211]
提供了包含编码本文所述的双抗体(例如,抗pd
‑
l1抗体部分)的多核苷酸的载体。还提供了包含编码本文所述双抗体一部分(如所述双抗体的第一或第二多肽的重链可变区或轻链可变区)的多核苷酸的载体。此类载体包括但不限于:dna载体、噬菌体载体、病毒载体、逆转录病毒载体等。在一些实施方案中,所述载体包含编码所述双抗体的第一或第二多肽的重链可变区或轻链可变区的多核苷酸序列。在一些实施方案中,所述载体包含编码所述双抗体的第一或第二多肽的多核苷酸序列。
[0212]
在一些实施方案中,选择了经优化以在cho或cho衍生的细胞、或nso细胞中表达多肽的载体。示例性的此类载体,描述于例如,running deer等,biotechnol.prog.20:880
‑
889(2004)。
[0213]
宿主细胞
[0214]
在一些实施方案中,本文所述的双抗体可在原核细胞(如细菌细胞)中表达;或在真核细胞中如真菌细胞(例如酵母)、植物细胞、昆虫细胞和哺乳动物细胞中表达。例如,可以根据本领域已知的方法进行这种表达。可用于表达多肽的示例性真核细胞,包括但不限于:cos细胞,包括cos7细胞;293细胞,包括293
‑
6e细胞;cho细胞,包括cho
‑
s、dg44.lec13 cho细胞和fut8 cho细胞;细胞(crucell);以及nso细胞。在一些实施方案中,可在酵母中表达本文所述的双抗体。参见例如,美国公开号us2006/0270045a1。在一些实施方案中,所述特定真核宿主细胞是基于其对双抗体的第一和/或第二多肽进行所需的翻译后修饰的能力来选择。例如,在一些实施方案中,所述cho细胞产生多肽,所述多肽具有比293细胞产生的相同多肽更高的唾液酸化水平。
[0215]
可通过任何方法将一种或多种核酸引入到所需的宿主细胞中,包括但不限于:磷酸钙转染、deae
‑
葡聚糖介导的转染、阳离子脂质介导的转染、电穿孔、转导、感染等。非限制性示例性方法,描述于例如,sambrook等,molecular cloning,a laboratory manual,第三版cold spring harbor laboratory press(2001)。可以根据任何合适的方法,将核酸瞬时或稳定地转染到所需的宿主细胞中。
[0216]
本发明还提供了包含本文所述的任何多核苷酸或载体的宿主细胞。在一些实施方案中,本发明提供了包含抗pd
‑
l1抗体的宿主细胞。任何能够过表达异源dna的宿主细胞都可以用于分离编码目的双抗体、多肽或蛋白的基因。哺乳动物宿主细胞的非限制性实例,包括但不限于:cos、hela和cho细胞。另参见pct公开号wo87/04462。合适的非哺乳动物宿主细胞,包括原核生物(如大肠杆菌(e.coli)或枯草芽孢杆菌(b.subtillis))和酵母菌(如酿酒酵母(s.cerevisae)、裂殖酵母(s.pombe);或乳杆菌(k.lactis))。
[0217]
在一些实施方案中,所述双抗体是在无细胞系统中产生的。非限制性示例性无细胞系统,描述于例如,sitaraman等,methods mol.biol.498:229
‑
44(2009);spirin,trends biotechnol.22:538
‑
45(2004);endo等,biotechnol.adv.21:695
‑
713(2003)。
[0218]
双抗体的纯化
[0219]
可以通过本领域已知的任何合适的方法纯化抗pd
‑
l1双抗体。此类方法包括但不
限于,使用亲和基质或疏水相互作用色谱法。示例性亲和纯化方法包括但不限于带组氨酸标签的蛋白质纯化。疏水相互作用色谱,例如丁基或苯基柱,可能适用于纯化双抗体。离子交换色谱法(例如阴离子交换色谱法和/或阳离子交换色谱法)也可能适用于纯化双抗体。混合模式色谱法(例如反相/阴离子交换、反相/阳离子交换、亲水相互作用/阴离子交换、亲水相互作用/阳离子交换等)也可能适用于纯化双抗体。
[0220]
vi.多核苷酸、核酸构建体、载体、宿主细胞和培养基
[0221]
多核苷酸
[0222]
在一些实施方案中,提供了编码本文所述双抗体中任一种或其一部分的多核苷酸。在一些实施方案中,提供了使用本文所述的任何一种方法制备的多核苷酸。
[0223]
在一些实施方案中,所述多核苷酸是dna。在一些实施方案中,所述多核苷酸是rna。在一些实施方案中,所述rna是mrna。在一些实施方案中,所述多核苷酸包含与seq id no:2、4、6、8、10、12、14、16、18和20中任一个的核酸序列具有至少约80%(如至少约80%、85%、90%、95%、96%、97%、98%或99%中任一个)序列同一性。
[0224]
核酸构建体
[0225]
在一些实施方案中,提供了包含本文所述多核苷酸中任一种的核酸构建体。在一些实施方案中,提供了使用本文所述的任何一种方法制备的核酸构建体。
[0226]
在一些实施方案中,所述核酸构建体还包含与多核苷酸可操作连接的启动子。在一些实施方案中,所述多核苷酸对应于基因,其中所述启动子是基因的野生型启动子。
[0227]
载体
[0228]
在一些实施方案中,提供了包含本文所述的任一种核酸构建体的载体。在一些实施方案中,提供了使用本文所述的任一种方法制备的载体。
[0229]
在一些实施方案中,所述载体是表达载体。
[0230]
在一些实施方案中,所述载体选自下组:质粒、噬菌体、粘粒、s因子、逆转录元件、逆转录病毒、病毒、人工染色体(例如,yac、bac或mac)、微型染色体和染色体。
[0231]
宿主细胞
[0232]
在一些实施方案中,提供了包含本文所述的任一种多肽、核酸构建体和/或载体的宿主细胞。在一些实施方案中,提供了使用本文所述的任一种方法制备的载体。
[0233]
在一些实施方案中,所述宿主细胞能够在发酵条件下产生本文所述的任一种抗pd
‑
l1双抗体。
[0234]
在一些实施方案中,所述宿主细胞是原核细胞。在一些实施方案中,所述宿主细胞是细菌细胞(例如,大肠杆菌细胞)。在一些实施方案中,所述宿主细胞是真核细胞。在一些实施方案中,所述宿主细胞是酵母细胞。在一些实施方案中,所述宿主细胞是动物细胞。在一些实施方案中,所述宿主细胞是哺乳动物细胞。在一些实施方案中,所述宿主细胞是cho细胞。
[0235]
培养基
[0236]
在一些实施方案中,提供了一种培养基,其包含本文所述的任一种双抗体、多核苷酸、核酸构建体、载体和/或宿主细胞。在一些实施方案中,提供了使用本文所述的任一种方法制备的培养基。
[0237]
在一些实施方案中,所述培养基包含次黄嘌呤、氨基蝶呤和/或胸苷(例如,hat培
养基)。在一些实施方案中,所述培养基不包含血清。在一些实施方案中,所述培养基包含血清。在一些实施方案中,所述培养基是d
‑
mem或rpmi
‑
1640培养基。
[0238]
vii.组合物、试剂盒和制品
[0239]
本文还提供了组合物(例如制剂),其包含本文所述的任何一种双抗体和/或标记试剂(例如,放射性核素化合物),编码任何一种双抗体的核酸,包含编码任何一种双抗体的核酸的载体,或包含所述核酸或载体的宿主细胞。
[0240]
可以通过将具有所需纯度的抗体试剂(如抗pd
‑
l1抗体试剂)和/或标记试剂(例如,放射性核素化合物)与任选的药学上可接受的载体、赋形剂或稳定剂混合,获得本文所述的抗pd
‑
l1双抗体和/或标记试剂(例如,放射性核素化合物)的合适制剂(remington's pharmaceutical sciences第16版,osol,a.ed.(1980)),其形式为冻干制剂或水溶液。可接受的载体、赋形剂或稳定剂在使用的剂量和浓度对接受者无毒,并包含缓冲剂如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六甲铵;苯扎氯铵,苄索氯铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3
‑
戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖,如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐的反离子如钠;金属络合物(例如,zn
‑
蛋白复合物);和/或非离子型表面活性剂,如tween
tm
、pluronics
tm
或聚乙二醇(peg)。wo97/04801中描述了适合皮下施用的冻干制剂。可以使用适合的稀释剂将这些冻干制剂重构为高蛋白浓度,并且该重构制剂可以经皮下施用于本文中待成像、诊断或治疗的个体。
[0241]
用于体内施用的制剂必须无菌。这可以通过例如无菌过滤膜的过滤来容易地完成。
[0242]
在一些实施方案中,提供了包含本文所述的任一种双抗体和螯合剂的试剂盒。在一些实施方案中,所述试剂盒还包含标记试剂(如放射性核素)。
[0243]
还提供了包含本文所述的任一种抗pd
‑
l1双抗体或双抗体试剂和/或标记试剂(例如,放射性核素化合物)的试剂盒。所述试剂盒可用于本文所述的任何成像、诊断和治疗方法。
[0244]
在一些实施方案中,提供了包含特异性结合pd
‑
l1的抗pd
‑
l1双抗体和缀合部分(例如,tco或tz)的试剂盒。
[0245]
在一些实施方案中,提供了试剂盒,其包含标记试剂,所述标记试剂包含标记(例如,放射性核素,如
68
ga),和缀合部分(例如,tco或tz)。在一些实施方案中,所述缀合部分还包含螯合放射性核素的螯合剂(例如,nota、dota或其衍生物)。
[0246]
在一些实施方案中,所述试剂盒还包含能够递送双抗体或双抗体试剂和/或标记试剂的装置。应用于诸如肠外递送的一类装置,是用于将组合物注射到受试者的体内的注射器。吸入装置也可用于某些应用。
[0247]
在一些实施方案中,所述试剂盒还包含用于治疗疾病或病况(例如癌症、传染病、自身免疫疾病或代谢疾病)的治疗剂。在一些实施方案中,所述治疗剂是pd
‑
l1或其受体(例如,pd
‑
1)的抑制剂。在一些实施方案中,所述治疗剂是特异性结合pd
‑
l1或其受体(例如,
pd
‑
1)的放射性标记分子。
[0248]
本技术的试剂盒被置于合适的包装内。合适的包装,包括但不限于:小瓶、瓶子、罐子、柔性包装(例如,密封的密拉(mylar)或塑料袋)等。试剂盒可以任选地提供其他组件如缓冲液和解释性信息。
[0249]
因此,本技术还提供了制品。所述制品可以包括容器以及在该容器上或与该容器粘合的标签或包装插页。合适的容器包括小瓶(例如密封小瓶)、瓶子、罐子、柔性包装等。通常,容器容纳有组合物,并可能具有无菌入口(例如,该容器可能是一个静脉输液袋或一个小瓶,带有可通过皮下注射针刺穿的塞子的小瓶)。所述标签或包装插页表明该组合物用于个体具体病况的成像、诊断或治疗。所述标签或包装插页将还包含用于将在该组合物施用于个体并用于对个体成像的说明。所述标签可表明重组和/或使用的方向。容纳该组合物的容器可为多种用途的小瓶,其允许重构制剂的重复施用(例如2
‑
6次施用)。包装插页是指通常包含在诊断产品的商业包装中的说明,其中该说明包含有关使用此类诊断产品的适应症、用法、剂量、施用、禁忌症和/或警告的信息。此外,该制品还可包括第二容器,该容器包含药学上可接受的缓冲液,如注射用抑菌水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和右旋糖溶液。其可能还包括从商业和用户角度出发所需的其他材料,包括其他缓冲液、稀释剂、过滤器、针头和注射器。
[0250]
所述试剂盒或制品可包括多个单位剂量的组合物和使用说明,并以足够存储和在药房(例如,医院药房和配制复方的药房)使用的数量包装。
[0251]
那些熟练的技术人员会认识到,在本发明的范围和精神内可以有多个实施方案。现在会参照以下非限制性实例更详细地描述本发明。以下实施例进一步说明了本发明,但是当然不应解释为以任何方式限制本发明的范围。
[0252]
示例性实施方案
[0253]
1.包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11中任一个的氨基酸序列的hc
‑
cdr3,或其变体,所述变体在hc
‑
cdr中包含至多总共约5个氨基酸取代;和b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20中任一个的氨基酸序列的lc
‑
cdr3,或其变体,所述变体在lc
‑
cdr中至多总共包含有约5个氨基酸取代。
[0254]
2.实施方案1的双抗体,其中:a)所述v
h
包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;和b)所述v
l
包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。
[0255]
3.包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),且其中a)第一多肽的v
h
和v
l
,b)第二多肽的v
h
和v
l
,c)第一多肽的v
h
和第二多肽的v
l
,或d)第二多肽的v
h
和第一多肽的v
l
形成结合域,所述结合域与包含第二重链可变区(v
h
‑2)和第二轻链可变区(v
l
‑2)的抗pd
‑
l1抗体竞争性地特异性结合pd
‑
l1,其中:a)所述v
h
‑2包含:含有seq id no:1的氨基酸序列的hc
‑
cdr1,含有seq id no:6的氨基酸序列的hc
‑
cdr2,以及含有seq id no:11的氨基酸序列的hc
‑
cdr3;和
b)所述v
l
‑2包含:含有seq id no:14的氨基酸序列的lc
‑
cdr1,含有seq id no:17的氨基酸序列的lc
‑
cdr2,以及含有seq id no:20的氨基酸序列的lc
‑
cdr3。
[0256]
4.包含第一多肽和第二多肽的分离的抗pd
‑
l1双抗体,其中所述第一多肽和第二多肽各自包含重链可变区(v
h
)和轻链可变区(v
l
),其中:a)所述v
h
包含hc
‑
cdr1、hc
‑
cdr2和hc
‑
cdr3,其分别包含具有如seq id no:22
‑
24中任一个所示序列的第二重链可变区(v
h
‑2)中的cdr1、cdr2和cdr3的氨基酸序列;和b)所述v
l
包含lc
‑
cdr1、lc
‑
cdr2和lc
‑
cdr3,其分别包含具有如seq id no:25
‑
27中任一个所示序列的第二轻链可变区(v
l
‑2)中的cdr1、cdr2和cdr3的氨基酸序列。
[0257]
5.实施方案1
‑
4中任一个的双抗体,其中第一多肽和第二多肽通过共价键连接。
[0258]
6.实施方案5的双抗体,其中所述共价键包含第一多肽的v
h
与第二多肽的v
l
之间的共价键,和/或第一多肽的v
l
与第二多肽的v
h
之间的共价键。
[0259]
7.实施方案1
‑
6中任一个的双抗体,其中所述第一多肽和第二多肽通过两个或更多个共价键连接。
[0260]
8.实施方案7的双抗体,其中所述两个或更多个共价键包含:a)第一多肽的v
h
和第二多肽的v
l
之间的第一共价键;以及b)第一多肽的v
h
和第二多肽的v
l
之间的第二共价键。
[0261]
9.实施方案5
‑
8中任一个的双抗体,其中所述共价键包含二硫键。
[0262]
10.实施方案7的双抗体,其中所述两个或更多个共价键包含至少两个二硫键。
[0263]
11.实施方案10的双抗体,其中所述至少两个二硫键包含:a)第一多肽的v
h
和第二多肽的v
l
之间的第一二硫键;以及b)第一多肽的v
h
和第二多肽的v
l
之间的第二二硫键。
[0264]
12.实施方案9
‑
11中任一个的双抗体,其中所述二硫键或至少两个二硫键中的一个由以下形成:a)第一多肽的hc
‑
fr2中的半胱氨酸残基和第二多肽的lc
‑
fr4中的半胱氨酸残基,和/或b)第一多肽的lc
‑
fr4中的半胱氨酸残基和第二多肽的hc
‑
fr2中的半胱氨酸残基。
[0265]
13.实施方案1
‑
12中任一个的双抗体,其中所述第一多肽和/或第二多肽中的v
h
包含根据kabat编号系统的g44c突变或q105c突变。
[0266]
14.实施方案1
‑
13中任一个的双抗体,其中所述第一多肽和/或第二多肽中的v
l
包含根据kabat编号系统的q100c突变或a43c突变。
[0267]
15.实施方案1
‑
14中任一个的双抗体,其中所述第一多肽和第二多肽中的v
h
各自包含g44c突变,并且其中所述第一多肽和第二多肽中的v
l
各自包含q100c突变,其中第一多肽的v
h
中的g44c和第二多肽的v
l
中的q100c形成第一二硫键,且其中第一多肽的v
l
中的q100c和第二多肽的v
h
中的g44c形成第二二硫键。
[0268]
16.实施方案1
‑
14中任一个的双抗体,其中所述第一多肽和第二多肽中的v
h
各自包含q105c突变,并且其中所述第一多肽和第二多肽中的v
l
各自包含a43突变。
[0269]
17.实施方案1
‑
16中任一个的双抗体,其中所述第一多肽的v
h
和v
l
通过肽接头彼此融合。
[0270]
18.实施方案1
‑
17中任一个的双抗体,其中所述第二多肽的v
h
和v
l
经由肽接头彼此融合。
[0271]
19.实施方案17或18的双抗体,其中所述肽接头具有约1
‑
30个氨基酸的长度。
[0272]
20.实施方案17
‑
19中任一项的双抗体,其中所述肽接头含有seq id no:28
‑
34中
任一个的氨基酸序列。
[0273]
21.实施方案1
‑
20中任一个的双抗体,其中所述第一多肽或第二多肽还包含与所述多肽的n
‑
末端融合的信号肽。
[0274]
22.实施方案21的双抗体,其中所述信号肽含有seq id no:35的氨基酸序列。
[0275]
23.实施方案1
‑
22中任一项的双抗体,其中所述v
h
含有seq id no:22
‑
24中任一个的氨基酸序列。
[0276]
24.实施方案1
‑
23中任一个的双抗体,其中所述v
l
含有seq id no:25
‑
27中任一个的氨基酸序列。
[0277]
25.实施方案1
‑
24中任一个的双抗体,其中所述第一多肽和/或第二多肽还包含标签。
[0278]
26.实施方案25的双抗体,其中所述标签融合到所述第一多肽和/或第二多肽的c末端。
[0279]
27.实施方案25或实施方案26的双抗体,其中所述标签包含his
‑
标签。
[0280]
28.实施方案25
‑
27中任一项的双抗体,其中所述标签通过第二接头与所述多肽融合。
[0281]
29.实施方案28的双抗体,其中所述第二接头具有约4
‑
15个氨基酸的长度。
[0282]
30.实施方案28或实施方案29的双抗体,其中所述第二接头含有ggggs的氨基酸序列。
[0283]
31.实施方案1
‑
30中任一个的双抗体,其中所述第一多肽和/或第二多肽包含seq id no:36
‑
43中任一个的氨基酸序列。
[0284]
32.一种药物组合物,其包含实施方案1
‑
31中任一个的双抗体和药学上可接受的载体。
[0285]
33.编码实施方案1
‑
31中任一个的双抗体的多核苷酸。
[0286]
34.包含实施方案33的多核苷酸的核酸构建体,任选地还包含与所述多核苷酸可操作连接的启动子。
[0287]
35.包含实施方案34的核酸构建体的载体。
[0288]
36.一种分离的宿主细胞,其包含根据实施方案33的多核苷酸、实施方案34的核酸构建体或实施方案35的载体。
[0289]
37.一种培养基,其包含实施方案1
‑
31中任一个的双抗体、实施方案33的多核苷酸、实施方案34的核酸构建体、实施方案35的载体或实施方案36的宿主细胞。
[0290]
38.一种产生抗pd
‑
l1双抗体的方法,其包括:a)在有效表达双抗体的条件下培养实施方案36的分离的宿主细胞;以及b)从所述宿主细胞中获得表达的双抗体。
[0291]
39.一种确定个体中pd
‑
l1分布的方法,其包括:a)向个体施用包含标记有放射性核素的实施方案1
‑
31中任一个的双抗体的成像剂;以及b)使用非侵入性成像技术使个体中的成像剂成像。
[0292]
40.一种诊断患有疾病或病况的个体的方法,其包括:a)使用实施方案39的方法确定个体中的pd
‑
l1分布;以及b)如果在目标组织处检测到成像剂的信号,则将个体诊断为pd
‑
l1阳性,或者如果在目标组织中未检测到成像剂的信号,则将个体诊断为pd
‑
l1阴性。
[0293]
41.一种治疗患有疾病或病况的个体的方法,其包括:a)使用实施方案40的方法诊
断个体;以及b)如果个体被诊断为pd
‑
l1阳性,则向个体施用有效量的靶向pd
‑
l1的治疗剂。
[0294]
42.一种治疗患有疾病或病况的个体的方法,其包括向个体施用有效量的实施方案1
‑
31中任一个的双抗体或实施方案32的药物组合物。
[0295]
43.一种成像剂,包含用放射性核素标记的实施方案1
‑
31中任一个的双抗体。
[0296]
44.一种制备靶向pd
‑
l1的成像剂的方法,其包括:a)将螯合化合物与实施方案1
‑
31中任一个的双抗体缀合以提供抗pd
‑
l1双抗体缀合物;以及b)将放射性核素与所述抗pd
‑
l1双抗体缀合物接触,从而提供成像剂。
[0297]
45.一种试剂盒,其包括:a)实施方案1
‑
31中任一个的双抗体;以及b)螯合剂。
[0298]
46.实施方案45的试剂盒,还包含放射性核素。
[0299]
47.一种确定个体中pd
‑
l1分布的方法,其包括:向个体施用有效量的双抗体试剂,所述双抗体试剂包含实施方案1
‑
31中任一个的双抗体和第一缀合部分;随后向个体施用有效量的放射性核素化合物,所述放射性核素化合物包含放射性核素和第二缀合部分,其中所述第一缀合部分和第二缀合部分在体内彼此缀合以提供成像剂;以及使用非侵入性成像技术使所述个体中的成像剂成像。
[0300]
48.实施方案47的方法,其中所述第一缀合部分和第二缀合部分各自包含点击化学对的成员,并且通过点击化学彼此缀合。
实施例
[0301]
以下实施例旨在纯粹作为本发明的示例,因此不应看作以任何方式限制本发明。以下实施例和详细说明仅以示例说明的方式而非以限制的方式提供。
[0302]
实施例1:抗hpd
‑
l1 scfv的生成
[0303]
抗hpd
‑
l1 scfv的构建体设计示意图如图1所示。具体而言,人工合成包含来自人源化抗hpd
‑
l1抗体的v
h
和v
l
抗原结合域和介于两者之间的肽接头的片段。参见图1中的构建体a。此外,单链二硫键稳定的fv片段(sc
‑
dsfv),也通过在v
h
44/v
l
100或v
h
105/v
l
43(根据kabat系统编号)引入单突变来构建。参见图1中的构建体b和构建体c。三种构建体的v
h
和v
l
序列参见表3。含有v
h
和v
l
的片段还包括分别位于5'和3'末端的限制性内切核酸酶hindiii和ecori识别位点,以及通过短的肽接头连接到c末端的his融合标签序列。然后将融合的重链和轻链克隆到pxc17.4表达载体的相应hindiii和ecori识别位点。
[0304]
表3:抗pd
‑
l1 scfv的序列
[0305][0306][0307]
实施例2:抗pd
‑
l1双抗体构建和表达
[0308]
对应于双抗体构建的单体形式的方案显示在图2中。具体而言,v
h
(g44c)和v
l
(q100c)基因片段是通过pcr从图1的构建体b生成的。v
h
(q105c)和v
l
(a43c)基因片段通过pcr从图1的构建体c生成。v
h
(g44c)和v
l
(q100c)基因片段通过重叠pcr融合在一起,并命名为h44/l100;v
h
(q105c)和v
l
(a43c)基因片段通过重叠pcr融合在一起,并命名为h105/l43。在pcr和重叠pcr中使用的pcr引物参见表4。
[0309]
表4:pcr引物
[0310][0311]
h44/l100和h105/l43pcr产物分别被hindiii和ecori消化。将消化产物插入pxc17.4表达载体。瞬时转染后5天,在cho细胞中评价两种产物的表达。收获细胞培养上清液,并通过captol亲和柱纯化由h44/l100或h105/l43消化的pcr产物的表达生成的蛋白质产物。表达结果显示在表5中。分析纯化的h44/l100蛋白质的双抗体形式和单体形式的比率。大约85%的总蛋白质是双抗体形式。双抗体形式通过尺寸排阻色谱或离子交换色谱纯化,纯度为100%。
[0312]
表5:
[0313]
30ml培养基中的产物纯化蛋白的量(双抗体和单体)h44/l100~5mgh105/l43<50μg
[0314]
实施例3:抗pd
‑
l1双抗体和抗pd
‑
l1 scfv的pd
‑
l1结合亲和力
[0315]
抗pd
‑
l1双抗体(h44/l100)如实施例2所示生成,抗pd
‑
l1 scfv从图1的构建体a生成,并测试了抗pd
‑
l1 igg抗体(具有相同的cdr)的pd
‑
l1结合亲和力。如表6所示,双抗体形式对pd
‑
l1的结合亲和力出乎意料地高于scfv形式。
[0316]
表6:
[0317]
样品k
d
范围(m)相对结合活性scfv形式5x10
‑8–
10
‑7 双抗体形式10
‑
10
‑
10
‑9 igg形式10
‑
11
‑
10
‑
10
[0318]
实施例4:抗pd
‑
l1
‑
scfv和nota的偶联以及用
68
ga标记nota
‑
抗pd
‑
l1 scfv
[0319]
nota与从图1的构建体a生成的抗pd
‑
l1 scfv偶联。偶联后,用同位素
68
ga标记抗pd
‑
l1 scfv。具体而言,将总体积400μl抗pd
‑
l1
‑
scfv添加到100μl 0.05m nahco3‑
na2co3缓冲液中,ph为8.7,然后以16000rpm离心20分钟。去除上清液以达到100μl的最终体积。再重复上述步骤一次,并将最终溶液转移到1.5ml离心管中。然后将2.75μl体积的p
‑
scn
‑
bn
‑
nota添加到离心管中,然后在37℃孵育1小时。
[0320]
将scfv/nota溶液添加到已用pbs预平衡的nap
‑
5柱中。然后用0.4ml pbs洗涤该柱,并用0.5ml pbs洗脱。将洗脱液等分成体积为0.05ml的部分,并储存于
‑
20℃。
[0321]
68
ga被洗脱到0.05n hcl,最终浓度为2.4mci/1mlhcl。然后加入体积为93μl的1.25m乙酸钠以将
68
ga溶液的ph值调节至4.0。将体积为50μl的nota
‑
抗
‑
pd
‑
l1 scfv(0.05mg/ml)与350ul 68
ga溶液混合,然后在25℃孵育10分钟。通过使用0.1m柠檬酸钠作为显影溶剂在薄层色谱纸上显影来确定标记率。nap
‑
5柱用pbs平衡,然后加入400ul体积的标
记产物。过滤后,加入400ul pbs。未收集滤液。然后加入400ul pbs,并收集滤液。通过使用0.1m柠檬酸钠作为显影溶剂在即时薄层色谱硅胶(itlc
‑
sg)上显影来确定产物的放射化学纯度。来源对应于产物,显影溶剂前端对应于游离
68
ga。
[0322]
如图3a
‑
3b所示,
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
scfv的标记率为66.9%。纯化后,放射化学纯度为95.9%。
[0323]
实施例5:
68
ga
‑
抗
‑
pd
‑
l1
‑
scfv的细胞结合
[0324]
用胰蛋白酶消化mc38和mc38
‑
b7h1细胞,然后培养并计数。每种类型的细胞以每孔2.5x105个细胞/0.5ml接种到24孔板中。在37℃过夜孵育后,将
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
scfv以36nm的最终浓度添加到每种类型的细胞中,并将细胞在37℃保持0.5小时。随后,加入冰冷的pbs洗涤细胞3次。然后用0.1m naoh裂解细胞。收集细胞裂解物并计数。使用graphpadprism软件进行数据分析和绘图。
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
scfv与mc38
‑
b7h1细胞或mc38细胞的结合显示于图4a。
[0325]
在单独的实验中,用胰蛋白酶消化mc38
‑
b7h1细胞,然后培养并计数。将细胞以每孔2.5x105个细胞/0.5ml接种到24孔板中。在37℃过夜孵育后,将
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
scfv以36nm的最终浓度添加到细胞中,存在或不存在终浓度为1.8μm的未标记抗pd
‑
l1 scfv。然后将细胞在37℃保持0.5小时。随后,加入冰冷的pbs洗涤细胞3次。然后用0.1m naoh裂解细胞。收集细胞裂解物并计数。使用graphpadprism软件进行数据分析和绘图。如图所示。如图4b所示,
68
ga
‑
nota
‑
抗pd
‑
l1
‑
scfv与mc38
‑
b7h1细胞的结合被未标记的抗pd
‑
l1
‑
scfv显著阻断。
[0326]
实施例6:
68
ga
‑
抗pd
‑
l1
‑
scfv的体内成像
[0327]
同时对总共10只约6
‑
8周大的雄性小鼠施用mc38细胞和mc38
‑
b7h1细胞。具体而言,将40万个mc38细胞注射到小鼠的左胁腹,将40万个mc38
‑
b7h1细胞注射到右胁腹。注射7天后,肿瘤生长到直径约0.5厘米的大小。然后将小鼠用于体内成像。通过尾静脉给5只小鼠施用40μci 68
ga
‑
抗
‑
抗
‑
pd
‑
l1
‑
scfv。其他5只小鼠以1:50的摩尔比同时施用40μci 68
ga
‑
抗
‑
抗
‑
pd
‑
l1
‑
scfv和未标记的冷抗
‑
pd
‑
l1抗体。在注射后1小时和2小时对小鼠进行成像。
[0328]
仅注射
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
scfv后,mc38
‑
b7h1肿瘤(右胁腹)被强烈染色。mc38肿瘤(左胁腹)染色较弱,肾脏摄入量最高。注射后120分钟的图像,比注射后60分钟的图像灵敏度更高。参见图5a。如图5b所示,50倍过量的未标记抗pd
‑
l1抗体,阻断了注射未标记抗pd
‑
l1抗体和
68
ga
‑
nota
‑
抗pd
‑
l1
‑
scfv的小鼠中b7
‑
h1阳性肿瘤的成像。参见图5b。
[0329]
实施例7:抗pd
‑
l1双抗体与nota的偶联和
68
ga标记nota
‑
抗pd
‑
l1双抗体
[0330]
nota与由h44/l100产物产生的抗pd
‑
l1双抗体偶联,如实施例2所示。偶联后,用同位素
68
ga标记抗pd
‑
l1双抗体。具体而言,将400μl抗pd
‑
l1双抗体加入100μl 0.05m nahco3‑
na2co3缓冲液中,该缓冲液的ph值为8.7,然后以16000rpm离心20分钟,并浓缩至100μl。然后将其加入400μl 0.05m nahco3‑
na2co3缓冲液中,以16000rpm离心20分钟。去除上清液以达到100μl的最终体积。将最终溶液转移到1.5ml离心管中。然后将2.75μl体积的p
‑
scn
‑
bn
‑
nota添加到离心管中,然后在37℃孵育1小时。
[0331]
将双抗体/nota溶液添加到已用pbs预平衡的nap
‑
5柱中。然后用0.4ml pbs洗涤该柱,并用0.5ml pbs洗脱。将洗脱液等分成体积为0.05ml的部分,并储存于
‑
20℃。
[0332]
68
ga被洗脱到0.05n hcl,最终浓度为2.4mci/1ml hcl。然后加入体积为93μl的
1.25m乙酸钠以将
68
ga溶液的ph值调节至4.0。将体积为50μl的nota
‑
抗pd
‑
l1双抗体(1.0mg/ml)与350ul 68
ga溶液混合,然后在25℃孵育10分钟。通过使用0.1m柠檬酸钠作为显影溶剂在薄层色谱纸上显影来确定标记率。nap
‑
5柱用pbs平衡,然后加入400ul体积的标记产物。过滤后,加入400μl pbs。未收集滤液。然后加入400μl pbs并收集滤液。通过使用0.1m柠檬酸钠作为显影溶剂在即时薄层色谱硅胶(itlc
‑
sg)上显影来确定产物的放射化学纯度。来源对应于产物,显影溶剂前端对应于游离
68
ga。
[0333]
如图6a
‑
6b所示,
68
ga
‑
nota
‑
抗pd
‑
l1
‑
双抗体的标记率为62.0%。纯化后,
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
双抗体的放射化学纯度为98.1%。
[0334]
实施例8:
68
ga
‑
抗
‑
pd
‑
l1
‑
双抗体的细胞结合实验
[0335]
用胰蛋白酶消化mc38和mc38
‑
b7h1细胞,然后培养并计数。每种类型的细胞以每孔2.5x105个细胞/0.5ml接种到24孔板中。在37℃过夜孵育后,将
68
ga
‑
nota
‑
抗pd
‑
l1
‑
双抗体以36nm的最终浓度添加到每种类型的细胞中,并将细胞在37℃保持0.5小时。随后,加入冰冷的pbs洗涤细胞3次。然后用0.1m naoh裂解细胞。收集细胞裂解物并计数。使用graphpadprism软件进行数据分析和绘图。如图所示。如图7a所示,
68
ga
‑
nota
‑
抗pd
‑
l1
‑
双抗体与mc38
‑
b7h1细胞的结合高于其与mc38细胞的结合
[0336]
在单独的实验中,用胰蛋白酶消化mc38
‑
b7h1细胞,然后培养并计数。将细胞以每孔2.5x105个细胞/0.5ml接种到24孔板中。在37℃过夜孵育后,将
68
ga
‑
nota
‑
抗pd
‑
l1
‑
双抗体以36nm的最终浓度添加到细胞中,存在或不存在具有1.8μm终浓度的未标记的抗pd
‑
l1双抗体。然后将细胞在37℃保持0.5小时。随后,加入冰冷的pbs洗涤细胞3次。然后用0.1m naoh裂解细胞。收集细胞裂解物并计数。使用graphpadprism软件进行数据分析和绘图。
68
ga
‑
nota
‑
抗
‑
pd
‑
l1
‑
双抗体与mc38
‑
b7h1细胞的结合被未标记的抗
‑
pd
‑
l1双抗体显著阻断。参见图7b。
[0337]
实施例9:
68
ga
‑
抗pd
‑
l1
‑
双抗体的体内成像
[0338]
同时对总共10只约6
‑
8周大的雄性小鼠施用mc38细胞和mc38
‑
b7h1细胞。具体而言,将40万个mc38细胞注射到小鼠的左胁腹,将40万个mc38
‑
b7h1细胞注射到右胁腹。注射7天后,肿瘤长到直径约0.5厘米的大小。然后将小鼠用于体内成像。通过尾静脉给5只小鼠施用40uci 68
ga
‑
抗
‑
抗
‑
pd
‑
l1
‑
双抗体。其他5只小鼠以1:50的摩尔比同时施用40uci 68
ga
‑
抗
‑
抗
‑
pd
‑
l1
‑
双抗体和未标记的冷抗
‑
pd
‑
l1抗体。在注射后1小时和2小时对小鼠进行成像。
[0339]
仅注射
68
ga
‑
nota
‑
抗pd
‑
l1
‑
双抗体后,mc38
‑
b7h1肿瘤(右胁腹)被强烈染色。mc38肿瘤(左胁腹)染色较弱,肾脏摄入量最高。注射后120分钟的图像比注射后60分钟的图像灵敏度更高。参见图8a。在注射了未标记的抗pd
‑
l1抗体和
68
ga
‑
nota
‑
抗pd
‑
l1双抗体的小鼠中,50倍过量的未标记抗pd
‑
l1抗体阻断了b7h1阳性肿瘤的成像。参见图8b。
[0340]
实施例10:
68
ga
‑
抗
‑
pd
‑
l1
‑
scfv和
68
ga
‑
抗
‑
pd
‑
l1
‑
双抗体成像的比较
[0341]
注射
68
ga
‑
抗pd
‑
l1
‑
scfv和
68
ga
‑
抗pd
‑
l1
‑
双抗体后1小时的代表性成像比较,表明
68
ga
‑
抗pd
‑
l1
‑
双抗体优于
68
ga
‑
抗
‑
pdl1
‑
scfv,具有更清晰的成像。参见图9。它还具有更高的肝脏摄入量。
[0342]
上述实施例至少表明,
68
ga标记的双抗体可用于成像pd
‑
l1阳性肿瘤。
[0343]
序列表
[0344]
[0345]
[0346]
[0347]
[0348]
[0349]
[0350]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。