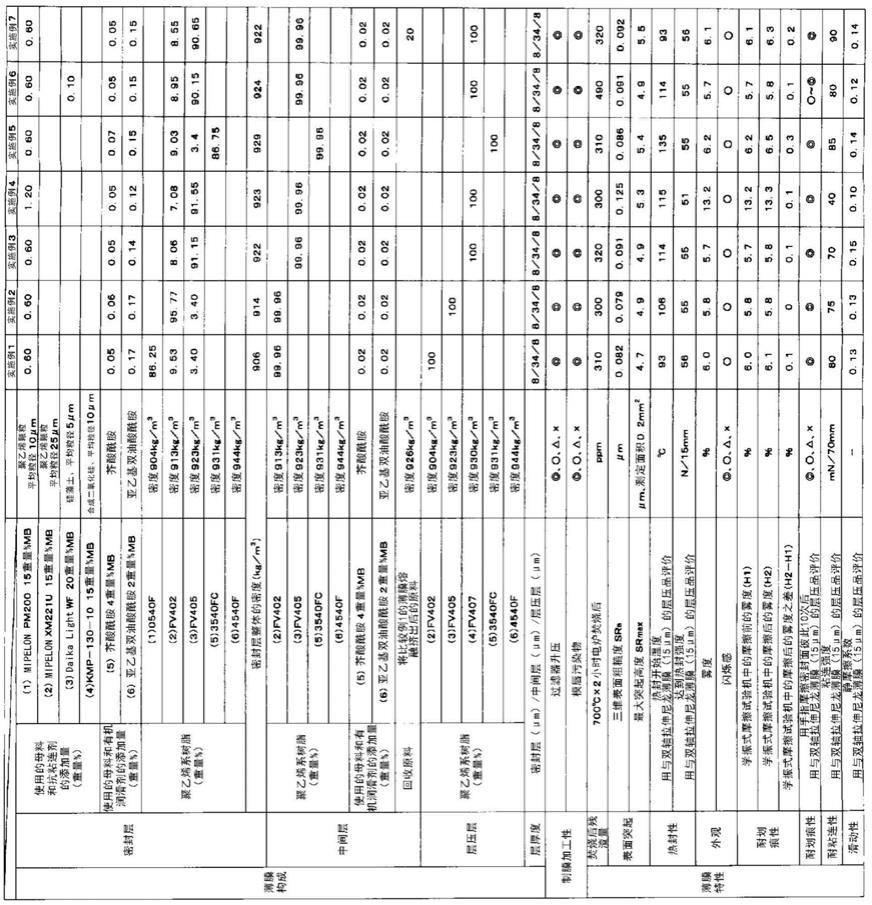
一种编码大豆ftsh金属蛋白酶基因gmftsh25及其应用
技术领域
1.本发明属于植物基因工程领域,涉及一种编码大豆ftsh金属蛋白酶基因gmftsh25及其应用。
背景技术:
2.光合作用被称为“地球上最重要的化学反应”,利用太阳光能和无机物co2与h2o形成的有机物不仅为植物的生命活动提供必需的能量,是几乎所有形式的生命(微生物、植物、动物和人类)赖以生存、发展和繁荣的前提。对植物而言,大约90%
‑
95%的干物质都来源于光合产物,通过提高农作物的光能利用效率来提高作物产量是一个重要的途径,目前已经有很多研究证明其可行性:如通过人工设计和改造植物光呼吸过程,成功抑制了c3作物的光呼吸作用,使得c3作物的产量提高(south et al.,2019);另外还有利用光遗传学控制气孔开关,使生物量增加2.2倍(papanatsiou et al.,2019);通过人工创建细胞核源d1蛋白合成新途径,使得水稻增产幅度达到8.1%
‑
21.0%(chen et al.,2020)。大豆作为c3作物,光合效率低是限制其产量提高的重要内在因素,所以利用基因工程手段修饰光合相关调节基因并解析其生物学功能,对于揭示光能的高效吸收、传递和转化过程的机理,还能为提高大豆光能利用效率、进而提高大豆产量提供理论依据。
3.ftsh是一种与膜相关的atp依赖性zn金属蛋白酶复合物,其具有aaa结构域和一个包含zn
2
结合的h
‑
e
‑
x
‑
x
‑
h基序(ito and akiyama,2005)。陆地植物具有多个ftsh直系同源物。在拟南芥中发现了12个ftsh同源物,其中有9个位于叶绿体,3个位于线粒体(sakamoto et al.,2003)。var1(atftsh5)或var2(atftsh2)的突变导致典型的叶片斑驳表现型和对光抑制的敏感性,并且已经发现atftsh8和atftsh1分别与atftsh2和atftsh5形成二聚体发挥作用,共同参与psii反应中心d1蛋白的光损伤降解(sakamoto et al.,2003)。除此之外,有报道表明敲除atftsh12突变体的种子不能正常发育,在早期就出现发育停滞的现象(meinke et al.,2008)。可见,ftsh蛋白酶在多个方面调节着植物的生长发育,一个具体的ftsh蛋白酶究竟具有何种生物功能,是无法预料的。目前,大豆中该类蛋白的研究报道极少,因此在大豆中研究ftsh基因对于解析其在调节大豆生长发育方面的生物学功能具有重要意义。
技术实现要素:
4.本发明的目的在于公开一种编码大豆ftsh金属蛋白酶基因gmftsh25在调节大豆光合作用方面的应用,该基因可作为目的基因稳定转化于大豆中,通过过量表达gmftsh25提高大豆的净光合速率进而为大豆高光效育种提供理论基础。
5.本发明的目的通过如下技术方案实现:
6.大豆ftsh金属蛋白酶基因gmftsh25,其cds核苷酸序列为:seq id no.1。
7.大豆ftsh金属蛋白酶基因gmftsh25,其氨基酸序列为:seq id no.2。
8.过表达本发明所述的编码大豆ftsh金属蛋白酶基因gmftsh25的重组表达载体。
9.作为本发明的一种优选,所述的重组表达载体是将所述的大豆ftsh金属蛋白酶基因gmftsh25插入过表达载体pba002中得到。
10.本发明所述的大豆ftsh金属蛋白酶基因gmftsh25在调节大豆光合作用方面的应用,就是利用根癌农杆菌介导的大豆子叶节转化方法将上述包含ftsh金属蛋白酶基因gmftsh25的重组质粒导入目的植物大豆中,获得gmftsh25过量表达的转基因大豆植株,所述转基因植株相比于对照植株的光合效率得到了显著提高。
11.本发明所述的重组表达载体在提高转基因大豆后代的净光合速率中的应用。
12.本发明的有益效果:
13.本发明发现在大豆中过量表达gmftsh25基因可以调节光合作用效率。通过对过表达转基因植株和对照植株的光合效率的测定发现,在1000μmol m
‑2s
‑1的光密度条件下,转基因植株的净光合速率显著高于对照,同时发现转基因植株在苗期的表现型也优于对照植株。因此,本发明成果可运用于通过生物技术调节gmftsh25基因的表达,对于揭示大豆光能高效传递转化及高光效育种具有重要意义。
14.携带有本发明所述的gmftsh25植物表达载体可通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并利用植物组织培养技术再生成植株。被转化的宿主既可以是水稻、小麦、玉米等单子叶植物,也可以是大豆、黄瓜、番茄和苜蓿等双子叶植物。
附图说明
15.图1pba002
‑
gmftsh25过表达载体图谱。注:gmftsh25 cds:目的基因gmftsh25的编码区;camv 35s promoter:花椰菜花叶病毒(camv)35s启动子;nos terminator:胭脂碱合成酶基因终止子;nos promoter:胭脂碱合成酶基因启动子;bar:膦丝菌素乙酰转移酶基因;e9terminator:核酮糖-1,5二磷酸羧化酶e9基因小亚基3’端序列;
16.sacⅰ:sacⅰ限制性内切酶酶切位点;mluⅰ:mluⅰ限制性内切酶酶切位点。lb t
‑
dna repeat:t
‑
dna左边界;rb t
‑
dna repeat:t
‑
dna右边界;primer f:扩增目的基因gmftsh25的上游引物;primer r:扩增目的基因gmftsh25的下游引物。该载体用于后续转基因转化。
17.图2 gmftsh25在jack各组织中的相对表达量。以jack大豆材料的根、茎、叶、花、15天和45天的荚皮及种子的cdna为模板,使用荧光定量qrt
‑
pcr的方法验证gmftsh25在植物不同组织中的表达模式。
18.图3 t1代阳性转基因大豆植株的pcr验证结果。注:其中上排胶图为bar检测条带,下排胶图为目的片段特异性检测条带。m1代表2000bp marker,条带组成(由下至上):100bp,250bp,500bp,750bp,1000bp,2000bp;m2代表5000bp marker,条带组成(由下至上):100bp,250bp,500bp,750bp,1000bp,2000bp,3000bp,5000bp;泳道1为阳性质粒,泳道2为阴性对照,泳道3为空白对照,泳道4
‑
7为株系7,泳道8
‑
11为株系10,泳道12
‑
17为株系12。。
19.图4 gmftsh25过表达转基因植株表型图。注:jack代表受体对照材料,oe
‑
7、oe
‑
10和oe
‑
12分别代表三个gmftsh25过表达转基因植株。
20.图5 gmftsh25过表达转基因植株的净光合速率。注:jack代表受体对照材料,oe
‑
7、oe
‑
10和oe
‑
12分别代表三个gmftsh25过表达转基因植株。
具体实施方式
21.在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。
22.下面结合具体的制备实施例和应用实施例,并参照数据进一步详细地描述本发明。应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
23.在以下的实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。所用到的引物,均在首次出现时标明,其后所用相同引物,均以首次标明的内容相同。
24.下述实施例中所用方法如无特别说明,均为常规方法。
25.实施例1、大豆gmftsh25基因在jack材料中的组织表达
26.(1)设计引物,提取rna,反转cdna:
27.用植物总rna提取试剂盒(dp419,天根)提取大豆jack各组织的总rna,经1%琼脂糖凝胶电泳检测rna的完整性。cdna的合成参照1st strand cdna synthesis kit试剂盒的说明操作。设计引物如下:
28.seq id no.3:gmftsh25 qpcr引物f
‘5‑
cgactgtgtttgtgagtgtgc
‑3’
29.seq id no.4:gmftsh25 qpcr引物r
‘5‑
actctgattcctgcaacctactac
‑3’
30.seq id no.5:tubulin qpcr引物f
‘5‑
ggagttcacagaggcagag
‑3’
31.seq id no.6:tubulin qpcr引物r
‘5‑
cacttacgcatcacatagca
‑3’
32.(2)实时荧光定量pcr,具体步骤如下:
33.步骤一:将上述(1)得到的各组织cdna样品稀释10倍用于qpcr反应,按照chamq universal sybr qpcr master mix说明书配制反应液(20μl体系):10μl 2
×
chamq universal sybr qpcr master mix,引物f和r各0.4μl,5μl cdna模板,4.2μl ddh2o补充体积到20μl。
34.步骤二:反应在bio
‑
rad cfx96
tm real
‑
time system荧光定量仪上进行,设定反应程序为:95℃预变性30sec;再95℃10sec,60℃30sec,共40个循环;然后95℃15sec,60℃60sec,95℃15sec进行溶解曲线采集。
35.步骤三:利用excel对数据进行分析。候选基因在大豆叶片中的相对表达量是通过比较ct(cycle threshold)值的方法进行分析的,根据公式相对表达量=2
‑△△
ct
(
△△
ct=(ct
target
‑
ct
tubulin
)
genotype
‑
(ct
target
‑
ct
tubulin
)
calibrator
)计算gmftsh25在各组织中的相对表达量。结果表明:gmftsh25在根、茎、叶、花、荚和种子中均有表达,其中在叶片中的表达量最高。
36.实施例2、大豆gmftsh25基因的克隆和植物过表达载体的构建
37.(1)以实施例1中得到的大豆jack叶片的cdna为模板,利用高保真聚合酶链式反应扩增cds片段。设计引物如下:
38.seq id no.7:引物f
‘5‑
ggatcttccagagat tacccacgttccaagttccg
‑3’
39.seq id no.8:引物r
‘5‑
ctgccgttcgacgat gcttcggagcaatggtgtca
‑3’
40.(2)pcr扩增,具体步骤如下:
41.步骤一:按照以下组份顺序配制pcr反应液(50μl体系):25μl 2
×
planta max buffer,引物f和r各2μl,1μl dntp mix,2μl叶片cdna模板,1μl super
‑
fidelity dna polymerase,17μl ddh2o补充体积到50μl。
42.步骤二:反应在bio
‑
rad ptc
‑
200型pcr仪上进行,设定反应程序为:95℃预变性3min;再95℃15sec,58℃15sec,72℃2min15sec,共35个循环;然后72℃彻底延伸5min;4℃保存。
43.步骤三:pcr产物回收后经重组反应连接到puc19
‑
t载体(诺唯赞)、转化大肠杆菌top10、氨苄青霉素(amp)筛选、摇菌、测序,序列如seq id no.1所示。
44.(3)植物过表达载体的构建
45.设计同源重组接头引物seq id no.9:oe
‑
f
‘5‑
gggcccaggcctacgcgtatgttacccttagagcatca
‑3’
和seq id no.10:oe
‑
r
‘5‑
tcggggaaattcgagctctcaggaacctgtctgcgatg
‑3’
,以上述(2)获得的含gmftsh25基因片段的t载体为模板,扩增出带重组接头的gmftsh25cds片段,通过同源重组技术将gmftsh25基因导入到表达载体pba002中,构建成pba002
‑
gmftsh25过表达载体(如图1所示),然后通过冻融法将载体转入根癌农杆菌菌株eha105中用于后续大豆转基因转化。同时该表达载体上还含有标记基因bar,该基因是从链霉菌分离出的编码ppt乙酰基转化酶(phosphinothricin acetyl
‑
transferase)的基因,bar基因具有对除草剂草铵膦的抗性,可用于转基因植株的阳性鉴定,是应用安全的标记基因之一。
46.实施例3、gmftsh25基因过表达转基因大豆的培育
47.利用根癌农杆菌介导的大豆子叶节转化方法将pba002
‑
gmftsh25过表达载体转入受体材料jack中,具体方法表述如下:
48.(1)挑选成熟饱满、无病斑、无硬实的干净种子,单层排列在90*15mm的培养皿中,对大豆种子的表面消毒进行氯气干法灭菌,在通风橱中进行,共灭菌6
‑
7小时。将培养皿加盖转移到无菌超净台上,打开培养皿的盖子,强风吹25
‑
40分钟除去残留氯气。将消毒后的种子种脐朝下播种在萌发培养基(sg4)上,将培养皿叠放,用保鲜膜包好,放在生物培养箱中24℃,黑暗培养16
‑
24小时。
49.(2)准备侵染大豆子叶节的农杆菌。吸取100μl实施例2得到的pba002
‑
gmftsh25过表达载体的农杆菌菌液于5ml添加了抗生素(1/1000)的yeb液体培养基中,28℃,220rpm振荡培养24
‑
36小时,然后吸取0.2
‑
1ml饱和菌液至添加了抗生素的250ml yeb液体培养基中扩大培养,至od
600
=0.85
‑
0.9。将菌液分装到两个个50ml无菌离心管中,离心(5000rpm,10min,25℃),收集菌落,用25
‑
50ml液体共培养基(lccm)轻轻吹打,重悬沉淀后备用。
50.(3)植物组织培养。首先用手术刀在吸胀的大豆种子的子叶节处划伤口,得到外植体,然后将所有的外植体放入准备好的侵染菌液中,120
‑
130rpm振荡侵染30分钟。之后将外植体取出并放在无菌吸水纸上吸干残留侵染液,然后将其置于放有无菌吸水纸的固体共培养基上(ccm),以上操作均在超净工作台中进行。将培养皿叠放,用保鲜膜封好后在人工智能培养箱中,25℃,黑暗共培养3
‑
5天。经过除菌后将外植体插入加有筛选剂草铵膦的芽诱导培养基(sim)上,25℃,光下培养14天。之后将残余子叶切除并转移到芽伸长培养基(sem)上,25℃,光下培养2
‑
4周,在此期间应根据实际情况及时更换新的sem培养基,并且应及时将已经伸长再生植株从根部切掉,迅速将其插入到固体生根培养基(sm)中,待根长约2
‑
3厘米时,将生根苗从培养基中取出,洗净根部残留的培养基,转入土中移至温室培养。
51.(4)转基因植株的阳性鉴定。待再生植株长出第三片新叶后,用剪刀剪取上中下三层叶片并将其混合,按照上海普迪生物科技有限公司植物总dna提取试剂盒的说明书进行dna的提取。然后以dna样品为模板,利用2
×
rapid taq master mix(诺唯赞)试剂盒说明书
进行pcr扩增,包括对目的基因gmftsh25和筛选基因bar在dna水平上的鉴定,包含目的基因gmftsh25在内的特异性片段扩增引物如:seq id no.11:35s
‑
f
‘5‑
gacgcacaatcccactatcc
‑3’
;seq id no.12:oe
‑
r
‘5‑
tcggggaaattcgagctc tcaggaacctgtctgcgatg
‑3’
。筛选基因bar特异性扩增引物如下所示:seq id no.13:bar
‑
f
‘5‑
cgagacaagcacggtcaactt
‑3’
;seq id no.14:bar
‑
r
‘5‑
aaacccacgtcatgccagttc
‑3’
。然后利用1%琼脂糖凝胶电泳检测目的条带(如图3)。若扩增出2480bp的目的基因片段和360bp的bar基因片段,则说明转基因植株为阳性植株。阳性植株单株收种并种植,直至t2代鉴定出纯合的转基因植株,即得到gmftsh25基因过表达植株。
52.实施例4、gmftsh25基因过表达转基因植株的净光合速率测定
53.根据实施例3中表述的植物转基因方法鉴定得到三个稳定的gmftsh25基因过表达转基因植株,分别命名为oe
‑
7、oe
‑
10和oe
‑
12。为了测定该过表达转基因植株的生长表现型及其光合相关性状,将受体材料jack和三个过表达转基因大豆材料种植于温室条件下,待植株生长至苗期时(如图4)对其进行净光合速率的测定,具体的测定方法如下所示:利用li
‑
6400xt便携式光合作用测量系统(licor inc,lincoln,ne,usa)测定光合相关表型性状数据净光合速率(pn)。选取生长健康的大豆植株的倒三叶进行光合相关性状的表型测定,光照强度设为1000μmol m
‑2s
‑1,每个株系测定3株,每株测定3次并取平均值作为独立的表型值。
54.利用excel表格对表型数据进行方差分析。转基因植株和对照材料净光合速率比较结果表明:相比于对照材料,三个gmftsh25基因过表达转基因植株的净光合速率均显著提高(图5)。因此,gmftsh25在调节大豆光合作用效率方面具有重要作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。