检测ntrk基因融合的fish探针系统及方法
技术领域
1.本发明属于生物技术领域,具体涉及检测ntrk基因融合的fish探针系统及方法。
背景技术:
2.神经营养因子受体络氨酸激酶(neuro trophin receptor kinase,ntrk)基因包括ntrk1、ntrk2和ntrk3,分别负责原肌球蛋白受体激酶(trk)家族蛋白trka、trkb和trkc的合成。trk激酶被磷酸化后,能够激活下游信号分子,从而起到调节细胞增殖、分化、代谢、凋亡等作用。ntrk基因可以与其他不相关的基因发生融合,使得trk融合蛋白处于持续活跃状态,导致trk激酶的高表达或者trk激酶活性持续升高,从而引发下游信号通路永久性级联反应,最终可能引起癌症的发生。
3.ntrk基因融合在多种成人和儿童的实体瘤中均有发现,ntrk1、ntrk2、ntrk3融合突变占比分别为45%、2%和53%。ntrk基因融合在部分罕见癌症类型如先天性肾瘤、婴儿肉瘤、唾液腺癌和分泌型乳腺癌等癌种中有极高的突变率,个别癌种出现频率大于90%,因此具有极高的临床应用价值。
4.trk抑制剂拉罗替尼(larotrectinib,loxo
‑
101)是一种有效且具有高选择性的一代trk抑制剂,用于治疗ntrk基因融合并无已知的获得性抗性突变的转移性或无法手术切除的实体瘤患者。它的作用机制是竞争性结合trk受体的atp结合位点,干扰trk激酶结构域的自磷酸化,从而抑制下游信号的传导。larotrectinib给药后30~60分钟可达到最大血药浓度,且在所有剂量水平下,对trk受体的抑制作用都达到了98%。bayer和loxo oncology在2018年的欧洲肿瘤内科学年会(esmo大会)上宣布,larotrectinib在ntrk基因融合肿瘤的治疗中产生81%的高应答率。综合来说,larotrectinib在ntrk融合阳性肿瘤患者治疗中具有良好活性。
5.恩曲替尼(entrectinib,rxdx
‑
101)是一种口服、具中枢神经系统作用活性的、针对ntrk1/2/3、ros1和alk驱动基因的酪氨酸激酶抑制剂,用于治疗ntrk融合型实体瘤患者,既往治疗后进展的局部晚期或转移性实体瘤患者,无标准治疗方案实体瘤患者的初始治疗。恩曲替尼缩小了一半以上(57.4%)的ntrk基因融合阳性、局部进展或转移性实体瘤患者的肿瘤,反应时(dor)为2.8~26个月,对乳腺癌、胆管癌、结直肠癌、妇科肿瘤、神经内分泌肿瘤、非小细胞肺癌、唾液腺癌、胰腺癌、肉瘤、甲状腺癌等多种实体肿瘤均有效。可见,恩曲替尼也是一款“广谱”抗癌药。“广谱”是指只基于肿瘤驱动基因而不考虑原发部位。
6.因此,拉罗替尼(larotrectinib)和恩曲替尼(entrectinib)对不同肿瘤类型的ntrk融合患者已经显示出非常好的疗效,检测肿瘤患者ntrk基因融合状态,有助于筛选出larotrectinib/entrectinib的敏感人群,指导临床用药。
7.目前,有多种方法可用于检测ntrk基因融合突变,包括荧光原位杂交(fish)、免疫组化(ihc)、荧光定量pcr(rt
‑
pcr)和高通量测序(ngs)等方法。
8.ngs是一种精确检测ntrk基因融合的方法,具有高通量、高灵敏度、高特异性等优点。基于ngs技术的检测方法不仅可以检测组织样本中的ntrk基因融合,同时也可以通过血
浆和胸水等多种样本检测基因融合状态。ngs检测技术灵敏度远高于目前传统检测技术,可以检出0.1%的融合突变,并可以进行dna、rna多层面检测以确保检测准确性。然而,不同大小的ngs panel往往需要设计rna或dna探针,来捕获这三个基因,特别是较大的ntrk2和ntrk3基因(dna片段分别长达39万和35万碱基对),外显子较多,融合类型复杂且分布不一,只能针对已知融合位点(序列)设计捕获探针,成本较高,操作繁琐,耗时长。
9.rt
‑
pcr法灵敏度高,检测样本选择也较为灵活,但是只可检测已知突变,且ntrk融合断点可位于外显子和内含子。三种亚型较长的基因序列造成了融合断点的多变性,给rt
‑
pcr的体系设计造成极大的挑战。
10.对于ihc法,目前文献报道的pan
‑
trk抗体有两种,克隆号分别为epr17341和c17f1的兔单克隆抗体。gatalica z等人的报道显示前者抗体的灵敏度为75%,与ngs的方法相比会漏诊一些ntrk融合患者;murphy等人的研究结果显示c17f1抗体具有100%阴性预测值,不会有漏诊情况,但阳性预测值仅为9.3%。因此,pan
‑
trk抗体存在灵敏度低或阳性预测值低的问题,用于ntrk融合检测还需要进一步优化。
11.fish往往被认为是检测基因融合的金标准,其具有稳定性高、灵敏度高、特异性好,实验周期短等优点,但是一组常规的fish探针通常只能检测一个靶标,只能用于一个基因的融合突变检测。例如,公开号为cn109988836a的中国专利申请公开了一种检测ntrk融合的fish探针组及其应用,采用的就是常规的fish探针,一次只能用于一种基因的融合检测。ntrk有3个基因,位于三条染色体上,那么就需要进行三次fish探针的检测,对ntrk1、ntrk2和ntrk3进行分开检测。
技术实现要素:
12.本发明的目的在于提供一种非同常规的检测ntrk基因融合的fish探针系统及方法,能够在一张标本切片上同时检测ntrk1、ntrk2和ntrk3三种基因融合。一方面,三种基因的联合检测提高了预后预测的灵敏度和准确率,能够更好地指导临床用药;另一方面,三种基因的一次性检测,能显著地节约肿瘤组织,且大大缩短了检测的时间和成本,对于肿瘤患者,尤其是晚期肿瘤患者,意义重大。
13.本发明的目的可以通过以下技术方案来实现:
14.本发明的第一方面,在于提供同时检测三种ntrk基因融合的fish探针系统,包含:
15.标记第一荧光素的第一探针,其与ntrk1基因断裂点5’端杂交;
16.标记第二荧光素的第二探针,其与ntrk1基因断裂点3’端杂交;
17.标记第三荧光素的第三探针,其与ntrk2基因断裂点5’端杂交;
18.标记第四荧光素的第四探针,其与ntrk2基因断裂点3’端杂交;
19.标记第一荧光素的第五探针,其与ntrk3基因断裂点5’端杂交;
20.标记第二荧光素的第六探针,其与ntrk3基因断裂点3’端杂交;
21.标记第五荧光素的第七探针,其与ntrk3基因断裂点5’端和3’端杂交;
22.其中,第一荧光素、第二荧光素、第三荧光素、第四荧光素、第五荧光素为不同颜色的荧光素。
23.在本发明的一些具体实例中,第一荧光素为绿色荧光素,第二荧光素为橙色荧光素,第三荧光素为蓝色荧光素,第四荧光素为红色荧光素,第五荧光素为金色荧光素。
24.此时,同时检测三种ntrk基因融合的fish探针系统,包含:
25.标记绿色荧光素的第一探针,其与ntrk1基因断裂点5’端杂交;
26.标记橙色荧光素的第二探针,其与ntrk1基因断裂点3’端杂交;
27.标记蓝色荧光素的第三探针,其与ntrk2基因断裂点5’端杂交;
28.标记红色荧光素的第四探针,其与ntrk2基因断裂点3’端杂交;
29.标记绿色荧光素的第五探针,其与ntrk3基因断裂点5’端杂交;
30.标记橙色荧光素的第六探针,其与ntrk3基因断裂点3’端杂交;
31.标记金色荧光素的第七探针,其与ntrk3基因断裂点5’端和3’端杂交。
32.在本发明的一些具体实例中,
33.第一探针位于chr1:156,824,627
‑
157,312,258;
34.第二探针位于chr1:156,355,849
‑
156,684,745;
35.第三探针位于chr9:86,545,621
‑
87,292,312;
36.第四探针位于chr9:87,958,032
‑
88,102,082;
37.第五探针位于chr15:88,064,591
‑
88,268,902;
38.第六探针位于chr15:88,734,571
‑
89,472,835;
39.第七探针位于chr15:87,684,180
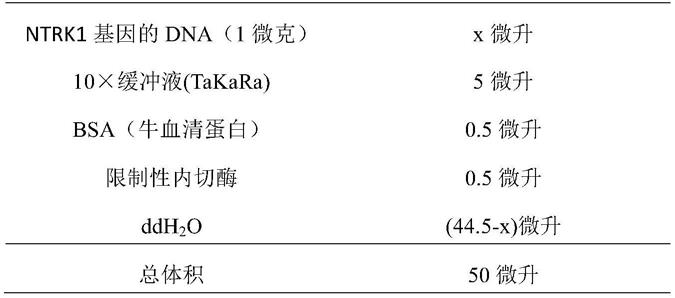
‑
89,869,300。
40.本发明的第二方面,在于提供制备上述同时检测三种ntrk基因融合的fish探针系统的方法:
41.所述的第一~第七探针通过以下步骤制得:利用携带有检测基因的bac菌种,获得所述检测基因的克隆后,大量提取所述检测基因的dna;根据设计的杂交位点,选定限制性内切酶对所述检测基因的dna进行两次酶切,得到所述检测基因的小片段dna探针;再采用缺口平移的方法将选定的荧光素标记连接到所述检测基因的小片段dna探针上,纯化得到所述检测基因的探针;所述检测基因为ntrk1、ntrk2或ntrk3基因。
42.在本发明的一些具体实例中,携带有ntrk1基因的bac菌种,编号为rp11
‑
107b16;携带有ntrk2基因的bac菌种,编号为rp11
‑
787g22;携带有ntrk3基因的bac菌种,编号为rp11
‑
594d9。
43.本发明的第三方面,在于提供同时检测三种ntrk基因融合的fish试剂盒,其包括上述的fish探针系统。
44.在本发明的一些具体实例中,同时检测三种ntrk基因融合的fish试剂盒,还包括:预处理液、蛋白酶液、洗涤缓冲液和dapi/抗荧光衰减封片剂。
45.本发明的第四方面,在于提供利用上述fish探针系统或fish试剂盒同时检测三种ntrk基因融合的方法,包括以下步骤:
46.(1)将待测样本固定在玻片上进行预处理切片;
47.(2)将上述fish探针系统加至所述待测样本切片的待杂交区域,共变性后,封片杂交;杂交完成后,洗涤玻片;对杂交区域细胞核进行复染,封片;
48.(3)使用具有匹配滤光块的荧光显微镜对玻片杂交区域进行观察,并对结果进行判断,以确定所述待测样本中ntrk1、ntrk2和ntrk3基因是否正常。
49.所述待测样本为肿瘤患者(尤其是肿瘤晚期患者)手术/穿刺组织的石蜡包埋切片。
50.在本发明的一些具体实例中,第一荧光素为绿色荧光素,第二荧光素为橙色荧光素,第三荧光素为蓝色荧光素,第四荧光素为红色荧光素,第五荧光素为金色荧光素。
51.在本发明的一些具体实例中,采用以下方法对结果来进行判断:
52.使用第一荧光素/第二荧光素双通道滤光片进行观察:观察到4个第一荧光素/第二荧光素融合信号,表示ntrk1/ntrk3均正常;当有第二荧光素和第一荧光素信号分离时,则需要通过第五荧光素的滤光片观察分离信号是否伴随第五荧光素信号:如果分离的第一荧光素和第二荧光素信号分别伴随一个第五荧光素信号,表示ntrk3基因分离,如果分离的第一荧光素和第二荧光素信号无第五荧光素信号伴随,表示ntrk1基因分离;
53.通过第三荧光素/第四荧光素对应的滤光片进行观察;观察到组合为2个第三荧光素/第四荧光素融合信号,表示ntrk2基因正常;当荧光信号组合为1个第三荧光素/第四荧光素融合信号1个第三荧光素信号1个第四荧光素信号,表示ntrk2基因分离。
54.在本发明的一些具体实例中,采用以下方法对结果来进行判断:
55.使用橙/绿双通道滤光片进行观察:观察到4个绿/橙融合信号,表示ntrk1/ntrk3均正常;当有橙色信号和绿色信号分离时,则需要通过金色荧光素的滤光片观察分离信号是否伴随金色信号:如果分离的橙色信号和绿色信号分别伴随一个金色信号,表示ntrk3基因分离;如果分离的橙色信号和绿色信号无金色信号伴随,表示ntrk1基因分离;
56.通过红/蓝色荧光素对应的滤光片进行观察:观察到组合为2个蓝/红融合信号,表示ntrk2基因正常;当荧光信号组合为1个蓝/红融合信号1个蓝色信号1个红色信号,表示ntrk2基因分离。
57.本发明设计了一种能同时检测ntrk1、ntrk2和ntrk3三种基因融合的fish探针系统。通过fish探针系统的巧妙设计,结合荧光显微镜在镜下的观察,通过不同荧光素颜色的组合,对各基因的异常情况作出判读,通过一次实验和一个探针系统,可以同时完成ntrk1、ntrk2和ntrk3三种基因融合的检测。
58.与现有技术相比较,本发明的fish探针系统以及检测方法具有以下有益的技术效果:
59.本发明的探针系统设计巧妙,实现了在一张标本切片上单次fish同时检测ntrk1、ntrk2和ntrk3三种基因融合的状态,快速确定患者是否存在上述基因融合,节省了标本和试剂,大大缩短了检测的时间。
60.本发明对ntrk1、ntrk2和ntrk3三种基因融合的联合检测,提高了预后预测的灵敏度和准确性,并根据检测结果选择相对应的分子靶向药物,能够更可靠地指导肺癌临床治疗方案制定,从而改善预后。
61.考虑到晚期肿瘤患者的肿瘤组织获取多采用穿刺或活检组织,而经病理诊断后其组织量非常有限,多次采样不但会增加患者的痛苦,甚至有时候根本就难以实现,且多次检测的成本也会相应增加。如果遇到检测费用高和/或可取样本量少的情况,患者就会失去检测三个基因异常的机会,从而错失对应的治疗方法。因此,本发明的探针系统对于肿瘤患者尤其是晚期肿瘤患者有着重要的意义。
附图说明
62.图1a~图1c分别为本发明的fish探针系统中ntrk1、ntrk2、ntrk3基因标记的位置
示意图(非按比例)。
63.图2为利用本发明的fish探针系统进行检测的镜检结果判读规则示意图。
64.图3为将本发明的fish探针系统与人外周血培养细胞(中期染色体)杂交后经荧光显微镜镜检得到的图像。
具体实施方式
65.下面结合附图和具体实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明,而不应视为限定本发明的范围。
66.下列实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场购得的常规产品。以下实施例中摩尔浓度单位采用的是领域内惯用书写方式:m,mm或μm,分别代表mol/l,mmol/l或μmol/l。
67.实施例1探针的制备
68.①
第一探针的制备
69.(1)将携带有ntrk1基因的bac菌种(rp11
‑
107b16)(美国invitrogen公司)接种于新鲜的含抗生素的lb营养琼脂平板,置于37℃过夜培养;次日,用10微升白色枪头挑取生长状态良好的单克隆菌种至液体培养基(2ml含抗生素的lb培养基)中,37℃振荡培养6~8h(274rpm);将2ml菌液转移至200ml液体lb培养基,37℃摇床(274rpm),过夜培养;按照qiagen公司质粒大量提取试剂盒的操作说明,进行dna大量提取和纯化,得到ntrk1基因的dna。
70.(2)针对ntrk1基因断裂点上游(5’端),选择限制性内切酶hindiii对ntrk1基因的dna进行酶切,获得大片段dna,包括以下步骤:将酶切反应体系(见下表1,表1中限制性内切酶为hindiii)的各成分混匀,37℃水浴反应1h,加入10微升50mm的edta终止反应,混匀,沉淀;吸取上清丢弃,加入100微升体积浓度为70%的乙醇,4℃混匀,离心15min;小心吸取上清丢弃,干燥沉淀,得到大片段(第一)dna。
71.表1酶切反应体系
[0072][0073]
(3)选择限制性内切酶ecor1对步骤(2)得到的大片段(第一)dna进行随机酶切,形成小片段dna(第一)探针:将随机酶切反应体系(见下表2,表2中限制性内切酶为ecor1)的各成分混匀,37℃水浴反应1h,加入10微升50mm的edta终止反应,混匀,沉淀;吸取上清丢弃,加入100微升体积浓度为70%的乙醇,4℃混匀,离心15min;小心吸取上清丢弃,干燥沉淀,得到小片段dna(第一)探针,放置于4℃保存,等连接反应备用。小片段dna(第一)探针序
列位于chr1:156,824,627
‑
157,312,258。
[0074]
表2随机酶切反应体系
[0075][0076]
(4)荧光素标记连接反应
[0077]
采用切口平移法对步骤(3)得到的小片段dna(第一)探针进行荧光素标记:取避光的ep管,按照下表3所示的连接反应体系(表3中荧光素datp/dye为绿色荧光素—异硫氰酸荧光素)加液:先加水,再加其它的,最后加入dnase(10纳克/微升)和dna聚合酶(10单位/微升,酶始终放在冰盒或冰上),混匀,孵育过夜。次日,70℃水浴10min中止反应。
[0078]
表3连接反应体系
[0079][0080]
(5)dna(探针)纯化
[0081]
按照qiagen公司的dna纯化试剂盒的操作步骤,纯化并回收步骤(4)得到的标记好荧光素的dna片段(或者说与荧光素连接好的dna片段),在
‑
20℃避光保存,作为第一探针备用。
[0082]
使用紫外分光光度计测定上述第一探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0083]
使用凝胶电泳判断上述第一探针的长度:取其中2μl第一探针进行2%琼脂糖凝胶电泳检查,以观察所标记第一探针的大小。第一探针的大小≤500bp。
[0084]
②
第二探针的制备
[0085]
采用与第一探针的制备基本相同的方法,制备第二探针,区别仅在于以下步骤:
[0086]
(2)针对ntrk1基因断裂点下游(3’端),限制性内切酶选用bamhi酶,对ntrk1基因的dna进行酶切,获得大片段(第二)dna。
[0087]
(3)小片段dna(第二)探针序列位于chr1:156,355,849
‑
156,684,745。
[0088]
(4)表3所示连接反应体系中,荧光素为橙色荧光素(罗丹明)。
[0089]
使用紫外分光光度计测定第二探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0090]
使用凝胶电泳判断第二探针的长度:取其中2μl第二探针进行2%琼脂糖凝胶电泳检查,以观察所标记第二探针的大小。第二探针的大小为≤500bp。
[0091]
③
第三探针的制备
[0092]
采用与第一探针的制备基本相同的方法,制备第三探针,区别仅在于以下步骤:
[0093]
(1)bac菌种为携带有ntrk2基因的bac菌种(rp11
‑
787g22)(美国invitrogen公司),得到的dna为ntrk2基因的dna。
[0094]
(2)针对ntrk2基因断裂点上游(5’端),限制性内切酶选用hindiii酶,对ntrk2基因的dna进行酶切,获得大片段(第三)dna。
[0095]
(3)小片段dna(第三)探针序列位于以下区域chr9:86,545,621
‑
87,292,312
[0096]
(4)表3所示连接反应体系中,荧光素为蓝色荧光素(deac琥珀酰亚胺酯)。
[0097]
使用紫外分光光度计测定第三探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0098]
使用凝胶电泳判断第三探针的长度:取其中2μl第三探针进行2%琼脂糖凝胶电泳检查,以观察所标记第三探针的大小。第三探针的大小为≤500bp。
[0099]
④
第四探针
[0100]
采用与第三探针的制备基本相同的方法,制备第四探针,区别仅在于以下步骤:
[0101]
(2)针对ntrk2基因断裂点下游(3’端),限制性内切酶采用bamhi酶,对ntrk2基因的dna进行酶切,获得大片段(第四)dna。
[0102]
(3)小片段dna(第四)探针序列位于chr9:87,958,032
‑
88,102,082。
[0103]
(4)表3所示连接反应体系中,荧光素为红色荧光素(texasred得州红)。
[0104]
使用紫外分光光度计测定第四探针的标记效率和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0105]
使用凝胶电泳判断第四探针的长度:取其中2μl第四探针进行2%琼脂糖凝胶电泳检查,以观察所标记第四探针的大小。第四探针的大小为≤500bp。
[0106]
⑤
第五探针的制备
[0107]
采用与第一探针的制备基本相同的方法,制备第五探针,区别仅在于以下步骤:
[0108]
(1)bac菌种为携带有ntrk3基因的bac菌种(rp11
‑
594d9)(美国invitrogen公司),得到的dna为ntrk3基因的dna。
[0109]
(2)针对ntrk3基因断裂点上游(5’端),限制性内切酶选用hindiii酶,对ntrk3基因的dna进行酶切,获得大片段(第五)dna。
[0110]
(3)小片段dna(第五)探针序列位于以下区域chr15:88,064,591
‑
88,268,902。
[0111]
(4)表3所示连接反应体系中,荧光素为绿色荧光素(异硫氰酸荧光素)。
[0112]
使用紫外分光光度计测定第五探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0113]
使用凝胶电泳判断第五探针的长度:取其中2μl第五探针进行2%琼脂糖凝胶电泳检查,以观察所标记第五探针的大小。第五探针的大小为≤500bp。
[0114]
⑥
第六探针的制备
[0115]
采用与第五探针的制备基本相同的方法,制备第六探针,区别仅在于以下步骤:
[0116]
(2)针对ntrk3基因断裂点下游(3’端),限制性内切酶采用bamhi酶,对ntrk3基因的dna进行酶切,获得大片段(第六)dna。
[0117]
(3)小片段dna(第六)探针序列位于以下区域chr15:88,734,571
‑
89,472,835;
[0118]
(4)表3所示连接反应体系中,荧光素为橙色荧光素(罗丹明)。
[0119]
使用紫外分光光度计测定第六探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0120]
使用凝胶电泳判断第六探针的长度:取其中2μl第六探针进行2%琼脂糖凝胶电泳检查,以观察所标记第六探针的大小。第六探针的大小为≤500bp。
[0121]
⑦
第七探针的制备
[0122]
采用与第五探针的制备基本相同的方法,制备第七探针,区别仅在于以下步骤:
[0123]
(2)针对ntrk3基因断裂点上游(5’端)和ntrk3基因断裂点下游(3’端),限制性内切酶选用ncoi酶,对ntrk3基因的dna进行酶切,获得大片段(第七)dna。
[0124]
(3)小片段dna(第七)探针序列位于以下区域chr15:87,684,180
‑
89,869,300。
[0125]
(4)表3所示连接反应体系中,荧光素为金色荧光素(罗丹明6g)。
[0126]
使用紫外分光光度计测定第七探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0127]
使用凝胶电泳判断第七探针的长度:取其中2μl第七探针进行2%琼脂糖凝胶电泳检查,以观察所标记第七探针的大小。第七探针的大小为≤500bp。
[0128]
上述各探针序列的探针区域的位置(非按比例)示意图如图1a~图1c所示。
[0129]
图1a中,ntrk1:绿色荧光素、橙色荧光素分别标记于ntrk1基因断裂点(1q23)两端(5’端/3’端);
[0130]
图1b中,ntrk2:蓝色荧光素、红色荧光素分别标记ntrk2基因断裂点(9q21)两端(5’端/3’端);
[0131]
图1c中,ntrk3:绿色荧光素、橙色荧光素分别标记ntrk3基因断裂点(15q25)两端(5’端/3’端);金色荧光素标记ntrk3基因断裂点(15q25)的5’端和3’端。
[0132]
实施例2探针系统的制备
[0133]
用甲酰胺缓冲液(每2ml甲酰胺缓冲液中,360微升5m nacl,40微升1mtris
‑
hcl,1ml甲酰胺,2微升10%(m/v)sds(十二烷基硫酸钠),598微升无菌水,ph7.4)对上述得到的各探针分别进行稀释,得到不同浓度的各个探针,并将同一基因的探针归入一个组合中,具体如下:
[0134]
ntrk1探针组合,包括第一和第二探针(ntrk1绿/橙),其浓度分别为:分别为8ng/ul、10ng/ul;
[0135]
ntrk2探针组合,包括第三和第四探针(ntrk2蓝/红),其浓度分别为:10ng/ul、8ng/ul;
[0136]
ntrk3探针组合,包括第五、第六和第七探针(绿/橙/金),其浓度分别为:8ng/ul、10ng/ul、5ng/ul;
[0137]
将上述ntrk1探针组合、ntrk2探针组合、ntrk3探针组合按照体积比为1:1:1混合,
得到fish探针系统。
[0138]
实施例3探针系统的杂交反应(利用实施例2的探针系统对样本进行检测)
[0139]
3.1样本的预处理
[0140]
①
将待测样本切片70℃10分钟。
[0141]
②
二甲苯(xylene)脱蜡,10分钟,二次。
[0142]
③
100%乙醇,100%乙醇,90%乙醇,70%乙醇中分别孵化切片5分钟。
[0143]
④
蒸馏水或去离子水洗2分钟,2次。
[0144]
⑤
切片在预热到98℃的预处理液中孵育15分钟。
[0145]
⑥
立即把切片转入蒸馏水或去离子水中洗2分钟,2次。
[0146]
⑦
在组织/细胞区域滴加蛋白酶液,并在37℃恒温恒湿箱孵化约10分钟。
[0147]
⑧
洗涤缓冲液中5分钟,蒸馏水或去离子水1分钟。
[0148]
⑨
脱水:经70%,90%,100%乙醇溶液中依次脱水各1分钟,空气干燥切片。
[0149]
3.2变性与杂交(第一天)
[0150]
①
用移液器吸取10μl的上述实施例2制备所得的fish探针系统,加入至切片待杂交区域。
[0151]
②
样本盖上盖玻片(22mm
×
22mm);橡胶胶水封片。
[0152]
③
75℃变性10分钟。
[0153]
④
37℃杂交过夜(>14h)。
[0154]
3.3杂交后洗涤(第二天)
[0155]
①
仔细除去胶水带。
[0156]
②
在置于染色缸内的室温洗涤缓冲液中洗涤1~3分钟,使盖玻片脱落。
[0157]
③
用洗涤缓冲液37℃洗涤切片5分钟,2次。
[0158]
④
置于70%,90%,100%乙醇溶液中洗涤切片各1分钟。避光风干,备用。
[0159]
3.4复染
[0160]
用移液器吸取30μl的dapi/抗荧光衰减封片剂到切片组织上,避免气泡,盖上盖玻片(24mm
×
60mm),避光孵育15分钟。
[0161]
3.5观察与保存
[0162]
使用具有匹配滤光块的荧光显微镜对玻片杂交区域进行观察,并采集图像:低倍镜下观察整张切片,初步判断检测质量;然后于油镜下通过特异通道滤光片观察信号,随机计数至少2个不同区域的50个癌细胞核中的信号,并进行信号计数。
[0163]
其中,荧光显微镜采用奥林巴斯bx53型荧光显微镜,滤光块荧光素如下:绿色fitc荧光素(激发波长503nm,发射波长528nm),橙色5
‑
carboxyl
‑
x
‑
rhodamine荧光素(激发波长548nm,发射波长573nm),蓝色aqua荧光素(激发波长418nm,发射波长467nm),红色texasred荧光素(激发波长580nm,发射波长599nm),金色carboxyrhodamine 6g荧光素(激发波长525nm,发射波长551nm)。
[0164]
3.6结果判读:
[0165]
使用橙/绿双通道的滤光片进行观察:
[0166]
当观察到4个融合(绿/橙融合)信号,表示ntrk1/ntrk3均正常;当有橙色信号和绿色信号分离时,则需要通过金色荧光素的滤光片观察分离信号是否伴随金色信号:如果分
离的橙色信号和绿色信号分别伴随一个金色信号,表示ntrk3基因分离;如果分离的橙色信号和绿色信号无金色信号伴随,表示ntrk1基因分离。
[0167]
通过红/蓝色荧光素对应的滤光片进行观察:
[0168]
观察到组合为2个融合(蓝/红融合)信号,表示ntrk2基因正常;当荧光信号组合为1融合(蓝/红融合)1蓝1红,表示ntrk2基因分离。
[0169]
上述判断规则如图2所示。
[0170]
图2中,标记a为绿色荧光信号,标记b为橙色荧光信号,标记c为蓝色荧光信号,标记d为红色荧光信号,标记e为金色荧光信号。
[0171]
实施例4探针系统的验证
[0172]
采用常规方法对所制备的探针进行验证,即采用正常人外周血培养单个核细胞(正常二倍体细胞)对上述实施例2所得的fish探针系统进行验证,以评估灵敏度和特异性,具体为:使用密度梯度离心法用ficoll液提取正常人外周血单个核细胞,按实施例3的方法制片、杂交。实验结果在正常二倍体细胞中,各基因拷贝数应为2。人外周血培养细胞(中期染色体)杂交图如图3所示。
[0173]
由图3可见各基因(ntrk1、ntrk2、ntrk3)分别杂交于对应的染色体位点,从而验证了各基因杂交位点正确,且无非特异性杂交。
[0174]
当前,使用商业化探针检测三个基因,需要用到三支探针在三张标本切片上进行三次fish测试,本发明的探针系统只需要使用一张标本切片、单次fish测试即可达到同样的效果,节省了标本和试剂,大大缩短了检测的时间。
[0175]
考虑到晚期肿瘤患者肿瘤组织获取多采用穿刺或活检组织,而经病理诊断后其组织量非常有限,多次采样不但会增加患者的痛苦,甚至有时候根本就难以实现,且多次检测的成本也会相应增加。如果遇到检测费用高和/或可取样本量少的情况,患者就会失去检测三个基因异常的机会,从而错失对应的治疗方法。因此,本发明的探针系统对于晚期肿瘤患者有着重要的意义。
[0176]
由此可见,本发明的目的已经完整并有效的予以实现。本发明的功能及结构原理已在实施例中予以展示和说明,在不背离所述原理的情况下,实施方式可作任意修改。所以,本发明包括了基于权利要求精神及权利要求范围的所有变形实施方式。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。