1.本发明涉及生物技术领域中一种构建重组解脂耶氏酵母的方法与应用。
背景技术:
2.赤藓糖醇(1,2,3,4
‑
丁四醇)是一种四碳功能糖醇,广泛分布于水果,发酵食品和动物中。由于其在机体内的代谢能量较低,可防治牙齿龋变,以及低胰岛素代谢响应等,是低热量甜味剂,因此被广泛应用于食品、医药和化工等领域。赤藓糖醇的市场发展空间巨大,应用前景十分广阔。尽管水果、海带等食物中广泛含有赤藓糖醇,但利用嗜高渗或耐高渗酵母生物发酵生产赤藓糖醇是主要的生产方式。目前,解脂耶氏酵母(yarrowialipolytica)已经实现了规模化赤藓糖醇发酵生产,取得了较好的经济效益。但利用该菌株生产赤藓糖醇的发酵温度一般是30℃,这样的发酵温度在夏天等温度较高的季节生产时需要进行循环冷却处理,从而增加生产成本,甚至导致工厂停产,严重影响企业的生产经营和经济效益。因此,提高解脂耶氏酵母的温度耐受性,增加生产周期,提高经济效益迫在眉睫。
3.传统的诱变耗时耗力,菌株遗传稳定性差,且通常以降低产物产量为代价,因此不适合构建工业微生物菌种。随着酿酒酵母在高温胁迫下应答和防御机制的阐明及嗜热菌来源耐热元件的表征,为理性育种耐高温酵母提供了新靶点。例如,研究者发现泛素连接酶rsp5和泛素结合酶的过表达导致在较高的温度(39℃)下改善多重胁迫耐受性;热应激还会引起ros损伤,而通过敲除糖基磷脂酰肌醇固定的膜蛋白编码基因dfg5可以提高酵母的耐热性。liu等通过引入来自腾冲嗜热厌氧菌(thermoanaerobactertengcongensis)的耐热元件,使酿酒酵母在42℃条件下的细胞活力明显高于对照菌株。zhou等通过异源表达来自凝结芽孢杆菌(baciluscoagulans)2
‑
6的冷激蛋白cspl,大大增强了大肠杆菌和酿酒酵母(在36℃时生物量增加了2.6倍)的高温生长。wang等通过在解脂耶氏酵母中单独过表达rsp5基因使其在33℃条件下保持高产赤藓糖醇的特性。
4.解脂耶氏酵母细胞在高温胁迫下,细胞内的功能蛋白可能会发生热变性、错误折叠及聚集等;细胞内的ph稳态可能会失衡;细胞内结构可能会受到氧化损伤;核酸可能会降解或突变。因此,针对高温胁迫对其造成的影响,挖掘具有相应保护功能的元件,对提高解脂耶氏酵母在高温下高产赤藓糖醇的能力具有非常重要的意义。
技术实现要素:
5.本发明所要解决的技术问题是如何提高解脂耶氏酵母温度耐受性,如何提高高温条件下解脂耶氏酵母的赤藓糖醇产量。
6.为了解决以上技术问题,本发明的第一个目的是提供了构建重组解脂耶氏酵母的方法,包括将高温耐受性基因导入解脂耶氏酵母,得到所述重组解脂耶氏酵母;所述高温耐受性基因下述基因中的至少一种:groes基因、hsp12基因、tsa1基因、hul5基因、vma2基因和yap1基因;
7.所述groes基因编码如下a1)
‑
a3)中任一种蛋白质:
8.a1)氨基酸序列是序列表中序列12的蛋白质,
9.a2)将a1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
10.a3)在a1)或a2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
11.所述hsp12基因编码如下b1)
‑
b3)中任一种蛋白质:
12.b1)氨基酸序列是序列表中序列8的蛋白质,
13.b2)将b1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
14.b3)在b1)或b2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
15.所述tsa1基因编码如下c1)
‑
c3)中任一种蛋白质:
16.c1)氨基酸序列是序列表中序列11的蛋白质,
17.c2)将c1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与c1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
18.c3)在c1)或c2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
19.所述hul5基因编码如下d1)
‑
d3)中任一种蛋白质:
20.d1)氨基酸序列是序列表中序列10的蛋白质,
21.d2)将d1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与d1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
22.d3)在d1)或d2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
23.所述vma2基因编码如下e1)
‑
e3)中任一种蛋白质:
24.e1)氨基酸序列是序列表中序列9的蛋白质,
25.e2)将e1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与e1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
26.e3)在e1)或e2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
27.所述yap1基因编码如下f1)
‑
f3)中任一种蛋白质:
28.f1)氨基酸序列是序列表中序列7的蛋白质,
29.f2)将f1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与f1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
30.f3)在f1)或f2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质。
31.所述高温为31℃
‑
40℃,具体可为35℃。
32.其中,序列表中的序列7由650个氨基酸残基组成,序列表中的序列8由109个氨基酸残基组成,序列表中的序列9由517个氨基酸残基组成,序列表中的序列10由910个氨基酸残基组成,序列表中的序列11由196个氨基酸残基组成,序列表中的序列12由101个氨基酸残基组成。
33.上述方法中,所述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
34.上述方法中,所述蛋白质可来源于酿酒酵母(saccharomycescerevisiae)或嗜热菌(thermus thermophilus)。
35.上述方法中,所述蛋白质标签(protein
‑
tag)是指利用dna体外重组技术,与目的蛋白质一起融合表达的一种多肽或者蛋白质,以便于目的蛋白质的表达、检测、示踪和/或纯化。所述蛋白质标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
36.上述方法中,所述同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
37.上述方法中,所述80%以上的同一性可为至少80%、85%、90%、91%、92%、95%、96%、98%、99%或100%的同一性。
38.上述方法中,所述groes基因为如下a1)或a2)所示的基因:
39.a1)编码链的编码序列(cds)是序列表中序列6的cdna分子或dna分子,
40.a2)编码链的核苷酸是序列表中序列6的cdna分子或dna分子;
41.所述hsp12基因为如下b1)或b2)所示的基因:
42.b1)编码链的编码序列(cds)是序列表中序列2的cdna分子或dna分子,
43.b2)编码链的核苷酸是序列表中序列2的cdna分子或dna分子;
44.所述tsa1基因为如下c1)或c2)所示的基因:
45.c1)编码链的编码序列(cds)是序列表中序列5的cdna分子或dna分子,
46.c2)编码链的核苷酸是序列表中序列5的cdna分子或dna分子;
47.所述hul5基因为如下d1)或d2)所示的基因:
48.d1)编码链的编码序列(cds)是序列表中序列4的cdna分子或dna分子,
49.d2)编码链的核苷酸是序列表中序列4的cdna分子或dna分子;
50.所述vma2基因为如下e1)或e2)所示的基因:
51.e1)编码链的编码序列(cds)是序列表中序列3的cdna分子或dna分子,
52.e2)编码链的核苷酸是序列表中序列3的cdna分子或dna分子;
53.所述yap1基因为如下f1)或f2)所示的基因:
54.f1)编码链的编码序列(cds)是序列表中序列1的cdna分子或dna分子,
55.f2)编码链的核苷酸是序列表中序列1的cdna分子或dna分子。
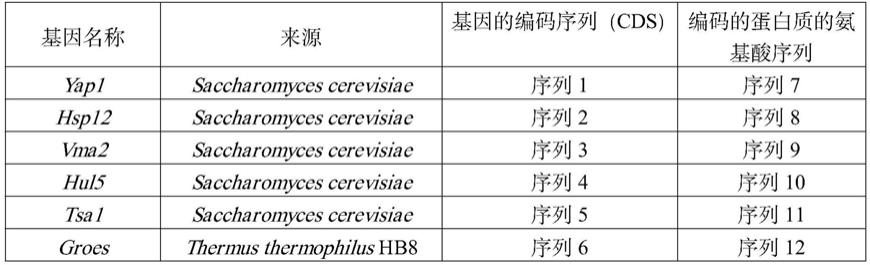
56.其中,序列表中的序列1由1953个核苷酸组成,编码序列表中的序列7所示的蛋白质;序列表中的序列2由330个核苷酸组成,编码序列表中的序列8所示的蛋白质;序列表中的序列3由1554个核苷酸组成,编码序列表中的序列9所示的蛋白质;序列表中的序列4由2733个核苷酸组成,编码序列表中的序列10所示的蛋白质;序列表中的序列5由591个核苷酸组成,编码序列表中的序列11所示的蛋白质;序列表中的序列6由306个核苷酸组成,编码序列表中的序列12所示的蛋白质。
57.上述方法中,所述重组解脂耶氏酵母在高温条件下的赤藓糖醇产量高于所述解脂耶氏酵母。所述高温为31℃
‑
40℃,具体可为35℃。
58.本发明第二个目的是保护以上述方法构建的重组解脂耶氏酵母。
59.本发明第三个目的是保护高温耐受性基因在提高高温条件下解脂耶氏酵母的赤藓糖醇产量中的应用或在提高解脂耶氏酵母高温耐受性中的应用,所述高温耐受性基因下述基因中的至少一种:groes基因、hsp12基因、tsa1基因、hul5基因、vma2基因和yap1基因;
60.所述groes基因编码如下a1)
‑
a3)中任一种蛋白质:
61.a1)氨基酸序列是序列表中序列12的蛋白质,
62.a2)将a1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
63.a3)在a1)或a2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
64.所述hsp12基因编码如下b1)
‑
b3)中任一种蛋白质:
65.b1)氨基酸序列是序列表中序列8的蛋白质,
66.b2)将b1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
67.b3)在b1)或b2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
68.所述tsa1基因编码如下c1)
‑
c3)中任一种蛋白质:
69.c1)氨基酸序列是序列表中序列11的蛋白质,
70.c2)将c1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与c1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
71.c3)在c1)或c2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
72.所述hul5基因编码如下d1)
‑
d3)中任一种蛋白质:
73.d1)氨基酸序列是序列表中序列10的蛋白质,
74.d2)将d1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与d1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
75.d3)在d1)或d2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
76.所述vma2基因编码如下e1)
‑
e3)中任一种蛋白质:
77.e1)氨基酸序列是序列表中序列9的蛋白质,
78.e2)将e1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与e1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
79.e3)在e1)或e2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
80.所述yap1基因编码如下f1)
‑
f3)中任一种蛋白质:
81.f1)氨基酸序列是序列表中序列7的蛋白质,
82.f2)将f1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与f1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
83.f3)在f1)或f2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质。
84.本发明还保护高温耐受性基因在构建耐高温重组解脂耶氏酵母中的应用,所述高温耐受性基因下述基因中的至少一种:groes基因、hsp12基因、tsa1基因、hul5基因、vma2基因和yap1基因;
85.所述groes基因编码如下a1)
‑
a3)中任一种蛋白质:
86.a1)氨基酸序列是序列表中序列12的蛋白质,
87.a2)将a1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到
的与a1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
88.a3)在a1)或a2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
89.所述hsp12基因编码如下b1)
‑
b3)中任一种蛋白质:
90.b1)氨基酸序列是序列表中序列8的蛋白质,
91.b2)将b1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
92.b3)在b1)或b2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
93.所述tsa1基因编码如下c1)
‑
c3)中任一种蛋白质:
94.c1)氨基酸序列是序列表中序列11的蛋白质,
95.c2)将c1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与c1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
96.c3)在c1)或c2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
97.所述hul5基因编码如下d1)
‑
d3)中任一种蛋白质:
98.d1)氨基酸序列是序列表中序列10的蛋白质,
99.d2)将d1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与d1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
100.d3)在d1)或d2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
101.所述vma2基因编码如下e1)
‑
e3)中任一种蛋白质:
102.e1)氨基酸序列是序列表中序列9的蛋白质,
103.e2)将e1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与e1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
104.e3)在e1)或e2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质;
105.所述yap1基因编码如下f1)
‑
f3)中任一种蛋白质:
106.f1)氨基酸序列是序列表中序列7的蛋白质,
107.f2)将f1)的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与f1)所示的蛋白质具有80%以上的同一性且具有高温耐受性活性的蛋白质,
108.f3)在f1)或f2)的n末端或/和c末端连接蛋白质标签得到的融合蛋白质。
109.上述应用中,所述高温为31℃
‑
40℃,具体可为35℃。
110.为了解决上述技术问题,本发明还提供了上述方法或上述重组解脂耶氏酵母在赤藓糖醇生产中的应用。所述赤藓糖醇生产为在高温条件下生产赤藓糖醇,所述高温为31℃
‑
40℃,具体可为35℃。
111.本发明所提供的试剂含有促进解脂耶氏酵母中上述高温耐受性基因表达的物质。
112.上述试剂的活性成分可为促进解脂耶氏酵母中高温耐受性基因表达的物质,上述试剂的活性成分还可含有其他生物成分或/和非生物成分,上述试剂的其他活性成分本领域技术人员可根据提高解脂耶氏酵母高温耐受性或赤藓糖醇产量的效果确定。
113.本发明还保护上述方法或试剂在赤藓糖醇生产中的应用。
114.本发明通过ncbi、pdb等数据库对已完成测序的酿酒酵母和嗜热微生物及其耐热基因信息进行挖掘整理,结合已有文献报道效果明显的不同功能的基因作为候选元件。密码子优化后构建质粒表达载体,转化到解脂耶氏酵母菌株中,筛选重组子表达菌株。通过发
酵评价,获得可以在35℃条件下提高其赤藓糖醇产量的不同功能的耐热基因yap1、hsp12、vma2、hul5、tsa1和groes。相比于转入空质粒的对照菌株,质粒型表达耐热基因yap1、hsp12、vma2、hul5、tsa1或groes的菌株在35℃条件下的生长有所改善,赤藓糖醇产量也有明显增加。
115.保藏说明
116.菌种名称:解脂耶氏酵母
117.拉丁名:yarrowialipolytica
118.菌株编号:ery01
119.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
120.保藏机构简称:cgmcc
121.地址:北京市朝阳区北辰西路1号院3号
122.保藏日期:2021年7月27日
123.保藏中心登记入册编号:cgmcc no.22966
附图说明
124.图1为本发明实施例1中35℃条件下,发酵72h时各菌株的生长情况。
125.图2为本发明实施例1中35℃条件下,发酵72h时各菌株的赤藓糖醇产量。
具体实施方式
126.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
127.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均为常规生化试剂,可从商业途径得到。
128.1菌株
129.下述实施例中的酿酒酵母by4741记载于非专利文献“zhang g,lin y,qi x,li l,wang q,ma y.talens
‑
assisted multiplex editing for accelerated genome evolution to improve yeast phenotypes.acs synth biol.2015;4(10):1101
–
11”,公众可以从中国科学院天津工业生物技术研究所获得,以重复本技术实验,不可作为其它用途使用。
130.下述实施例中的yarrowialipolyticastrain w29(clib89)为ars culture collection(nrrl)产品。
131.下述实施例中的解脂耶氏酵母工业菌株ery01已保藏到中国微生物菌种保藏管理委员会普通微生物中心,登记入册编号:cgmcc no.22966,分类名:解脂耶氏酵母(yarrowia lipolytica),保藏日期:2021年7月27日,保藏单位地址:北京市朝阳区北辰西路1号院3号。
132.2培养基
133.种子液培养基由溶质和溶剂组成,溶剂为水,溶质及其浓度为:葡萄糖20%(w/v:g/ml),酵母膏1%,磷酸二氢钾0.1%,柠檬酸铵0.5%,七水硫酸镁0.05%,诺尔斯菌素800mg/l。
134.发酵培养基由溶质和溶剂组成,溶剂为水,溶质及其浓度为:食品级葡萄糖(一个结晶水)337.5g/l,酵母浸膏8.6g/l,玉米浆6.1g/l,硫酸镁(七个结晶水)0.173g/l,磷酸氢二铵3.07g/l,vb10.0086 g/l,硫酸锰(一个结晶水)0.013g/l,硫酸铜(无水)0.002g/l,谷氨酸钠0.0173g/l,诺尔斯菌素800mg/l。
135.下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna的5
′
末端核苷酸,末位均为相应dna的3
′
末端核苷酸。
136.实施例1
137.本发明实现目的技术路线如下:
138.(1)对已有文献报道、生物信息数据库中有基因序列的酿酒酵母来源及嗜热微生物来源的耐热基因进行检索,获得耐热元件库。
139.通过ncbi、pdb等数据库对已完成测序的酿酒酵母和嗜热微生物及其耐热基因信息进行挖掘整理,结合已有文献报道中效果明显的不同功能的基因作为候选元件组成耐热元件库。
140.(2)对耐热元件库中的基因按照来源及功能进行分类,筛选来自不同物种具有不同功能的耐热基因作为候选基因。
141.将步骤(1)耐热元件库中的基因按照功能进行分类,得到耐热基因类型具体见表1:
142.表1不同功能耐热基因信息
[0143][0144]
(3)对酿酒酵母(saccharomycescerevisiae)来源的候选基因以酿酒酵母by4741基因组为模板进行pcr扩增;对嗜热菌(thermusthermophilus)来源的候选基因按照解脂耶氏酵母进行密码子优化合成。
[0145]
对酿酒酵母(saccharomycescerevisiae)来源的候选基因yap1、hsp12、vma2、hul5和tsa1,以酿酒酵母by4741基因组为模板进行pcr扩增,所用引物具体如下:
[0146]
以引物对yap1
‑
f/yap1
‑
r扩增yap1基因片段(核苷酸序列如序列表序列1的第1至第1953位所示):
[0147]
yap1
‑
f:5
′‑
gacatatctacagcaatgagtgtgtctaccgccaa
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列);
[0148]
yap1
‑
r:5
′‑
accggcaacgtggggttagttcatatgcttattca
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列)。
[0149]
以引物对hsp12
‑
f/hsp12
‑
r扩增hsp12基因片段(核苷酸序列如序列表序列2的第1至第330位所示):
[0150]
hsp12
‑
f:5
′‑
gacatatctacagcaatgtctgacgcaggtagaaa
‑3′
(带下划线的核苷酸为
与质粒ptib完全匹配的同源序列);
[0151]
hsp12
‑
r:5
′‑
accggcaacgtggggttacttcttggttgggtctt
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列)。
[0152]
以引物对vma2
‑
f/vma2
‑
r扩增vma2基因片段(核苷酸序列如序列表序列3的第1至第1554位所示):
[0153]
vma2
‑
f:5
′‑
gacatatctacagcaatggttttgtctgataagga
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列);
[0154]
vma2
‑
r:5
′‑
accggcaacgtggggttagattagagattcttctt
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列)。
[0155]
以引物对hul5
‑
f/hul5
‑
r扩增hul5基因片段(核苷酸序列如序列表序列4的第1至第2733位所示):
[0156]
hul5
‑
f:5
′‑
gacatatctacagcaatgttaaacttcaccggtca
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列);
[0157]
hul5
‑
r:5
′‑
accggcaacgtggggttatgataagtcaaacctgg
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列)。
[0158]
以引物对tsa1
‑
f/tsa1
‑
r扩增tsa1基因片段(核苷酸序列如序列表序列5的第1至第591位所示):
[0159]
tsa1
‑
f:5
′‑
gacatatctacagcaatggtcgctcaagttcaaaa
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列);
[0160]
tsa1
‑
r:5
′‑
accggcaacgtggggttatttgttggcagcttcga
‑3′
(带下划线的核苷酸为与质粒ptib完全匹配的同源序列)。
[0161]
对嗜热菌(thermusthermophilus)的候选基因groes交由公司按照解脂耶氏酵母基因组进行密码子优化合成,合成了groes基因片段,其核苷酸序列如序列表序列6的第1至第306位所示。
[0162]
(4)过表达载体ptib的构建:
[0163]
以商业化质粒puc57为模板,利用引物primer17/primer18扩增原核生物复制起始位点及氨苄抗生素基因表达盒片段,命名为ori
‑
amp:
[0164]
primer 17:atcaatgggccttggtttccataggctccgccccc(带下划线的核苷酸为与chre1
‑
down完全匹配的同源序列)
[0165]
primer 18:cgcccaaaatgccagcgcggaacccctatttgttt(带下划线的核苷酸为与pxpr2完全匹配的同源序列)
[0166]
以yarrowialipolyticastrain w29(clib89)基因组为模板,利用引物primer1/primer2扩增基因xpr2的启动子,命名为pxpr2:
[0167]
primer 1:aataggggttccgcgctggcattttgggcgttttc(带下划线的核苷酸为与ori
‑
amp完全匹配的同源序列)
[0168]
primer 2:caaagtagtacccattgttggattggaggattgga(带下划线的核苷酸为与nat完全匹配的同源序列)
[0169]
在ncbi查找诺尔斯菌素抗性基因氨基酸序列(来源于cloning vectorpnz11),交由金唯智公司按照解脂耶氏酵母的密码子进行优化后合成,利用引物primer3/primer4扩
增诺尔斯菌素抗性基因,命名为nat:
[0170]
primer 3:tcctccaatccaacaatgggtactactttggatga(带下划线的核苷酸为与pxpr2完全匹配的同源序列)
[0171]
primer 4:gattccgaacagaagtcatggacatggcatagaca(带下划线的核苷酸为与tlip2完全匹配的同源序列)
[0172]
以ery01基因组为模板,利用引物primer5/primer6扩增基因lip2的终止子,命名为tlip2:primer 5:atgccatgtccatgacttctgttcggaatcaacct(带下划线的核苷酸为与nat完全匹配的同源序列)
[0173]
primer 6:tccattatctacgaacagatgcattcttgggcggt(带下划线的核苷酸为与cen1完全匹配的同源序列)
[0174]
以yarrowia lipolytica strain w29(clib89)基因组为模板,利用引物primer7/primer8扩增真核生物复制起始位点,命名为cen1:
[0175]
primer 7:ccaagaatgcatctgttcgtagataatggaataca(带下划线的核苷酸为与tlip2完全匹配的同源序列)
[0176]
primer 8:ttcggggtctgccagcatcaaatttagggatgcca(带下划线的核苷酸为与chre1
‑
up完全匹配的同源序列)
[0177]
以ery01基因组为模板,利用引物primer9/primer10扩增基因插入位点chre1的上游同源臂500bp序列片段,命名为chre1
‑
up:
[0178]
primer 9:tccctaaatttgatgctggcagaccccgaaaccta(带下划线的核苷酸为与cen1完全匹配的同源序列)
[0179]
primer 10:ggcgccaaactccttacaacagccagtcctccacg(带下划线的核苷酸为与pexp1完全匹配的同源序列)
[0180]
以yarrowia lipolytica strain w29(clib89)基因组为模板,利用引物primer11/primer12扩增启动子pexp1片段,命名为pexp1:
[0181]
primer 11:aggactggctgttgtaaggagtttggcgcccgttt(带下划线的核苷酸为与chre1
‑
up完全匹配的同源序列)
[0182]
primer 12:accggcaacgtgggggcgatcgctgctgtagatatgtcttgtg(带下划线的核苷酸为与ttef完全匹配的同源序列)
[0183]
以yarrowia lipolytica strain w29(clib89)基因组为模板,利用引物primer13/primer14扩增终止子ttef片段,命名为ttef:
[0184]
primer 13:tacagcagcgatcgcccccacgttgccggtcttgc(带下划线的核苷酸为与pexp1完全匹配的同源序列)
[0185]
primer 14:ggtgtccgagcgtcggaattcggacacgggcatct(带下划线的核苷酸为与chre1
‑
down完全匹配的同源序列)
[0186]
以ery01基因组为模板,利用引物primer15/primer16扩增基因插入位点chre1的下游同源臂500bp序列片段,命名为chre1
‑
down:
[0187]
primer 15:cccgtgtccgaattccgacgctcggacacctctgg(带下划线的核苷酸为与ttef完全匹配的同源序列)
[0188]
primer 16:cggagcctatggaaaccaaggcccattgattgaga(带下划线的核苷酸为与
ori
‑
amp完全匹配的同源序列)
[0189]
将扩增得到的ori
‑
amp与pxpr2通过融合pcr进行融合,得到片段ori
‑
amp
‑
pxpr2;tlip2与cen1通过融合pcr进行融合,得到片段tlip2
‑
cen1;nat与tlip2
‑
cen1通过融合pcr进行融合,得到片段nat
‑
tlip2
‑
cen1;ori
‑
amp
‑
pxpr2与nat
‑
tlip2
‑
cen1通过融合pcr进行融合,得到片段ori
‑
amp
‑
pxpr2
‑
nat
‑
tlip2
‑
cen1;chre1
‑
up与pexp1通过融合pcr进行融合,得到片段chre1
‑
up
‑
pexp1;ttef与chre1
‑
down通过融合pcr进行融合,得到片段ttef
‑
chre1
‑
down;利用trelief sosoo cloning kit ver.2试剂盒将片段ori
‑
amp
‑
pxpr2
‑
nat
‑
tlip2
‑
cen1、chre1
‑
up
‑
pexp1和ttef
‑
chre1
‑
down进行组装,经测序得到正确的过表达载体ptib(核苷酸序列如序列表中序列13所示,其中第1
‑
1752位为pxpr2启动子序列,第1753
‑
2325位为nat序列,第2326
‑
3262位为tlip2序列,第3263
‑
3481位为cen1序列,第3482
‑
3966位为chre1
‑
up序列,第3967
‑
4967位为pexp1序列,第4968
‑
4975位为asisi酶识别位点,第4976
‑
5385位为ttef序列,第5386
‑
5885位为chre1
‑
down序列,第5886
‑
7610位为ori
‑
amp序列)。
[0190]
(5)将耐热基因片段与过表达载体ptib相连,得到重组表达载体。
[0191]
将步骤(3)pcr扩增获得的各个耐热基因片段连接到用限制性内切酶asisi酶切过的载体ptib上,经测序得到正确的重组载体,具体如下:
[0192]
将yap1基因片段(核苷酸序列如序列表序列1的第1至第1953位所示)连接到用限制性内切酶asisi酶切过的体ptib上,得到yap1蛋白的重组表达载体,命名为ptib
‑
yap1。ptib
‑
yap1含有编码序列(cds)是序列表中序列1的第1至第1953位所示的yap1基因,由启动子pexp1启动yap1基因转录。
[0193]
将hsp12基因片段(核苷酸序列如序列表序列2的第1至第330位所示)连接到用限制性内切酶asisi酶切过的体ptib上,得到hsp12蛋白的重组表达载体,命名为ptib
‑
hsp12。ptib
‑
hsp12含有编码序列(cds)是序列表中序列2的第1至第330位所示的hsp12基因,由启动子pexp1启动hsp12基因转录。
[0194]
将vma2基因片段(核苷酸序列如序列表序列3的第1至第1554位所示)连接到用限制性内切酶asisi酶切过的体ptib上,得到vma2蛋白的重组表达载体,命名为ptib
‑
vma2。ptib
‑
vma2含有编码序列(cds)是序列表中序列3的第1至第1554位所示的vma2基因,由启动子pexp1启动vma2基因转录。
[0195]
将hul5基因片段(核苷酸序列如序列表序列4的第1至第2733位所示)连接到用限制性内切酶asisi酶切过的体ptib上,得到hul5蛋白的重组表达载体,命名为ptib
‑
hul5。ptib
‑
hul5含有编码序列(cds)是序列表中序列4的第1至第2733位所示的hul5基因,由启动子pexp1启动hul5基因转录。
[0196]
将tsa1基因片段(核苷酸序列如序列表序列5的第1至第591位所示)连接到用限制性内切酶asisi酶切过的体ptib上,得到tsa1蛋白的重组表达载体,命名为ptib
‑
tsa1。ptib
‑
tsa1含有编码序列(cds)是序列表中序列5的第1至第591位所示的tsa1基因,由启动子pexp1启动tsa1基因转录。
[0197]
将步骤(3)合成的groes基因片段直接连到ptib的asisi酶切位点处,保持ptib载体的其它序列不变,得到groes蛋白的重组表达载体,命名为ptib
‑
groes。ptib
‑
groes含有编码序列(cds)是序列表中序列6的第1至第306位所示的groes基因,由启动子pexp1启动
groes基因转录。
[0198]
(5)将重组载体转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,得到重组菌株。
[0199]
将上述步骤(4)获得的重组载体(ptib
‑
yap1,ptib
‑
hsp12,ptib
‑
vma2,ptib
‑
hul5,ptib
‑
tsa1和ptib
‑
groes,以空质粒ptib为对照)分别转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到正确转化的重组菌株,具体操作步骤如下:
[0200]
制备感受态细胞:
[0201]
将出发菌株ery01在ypd平板划线后置于30℃培养箱培养24h;培养后的菌株再次划线ypd平板后置于30℃培养箱培养24h;将培养的细胞刮下来后重悬于1ml无菌水中,3000g离心5min去除上清,此步骤重复两次;用1ml无菌水重悬细胞,并测定od
600
;取出od值9.2的菌置于新的无菌离心管中,3000g离心5min去除上清,得到ery01感受态细胞,用于一次转化。
[0202]
转化过程:
[0203]
1)取500ng质粒(分别为ptib
‑
yap1,ptib
‑
hsp12,ptib
‑
vma2,ptib
‑
hul5,ptib
‑
tsa1、ptib
‑
groes和空质粒ptib)加入ery01感受态细胞;
[0204]
2)用转化液混合物重悬细胞:
[0205]
表2
[0206]
成分含量peg(stock50%;sterile
‑
filtrated;end43.8%)87.5μlliac(stock2m;sterile
‑
filtrated;end0.1m)5.0μlssdna(stock10mg/ml;end0.25g/l)2.5μldtt(stock2m;sterile
‑
filtrated;end100mm)5.0μl
[0207]
3)39℃孵育1h;
[0208]
4)3000g离心5min中后去上清,加入500μl的ypd培养基重悬后置于30℃摇床培养2h;
[0209]
5)3000g离心5min中后去上清,用100μl的无菌水重悬后涂布于含有诺尔斯菌素(800mg/l)的ypd平板上,置于30℃培养。
[0210]
按照上述操作步骤,将重组载体ptib
‑
yap1转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到含有ptib
‑
yap1的重组解脂耶氏酵母菌株,命名为ery01ptib
‑
yap1。
[0211]
按照上述操作步骤,将重组载体ptib
‑
hsp12转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到含有ptib
‑
hsp12的重组解脂耶氏酵母菌株,命名为ery01ptib
‑
hsp12。
[0212]
按照上述操作步骤,将重组载体ptib
‑
vma2转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到含有ptib
‑
vma2的重组解脂耶氏酵母菌株,命名为ery01ptib
‑
vma2。
[0213]
按照上述操作步骤,将重组载体ptib
‑
hul5转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到含有ptib
‑
hul5的重组解脂耶氏酵母菌株,命名为ery01ptib
‑
hul5。
[0214]
按照上述操作步骤,将重组载体ptib
‑
tsa1转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到含有ptib
‑
tsa1的重组解脂耶氏酵母菌株,命名为ery01ptib
‑
tsa1。
[0215]
按照上述操作步骤,将重组载体ptib
‑
groes转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到含有ptib
‑
groes的重组解脂耶氏酵母菌株,命名为ery01ptib
‑
groes。
[0216]
按照上述操作步骤,将空质粒ptib转化至高产赤藓糖醇的解脂耶氏酵母工业菌株ery01中,经测序得到含有ptib的重组解脂耶氏酵母菌株,命名为ery01ptib。
[0217]
(6)将各株重组菌株在35℃条件下进行发酵培养,通过分光光度计测定细胞的生长情况;通过hplc测定赤藓糖醇的产量。
[0218]
将上述重组解脂耶氏酵母菌株(ery01ptib
‑
yap1,ery01ptib
‑
hsp12,ery01ptib
‑
vma2,ery01ptib
‑
hul5,ery01ptib
‑
tsa1,ery01ptib
‑
groes,ery01ptib)分别划线含有诺尔斯菌素的ypd平板培养,待长起后挑单克隆到种子液培养基进行培养。培养温度为30℃,培养36小时,得到种子液。
[0219]
将种子液转接至发酵培养基至初始od
600
为0.1,在35℃进行培养72h,,收集发酵液。每个菌株进行3个平行实验。
[0220]
将发酵液稀释后进行od
600
测定,同时利用hplc进行赤藓糖醇含量的测定。hplc中,以赤藓糖醇(北京索莱宝科技有限公司,产品cas号149
‑
32
‑
6)为标准品根据标准品的保留时间定性,采用标准曲线法(外标法)进行定量分析赤藓糖醇。hplc检测条件:hplc(hpx
‑
87h色谱柱,300mm
×
7.8mm,bio
‑
rad,hercules,ca,usa),柱温55℃,流动相为0.008m硫酸溶液,流速为0.6m l/min,进样量为5μl。
[0221]
采用excel软件对数据进行处理,实验结果以平均值
±
标准偏差表示。
[0222]
测定结果如图1、图2所示。相比于转入空质粒ptib的对照菌株ery01ptib,所有重组质粒型表达耐热基因的菌株(ery01ptib
‑
yap1,ery01ptib
‑
hsp12,ery01ptib
‑
vma2,ery01ptib
‑
hul5,ery01ptib
‑
tsa1,ery01ptib
‑
groes)在35℃条件下的生长均有所改善,赤藓糖醇产量也有明显增加。其中,ery01ptib
‑
groes的赤藓糖醇产量最高,为31.6
±
0.6g赤藓糖醇/l发酵液;ery01ptib
‑
yap1的赤藓糖醇产量为14.2
±
0.3g赤藓糖醇/l发酵液;ery01ptib
‑
hsp12的赤藓糖醇产量为22
±
1.4g赤藓糖醇/l发酵液;ery01ptib
‑
vma2的赤藓糖醇产量为19.8
±
0.7g赤藓糖醇/l发酵液;ery01ptib
‑
hul5的赤藓糖醇产量为20.3
±
1.5g赤藓糖醇/l发酵液;ery01ptib
‑
tsa1的赤藓糖醇产量为21.3
±
1.1g赤藓糖醇/l发酵液;ery01ptib的赤藓糖醇产量为11
±
0.9g赤藓糖醇/l发酵液。
[0223]
(7)筛选得到能使解脂耶氏酵母工业菌株在35℃条件下生长良好且高产赤藓糖醇的不同功能的耐热基因。
[0224]
根据步骤(6)的结果,筛选得到能使解脂耶氏酵母工业菌株在35℃条件下生长良好且高产赤藓糖醇的不同功能的耐热基因yap1、hsp12、vma2、hul5、tsa1和groes。
[0225]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本申
请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。