一株红霉素降解菌w1及其应用
技术领域
1.本发明属于生物技术领域,具体为一株红霉素降解菌w1以及在土壤、水体中红霉素降解领域的应用。
背景技术:
2.红霉素属于大环内酯类抗生素,具有很强的抗菌作用,应用广泛,作用机制主要是与核糖核蛋白体的50s亚单位相结合,抑制肽酰基转移酶,影响核糖核蛋白体的移位过程,妨碍肽链增长,抑制细菌蛋白质的合成,系抑菌剂。而且红霉素是一种多组分抗生素,临床上主要应用红霉素a,其化学结构由具有14元环的红霉内酯(erythronolide)、脱氧氨基乙糖(desosamine)和红霉糖(cladnose)3部分组成。红霉素结构稳定,很难通过水解或光解等自然降解途径去除,易在环境中不断积聚,达到一定浓度后会抑制植物生长,特别不利于农作物的生长,甚至会影响农作物的产量。但因为红霉素药效好、成本低,现已广泛应用于农业、畜牧业和水产养殖业。
3.在自然生态系统中,微生物之间的相互作用和它们对有机污染物的共代谢作用,可加快或促进有机污染物的降解;因此,利用微生物对各类有机污染物进行降解和转化极具潜力。现有的处理工艺,如曝气生物滤池,只能消减废水中的微量红霉素,若要更有效地降解环境中的红霉素残留,还要依靠特定的微生物。因此,生产中亟需筛选到可有效降解红霉素的微生物,并投入使用。但是,目前国内外针对红霉素等大环内酯类抗生素造成的污染,筛选红霉素降解菌进行治理的报道甚少,已经报道的菌种资源也非常有限,极大地阻碍了红霉素污染微生物修复技术的应用,也限制了对红霉素降解酶、降解途径等的阐明。
技术实现要素:
4.本发明的目的在于提供一株红霉素降解菌w1,该红霉素降解菌为聚多曲霉 (aspergillus sydowii),该菌已于2021年07月29日在中国微生物菌种保藏管理委员会普通微生物中心保藏,北京市朝阳区北辰西路1号院3号,保藏号为cgmcc no.23059。
5.上述诉红霉素降解菌w1对被红霉素污染的环境具有修复作用,尤其对被红霉素污染的土壤环境,以及被红霉素污染的水体具有修复作用。
6.上诉红霉素降解菌w1对土壤中的废弃红霉素具有降解作用,对水体中所含的红霉素具有降解作用,可直接应用于农田的净化处理领域。
7.上述的该红霉素降解菌w1的筛选方法,步骤如下:
8.1)从被红霉素污染的污泥中称取泥土,加入红霉素降解菌筛选液体培养基进行富集,在35
‑
40℃、150
‑
200r/min恒温摇床中培养4
‑
10天;
9.2)吸取步骤1中所得的培养基加入新的红霉素降解菌筛选液体培养基进行传代,如此传代3
‑
6次;
10.3)取步骤2中所得菌液在lb平板上划线分离,得到红霉素降解菌w1;
11.其中红霉素降解菌筛选培养基成分为:每1l去离子水中含有红霉素 100mg/l,氯
化铵(nh4cl)0.66g,磷酸氢二钾(k2hpo4)1.5g,磷酸二氢钾(kh2po4) 0.5g,硫酸镁(mgso4)0.1g,磷酸氢二钾(k2hpo4)1.5g,氯化钠(nacl) 0.35g,ph 7.0
‑
7.2;
12.pda固体培养基成分为:称取200g马铃薯切成小块,先洗净去皮再加水煮烂(煮沸20
‑
30min,能被玻璃棒戳破即可),用八层纱布过滤,加热,加15g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入葡萄糖,搅拌均匀,稍冷却后再补足水分至1l,分装锥形瓶包扎,115℃灭菌20min。
13.上述红霉素降解菌w1的优选筛选方法,步骤如下:
14.1)从被红霉素污染的污泥中称取泥土5g,加入100ml红霉素降解菌筛选液体培养基进行富集,在37℃、180r/min恒温摇床中培养5
‑
7天;
15.2)吸取步骤1中所得的培养基3ml加入新的红霉素降解菌筛选液体培养基进行传代,如此传代4
‑
5次;
16.3)取步骤2中所得菌液在lb平板上划线分离,得到红霉素降解菌w1;
17.上述红霉素降解菌w1的干粉剂,为用使用扩大培养后的红霉素降解菌w1 培养物,经过常规方法干燥而成。
18.所述红霉素降解菌w1是按照如下所述方法筛选获得:
19.一、从江苏常州武进区被红霉素污染的污泥中称取泥土分离菌株,称取污泥 5g,加入100ml红霉素降解菌筛选液体培养基进行富集,在37℃、180r/min恒温摇床中培养5
‑
7天;然后吸取培养基3ml加入新的红霉素降解菌筛选液体培养基进行传代,如此传代4
‑
5次,在pda平板上划线分离,经过多次分离试验筛选,最终得到一批能在以红霉素作为唯一碳源的培养基中生存的菌种;
20.所述红霉素降解菌筛选培养基成分为:每1l去离子水中含有红霉素100mg/l,氯化铵(nh4cl)0.66g,磷酸氢二钾(k2hpo4)1.5g,磷酸二氢钾(kh2po4) 0.5g,硫酸镁(mgso4)0.1g,磷酸氢二钾(k2hpo4)1.5g,氯化钠(nacl)0.35 g,ph 7.0
‑
7.2;
21.所述pda固体培养基成分为:称取200g马铃薯切成小块,先洗净去皮再加水煮烂(煮沸20
‑
30min,能被玻璃棒戳破即可),用八层纱布过滤,加热,加15 g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入葡萄糖,搅拌均匀,稍冷却后再补足水分至1l,分装锥形瓶包扎,115℃灭菌20min。
22.二、分析分离得到的不同菌株对培养基中红霉素的降解效率,筛选获得红霉素降解效果最佳的菌株。
23.具体测定方法如下:
24.1、培养基制备
25.基础盐培养基:nh4cl 0.66g,k2hpo41.5 g,kh2po40.5 g,mgso40.1 g, k2hpo41.5 g,nacl 0.35g,ph 7.0
‑
7.2;121℃灭菌20min。
26.ypd液体培养基:1溶解10g酵母膏,20g蛋白胨于900ml水中,高压115℃灭菌30min。加入100ml含20g葡萄糖溶液(葡萄糖溶液灭菌后加入)。
27.2、红霉素降解效率测定方法
28.2.1红霉素标准曲线的绘制
29.取0.5g红霉素标准品,用色谱乙腈溶解,定容至50ml容量瓶中,制成10 g/l的母液。再用色谱纯乙腈稀释母液,逐级配置10、20、50、70、100mg/l浓度的系列标准溶液,利用
高效液相色谱仪在波长210nm条件下,测定峰面积,作红霉素浓度
‑
峰面积标准曲线。
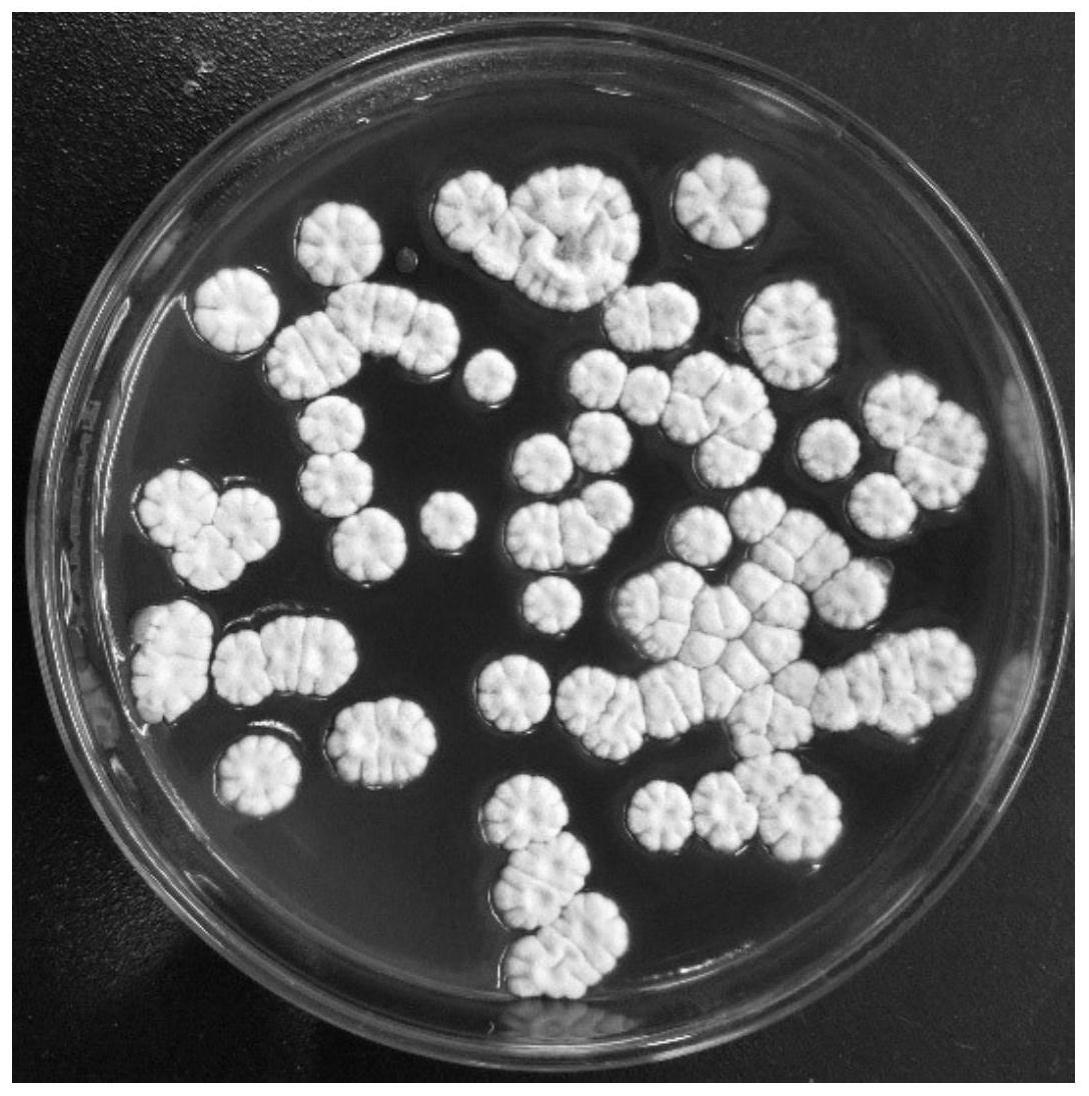
30.2.2红霉素降解率测定方法
31.取培养液,用高效液相色谱仪在波长210nm条件下,流动相为含乙腈 /0.005m k2hpo4(60/40,v/v)的混合物以0.6ml/min流速输送洗脱。进样体积为10 μl,柱温保持在35℃,测定峰面积。利用红霉素标准曲线所建立的线性回归方程计算出红霉素浓度,进一步计算得出红霉素降解率。所有实验均设置三个重复。
32.2.3通过红霉素降解菌对红霉素的降解率,得出最优菌种
33.将红霉素降解菌菌株在ypd液体培养基中培养,离心收集菌体,用无菌水重悬,将所选菌株接种1%(每100ml无机盐培养基内添加1g菌体)到100.0ml 含100mg/l红霉素的基础液体无机盐培养基中,置于恒温摇床中180r/min,30℃培养,每12小时取样测定降解率。
34.其中,筛选得到红霉素降解菌w1对红霉素的降解效果明显,且菌株生长良好,其80h对红霉素的降解率为83.53%。
35.2.4红霉素降解菌w1对土壤中的废弃红霉素的降解
36.将红霉素降解菌w1按1%(每100ml无机盐培养基内添加1g菌体)的接种量接种于100ml灭菌的含红霉素的废水中,经高效液相色谱仪测定该废水的红霉素的含量为55mg/l,于30℃、静置培养80h,测定红霉素降解率为:66.44%。
37.2.5红霉素降解菌w1对废水中的废弃红霉素的降解
38.将红霉素降解菌w1按1%(每100ml无机盐培养基内添加1g菌体)的接种量接种于100ml灭菌的土壤液中,经高效液相色谱仪测定,土壤中的红霉素的含量为60mg/kg,于30℃、静置培养80h,测定红霉素降解率为68.52%。
39.菌株鉴定
40.采用振荡破碎法获得红霉素降解菌w1基因组dna,通过pcr方法对菌株 its rdna进行扩增并送至上海捷瑞生物公司进行测序分析;用于扩增its rdna 的上游引物序列为:5
’‑
tccgtaggtgaacctgcgg
‑3’
,下游引物序列为 5
’‑
tcctccgcttattgatatgc
‑3’
。
41.pcr反应条件是:98℃预变性5min,98℃变性15s,54℃退火15s,72℃延伸50s,反应32个循环,10℃延伸5min。使用ncbi的blast功能在genebank 数据库中进行序列比对,分析菌株的分类为:聚多曲霉(aspergillus sydowii)。
42.红霉素降解菌w1its rdna序列见序列表。
43.本发明的有益效果为:
44.1.筛选出一种可以在红霉素为唯一碳源的环境中存活的红霉素降解菌w1,经降解分析表明,该菌株可以在含100mg/l红霉素筛选固体培养基和液体培养基中生长良好,具有很高的红霉素降解特性。
45.2.该红霉素降解菌w1将在土壤中红霉素降解、水体污染中红霉素的降解、土壤中废弃红霉素的降解和环境污染修复中具有应用前景。
46.3.本发明红霉素降解菌的应用,有利于避免因物理或化学方法降解红霉素而造成的二次污染。
附图说明
47.图1为红霉素降解菌w1单菌落形态图。
48.图2为实施例2中红霉素降解菌w1的降解曲线图。
49.图3为实施例3中红霉素降解菌w1的降解曲线图。
50.图4为实施例4中红霉素降解菌w1的降解曲线图。
具体实施方式
51.红霉素降解菌w1的筛选过程
52.(一)、主要材料
53.1、培养基
54.红霉素筛选液体培养基成分:每1l去离子水中含有红霉素100mg/l,氯化铵(nh4cl)0.66g,磷酸氢二钾(k2hpo4)1.5g,磷酸二氢钾(kh2po4) 0.5g,硫酸镁(mgso4)0.1g,磷酸氢二钾(k2hpo4)1.5g,氯化钠(nacl) 0.35g,ph 7.0
‑
7.2
55.相对应的固体培养基则在1l液体培养基中添加琼脂粉15g配制成。
56.pda固体培养基成分为:称取200g马铃薯切成小块,先洗净去皮再加水煮烂(煮沸20
‑
30min,能被玻璃棒戳破即可),用八层纱布过滤,加热,加15g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入葡萄糖,搅拌均匀,稍冷却后再补足水分至1l,分装锥形瓶包扎,115℃灭菌20min。
57.ypd液体培养基:1溶解10g酵母膏,20g蛋白胨于900ml水中,高压115℃灭菌30min。加入100ml含20g葡萄糖溶液(葡萄糖溶液灭菌后加入)。2、仪器设备
58.flexcycler pcr扩增仪,tanon
‑
3500凝胶成像系统,北京市六一仪器厂电泳仪,灭菌锅,英衡电子天平,uv1900紫外可见分光光度计,恒温培养箱,eppendorf高速冷冻离心机,摇床,青岛海尔集团的低温冰箱,赛默飞世尔科技(中国)有限公司的高效液相色谱仪。
59.(二)、红霉素降解菌w1的筛选过程
60.(1)从江苏常州武进区被红霉素污染的污泥中称取泥土分离菌株,称取污泥5g,加入100ml红霉素降解菌筛选液体培养基进行富集,在37℃、 180r/min恒温摇床中培养5
‑
7天;然后吸取培养基3ml加入新的红霉素降解菌筛选液体培养基进行传代,如此传代4
‑
5次,在pda平板上划线分离,经过多次分离试验筛选,最终得到一批能在以红霉素作为唯一碳源的培养基中生存的菌种;
61.所述红霉素降解菌筛选培养基成分为:每1l去离子水中含有红霉素 100mg/l,氯化铵(nh4cl)0.66g,磷酸氢二钾(k2hpo4)1.5g,磷酸二氢钾(kh2po4)0.5g,硫酸镁(mgso4)0.1g,磷酸氢二钾(k2hpo4)1.5g,氯化钠(nacl)0.35g,ph 7.0
‑
7.2;
62.pda固体培养基成分为:称取200g马铃薯切成小块,先洗净去皮再加水煮烂(煮沸20
‑
30min,能被玻璃棒戳破即可),用八层纱布过滤,加热,加15g琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入葡萄糖,搅拌均匀,稍冷却后再补足水分至1l,分装锥形瓶包扎,115℃灭菌30min。
63.(2)将培养物在pda平板上划线分离,置于30℃恒温培养箱中培养 48
‑
72小时,获得红霉素降解菌株w1单菌落形态图(见图1);
64.下面为具体实施例部分。
65.实施例1
66.将红霉素降解菌w1在ypd液体培养基中培养,离心收集菌体,用无菌水重悬,将所
选菌株接种1%(每100ml无机盐培养基内添加1g菌体)到含 100.0mg/l红霉素的基础液体无机盐培养基中,置于恒温摇床中120r/min、 30℃培养80h,红霉素降解菌有明显的生长,对红霉素降解效率较高。
67.实施例2
68.将红霉素降解菌w1按1%(每100ml无机盐培养基内添加1g菌体) 的接种量接种于100ml的无菌msm中,添加红霉素至终浓度100mg/l,置于30℃、静置培养80h,测定红霉素降解率为83.53%(见图2)。
69.实施例3
70.将红霉素降解菌w1按1%(每100ml无机盐培养基内添加1g菌体) 的接种量接种于100ml含红霉素的废水中,经测定该废水的红霉素的含量为60mg/l,于30℃、静置培养80h,测定红霉素降解率为:68.52%(见图 3)
71.实施例4
72.将红霉素降解菌w1按1%(每100ml无机盐培养基内添加1g菌体) 的接种量接种于100g灭菌的土壤中,经测定,土壤中红霉素的含量为55mg/kg,于37℃恒温静置培养80h,测定红霉素降解率为66.44%(见图4)。
73.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
74.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。