抗b7-h3抗体及其制备和应用
技术领域
1.本发明涉及生物医药领域,更具体地涉及一种抗b7-h3抗体及其制备和应用。
背景技术:
2.肿瘤的生长和转移在很大程度上取决于其逃避宿主免疫监视并战胜宿主防御的能力。虽然大部分肿瘤表达可在不同程度上被宿主免疫系统识别的抗原,但是在许多情况下,由于效应t细胞的低效活化而引发不充分的免疫反应。
3.cd4 t-淋巴细胞是大多数哺乳动物免疫反应和自身免疫反应的主要组织者。已发现cd4 辅助性t-细胞的活化是通过抗原递呈细胞与初始cd4 t-淋巴细胞之间的共刺激所介导的,该过程需要两种细胞间的相互作用。在第一种相互作用中,抗原递呈细胞必须将相关的靶抗原通过主要组织相容性复合物(mhc)展示在细胞表面,使得其可结合初始cd4 t-淋巴细胞的t-细胞受体(“tcr”)。在第二种相互作用中,抗原递呈细胞的配体必须与cd4 t-淋巴细胞表面的cd28受体结合。cd4辅助性t-细胞在接受了共刺激信号后,便能够对细胞因子(例如白介素-2和白介素-12)产生相应,从而进一步发育成th1细胞。这些细胞能产生干扰素-γ(ifn-γ)和肿瘤坏死因子-α(tnf-α),进一步介导对表达靶抗原的靶细胞的炎症反应。b-细胞活化和增殖同样也会发生,进而产生针对靶抗原的特异性抗体。在t-细胞活化期间,任意一种共刺激信号的缺失,将导致t细胞进入克隆无能状态。在病理状态下,th1细胞是多种器官特异性自身免疫疾病,例如i型糖尿病、风湿性关节炎和多发性硬化的关键参与者。
4.b7家族成员是具有免疫球蛋白-v样结构域和免疫球蛋白-c样结构域(例如,igv-igc)的免疫球蛋白超家族成员。b7家族成员的igv和igc结构域各自由单一外显子编码,另外的外显子编码前导序列、跨膜结构域和胞质结构域。胞质结构域是短的,长度在19至62个氨基酸残基范围内且可由多个外显子编码。
5.b7-h3的独特之处在于其主要人类形式包含两个细胞外串联的igv-igc结构域(即,igv-igc-igv-igc)。b7家族的成员被预测为在细胞表面形成背靠背、非共价的同二聚体,且已发现这些二聚体与b7-1(cd80)和b7-2(cd86)有关。已鉴定到四个免疫球蛋白胞外域的变体(“4ig-b7-h3”)并发现其是更常见的人蛋白质形式。因为天然的小鼠形式(2ig)和人4ig形式显示出相似的功能,未观察到这两种形式之间的功能差异。4ig-b7-h3分子抑制自然杀伤细胞介导的癌细胞裂解)。已发现人b7-h3(2ig形式)通过结合活化的t细胞上的特定受体促进t-细胞活化和ifn-γ产生。
6.当b7-h3介导t细胞共刺激和共抑制时,该蛋白质的作用方式是复杂的。b7-h3结合(trem)-样转录物2(tlt-2)并共刺激t细胞活化,而且结合至今仍未确认的受体来介导t细胞的共抑制。另外,通过与未知受体的相互作用,b7-h3成为自然杀伤细胞和成骨细胞的抑制因子,该抑制可通过与大多数信号通路的成员的相互作用进行,t细胞受体(tcr)通过这些信号通路调节基因转录(例如nfta、nf-κb或ap-1因子)。b7-h3共刺激cd4 和cd8 t-细胞的增殖。b7-h3还刺激ifn-γ产生和cd8 的裂解活性。然而,该蛋白质还可能通过nfat(用于
活化的t细胞的核因子)、nf-κb(核因子κb)和ap-1(激活蛋白-1)因子来抑制t细胞活化。b7-h3还被认为能在体内抑制th1、th2或th17。
7.多个独立研究已表明人恶性肿瘤细胞在b7-h3蛋白表达方面表现出显著的增加且这种表达增加与疾病严重度的增加有关,表明b7-h3被肿瘤作为免疫逃避通路利用。人b7-h3除了表达在成神经细胞瘤细胞上,还已知其表达在多种其他癌细胞(例如,胃癌、卵巢癌和非小细胞肺癌)上。通过阻断b7-h3与其受体的结合,或以b7-h3作为肿瘤高表达抗原开发相应的靶向治疗产品,是治疗多种不同肿瘤的潜在手段。
8.目前,现有技术中针对b7-h3开发的肿瘤靶向治疗产品还有许多的不足,本领域需要开发新的治疗性抗体相关产品。
技术实现要素:
9.本发明的目的在于提供一种抗b7-h3抗体及其制备和应用。
10.在本发明的第一方面,提供了一种抗体的重链可变区,所述的重链可变区包括以下三个互补决定区cdr:
11.seq id no:3n所示的vh-cdr1,
12.seq id no:3n 1所示的vh-cdr2,和
13.seq id no:3n 2所示的vh-cdr3;
14.其中,各n独立地为11、12、13、14、15、16、或17;
15.或者,所述的重链可变区包括以下三个互补决定区cdr:
16.seq id no:33所示的vh-cdr1,
17.seq id no:54所示的vh-cdr2,和
18.seq id no:35所示的vh-cdr3;
19.或
20.seq id no:36所示的vh-cdr1,
21.seq id no:55所示的vh-cdr2,和
22.seq id no:56所示的vh-cdr3;
23.或
24.seq id no:57所示的vh-cdr1,
25.seq id no:40所示的vh-cdr2,和
26.seq id no:41所示的vh-cdr3;
27.或
28.seq id no:51所示的vh-cdr1,
29.seq id no:52所示的vh-cdr2,和
30.seq id no:58所示的vh-cdr3;
31.或
32.seq id no:51所示的vh-cdr1,
33.seq id no:59所示的vh-cdr2,和
34.seq id no:60所示的vh-cdr3;
35.其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰
和/或取代至少一个氨基酸的,并能够保留b7-h3结合亲和力的衍生序列。
36.在另一优选例中,所述重链可变区包括以下三个互补决定区cdr:
[0037][0038]
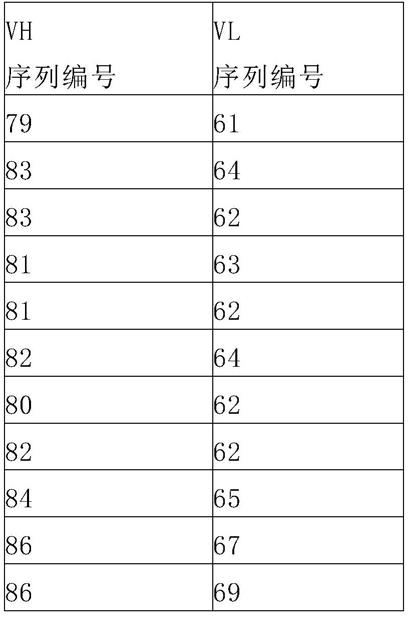
在另一优选例中,所述重链可变区具有seq id no:79-96中任一所示的氨基酸序列。
[0039]
在本发明的第二方面,提供了一种抗体的重链,所述的重链具有如本发明的第一方面所述的重链可变区。
[0040]
在另一优选例中,所述重链还包括重链恒定区。
[0041]
在另一优选例中,所述重链恒定区为人源。
[0042]
在另一优选例中,所述重链恒定区为人源抗体重链igg1或igg4恒定区。
[0043]
在本发明的第三方面,提供了一种抗体的轻链可变区,所述的轻链可变区包括以下三个互补决定区cdr:
[0044]
seq id no:3m 1所示的vl-cdr1,
[0045]
seq id no:3m 2所示的vl-cdr2,和
[0046]
seq id no:3m 3所示的vl-cdr3;
[0047]
其中,各m独立地为0、1、2、3、4、5、6、或7;
[0048]
或者,所述的轻链可变区包括以下三个互补决定区cdr:
[0049]
seq id no:1所示的vl-cdr1,
[0050]
seq id no:25所示的vl-cdr2,和
[0051]
seq id no:3所示的vl-cdr3;
[0052]
或
[0053]
seq id no:1所示的vl-cdr1,
[0054]
seq id no:26所示的vl-cdr2,和
[0055]
seq id no:3所示的vl-cdr3;
[0056]
或
[0057]
seq id no:27所示的vl-cdr1,
[0058]
seq id no:5所示的vl-cdr2,和
[0059]
seq id no:6所示的vl-cdr3;
[0060]
或
[0061]
seq id no:27所示的vl-cdr1,
[0062]
seq id no:28所示的vl-cdr2,和
[0063]
seq id no:6所示的vl-cdr3;
[0064]
或
[0065]
seq id no:29所示的vl-cdr1,
[0066]
seq id no:11所示的vl-cdr2,和
[0067]
seq id no:12所示的vl-cdr3;
[0068]
或
[0069]
seq id no:30所示的vl-cdr1,
[0070]
seq id no:23所示的vl-cdr2,和
[0071]
seq id no:31所示的vl-cdr3;
[0072]
或
[0073]
seq id no:30所示的vl-cdr1,
[0074]
seq id no:23所示的vl-cdr2,和
[0075]
seq id no:32所示的vl-cdr3;
[0076]
其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留b7-h3结合亲和力的衍生序列。
[0077]
在另一优选例中,所述轻链可变区包括以下三个互补决定区cdr:
[0078]
[0079][0080]
在另一优选例中,所述轻链可变区具有seq id no:61-78中任一所示的氨基酸序列。
[0081]
在本发明的第四方面,提供了一种抗体的轻链,所述的轻链具有如本发明的第三方面所述的轻链可变区。
[0082]
在另一优选例中,所述轻链还包括轻链恒定区。
[0083]
在另一优选例中,所述轻链恒定区为人源。
[0084]
在另一优选例中,所述轻链恒定区为人源抗体轻链kappa恒定区。
[0085]
在本发明的第五方面,提供了一种抗体,所述抗体具有:
[0086]
(1)如本发明的第一方面所述的重链可变区;和/或
[0087]
(2)如本发明的第三方面所述的轻链可变区;
[0088]
或者,所述抗体具有:如本发明的第二方面所述的重链;和/或如本发明的第四方面所述的轻链,
[0089]
其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留b7-h3结合亲和力的衍生序列。
[0090]
在另一优选例中,上述任一cdr的氨基酸序列中包含经过添加、缺失、修饰和/或取代1、2或3个氨基酸的衍生cdr序列,并且使得含有所述衍生cdr序列的vh和vl所构成的衍生抗体能够保留与b7-h3结合的亲和力。
[0091]
在另一优选例中,所述的衍生抗体与b7-h3结合的亲和力f1与相应非衍生的抗体与b7-h3结合的亲和力f0之比(f1/f0)为0.5-2,较佳地为0.7-1.5,和更佳地0.8-1.2。
[0092]
在另一优选例中,所述添加、缺失、修饰和/或取代的氨基酸数量为1-5个(如1-3个,较佳地1-2个,更佳地1个)。
[0093]
在另一优选例中,所述的经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留b7-h3结合亲和力的衍生序列为同源性或序列相同性为至少96%的氨基酸序列。
[0094]
在另一优选例中,所述的抗体还包括重链恒定区和/或轻链恒定区。
[0095]
在另一优选例中,所述的重链恒定区为人源的,和/或所述的轻链恒定区为人源的。
[0096]
在另一优选例中,所述重链恒定区为人源抗体重链igg1或igg4恒定区,且所述轻链恒定区为人源抗体轻链kappa恒定区。
[0097]
在另一优选例中,所述抗体选自下组:动物源抗体、嵌合抗体、人源化抗体、全人抗体、或其组合。
[0098]
在另一优选例中,所述的嵌合抗体在人中的免疫原性z1与非嵌合的抗体(如鼠源抗体)在人中的免疫原性z0之比(z1/z0)为0-0.5,较佳地0-0.2,更佳地0-0.05(如0.001-0.05)。
[0099]
在另一优选例中,所述的抗体是部分或全人源化、或全人的单克隆抗体。
[0100]
在另一优选例中,所述的抗体为双链抗体、或单链抗体。
[0101]
在另一优选例中,所述抗体为抗体全长蛋白、或抗原结合片段。
[0102]
在另一优选例中,所述抗体为双特异性抗体、或多特异性抗体。
[0103]
在另一优选例中,所述抗体具有选自下组的一个或多个特性:
[0104]
(a)抑制肿瘤细胞迁移或转移;
[0105]
(b)抑制肿瘤生长;和
[0106]
(c)解除肿瘤对t细胞的免疫抑制。
[0107]
在另一优选例中,所述的抗体具有如本发明的第一方面所述的重链可变区和如本发明的第三方面所述的轻链可变区;
[0108]
其中,所述的重链可变区和所述的轻链可变区如下:
[0109][0110][0111]
其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留b7-h3结合亲和力的衍生序列。
[0112]
在另一优选例中,所述的抗体具有如本发明的第一方面所述的重链可变区和如本发明的第三方面所述的轻链可变区;其中,
[0113]
所述的重链可变区包括以下三个互补决定区cdr:
[0114]
seq id no:33所示的vh-cdr1,
[0115]
seq id no:54所示的vh-cdr2,和
[0116]
seq id no:35所示的vh-cdr3;
[0117]
所述的轻链可变区包括以下三个互补决定区cdr:
[0118]
seq id no:1所示的vl-cdr1,
[0119]
seq id no:26所示的vl-cdr2,和
[0120]
seq id no:3所示的vl-cdr3;
[0121]
或
[0122]
所述的重链可变区包括以下三个互补决定区cdr:
[0123]
seq id no:33所示的vh-cdr1,
[0124]
seq id no:54所示的vh-cdr2,和
[0125]
seq id no:35所示的vh-cdr3;
[0126]
所述的轻链可变区包括以下三个互补决定区cdr:
[0127]
seq id no:1所示的vl-cdr1,
[0128]
seq id no:2所示的vl-cdr2,和
[0129]
seq id no:3所示的vl-cdr3;
[0130]
或
[0131]
所述的重链可变区包括以下三个互补决定区cdr:
[0132]
seq id no:33所示的vh-cdr1,
[0133]
seq id no:34所示的vh-cdr2,和
[0134]
seq id no:35所示的vh-cdr3;
[0135]
所述的轻链可变区包括以下三个互补决定区cdr:
[0136]
seq id no:1所示的vl-cdr1,
[0137]
seq id no:25所示的vl-cdr2,和
[0138]
seq id no:3所示的vl-cdr3。
[0139]
在另一优选例中,所述抗体的重链可变区含有seq id no:79-96中任一所示的氨基酸序列;和/或所述抗体的轻链可变区含有seq id no:61-78中任一所示的氨基酸序列。
[0140]
在另一优选例中,所述的抗体为人源化抗体,并且所述抗体的重链可变区含有seq id no:83所示的氨基酸序列;且所述抗体的轻链可变区含有seq id no:64所示的氨基酸序列;
[0141]
或者,所述抗体的重链可变区含有seq id no:83所示的氨基酸序列;且所述抗体的轻链可变区含有seq id no:62所示的氨基酸序列;
[0142]
或者,所述抗体的重链可变区含有seq id no:81所示的氨基酸序列;且所述抗体的轻链可变区含有seq id no:63所示的氨基酸序列。
[0143]
在另一优选例中,所述重链可变区的氨基酸序列与如序列表中seq id no:79-96中任一所示的氨基酸序列至少有80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同源性或序列相同性。
[0144]
在另一优选例中,所述轻链可变区的氨基酸序列与如序列表中seq id no:61-78中任一所示的氨基酸序列至少有80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同源性或序列相同性。
[0145]
重组蛋白,所述的重组蛋白包括:
[0146]
(i)如本发明的第一方面所述的重链可变区、如本发明的第二方面所述的重链、如本发明的第三方面所述的轻链可变区、如本发明的第四方面所述的轻链、或如本发明的第
五方面所述的抗体;以及
[0147]
(ii)任选的协助表达和/或纯化的标签序列。
[0148]
在另一优选例中,所述的标签序列包括6his标签。
[0149]
在另一优选例中,所述的重组蛋白(或多肽)包括融合蛋白。
[0150]
在另一优选例中,所述的重组蛋白为单体、二聚体、或多聚体。
[0151]
在本发明的另一方面,提供了一种靶向b7-h3的嵌合抗原受体(car),所述car的抗原结合结构域包括如本发明的第一方面所述的重链可变区、或如本发明的第三方面所述的轻链可变区。
[0152]
在另一优选例中,所述car的结构如下式i所示:
[0153]
l-scfv-h-tm-c-cd3ζ(i)
[0154]
式中,
[0155]
各
“-”
独立地为连接肽或肽键;
[0156]
l为无或信号肽序列;
[0157]
h为无或铰链区;
[0158]
tm为跨膜结构域;
[0159]
c为共刺激信号分子;
[0160]
cd3ζ为源于cd3ζ的胞浆信号传导序列。
[0161]
在本发明的第七方面,提供了一种多核苷酸,所述多核苷酸编码选自下组的多肽:
[0162]
(1)如本发明的第一方面所述的重链可变区、如本发明的第二方面所述的重链、如本发明的第三方面所述的轻链可变区、如本发明的第四方面所述的轻链、或如本发明的第五方面所述的抗体;以及
[0163]
(2)如本发明的第六方面所述的重组蛋白。
[0164]
在本发明的第八方面,提供了一种载体,所述载体含有本发明的第七方面所述的多核苷酸。
[0165]
在另一优选例中,所述的载体包括:细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒、或其他载体。
[0166]
在本发明的第九方面,提供了一种遗传工程化的宿主细胞,所述宿主细胞含有本发明的第八方面所述的载体或基因组中整合有本发明的第七方面所述的多核苷酸。
[0167]
在本发明的第十方面,提供了一种抗体偶联物,该抗体偶联物含有:
[0168]
(a)抗体部分,所述抗体部分选自下组:如本发明的第一方面所述的重链可变区、如本发明的第二方面所述的重链、如本发明的第三方面所述的轻链可变区、如本发明的第四方面所述的轻链、或如本发明的第五方面所述的抗体、或其组合;和
[0169]
(b)与所述抗体部分偶联的偶联部分,所述偶联部分选自下组:可检测标记物、药物、毒素、细胞因子、放射性核素、酶、或其组合。
[0170]
在另一优选例中,所述的抗体部分与所述的偶联部分通过化学键或接头进行偶联。
[0171]
在另一优选例中,所述抗体药物偶联物adc如下分子式所示:
[0172][0173]
其中:
[0174]
ab是抗b7-h3的抗体,
[0175]
lu是接头(又称连接子);
[0176]
d是药物;
[0177]
而且下标p是选自1-10,较佳地1-8的值。
[0178]
在另一优选例中,所述药物选自下组:化疗药物、放疗药物、激素治疗药物或免疫治疗药物。
[0179]
在另一优选例中,所述毒素选自下组:紫杉烷类(taxane)、美登素类(maytansinoid)、奥利斯他汀类(auristatin)、卡奇霉素(calicheamicin)、蒽环类药物(anthracycline)、多西他赛(docetaxel)、组织蛋白酶(cathepsin)、蓖麻毒素(ricin)、白树毒素(gelonin)、绿脓杆菌外毒素(pseudomonas exotoxin)、白喉毒素(diphtheria toxin)、核糖核酸酶(rnase)和放射性同位素(radioisotope)。
[0180]
在本发明的第十一方面,提供了一种免疫细胞,所述免疫细胞表达或在细胞膜外暴露有本发明的第五方面所述的抗体。
[0181]
在另一优选例中,所述的免疫细胞包括nk细胞、t细胞。
[0182]
在另一优选例中,所述的免疫细胞来自人或非人哺乳动物(如鼠)。
[0183]
在本发明的第十二方面,提供了一种药物组合物,所述药物组合物含有:
[0184]
(i)活性成分,所述活性成分选自下组:如本发明的第一方面所述的重链可变区、如本发明的第二方面所述的重链、如本发明的第三方面所述的轻链可变区、如本发明的第四方面所述的轻链、或如本发明的第五方面所述的抗体、如本发明的第六方面所述的重组蛋白、如本发明的第十方面所述的抗体偶联物、本发明的第十一方面所述的免疫细胞、或其组合;以及
[0185]
(ii)药学上可接受的载体。
[0186]
在另一优选例中,所述的药物组合物为液态制剂。
[0187]
在另一优选例中,所述的药物组合物为注射剂。
[0188]
在另一优选例中,所述的药物组合物包括0.01-99.99%的如本发明的第五方面所述的抗体、如本发明的第六方面所述的重组蛋白、如本发明的第十方面所述的抗体偶联物、本发明的第十一方面所述的免疫细胞、或其组合和0.01-99.99%的药用载体,所述百分比为占所述药物组合物的质量百分比。
[0189]
在另一优选例中,所述的药物组合物还包含第二活性成分,所述第二活性成分包括第二抗体、或化疗剂。
[0190]
在另一优选例中,所述第二抗体选自下组:ctla4抗体、pd-1抗体、pd-l1抗体、vegf抗体、b7-h4抗体、her2抗体、lag3抗体、tim-3抗体、4-1bb抗体、cd3抗体、tigit抗体。
[0191]
在另一优选例中,所述化疗剂选自下组:多西他赛、卡铂、或其组合。
[0192]
在本发明的第十三方面,提供了一种活性成分的用途,所述活性成分选自下组:如本发明的第一方面所述的重链可变区、如本发明的第二方面所述的重链、如本发明的第三
方面所述的轻链可变区、如本发明的第四方面所述的轻链、或如本发明的第五方面所述的抗体、如本发明的第六方面所述的重组蛋白、如本发明的第十方面所述的抗体偶联物、本发明的第十一方面所述的免疫细胞、或其组合,其中所述活性成分被用于(a)制备预防和/或治疗与b7-h3表达或功能异常相关的疾病的药物;和/或(b)制备诊断试剂或试剂盒。
[0193]
在另一优选例中,所述的诊断试剂为检测片或检测板。
[0194]
在另一优选例中,所述b7-h3表达或功能异常相关的疾病选自下组:肿瘤和自身免疫性疾病。
[0195]
在另一优选例中,所述肿瘤选自下组:黑色素瘤,间皮瘤,非小细胞肺癌,乳腺癌,肝癌,胰胃食管癌,腺癌,头颈部癌、滑膜肉瘤,结直肠癌,肾癌,膀胱癌,前列腺癌,卵巢癌,丙型肝炎病毒慢性感染,晚期实体癌,消化器官恶性肿瘤,子宫内膜癌,复发黑色素瘤,头颈部鳞状细胞癌,皮肤t细胞淋巴瘤,输卵管癌,腹膜肿瘤,肌肉浸润性膀胱癌,广泛的阶段小细胞肺癌,成人急性髓细胞性白血病,非典型慢性粒细胞白血病,卵巢上皮细胞癌,b细胞慢性淋巴细胞白血病,皮肤b细胞非霍奇金淋巴瘤,眼内淋巴瘤,睾丸绒毛膜癌,神经母细胞瘤,食管癌。
[0196]
在另一优选例中,所述自身免疫性疾病选自下组:系统性红斑狼疮、口眼干燥综合征、类风湿性关节炎、强直性脊柱炎、硬皮病、结节性多动脉炎、wegener肉芽肿病、甲状腺功能亢进、胰岛素依赖型糖尿病、重症肌无力、寻常天皰疮、类天皰疮、移植排斥。
[0197]
在另一优选例中,所述诊断试剂或试剂盒用于:检测样品中b7-h3蛋白。
[0198]
在另一优选例中,所述的诊断试剂或试剂盒用于诊断b7-h3相关疾病。
[0199]
在本发明的第十四方面,提供了一种体外检测(包括诊断性或非诊断性)样品中b7-h3蛋白的方法,所述方法包括步骤:
[0200]
(1)在体外,将所述样品与如本发明的第五方面所述的抗体接触;
[0201]
(2)检测是否形成抗原-抗体复合物,其中形成复合物就表示样品中存在b7-h3蛋白。
[0202]
在本发明的第十五方面,提供了一种体外检测样品中b7-h3蛋白的组合物,其包括如本发明的第五方面所述的抗体、如本发明的第六方面所述的重组蛋白、如本发明的第十方面所述的抗体偶联物、本发明的第十一方面所述的免疫细胞、或其组合作为活性成分。
[0203]
在本发明的第十六方面,提供了一种检测板,所述的检测板包括:基片(支撑板)和测试条,所述的测试条含有如本发明的第五方面所述的抗体、如本发明的第六方面所述的重组蛋白、如本发明的第十方面所述的抗体偶联物、本发明的第十一方面所述的免疫细胞、或其组合。
[0204]
在本发明的第十七方面,提供了一种试剂盒,所述试剂盒中包括:
[0205]
(1)第一容器,所述第一容器中含有本发明的抗体;和/或
[0206]
(2)第二容器,所述第二容器中含有抗本发明抗体的二抗;
[0207]
或者,
[0208]
所述试剂盒含有如本发明的第十六方面所述的检测板。
[0209]
在本发明的第十八方面,提供了一种重组多肽的制备方法,该方法包括:
[0210]
(a)在适合表达的条件下,培养如本发明的第九方面所述的宿主细胞;
[0211]
(b)从培养物中分离出重组多肽,所述的重组多肽是如本发明的第五方面所述的
抗体或如本发明的第六方面所述的重组蛋白。
[0212]
在本发明的第十九方面,提供了一种治疗与b7-h3表达或功能异常相关的疾病的方法,向有需要的对象施用有效量的如本发明的第五方面所述的抗体、或如本发明的第六方面所述的重组蛋白、或如本发明的第十方面所述的抗体偶联物、或如本发明的第十一方面所述的免疫细胞、或如本发明的第十二方面所述的药物组合物、或其组合。
[0213]
在另一优选例中,所述与b7-h3表达或功能异常相关的疾病为癌症。
[0214]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0215]
图1显示了nci-h1975皮下异种移植瘤相对肿瘤体积(平均值
±
标准误)。
[0216]
图2显示了nci-h1975皮下异种移植瘤荷瘤鼠相对动物体重(平均值
±
标准误)。
具体实施方式
[0217]
本发明人经过广泛而深入地研究,首次意外地发现一种抗b7-h3抗体。本发明还提供了该抗体的制备方法和相关应用。本发明的抗体对靶蛋白b7-h3拥有高亲和力和高选择性,能够有效地被细胞内吞,且易于表达和纯化。利用本发明的抗体制备成adc在动物模型中表现出明显的肿瘤抑制效果。在此基础上完成了本发明。
[0218]
具体地,本发明分别采用b7-h3-his蛋白和过表达b7-h3的cho-k细胞,通过皮下、腹腔多点注射免疫健康balb/c小鼠,免疫3-4次后去血清效价最高的小鼠,安乐死后取脾脏构建噬菌体展示库。经过三轮液相筛选,用b7-h3-his包被酶标板,加入抗b7-h3的fab上清,通过elisa筛选获得特异性结合b7-h3的阳性克隆。对阳性克隆测序,并进行细胞水平结合验证以及猴b7-h3交叉结合验证,将能同时与细胞水平b7-h3和猴b7-h3结合的候选抗体进行全长抗体构建。
[0219]
同时,用4000多例人pbmc样本,进行rna的抽提,并根据imgt数据库设计了不同germline的引物,并按照文献报道的人源基因占比,设定建库方案,共组建了四个不同germline占比的百亿库,合并为千亿级抗体库。经过三轮液相筛选后,用anti-fd包被酶标板,然后加入抗b7-h3的fab上清,通过夹心法elisa筛选获得特异性结合b7-h3的阳性克隆。将获得的阳性克隆进行测序,得到的单克隆进行细胞水平结合、猴子b7-h3结合的验证,将能与细胞水平b7-h3以及猴子b7-h3结合的候选抗体进行全长抗体构建。
[0220]
将载有上述小鼠免疫库和人源库筛选到的抗体轻链和重链的质粒共转染expicho-s细胞,表达7天后收集细胞表达上清,利用protein a亲和层析柱进行纯化,纯化后通过sds-page和sec鉴定抗体的纯度。
[0221]
纯化后的抗体,经过蛋白水平结合、种属交叉检测、细胞水平结合以及内吞或活性检测。综合所有实验结果,最终获得了8条小鼠免疫库和3条人源库的候选抗体。进一步的,在小鼠免疫库候选抗体中,选择了其中两个抗体进行人源化。通过cdr移植将鼠源的抗体的cdr移植到对应的人源抗体骨架上,然后通过3d结构模拟设计若干对轻重链的突变体,瞬转表达之后验证抗体的活性。
[0222]
b7-h3
[0223]
在细胞免疫反应中,t细胞的增殖和活化不仅需要t细胞受体tcr识别apc或肿瘤细胞表面mhc提呈的第一信号,还需要共刺激分子提供的第二信号。b7-cd28超家族是目前发现的共刺激分子家族之一,属于免疫球蛋白超家族。b7家族分子可提供刺激信号来增强和维持t细胞免疫应答,也可产生抑制信号来限制和减弱t细胞免疫反应。因此该家族在肿瘤疾病、器官移植和自身免疫病中发挥重要作用。
[0224]
根据功能,b7家族可以分为3类。
[0225]
第一组:b7-1(cd80)和b7-2(cd86)。
[0226]
第二组:b7-h1(pd-l1)和b7-dc(pd-l2)
[0227]
第三组:b7-h3(cd276)和b7-h4(b7x)组成。它们的受体尚未被确定,但被认为参与了共刺激和共抑制途径。
[0228]
b7-h3(b7homolog 3protein)又名cd276,是b7-cd28家族重要的免疫检查点分子。它是chapoval等人于2001年在人树突状细胞cdna文库中鉴定到的b7家族成员。b7-h3主要以膜蛋白和可溶形式存在,可溶的b7-h3(soluble b7-h3,sb7-h3)由膜蛋白经金属蛋白酶剪切而来。此外,在外泌体和其他胞外小泡中也发现了b7-h3蛋白。
[0229]
b7-h3是一种t细胞共抑制分子,具有部分共刺激功能。b7-h3可有效抑制t细胞和nk细胞功能,对骨发育也有作用。
[0230]
b7-h3在多种恶性肿瘤中均有表达,与恶性肿瘤的生长、转移、复发、预后不良等因素密切相关。b7-h3可下调t辅助1型介导的免疫反应抑制cd4 t细胞活化,并抑制细胞因子的产生,因而可能发挥促进癌细胞免疫逃逸的作用。
[0231]
b7-h3是由316个氨基酸组成的i型跨膜糖蛋白,分子量为45-66kda,其与b7-h1(pd-l1)有相似的分子结构。它包含一个推定的28aa信号肽,一个由免疫球蛋白恒定(igc)和可变(igv)结构组成的217aa细胞外区域,一个跨膜区域和45个氨基酸的胞质结构域。该基因由10个外显子组成,其中4-7个外显子编码胞外igv-igc结构域。
[0232]
目前发现b7-h3有两种存在形式:2ig-b7-h3和4ig-b7-h3。2ig-b7-h3表达于鼠与人的细胞中,其有细胞外的igv-igc结构;4ig-b7-h3仅表达于人细胞中,由串联重复的igv-igc-igv-igc结构组成。人类b7-h3的主要存在形式为4igb7-h3,位于15号染色体。小鼠b7-h3基因则位于第9号染色体。b7-h3是进化最保守的b7家族成员之一,因为它在从硬骨鱼类到哺乳动物的各种物种中普遍表达。
[0233]
b7-h3转录本广泛表达于心脏、肝脏、胎盘、前列腺、睾丸、子宫、胰腺、小肠和结肠等组织。而b7-h3蛋白的表达更多地局限于细胞表面,例如活化的树突状细胞、单核细胞、t细胞、b细胞和nk细胞。
[0234]
b7-h3异常髙表达于多种癌细胞或组织中,包括胃癌、肺癌、前列腺癌、肾癌、胰腺癌、卵巢癌、乳腺癌、子宫内膜癌、肝癌、结肠直肠癌、口腔癌、膀胱癌、骨肉瘤及血液系统恶性疾病。
[0235]
调节b7-h3表达的分子机制尚不清楚,但b7-h3蛋白的表达与mir-29水平成反比,且b7-h3上的mir-29结合位点在进化中是保守的。
[0236]
抗体
[0237]
如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的
异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。
[0238]
如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
[0239]
脊椎动物抗体(免疫球蛋白)的“轻链”可根据其恒定区的氨基酸序列归为明显不同的两类(称为κ和λ)中的一类。根据其重链恒定区的氨基酸序列,免疫球蛋白可以分为不同的种类。主要有5类免疫球蛋白:iga、igd、ige、igg和igm,其中一些还可进一步分成亚类(同种型),如igg1、igg2、igg3、igg4、iga和iga2。对应于不同类免疫球蛋白的重链恒定区分别称为α、δ、ε、γ、和μ。不同类免疫球蛋白的亚单位结构和三维构型是本领域人员所熟知的。
[0240]
一般,抗体的抗原结合特性可由位于重链和轻链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。
[0241]
本发明不仅包括完整的抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。
[0242]
在本发明中,抗体包括用本领域技术人员熟知技术所制备的鼠的、嵌合的、人源化的或者全人的抗体。重组抗体,例如嵌合的和人源化的单克隆抗体,包括人的和非人的部分,可以通过标准的dna重组技术获得,它们都是有用的抗体。嵌合抗体是一个分子,其中不同的部分来自不同的动物种,例如具有来自鼠的单克隆抗体的可变区,和来自人免疫球蛋白的恒定区的嵌合抗体(见例如美国专利4,816,567和美国专利4,816,397,在此通过引用方式整体引入本文)。人源化的抗体是指来源于非人物种的抗体分子,具有一个或多个来源于非人物种的互补决定区(cdrs)和来源于人免疫球蛋白分子的框架区域(见美国专利5,585,089,在此通过引用方式整体引入本文)。这些嵌合和人源化的单克隆抗体可以采用本领域熟知的dna重组技术制备。
[0243]
在本发明中,抗体可以是单特异性、双特异性、三特异性、或者更多的多重特异性。
[0244]
在本发明中,本发明的抗体还包括其保守性变异体,指与本发明抗体的氨基酸序
列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
[0245]
表a
[0246][0247][0248]
抗b7-h3抗体
[0249]
本发明提供一种针对b7-h3的高特异性和高亲和力的抗体,其包括重链和轻链,所述重链含有重链可变区(vh)氨基酸序列,所述轻链含有轻链可变区(vl)氨基酸序列。
[0250]
在另一优选例中,所述抗体包含重链可变区和轻链可变区;
[0251]
其中,所述重链可变区包括以下三个互补决定区cdr:
[0252][0253]
所述轻链可变区包括以下三个互补决定区cdr:
[0254]
[0255][0256]
在另一优选例中,所述抗体的重链可变区含有seq id no:79-96中任一所示的氨基酸序列;和/或所述抗体的轻链可变区含有seq id no:61-78中任一所示的氨基酸序列。
[0257]
在另一优选例中,所述的抗体包括:
[0258]
[0259][0260]
在优选的实施方式中,所述的抗体包含重链可变区和轻链可变区;其中,
[0261]
所述的重链可变区包括以下三个互补决定区cdr:
[0262]
seq id no:33所示的vh-cdr1,
[0263]
seq id no:54所示的vh-cdr2,和
[0264]
seq id no:35所示的vh-cdr3;
[0265]
所述的轻链可变区包括以下三个互补决定区cdr:
[0266]
seq id no:1所示的vl-cdr1,
[0267]
seq id no:26所示的vl-cdr2,和
[0268]
seq id no:3所示的vl-cdr3;
[0269]
或
[0270]
所述的重链可变区包括以下三个互补决定区cdr:
[0271]
seq id no:33所示的vh-cdr1,
[0272]
seq id no:54所示的vh-cdr2,和
[0273]
seq id no:35所示的vh-cdr3;
[0274]
所述的轻链可变区包括以下三个互补决定区cdr:
[0275]
seq id no:1所示的vl-cdr1,
[0276]
seq id no:2所示的vl-cdr2,和
[0277]
seq id no:3所示的vl-cdr3;
[0278]
或
[0279]
所述的重链可变区包括以下三个互补决定区cdr:
[0280]
seq id no:33所示的vh-cdr1,
[0281]
seq id no:34所示的vh-cdr2,和
[0282]
seq id no:35所示的vh-cdr3;
[0283]
所述的轻链可变区包括以下三个互补决定区cdr:
[0284]
seq id no:1所示的vl-cdr1,
[0285]
seq id no:25所示的vl-cdr2,和
[0286]
seq id no:3所示的vl-cdr3。
[0287]
在另一优选例中,所述的抗体为人源化抗体,并且所述抗体的重链可变区含有seq id no:83所示的氨基酸序列;且所述抗体的轻链可变区含有seq id no:64所示的氨基酸序列;
[0288]
或者,所述抗体的重链可变区含有seq id no:83所示的氨基酸序列;且所述抗体
的轻链可变区含有seq id no:62所示的氨基酸序列;
[0289]
或者,所述抗体的重链可变区含有seq id no:81所示的氨基酸序列;且所述抗体的轻链可变区含有seq id no:63所示的氨基酸序列。
[0290]
在另一优选例中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留b7-h3结合亲和力的衍生序列。
[0291]
在另一优选例中,所述经过添加、缺失、修饰和/或取代至少一个氨基酸序列所形成的序列优选为同源性为至少80%,较佳地至少85%,更佳地至少为90%,最佳地至少95%的氨基酸序列。更优选地,所述添加、缺失、修饰和/或取代的氨基酸数量,可以是1-7个,更优选为1-5个,更优选为1-3个,更优选为1-2个。
[0292]
本发明的抗体可以是双链或单链抗体,并且可以是选自动物源抗体、嵌合抗体、人源化抗体,更优选为人源化抗体、人-动物嵌合抗体,更优选为全人源化抗体。
[0293]
本发明所述抗体衍生物可以是单链抗体、和/或抗体片段,如:fab、fab'、(fab')2或该领域内其他已知的抗体衍生物等,以及iga、igd、ige、igg以及igm抗体或其他亚型的抗体中的任意一种或几种。
[0294]
其中,所述动物优选为哺乳动物,如鼠。
[0295]
本发明抗体可以是靶向人b7-h3的嵌合抗体、人源化抗体、cdr嫁接和/或修饰的抗体。
[0296]
抗体的制备
[0297]
本发明抗体或其片段的dna分子的序列可以用常规技术,比如利用pcr扩增或基因组文库筛选等方法获得。此外,还可将轻链和重链的编码序列融合在一起,形成单链抗体。
[0298]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
[0299]
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
[0300]
目前,已经可以完全通过化学合成来得到编码所述的本发明的抗体(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0301]
本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0302]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。优选的动物细胞包括(但并不限于):cho-s、hek-293细胞。
[0303]
通常,在适合本发明抗体表达的条件下,培养转化所得的宿主细胞。然后用常规的免疫球蛋白纯化步骤,如蛋白a-sepharose、羟基磷灰石层析、凝胶电泳、透析、离子交换层析、疏水层析、分子筛层析或亲和层析等本领域技术人员熟知的常规分离纯化手段纯化得到本发明的抗体。
[0304]
所得单克隆抗体可用常规手段来鉴定。比如,单克隆抗体的结合特异性可用免疫沉淀或体外结合试验(如放射性免疫测定(ria)或酶联免疫吸附测定(elisa))来测定。单克隆抗体的结合亲和力例如可用munson等,anal.biochem.,107:220(1980)的scatchard分析来测定。
[0305]
本发明的抗体可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超声处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0306]
抗体-药物偶联物(adc)
[0307]
本发明还提供了基于本发明抗体的抗体偶联药物(antibody-drug conjugate,adc)。
[0308]
典型地,所述抗体偶联药物包括所述抗体、以及效应分子,所述抗体与所述效应分子偶联,并优选为化学偶联。其中,所述效应分子优选为具有治疗活性的药物。此外,所述效应分子可以是毒素、毒蛋白、化疗药物、小分子药物或放射性核素中的一种或多种。
[0309]
本发明抗体与所述效应分子之间可以是通过偶联剂进行偶联。所述偶联剂的例子可以是非选择性偶联剂、利用羧基的偶联剂、肽链、利用二硫键的偶联剂中的任意一种或几种。所述非选择性偶联剂是指使效应分子和抗体形成共价键连接的化合物,如戊二醛等。所述利用羧基的偶联剂可以是顺乌头酸酐类偶联剂(如顺乌头酸酐)、酰基腙类偶联剂(偶联位点为酰基腙)中的任意一种或几种。
[0310]
抗体上某些残基(如cys或lys等)用于与多种功能基团相连,其中包括成像试剂(例如发色基团和荧光基团),诊断试剂(例如mri对比剂和放射性同位素),稳定剂(例如乙二醇聚合物)和治疗剂。抗体可以被偶联到功能剂以形成抗体-功能剂的偶联物。功能剂(例如药物,检测试剂,稳定剂)被偶联(共价连接)至抗体上。功能剂可以直接地、或者是通过接头间接地连接于抗体。
[0311]
抗体可以偶联药物从而形成抗体药物偶联物(adcs)。典型地,adc包含位于药物和抗体之间的接头。接头可以是可降解的或者是不可降解的接头。可降解的接头典型地在细胞内环境下容易降解,例如在目标位点处接头发生降解,从而使药物从抗体上释放出来。合适的可降解的接头包括,例如酶降解的接头,其中包括可以被细胞内蛋白酶(例如溶酶体蛋白酶或者内体蛋白酶)降解的含有肽基的接头,或者糖接头例如,可以被葡糖苷酸酶降解的含葡糖苷酸的接头。肽基接头可以包括,例如二肽,例如缬氨酸-瓜氨酸,苯丙氨酸-赖氨酸或者缬氨酸-丙氨酸。其它合适的可降解的接头包括,例如,ph敏感接头(例如ph小于5.5时水解的接头,例如腙接头)和在还原条件下会降解的接头(例如二硫键接头)。不可降解的接头典型地在抗体被蛋白酶水解的条件下释放药物。
[0312]
连接到抗体之前,接头具有能够和某些氨基酸残基反应的活性反应基团,连接通过活性反应基团实现。巯基特异性的活性反应基团是优选的,并包括:例如马来酰亚胺类化合物,卤代酰胺(例如碘、溴或氯代的);卤代酯(例如碘、溴或氯代的);卤代甲基酮(例如碘、溴或氯代),苄基卤代物(例如碘、溴或氯代的);乙烯基砜,吡啶基二硫化物;汞衍生物例如3,6-二-(汞甲基)二氧六环,而对离子是醋酸根、氯离子或者硝酸根;和聚亚甲基二甲基硫醚硫代磺酸盐。接头可以包括,例如,通过硫代丁二酰亚胺连接到抗体上的马来酰亚胺。
[0313]
药物可以是任何细胞毒性,抑制细胞生长或者免疫抑制的药物。在实施方式中,接头连接抗体和药物,而药物具有可以和接头成键的功能性基团。例如,药物可以具有可以和连接物成键的氨基,羧基,巯基,羟基,或者酮基。在药物直接连接到接头的情况下,药物在
连接到抗体之前,具有反应的活性基团。
[0314]
在另一优选例中,所述药物选自下组:化疗药物、放疗药物、激素治疗药物或免疫治疗药物。具体地,有用的药物类别包括,例如,抗微管蛋白药物、dna小沟结合试剂、dna复制抑制剂、烷化试剂、抗生素、叶酸拮抗物、抗代谢药物、化疗增敏剂、拓扑异构酶抑制剂、长春花生物碱等。特别有用的细胞毒性药物类的例子包括,例如,dna小沟结合试剂、dna烷基化试剂、和微管蛋白抑制剂、典型的细胞毒性药物包括、例如奥瑞他汀(auristatins)、喜树碱(camptothecins)、多卡霉素/倍癌霉素(duocarmycins)、依托泊甙(etoposides)、美登木素(maytansines)和美登素类化合物(maytansinoids)(例如dm1和dm4)、紫杉烷(taxanes)、苯二氮卓类(benzodiazepines)或者含有苯二氮卓的药物(benzodiazepine containing drugs)(例如吡咯并[1,4]苯二氮卓类(pbds),吲哚啉苯并二氮卓类(indolinobenzodiazepines)和噁唑烷并苯并二氮卓类(oxazolidinobenzodiazepines))和长春花生物碱(vinca alkaloids)。
[0315]
本发明优选的毒素选自下组:紫杉烷类(taxane)、美登素类(maytansinoid)、奥利斯他汀类(auristatin)、卡奇霉素(calicheamicin)、蒽环类药物(anthracycline)、多西他赛(docetaxel)、组织蛋白酶(cathepsin)、蓖麻毒素(ricin)、白树毒素(gelonin)、绿脓杆菌外毒素(pseudomonas exotoxin)、白喉毒素(diphtheria toxin)、核糖核酸酶(rnase)和放射性同位素(radioisotope)。
[0316]
在本发明中,药物-接头可以用于在一个简单步骤中形成adc。在其它实施方式中,双功能连接物化合物可以用于在两步或多步方法中形成adc。例如,半胱氨酸残基在第一步骤中与接头的反应活性部分反应,并且在随后的步骤中,接头上的功能性基团与药物反应,从而形成adc。
[0317]
通常,选择接头上功能性基团,以利于特异性地与药物部分上的合适的反应活性基团进行反应。作为非限制性的例子,基于叠氮化合物的部分可以用于特异性地与药物部分上的反应性炔基基团反应。药物通过叠氮和炔基之间的1,3-偶极环加成,从而共价结合于接头。其它的有用的功能性基团包括,例如酮类和醛类(适合与酰肼类和烷氧基胺反应),膦(适合与叠氮反应);异氰酸酯和异硫氰酸酯(适合与胺类和醇类反应);和活化的酯类,例如n-羟基琥珀酰亚胺酯(适合与胺类和醇类反应)。这些和其它的连接策略,例如在《生物偶联技术》,第二版(elsevier)中所描述的,是本领域技术人员所熟知的。本领域技术人员能够理解,对于药物部分和接头的选择性反应,当选择了一个互补对的反应活性功能基团时,该互补对的每一个成员既可以用于接头,也可以用于药物。
[0318]
本发明还提供了制备adc的方法,可进一步地包括:将抗体与药物-接头化合物,在足以形成抗体偶联物(adc)的条件下进行结合。
[0319]
在某些实施方式中,本发明方法包括:在足以形成抗体-接头偶联物的条件下,将抗体与双功能接头化合物进行结合。在这些实施方式中,本发明方法还进一步地包括:在足以将药物部分通过接头共价连接到抗体的条件下,将抗体接头偶联物与药物部分进行结合。
[0320]
在一些实施方式中,抗体药物偶联物adc如下分子式所示:
[0321][0322]
其中:
[0323]
ab是抗体,
[0324]
lu是接头;
[0325]
d是药物;
[0326]
而且下标p是选自1到8的值。
[0327]
应用
[0328]
本发明还提供了本发明抗体、抗体偶联物adc、重组蛋白、和/或免疫细胞的用途,例如用于制备诊断制剂或制备药物。
[0329]
较佳地,所述的药物是用于预防和/或治疗与b7-h3表达或功能异常相关的疾病的药物。
[0330]
本发明抗体、adc、重组蛋白、和/或免疫细胞的用途,包括(但并不限于):
[0331]
(i)诊断、预防和/或治疗肿瘤发生、生长和/或转移,尤其是b7-h3高表达的肿瘤。所述肿瘤包括(但并不限于):黑色素瘤,间皮瘤,非小细胞肺癌,乳腺癌,肝癌,滑膜肉瘤,转移性结肠癌,肾癌,膀胱癌,前列腺癌,卵巢癌,丙型肝炎病毒慢性感染,晚期实体癌,消化器官恶性肿瘤,子宫内膜癌,复发黑色素瘤,头颈部鳞状细胞癌,皮肤t细胞淋巴瘤,输卵管癌,腹膜肿瘤,肌肉浸润性膀胱癌,广泛的阶段小细胞肺癌,成人急性髓细胞性白血病,非典型慢性粒细胞白血病,卵巢上皮细胞癌,b细胞慢性淋巴细胞白血病,皮肤b细胞非霍奇金淋巴瘤,眼内淋巴瘤,睾丸绒毛膜癌,神经母细胞瘤,食管癌。
[0332]
(ii)诊断、预防和/或治疗自身免疫性疾病,所述自身免疫性疾病包括(但并不限于):系统性红斑狼疮、口眼干燥综合征、类风湿性关节炎、强直性脊柱炎、硬皮病、结节性多动脉炎、wegener肉芽肿病、甲状腺功能亢进、胰岛素依赖型糖尿病、重症肌无力、寻常天皰疮、类天皰疮、移植排斥。
[0333]
检测用途和试剂盒
[0334]
本发明的抗体或其adc可用于检测应用,例如用于检测样本,从而提供诊断信息。
[0335]
本发明中,所采用的样本(样品)包括细胞、组织样本和活检标本。本发明使用的术语“活检”应包括本领域技术人员已知的所有种类的活检。因此本发明中使用的活检可以包括例如肿瘤的切除样本、通过内窥镜方法或器官的穿刺或针刺活检制备的组织样本。
[0336]
本发明中使用的样本包括固定的或保存的细胞或组织样本。
[0337]
本发明还提供了一种指含有本发明的抗体(或其片段)的试剂盒,在本发明的一个优选例中,所述的试剂盒还包括容器、使用说明书、缓冲剂等。在优选例中,本发明的抗体可以固定于检测板。
[0338]
药物组合物
[0339]
本发明还提供了一种组合物。在优选例中,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白或其adc或相应的免疫细胞,以及药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有
所变化。
[0340]
配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):瘤内、腹膜内、静脉内、或局部给药。典型地,本发明所述的药物组合物的给药途径较佳地为注射给药或口服给药。所述注射给药较佳地包括静脉注射、肌肉注射、腹腔注射、皮内注射或皮下注射等途径。所述的药物组合物为本领域常规的各种剂型,较佳地为固体、半固体或液体的形式,可以为水溶液、非水溶液或混悬液,更佳地为片剂、胶囊、颗粒剂、注射剂或输注剂等。
[0341]
本发明所述抗体也可以是由核苷酸序列在细胞内表达用于的细胞治疗,比如,所述抗体用于嵌合抗原受体t细胞免疫疗法(car-t)等。
[0342]
本发明所述的药物组合物是用于预防和/或治疗与b7-h3表达或功能异常相关的疾病的药物组合物。
[0343]
本发明的药物组合物可直接用于结合b7-h3蛋白分子,因而可用于预防和治疗肿瘤等疾病。
[0344]
本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的单克隆抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克/千克体重-约5毫克/千克体重。此外,本发明的多肽还可与其他治疗剂一起使用。
[0345]
本发明中,较佳地,本发明所述的药物组合物还包括一种或多种药用载体。所述的药用载体为本领域常规药用载体,所述的药用载体可以为任意合适的生理学或药学上可接受的药物辅料。所述的药物辅料为本领域常规的药物辅料,较佳的包括药学上可接受的赋形剂、填充剂或稀释剂等。更佳地,所述的药物组合物包括0.01~99.99%的上述蛋白质和0.01~99.99%的药用载体,所述百分比为占所述药物组合物的质量百分比。
[0346]
本发明中,较佳地,所述的药物组合物的施用量为有效量,所述有效量为能够缓解或延迟疾病、退化性或损伤性病症进展的量。所述有效量可以以个体基础来测定,并将部分基于待治疗症状和所寻求结果的考虑。本领域技术人员可以通过使用个体基础等上述因素和使用不超过常规的实验来确定有效量。
[0347]
使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约50毫克/千克体重,较佳地该剂量是约10微克/千克体重-约20毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0348]
本发明提供上述药物组合物在制备预防和/或治疗与b7-h3表达或功能异常相关的疾病的药物中的应用。较佳地,所述与b7-h3表达或功能异常相关的疾病为癌症和自身免疫性疾病。
[0349]
本发明的主要优点包括:
[0350]
(a)本发明的抗体对靶蛋白b7-h3拥有高亲和力和高选择性。
[0351]
(b)在细胞实验中,本发明的抗体在结合靶蛋白后,能够有效被细胞内吞。
[0352]
(c)本发明的抗体易于表达和纯化。
[0353]
(d)本发明的抗体制备成adc后,在荷瘤鼠动物模型中,单次给药即有明显的肿瘤抑制效果。
[0354]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0355]
实施例1小鼠免疫
[0356]
选用健康的balb/c小鼠,通过皮下、腹腔多点注射进行免疫,每两周免疫一次。一组小鼠用b7-h3his蛋白进行免疫,另一组小鼠用过表达b7-h3的chok细胞进行免疫。第一次免疫使用弗氏完全佐剂,之后使用弗氏不完全佐剂进行免疫。免疫三到四次后,通过elisa进行小鼠血清效价检测,效价最高的小鼠处死之后取脾脏进行噬菌体展示库构建。
[0357]
实施例2小鼠免疫库构建及筛选
[0358]
取免疫后效价合格的小鼠脾脏,用氯仿提取小鼠脾脏总rna,然后通过反转录pcr制备cdna文库。通过三优生物自有的组合引物扩增小鼠的轻链和重链可变区基因,组合成的fab片段插入到噬菌粒载体中,构建fab抗体库。将文库制备成噬菌体展示库,采用液相筛选的方法,将b7-h3hisbiotin包被到磁珠上进行三轮液相筛选。做完三轮液相筛选后,用b7-h3his包被酶标板,然后加入抗b7-h3的fab上清,通过elisa筛选获得特异性结合b7-h3的阳性克隆。
[0359]
将获得的阳性克隆进行测序,得到的单克隆进行细胞水平结合、猴子b7-h3结合的验证,将能与细胞水平b7-h3以及猴子b7-h3结合的候选抗体进行全长抗体构建。
[0360]
本实施例构建的部分抗体名称及其序列编号如表1所示。
[0361]
表1鼠源抗体及其序列编号
[0362][0363]
实施例3全人天然库构建及筛选
[0364]
三优千亿级抗体库构建:用4000多例人的pbmc样本,进行rna的抽提,并根据imgt数据库设计了不同germline的引物,并按照文献报道的人源基因占比,设定建库方案,共组建了四个不同germline占比的百亿库,合并为千亿级抗体库。
[0365]
采用液相筛选的方法,将b7-h3hisbiotin包被到磁珠上进行三轮液相筛选。做完三轮液相筛选后,用antifd包被酶标板,然后加入抗b7-h3的fab上清,孵育1小时后,再加入2μg/ml的b7-h3hisbiotin孵育1小时,最后用neutravidinhrp检测信号。通过夹心法elisa筛选获得特异性结合b7-h3的阳性克隆。
[0366]
将获得的阳性克隆进行测序,得到的单克隆进行细胞水平结合、猴b7-h3结合的验证,将能与细胞水平b7-h3以及猴b7-h3结合的候选抗体进行全长抗体构建。
[0367]
本实施例构建的部分抗体名称及其序列编号如表2所示。
[0368]
表2全人抗体及其序列编号
[0369][0370]
实施例4全长抗体表达纯化和鼠源抗体的人源化
[0371]
将载有抗体轻链和重链的质粒共转染expichos细胞,表达7天后收集细胞表达上清,利用protein a亲和层析柱进行纯化,具体实验步骤参考akta使用手册。纯化的抗体通过透析置换成ph7.2的pbs缓冲液。总共对23条小鼠免疫库和39条人源库的抗体进行了表达纯化,最终获得成功表达并纯化的抗体共57条,其中19条来源于小鼠免疫库,38条来源于人源库。
[0372]
结果显示,实施例2和3中列出的具体抗体均在expichos细胞中成功表达。
[0373]
通过cdr移植将鼠源抗体(il-p7-c05、il-p5-c06)的cdr移植到对应的人源抗体骨架上,然后通过3d结构模拟设计若干对轻重链的突变体,瞬转表达之后验证抗体的活性。
[0374]
本实施例构建的部分抗体重链、轻链可变区及其序列编号如表3所示。
[0375]
表3人源化的重链、轻链可变区及其序列编号
[0376]
重链可变区氨基酸序列编号轻链可变区氨基酸序列编号ilp7c05huvh180ilp7c05huvl162ilp7c05huvh281ilp7c05huvl263ilp7c05huvh382ilp7c05huvl364ilp7c05huvh483ilp5c06huvl166ilp5c06huvh185ilp5c06huvl267ilp5c06huvh286ilp5c06huvl368ilp5c06huvh387ilp5c06huvl469
[0377]
上述重链可变区和轻链可变区可以任意组合,构成新的人源化抗体。
[0378]
实施例5蛋白水平结合及种属交叉检测
[0379]
将人b7-h3his、鼠b7-h3his和猴b7-h3his用pbs稀释到2μg/ml,按30μl每孔加入到酶标板中,然后将酶标板在放在4度冰箱中孵育16~20个小时。第二天,用洗液(含0.05%吐温20的pbs)将酶标板洗一遍,然后加入5%的脱脂奶粉封闭1小时。封闭完成后,将酶标板洗一遍,然后加入梯度稀释的抗b7-h3的抗体,置于室温孵育1小时。孵育完成后,将酶标板洗
三遍,然后加入羊抗人的酶标二抗,置于室温孵育1小时。孵育完成后,将酶标板洗三遍,然后加入tmb显色5~15分钟,最后用2m硫酸终止,在酶标仪上记录数据。
[0380]
种属交叉检测结果如表4所示,几乎所有抗体均有人猴交叉,大部分存在人小鼠交叉。
[0381]
随后,再次对实施例4构建的人源化抗体以及部分鼠源抗体和全人抗体进行了人b7-h3蛋白水平结合的验证,结果如表5所示,所列抗体与人b7-h3均有很高亲和力。
[0382]
表4 b7-h3蛋白结合种属交叉活性
[0383][0384][0385]
表5抗体与人b7-h3蛋白水平结合活性
[0386]
名称蛋白结合活性ec50(μg/ml)il-p7-c050.044il-p7-c05-h4l30.03953il-p7-c05-h4l10.035il-p7-c05-h2l20.051il-p7-c05-h2l10.111il-p7-c05-h3l30.071il-p7-c05-h1l10.053il-p7-c05-h3l10.026il-p5-c060.302il-p5-c06-h2l20.147il-p5-c06-h2l40.223il-p5-c06-h2l30.151il-p5-c06-h1l40.237il-p5-c06-h1l10.206il-p5-c06-h1l30.164il-p5-c06-h3l30.151il-p5-c06-h3l40.156
il-p6-d060.233il-p6-c110.182il-p6-b070.194il-p6-c080.088il-p5-b010.248il-p7-a060.172nl24-a170.280nl24-a680.285nl24-a100.355
[0387]
实施例6细胞水平结合检测
[0388]
将过表达b7-h3的chok细胞或内源性表达b7-h3的ncih322细胞按每孔100000个细胞加入到圆底96孔板中,离心去上清,然后加入梯度稀释的抗b7-h3的抗体,置于4度孵育1小时。孵育完成后,用facs buffer(含2%fbs的pbs)将细胞洗两遍,然后加入荧光标记的羊抗人的二抗(abcam,ab98596),孵育0.5小时。孵育完成后用facs buffer将细胞洗两遍,用facs buffer将细胞重悬后在流式细胞仪(beckman,cytoflex)上进行检测。
[0389]
结果如表6所示,表中所列抗体无论对人工表达b7-h3的cho cell细胞,以及高表达b7-h3蛋白的人源非小细胞肺癌细胞(nci-h322),均有很高的结合能力。
[0390]
表6抗体的细胞水平结合活性
[0391][0392]
实施例7候选抗体内吞活性检测
[0393]
将过表达b7-h3的chok细胞或内源性表达b7-h3的ncih322细胞接种到96孔板中,置于37摄氏度培养箱培养过夜。先用含毒素的二抗(ats,it51)标记抗b7-h3的抗体,然后将抗体加入到细胞中,置于37摄氏度培养箱培养3天。当抗体内吞时,抗体上标记的毒素随着抗体内吞进入细胞内,对细胞产生毒性,使细胞活率降低,最后用细胞毒性检测试剂盒(promega,g3581)检测细胞的活性。
[0394]
结果如表7所示,所列抗体均能够有效被表达b7-h3的cho cell有效内吞,且部分选定抗体进一步在人源非小细胞肺癌细胞(nci-h322)内吞实验中,也同样显示出高效的内吞活性。
[0395]
表7候选抗体的内吞活性
[0396][0397]
实施例10体外药效学评价
[0398]
以mmae(monomethyl auristatin e)作为偶联效应分子,利用前述制备的抗体il-p7-c05-h4l3构建抗体药物偶联物il-p7-c05-h4l3-mmae,进行体外药效学评价。
[0399]
采用celltiter-glo方法检测il-p7-c05-h4l3-mmae孵育72h对b7-h3阳性的人源肿瘤细胞系nci-h1975、bxpc-3以及b7-h3阴性的人源肿瘤细胞系raji的抑制活性。
[0400]
结果如表8所示,il-p7-c05-h4l3-mmae对高表达b7-h3肿瘤细胞(nci-h1975和bxpc-3)有强大的杀伤能力,而对b7-h3阴性肿瘤细胞杀伤活性较差。
[0401]
表8.il-p7-c05-h4l3-mmae孵育72h对人源肿瘤细胞系增殖抑制ic
50
值
[0402]
细胞系类别ic
50
(μm)nci-h1975人非小细胞肺癌0.0074bxpc-3人胰腺癌0.0077raji人淋巴瘤0.0341
[0403]
采用celltiter-glo方法检测il-p7-c05-h4l3-mmae及同型对照isotype-mmae孵育5天对b7-h3阳性的人源肿瘤细胞系calu-6、bxpc-3以及b7-h3阴性的人源肿瘤细胞系raji的抑制活性。
[0404]
结果如表9所示,il-p7-c05-h4l3-mmae对高表达b7-h3肿瘤细胞(calu-6和bxpc-3)有强大的杀伤能力,而对b7-h3阴性肿瘤细胞杀伤活性较差。isotype-mmae对照对细胞杀伤活性远低于il-p7-c05-h4l3-mmae。
[0405]
表9.il-p7-c05-h4l3-mmae及isotype-mmae孵育5天对人源肿瘤细胞系增殖抑制ic
50
值
[0406][0407][0408]
实施例11体内药效学评价
[0409]
在人非小细胞肺癌nci-h1975细胞balb/c裸鼠皮下移植瘤模型中,检测il-p7-c05-h4l3-mmae及同型对照isotype-mmae单次给药对肿瘤生长的抑制作用。
[0410]
肿瘤体积及动物体重如图1和图2所示。
[0411]
结果显示,il-p7-c05-h4l3-mmae在1mg/kg及3mg/kg剂量下经尾静脉给药一次,均对nci-h1975皮下移植瘤的生长具有显著抑制作用(p<0.01),实验结束(给药后21天)对肿瘤生长的抑制率(tgi)分别为78.4%和101.8%,两个剂量组的相对肿瘤增殖率(%t/c)分别为26.2%和4.2%;且3mg/kg剂量组肿瘤出现萎缩消退。同型对照isotype-mmae在3mg/kg剂量下经尾静脉单次给药后,肿瘤生长与溶剂对照组的差异无统计学意义(p>0.05)。il-p7-c05-h4l3-mmae在1mg/kg及3mg/kg剂量下单次给药,以及同型对照isotype-mmae在3mg/kg剂量下单次给药,对动物体重变化均无明显影响,且未见明显异常临床表征,动物耐受良好。
[0412]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
[0413]
本技术涉及的序列
[0414]
轻链可变区cdr
[0415][0416]
重链可变区cdr
[0417][0418][0419]
轻链可变区
[0420]
[0421][0422]
重链可变区
[0423]
[0424]
[0425]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。