1.本发明涉及一种检测方法,具体为烈性噬菌体结合生物膜干涉技术的单增李斯特菌快速检测,属于单增李斯特菌检测技术领域。
背景技术:
2.单增李斯特菌是一种兼性厌氧性食源性致病菌,对低温、高盐及消毒剂有较强的抵抗力。单增李斯特菌感染后可能产生低热、高热等症状,免疫力低下的人可能会引起肠胃炎甚至会产生脑膜炎,孕妇会发生流产、早产或死产。
3.传统的单增李斯特菌检测方法是先对细菌进行增殖培养,再经过氧化氢酶试验、溶血试验等进行鉴定,检测周期长达7天,无法实现快速检测。常用的单增李斯特菌检测方式还有显微镜分析、聚合酶链式反应(pcr)和免疫学分析等方法。但是显微镜分析方法存在着鉴别种属不准确和特异性较低的缺点;免疫分析方法对试剂的选择性高,检测时间仍较长;pcr测定法(含常规和定量)易受污染而产生假阳性结果,为减少该现象的发生需要进行排除实验,耗时较长,且该方法对工作人员的技术经验要求高。
技术实现要素:
4.(一)解决的技术问题本发明的目的就在于为了解决上述问题而提供烈性噬菌体结合生物膜干涉技术的单增李斯特菌快速检测,以解决现有技术中单增李斯特菌检测周期长和易产生假阳性结果的问题。
5.(二)技术方案为实现以上目的,本发明通过以下技术方案予以实现:烈性噬菌体结合生物膜干涉技术的单增李斯特菌快速检测,包括:步骤一、传感器平衡,所述传感器平衡包括链霉亲和素传感器、纯水和含0.02%吐温-20的pbs磷酸盐缓冲溶液;步骤二、噬菌体固定化,所述噬菌体固定化包括生物素化试剂处理后的噬菌体悬液;步骤三、生物素封闭,所述生物素封闭包括生物素溶液;步骤四、样品检测及结果分析,所述样品检测及结果分析包括样品。
6.优选的,将链霉亲和素传感器末端浸入纯水中预湿10分钟或10分钟以上,随后将链霉亲和素传感器末端浸入含0.02%吐温-20的pbs磷酸盐缓冲溶液中平衡60
‑
180秒,具体平衡时间设置为60
‑
120秒时,高效地对链霉亲和素传感器进行预处理,去掉链霉亲和素传感器上的保护膜,使传感器进入工作态,进而保证后续噬菌体的有效固定化。
7.优选的,将平衡后的链霉亲和素传感器浸入用0.5
‑
2%的生物素化试剂处理过的效价为108‑
109pfu/ml的噬菌体悬液中300
‑
1200秒,具体操作时,将平衡后的链霉亲和素传感器浸入用2%的生物素化试剂处理过的效价为109pfu/ml的噬菌体悬液中300秒,使链霉亲和
素传感器与噬菌体悬液充分接触,从而使悬液中的噬菌体足量且牢固地固定在链霉亲和素传感器上。
8.优选的,将固定了噬菌体的链霉亲和素传感器浸入10μg/ml生物素溶液中封闭60
‑
180秒,具体封闭时间可以设置为120秒,使链霉亲和素传感器上未固定噬菌体的多余的结合位点被封闭掉,从而避免非特异性结合信号的产生,确保检测结果的准确性。
9.优选的,将链霉亲和素传感器浸入含0.02%吐温-20的pbs磷酸盐缓冲溶液中平衡150
‑
450秒,然后将链霉亲和素传感器浸入样品中进行单增李斯特菌的检测,实时地读取结合信号;根据读取出的结合信号定性分析,当读取出的结合信号值大于或等于仪器的有效信号值0.0075nm时,即可判定样品中有单增李斯特菌;对于定量分析,将结合时间为180秒、360秒、540秒时的结合信号y分别代入菌浓度和结合信号间的数学公式(1)、(2)、(3)。
10.优选的,所述(1)具体为:c
180
=(1.24486
×
10
15
)
y^0.203021
;所述(2)具体为:c
360
=(1.17791
×
10
14
)
y^0.1975836
;所述(3)具体为:c
540
=(6.57095
×
10
13
)
y^0.2025546
;所述c求解所得数值即为样品中单增李斯特菌的具体浓度,所述c
180
表示结合时间为180秒时求得的菌浓度,对应的单增李斯特菌的最低检出限是3.89
×
105cfu/ml;所述c
360
表示结合时间为360秒时求得的菌浓度,对应的单增李斯特菌的最低检出限是2.25
×
105cfu/ml;所述c
540
表示结合时间为540秒时求得的菌浓度,对应的单增李斯特菌的最低检出限是1.35
×
105cfu/ml。链霉亲和素传感器平衡时间可以具体到150
‑
300秒,通过多组数据进行对比,保证检测结果的准确性,提高检测结果的严谨性和实时性,保证最终数据的可信度。
11.本发明提供了烈性噬菌体结合生物膜干涉技术的单增李斯特菌快速检测,其具备的有益效果如下:1、该烈性噬菌体结合生物膜干涉技术的单增李斯特菌快速检测,操作步骤较少,并且可以进行无需标记的实时监测,整体操作流程简便快速,能实现样品的随到随检,提高了检测的效率。并且操作方法简单易学,仅需要向样品板中添加配置好的试剂及制备好的样品即可上机检测,降低了工作人员的技术经验要求,也减少了检测结果中人为影响的比重,提高了检测结果的严谨性和科学性,实时读取结合信号即可快速判断单增李斯特菌的存在。
12.2、该烈性噬菌体结合生物膜干涉技术的单增李斯特菌快速检测,可实现高通量检测,只需要配合相应的bli生物分子相互作用仪及配套使用的样品板,可实现多达95个样品的同时检测,节约了时间的成本,降低了样品检测的成本投入。
附图说明
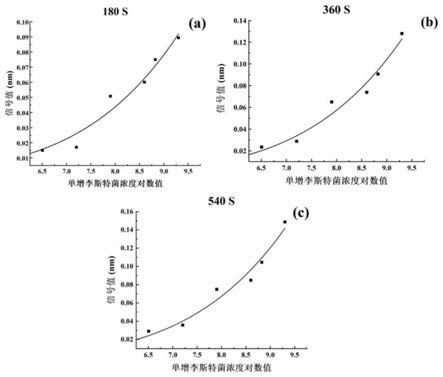
13.图1为标准曲线图;图2为方法的特异性试验结果图。
14.图1中:(a)、(b)和(c)分别为检测方法中结合时间为180秒、360秒、540秒时单增李斯特菌浓度对数值和结合信号间的标准曲线图,对结合时间为180秒、360秒和540秒处的结合信号值进行拟合分析,得到结合信号强度与单增李斯特菌浓度对数之间的标准曲线和非线性回归方程(r2>0.95)。通过基于基线噪声的三倍数值来推算在结合时间为180秒、360
秒和540秒时的检测限,对于使用的octetred96仪器,基线噪声信号强度为0.0025nm。根据回归方程计算可得,结合时间为180秒、360秒、540秒时所对应的单增李斯特菌的最低检出限分别是3.89
×
105cfu/ml、2.25
×
105cfu/ml、1.35
×
105cfu/ml。
具体实施方式
15.本发明实施例提供烈性噬菌体结合生物膜干涉技术的单增李斯特菌快速检测。
16.针对传统检测单增李斯特菌方法实施过程中存在的操作复杂、检测时间长等问题,充分利用烈性噬菌体的特性和新兴的生物膜干涉技术,以解决传统检测单增李斯特菌方法的缺点为出发点,研究出了一种操作简便、检测速度快、特异性强、高通量的单增李斯特菌检测方法,是一种实时无标记检测新方法。
17.生物膜干涉技术是一种用于测量生物分子间相互作用的、实时的、灵敏且无标记的光学分析技术。已成功应用于蛋白质-蛋白质、蛋白质-小分子和受体-病毒等相互作用的实时无标记检测。具有高灵敏度、无微流控系统、免标记、快速、简便、可实时提供检测结果等优点,非常适合于对食源性致病菌进行快速、灵敏的检测。
18.烈性噬菌体是能裂解细菌等微生物的病毒的总称。其对目标菌的识别和裂解具有高度的特异性。噬菌体数量丰富、获取容易、增殖快、筛选纯化时间短、制备成本低、安全性好、室温下也可长期保持活性。噬菌体的这些特性为其作为传感器的生物识别元件奠定了良好的基础。
19.具体实施方式如下:步骤一、传感器平衡,所述传感器平衡包括链霉亲和素传感器、纯水和含0.02%吐温-20的pbs磷酸盐缓冲溶液,将链霉亲和素传感器末端浸入纯水中预湿10分钟或10分钟以上,随后将链霉亲和素传感器末端浸入含0.02%吐温-20的pbs磷酸盐缓冲溶液中平衡60
‑
180秒;通过纯水和含0.02%吐温-20的pbs磷酸盐缓冲溶液对链霉亲和素传感器进行预先处理,去掉链霉亲和素传感器上的保护膜,保证链霉亲和素传感器的干净,进而保证后续噬菌体的有效固定化。
20.步骤二、噬菌体固定化,所述噬菌体固定化包括生物素化试剂处理过的噬菌体悬液,将平衡后的链霉亲和素传感器浸入用0.5
‑
2%的生物素化试剂处理过的效价为108‑
109pfu/ml的噬菌体悬液中300
‑
1200秒;使用经过步骤一平衡后的链霉亲和素传感器与噬菌体悬液接触一段时间,从而使悬液中的噬菌体足量且牢固地固定在链霉亲和素传感器上。
21.步骤三、生物素封闭,所述生物素封闭包括生物素溶液,将固定了噬菌体的链霉亲和素传感器浸入10μg/ml生物素溶液中封闭60
‑
180秒;已固定化了噬菌体的链霉亲和素传感器与生物素溶液接触一段时间,使链霉亲和素传感器上未固定噬菌体的多余的结合位点被封闭掉,从而避免非特异性结合信号的产生,确保检测结果的准确性。
22.步骤四、样品检测及结果分析,所述样品检测及结果分析包括样品,将链霉亲和素传感器浸入含0.02%吐温-20的pbs磷酸盐缓冲溶液中平衡150
‑
450秒,然后将链霉亲和素传感器浸入样品中进行单增李斯特菌的检测,实时地读取结合信号;根据读取出的结合信
号定性分析,当读取出的结合信号值大于或等于仪器的有效信号值0.0075nm时,即可判定样品中有单增李斯特菌;对于定量分析,将结合时间为180秒、360秒、540秒时的结合信号y分别代入菌浓度和结合信号间的数学公式(1)、(2)、(3);所述(1)具体为:c
180
=(1.24486
×
10
15
)
y^0.203021 ;所述(2)具体为:c
360
=(1.17791
×
10
14
)
y^0.1975836 ;所述(3)具体为:c
540
=(6.57095
×
10
13
)
y^0.2025546 ;所述c求解所得数值即为样品中单增李斯特菌的具体浓度,所述c
180
表示结合时间为180秒时求得的菌浓度,对应的单增李斯特菌的最低检出限是3.89
×
105cfu/ml;所述c
360
表示结合时间为360秒时求得的菌浓度,对应的单增李斯特菌的最低检出限是2.25
×
105cfu/ml;所述c
540
表示结合时间为540秒时求得的菌浓度,对应的单增李斯特菌的最低检出限是1.35
×
105cfu/ml。
23.本发明所使用到的材料、试剂和主要仪器设备均为市场上常见物品,具体详情见表1和表2,也可使用可代替物品代替表1和表2中物品。
24.表1主要材料与试剂信息表材料与试剂名称厂家pbs磷酸盐缓冲溶液北京索莱宝科技有限公司吐温-20北京索莱宝科技有限公司胰蛋白胨大豆肉汤培养基(tsb)青岛高科园海博生物技术有限公司胰蛋白胨大豆琼脂(tsa)青岛高科园海博生物技术有限公司链霉亲和素生物传感器(sa)sartoriusgenemore生物素化试剂盒江苏博美达生命科学有限公司d-生物素生工生物工程(上海)股份有限公司96孔板greinerbio
‑
one表2主要仪器设备信息表仪器设备名称厂家octetred96分子相互作用仪fortebiojyd
‑
400拍击式均质机上海五相仪器仪表有限公司具体实施例一:本技术方案的特异性考察;以单增李斯特菌为目标菌,以沙门氏菌、大肠杆菌、金黄色葡萄球菌为非目标菌进行检测分析,具体步骤如下:(1)、用接种环将单增李斯特菌、沙门氏菌、大肠杆菌、金黄色葡萄球菌分别接种到已灭菌的胰蛋白胨大豆肉汤培养基中,在37℃、200rpm并且振荡的环境中培养15
‑
18小时;随后对菌悬液进行离心处理,将上清液进行废弃处理,随后加pbs磷酸盐缓冲溶液重悬沉淀物,8000rpm转速下离心5分钟,废弃处理上清液,加pbs磷酸盐缓冲溶液重悬菌体沉淀,然后8000rpm转速下再次离心5分钟,废弃处理上清液,最终使用含0.02%吐温-20的pbs磷酸盐缓冲溶液重悬菌体沉淀并将四种菌的菌悬液浓度均调整为8
×
10
7 cfu/ml,完成检测准备工作,待检样品准备完成。
25.(2)、在96孔板相应位置依次加入含0.02%吐温-20的pbs磷酸盐缓冲溶液、生物素化了的噬菌体悬液、10μg/ml的生物素溶液、含0.02%吐温-20的pbs磷酸盐缓冲溶液,以及
(1)中的待检样品。
26.(3)、提前将链霉亲和素传感器水合10分钟,即将传感器末端浸入纯水中内部10分钟,然后将经过步骤(2)处理后的96孔板放入octetred96分子相互作用仪,随后运行系统;链霉亲和素传感器末端依次浸入含0.02%吐温-20的磷酸盐缓冲溶液中120秒、生物素化了的噬菌体悬液内部300秒、10μg/ml的生物素溶液内部120秒、含0.02%吐温-20的pbs磷酸盐缓冲溶液内部150秒、样品内部180秒。
27.(4)、在仪器运行时可实时观察检测信号值,数值具体分布状态如图2所示,目标菌单增李斯特菌样品的信号值远在有效信号值(0.0075nm)之上,非目标菌沙门氏菌、大肠杆菌、金黄色葡萄球菌的信号值均为负值,经过观察对比后,可发现该方法具有较高的特异性,达到准确定性检测的目的。
28.具体实施例二:牛奶样品中单增李斯特菌的检测(1)、首先将牛奶中单增李斯特菌的浓度调整为8
×
107cfu/ml,将样品在12000rpm转速下离心5分钟后,废弃处理上清液,随后加pbs磷酸盐缓冲溶液重悬沉淀物,8000rpm转速下离心5分钟,废弃处理上清液,加pbs磷酸盐缓冲溶液重悬沉淀物,然后8000rpm转速下再次离心5分钟,废弃处理上清液,最后用含0.02%吐温-20的磷酸盐缓冲溶液重悬菌体沉淀制成待检样品。
29.(2)、步骤同具体实施例一中的(2)。
30.(3)、提前将链霉亲和素传感器水合10分钟,即将传感器末端浸入纯水中内部10分钟,然后将经过步骤(2)处理后的96孔板放入octetred96分子相互作用仪,随后运行系统;链霉亲和素传感器末端依次浸入含0.02%吐温-20的磷酸盐缓冲溶液中120秒、生物素化了的噬菌体悬液内部300秒、10μg/ml的生物素溶液内部120秒、含0.02%吐温-20的pbs磷酸盐缓冲溶液内部150秒、样品内部540秒。
31.(4)检测结束后,将结合信号值代入菌浓度和结合信号拟合的标准曲线的数学方程式中,可以计算出回收的菌浓度;不同结合时间回收菌浓度为8
×
10
7 cfu/ml的牛奶样品,所得的菌浓度统计结果如表3所示;从表3中可以看出不同结合时间的回收率均接近100%,说明该技术方案用于实际样品中单增李斯特菌的检测具有很高的准确率。另外,通过比较表3中所示的不同结合时间下菌的回收率,可以看出随着结合时间的延长,菌的回收率也更加接近于100%,说明结合时间与检测结果的准确性成正比。
32.表3结合时间为180s、360s、540s时牛奶样品中添加菌的回收结果统计表
具体实施例三:冰淇淋样品中单增李斯特菌的检测;(1)、将冰淇淋中单增李斯特菌的浓度数值调整为3.2
×
10
6 cfu/ml,随后按照具体实施例二中步骤(1)的方法处理得待检样品。
33.(2)、按照具体实施例二中步骤(2)进行具体操作。
34.(3)、按照具体实施例二中步骤(3)进行具体操作。
35.(4)、待检样品检测结束后,将结合信号值代入菌浓度和结合信号拟合的标准曲线的数学方程式中,计算得出回收的菌浓度。表4所示为菌浓度为3.2
×
106cfu/ml的冰淇淋样品在不同结合时间回收的菌浓度统计结果。从表4中可以看出不同结合时间的回收率均接近100%,说明该技术方案在实际冰淇淋样品检测中也有很高的准确率。另外,通过比较不同结合时间下菌的回收率可以看出,随着结合时间的延长,菌的回收率也更加接近于100%,说明结合时间的延长可以在一定程度上使得检测结果更加准确。
36.表4结合时间为180s、360s、540s时冰淇淋样品中添加菌的回收结果统计表具体实施例四:西红柿样品中单增李斯特菌的检测;(1)、首先将25g的西红柿样品放置到无菌均质袋中,随后向无菌均质袋中加入225ml已灭菌的pbs磷酸盐缓冲溶液,加入适量的单增李斯特菌菌液使样品菌浓度为1.6
×
107cfu/ml,然后用均质机击打样品1
‑
2min后摇晃混合均匀。将处理后样品取出1ml悬液于1.5ml离心管中,3000rpm转速下离心5分钟,取上清液在8000rpm转速下离心5分钟,随后废弃处理出现的上清液,加pbs磷酸盐缓冲溶液重悬沉淀物,8000rpm转速下离心5 分钟,废弃处理上清液,加pbs磷酸盐缓冲溶液重悬沉淀物,然后8000rpm转速下再次离心5 分钟,废弃处理上清液,最后用含0.02%吐温-20的pbs磷酸盐缓冲溶液重悬菌体沉淀制成待检样品。
37.(2)、(3)步骤按照具体实施例二中的(2)、(3)步骤进行操作。
38.(4)、检测结束后,将结合信号值代入到菌浓度和结合信号拟合的标准曲线的数学方程式中进行计算,通过公式计算得出回收的菌浓度。表5为菌浓度为1.6
×
10
7 cfu/ml的西红柿样品在不同结合时间回收时,计算得到的菌浓度统计结果。从表5中可以看出不同结合时间的回收率均接近100%,说明该技术方案在实际样品检测中具有可靠的准确性。
39.表5结合时间为180s、360s、540s时西红柿样品中添加菌的回收结果统计表
经过具体实施例一、二、三和四的实际操作应用后,可以发现本方法的操作步骤较少,并且可以进行无需标记的实时监测,整体操作流程简便快速,能实现样品的随到随检,提高了检测的效率。并且操作方法简单易学,仅需要向样品板中添加配置好的试剂及制备好的样品即可上机检测,降低了工作人员的技术经验要求,也减少了检测结果中人为影响的比重,提高检测结果的严谨性和科学性,实时读取结合信号即可快速判断单增李斯特菌的存在。根据样品中所含单增李斯特菌浓度的不同,单纯的样品检测环节只需数十秒到几分钟的时间。例如具体实施例一、二、三和四中实际样品中的单增李斯特菌浓度在3.89
×
10
5 cfu/ml时,只需要3分钟左右即可判断出样品中有目标菌存在;并且菌浓度与判断时间的长短成反比关系。
40.噬菌体易于获取且数量丰富,稳定性好且易于保存,并且生物素化后的噬菌体可以简单地回收后,进行重复使用,降低了检测成本的投入。本方法在实际应用中可实现高通量检测,只需要配合相应的bli生物分子相互作用仪及配套使用的样品板,可实现多达95个样品的同时检测,节约了时间的成本,提高了样品检测的效率。
41.以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。