1.本发明涉及生物微粒分选技术领域,具体涉及一种用于对流体样本内的微粒进行筛选的装置和方法。
背景技术:
2.生物体体内部具有多种细胞,如体细胞,血细胞淋巴细胞等。对于同种或者不同种细胞的分选,具有十分重要的意义。以癌细胞为例,癌症相关手术可以较好的切除病灶,但无法阻止癌细胞向循环系统扩散,肿瘤细胞往往会随着循环系统遍布全身,使切除后的肿瘤仍有较高的复发率,因此对于细胞的检测就显得尤为重要。肿瘤细胞的转移可通过循环系统,如血液及淋巴等途径,扎根于其他组织和器官中,如果能够在病人的血液样本中检测并获取到循环肿瘤细胞,无论对癌症病人的病理化检测还是肿瘤的定性,都将产生极大的裨益。
3.循环肿瘤细胞在血液中有几个特点:(1)循环肿瘤细胞的数量稀少。一般患者每毫升的全血中,循环肿瘤细胞数目约为几个到几十个(少于血细胞的浓度:每毫升约106个),所以基于显微形态学的方法在血液中获取循环肿瘤细胞并不是一件容易的事。(2)粒径与其他细胞差异不大。红细胞的粒径为4~8微米,白细胞粒径为7~18微米,循环肿瘤细胞的粒径在14~26微米的范围内,循环肿瘤细胞与其他正常细胞存在交叠。
4.现有的对细胞进行分离和筛查的方法主要包括非标记法和标记法两类:非标记法是根据细胞尺寸、脂溶性/水溶性或电磁学特性等物理性质对细胞进行分筛;标记法指的是利用细胞表面的抗体,与和其相匹配的的抗原结合,并依此进行筛选。其中,非标记法具体可以是离心法、微孔筛法、水流动力学、光学声学捕获等方法实现非标记的细胞分选,各种非标记分选方法都有一个共同的缺陷,即,若是待筛选的细胞在尺寸、密度、重量、形状等物理性质上没有明显区别于其他细胞的特征,此时非标记分选方法无法有效地分选出目标细胞。因此,针对物理性质差异不大的细胞进行分选时,需要使用标记分选法。
5.目前,标记分选法主要是磁珠分选法,磁珠分选法是利用微小的磁珠对细胞表面的特异性抗体结合,通过磁珠在磁场中的受力,将特定的细胞筛选出来。磁珠分选法在磁珠上要求高,目前人工合成的微米级磁珠的蛋白偶联量小,而纳米级磁珠的磁性过小且与磁体分离困难,同时磁珠密度大而易于聚集,由此导致分选工艺复杂,效率较低,成本也较高。
技术实现要素:
6.有鉴于此,本发明提供了一种用于对流体样本内的微粒进行筛选的装置和方法,以解决现有的标记分选法工艺过程复杂、分选效率低的问题。
7.为了实现上述目的,本发明采用了如下的技术方案:
8.一种用于对流体样本内的微粒进行筛选的装置,其包括:
9.基底,具有基底表面;
10.流体样本通道,附着于所述基底表面上且沿第一方向延伸,所述流体样本通道的
第一端设置有供所述流体样本输入的至少一个入口,所述流体样本通道的第二端设置有供所述流体样本输出的至少两个出口;
11.表面声波发生器,设置在所述基底表面上,用于产生沿垂直于所述第一方向传递并施加在所述流体样本通道上的表面声场,所述表面声场包括在所述第一方向上依次分布的驻波声场和行波声场。
12.具体地,所述表面声波发生器包括位于所述流体样本通道的一侧的第一叉指电极和位于所述流体样本通道的相对另一侧的第二叉指电极,所述第一叉指电极在所述第一方向上被划分为第一部分和第二部分,所述第二叉指电极正对于所述第一叉指电极的第一部分设置;在信号源的作用下,所述第一叉指电极的第一部分和所述第二叉指电极共同激励产生所述驻波声场,所述第一叉指电极的第二部分激励产生所述行波声场。
13.具体地,在所述第一方向上,所述第一叉指电极的宽度为4mm~12mm,所述第二叉指电极的宽度为2mm~8mm。
14.具体地,所述流体样本通道的长度为15mm~30mm。
15.具体地,所述基底为铌酸锂晶体,所述流体样本通道的材料为聚二甲基硅氧烷,所述第一叉指电极和所述第二叉指电极的材料为金属。
16.具体地,所述流体样本通道通过键合结合附着于所述基底表面上,所述第一叉指电极和所述第二叉指电极通过光刻工艺制备形成在所述基底表面上。
17.本发明还提供了一种用于对流体样本内的微粒进行筛选的方法,采用如上所述的装置,其中,所述方法包括:
18.提供流体样本,所述流体样本内的微粒包括目标微粒和非目标微粒,使用分选标记物对所述目标微粒进行标记,以使标记的目标微粒和所述非目标微粒具有不同的声学特性;
19.将所述流体样本输入至所述流体样本通道的入口,向所述表面声波发生器施加信号以形成所述驻波声场和所述行波声场,所述流体样本依次通过所述驻波声场和所述行波声场朝向所述流体样本通道的出口流动;
20.其中,所述驻波声场将所述流体样本中的所述标记的目标微粒和所述非目标微粒捕获在同一路径上传输,所述行波声场驱动所述标记的目标微粒和所述非目标微粒相互偏离形成不同的传输路径,使得所述标记的目标微粒和所述非目标微粒从所述流体样本通道的不同出口输出。
21.具体地,所述不同的声学特性是指在所述行波声场的作用下产生不同的声辐射力。
22.具体地,所述目标微粒和所述非目标微粒是表面受体蛋白的功能性具有差异的同种类型微粒。
23.具体地,所述微粒为细胞、脂粒或大分子蛋白,所述分选标记物为生物素化的微泡或聚二甲基硅氧烷颗粒。
24.本发明实施例中提供的用于对流体样本内的微粒进行筛选的装置及其相应的筛选方法,其具有以下的有益效果:
25.(1)、首先对所述目标微粒进行标记以使标记的目标微粒和所述非目标微粒具有不同的声学特性,然后通过表面声波发生器产生的驻波声场和行波声场实现目标微粒和非
目标微粒的富集与分离,可以实现对诸如细胞等流体样本内的微粒进行有效、快速地筛选。
26.(2)所述装置中,流体样本通道和表面声波发生器均是通过微纳加工工艺集成设置在基底上,该装置体积小,易携带,能够适用于更加广泛的应用场景。进一步地,该装置中,基于非对称的叉指电极结构,将实现聚体功能的驻波声场和实现分离功能的行波声场紧密结合到了一起,使得装置更加的紧凑高效。
27.(3)、相比较于现有的磁珠分选法,本发明中的分选标记物是基于声学特性,其与诸如细胞等流体样本内的微粒的结合以及分离更加容易实现,避免了磁珠分选法中较为繁琐的脱去磁珠的过程,保证了分选后样本溶液的纯净度,分选工艺更加快速、高效。
附图说明
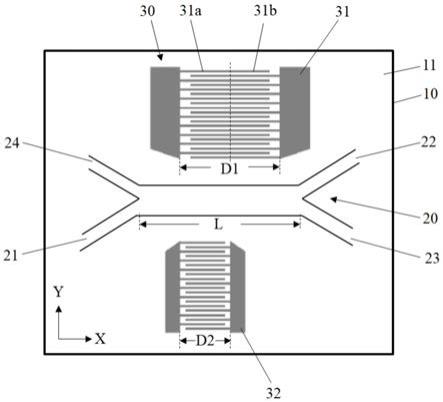
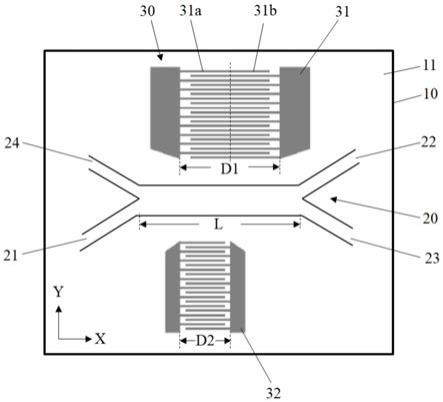
28.图1是本发明实施例中的筛选装置的结构示意图;
29.图2是本发明实施例中的筛选方法的工艺过程图示;
30.图3是本发明实施例中对流体样本内的微粒进行筛选的电子显微镜图示。
具体实施方式
31.为使本发明的目的、技术方案和优点更加清楚,下面结合附图对本发明的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本发明的实施方式仅仅是示例性的,并且本发明并不限于这些实施方式。
32.在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
33.本发明实施例首先提供了一种用于对流体样本内的微粒进行筛选的装置,如图1所示,所示装置主要包括基底10以及结合在所述基底10的基底表面11上的流体样本通道20和表面声波发生器30。
34.其中,所述流体样本通道20附着于所述基底表面11上并沿第一方向(如图1中的x方向)延伸,所述流体样本通道20的第一端设置有供所述流体样本输入的至少一个入口(21),所述流体样本通道20的第二端设置有供所述流体样本输出的至少两个出口(22,23)。
35.其中,所述表面声波发生器30设置在所述基底表面11上,所述表面声波发生器30用于产生沿垂直于所述第一方向传递(如图1中的y方向)并施加在所述流体样本通道20上的表面声场,所述表面声场包括在所述第一方向上依次分布的驻波声场和行波声场。
36.在优选的方案中,为获得较大的机电耦合系数,所述基底选择为128
°
yx双面抛光的铌酸锂晶体。
37.其中,所述流体样本通道20的材料优选为聚二甲基硅氧烷(pdms)。
38.其中,所述流体样本通道20可以是通过光刻工艺制备获得,在通过键合结合附着于所述基底表面11上。
39.具体地,所述流体样本通道20的制备工艺过程包括以下步骤:
40.s11、借助匀胶机,用旋涂的方法将光刻胶均匀的涂布在硅片表面并烘干。
41.s12、将涂布了光刻胶层的硅片放入光刻机,通过具有所述流体样本通道20图案的掩模版对光刻胶层进行曝光,然后显影,获得具有对应于所述流体样本通道20图案的硅片
模具。
42.s13、将pdms材料倒入所述硅片模具,抽去空气后烘烤固化,然后脱模获得所述流体样本通道20。
43.s14、利用等离子清洗仪,将所述流体样本通道20键合结合到所述基底表面11上。
44.在优选的方案中,如图1所示,所述流体样本通道20的第一端设置有两个入口(21,24),第二端设置有两个出口(22,23)。
45.在优选的方案中,参阅图1,所述流体样本通道20的长度l为15mm~30mm,最为优选是设置为20mm。
46.在本发明实施例中,如图1所示,所述表面声波发生器30包括位于所述流体样本通道20的一侧的第一叉指电极31和位于所述流体样本通道20的相对另一侧的第二叉指电极32。其中,所述第一叉指电极31在所述第一方向上被划分为第一部分31a和第二部分31b,所述第二叉指电极32正对于所述第一叉指电极31的第一部分31a设置。由此,在信号源的作用下,所述第一叉指电极31的第一部分31a和所述第二叉指电极32共同激励产生所述驻波声场,所述第一叉指电极31的第二部分31b激励产生所述行波声场。基于以上的非对称的叉指电极结构,该装置中将驻波声场和行波声场结合到了一起,即,在同一组信号源的作用下,该装置能够同时激励产生驻波声场和行波声场,使得该装置更加的紧凑高效。
47.在优选的方案中,参阅图1,在所述第一方向上,所述第一叉指电极31的宽度d1可以设置为4mm~12mm,所述第二叉指电极32的宽度d2可以设置为2mm~8mm。优选地,所述第一叉指电极31的第一部分31a和第二部分31b具有相等的宽度,所述第二叉指电极32的宽度与所述第一叉指电极31的第一部分31a的宽度相等,例如,所述第一叉指电极31的宽度d1为8mm,并且第一部分31a和第二部分31b的宽度分别为4mm,所述第二叉指电极32的宽度d2设置为4mm。
48.其中,所述第一叉指电极31和所述第二叉指电极32的材料为金属。所述第一叉指电极31和所述第二叉指电极32是通过光刻工艺制备形成在所述基底表面11上。
49.具体地,所述第一叉指电极31和所述第二叉指电极32的制备工艺过程包括以下步骤:
50.s21、通过匀胶机在所述基底表面11上涂布光刻胶层并烘干。
51.s22、将涂布了光刻胶层的基底10放入光刻机,通过具有所述第一叉指电极31和所述第二叉指电极32图案的掩模版对光刻胶层进行曝光,然后显影,由此将第一叉指电极31和第二叉指电极32的图案转移到光刻胶层中,形成光刻胶掩模层。
52.s23、在所述光刻胶掩模层的遮挡下,在所述基底表面11上溅射沉积金属层,然后剥离所述光刻胶掩模层及其上方的金属层,由此在所述基底表面11上制备形成所述第一叉指电极31和所述第二叉指电极32。
53.需要说明的是,以上的装置的制备工艺过程中,需要先制备获得所述第一叉指电极31和所述第二叉指电极32,然后再将制备得到的流体样本通道20键合到所述基底表面11上。
54.另外,通过设定叉指电极的不同参数,如叉指数量,周期、占空比等参数,由此可以改变叉指电极产生的声波性质。因此,这些参数需要根据实际需要设定,在本发明实施例中不作具体限定。
55.如上实施例提供的用于对流体样本内的微粒进行筛选的装置,其中的流体样本通道和表面声波发生器均是通过微纳加工工艺集成设置在基底上,该装置体积小,易携带,能够适用于更加广泛的应用场景。进一步地,该装置中将实现聚体功能的驻波声场和实现分离功能的行波声场共能结合到了一起,使得装置更加的紧凑高效。
56.基于以上实施例提供的装置,本发明实施例还提供了一种用于对流体样本内的微粒进行筛选的方法,参阅图2并结合图1,所述方法包括以下步骤:
57.s1、提供流体样本,所述流体样本内的微粒包括目标微粒和非目标微粒,使用分选标记物对所述目标微粒进行标记,以使标记的目标微粒和所述非目标微粒具有不同的声学特性。
58.具体地,所述不同的声学特性是指在所述行波声场的作用下产生不同的声辐射力。
59.具体地,所述微粒例如是细胞、脂粒或大分子蛋白,所述分选标记物为生物素化的微泡或聚二甲基硅氧烷颗粒。
60.优选的,本发明实施例的方法特别适用于所述目标微粒和所述非目标微粒是表面受体蛋白的功能性具有差异的同种类型微粒。例如,所述流体样本内的微粒为血液细胞,其中的目标微粒为活细胞而非目标微粒为死细胞,或者是,目标微粒为循环肿瘤细胞而非目标微粒为红细胞和白细胞。
61.s2、将所述流体样本输入至所述流体样本通道20的入口21,向所述表面声波发生器30施加信号以形成所述驻波声场和所述行波声场,所述流体样本依次通过所述驻波声场和所述行波声场朝向所述流体样本通道20的出口22/23流动。
62.具体到本实施例中,向所述表面声波发生器30的第一叉指电极31和第二叉指电极32施加信号,在信号源的作用下,第一叉指电极31的第一部分31a和第二叉指电极32共同激励产生所述驻波声场ssaw,第一叉指电极31的第二部分31b激励产生行波声场tsaw。其中,所述驻波声场ssaw将所述流体样本中的所述标记的目标微粒1(图2中3为分选标记物)和所述非目标微粒2捕获在同一路径上传输,所述行波声场tsaw驱动所述标记的目标微粒1和所述非目标微粒2相互偏离形成不同的传输路径,使得所述标记的目标微粒1和所述非目标微粒2从所述流体样本通道20的不同出口输出。
63.本实施例中,作为一个具体的案例,所述流体样本内的微粒为细胞,其中的目标微粒为活细胞而非目标微粒为死细胞,所述分选标记物为微泡。使用分选标记物对目标微粒进行标记的过程如下:
64.s31、将生物素注射入磷脂微泡溶液中,利用震荡仪将微泡溶液震荡,获得具有预定尺寸微泡的生物素化微泡溶液。
65.s32、基于活细胞(目标微粒)的表面受体蛋白的生物功能正常而死细胞(非目标微粒)的表面受体蛋白的生物功能缺失的功能性差异,使用生物素对活细胞进行标记,然后再使用亲和素修饰前述生物素化的活细胞。
66.s33、将步骤s31的生物素化微泡溶液和步骤s32的细胞溶液搅拌混合并孵育,由此使得生物素化微泡与生物素化的活细胞,即,目标微粒活细胞被生物素化微泡标记。
67.将包含以上微泡标记的活细胞和未标记的死细胞的样本通入到流体样本通道20,样本依次通过驻波声场ssaw和行波声场tsaw:样本通过驻波声场ssaw区域时,声场的势阱
将样本内部的被标记的活细胞1和未标记的死细胞2捕获在同一路径上传输;样本通过行波声场tsaw区域时,由于微泡所受到的声辐射力远大于细胞所受到的声辐射力,因此结合有微泡的活细胞1与死细胞2受力不同,两者的运动轨迹产生差异形成不同的传输路径,最终从流体样本通道20的不同出口输出,由此实现了对目标微粒活细胞的筛选。图3是筛选过程的电子显微镜图,如图3中,目标微粒活细胞(如图3中右下出口)与非目标微粒死细胞(如图3中右上出口)具有不同的传输路径。
68.除了对活细胞和失活细胞的筛选之外,也可以通过微泡结合抗体的形式,筛选具有该抗体和没有该抗体的物质,例如t细胞和杂质颗粒(可以为各种死细胞,脂粒,无机磁珠等)混合在一起,采用可与t细胞表面受体结合的抗体,与微泡共同孵育,利用微泡结合t细胞,从杂质中分离。
69.综上所述,本发明实施例中提供的用于对流体样本内的微粒进行筛选的装置及其相应的筛选方法,通过对目标微粒进行声学特性标记,在利用表面声波发生器产生的驻波声场和行波声场实现目标微粒和非目标微粒的富集与分离,可以实现对诸如细胞等流体样本内的微粒进行有效、快速地筛选,并且该装置体积小,易携带,能够适用于更加广泛的应用场景。
70.以上所述仅是本技术的具体实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本技术的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。