微滴数字pcr检测前列腺癌组织中cthrc1基因含量的方法
技术领域
1.本发明涉及一种微滴数字pcr检测前列腺癌组织中cthrc1基因含量的方法,属于cthrc1基因含量的检测方法技术领域。
背景技术:
2.前列腺癌是男性泌尿系统最常见的恶性肿瘤之一,其死亡率占男性恶性肿瘤相关死亡的第三位。随着我国生活水平,老龄化程度及诊断技术的提高,前列腺癌的发病率也在逐年增高。目前tpsa仍是我国前列腺癌经济、便捷的诊断指标,早期tpsa的检测可降低前列腺癌的病死率。但中国前列腺癌联盟(cpcc)研究数据显示,在tpsa 4
‑
10ng/ml时,前列腺穿刺阳性率约26%。同时tpsa水平受炎症、直肠指诊和良性前列腺增生等因素影响,容易产生假阳性情况,因此,临床迫切需要寻找新的前列腺癌诊断标志物,为前列腺癌的早期筛查提供新的指标。
3.cthrc1是一个28kd的分泌型糖基化蛋白,在人和大鼠中,该基因的氨基酸序列具有92%的同源性。多项研究显示,在癌症组织中cthrc1可参与多种信号通路的调节,并促进这些癌症的侵袭和转移,最近已被证明在人胰腺癌、乳腺癌、肝癌、胃癌和大肠癌中存在高表达现象。cthrc1也可作为前列腺癌诊断标志物。目前,对cthrc1基因含量的检测方法,存在灵敏度不高等问题。因此,设计一种微滴数字pcr检测前列腺癌组织中cthrc1基因含量的方法,能够提高对cthrc1基因含量的检测灵敏度。
技术实现要素:
4.本发明所要解决的技术问题在于:提供一种微滴数字pcr检测前列腺癌组织中cthrc1基因含量的方法,它解决了目前对前列腺癌组织中cthrc1基因含量的检测灵敏度有待进一步提高的问题。
5.本发明所要解决的技术问题采取以下技术方案来实现:
6.微滴数字pcr检测前列腺癌组织中cthrc1基因含量的方法,其特征在于,它包括以下步骤:
7.(1)引物与质粒准备
8.根据cthrc1的序列设计引物,经过序列比对分析,针对cthrc1保守区设计引物,5
′→3′
引物序列为f:cttcatatgtggccgccagg;r:agatgagcccctggaaagca;同时设计β
‑
actin内参引物,5
′→3′
引物序列为f:cctggcacccagcacaat;r:gggccggactcgtcatac;利用cthrc1引物扩增的该段目的基因片段构建puc57质粒,质粒含有3070bp,质粒浓度为40ng/μl,通过换算为1.19
×
10
10
copies/μl;
9.(2)酶切puc57质粒
10.将含有目的基因的puc57质粒与ecori试剂按体积比例进行混合,其中,ecori:10
×
buffer:puc57 plasmid:ddh2o=1:2:4:13,取总体积为20μl的上述酶切混合物,将混合物放入37℃恒温金属浴中孵育2h,然后将混合物在65℃孵育20min,灭活ecori酶;
11.(3)ddpcr检测
12.按照pcr检测仪器操作指南,反应体系为20μl,其中2x ddpcr supermix evagreen 10μl,上下游引物(10μm)各0.4μl,模板3μl,ddh2o 6.2μl;使用qx200
tm
微滴生成仪生成微滴,然后用px1
tm
pcr板封口机热封96孔板,最后使用qx100
tm
pcr仪对含有目的基因进行扩增,反应条件为:95℃5min;95℃30s,60℃1min,40个循环;4℃5min;90℃5min;4℃保存;扩增结束后将96孔板放入qx200
tm
微滴读取仪中对扩增产物进行分析,检测到荧光信号的被记为阳性反应,没有检测到荧光的被记为阴性反应,最后通过quantasoft分析软件计算出质粒的绝对浓度。
13.本发明的有益效果是:通过电泳验证引物的特异性,引物符合要求;ddpcr检测cthrc1的正确度分析表现出很好的线性关系;ddpcr通过检测连续稀释的质粒,得出它检测cthrc1的灵敏度高。
附图说明
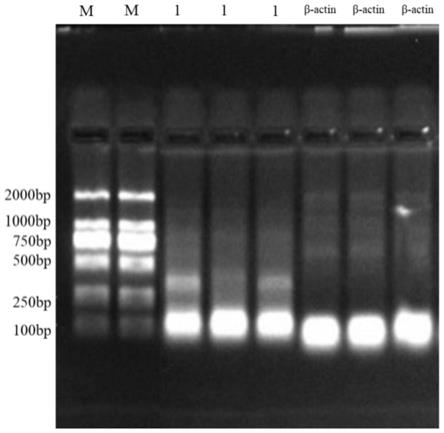
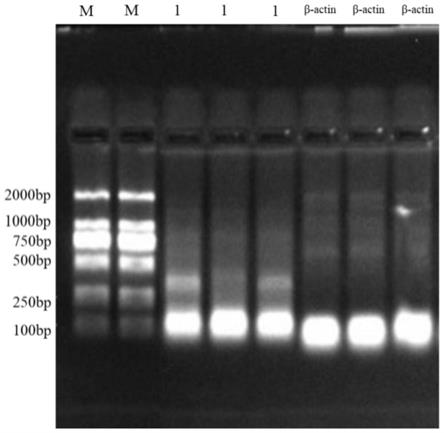
14.图1为两对引物分别对3例标本扩增后电泳图。
15.图2为β
‑
actin引物检测6例标本结果。
16.图3为1号引物检测6例标本结果。
17.图4为ddpcr检测cthrc1正确度分析结果。
18.图5为ddpcr检测cthrc1的线性范围。
19.图6为105copies/μl的质粒ddpcr检测结果。
20.图7为cthrc1、tpsa以及cthrc1 tpsa联合检测诊断前列腺癌的roc曲线。
具体实施方式
21.为了对本发明的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐述本发明。
22.实施例
23.1资料与方法
24.1.1一般资料
25.收集2019年
‑
2020年复旦大学附属中山医院泌尿外科住院患者73例前列腺穿刺组织,其中前列腺癌组织40例,年龄42~85岁,平均年龄(70.56
±
8.42)岁,非前列腺癌组织33例,年龄49~85岁,平均年龄(68.56
±
7.67)岁。
26.1.2仪器与试剂
27.电泳仪是天能eps 300,凝胶成像系统是champgel 5000plus,qx200
tm
微滴生成仪、px1
tm
pcr板封口机、qx100
tm
pcr仪、qx200
tm
微滴读取仪购自美国bio
‑
rad公司,其试剂与耗材均购自美国bio
‑
rad公司。ecori内切酶购自上海生工生物工程股份有限公司。
28.1.3总rna提取及cdna合成
29.总rna提取使用的是上海生工生物工程股份有限公司生产的柱式动物组织总rna抽提纯化试剂盒,cdna合成使用的是赛默飞第一链cdna合成试剂盒,所有操作按试剂说明书完成。
30.1.4引物与质粒准备
31.根据genbank中cthrc1的序列设计引物,经过序列比对分析,针对cthrc1保守区设计引物。5
′→3′
引物序列为f:cttcatatgtggccgccagg;r:agatgagcccctggaaagca。同时设计β
‑
actin内参引物,5
′→3′
引物序列为f:cctggcacccagcacaat;r:gggccggactcgtcatac。利用cthrc1引物扩增的该段目的基因片段构建puc57质粒,质粒含有3070bp,质粒浓度为40ng/μl,通过换算为1.19
×
10
10
copies/μl。引物的合成和质粒的构建均由上海生工生物工程有限公司完成。
32.1.5酶切puc57质粒
33.将含有目的基因的puc57质粒与ecori试剂按比例进行混合,酶切总体积为20μl,见表1。将混合物放入37℃恒温金属浴中孵育2h。然后将混合物再65℃孵育20min,灭活ecori酶。
34.试剂体积(μl)ecori110
×
buffer2puc57plasmid4ddh2o13
35.表1 puc57质粒20μl酶切反应体系
36.1.6ddpcr检测
37.按照仪器操作指南,反应体系为20μl,其中2x ddpcr supermix evagreen10μl,上下游引物(10μm)各0.4μl,模板3μl,ddh2o 6.2μl。使用qx200
tm
微滴生成仪生成微滴,然后用px1
tm
pcr板封口机热封96孔板,最后使用qx100
tm
pcr仪对含有目的基因进行扩增,反应条件为:95℃5min;95℃30s,60℃1min,40个循环;4℃5min;90℃5min;4℃保存。扩增结束后将96孔板放入qx200
tm
微滴读取仪中对扩增产物进行分析,检测到荧光信号的被记为阳性反应,没有检测到荧光的被记为阴性反应。最后通过quantasoft分析软件计算出质粒的绝对浓度。
38.1.7统计学处理
39.采用spss 20.0软件进行统计学分析。计量资料以(mean
±
sd)表示,拷贝数进行log
10
转换,偏态分布资料采用mann
‑
whitney u检验。ddpcr检测cthrc1的正确度和线性范围的线性回归分析采用graphpad prism 8.0.1软件进行。cthrc1鉴别前列腺癌的价值采用受试者工作特征(roc)曲线分析。以p<0.05为差异有统计学意义。
40.2结果
41.2.1引物特异性验证
42.如图1
‑
图3所示,用生工生物工程股份有限公司生产的柱式动物组织总rna抽提纯化试剂盒抽提3例前列腺癌穿刺标本,然后使用赛默飞第一链cdna合成试剂盒将这3例标本的rna反转录为cdna。用本发明设计的1号引物和内参β
‑
actin引物对3例标本的cdna进行扩增,然后对扩增产物进行电泳(2%的凝胶,电泳25min),电泳结果见图1。图1中1号引物和内参β
‑
actin引物扩增产物的电泳条带符合各自基因片段所在的位置。同时也用ddpcr对这两对引物进行验证,图2、图3显示的是β
‑
actin引物和1号引物检测6例前列腺癌穿刺标本的结果,如图2、图3所示,这两对引物都能检测出各自的目的基因,特异性符合要求。所以,选择了这两对引物作为后续实验的引物。
43.2.2ddpcr检测cthrc1正确度评估
44.首先用ddh2o将酶切的puc57质粒稀释至104,103,102,101和100copies/μl,然后用ddpcr对每个稀释度重复检测三次,最后将检测值和理论值通过对数转换,再进行比较。两组数据之间的log值差异都小于1,同时两组数据之间展示出了很好的拟合度(r2=0.9959),如图4所示。ddpcr检测cthrc1正确度满足实验要求。
45.2.3ddpcr检测cthrc1精密度评估
46.验证ddpcr检测cthrc1的批内精密度时,选用的是一个低浓度和一个高浓度的质粒,分别是101和103copies/μl的酶切puc57质粒,每个浓度在同一批次里用ddpcr各检测20次,计算sd值,平均值和cv值。从表2中可以得出,批内精密度高低浓度质粒的cv值都小于10%,说明ddpcr检测cthrc1的批内精密度符合要求。在验证ddpcr检测cthrc1的批间精密度时,分四批对高低浓度的质粒各检测20次,计算sd值,平均值和cv值。高低浓度质粒的cv值都小于15%,如表2所示,说明ddpcr检测cthrc1的批间精密度也符合要求。
[0047][0048]
表2 ddpcr检测cthrc1的精密度
[0049]
2.4ddpcr检测cthrc1检测下限
[0050]
由于ddpcr理论检测下限是1copies/μl,所以将酶切的puc57质粒稀释到100copies/μl,用ddpcr检测10次,如表3所示,100copies/μl的puc57质粒10次全部都能检测出来,所以ddpcr检测cthrc1下限能达到100copies/μl。
[0051][0052]
表3ddpcr检测cthrc1下限验证结果
[0053]
2.5ddpcr检测cthrc1线性范围
[0054]
将酶切的puc57质粒稀释到104,103,102,101和100copies/μl,每个稀释度检测3次,检测结果取平均值,再将平均值与质粒的理论值对数转换后进行相关性分析,结果平均值与puc57质粒的理论值之间有很好的线性相关性r2=0.9972,如图5所示。同时也检测了稀释度为105copies/μl的质粒,但发现当模板数大于105copies/μl时,ddpcr的阳性微滴数就达到了饱和状态,基底荧光信号基本消失,检测值与理论值之间发生了偏离而不相符,如图6所示。所以ddpcr检测cthrc1的有效检测范围是100‑
105copies/μl。
[0055]
2.6ddpcr检测73例前列腺组织穿刺标本中cthrc1含量
[0056]
用ddpcr检测73例临床前列腺组织穿刺标本,检测结果用mann
‑
whitney u检验和roc曲线进行分析。分析结果发现,其中40例前列腺癌穿刺标本中cthrc1基因含量显著高于33例非前列腺癌穿刺标本中cthrc1基因含量,差异有统计学意义(z=
‑
4.339,p<0.001)。将
cthrc1检测结果与血清tpsa结果绘制roc曲线,见图7,发现联合检测可以显著提高前列腺癌检测的曲线下面积(auc),敏感性和特异性,其结果分别为0.847,83.3%,67.7%,详细统计结果见表4。
[0057]
项目auc敏感性(%)特异性(%)95%置信区间tpsa0.72073.361.30.589
‑
0.850cthrc10.79780.066.70.696
‑
0.897cthrc1 tpsa0.84783.367.70.746
‑
0.949
[0058]
表4roc曲线评价tpsa、cthrc1以及cthrc1 tpsa联合检测统计结果
[0059]
3讨论
[0060]
近年来,我国前列腺癌的发病率和死亡率有逐年增高的趋势,早期诊断的困难是影响其诊疗效果的主要因素。目前,tpsa和fpsa在临床上运用最为广泛,但由于tpsa特异性较低,在前列腺炎,良性前列腺增生等良性疾病中也有升高,而fpsa存在含量低、半衰期短、稳定性差等缺点,因此,深入研究前列腺癌发生发展机制,发现早期诊断前列腺癌的分子标志物,对于前列腺癌的治疗和预后具有重要意义。cthrc1是一种分泌性蛋白,其表达的增加能够提高癌细胞的浸润能力和转移风险,进而加剧临床病情的进展。研究显示cthrc1与多种实体肿瘤的转移密切相关。
[0061]
ddpcr是不依赖于外部校准曲线,能敏感和特异的检测核酸,同时相比qpcr,它对pcr抑制物高耐受,已成为一种新的分子检测技术。ddpcr的应用越来越广泛,在癌症检测,核酸定量上应用越来越多。ddpcr正在迅速取代qpcr作为独立的核酸定量分析的一种有效方法。
[0062]
本研究对cthrc1的一段保守区域设计引物,同时对这段保守区域构建质粒,利用构建的puc57质粒来验证ddpcr技术检测cthrc1的性能。实验结果表明,在正确度方面,ddpcr技术检测cthrc1的检测值与质粒理论值之间展现了很高的拟合度(r2=0.9959)。在精密度方面,验证了批内精密度和批间精密度,结果ddpcr技术检测cthrc1的批内精密度和批间精密度的cv值最低能达到4.8%和6.9%。在检测下限方面,ddpcr技术检测cthrc1模板的最低检出限可以达到1copies/μl。在验证线性范围方面,用连续稀释的puc57质粒来评估ddpcr技术检测cthrc1的线性范围,结果表明,该方法有效检测范围是1
‑
105copies/μl,因为当cthrc1质粒上限超过105copies/μl时,ddpcr产生的微滴达到饱和使泊松的统计方法失效。通过方法学验证数据说明ddpcr适合前列腺癌患者临床样本中cthrc1含量的检测,该方法是一种可靠、准确、灵敏的癌症研究工具。
[0063]
为了明确cthrc1与前列腺癌的关系,利用ddpcr检测了40例前列腺癌穿刺标本和33例非前列腺癌穿刺标本中cthrc1基因含量。分析结果发现cthrc1在前列腺癌患者样本中的基因含量显著高于非前列腺癌患者,差异有统计学意义(p<0.001),初步证实cthrc1基因含量在前列腺癌中高表达。同时为了评价cthrc1对前列腺癌的诊断价值,将cthrc1检测结果与血清tpsa结果绘制roc曲线,结果发现相比tpsa,cthrc1作为前列腺癌的判断因子具有较好的预测价值。而联合检测是筛查前列腺癌的有效手段,可使局限性前列腺癌和无症状的隐匿性前列腺癌被发现的频率增加,从而使可根治的前列腺癌能被早期发现。为此,利用roc曲线分析了cthrc1与tpsa联合检测前列腺癌和非前列腺癌的性能,发现联合检测比单独tpsa和cthrc1检测具有更高的曲线下面积,敏感性和特异性,其结果分别为0.847,
83.3%,67.7%,因此联合检测cthrc1与tpsa有利于进一步提高对前列腺癌的诊断能力,为前列腺的早期治疗和改善预后提供帮助。
[0064]
4结论
[0065]
综上所述,ddpcr的高敏感性和高特异性可用于前列腺癌患者组织中cthrc1基因含量的检测,而cthrc1在前列腺癌中异常表达提示它有可能成为前列腺癌患者早期诊断的筛查指标和治疗的潜在靶点。然而,cthrc1在前列腺癌发展中的具体作用机制以及是否可以作为肿瘤标志物用于前列腺癌的临床检测还需要大量的研究去进一步阐述。
[0066]
以上显示和描述了本发明的基本原理、主要特征和优点。本领域的技术人员应该了解,本发明不受上述实施例的限制,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入本发明要求保护的范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。