一株受缺磷信号调控的解磷菌rbc25及其应用
技术领域
1.本发明属于微生物技术领域,具体涉及一株受缺磷信号调控的解磷菌rbc25及其应用。
背景技术:
2.磷对植物的重要性仅次于氮,是植物生长发育中所需的大量矿质营养元素之一。植物对磷的获取主要是通过根系从土壤中以磷酸根的形式吸收。然而,由于土壤中的磷酸根易被土壤中的钙、铁、铝等阳离子固定,或者形成有机磷,不能被植物直接吸收利用,导致土壤中可供植物吸收利用的磷的浓度极低,是限制植物生长的重要因素。但是在进化上,植物可以通过与土壤中微生物的相互作用,促进植物对土壤中磷的吸收利用。因此,分离和应用土壤中能在植物根系大量定殖的解磷微生物是提高植物吸收利用土壤中的磷,促进植物生长的有效途径。
技术实现要素:
3.本发明目的在于提供一株受缺磷信号调控的解磷菌rbc25及其应用。
4.为实现上述目的,本发明采用以下技术方案:一株受缺磷信号调控的解磷菌rbc25,所述的受缺磷信号调控的解磷菌rbc25是分离自种植于酸性土壤的大豆根部,其分类命名为:伯克霍尔德氏菌属(burkholderia sp.)rbc25;于2021年6月28日保藏于武汉大学中国典型培养物保藏中心,保藏编号分别为cctcc no:m2021796;保藏地址为中国.武汉.武汉大学。
5.解磷菌rbc25的培养及形态特征:分离的解磷菌rbc25能够在tsb 培养基和普通的lb 培养基上生长,在固体培养基上其菌落形态为淡黄色,菌落表面有光泽,菌落呈圆形,菌落边界清晰。
6.解磷菌rbc25的生理生化特征:解磷菌rbc25 在难溶性无机磷和难溶有机磷的固体培养基上生长,在菌落周围产生透明的溶磷圈。
7.上述受缺磷信号调控的解磷菌rbc25,受大豆缺磷信号诱导,缺磷条件下在大豆根系大量富集。
8.上述受缺磷信号调控的解磷菌rbc25在促进大豆生长中的应用。
9.本发明的有益效果在于:本发明提供的受缺磷信号调控的解磷菌rbc25不仅具有溶解钙磷、铝磷和矿化有机磷植酸的能力,还能在大豆根部进行定殖,并且其菌群丰度是受大豆磷信号调控的,缺磷信号诱导其在大豆根系大量定殖。该菌通过解磷和矿化有机磷提高大豆对磷的吸收利用,促进大豆生长。在室内盆栽条件下接种rbc25与对照相比,大豆的生物量和磷含量分别提高了39.6%和35.4%;在大田条件下应用rbc25对大豆的生物量和磷含量分别提高了12.5%和16.9%。
10.附图说明:
图1. 解磷菌rbc25溶磷功能鉴定。a:钙磷;b:植酸磷;c:铝磷。
11.图2. 解磷菌rbc25的进化树。
12.图3. rbc25(荧光标记)在大豆根系的定殖分析。
13.图4. 低磷促进rbc25在大豆根系定殖。bf: 白光;gfp:绿色荧光通道; lp:低磷条件;hp:高磷条件。
14.图5. 室内盆栽接种rbc25大豆生物量和磷吸收的影响。
15.图6. 大田条件下接种rbc25对大豆生物量和磷养分吸收的影响。a:大豆植株生长情况;b:生物量;c:磷吸收总量。
具体实施方式
16.为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
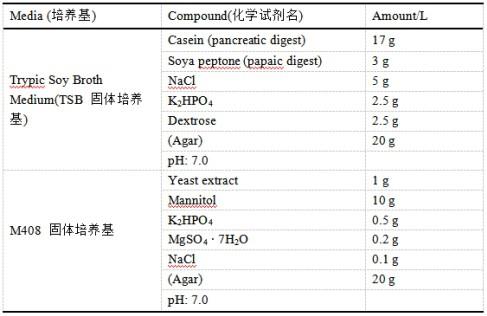
17.实施例1菌株的筛选(1)菌株获取收集种植于大田(广东省惠州市博罗县,根系生物学研究中心实验基地)的酸性红壤下的巴西10(bx10)大豆根系,用pbs缓冲液洗去根表土壤,之后用7vol%酒精(1 min)与2 vol%的次氯酸钠溶液(5 min)对洗涤后样品进行表面进行消毒。表面消毒后的样品用无菌水洗涤5次。取出样品在灭菌后的滤纸上将水吸干。加入5 ml无菌水,通过组织裂解器对样品进行匀浆处理。将匀浆母液进行初步过滤后,以无菌水10000倍进行稀释,稀释之后取 100 μl分别涂布于两种细菌固体培养基上(表1)上。平板置于28℃培养箱,从涂布后第三天开始挑取单菌落,并进行划线纯化,挑选单克隆用相应的液体培养基培养后,加入等体积50vol%无菌甘油,混匀后,将保存菌种于
‑
80℃。
18.表1 两种细菌固体培养基配方(2)菌株溶磷能力筛选与鉴定将从大豆根系分离得到的菌进行溶磷功能的检测:在超净工作台中,将保存的菌
液每个吸取2
ꢀµ
l接种到蒙金娜植酸钙(有机磷)、蒙金娜磷酸三钙(无机磷)培养基平板上(培养基配方参见表2),30℃培养3~5 d,期间观察菌株的生长状态如果有溶磷圈的出现,表明菌株具有溶磷能力。从中筛选、鉴定获得菌株rbc25具有强的溶磷能力(图1)。
19.rbc25的铝磷溶解能力鉴定:将od
600 = 1.0 的rbc25菌液,取5 ml 接种到100 ml 的蒙金娜铝磷液体培养基(表3),于28℃下培养,在不同时间点取培养基,12000 rpm 离心取上清,最后用钼锑抗显色法测定液体培养基上清的可溶磷含量,具体结果如图1c 所示。
20.表2 种细菌溶磷固体培养基配方表3 蒙金娜液体培养基配方(3)菌株rbc25的培养及形态特征、生理生化特征
分离的解磷菌rbc25能够在tsb 培养基和普通的lb 培养基上生长,在固体培养基上其菌落形态,淡黄色,菌落便面有光泽,菌落呈圆形,菌落边界清晰。解磷菌rbc25 在难溶性无机磷和难溶有机磷的固体培养基上生长,在菌落周围产生透明的溶磷圈。
21.(4)菌株rbc25的16s rdna序列分析利用引物16s
‑
rrna
‑
f: agagtttgatcctggctcag ;16s
‑
rrna
‑
r: tacggctaccttgttacgactt扩增菌株rbc25的16 rdna,并进行测序(具体序列如seq id no.1所示),将得到的序列提交ncbi(https://www.ncbi.nlm.nih.gov/)进行blast比对分析,构建进化树(图2)。通过分析发现,菌株rbc25 属于伯克霍尔德氏菌属(burkholderia sp.)。
22.实施例2菌株的定殖分析(1)利用含有萤火虫荧光素酶基因的载体 pmg103
‑
nptii
‑
luc 和含有绿色荧光蛋白的细菌表达载体pmg103
‑
nptii
‑
gfp,以电转法(12.5kv/cm),将载体分别电击转化至解磷菌rbc25中,在kan
(50 μg/ml)抗性lb平板上筛选阳性克隆,获得分别含有萤火虫荧光素酶和绿色荧光蛋白标记的解磷菌rbc25。
23.(2)将10 ml od
600 = 0.2 的含有萤火虫荧光素酶标记的解磷菌rbc25菌悬液接种到泥炭基质中,与5天的大豆幼苗共培养一周,从基质中取出大豆植株,抖去根上疏松的基质,并喷施萤火虫荧光素酶的底物,反应5min,置于天能化学发光成像仪器的成像室进行荧光信号采集。结果如图3所示,在大豆的根系能检测到明显的化学荧光信号,说明解磷菌rbc25 能在大豆根系的各个部位进行定殖。
24.(3)将携带有绿色荧光蛋白表达载体pmg103
‑
nptii
‑
gfp的解磷菌rbc25 菌悬液(od
600 = 0.2)5 ml 喷施到生长于(低磷的5 μm pi见表4和高磷:500 μm pi见表5)ms 培养基的毛根上,于28℃共培养5天,将带有毛根的培养皿置于体式荧光显微镜下,在绿色荧光通道观察gfp 信号。结果(图4)显示,在低磷条件下的大豆毛根的根上检测到了明显的gfp荧光信号,而在高磷条件下的gfp荧光信号较弱。结果表明:缺磷信号(低磷处理)调控了解磷菌rbc25在大豆根系上的定殖。
25.实施例3室内盆栽接种解磷菌rbc25对大豆磷吸收以及生长的影响(1)菌株活化:将
‑
80℃保存的菌株rbc25划线接种于tsb固体培养基,放置于28℃培养箱进行培养。待长出单克隆之后,将活化后的菌株转接在5 ml液体tsb培养基中培养,置于28℃,200 rpm的摇床,培养至菌液od
600 = 1.0。
26.取菌液500 μl,转接到50 ml液体tsb培养基中,于28℃,200 rpm下培养2
‑
3天,至od
600 = 1.5。
27.(2)通过离心方式(5000 rpm, 10 min)收集菌体,菌体用50 ml无菌水悬浮,并用无菌水将od
600 调整至od
600 = 0.2。
28.(3)将大豆种子种植于7
×7×
10 cm的装有灭菌(121℃,30 min)生长基质(jiffy base peat(泥炭基质:荷兰捷菲公司))盆子中,(基质距离盆口1 cm ,同时在每盆的基质中再添加0.5 g 无机难溶磷ca3(po4)2和0.5 g 难溶有机磷植酸钙(c6h6ca6o
24
p6)粉末。
29.(4)每盆种4粒大豆种子(williams82),种植之前大豆种子经过表面消毒(70vol% 酒精处理1分钟),于大豆真叶完全展开后,去除长势不均一的苗子,每盆只留下一株。实验设置接种处理和不接种处理,实验组每盆基质接种10 ml od
600 = 0.2的解磷菌rbc25菌液,对照组不接种解磷菌rbc25,实验组和对照组每个处理种植6盆。在大豆生长期间,每盆大豆
每两天提供50 ml 的低磷营养液(5 μm pi)(表4),大豆与解磷菌rbc25于生长室内共培养1个月,之后对大豆的长势进行拍照,测定植株生物量和磷含量。结果显示(图5):在低磷条件下,与对照相比,接种受缺磷信号调控的解磷菌rbc25能明显的促进大豆的生长,显著增加了大豆的生物量和磷吸收量,其中植株的生物量提高了39.6%, 植株磷吸收总量提高了35.4%。表明低磷下接种受缺磷信号调控的解磷菌rbc25通过提高大豆对磷的吸收,促进了植株生长。
30.表4 低磷营养液(5 μm pi)的配方表5 高磷营养液(500 μm pi)的配方实施例4大田条件下接种解磷菌rbc25对大豆磷养分吸收以及生长的影响。
31.(1)菌株活化:将
‑
80℃保存的菌株rbc25先转接于tsb固体培养基,放置于28℃培养箱进行活化,然后将活化后的菌株转接到tsb液体培养基,培养至菌液od
600 = 1.5。
32.(2)取上述菌液500 μl,接种到50 ml tsb液体培养基中,于28℃,200 rpm下培养2
‑
3天,至od
600 = 1.5。
33.(3)通过离心方式(5000 rpm, 10 min)分别收集菌体,菌体用50 ml无菌水重悬,并用无菌水将od
600
调整至od
600 = 1.0。
34.(4)将50 ml重悬后od
600 = 1.0的菌液与含20 g植物生长基质(jiffy base peat/荷兰捷菲公司)按体积比1:1混合均匀,制备菌剂。实验设置以不接种菌剂为对照。
35.(5)大田实验规划:实验每个小区设置:5米行长,1.2米行宽。大豆株距为20 cm,行距为40 cm。每穴播种2粒种子。以接种解磷菌rbc25为实验组,播种之前大豆种子与配制好的菌剂均匀混合。实验以不接种菌剂为对照。实验分为实验组和对照组分别设置3个小区。大豆种植过程中,根据需求正常浇水,不施肥。于大豆生育期的鼓荚期进行收获,检测大豆的磷吸收总量和生物量指标。
36.(6)结果如图6所示:在田间条件下接种受缺磷信号调控的解磷菌rbc25能够促进大豆生长,相比对照组,其中生物量提高了12.5%,磷吸收总量提高了16.9%。说明接种受缺磷信号调控的解磷菌rbc25能够提高磷吸收,促进大豆生长,具有较好的应用前景。
37.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。