含aif1细胞因子抗体的金鞭藻及其制备方法和应用
技术领域
1.本发明属于生物技术领域,涉及含aif1细胞因子抗体的金鞭藻及其制备方法和应用。
背景技术:
2.我国是世界水产养殖大国,总产量连续多年位于世界首位,但由于我国水产养殖规模化、集约化不断扩大,致使养殖水环境逐年恶化,病害暴发严重,根据中国科协发布的《病虫害防治绿皮书》,我国水产养殖病害平均年损失超百亿元之巨。同时,长期不科学的滥用渔药,使得致病微生物的耐药性不断增强,药物残留量超标问题等日益突出,这也成为我国人民饮食产品安全与健康的重要问题。上述病害的严重高发和化学药物及抗生素的滥用,严重阻碍了我国水产养殖产业的发展,水产动物病害的合理、有效防控成为我国水产养殖业可持续健康发展的核心问题。
3.我们前期对aif1对革兰氏阴性菌成份lps和类立克次氏体(rlo)抗感染的研究显示:牡蛎aif1(ca
‑
aif1)多克隆兔抗血清能显著抑制类立克次氏体(rlo)和lps刺激引起的炎症相关因子litaf的表达(lps anti
‑
ca
‑
aif1,1.5
‑
12小时分别降低70.95%,84.18%, 39.49%和87.53%;rlo anti
‑
ca
‑
aif1,1.5
‑
12小时分别降低88.57%,84.80%,59.36%和 59.16%),说明ca
‑
aif1多克隆抗血清具有有效抑制rlo感染和革兰氏阴性菌引起的炎症反应的作用。再比如,ca
‑
aif1抗血清能够显著抑制rlo感染和革兰氏阴性菌引起的细胞凋亡和细胞坏死,显著增加细胞存活率,rlo anti
‑
ca
‑
aif1实验组和lps anti
‑
ca
‑
aif1实验组活细胞数分别增加了51%和49%;而晚期凋亡细胞率分别减少了约50%和18%。
技术实现要素:
4.针对上述现有技术中存在的缺乏,本发明提供了aif1细胞因子抗体驯化培养金鞭藻及其贝类及鱼虾病害抗感染防治的免疫抗病饵料应用。
5.一种含有aif1细胞因子抗体的金鞭藻。
6.含有aif1细胞因子抗体的金鞭藻的制备方法,采用纯化出来的近江牡蛎aif1细胞因子抗体蛋白制品标记fitc荧光标记,以pvec穿膜肽为载体将aif1细胞因子抗体蛋白分子导入金鞭藻,在室温黑暗条件下,进行aif1细胞因子抗体孵育金鞭藻,从而获得含有aif1细胞因子抗体的金鞭藻。
7.aif1细胞因子抗体的制备包括如下步骤:
8.1)以近江牡蛎血淋巴细胞总rna为模板,反转录成一链cdna,克隆获得aif1基因的编码框核苷酸序列;
9.2)将aif1基因编码框的序列片段克隆到pmd19
‑
t载体中,再经限制性内切酶酶切,与经同样酶切的pet
‑
32(a)原核表达载体连接,获得重组表达质粒pet
‑
32(a)
‑
aif1;
10.3)将阳性重组质粒pet
‑
32(a)
‑
aif1转化到表达宿主菌e.coli rossetta(de3),异丙基硫代半乳糖苷(iptg)诱导表达,sds
‑
聚丙烯酰胺凝胶电泳(sds
‑
page)进行检测;
11.4)将阳性表达菌液扩大培养,利用蛋白质纯化试剂盒分离纯化重组蛋白质;
12.5)将纯化的aif1蛋白多点注射新西兰大白兔,制备纯化多克隆抗体。
13.其中,aif1细胞因子抗体蛋白分子导入金鞭藻包括如下步骤:
14.1)aif1细胞因子抗体纯化及绿色荧光标记
15.采用protein a sepharose亲和层析柱纯化获得抗血清的总igg;使用nhs
‑
fluorescein (pierce,美国)标记纯化的aif1多克隆抗体;
16.2)金鞭藻培养及生长曲线绘制
17.金鞭藻采用以天然海水为基础的培养液进行传代培养,将无菌金鞭藻按照1:10比例接种到新鲜培养基中,培养条件:温度23℃,光照强度3000lx,光暗周期比为12h:12h;每隔24h无菌条件下取藻样于酶标仪上测定660nm处吸光值,绘制金鞭藻生长曲线,每个时间点执行3个生物学重复;
18.3)aif1细胞因子抗体导入金鞭藻
19.收集处于对数生长期的金鞭藻并离心,使用无菌pbs洗涤金鞭藻3次,使用细胞计数板显微镜下计数将浓度调整为106cell/ml,离心去掉上清液;将100μl终浓度为100 μg/ml aif1抗体与终浓度为20μm pvec混合后加入藻沉淀中,使其浓度为106cell/ml;室温暗室中孵育,分别在孵育15min,30min时取样置于载玻片上,50%甘油封片于共聚焦显微镜下观察拍照,每个实验设置3个生物学重复。
20.优选的,采用激光共聚焦显微镜检测、验证金鞭藻体内含有牡蛎aif1细胞因子抗体蛋白质成分及其含量。
21.另外,本发明提供含有aif1细胞因子抗体的金鞭藻用于制备鱼虾病害抗感染防治的免疫抗病饵料的应用。
22.所述应用为制备抗革兰氏阴性菌和类立克次氏体(rlo)感染的免疫饵料。
23.本发明还提供一种饵料,含有权利要求1所述含有aif1细胞因子抗体的金鞭藻。
24.本发明采用纯化出来的近江牡蛎aif1细胞因子抗体蛋白制品标记fitc荧光标记,以pvec 穿膜肽为载体将aif1细胞因子抗体蛋白分子导入金鞭藻(备注:金鞭藻是培育牡蛎幼虫和鱼虾饵料的主要藻类),在室温黑暗条件下,进行aif1细胞因子抗体孵育金鞭藻,从而获得含有aif1细胞因子抗体分子物质成分的金鞭藻种类。采用抗体分子免疫荧光标记生物学技术、激光共聚焦显微镜检测、验证金鞭藻体内含有牡蛎aif1细胞因子抗体蛋白质成分及其含量。本发明具有以下特点:
25.1.采用基因克隆技术,制备、纯化牡蛎促炎细胞因子aif1蛋白质。
26.2.制备并且纯化抗革兰氏阴性菌和类立克次氏体(rlo)病的aif1抗体蛋白分子(或制品)。
27.3.采用纯化出来的近江牡蛎aif1细胞因子的抗体蛋白分子(或制品),进行aif1细胞因子抗体分子导入金鞭藻的研究和金鞭藻驯化混合培养。
28.4.采用分子生物学技术(包括分子免疫学技术、蛋白质分离纯化技术、抗体分子免疫荧光标记生物学技术、激光共聚焦显微镜等)检测、验证金鞭藻体内含有近江牡蛎aif1细胞因子抗体蛋白质成分及其含量。
29.本发明的有益效果在于:
30.本发明获得了aif1细胞因子抗体蛋白分子导入金鞭藻的技术;含有牡蛎aif1细胞
因子抗体驯化培养的金鞭藻种类;获得了含有近江牡蛎aif1细胞因子抗体驯化培养的金鞭藻用于制备抗革兰氏阴性菌和类立克次氏体(rlo)感染的免疫饵料及其技术。
附图说明
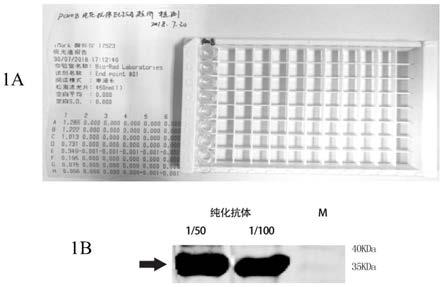
31.图1 aif1抗体滴度检测其中1a:elisa方法,1b:western blot。
32.图2共聚焦检测aif1细胞因子导入金鞭藻,其中2a:fitc标记aif抗体;2b:pvec孵育 fitc抗体15min;2c:pvec孵育fitc抗体30min。
33.图3穿膜肽pvec介导aif1抗体进入金鞭藻机制示意图。
具体实施方式
34.本发明的实现步骤包括:
35.一、采用基因克隆技术,制备、纯化牡蛎促炎细胞因子aif1蛋白质及其细胞因子抗体制备
36.1、以近江牡蛎血淋巴细胞总rna为模板,反转录成一链cdna,克隆获得aif1基因的编码框核苷酸序列。
37.2、将aif1基因编码框的序列片段克隆到pmd19
‑
t载体(takara公司,日本)中,再经限制性内切酶酶切,与经同样酶切的pet
‑
32(a)原核表达载体(novagen公司,美国)连接,获得重组表达质粒pet
‑
32(a)
‑
aif1。
38.3、将阳性重组质粒pet
‑
32(a)
‑
aif1转化到表达宿主菌e.coli rossetta(de3)(全式金,中国),异丙基硫代半乳糖苷(iptg)(sangon公司,加拿大)诱导表达,sds
‑
聚丙烯酰胺凝胶电泳(sds
‑
page)进行检测。
39.4、将阳性表达菌液扩大培养,利用蛋白质纯化试剂盒分离纯化重组蛋白质。
40.5、将纯化的aif1蛋白多点注射新西兰大白兔,制备纯化多克隆抗体。
41.具体的操作步骤如下:
42.1、近江牡蛎血淋巴细胞rna提取和cdna一链扩增
43.提取近江牡蛎血淋巴细胞总rna,使用one
‑
step gdna removal and cdnasynthesis supermix(全式金,中国)反转录为cdna一链。
44.2、近江牡蛎aif1编码框核苷酸全长序列的获得
45.根据ncbi数据库中aif1(hm749971.1)基因序列设计特异性引物(aif1f: cgcggatccatgtcggtggacttcaaag,aif1r:ccgctggagtggcagatcggagagggatttc,酶切位点分别为bamhi和xhoi),使用高保真酶(hs dna polymerase,takara,日本) 克隆aif1编码框核苷酸全长序列。反应条件为:94℃预变性5分钟,35个循环(94℃变性 30s,55℃退火30s,72℃延伸30s),72℃延伸10min。pcr扩增连入pmd
‑
19t载体,转化大肠杆菌dh5α(takara公司,日本),挑取若干个克隆进行pcr鉴定及进一步的测序鉴定。
46.3、pet
‑
32(a)
‑
aif1表达载体的构建
47.将步骤2中鉴定正确的阳性克隆子扩大培养提取质粒,使用bamhi、xhoi限制性内切酶 (takara公司,日本)双酶切,连接入经过同样双酶切的pet
‑
32a载体的相应位点上,转化大肠杆菌dh5α(天根公司,中国)。pcr筛选阳性克隆,经测序鉴定获得编码框正确的表达载体pet
‑
32(a)
‑
aif1。
48.4、重组蛋白质的表达
49.将步骤3中鉴定正确的阳性克隆子扩大培养提取重组质粒pet
‑
32(a)
‑
aif1,转化至表达宿主菌e.coli rossetta(de3)感受态,使用菌落pcr筛选阳性克隆。将阳性菌按1:100 扩大培养至od
600
为0.4
‑
0.5时,加入终浓度为1mmol/l iptg,继续培养4小时,离心收集宿主菌。细菌经超声波裂解后(300w,20min,超声2s,间隔3s)离心分离上清液和沉淀,进行sds
‑
page电泳。
50.5、重组蛋白质的纯化和定量
51.将阳性表达菌扩大培养,按步骤4超声处理,利用ni
‑
nta亲和层析柱(全式金,中国) 对表达产物进行分离纯化,并采用12%的sds
‑
page进行电泳鉴定。
52.将纯化蛋白质使用bradford蛋白质定量试剂盒(天根生化科技有限公司,中国)进行定量。
53.6、pet32a
‑
aif1多克隆兔抗血清制备
54.蛋白质定量后,取适量蛋白,挑选2只体重约2kg的健康新西兰大白兔(雄兔),进行多克隆抗体制备,用纯化所得的pet32a
‑
aif1为抗原加入等体积的佐剂充分乳化后免疫兔子,采用多点背部皮下注射,共免疫四次。
55.(1)免疫前,从耳静脉处收集3
‑
5ml正常血清作为检测抗体时的阴性对照。
56.(2)用剪刀剪去兔子背部部分兔毛,酒精消毒后进行背部皮下多点注射。
57.(3)初次免疫:取约500μg抗原,加入等体积的完全弗氏佐剂充分乳化后注射,背部选取8
‑
10个点,每个点注射约0.1ml;
58.(4)第二次免疫:间隔14d后进行,抗原量为500μg,加入等体积不完全弗氏佐剂充分乳化后注射,方法同上;
59.(5)第三、四次免疫:间隔14d后按同样方法进行,第四次免疫后,从耳静脉采血1ml 分离血清,用双相琼脂扩散法进行免疫血清的抗体效价检测,效价应达到1:16以上才能放血;
60.(6)分离血清:第四次免疫后第7d,待抗体效价达到要求后,进行颈动脉采血并分离血清。分装后,
‑
80℃保存。
61.7、aif1细胞因子多克隆抗体效价测定
62.7.1elisa(酶联免疫吸附)方法检测
63.用间接elisa法测定免疫兔血清中aif1特异性抗体滴度,具体步骤如下:
64.(1)抗原包被:用包被缓冲液将抗原稀释至1~10μg/ml,按100μl/孔加入酶标板中,覆膜,置于4℃过夜。
65.(2)洗涤:次日取出酶标板,倒掉孔中液体,置于纸上拍干;按300μl/孔加入ttbs, 室温放置3min,倒掉拍干,共洗涤3次。
66.(3)封闭:往酶标板中加入封闭液200μl/孔,覆膜,37℃封闭1h。
67.(4)保存:倒掉封闭液,不必拍干,将封闭好的酶标板装入自封袋中置于
‑
20℃保存待用。(注:酶标板上做好对于抗原标记;拿酶标板带手套。)
68.(5)一抗孵育:用封闭液稀释一抗,稀释梯度1:1000,1:3000,1:9000,1:27000,1:81000, 1:243000设置空白对照(封闭液),阴性对照(未免疫血液上清),梯度稀释过程中应充分混匀;稀释好后往酶标板中加入一抗稀释液100μl/孔,37℃孵育1h。
69.(6)孵育完后倒掉一抗,加入ttbs,300μl/孔,室温静置3min,共洗涤3次。
70.(7)二抗孵育:用封闭液稀释二抗(1:1000),洗涤完毕后,加入二抗稀释液100μl/ 孔,37℃孵育1h。
71.(8)孵育完毕后,用ttbs洗涤,300μl/孔,每次静置3min,洗完拍干,共洗涤4次。
72.(9)洗涤后将酶标板置于暗室中,加入150μl/孔tmb,待显呈梯度蓝色后加入50μl/ 孔2m的h2so4,终止反应。(注:便于观察颜色变化可在酶标板下面垫一张白纸;加tmb的顺序应和加h2so4,顺序一致。)
73.(10)将酶标板置于酶标仪中检测450nm吸光度。
74.(11)保存数据,对酶标板和数据打印纸拍照,做好记录。
75.7.2western blot(免疫印迹)方法检测
76.参照sambrook等的方法进行(sambrook j,russell d w.molecular cloning:a laboratory manual,3rd ed.new york:cold spring harbor laboratory press,2001),按一定比例稀释aif1多克隆兔抗血清检测抗体效价,具体步骤如下:
77.(1)sds
‑
page电泳:开始90v电泳,待跑到浓缩胶下面再调为150v直至电泳完毕。(注:点预染marker)
78.(2)剪膜:剪跟胶大小一样的pvdf膜,并标明孔序和marker位置,先用甲醇活化1
‑
2min,再放入转膜buffer中,并将两块滤纸、转移夹一并放入buffer中。(注:buffer盒子封闭避免甲醇挥发)
79.(3)转膜:电泳完毕,小心取下凝胶,切掉琼脂糖凝胶和浓缩胶后将胶置于buffer中,打开转移夹(黑面朝下),先放一个湿润的滤纸,将凝胶放在滤纸上面,再将膜覆盖于凝胶之上,然后再盖上另一块滤纸,最后盖上转移夹置于buffer中夹紧。安装好转移槽,在冰水浴中电泳,恒流180ma电泳2h。
80.(4)封闭:塑料盒中倒入一部分已配好的封闭液,电泳完毕取出pvdf膜,用甲醇活化1
‑
2 min后吹干,将膜放入塑料盒中,再将塑料盒置于摇床上37℃封闭1h。
81.(5)孵育:用1.5ml离心管管取1ml封闭液,加入对应的一抗和二抗各(一般一抗二抗各1μl,具体根据抗体效价),充分混匀,再将膜放于塑料袋中,加入抗体稀释液后封口,置于摇床上37℃孵育1h。(注:pvdf膜尽量一直处于湿润状态)
82.(6)洗涤:孵育完成后,将膜放进塑料盒中加入适量ttbs溶液(淹没膜)置于摇床洗涤 3次,每次10min。
83.(7)凝胶成像系统曝光:配制显色液,每张膜需a液、b液各200μl(现配现用),将 pvdf膜的水分吸干,然后将显色液均匀加在pvdf膜上,放入成像仪器中,设置曝光时间进行条带的显现。
84.二、aif1细胞因子抗体蛋白分子导入金鞭藻
85.1.aif1细胞因子抗体纯化及绿色荧光标记
86.1.1aif1细胞因子多克隆抗体纯化
87.采用protein a sepharose亲和层析柱(索莱宝,中国)按照说明书纯化获得上述抗血清的总igg。具体方法如下:使用binding buffer(0.15m nacl,20mm na2hpo4,ph 7.0) 调节血清至ph 7.0,上样至层析柱,依次用约10倍柱体积的binding buffer(ph 7.0)洗除杂质,最后用洗脱buffer(100mmol/l甘氨酸,ph3.0)解吸附并收集蛋白,收集的蛋白立即用
1.0mol/l tris
‑
hcl(ph 8.0)中和,
‑
20℃保存。
88.1.2纯化的aif1细胞因子多克隆抗体荧光标记
89.使用nhs
‑
fluorescein(pierce,美国)标记纯化的aif1多克隆抗体,步骤如下:取1ml 浓度为7.88mg/ml的纯化aif1多克隆抗体转移至1.5ml无菌离心管中,加入37μl浓度为10mg/ml的nhs
‑
fluorescein荧光溶液,4℃反应24h。反应完成后将反应产物装入透析袋(viskase,美国)中置于1l pbs中透析(4度),去除未结合度荧光素,换3次透析液,透析完全(透析外液为透明无色溶液)后取出偶联产物。稀释5倍后,分别测定a280 和a493吸光度值检测标记蛋白浓度和荧光标记率。
90.2.金鞭藻培养及生长曲线绘制
91.实验所用金鞭藻由广西壮族自治区海洋研究所馈赠,采用以天然海水为基础的优化培养液(60mg/l nano,4mg/l kh2po4,0.5mg/lfec6h5o7,1.0g/l nai
‑
ico,150μg/l维生素b1,200ng/l维生素b
12
)进行传代培养,将无菌金鞭藻按照1:10比例接种到新鲜培养基中,培养条件:温度23℃,光照强度3000lx,光暗周期比为12h:12h。每隔24h无菌条件下取藻样于酶标仪上测定660nm处吸光值,绘制金鞭藻生长曲线,每个时间点执行3 个生物学重复。
92.3.aif1细胞因子抗体导入金鞭藻
93.4.收集处于对数生长期的金鞭藻并离心(400
×
g,10min),使用无菌pbs 洗涤金鞭3次,使用细胞计数板显微镜下计数将浓度调整为106cell/ml,离心去掉上清液。将100μl终浓度为100μg/ml aif1抗体与终浓度为20μm pvec混合后加入藻沉淀中,使其浓度为106cell/ml。室温暗室中孵育,分别在孵育15min,30min时取样置于载玻片上, 50%甘油封片于共聚焦显微镜下观察拍照,每个实验设置3个生物学重复。
94.具体的实施例子:
95.1、aif1细胞因子多克隆抗体纯化
96.采用protein a sepharose亲和层析柱纯化aif1多克隆抗体。具体方法如下:将proteina sepharose装柱,使用binding buffer(0.15m nacl,20mm na2hpo4,ph 7.0)将制备的兔抗aif1多克隆抗体血清调节ph至7.0,上样至protein a sepharose亲和层析柱,用10 倍柱体积的binding buffer(ph 7.0)洗柱,最后用100mmol/l甘氨酸(ph3.0)洗脱蛋白并收集至1.5ml离心管中,收集的蛋白立即用1.0mol/l tris
‑
hcl(ph 8.0)中和,
‑
20℃保存。
97.2、纯化的aif1细胞因子抗体效价测定
98.通过elisa和western方法检测到制备的兔抗aif1多克隆抗体效价超过1:243000,抗体滴度较高(图1)。
99.3、aif1细胞因子多克隆抗体荧光标记
100.取1ml浓度为7.88mg/ml的纯化aif1多克隆抗体转移至1.5ml无菌离心管中,加入 37μl浓度为10mg/ml的nhs
‑
fluorescein荧光溶液,4℃反应24h。反应完成后将反应产物装入透析袋(viskase,美国)中置于1l pbs中透析(4度),去除未结合度荧光素,换3次透析液,透析完全(透析外液为透明无色溶液)后取出偶联产物。稀释5倍后,测得 a280=1.066和a493=0.715,其中493nm为fitc的特异吸收峰,fitc的摩尔消光系数为 70000m
‑1cm
‑1,计算得到产物中fitc的摩尔浓度为5.11
×
10
‑5m;另外,fitc在280nm 处也有吸收,吸光度为493nm处的30%,因此aif1抗体的吸光度为(1.066
‑
0.715
×
0.3)
ꢀ×
5=4.26,抗体的摩尔消
光系数为210000m
‑1cm
‑1,计算得到产物中抗体摩尔浓度为2.03
ꢀ×
10
‑5m,抗体质量浓度为3.04mg/ml,fitc标记率为fitc:抗体=2.52:1。
101.4、荧光标记aif1细胞因子多克隆抗体导入金鞭藻
102.收集处于对数生长期的金鞭藻并离心(400g,10min),使用无菌pbs洗涤金鞭藻3次,使用细胞计数板将其浓度调整为106cell/ml。移取100μl藻液至1.5ml无菌离心管,室温400g离心10min,去除上清收集沉淀。取100μlpbs至1.5ml离心管中,加入fitc 标记aif1抗体和pvec细胞穿膜肽使其终浓度分别为100μg/ml和20μm。将此混合物加入到藻沉淀中使藻悬浮。室温暗室中孵育,分别在孵育15min、30min取样置于载玻片上,50%甘油封片于共聚焦显微镜下观察拍照。由图2可见,当荧光标记aif1抗体与金鞭藻孵育15min 时,仅个别金鞭藻(自发红色荧光)中含有绿色荧光(fitc标记aif1抗体)(fig.2a)。孵育时间达到30min时,可见金鞭藻中大量绿色荧光呈现(fig.2b)。表明,aif1多克隆抗体已成功导入金鞭藻中。图3为穿膜肽pvec介导aif1抗体进入金鞭藻机制示意图。
103.最后,还需要注意的是,以上列举的仅是本发明的若干具体实施例框架。显然,本发明不限于以上实施例,本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。