1.本发明属于微生物领域,涉及一种贝莱斯芽孢杆菌(bacillus velezensis)及其应用。
背景技术:
2.芽孢杆菌属(bacillus)细菌是一类好氧或兼性厌氧,能够产生抗逆性内生孢子的杆状细菌。由于芽孢杆菌可分泌产生多种活性蛋白酶及抑菌活性物质,其在医药及农业领域有着广泛应用。尤其在农业领域,芽孢杆菌属的细菌能够为动植物提供广泛的益处,其可分泌大量的抑菌活性物质,杀灭一些动植物中常见病原菌,包括保护动植物抵抗病原微生物、昆虫及线虫的危害。此外,芽孢杆菌可改善根际微生物菌群,诱导植物自身抗性,促进植物生长,且不会对环境造成损害,在动植物病害防治中受到越来越多的重视。
3.常用的防治动植物病害的芽孢杆菌属细菌主要有枯草芽孢杆菌(bacillus subtilis)、地衣芽孢杆菌(b. licheniformis)、解淀粉芽孢杆菌(b. amyloliquefaciens)等,如枯草芽孢杆菌bs
‑
2分泌的抗菌多肽,对植物炭疽病菌和番茄青枯病菌等多种植物病原真菌与细菌有强抑制作用,对辣椒果炭疽病具有69.79%的防病效果。同时随着研究的不断深入,越来越多其它种类的芽孢杆菌属细菌被应用于生物防治中,如美国拜耳作物科学公司(bayer cropscience inc., usa)生产的商业产品“yield shield”由短小芽孢杆菌gb34(b. pumilus)组成,被用于诱导植物系统性抗性并促进植物生长,该产品在美国环境保护局注册,被用于防治大豆纹枯病和镰刀菌。最新的研究也表明贝莱斯芽孢杆菌(b.velezensis)具有多种应用潜力,可以产生伊枯菌素、芬介素及表面活性素,抑制病原细菌及真菌(包括单核细胞增多性李斯特氏菌及多种曲霉属和镰刀菌属真菌),当被应用于玉米时,贝莱斯芽孢杆菌可抑制以上多种病原真菌生长,并降低黄曲霉毒素和赭曲霉毒素的产生。因此,芽孢杆菌属细菌被认为是应用于动植物病害生物防治的有益微生物资源库,在国内外得到越来越多的研究。但是,由于抑菌范围和效果的限制,仍需挖掘效果优异用于农业生物防治的菌株。
技术实现要素:
4.为了解决上述问题,本发明的目的是提供一种贝莱斯芽孢杆菌及其应用。
5.本发明所提供的贝莱斯芽孢杆菌,分类命名为贝莱斯芽孢杆菌bacillus velezensis,名称为贝莱斯芽孢杆菌(bacillus velezensis)fb17,已于2020年06月04日保存于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no. 20022。
6.其中,所述贝莱斯芽孢杆菌(bacillus velezensis)fb17 cgmcc no. 20022对植物病原真菌、植物病原细菌、蜜蜂病原真菌、蜜蜂病原细菌和条件致病菌具有抑菌作用。
7.本发明的另一个目的是提供所述的贝莱斯芽孢杆菌在抑制植物病原真菌、植物病原细菌、蜜蜂病原真菌、蜜蜂病原细菌和条件致病菌中的应用。
8.本发明的又一个目的是提供一种用于抑制植物病原真菌、植物病原细菌、蜜蜂病原真菌、蜜蜂病原细菌和条件致病菌的抑菌剂。
9.本发明所提供的抑菌剂包含作为活性成分的所述贝莱斯芽孢杆菌。
10.其中,所述植物病原真菌为核盘菌(sclerotinia sclerotiorum)、芸薹生链格孢 (alternaria brassicicola)、尖孢镰刀菌(fusarium oxysporum)、毁灭柱孢菌(cylindrocarpon destructans)、灰霉菌(botrytis cinerea)、禾谷镰刀菌(fusarium graminearum)、刺盘孢菌(colletotrichum orbiculare (berk.&mont.) arx)、天门冬茎点霉菌(pythium sp)、葡萄球座菌(guignardia bidwellii (ell.) viala et ravaz)、稻绿核菌(ustilaginoidea oryzae (patou.) bref=u.virens (cooke) tak.)、立枯丝核菌(rhizoctonia cerealis vander hoeven)、禾旋孢腔菌(cochliobolus sativus (ito & kurib.) drechsler)、匍枝根霉(rhizopus stolonifer)、苹果黑腐皮壳菌(valsa mali miyabe et yamada.)、大斑突脐孢菌(exserohilum turcicum)、灰葡萄孢菌(botrytis cinerea pers. fr.)和玉蜀黍赤霉(gibperella zeae (schw.) petch.)中的一种或多种;和/或所述蜜蜂病原真菌为蜜蜂球囊菌(ascosphaera apis)。
11.所述植物病原细菌为水稻白叶枯菌(xanthomonas oryzae pv. oryzae)、棉角斑病黄单胞菌(xanthomonas campestris pv. malvacearum (smith) dye)、青枯假单胞杆菌(pseudomonas solanacearum)中的一种或多种;所述蜜蜂病原细菌为幼虫芽孢杆菌(paenibacillus larvae);和/或所述条件致病菌为藤黄微球菌(micrococcus luteus)。
12.本发明的贝莱斯芽孢杆菌fb17 cgmcc no. 20022对病原真菌展现了较强的抑菌活性,对真菌的抑菌谱较广,能够抑制所有检测的真菌,并且对病原细菌展现了较强的抑菌活性。
附图说明
13.图1示出了菌株fb8、fb17及fb23的菌落形态;图2示出了菌株fb8、fb17及fb23的淀粉水解试验的结果;图3示出了菌株fb8、fb17及fb23的油脂水解试验的结果;图4示出了菌株fb8、fb17及fb23的明胶水解试验的结果;图5示出了菌株fb8、fb17及fb23的酪蛋白水解检测的结果;图6示出了菌株fb8、fb17及fb23的d
‑
葡萄糖发酵实验的结果;图7示出了菌株fb8、fb17及fb23的d
‑
果糖发酵实验的结果;图8示出了菌株fb8、fb17及fb23的蔗糖发酵实验的结果;图9示出了菌株fb8、fb17及fb23的d
‑
甘露醇发酵实验的结果;图10示出了菌株fb8、fb17及fb23的硫化氢试验的结果;图11示出了菌株fb8、fb17及fb23的吲哚试验的结果;图12示出了菌株fb8、fb17及fb23的甲基红试验的结果;图13示出了菌株fb8、fb17及fb23的v
‑
p试验的结果;图14示出了菌株fb8、fb17及fb23的革兰氏染色的结果;图15示出了菌株fb8、fb17及fb23的芽孢染色的结果;图16示出了16s rdna的pcr扩增产物的琼脂糖凝胶电泳结果;
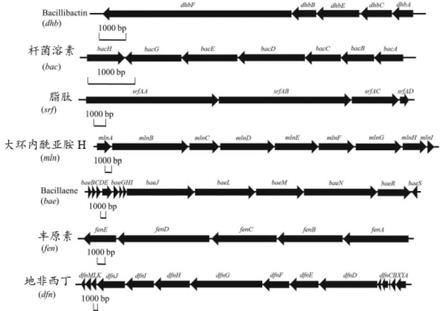
图17示出了gyrb基因的pcr扩增产物的琼脂糖凝胶电泳结果;图18示出了贝莱斯芽孢杆菌fb17 cgmcc no. 20022合成的7种抗菌肽基因簇示意图。
具体实施方式
14.下述实施例中的方法,如无特别说明,均为常规方法。
15.下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
实施例
16.一、菌株fb8、fb17及fb23的分离及鉴定(一)菌株的分离菌株fb8和fb23分离自陕西省榆林市的枣花蜜样品,样品采集后常温储存。取50 ml枣花蜜,水浴45℃加热30 min增加蜂蜜的流动性。取10 ml枣花蜜与10 ml无菌生理盐水(已预热)混合均匀。将稀释后的枣花蜜再次10倍梯度稀释至10
‑2倍,分别取稀释2倍、20倍及200倍的样品100 μl涂布lb培养基平板,每个稀释度重复3次。将平板置于37℃培养24
‑
48 h。挑取不同形态的单菌落在lb培养基平板划线纯化,获得细菌的纯培养物,并对不同的菌株进行编号,然后在20%的甘油中于
‑
80℃保存。
17.菌株fb17分离自湖北省孝感市的蜜蜂样品,样品采集后储存于4℃冰箱。取2
‑
3只蜜蜂置于无菌1.5 ml离心管中,加入600 μl无菌生理盐水,用研磨棒磨碎至匀浆,然后漩涡混匀。稍静置,吸取浑浊液,利用无菌生理盐水10倍梯度稀释至10
‑5。分别取10
‑1至10
‑5稀释度的样品100 μl涂布lb培养基平板,每个稀释度重复3次。将平板置于37℃培养24
‑
48 h。挑取不同形态的单菌落在lb培养基平板划线纯化,获得细菌的纯培养物,并对不同的菌株进行编号,然后在20%的甘油中于
‑
80℃保存。
18.表1 样品采集信息3株菌株的菌落形态如图1所示,菌株fb8在lb固体培养基上37℃培养48 h后,菌落不规则,边缘缺刻且毛发状生长,乳白色,不透明,质地较致密但边缘疏松。菌株fb17在lb固体培养基上37℃培养48 h后,菌落圆形略规则,边缘缺刻,中间有环状凸起,环内有褶皱,乳白色,不透明,菌落内部呈黏液状,菌落表面质地较致密。菌株fb23在lb固体培养基上37℃培养48 h后,菌落圆形较规则,边缘整齐,菌落有不规则褶皱,菌落淡黄色,不透明,质地较致密。
19.(二)菌株的鉴定
1. 菌株的生理生化鉴定1.1 淀粉水解试验:将芽孢杆菌的新鲜固体培养物划线接种于淀粉培养基中,37℃恒温倒置培养48 h,形成明显的菌落后,在平板上滴加碘液,平板呈蓝黑色,菌落周围如有透明圈,表示淀粉水解阳性;菌落周围仍是蓝黑色,则淀粉水解为阴性。
20.淀粉培养基(lb培养基 1.0%可溶性淀粉)(100 ml):胰蛋白胨1.0 g、酵母提取物0.5 g、nacl 1.0 g、可溶性淀粉1.0 g、琼脂1.5 g、蒸馏水100 ml。水浴溶化后,121℃高压灭菌20 min,倒平板备用。
21.3株菌株分别在淀粉培养基上培养48 h后,在菌落周围滴加碘液,进行观察。结果如图2所示,菌株fb8及fb17周围均形成透明圈,而菌株fb23周围没有形成透明圈,说明菌株fb8及fb17可以分泌淀粉酶水解淀粉,而菌株fb23不能分泌淀粉酶水解淀粉,因此菌株fb8、fb17淀粉水解阳性,而菌株fb23淀粉水解阴性。
22.1.2 油脂水解试验:将融化的固体油脂培养基冷却至50℃左右,充分摇荡,使油脂均匀分布,倒平板。将芽孢杆菌划线接种油脂培养基。37℃恒温倒置培养24 h。观察菌苔颜色。如出现红色斑点,说明脂肪水解,为阳性反应。
23.脂肪培养基(100 ml):蛋白胨1.0 g、牛肉膏0.5 g、nacl 0.5 g、花生油或香油1.0 g、1.6%中性红水溶液0.1 ml、琼脂1.5 g、蒸馏水100 ml,ph7.2,121℃高压灭菌20 min,倒平板备用。
24.1.6%中性红水溶液:中性红1.6 g、95%乙醇28 ml、蒸馏水72 ml。
25.结果如图3所示,菌株fb23菌落出现红色斑点,脂肪酸被水解,说明其能产生脂肪酶,脂肪酶水解阳性。菌株fb8及fb17的菌落周围无红色斑点出现,说明它们不能产生脂肪酶,脂肪酶水解阴性。
26.1.3 明胶水解试验:取明胶培养基试管,用接种针分别穿刺接种芽孢杆菌。将接种后的试管置于20℃培养2
‑
5天。观察明胶液化情况。
27.明胶培养基(100 ml):lb培养基、明胶12
‑
18 g,ph 7.2
‑
7.4。水浴锅中将上述成分溶化后调节ph7.2
‑
7.4,分装试管,121℃高压灭菌20 min。
28.在明胶培养基上穿刺接种3株芽孢杆菌后,20℃培养3
‑
4天时进行观察。结果如图4所示,观察到明胶培养基均发生了液化,因此菌株fb8、fb17及fb23可产生明胶酶水解明胶,以上结果表明菌株fb8、fb17及fb23明胶水解试验阳性。
29.1.4 酪蛋白水解检测(石蕊牛奶试验):将芽孢杆菌接种牛奶石蕊培养基试管中,37℃培养24
‑
48 h,牛奶变清者为阳性。
30.牛奶石蕊培养基:脱脂牛奶100 ml、2.5%石蕊水溶液(过夜后过滤使用)4 ml,混合后的颜色为丁香或紫色,分装试管,牛奶高度4 cm,121℃高压灭菌15 min。
31.分别将菌株fb8、fb17及fb23接种牛奶石蕊培养基,空白对照是未接种菌株的牛奶石蕊培养基,在37℃培养48 h。结果如图5所示,接种fb17、fb23的培养基牛奶变清,而接种fb8的培养基与对照相比没有明显变化(牛奶未变清)。以上结果表明菌株fb8酪蛋白水解实验为阴性,不能水解酪蛋白,而菌株fb17、fb23酪蛋白水解实验为阳性,能够水解酪蛋白。
32.1.5 糖醇发酵实验将培养18 h的芽孢杆菌接种于糖发酵培养基中,并设置阴性对照,37℃培养24
‑
48 h,检查结果。观察各试管颜色的变化及杜氏小管中有无气泡产生。指示剂由紫色变黄表示糖类发酵产酸,为阳性。
33.糖发酵培养基(100 ml):1 g胰蛋白胨、0.5 g nacl、1.6%溴甲酚紫乙醇液0.05 ml,ph 7.6,定容至100 ml,分装试管(10 ml/管),每管无菌添加0.5 ml的20%的糖溶液,每管放入一杜氏小管,使充满培养液,121℃高压灭菌20 min。
34.20%糖溶液(d
‑
葡萄糖、d
‑
果糖、蔗糖、d
‑
甘露醇)经过113℃高压灭菌30 min。
35.d
‑
葡萄糖发酵实验结果如图6所示,接种菌株fb8、fb17及fb23的葡萄糖发酵培养基颜色均由紫色变为黄色,杜氏管中无气泡产生,说明菌株fb8、fb17及fb23均能分解d
‑
葡萄糖,产酸不产气。d
‑
果糖发酵实验结果如图7所示,接种菌株fb8、fb17及fb23的果糖发酵培养基颜色均由紫色变为黄色,杜氏管中无气泡产生,说明菌株fb8、fb17及fb23均能分解d
‑
果糖,产酸不产气。蔗糖发酵实验结果如图8所示,接种菌株fb8、fb17及fb23的蔗糖发酵培养基颜色均由紫色变为黄色,杜氏管中无气泡产生,说明菌株fb8、fb17及fb23均能分解果糖,产酸不产气。d
‑
甘露醇发酵实验结果如图9所示,接种菌株fb8的d
‑
甘露醇发酵培养基颜色由紫色变为黄色,杜氏管中无气泡产生,而接种菌株fb17及fb23的d
‑
甘露醇发酵培养基颜色未变化,仍为紫色,且杜氏管中无气泡产生,说明菌株fb8能分解d
‑
甘露醇,产酸不产气,而菌株fb17及fb23不能分解d
‑
甘露醇,不产酸不产气。
36.1.6 硫化氢试验:用接种针将芽孢杆菌穿刺接入醋酸铅培养基,置37℃培养48 h,培养基呈黑色为阳性,阴性继续培养至6天。
37.醋酸铅培养基(100 ml):牛肉膏0.3 g、蛋白胨1.0 g、nacl 0.5 g、琼脂1.5 g,定容至100 ml加热溶解,冷却至60℃时加入硫代硫酸钠0.25 g,ph7.2,分装于三角烧瓶中,115℃灭菌15 min;取出后冷却至55
‑
60℃,加入10%醋酸铅水溶液(无菌)1 ml,混匀后倒入无菌试管。
38.结果如图10所示,在醋酸铅培养基上分别穿刺接种菌株fb8、fb17及fb23,37℃培养48 h后,3支试管均没有变黑,继续培养至第5天时,菌株fb8在穿刺线附近没有变黑,而菌株fb17及fb23在穿刺线附近变黑,说明菌株fb8不产硫化氢,硫化氢试验阴性,而菌株fb17及fb23可以产生硫化氢,硫化氢试验阳性。
39.1.7 吲哚试验:将芽孢杆菌接入吲哚培养基,置37℃培养48 h。沿管壁缓慢加入2滴的吲哚试剂于表面,液层界面产生红色者,为阳性反应,若不明显,先加4~5滴乙醚到培养液中,静置1 min,待乙醚上升后,再加吲哚试剂,观察颜色反应。在乙醚和培养物之间产生红色环状物为阳性反应。
40.吲哚培养基(100 ml):胰酪蛋白胨 1.0 g、nacl 0.5 g和l
‑
色氨酸 0.05 g,ph 7.6,121℃高压灭菌15分钟备用。吲哚试剂:对二甲氨基苯甲醛2 g、95%乙醇190 ml和浓hcl 40 ml。
41.将菌株fb8、fb17及fb23接种吲哚培养基后37℃培养48 h,沿管壁缓慢加入2 滴吲哚试剂。结果如图11所示,3株菌的液层界面均未产生红色,说明3株菌的吲哚反应为阴性。
42.1.8. 甲基红试验:挑取芽孢杆菌接种于葡萄糖蛋白胨水培养基,37℃培养,从第二天起,每日取培养液1ml,加甲基红指示剂1~2滴,阳性呈鲜红色,弱阳性呈淡红色,阴性为黄色。发现阳性或至第5天仍为阴性、即可判定结果。
43.葡萄糖蛋白胨水培养基(100 ml):0.5 g蛋白胨、0.5 g葡萄糖、0.2 g k2hpo4,将上述成分溶于100 ml水中,调整ph值7.0
‑
7.2,分装试管10 ml,113℃灭菌30 min。甲基红试剂:0.04 g甲基红、60 ml 95%乙醇、40 ml蒸馏水。先溶于乙醇,再加蒸馏水。
44.将菌株fb8、fb17及fb23分别接种葡萄糖蛋白胨水培养基,37℃培养。结果如图12所示,菌株fb8及fb23在培养24 h后,取培养液1 ml,加甲基红指示剂1~2滴,菌液呈鲜红色,菌株fb17在培养后直至第5天取样,加入甲基红指示剂,菌液颜色与空白对照(未接种的培养基)相同,为黄色。以上结果说明fb8及fb23甲基红反应为阳性,而菌株fb17甲基红反应为阴性。
45.1.9 v
‑
p试验将芽孢杆菌接种葡萄糖蛋白胨水培养基(v
‑
p测定培养基),37℃培养48 h,向试管中加入1 ml 40% naoh和1 ml 5% α
‑
萘酚,用力震荡,再放入37℃保温15
‑
30 min,以加快反应速度,若培养物呈红色,则为v
‑
p反应阳性。
46.v
‑
p测定培养基(100 ml):0.5 g蛋白胨、0.5 g葡萄糖、0.2 g nacl,将上述成分溶于100 ml水中,调整ph值7.0
‑
7.2,分装试管4
‑
5 ml,113℃灭菌30 min。5% α
‑
萘酚:5 g α
‑
萘酚,100 ml无水乙醇。
47.将菌株fb8、fb17及fb23分别接种葡萄糖蛋白胨水培养基,37℃培养48 h后,分别加入1 ml 40% naoh和1 ml 5% α
‑
萘酚。结果如图13所示,3株菌株的发酵液均变为红色,而没有接种菌种的空白培养基颜色无变化,说明3株菌株的v
‑
p反应均为阳性。
48.1.10过氧化氢酶的测定从lb斜面上挑取少量芽孢杆菌培养物,涂在干净的载玻片上,滴加10%的过氧化氢,有气泡产生者为阳性。
49.从菌株fb8、fb17及fb23划线纯化的平板上分别挑取少量培养物,涂在干净的载玻片上,滴加10%的过氧化氢。3株菌均有气泡产生,因此fb8、fb17及fb23过氧化氢酶反应(接触酶反应)均为阳性。
50.2. 革兰氏染色(革兰氏染色试剂盒)革兰氏染色利用索莱宝革兰氏染色试剂盒(货号g1060),具体操作步骤如下:(1)挑取平板上培养的菌株fb8、fb17及fb23接种lb试管,37℃震荡培养24 h。(2)涂片固定:吸取10 μl菌液于载玻片上,固定时通过火焰1
‑
2次即可,不可以过热。(3)染色:加上结晶紫后,染色1 min,水洗。加上碘液后染色1 min,水洗。加上脱色液,摇动玻片,根据涂片厚度,脱色约20
‑
60 s,水洗,吸取水分。加上番红后,染色1 min,水洗。吸干或在空气中晾干后,油镜镜检。革兰氏阴性菌呈红色,革兰氏阳性菌呈紫色。
51.革兰氏染色结果如图14所示,菌株fb8的菌体为长杆状,而菌株fb17及fb23的菌体均为短杆状,两端钝圆。此外3株菌经革兰氏染色后,细胞为紫色,说明3株菌均为革兰氏阳性菌。
52.3. 芽孢染色(芽孢染色试剂盒)
芽孢染色利用源叶生物技术有限公司的芽孢染色试剂盒(货号r23109),采用scharffer
‑
fulton法,即孔雀绿染色法,具体操作步骤如下:(1)挑取平板上培养的菌株fb8、fb17及fb23接种lb试管,37℃震荡培养48 h;(2)吸取10 μl菌液于洁净无油脂的载玻片上,制成涂片,自然干燥;(3)在涂液处滴加孔雀绿染色液,使细菌分布均匀;(4)弱火间断加热染色10 min;(5)用水轻轻冲洗;(6)用芽孢复染液染色1 min,用水冲洗;(7)镜检:干燥后油镜镜检,芽孢染色为绿色,菌体染色为红色。
53.芽孢染色结果如图15所示,3株芽孢杆菌fb8、fb17及fb23细胞中芽孢经染色为绿色,说明3株芽孢杆菌都能产生芽孢,其中菌株fb8的芽孢为中生且膨大,菌株fb17的芽孢为端生,菌株fb23的芽孢为近端生且膨大。
54.4. 运动性用接种针穿刺接种,将芽孢杆菌接种到lb培养基上,37℃培养48 h,接种后每24 h目测观察生长情况。若生长物由穿刺线向四周呈云雾状扩散,则表示试验菌株有运动性,为阳性。
55.lb培养基(100 ml):胰蛋白胨1.0 g、酵母提取物0.5 g、nacl 1.0 g、琼脂1.5 g、蒸馏水100 ml,ph=7.2,分装试管,121℃高压灭菌20 min。
56.将3株芽孢杆菌穿刺接种lb培养基培养48 h后,三株菌株均沿穿刺线向四周生长,3株菌株均具有运动性。其中菌株fb8呈显著的云雾状生长,运动性最强,菌株fb23的运动性次之,菌株fb17的运动性较弱。
57.综上,3株菌株的基本生物学特征如下表2:表2. 3株菌株的基本生物学特征
5. 菌株的分子鉴定5.1 基因组dna的提取从划线活化的lb平板上挑取单菌落接种新鲜lb液体培养基,37℃,200 rpm震荡培养,至菌液od
600
生长至0.8
‑
1.0时取5 ml菌液,离心收集菌体。利用细菌基因组dna提取试剂盒(cw0552s,康为世纪,中国)提取基因组dna。
58.5.2 16s rdna的pcr扩增以基因组dna为模板,设计并合成引物(博迈德生物科技有限公司,中国),扩增16s rdna:27f:5'
‑
agagtttgatcctggctcag
‑
3' (序列表中的序列3)1492r:5'
‑
ggttaccttgttacgactt
‑
3' (序列表中的序列4)然后利用q5高保真聚合酶(bdtp1180, neb,美国)扩增16s rdna片段,扩增到的片段经1%的琼脂糖凝胶电泳检测为单一条带后(片段长度约为1500 bp,结果如图16所示),送测序公司测序(博迈德生物科技有限公司,中国)。测序获得16s rdna片段序列后,将序列在genbank中进行blast(http://www.ncbi.nlm.nih.gov)比对分析,得出与3株菌株相近的已鉴定的菌株名称,鉴定菌种。pcr体系:基因组dna 50
‑
100 ng,27f0.5 mm,1492r 0.5 mm,2
×
q5 mix25 μl, h2o补充至50 μl。dna扩增程序:先98℃ 30秒,然后98℃ 10秒,50℃ 15秒,72℃ 45秒,30个循环,最后,72℃ 10分钟。
59.5.3 gyrb基因的pcr扩增以基因组dna为模板,设计简并引物并合成引物(博迈德生物科技有限公司,中
国),扩增gyrb基因(dna gyrase subunit b gene, partial sequence,长度约为1200 bp),划线部分为测序引物分别是up
‑
1s及up
‑
2sr:gyrb
‑
f:(序列表中的序列5)5'
‑
gaagtcatcatgaccgttctgcaygcnggnggnaarttyga
‑
3'gyrb
‑
r:(序列表中的序列6)5'
‑
agcacggtacggatgtgcgagccrtcnacrtcngcrtcngcrtcngtcat
‑
3'然后利用q5高保真聚合酶(bdtp1180,neb,美国)扩增gyrb基因片段,扩增到的片段经1%的琼脂糖凝胶电泳检测为单一条带后(片段长度约为1200 bp,结果如图17所示),利用测序引物up
‑
1s及up
‑
2sr送测序公司测序(博迈德生物科技有限公司,中国)。pcr体系:基因组dna 50
‑
100 ng,gyrb
‑
f 0.5 mm,gyrb
‑
r 0.5 mm,2
×
q5 mix 25 μl,h2o补足至50 μl。dna扩增程序:先98℃ 30秒,然后98℃ 10秒,55℃ 15秒,72℃ 36秒,30个循环,最后,72℃ 10分钟。
60.5.4 16s rdna与gyrb基因序列分析将3株菌株(fb17、fb8、fb23)的16s rdna和gyrb基因测序后所得序列在ncbi的数据库中进行blast比对,比对结果见下表。
61.由表3可知,菌株fb17的16s rdna序列(序列表中的序列1)与解淀粉芽孢杆菌(b. amyloliquefaciens)、贝莱斯芽孢杆菌(b. velezensis)、暹罗芽孢杆菌(b. siamensis)的序列相似性最高,均为100%,菌株fb17的gyrb基因序列(序列表中的序列2)与贝莱斯芽孢杆菌(bacillus velezensis)的序列相似性最高,为99.51%,确定fb17菌株为贝莱斯芽孢杆菌(bacillus velezensis)。
62.表3. 3株芽孢杆菌属细菌分子鉴定贝莱斯芽孢杆菌(bacillus velezensis)fb17,分类命名为贝莱斯芽孢杆菌bacillus velezensis,,已于2020年06月04日保存于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no. 20022。
63.地衣芽孢杆菌(bacillus licheniformis)fb8,分类命名为地衣芽孢杆菌bacillus licheniformis,已于2020年06月04日保存于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no. 20021。
64.短小芽孢杆菌(bacillus pumilus)fb23,分类命名为短小芽孢杆菌bacillus pumilus已于2020年06月04日保存于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no. 20023。
65.二、测定地衣芽孢杆菌菌株fb8、贝莱斯芽孢杆菌fb17 cgmcc no. 20022及短小芽
孢杆菌fb23的抑菌活性利用双培养法体外检测芽孢杆菌对病原真菌抑菌活性,利用挖孔扩散法体外检测芽孢杆菌对病原细菌的抑菌活性,以17种植物病原真菌、4种植物病原细菌、1种蜜蜂病原真菌、1种蜜蜂病原细菌及1株条件致病菌(24种病原菌见下表4,由中国农业科学院植物保护研究所植物病虫害实验室及蜜蜂研究所蜜蜂病虫害学实验室提供,以上菌株按照本领域已知的常规方法从自然界分离并鉴定)为靶标菌,分别测定fb8、fb17及fb23菌株的抑菌活性。
66.表4. 24种植物(或蜜蜂)病原真菌及细菌1.病原菌活化真菌活化:将4℃保存的病原真菌菌种,用灭菌接种环挑取菌丝到新的pda培养基
平板中,28℃恒温培养箱中培养4
‑
5天,备用。
67.细菌活化:取出细菌菌种,用灭菌接种环划线接种到新鲜的lb固体培养基中,放入37℃恒温培养箱中培养24
‑
48 h,备用。液体培养时,挑取单菌落于3 ml液体lb培养基中,37℃、200 r/min,振荡培养12 h。
68.2. 双培养法测定拮抗细菌对病原真菌的抑菌作用将活化好的病原真菌用灭菌打孔器打取6 mm直径的菌块,在其四周等距离处接入细菌(距离约3 cm),以不接任何细菌的培养为对照(ck),每个处理重复3次,28℃恒温培养5
‑
7天后,开始测量抑菌带宽度(拮抗菌距离病原真菌边缘的距离)。
69.3. 挖孔扩散法测定拮抗细菌对病原细菌的抑菌作用制备病原细菌菌液,当细菌生长至对数期的时候,取100 μl菌液涂布lb固体培养基,在培养基四周均匀地打孔(孔直径6 mm),然后在孔中加入50 μl过滤除菌的拮抗细菌菌液(fb8、fb17 cgmcc no.20022、fb23),每个培养皿重复3次,37℃培养,1
‑
2天后测量抑菌圈直径。
70.4. 结果与分析4.1菌株fb8、fb17 cgmcc no.20022、fb23对植物病原真菌的抑菌活性测定的结果如表5所示。
71.表5.对植物(或蜜蜂)病原真菌的抑菌活性的测定结果注:弱* 指有抑菌圈存在,真菌菌丝生长塌陷,存在继续生长情况。
72.通过双培养法,分别测得菌株fb8、fb17 cgmcc no.20022、fb23对18种病原真菌的抑菌活性,测定结果如表5所示。由实验结果可知,菌株fb8、fb17 cgmcc no.20022、fb23具
no. 20022基因组中所包含的抗菌肽合成基因簇的种类如下表8所示。
79.表8. 贝莱斯芽孢杆菌fb17 cgmcc no. 20022芽孢杆菌基因组中抗菌肽合成基因簇以上结果表明,3株芽孢杆菌都具有合成多种抗菌肽的潜力,其中贝莱斯芽孢杆菌fb17含有7种抗菌肽合成基因簇,这也是其抑菌谱宽且具有较强抑菌活性的决定因素之一。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。