1.本发明属于生物材料领域,涉及一种生物粘附性水凝胶及其应用。
背景技术:
2.生物水凝胶是由各类生物亲和性大分子经修饰改性并具有成胶能力的材料,其可用于液体状态下涂覆在伤口或出血部位后引发固化成胶从而进行原位止血或原位伤口封闭,也可以用于与3d打印技术结合从而打印各种生物组织及生物组织支架,还可以在固化的同时包裹药物得到含药物凝胶制品,即,可以作为药物载体应用。
3.当应用于原位止血、原位伤口封闭或生物打印时,由于需要在短时间内固化,生物水凝胶的固化成胶性能至关重要。现有技术中存在多种经光照即可成胶的生物水凝胶材料,例如,cn105131315a公开了一种非自由基光化学交联水凝胶材料,该材料包括含有邻硝基苄基类光扳机修饰的高分子衍生物的组分a以及含有酰肼、羟胺或伯胺类高分子衍生物的组分b,使用时将组分a、组分b混合并光照30s~1min即可形成凝胶,实现创面修复或创面组织隔离。又如,cn108187130a公开了一种用于生物损伤修复或止血的试剂,该试剂包括光引发剂以及由邻硝基苄基类光扳机等光响应交联基团进行修饰的天然生物大分子,使用时光照数秒即可固化从而实现快速止血。
4.上述生物胶类材料均利用了邻硝基苄基类光扳机修饰后的基团能够用于进行交联的特性。然而,邻硝基苄基光扳机类化合物整体价格较高,相应地,其修饰生物大分子的成本也较高,难以推广应用。不仅如此,现有技术中用于进行修饰的邻硝基苄基光扳机类化合物多数未经生物安全性方面的验证,若在生物体内降解产生毒性小分子则将带来极高的使用风险,这一点也影响了其在生物体,尤其是人体体内的应用。
技术实现要素:
5.本发明的目的在于解决上述问题,提供一种固化速度快、湿面组织粘附力高、成本低且没有安全疑虑的生物胶材料。本发明的发明人研究发现,若采用邻二氢吡啶硝基苯衍生物或吡啶甲基硝基烯咪唑类衍生物对一些常见生物大分子进行修饰,在光照时,这些修饰基团就能够产生亚硝基,而亚硝基能够与糖环羟甲基、双键、巯基在光引发剂自由基的作用下发生化学键合,从而使得生物大分子发生交联。也就是说,在光照以及光引发剂条件下,邻二氢吡啶硝基苯衍生物或吡啶甲基硝基烯咪唑类衍生物的修饰基团能够与糖环羟甲基、双键或巯基发生键合而让生物大分子交联,从而固化成胶。
6.基于上述发现,本发明提供了一种生物粘附性水凝胶,其特征在于,包括:交联性生物大分子以及光引发剂,其中,交联性生物大分子含有第一交联基团以及第二交联基团,第一交联基团在光照条件下产生亚硝基,该亚硝基在光引发剂存在条件下与第二交联基团发生化学键合从而成胶,第一交联基团为邻二氢吡啶硝基苯衍生物或吡啶甲基硝基烯咪唑类衍生物,第二交联基团为糖环羟甲基、双键、巯基中的任意一种或任意几种的组合,邻二氢吡啶硝基苯衍生物的结构如下式i所示:
[0007][0008]
式i中:
[0009]
r1,r2,r3,r4,r5,r6,r7,r8中任意的一个或多个选自末端胺基、羟基、巯基、卤素、羧基、羧酸盐基或活性酯基改性的芳基、杂芳基、烷基、亚烷基、改性烷基或改性亚烷基,其余地可自由地选自氢、卤原子、羟基、巯基、胺基、硝基、氰基、醛基、酮基、羧基、羧酸盐基、酯基、酰胺基、膦酸基、膦酸酯基、磺酸基、磺酸酯基、砜基、亚砜基、芳基、杂芳基、烷基、亚烷基、改性烷基或改性亚烷基;
[0010]
吡啶甲基硝基烯咪唑类衍生物的结构如下式ii所示:
[0011][0012]
式ii中,r9,r
10
,r
11
,r
12
,r
13
,r
14
中任意的一个或多个选自末端胺基、羟基、巯基、卤素、羧基、羧酸盐基或活性酯基改性的芳基、杂芳基、烷基、亚烷基、改性烷基或改性亚烷基,其余地可自由地选自氢、卤原子、羟基、巯基、胺基、硝基、氰基、醛基、酮基、羧基、羧酸盐基、酯基、酰胺基、膦酸基、膦酸酯基、磺酸基、磺酸酯基、砜基、亚砜基、芳基、杂芳基、烷基、亚烷基、改性烷基或改性亚烷基。
[0013]
上述基团中:
[0014]
烷基为具有1~30个碳原子的饱和或不饱和脂肪族直链或支链的烷基;
[0015]
亚烷基为具有1~30个碳原子的饱和或不饱和脂肪族直链或支链的亚烷基;
[0016]
改性烷基为烷基的任意碳原子被选自卤原子、-oh、-sh、-no2、-cn、-cho、-cooh、酯基、酰胺基、芳基、亚芳基、-co-、-o-、-s-、-so-、-so
2-、伯胺基、仲胺基、叔胺基、季铵盐基、饱和或不饱和的单环或双环亚环烃基、桥联脂杂环中的至少一种基团置换所得的基团,改性烷基具有1~30个原子,其碳碳单键可任意地被碳碳双键或碳碳叁键替换;
[0017]
改性亚烷基为亚烷基的任意碳原子被选自卤原子、-oh、-sh、-no2、-cn、-cho、-cooh、酯基、酰胺基、芳基、亚芳基、-co-、-o-、-s-、-so-、-so
2-、伯胺基、仲胺基、叔胺基、季铵盐基、饱和或不饱和的单环或双环亚环烃基、桥联脂杂环中的至少一种基团置换所得的基团,改性亚烷基具有1~30个原子,其碳碳单键可任意地被碳碳双键或碳碳叁键替换;
[0018]
醚键类取代基选自以下结构:
[0019]-(ch2)
x
ch3、-(ch2ch2o)
x
ch3、-(ch2)
x
(ch2ch2o)
y
ch3、或其中x和y≥0且为整数;
[0020]
酯键类取代基选自以下结构:
[0021]-co(ch2)
x
ch3、-co(ch2ch2o)
x
ch3、-co(ch2)
x
(ch2ch2o)
y
ch3,其中x和y≥0且为整数;
[0022]
碳酸酯键类取代基选自以下结构:
[0023]-coo(ch2)
x
ch3、-coo(ch2ch2o)xch3、-coo(ch2)
x
(ch2ch2o)
y
ch3,其中x和y≥0且为整数;
[0024]
胺基甲酸酯键类取代基选自以下结构:
[0025]-conh(ch2)
x
ch3、-conh(ch2ch2o)
x
ch3、-conh(ch2)
x
(ch2ch2o)
y
ch3,其中x和y≥0且为整数;
[0026]
巯基甲酸酯键类取代基选自以下结构:
[0027]-cos(ch2)
x
ch3、-cos((ch2ch2o)
x
ch3、-cos(ch2)
x
(ch2ch2o)
y
ch3,其中x和y≥0且为整数;
[0028]
磷酸酯键类取代基选自以下结构:-pooo(ch2)
x
ch3、-pooo(ch2ch2o)
x
ch3、-pooo(ch2)
x
(ch2ch2o)
y
ch3,其中x和y≥0且为整数;
[0029]
芳基为5~10元芳香单环或芳香稠合双环结构;
[0030]
杂芳基为环上含有选自o、s、n或si中的至少一种杂原子的5~10元芳香单环或芳香稠合双环结构;
[0031]
卤原子各自独立地选自f、cl、br、i;
[0032]
脂环为饱和或不饱和的3~10元单环或多环脂环;
[0033]
脂杂环为环上含有选自o、s、n或si中的至少一种杂原子的饱和或不饱和的3-10元单环或多环脂杂环,脂杂环上含有s原子时,其任选为-s-、-so-或-so2-;
[0034]
脂环或脂杂环上的h还可任意地被卤原子、硝基、芳基、烷基或改性烷基取代;
[0035]
芳环为5~10元芳香单环或芳香稠合双环;
[0036]
芳杂环为环上含有选自o、s、n或si中的至少一种杂原子的5~10元芳香单环或芳香稠合双环;
[0037]
芳环或芳杂环上的h还可任意地被卤原子、硝基、芳基、烷基或改性烷基取代。
[0038]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,交联性生物大分子包括第一交联性生物大分子以及第二交联性生物大分子,其中,第一交联性生物大分子为含有第一交联基团的生物大分子,第二交联性生物大分子为含有第二交联基团的生物大分子。
[0039]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,交联性生物大分子为第三交联性生物大分子,第三交联性生物大分子为含有第一交联基团以及第二交联基团的生物大分子。进一步,该第三交联性生物大分子可以由第一交联基团对含有第二交联基团的生物大分子进行修饰而得到。
[0040]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,含有糖环羟甲基的生物大分子为透明质酸、羧甲基纤维素、甲基纤维素、羟乙基纤维素、羟丙基纤维素、葡聚糖、琼脂糖、肝素、壳聚糖、蔗糖、葡萄糖、淀粉中的任意一种或任意一种的衍生物,含有双键基团的生物大分子具体含有甲基丙烯酰胺、甲基丙烯酸酐、甲基马来酸酐中的任意一种或任意几种的组合,含有巯基的生物大分子为明胶、胶原或丝素蛋白。
[0041]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,r1,r2,r3,r4,r5,r6,r7,r8中的任意两个相互连接形成饱和或不饱和的脂环或脂杂环,或者,相互连接形成芳环或芳杂环。
[0042]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,邻二氢吡啶硝基苯衍生物的结构为如下结构式nf-1~nf-6中的任意一种:
[0043][0044]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,r
13
,r
14
相互连接形成饱和或不饱和的脂环或脂杂环,或者,相互连接形成芳环或芳杂环。
[0045]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,吡啶甲基硝基烯咪唑类衍生物的结构为如下结构式nf-7~nf-30中的任意一种:
[0046]
[0047][0048][0049]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,糖环羟甲基
的结构为式iv、式v、式vi、式vii中的任意一种所示:
[0050][0051]
式iv、式v、式vi、式vii中,r自由地选自氢、卤原子、羟基、巯基、胺基、硝基、氰基、醛基、酮基、羧基、羧酸盐基、酯基、酰胺基、膦酸基、膦酸酯基、磺酸基、磺酸酯基、砜基、亚砜基、芳基、杂芳基、烷基、亚烷基、改性烷基或改性亚烷基。
[0052]
本发明提供的生物粘附性水凝胶,还可以具有这样的技术特征,其中,光引发剂为:2-羟基-4
’-
(2-羟乙氧基)-2-甲基苯丙酮、苯基(2,4,6-三甲基苯甲酰基)磷酸锂、苯基(2,4,6-三甲基苯甲酰基)磷酸钠、苯基(2,4,6-三甲基苯甲酰基)磷酸镁中的任意一种或任意几种的组合物。
[0053]
作为另一种实施形态,本发明还提供了上述任一项的生物粘附性水凝胶在制备快速止血或组织修复制品中的应用,其中,第一交联基团在光照以及光引发剂存在条件下产生的亚硝基在与第二交联基团发生化学键合从而成胶的同时,还与生物组织表面的细胞外基质中的蛋白聚糖以及糖胺聚糖上的糖环羟甲基、巯基中的至少一种发生化学键合,使形成的胶体粘附在生物组织表面。
[0054]
作为另一种实施形态,本发明还提供了一种药物载体,其特征在于,含有上述任一项的生物粘附性水凝胶。
[0055]
作为另一种实施形态,本发明还提供了一种生物打印材料,其特征在于,含有上述任一项的生物粘附性水凝胶。
[0056]
发明作用与效果
[0057]
根据本发明提供的生物粘附性水凝胶,由于包括交联性生物大分子以及光引发剂,交联性生物大分子包括第一交联基团和第二交联基团,其中第一交联基团为邻二氢吡啶硝基苯衍生物或吡啶甲基硝基烯咪唑类衍生物,第二交联基团为糖环羟甲基、双键、巯基中的任意一种或任意几种的组合,因此,在光照条件下,第一交联基团可产生亚硝基,进而在光引发剂存在条件下与第二交联基团发生化学键合、固化成胶,其固化速度快、胶体强度好、湿面组织粘附力强,且具有良好的生物相容性和促进组织再生的作用,能够应用于快速止血、组织修复、载药、生物打印等。
[0058]
由于第一交联基团为邻二氢吡啶硝基苯衍生物或吡啶甲基硝基烯咪唑类衍生物,这些衍生物在医药行业已有药物应用的先例,因此安全风险低,能够应用于生物体内;此外,由于这些衍生物的应用已经较为成熟,其价格也相对低廉,使得本发明的生物粘附性水凝胶的制造成本更低。
附图说明
[0059]
图1是本发明各实施例的生物粘附性水凝胶溶液的固化照片;
[0060]
图2是本发明各实施例的湿面组织粘附力测试结果柱形图;
[0061]
图3是本发明实施例九的止血性能实验过程的照片;
[0062]
图4是本发明实施例十的组织再生性能实验过程示意图以及照片;
[0063]
图5是本发明实施例十一的载药性能实验照片;
[0064]
图6是本发明实施例十二的生物打印过程示意图以及打印结果照片。
具体实施方式
[0065]
以下结合附图来说明本发明的具体实施方式。下述各实施例中所采用的试剂为普通商业途径购得,未注明的实验操作及实验条件参考本领域的常规操作及常规条件。
[0066]
以下各实施例均采用苯基(2,4,6-三甲基苯甲酰基)磷酸锂作为光引发剂,但本发明中该苯基(2,4,6-三甲基苯甲酰基)磷酸锂还可以用其他同类光引发剂来代替,例如2-羟基-4
’-
(2-羟乙氧基)-2-甲基苯丙酮、苯基(2,4,6-三甲基苯甲酰基)磷酸锂、苯基(2,4,6-三甲基苯甲酰基)磷酸钠、苯基(2,4,6-三甲基苯甲酰基)磷酸镁。此外,引发剂还可以是这些光引发剂中的任意几种的组合。
[0067]
实施例中,第一交联性生物大分子为含有第一交联基团的生物大分子,第二交联性生物大分子为含有第二交联基团的生物大分子,第三交联性生物大分子为同时含有第一交联基团以及第二交联基团的生物大分子。通常情况下,一些常见生物大分子自身就含有第二交联基团,因此不需要额外修饰,可以直接作为第二交联性生物大分子使用;由于常见生物大分子通常不含有第一交联基团,因此第一交联性生物大分子需由第一交联基团对生物大分子修饰得到,第三交联性生物大分子需由第一交联基团对自身含有第二交联基团的生物大分子(相当于第二交联性生物大分子)进行修饰得到。
[0068]
另外,以下各实施例中描述了第一交联性生物大分子、第二交联性生物大分子配合使用的例子,以及第三交联性生物大分子单独使用(即不与另外两种配合使用)的例子。然而,在本发明中,第三交联性生物大分子还可以与第一交联性生物大分子、第二交联性生物大分子中的任意一种配合使用,或者与第一交联性生物大分子以及第二交联性生物大分子共同使用,其同样能够达到以下实施例所描述的效果。
[0069]
<实施例一>
[0070]
本实施例提供的生物粘附性水凝胶的主要成分包括第一交联性生物大分子、第二交联性生物大分子以及光引发剂。
[0071]
第一交联性生物大分子为由化合物nf-1修饰的硫酸软骨素(以下简写为csnf)。其中,硫酸软骨素(cs)不含有糖环羟甲基、巯基和双键;化合物nf-1是一种邻二氢吡啶硝基苯衍生物,结构式如下:
[0072][0073]
本实施例的csnf的制备过程为:将nf-1:硫酸软骨素:edc:nhs按照质量比为1:10:1:1溶解于水,调节ph至4.5~6.5,加热到35℃以上搅拌反应2小时,随后透析冻干,得到接枝率为20%的csnf。
[0074]
本实施例中,能够与csnf相配合的第二交联性生物大分子可以是包含巯基、糖环羟甲基、双键中的任意一种或几种的大分子化合物,包括:明胶(gelatin),其自身含有巯基;透明质酸(ha),其自身含有糖环羟甲基结构;含双键修饰的硫酸软骨素(csma)。此外,其他实施例所采用的几种第二交联性生物大分子也可以用于本实施例。
[0075]
将上述第一交联性生物大分子、第二交联性生物大分子和lap溶解于去离子水即可得到本实施例的生物粘附性水凝胶溶液。本实施例采用csnf制备了三种生物粘附性水凝胶,如下:
[0076]
(1)将csnf和lap按照质量比为1:0.02溶解到水中形成水溶液(记为csnf组),其中csnf质量浓度为3%,该csnf lap溶液中不含第二交联性生物大分子,用于作为对照;
[0077]
(2)将csnf与gelatin、lap按照质量比为1:0.5:0.02溶解于水形成水溶液(记为csnf gelatin组),其中csnf质量浓度为3%;
[0078]
(3)将csnf与ha、lap按照质量比为1:1:0.02溶解到水中形成水溶液(记为csnf ha组),其中csnf质量浓度为3%;
[0079]
(4)将csnf与csma、lap按照质量比为1:1:0.02溶解到水中形成水溶液(记为csnf csma组),其中csnf质量浓度为3%。
[0080]
<实施例二>
[0081]
本实施例提供的生物粘附性水凝胶的主要成分包括第一交联性生物大分子、第二交联性生物大分子以及光引发剂。
[0082]
第一交联性生物大分子为由化合物nf-7修饰的聚谷氨酸(以下简写为pganf)。其中,聚谷氨酸自身不含有糖环羟甲基、巯基和双键;化合物nf-7是一种吡啶甲基硝基烯咪唑类衍生物,结构式如下:
[0083][0084]
本实施例的pganf的制备过程为:将nf-7:聚谷氨酸:edc:nhs按照质量比为1:15:1:1溶解于水,调节ph为4.5~6.5,加热至35℃以上搅拌反应3小时,随后透析、冻干,得到接
枝率为10%的pganf。
[0085]
本实施例中,能够与pganf相配合的第二交联性生物大分子可以是包含巯基、糖环羟甲基、双键中的任意一种或几种的大分子化合物,其中的巯基、糖环羟甲基、双键可以是生物大分子中自带结构,也可以通过化学反应修饰至原本不带这些结构的生物大分子中。
[0086]
本实施例使用的第二交联性生物大分子包括:丝素(silk),其自身含有巯基;羧甲基纤维素(cmc),其自身含有糖环羟甲基;含有双键修饰的聚乙二醇(pegda)。此外,其他实施例所采用的几种第二交联性生物大分子也可以用于本实施例。
[0087]
将上述第一交联性生物大分子、第二交联性生物大分子和lap溶解于去离子水即可得到本实施例的生物粘附性水凝胶溶液。本实施例采用pganf制备了三种生物粘附性水凝胶,如下:
[0088]
(1)将pganf和lap按照质量比为1:0.02溶解于水形成水溶液(记为pganf组),其中pganf质量浓度为10%。该pganf lap溶液中不含第二交联性生物大分子,用于作为对照。
[0089]
(2)将pganf与silk、lap按照质量比为1:1:0.02溶解于水形成水溶液(记为pganf silk组),其中pganf质量浓度为10%。
[0090]
(3)将pganf与cmc、lap按照质量比为1:0.1:0.02溶解于水形成水溶液(记为pganf cmc组),其中pganf质量浓度为5%。
[0091]
(4)将pganf与pegda、lap按照质量比为1:0.5:0.02溶解到水中形成水溶液(记为pganf pegda组),其中pganf质量浓度为5%。
[0092]
<实施例三>
[0093]
本实施例提供的生物粘附性水凝胶的主要成分包括第一交联性生物大分子、第二交联性生物大分子以及光引发剂。
[0094]
第一交联性生物大分子为由化合物nf-2修饰的四臂聚乙二醇(以下简写为4pnf)。其中,四臂聚乙二醇自身不含有糖环羟甲基、巯基和双键,且其结构中具有氨基封端;化合物nf-2是一种邻二氢吡啶硝基苯衍生物,结构式如下:
[0095][0096]
本实施例的pganf的制备过程为:将nf-2:氨基封端的四臂聚乙二醇:edc:nhs按照质量比为1:15:1:1溶解于水,调节ph为4.5~6.5,加热到35℃以上搅拌反应3小时,随后透析、冻干,得到接枝率为100%的4pnf。
[0097]
本实施例中,能够与pganf相配合的第二交联性生物大分子可以是包含巯基、糖环羟甲基、双键中的任意一种或几种的大分子化合物,例如,含有双键修饰的聚赖氨酸(pls)、含有巯基的聚半胱氨酸(pcys),或其他实施例所述的第二交联性生物大分子。
[0098]
将上述第一交联性生物大分子、第二交联性生物大分子和lap溶解于去离子水即可得到本实施例的生物粘附性水凝胶溶液。本实施例采用pganf制备了三种生物粘附性水
凝胶,如下:
[0099]
(1)将4pnf和lap按照质量比为1:0.02溶解到水中形成水溶液(记为4pnf组),其中4pnf质量浓度为30%。该4pnf lap不含有第二交联性生物大分子,用于作为对照。
[0100]
(2)将4pnf与cs、lap按照质量比为1:0.02溶解到水中形成水溶液(记为4pnf cs组),其中4pnf质量浓度为30%。cs中不含有巯基、糖环羟甲基或双键,用于作为对照。
[0101]
(3)将4pnf与ha、lap按照质量比为1:0.1:0.02溶解到水中形成水溶液(记为4pnf ha组),其中4pnf质量浓度为20%。
[0102]
(4)将4pnf与pls、lap按照质量比为1:1:0.02溶解到水中水溶液(记为4pnf pls组),其中形成4pnf质量浓度为10%。
[0103]
(5)将4pnf与pcys、lap按照质量比为1:0.1:0.02溶解到水中形成水溶液(记为4pnf pcys组),其中4pnf质量浓度为10%。
[0104]
<实施例四>
[0105]
本实施例提供的生物粘附性水凝胶的主要成分包括第三交联性生物大分子以及光引发剂。
[0106]
本实施例的第三交联性生物大分子为由化合物nf-13修饰的羧甲基纤维素(以下简写为cmcnf)。nf-13是一种吡啶甲基硝基烯咪唑类衍生物,结构如下:
[0107][0108]
cmcnf的制备过程为:将nf-13:cmc:edc:nhs按照质量比为1:20:1:1溶解到水中,调节ph为4.5~6.5,加热到35℃以上搅拌反应2小时,随后透析、冻干,得到接枝率为5%的cmcnf。
[0109]
将上述第三交联性生物大分子和lap溶解于去离子水即可得到本实施例的生物粘附性水凝胶溶液。具体地,本实施例中,将cmcnf与lap按照质量比为1:0.02溶解到水中水溶液(记为cmcnf组),形成cmcnf质量浓度为3%。
[0110]
<实施例五>
[0111]
本实施例提供的生物粘附性水凝胶的主要成分包括第三交联性生物大分子以及光引发剂。
[0112]
本实施例的第三交联性生物大分子为由化合物nf-19修饰的透明质酸(以下简写为hanf),其中,透明质酸本身就含有糖环羟甲基结构,nf-19是一种吡啶甲基硝基烯咪唑类衍生物,其结构如下:
[0113]
[0114]
hanf的制备过程为:将nf-19:透明质酸:edc:nhs按照质量比为1:30:1:1溶解到加入到水中,调节ph为4.5~6.5,热到35度以上搅拌反应2小时,随后透析冻干,得到接枝率为3%的hanf。
[0115]
本实施例的生物粘附性水凝胶的具体制备过程为:将hanf与lap按照质量比为1:0.02溶解到水中形成水溶液(记为hanf组),其中hanf质量浓度为5%。
[0116]
<实施例六>
[0117]
本实施例提供的生物粘附性水凝胶的主要成分包括第三交联性生物大分子以及光引发剂,该第三交联性生物大分子为由化合物nf-3修饰的壳聚糖(以下简写为ctsnf),其中,壳聚糖(cts)本身就含有糖环羟甲基结构,nf-3是一种邻二氢吡啶硝基苯衍生物,其结构如下:
[0118][0119]
ctsnf的制备过程为:将nf-3:壳聚糖:edc:nhs按照质量比为1:10:1:1溶解到水中,调节ph为4.5~6.5,加热到35℃以上搅拌反应2小时,随后透析、冻干,得到接枝率为100%的ctsnf。
[0120]
本实施例的生物粘附性水凝胶的具体制备过程为:将ctsnf与lap按照质量比为1:0.02溶解到水中形成水溶液(记为ctsnf组),其中ctsnf质量浓度为5%。
[0121]
<实施例七>
[0122]
本实施例为前述实施例一~实施例六的各生物粘附性水凝胶的固化性能测试实验。
[0123]
将实施例一~实施例六的各生物粘附性水凝胶溶液用波长为365nm、光强为30mw/cm2的光照射,记录从开始照射至完全固化所需的时间,结果如下表1所示。表1中,符号
“-”
表示在光照持续时间(60s)内均未出现固化成胶现象。
[0124]
表1生物粘附性水凝胶溶液光照固化时间
[0125][0126]
图1是本发明各实施例的生物粘附性水凝胶溶液的固化照片,其中,图1(a)对应于实施例一~实施例二的各组,图1(b)对应于实施例三~六的各组。图1中各离心管被倒置后拍摄照片,固化后的胶体位于上侧(离心管管底处),未固化的胶液位于下侧(离心管管口处)。
[0127]
如表1及图1所示,实施例一中,csnf组在光引发剂以及光照条件下不固化成胶,说明仅nf修饰的生物大分子不能在光引发剂以及光照条件下交联。除此之外,csnf gelatin组、csnf ha组、csnf csma组均在光照2秒左右即固化成胶,说明含有巯基、糖环羟甲基或双键的大分子均可以在光引发剂以及光照条件下与csnf发生交联反应。类似地,实施例二中,pganf组在光引发剂以及光照条件下不固化成胶,但pganf silk、pganf cmc以及pganf pegda三组均能够在光引发剂以及光照条件下固化成胶;实施例三中,4pnf、4pnf cs均不能在光引发剂以及光照条件固化成胶,4pnf cmc则能够固化成胶。
[0128]
将4pnf cmc组与实施例四的cmcnf组对比可以看出,由于cmcnf是将含有糖环羟甲基的cmc用吡啶甲基硝基烯咪唑类衍生物nf-13修饰而得到,其含有糖环羟甲基和nf基团,因此能够在光照以及光引发剂条件下自身交联。另外,与实施例四类似,实施例五的hanf、实施例六的ctsnf均能够在光照以及光引发剂条件下自身交联,这些交联结果说明,经过nf(包括邻二氢吡啶硝基苯衍生物以及吡啶甲基硝基烯咪唑类衍生物)修饰的生物大分子能
够与糖环羟甲基、双键或巯基在光照以及光引发剂条件下交联;经进一步的机理研究发现,其交联的过程为:nf基团在光照条件下产生亚硝基,而亚硝基在光引发剂自由基的作用下与糖环羟甲基、双键或巯基发生化学键合,从而交联。
[0129]
<实施例八>
[0130]
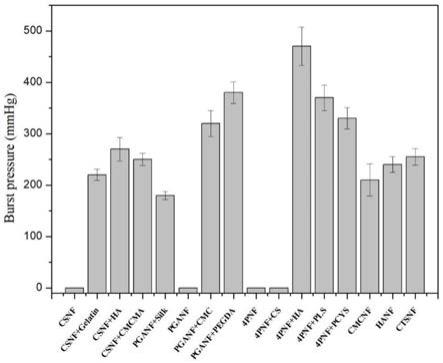
本实施例为前述实施例一~实施例六的各生物粘附性水凝胶的湿面组织粘附力测试实验,该湿面组织粘附力测试采用burst pressure方法进行,结果如下表2所示。
[0131]
表2本发明各实施例的湿面组织粘附力测试结果
[0132][0133][0134]
图2是本发明各实施例的湿面组织粘附力测试结果柱形图。
[0135]
如表2及图2所示,各实施例中,除了对照组以外,各组生物粘附性水凝胶溶液均具有一定的湿面组织粘附力,说明能够作为生物修复胶应用于快速止血。另外,实施例四~六的湿面组织粘附力整体低于实施例一~三,其原因可能是两种交联性生物大分子相互交联后的粘附力高于一种交联性生物大分子自身交联。
[0136]
另外,上述各组能够固化的生物粘附性水凝胶溶液的湿面组织粘附力均高于160mmhg,即,高于通常的动脉血压。也就是说,这些组的生物粘附性水凝胶的粘附力足够承受动脉血压的压力,从而能够应用于主动脉或心脏等血压较高部位的快速止血。
[0137]
<实施例九>
[0138]
本实施例为生物粘附性水凝胶的止血性能实验。
[0139]
图3是本发明实施例九的止血性能实验过程的照片。图3中,虚线框内为止血性能试验的手术部位。
[0140]
如图3所示,生物粘附性水凝胶的止血性能实验具体过程为:在猪左心室上用直径为8mm的钢管将心室壁刺穿,血柱迅速喷出。将实施例五中的hanf溶液涂抹在缺损喷血处,用波段为365nm,光强为60mw/cm2光照射5秒,反复操作3~5次后,可观察到伤口不再出血(图3最左侧照片),等待并观察15分钟内也未见血液继续流出,证明了hanf优异的快速止血性能。
[0141]
此外,采用实施例一的csnf gelatin、实施例二的pganf pegda替换上述hanf并进行相同的止血性能实验,其结果与图3所示结果类似,即,均能够在反复操作3~5次后止血,并且在15分钟内也未见血液继续流出,说明本发明各实施例的生物粘附性水凝胶均能够应用于心脏部位的快速止血。另外,由于其他部位的血压低于心脏部位,对于湿面组织粘附力的要求更低,因此,本发明的生物粘附性水凝胶显然也可以用于其他部位的快速止血。
[0142]
<实施例十>
[0143]
本实施例为生物粘附性水凝胶的组织再生性能实验。
[0144]
图4是本发明实施例十的组织再生性能实验过程示意图以及照片。其中,图4(a)为实验过程示意图,图4(b)为相应的实验过程照片,图4(c)为创口缺损愈合面积结果柱形图,图4(d)为创口缺损愈合厚度结果柱形图。图4(b)、图4(c)、图4(d)中,control为未采用水凝胶处理的对照组,fls为实验组肤;图4(c)的纵坐标为缺损愈合面积(%),图4(d)的纵坐标为缺损愈合厚度(μm),图4(d)的normal为未缺损部位的皮肤厚度。
[0145]
如图4所示,组织再生性能实验的具体过程为:在猪皮肤处用手术刀切4.5cm*4.5cm*0.5cm的大块皮肤损伤模型,用实施例一的csnf gelatin溶液填充满伤口,再用波段为365nm、光强为60mw/cm2光照射20秒后,纱布覆盖保护创面。术后30天观察,可见创口完美再生,再生的皮肤毛孔结构与周边未缺损的皮肤一致,且没有明显疤痕生成,如图4(b)中fls组所示。而没有用凝胶处理的对照组在30天后有明显疤痕组织,且新生皮肤上没有毛孔结构,如图4(b)中control组所示。这一结果证明了csnf gelatin良好的组织再生性能。
[0146]
此外,采用实施例三的4pnf pls、实施例六的ctsnf替换上述csnf gelatin并进行相同的组织再生性能实验,其结果与图4所示结果类似,即,均能够在处理30天后促进创口再生,并且再生的皮肤毛孔结构等与周边未缺损皮肤一致。可见,本发明的生物粘附性水凝胶具有促进皮肤组织再生的效果,能够用于缺损组织修复。
[0147]
<实施例十一>
[0148]
本实施例为生物粘附性水凝胶的载药性能实验。
[0149]
图5是本发明实施例十一的载药性能实验照片。图5中,虚线框内部位为颅骨右侧实验部位。
[0150]
如图5所示,载药性能实验的具体过程为:在大鼠颅骨左右两侧分别开一个直径为10mm的圆孔,将生长因子bmp2均匀混合到实施例二的pganf silk溶液中,随后注射到颅骨左侧缺损孔中,并用波段为395nm,光强为60mw/cm2光照射15秒。右侧缺损孔作为对照组不做其他处理。术后将动物饲养四周后处死,取样分析,发现左侧颅骨缺损处已经完美再生,找不到损伤再生的界限,且没有异位骨化的情况发生,而右侧缺损孔对照组只有少量膜状
组织形成,缺损处没有明显骨再生,这证明了本发明的生物粘附性水凝胶具有载药性能和定点释放性能,能够作为药物载体应用。
[0151]
<实施例十二>
[0152]
本实施例为生物粘附性水凝胶应用于生物打印的性能测试。
[0153]
图6是本发明实施例十二的生物打印过程示意图以及打印结果照片。其中,图6(a)为打印过程原理图,图6(b)为打印头处结构照片,图6(c)为打印模型设计图,图6(d)为打印模型内部结构图,图6(e)为打印产物照片。
[0154]
如图6所示,生物粘附性水凝胶应用于生物打印的具体过程为:将实施例六中的ctsnf溶液加入到dlp生物3d打印机的墨盒中,选择孔径为200的脚手架模型,调节打印光强为30mw/cm2,层厚为10μm,曝光时间为1秒/层。上述打印过程完成后,可以得到孔径为200μm的全连通孔脚手架支架,如图6(e)所示。该实验能够证明,本发明的生物粘附性水凝胶的固化时间以及成胶强度能够满足生物打印的性能需求,能够用于作为生物打印材料应用。
[0155]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。