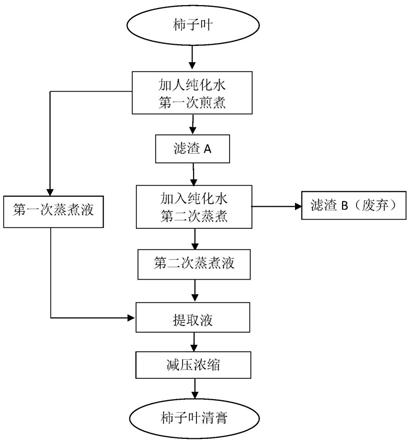
1.本发明涉及一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集系统及方法,其属于炎性小体活性状态分析
技术领域:
:。
背景技术:
::2.炎性小体是由多种蛋白质组成的复合体,分子量约700kda。炎性小体能够调节胱冬肽酶‑1(caspase‑1)的活化进而在天然免疫防御的过程中促进细胞因子前体pro‑il‑1β和pro‑il‑18的成熟和分泌。其还能调节caspase‑1依赖的形式编程性细胞焦亡,诱导细胞在炎性和应激的病理条件下死亡。在现代医学中,肿瘤是致死的主要原因之一。在肿瘤发展过程中,大多数肿瘤出现炎性小体的激活。炎性小体活性增强可促进肿瘤增殖、血管形成、转移及免疫逃逸。在临床上,炎性小体的激活往往与肿瘤复发、耐药及不良预后密切相关。近年来的研究表明炎性小体的激活可通过重塑肿瘤细胞微环境,增强肿瘤细胞免疫抑制状态,从而导致耐药或免疫逃逸。可见,分析炎性小体的活性状态对于研究肿瘤细胞的生命活动具有重要的意义,然而,目前没有一种评估肿瘤炎性小体活性的方法。技术实现要素:3.为了解决现有技术中存在的问题,本发明提供一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集系统及方法。4.为实现发明目的,本发明采用如下技术方案:一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集,所述基因集为炎性小体活性相关基因集irgs,炎性小体活性相关基因集irgs包含15个炎症小体核心基因、34个casp1调控基因、92个il1b调控基因、8个il18调节基因、13个gsdmd调节基因五个基因集。5.所述15个炎症小体核心基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard十五个基因。6.所述34个casp1调控基因包含tmem260、tifa、lsm4、cers2、plcg2、fam219a、lamtor3、klf11、ctsh、capza2、actl6a、c10orf11、klrb1、ubr1、ppp1r12b、znf512b、farp2、ppip5k1、phka1、bace1、mrps27、trappc12、tas1r3、cd247、cybrd1、pced1a、ap5m1、rmdn1、fbxo31、bloc1s6、atp10d、fmo1、fkbp5和nnt三十四个基因。7.所述92个il1b调控基因包含adam17、slc11a2、ereg、csf1、esr1、bid、bach1、tnfrsf1b、mapkapk3、ifnar2、nfkb2、osmr、btn1a1、irf5、gnaq、sulf2、slc7a11、slamf1、selp、npy1r、prokr1、sod2、serpinb2、rab32、ptger4、stx11、igsf3、arhgap27、tbc1d9、tnip1、slamf8、actr3b、pim1、map3k8、polr3k、bcl3、hoxd13、cdca2、rnd1、cers5、gpr171、ptgs2、nfatc2、b3gat1、ch25h、il33、slc5a1、nfkbie、socs3、elf3、sele、tnfaip2、tlr2、chl1、ccl2、steap4、zc3h12a、il6、vcam1、nfkbiz、cxcl1、ccl20、lacc1、znf608、gbp6、lim2、hs3st2、cox5b、pde4b、ascl2、ehd2、scn3a、sc5d、dync2h1、bcl9l、alg9、tmem25、nxpe4、ift46和rnf214九十二个基因。8.所述8个il18调节基因包含cd226、klrb1、cxcr6、thy1、samd3、txk、c5orf28、faslg、rgs11、ctsw、mid1、camk2b和cnbd2八个基因。9.所述13个gsdmd调节基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard八个基因。10.一种采用所述基因集预测肿瘤炎性小体活性状态及治疗敏感性的系统,所述系统包含数据输入模块、数据分析模块和输出模块,数据分析模块与数据输入模块和输出模块数据通信连接,所述数据输入模块用于输入训练样本数据集的基因表达数据、从肿瘤药敏数据库gdsc和ccle数据库获得的细胞系的基因表达数据和相关药敏筛选数据、从免疫治疗数据库imvigor210corebiologies获得的对应样本的基因表达和免疫治疗反应性数据、待测样本的基因表达数据。11.所述训练样本数据集包含肿瘤基因组图谱tcga数据库获得的33类肿瘤类型共9881例数据。12.所述数据分析模块包含炎性小体活性状态分类模块、靶向治疗分析模块和免疫治疗分析模块。13.所述炎性小体活性状态分类模块首先以训练样本数据集的基因表达数据为输入,采用ssgsea算法计算训练样本数据集中每例样本的炎性小体活性相关基因集irgs的评分,根据评分利用非监督k‑均值聚类对炎性小体活性状态进行分类,根据分类结果将炎性小体活性状态定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高,然后以待测样本的基因表达数据为输入,得到待测样本的炎性小体活性状态类型。14.所述靶向治疗分析模块首先以细胞系的基因表达数据和相关药敏筛选数据为输入,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到六类炎性小体活性状态类型中,比较每种靶向药的ic50值在六类炎性小体活性状态类型中的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否braf靶向药抵抗。15.所述免疫治疗分析模块首先以对应样本的基因表达和免疫治疗反应性数据为输入,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否免疫治疗抵抗。16.所述输出模块用于输出待测样本的炎性小体活性状态类型、是否braf靶向药抵抗和是否免疫治疗抵抗。17.一种预测肿瘤炎性小体活性状态及治疗敏感性的方法,包含如下步骤:步骤一:获取训练样本数据集,从肿瘤基因组图谱tcga数据库获得33类肿瘤类型共9881例数据作为训练样本数据集,所述9881例数据包含每例样本的基因突变数据、基因拷贝数变异数据、基因表达数据和临床信息数据。18.步骤二:炎性小体活性相关基因集irgs的构建,所述炎性小体活性相关基因集irgs包含15个炎症小体核心基因、34个casp1调控基因、92个il1b调控基因、8个il18调节基因、13个gsdmd调节基因共五个基因集。19.所述15个炎症小体核心基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard十五个基因。20.所述34个casp1调控基因包含tmem260、tifa、lsm4、cers2、plcg2、fam219a、lamtor3、klf11、ctsh、capza2、actl6a、c10orf11、klrb1、ubr1、ppp1r12b、znf512b、farp2、ppip5k1、phka1、bace1、mrps27、trappc12、tas1r3、cd247、cybrd1、pced1a、ap5m1、rmdn1、fbxo31、bloc1s6、atp10d、fmo1、fkbp5和nnt三十四个基因。21.所述92个il1b调控基因包含adam17、slc11a2、ereg、csf1、esr1、bid、bach1、tnfrsf1b、mapkapk3、ifnar2、nfkb2、osmr、btn1a1、irf5、gnaq、sulf2、slc7a11、slamf1、selp、npy1r、prokr1、sod2、serpinb2、rab32、ptger4、stx11、igsf3、arhgap27、tbc1d9、tnip1、slamf8、actr3b、pim1、map3k8、polr3k、bcl3、hoxd13、cdca2、rnd1、cers5、gpr171、ptgs2、nfatc2、b3gat1、ch25h、il33、slc5a1、nfkbie、socs3、elf3、sele、tnfaip2、tlr2、chl1、ccl2、steap4、zc3h12a、il6、vcam1、nfkbiz、cxcl1、ccl20、lacc1、znf608、gbp6、lim2、hs3st2、cox5b、pde4b、ascl2、ehd2、scn3a、sc5d、dync2h1、bcl9l、alg9、tmem25、nxpe4、ift46和rnf214九十二个基因。22.所述8个il18调节基因包含cd226、klrb1、cxcr6、thy1、samd3、txk、c5orf28、faslg、rgs11、ctsw、mid1、camk2b和cnbd2八个基因。23.所述13个gsdmd调节基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard八个基因。24.步骤三:计算炎性小体活性相关基因集irgs中五个基因集的irg评分,以所述训练样本数据集的基因表达数据为输入,用ssgsea算法计算每例样本的五个基因集的irg评分,基于每例样本的五个基因集的irg评分,利用非监督k‑均值聚类,对所述训练样本数据集进行分类,k‑均值聚类的参数设置为:模拟次数=100,距离=欧几里得距离,聚类后根据一致性数据将聚类数定为6。25.步骤四:确定六类炎性小体活性强弱及激活模式,根据步骤三中五个基因集的irg评分在不同类型中的分布情况,把训练样本数据集中的样本定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高。26.步骤五:靶向治疗敏感性分析,从肿瘤药敏数据库gdsc和ccle数据库获得细胞系数据的基因表达数据和相关药敏筛选数据,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到步骤四的六类炎性小体活性状态类型中,比较每种靶向药的ic50值在六类炎性小体活性状态类型中的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗。27.步骤六:免疫治疗敏感性分析,从免疫治疗数据库imvigor210corebiologies获得对应样本的基因表达和免疫治疗反应性数据,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于五个irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗。28.步骤七:待测样本的炎性小体活性状态分析,获得待测样本的基因表达数据,利用ssgsea算法计算待测样本的五个基因集的irg评分,基于待测样本的五个irg评分和训练样本数据集六类炎性小体活性状态类型标签,确定待测样本的炎性小体活性状态类型、是否braf靶向药抵抗和是否免疫治疗抵抗。29.本发明的有益效果是:一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集系统及方法,通过分析建立了一种能够预测肿瘤炎性小体活性状态及治疗敏感性的基因集,利用该基因集建立了一种预测系统及方法,该预测系统和方法基于样本训练数据集和五个基因集通过ssgsea算法、非监督k‑均值聚类和svm机器学习算法来建立预测模型,将样本分成一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低和六类‑炎性小体活性高‑il18高六种类型。并通过靶向治疗敏感性和免疫治疗敏感性分析,预测出二类‑炎性小体活性低‑il1b高为braf靶向药抵抗,而炎性小体活性状态越强的类型如五类‑炎性小体活性高‑il18低和六类‑炎性小体活性高‑il18高对于免疫治疗抵抗。该预测模型可高效的评估和识别出不同样本的炎性小体的活性状态,为分析炎性小体活性状态及不同炎性小体活性状态肿瘤的治疗敏感性提供一种新的基因集、预测系统和预测方法。附图说明30.图1是一种预测肿瘤炎性小体活性状态及治疗敏感性的系统的结构示意图。31.图2是一种预测肿瘤炎性小体活性状态及治疗敏感性的方法的流程示意图。32.图3是鼠原代胶质瘤免疫检查点阻断联合炎性小体活性抑制剂的治疗反应性结果图。33.图4是外部数据乳腺癌患者炎性小体活性状态分类预测图。具体实施方式34.为使本发明的技术方案更加清楚,下面将结合本发明的实施例,对实施例中的技术方案进行清楚、完整地描述,以下实施例用于说明本发明,但不用来限制本发明的范围。35.一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集的构建过程:炎性小体活性信号主要涉及三个阶段,包括起始阶段(受炎性体复合物调控),加工阶段(受caspase‑1调控)和终末阶段(受gsdmd、il1b和il18调控)。从名称为nod‑likereceptorsandinflammasomes:areviewoftheircanonicalandnon‑canonicalsignalingpathways(archivesofbiochemistryandbiophysics670(2019)4–14)和theemergingrolesofinflammasome‑dependentcytokinesincancerdevelopment(emboreports(2019)20:e47575)的文献中收集了15个与炎症小体复合物相关的基因(称为炎症小体核心基因)。从名称为analysesofcaspase‑1‑regulatedtranscriptomesinvarioustissuesleadtoidentificationofnovelil‑1β‑,il‑18‑ꢀandsirtuin‑1‑independentpathways(lietal.journalofhematology&oncology(2017)10:40)的文献中的一项基于geo数据集的基因表达谱进行荟萃分析研究中识别出34个casp1调控基因和92个il1b调控基因。通过对geo号为gse64308,gse64309,gse64310的geo数据集进行了与前述相同的荟萃分析程序识别出8个il18调节的基因。相同荟萃分析未能发现gsdmd调节的基因。然后我们通过对geo号为gse126289的geo数据进行差异基因分析识别到13个gsdmd调节的基因。由上述的五个基因集组成炎性小体活性相关基因集(irgs)。36.炎性小体活性相关基因集(irgs)中五个基因集的基因组成如表1所列:表1基因集组成基因集基因名称基因集亚分类casp1tmem260casp1_up_regulated_genecasp1tifacasp1_up_regulated_genecasp1lsm4casp1_up_regulated_genecasp1cers2casp1_up_regulated_genecasp1plcg2casp1_up_regulated_genecasp1fam219acasp1_up_regulated_genecasp1lamtor3casp1_up_regulated_genecasp1klf11casp1_up_regulated_genecasp1ctshcasp1_up_regulated_genecasp1capza2casp1_up_regulated_genecasp1actl6acasp1_up_regulated_genecasp1c10orf11casp1_up_regulated_genecasp1klrb1casp1_up_regulated_genecasp1ubr1casp1_down_regulated_genecasp1ppp1r12bcasp1_down_regulated_genecasp1znf512bcasp1_down_regulated_genecasp1farp2casp1_down_regulated_genecasp1ppip5k1casp1_down_regulated_genecasp1phka1casp1_down_regulated_genecasp1bace1casp1_down_regulated_genecasp1mrps27casp1_down_regulated_genecasp1trappc12casp1_down_regulated_genecasp1tas1r3casp1_down_regulated_genecasp1cd247casp1_down_regulated_genecasp1cybrd1casp1_down_regulated_genecasp1pced1acasp1_down_regulated_genecasp1ap5m1casp1_down_regulated_genecasp1rmdn1casp1_down_regulated_genecasp1fbxo31casp1_down_regulated_genecasp1bloc1s6casp1_down_regulated_genecasp1atp10dcasp1_down_regulated_genecasp1fmo1casp1_down_regulated_genecasp1fkbp5casp1_down_regulated_genecasp1nntcasp1_down_regulated_geneil1badam17il1b_up_regulated_geneil1bslc11a2il1b_up_regulated_geneil1beregil1b_up_regulated_geneil1bcsf1il1b_up_regulated_geneil1besr1il1b_up_regulated_geneil1bbidil1b_up_regulated_geneil1bbach1il1b_up_regulated_geneil1btnfrsf1bil1b_up_regulated_geneil1bmapkapk3il1b_up_regulated_geneil1bifnar2il1b_up_regulated_geneil1bnfkb2il1b_up_regulated_geneil1bosmril1b_up_regulated_geneil1bbtn1a1il1b_up_regulated_geneil1birf5il1b_up_regulated_geneil1bgnaqil1b_up_regulated_geneil1bsulf2il1b_up_regulated_geneil1bslc7a11il1b_up_regulated_geneil1bslamf1il1b_up_regulated_geneil1bselpil1b_up_regulated_geneil1bnpy1ril1b_up_regulated_geneil1bprokr1il1b_up_regulated_geneil1bsod2il1b_up_regulated_geneil1bserpinb2il1b_up_regulated_geneil1brab32il1b_up_regulated_geneil1bptger4il1b_up_regulated_geneil1bstx11il1b_up_regulated_geneil1bigsf3il1b_up_regulated_geneil1barhgap27il1b_up_regulated_geneil1btbc1d9il1b_up_regulated_geneil1btnip1il1b_up_regulated_geneil1bslamf8il1b_up_regulated_geneil1bactr3bil1b_up_regulated_geneil1bpim1il1b_up_regulated_geneil1bmap3k8il1b_up_regulated_geneil1bpolr3kil1b_up_regulated_geneil1bbcl3il1b_up_regulated_geneil1bhoxd13il1b_up_regulated_geneil1bcdca2il1b_up_regulated_geneil1brnd1il1b_up_regulated_geneil1bcers5il1b_up_regulated_geneil1bgpr171il1b_up_regulated_geneil1bptgs2il1b_up_regulated_geneil1bnfatc2il1b_up_regulated_geneil1bb3gat1il1b_up_regulated_geneil1bch25hil1b_up_regulated_geneil1bil33il1b_up_regulated_geneil1bslc5a1il1b_up_regulated_geneil1bnfkbieil1b_up_regulated_geneil1bsocs3il1b_up_regulated_geneil1belf3il1b_up_regulated_geneil1bseleil1b_up_regulated_geneil1btnfaip2il1b_up_regulated_geneil1btlr2il1b_up_regulated_geneil1bchl1il1b_up_regulated_geneil1bccl2il1b_up_regulated_geneil1bsteap4il1b_up_regulated_geneil1bzc3h12ail1b_up_regulated_geneil1bil6il1b_up_regulated_geneil1bvcam1il1b_up_regulated_geneil1bnfkbizil1b_up_regulated_geneil1bcxcl1il1b_up_regulated_geneil1bccl20il1b_up_regulated_geneil1blacc1il1b_up_regulated_geneil1bznf608il1b_up_regulated_geneil1bgbp6il1b_up_regulated_geneil1blim2il1b_down_regulated_geneil1bhs3st2il1b_down_regulated_geneil1bcox5bil1b_down_regulated_geneil1bpde4bil1b_down_regulated_geneil1bascl2il1b_down_regulated_geneil1behd2il1b_down_regulated_geneil1bscn3ail1b_down_regulated_geneil18sc5dil18_up_regulated_geneil18dync2h1il18_up_regulated_geneil18bcl9lil18_up_regulated_geneil18alg9il18_up_regulated_geneil18tmem25il18_up_regulated_geneil18nxpe4il18_up_regulated_geneil18ift46il18_down_regulated_geneil18rnf214il18_down_regulated_genegsdmdcd226gsdmd_up_regulated_genegsdmdklrb1gsdmd_up_regulated_genegsdmdcxcr6gsdmd_up_regulated_genegsdmdthy1gsdmd_up_regulated_genegsdmdsamd3gsdmd_up_regulated_genegsdmdtxkgsdmd_up_regulated_genegsdmdc5orf28gsdmd_up_regulated_genegsdmdfaslggsdmd_up_regulated_genegsdmdrgs11gsdmd_up_regulated_genegsdmdctswgsdmd_up_regulated_genegsdmdmid1gsdmd_up_regulated_genegsdmdcamk2bgsdmd_down_regulated_genegsdmdcnbd2gsdmd_down_regulated_geneinflammasomenlrp1inflammasome_hubgeneinflammasomenlrp3inflammasome_hubgeneinflammasomecasp4inflammasome_hubgeneinflammasomecasp5inflammasome_hubgeneinflammasomenlrc5inflammasome_hubgeneinflammasomenlrp6inflammasome_hubgeneinflammasomenlrp12inflammasome_hubgeneinflammasomenlrp7inflammasome_hubgeneinflammasomenaipinflammasome_hubgeneinflammasomenlrc4inflammasome_hubgeneinflammasomeaim2inflammasome_hubgeneinflammasomeifi16inflammasome_hubgeneinflammasomemefvinflammasome_hubgeneinflammasomenlrp2inflammasome_hubgeneinflammasomepycardinflammasome_hubgene荟萃分析具体过程为:针对于收集到的具有分组信息的geo数据集,我们首先通过limma这个r包进行差异分析。然后,对于各geo数据集中的每个基因,我们使用metama这个r包中的效应大小函数计算效应大小。紧接着,我们使用metama包中的directescombi函数在多个geo数据集中合并了无偏效应大小及其方差,同时使用benjamini‑hochberg方法对p值进行校正。最后校正后p值小于0.05的基因被纳入最后的研究。37.差异基因分析过程:根据geo数据集样本分组信息构建比较矩阵,接着将比较矩阵和表达谱数据逐步代入limma包的lmfit和ebayes函数进行分析,最后通过toptable函数输出差异分析结果。38.图1示出了一种预测肿瘤炎性小体活性状态及治疗敏感性的系统的结构示意图,图中,这种采用所述基因集预测肿瘤炎性小体活性状态及治疗敏感性的系统包含数据输入模块、数据分析模块和输出模块,数据分析模块与数据输入模块和输出模块数据通信连接,数据输入模块用于输入训练样本数据集的基因表达数据、从肿瘤药敏数据库gdsc和ccle数据库获得的细胞系的基因表达数据和相关药敏筛选数据、从免疫治疗数据库imvigor210corebiologies获得的对应样本的基因表达和免疫治疗反应性数据、待测样本的基因表达数据。39.训练样本数据集包含肿瘤基因组图谱tcga数据库获得的33类肿瘤类型共9881例数据。数据分析模块包含炎性小体活性状态分类模块、靶向治疗分析模块和免疫治疗分析模块。40.炎性小体活性状态分类模块首先以训练样本数据集的基因表达数据为输入,采用ssgsea算法计算训练样本数据集中每例样本的炎性小体活性相关基因集irgs的评分,根据评分利用非监督k‑均值聚类对炎性小体活性状态进行分类,根据分类结果将炎性小体活性状态定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高,然后以待测样本的基因表达数据为输入,得到待测样本的炎性小体活性状态类型。41.靶向治疗分析模块首先以细胞系的基因表达数据和相关药敏筛选数据为输入,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到六类炎性小体活性状态类型中,比较每种靶向药的ic50值在六类炎性小体活性状态类型中的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否braf靶向药抵抗。42.免疫治疗分析模块首先以对应样本的基因表达和免疫治疗反应性数据为输入,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否免疫治疗抵抗。43.输出模块用于输出待测样本的炎性小体活性状态类型、是否braf靶向药抵抗和是否免疫治疗抵抗。44.数据输入模块、数据分析模块和输出模块均采用现有的用于输入、输出和分析装置。45.图2示出了一种预测肿瘤炎性小体活性状态及治疗敏感性的方法的流程示意图。图中,这种预测肿瘤炎性小体活性状态及治疗敏感性的方法包含以下步骤:步骤一:获取训练样本数据集,从肿瘤基因组图谱tcga数据库获得训练样本数据集,所述训练样本数据集包括33类肿瘤类型共9881例数据,所述9881例数据包含每例样本的基因突变数据、基因拷贝数变异数据、基因表达数据和临床信息数据。46.步骤二:构建炎性小体活性相关基因集,该炎性小体活性相关基因集采用上述构建的炎性小体活性相关基因集irgs。47.步骤三:以步骤二的五个irgs基因集的tcga基因表达数据为输入,利用ssgsea算法分别计算五个基因集的irg评分,基于五个基因集的irg评分,利用非监督k‑均值聚类,对训练样本数据集进行分类。参数如下:模拟次数=100;距离=欧几里得距离。聚类后根据一致性数据将聚类数定为6。对5个评分进行tumormap分析发现,聚类数为6时,可以很好地把各类患者分开。48.步骤四:6类炎性小体活性强弱及激活模式确定,根据五个irg评分在不同类型中分布情况,把样本定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高。49.步骤五:靶向治疗敏感性分析,从肿瘤药敏数据库gdsc及ccle数据库获得细胞系数据的基因表达数据和相关药敏筛选数据,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到步骤四所述的六类炎性小体活性状态类型中去,比较每种靶向药的ic50值在六类炎性小体活性状态类型的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗。50.步骤六:免疫治疗敏感性分析,从免疫治疗数据库imvigor210corebiologies获得样本的基因表达和免疫治疗反应性数据,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗。51.步骤七:待测样本的炎性小体活性状态分析,获得待测样本的基因表达数据,利用ssgsea算法计算待测样本的五个基因集的irg评分,基于待测样本的五个基因集的irg评分和tcga样本六类炎性小体活性状态类型标签,预测待测样本的炎性小体活性状态类型,通过步骤五和步骤六的svm机器学习算法来预测待测样本是否braf靶向药抵抗和是否免疫治疗抵抗。52.为了通过五个炎性小体活性相关评分来预测外部数据集中样本的炎症小体活性状态类型,我们使用了两层验证策略来比较六种机器学习算法的预测准确性,这些算法包括分类和回归树(cart),逻辑回归(lr),线性判别分析(lda),kneighbors分类器(knn),高斯nb(nb)和支持向量机(svm)。简而言之,将tcga样本随机分为训练集(80%)和验证集(20%)。然后使用训练集通过五次交叉验证过程来比较六种算法的预测准确性,以克服过度拟合的问题。使用验证集作为外层评估进一步评估了六种算法的准确性。最后,两层验证策略中具有最高预测精度的是svm算法。53.实施例1从鼠自发瘤模型(sb模型)中提取原代鼠胶质瘤细胞(sb1),对鼠原代胶质瘤细胞sb1进行测序,获得其基因表达谱,按照具体实施方式中的步骤七对鼠原代胶质瘤细胞sb1的基因表达谱进行分析,确定鼠原代胶质瘤细胞sb1属于五类‑炎性小体活性高‑il18低。利用小鼠立体定向技术,将sb1原位种植于小鼠脑中,对其分别进行免疫检查点治疗和使用mb抑制五类‑炎性小体活性高‑il18低型中的炎性小体活性,一组对比不同治疗方法小鼠的存活期。另外一组,在15天时处死小鼠,将小鼠脑组织取出,多聚甲醛固定,石蜡包埋切片,采用苏木精—伊红染色法检测肿瘤大小。54.图3是鼠原代胶质瘤免疫检查点阻断联合炎性小体活性抑制剂治疗效果对比图,其中,图a是经治疗后生存期对比图,图b是治疗后肿瘤大小对比图,图中, pbs是加pbs的对照组, antipd‑l1ab是免疫检查点治疗组, antipd‑l1ab&mb是免疫检查点阻断联合炎性小体活性抑制剂治疗组。从图中可以看出,五类‑炎性小体活性高‑il18低型鼠原代胶质瘤经免疫检查点联合炎性小体活性抑制剂治疗后肿瘤明显缩小,小鼠的生存期延长。通过mb抑制五类‑炎性小体活性高‑il18低型中的炎性小体活性可以提高免疫检查点治疗的治疗效果。可见,这种预测肿瘤炎性小体活性状态及治疗敏感性的方法能够准确预测炎性小体的活性状态。55.实施例2我们通过cbioportal数据库(http://www.cbioportal.org/datasets)下载了168例乳腺癌基因表达数据,通过具体实施方式中的步骤七对其进行分析,可将168例乳腺癌预测为六种炎性小体活性状态类型中四种。同时,按照步骤四对分类后的四组炎性小体活性状态类型进行分析。56.图4是外部数据乳腺癌患者炎性小体活性状态分类预测结果,其中,a是炎性小体活性状态分类预测结果及生物功能相关进程及通路的评分在不同类型中分部情况,b是五个炎性小体活性相关的评分在不同分类中分布情况,c是免疫微环境相关的评分在不同类型中的分布情况。根据图4,外部数据乳腺癌患者被分在六种炎性小体活性状态类型中四种(二类、三类、四类及五类),我们发现三到五类属于炎性小体增强型,增强型的类型具有更强的免疫抑制状态。可以看出,168例乳腺癌患者的表达谱特征符合一、二类炎性小体活性弱,三、四类炎性小体活性中度增强,五、六类炎性小体活性高度增强,且符合炎性小体活性增强型具有更强的免疫抑制特征。57.gdsc是药敏数据库,从细胞系的表达谱数据,就可以计算对应的五个irg评分,然后将其分为六种炎性小体活性状态类型,比较每种药物在六种不同炎性小体活性状态类型中的敏感性情况,从而得到治疗敏感性。imvigor210corebiologies是免疫治疗数据库,从接受免疫治疗的患者的表达谱中计算对应的五个irg评分,将其分类,然后比较每类患者中,免疫治疗的反应率,从而得到每类间质化类型的免疫治疗(免疫检查点阻断治疗)敏感或抵抗。之后任意样本的数据代入模型中,得到分类。然后根据gdsc和imvigor210corebiologies数据库分析出来的特性,来预测这个样本的特性。58.imvigor210corebiologies数据库中患者信息中有抗pd‑l1的治疗反应结果,通过卡方检验不同炎性小体活性状态类型中抗pd‑l1治疗反应或抵抗分布情况,发现炎性小体活性越强的类型包括更多治疗无反应的患者。59.ic50是gdsc数据库自带的,就是评价某个药在某一个细胞系中的药物敏感性。通过wilcoxon检验来比较某一个药在某一类和其他所有类细胞系中药敏指标ic50的差异,某药ic50在某一类中的中位值越高,同时校正后p值小于0.05,说明这一类细胞系对该药更抵抗。其他类没找到典型明显抵抗或敏感的药。当前第1页12当前第1页12
技术领域:
:。
背景技术:
::2.炎性小体是由多种蛋白质组成的复合体,分子量约700kda。炎性小体能够调节胱冬肽酶‑1(caspase‑1)的活化进而在天然免疫防御的过程中促进细胞因子前体pro‑il‑1β和pro‑il‑18的成熟和分泌。其还能调节caspase‑1依赖的形式编程性细胞焦亡,诱导细胞在炎性和应激的病理条件下死亡。在现代医学中,肿瘤是致死的主要原因之一。在肿瘤发展过程中,大多数肿瘤出现炎性小体的激活。炎性小体活性增强可促进肿瘤增殖、血管形成、转移及免疫逃逸。在临床上,炎性小体的激活往往与肿瘤复发、耐药及不良预后密切相关。近年来的研究表明炎性小体的激活可通过重塑肿瘤细胞微环境,增强肿瘤细胞免疫抑制状态,从而导致耐药或免疫逃逸。可见,分析炎性小体的活性状态对于研究肿瘤细胞的生命活动具有重要的意义,然而,目前没有一种评估肿瘤炎性小体活性的方法。技术实现要素:3.为了解决现有技术中存在的问题,本发明提供一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集系统及方法。4.为实现发明目的,本发明采用如下技术方案:一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集,所述基因集为炎性小体活性相关基因集irgs,炎性小体活性相关基因集irgs包含15个炎症小体核心基因、34个casp1调控基因、92个il1b调控基因、8个il18调节基因、13个gsdmd调节基因五个基因集。5.所述15个炎症小体核心基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard十五个基因。6.所述34个casp1调控基因包含tmem260、tifa、lsm4、cers2、plcg2、fam219a、lamtor3、klf11、ctsh、capza2、actl6a、c10orf11、klrb1、ubr1、ppp1r12b、znf512b、farp2、ppip5k1、phka1、bace1、mrps27、trappc12、tas1r3、cd247、cybrd1、pced1a、ap5m1、rmdn1、fbxo31、bloc1s6、atp10d、fmo1、fkbp5和nnt三十四个基因。7.所述92个il1b调控基因包含adam17、slc11a2、ereg、csf1、esr1、bid、bach1、tnfrsf1b、mapkapk3、ifnar2、nfkb2、osmr、btn1a1、irf5、gnaq、sulf2、slc7a11、slamf1、selp、npy1r、prokr1、sod2、serpinb2、rab32、ptger4、stx11、igsf3、arhgap27、tbc1d9、tnip1、slamf8、actr3b、pim1、map3k8、polr3k、bcl3、hoxd13、cdca2、rnd1、cers5、gpr171、ptgs2、nfatc2、b3gat1、ch25h、il33、slc5a1、nfkbie、socs3、elf3、sele、tnfaip2、tlr2、chl1、ccl2、steap4、zc3h12a、il6、vcam1、nfkbiz、cxcl1、ccl20、lacc1、znf608、gbp6、lim2、hs3st2、cox5b、pde4b、ascl2、ehd2、scn3a、sc5d、dync2h1、bcl9l、alg9、tmem25、nxpe4、ift46和rnf214九十二个基因。8.所述8个il18调节基因包含cd226、klrb1、cxcr6、thy1、samd3、txk、c5orf28、faslg、rgs11、ctsw、mid1、camk2b和cnbd2八个基因。9.所述13个gsdmd调节基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard八个基因。10.一种采用所述基因集预测肿瘤炎性小体活性状态及治疗敏感性的系统,所述系统包含数据输入模块、数据分析模块和输出模块,数据分析模块与数据输入模块和输出模块数据通信连接,所述数据输入模块用于输入训练样本数据集的基因表达数据、从肿瘤药敏数据库gdsc和ccle数据库获得的细胞系的基因表达数据和相关药敏筛选数据、从免疫治疗数据库imvigor210corebiologies获得的对应样本的基因表达和免疫治疗反应性数据、待测样本的基因表达数据。11.所述训练样本数据集包含肿瘤基因组图谱tcga数据库获得的33类肿瘤类型共9881例数据。12.所述数据分析模块包含炎性小体活性状态分类模块、靶向治疗分析模块和免疫治疗分析模块。13.所述炎性小体活性状态分类模块首先以训练样本数据集的基因表达数据为输入,采用ssgsea算法计算训练样本数据集中每例样本的炎性小体活性相关基因集irgs的评分,根据评分利用非监督k‑均值聚类对炎性小体活性状态进行分类,根据分类结果将炎性小体活性状态定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高,然后以待测样本的基因表达数据为输入,得到待测样本的炎性小体活性状态类型。14.所述靶向治疗分析模块首先以细胞系的基因表达数据和相关药敏筛选数据为输入,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到六类炎性小体活性状态类型中,比较每种靶向药的ic50值在六类炎性小体活性状态类型中的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否braf靶向药抵抗。15.所述免疫治疗分析模块首先以对应样本的基因表达和免疫治疗反应性数据为输入,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否免疫治疗抵抗。16.所述输出模块用于输出待测样本的炎性小体活性状态类型、是否braf靶向药抵抗和是否免疫治疗抵抗。17.一种预测肿瘤炎性小体活性状态及治疗敏感性的方法,包含如下步骤:步骤一:获取训练样本数据集,从肿瘤基因组图谱tcga数据库获得33类肿瘤类型共9881例数据作为训练样本数据集,所述9881例数据包含每例样本的基因突变数据、基因拷贝数变异数据、基因表达数据和临床信息数据。18.步骤二:炎性小体活性相关基因集irgs的构建,所述炎性小体活性相关基因集irgs包含15个炎症小体核心基因、34个casp1调控基因、92个il1b调控基因、8个il18调节基因、13个gsdmd调节基因共五个基因集。19.所述15个炎症小体核心基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard十五个基因。20.所述34个casp1调控基因包含tmem260、tifa、lsm4、cers2、plcg2、fam219a、lamtor3、klf11、ctsh、capza2、actl6a、c10orf11、klrb1、ubr1、ppp1r12b、znf512b、farp2、ppip5k1、phka1、bace1、mrps27、trappc12、tas1r3、cd247、cybrd1、pced1a、ap5m1、rmdn1、fbxo31、bloc1s6、atp10d、fmo1、fkbp5和nnt三十四个基因。21.所述92个il1b调控基因包含adam17、slc11a2、ereg、csf1、esr1、bid、bach1、tnfrsf1b、mapkapk3、ifnar2、nfkb2、osmr、btn1a1、irf5、gnaq、sulf2、slc7a11、slamf1、selp、npy1r、prokr1、sod2、serpinb2、rab32、ptger4、stx11、igsf3、arhgap27、tbc1d9、tnip1、slamf8、actr3b、pim1、map3k8、polr3k、bcl3、hoxd13、cdca2、rnd1、cers5、gpr171、ptgs2、nfatc2、b3gat1、ch25h、il33、slc5a1、nfkbie、socs3、elf3、sele、tnfaip2、tlr2、chl1、ccl2、steap4、zc3h12a、il6、vcam1、nfkbiz、cxcl1、ccl20、lacc1、znf608、gbp6、lim2、hs3st2、cox5b、pde4b、ascl2、ehd2、scn3a、sc5d、dync2h1、bcl9l、alg9、tmem25、nxpe4、ift46和rnf214九十二个基因。22.所述8个il18调节基因包含cd226、klrb1、cxcr6、thy1、samd3、txk、c5orf28、faslg、rgs11、ctsw、mid1、camk2b和cnbd2八个基因。23.所述13个gsdmd调节基因包含nlrp1、nlrp3、casp4、casp5、nlrc5、nlrp6、nlrp12、nlrp7、naip、nlrc4、aim2、ifi16、mefv、nlrp2和pycard八个基因。24.步骤三:计算炎性小体活性相关基因集irgs中五个基因集的irg评分,以所述训练样本数据集的基因表达数据为输入,用ssgsea算法计算每例样本的五个基因集的irg评分,基于每例样本的五个基因集的irg评分,利用非监督k‑均值聚类,对所述训练样本数据集进行分类,k‑均值聚类的参数设置为:模拟次数=100,距离=欧几里得距离,聚类后根据一致性数据将聚类数定为6。25.步骤四:确定六类炎性小体活性强弱及激活模式,根据步骤三中五个基因集的irg评分在不同类型中的分布情况,把训练样本数据集中的样本定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高。26.步骤五:靶向治疗敏感性分析,从肿瘤药敏数据库gdsc和ccle数据库获得细胞系数据的基因表达数据和相关药敏筛选数据,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到步骤四的六类炎性小体活性状态类型中,比较每种靶向药的ic50值在六类炎性小体活性状态类型中的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗。27.步骤六:免疫治疗敏感性分析,从免疫治疗数据库imvigor210corebiologies获得对应样本的基因表达和免疫治疗反应性数据,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于五个irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗。28.步骤七:待测样本的炎性小体活性状态分析,获得待测样本的基因表达数据,利用ssgsea算法计算待测样本的五个基因集的irg评分,基于待测样本的五个irg评分和训练样本数据集六类炎性小体活性状态类型标签,确定待测样本的炎性小体活性状态类型、是否braf靶向药抵抗和是否免疫治疗抵抗。29.本发明的有益效果是:一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集系统及方法,通过分析建立了一种能够预测肿瘤炎性小体活性状态及治疗敏感性的基因集,利用该基因集建立了一种预测系统及方法,该预测系统和方法基于样本训练数据集和五个基因集通过ssgsea算法、非监督k‑均值聚类和svm机器学习算法来建立预测模型,将样本分成一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低和六类‑炎性小体活性高‑il18高六种类型。并通过靶向治疗敏感性和免疫治疗敏感性分析,预测出二类‑炎性小体活性低‑il1b高为braf靶向药抵抗,而炎性小体活性状态越强的类型如五类‑炎性小体活性高‑il18低和六类‑炎性小体活性高‑il18高对于免疫治疗抵抗。该预测模型可高效的评估和识别出不同样本的炎性小体的活性状态,为分析炎性小体活性状态及不同炎性小体活性状态肿瘤的治疗敏感性提供一种新的基因集、预测系统和预测方法。附图说明30.图1是一种预测肿瘤炎性小体活性状态及治疗敏感性的系统的结构示意图。31.图2是一种预测肿瘤炎性小体活性状态及治疗敏感性的方法的流程示意图。32.图3是鼠原代胶质瘤免疫检查点阻断联合炎性小体活性抑制剂的治疗反应性结果图。33.图4是外部数据乳腺癌患者炎性小体活性状态分类预测图。具体实施方式34.为使本发明的技术方案更加清楚,下面将结合本发明的实施例,对实施例中的技术方案进行清楚、完整地描述,以下实施例用于说明本发明,但不用来限制本发明的范围。35.一种预测肿瘤炎性小体活性状态及治疗敏感性的基因集的构建过程:炎性小体活性信号主要涉及三个阶段,包括起始阶段(受炎性体复合物调控),加工阶段(受caspase‑1调控)和终末阶段(受gsdmd、il1b和il18调控)。从名称为nod‑likereceptorsandinflammasomes:areviewoftheircanonicalandnon‑canonicalsignalingpathways(archivesofbiochemistryandbiophysics670(2019)4–14)和theemergingrolesofinflammasome‑dependentcytokinesincancerdevelopment(emboreports(2019)20:e47575)的文献中收集了15个与炎症小体复合物相关的基因(称为炎症小体核心基因)。从名称为analysesofcaspase‑1‑regulatedtranscriptomesinvarioustissuesleadtoidentificationofnovelil‑1β‑,il‑18‑ꢀandsirtuin‑1‑independentpathways(lietal.journalofhematology&oncology(2017)10:40)的文献中的一项基于geo数据集的基因表达谱进行荟萃分析研究中识别出34个casp1调控基因和92个il1b调控基因。通过对geo号为gse64308,gse64309,gse64310的geo数据集进行了与前述相同的荟萃分析程序识别出8个il18调节的基因。相同荟萃分析未能发现gsdmd调节的基因。然后我们通过对geo号为gse126289的geo数据进行差异基因分析识别到13个gsdmd调节的基因。由上述的五个基因集组成炎性小体活性相关基因集(irgs)。36.炎性小体活性相关基因集(irgs)中五个基因集的基因组成如表1所列:表1基因集组成基因集基因名称基因集亚分类casp1tmem260casp1_up_regulated_genecasp1tifacasp1_up_regulated_genecasp1lsm4casp1_up_regulated_genecasp1cers2casp1_up_regulated_genecasp1plcg2casp1_up_regulated_genecasp1fam219acasp1_up_regulated_genecasp1lamtor3casp1_up_regulated_genecasp1klf11casp1_up_regulated_genecasp1ctshcasp1_up_regulated_genecasp1capza2casp1_up_regulated_genecasp1actl6acasp1_up_regulated_genecasp1c10orf11casp1_up_regulated_genecasp1klrb1casp1_up_regulated_genecasp1ubr1casp1_down_regulated_genecasp1ppp1r12bcasp1_down_regulated_genecasp1znf512bcasp1_down_regulated_genecasp1farp2casp1_down_regulated_genecasp1ppip5k1casp1_down_regulated_genecasp1phka1casp1_down_regulated_genecasp1bace1casp1_down_regulated_genecasp1mrps27casp1_down_regulated_genecasp1trappc12casp1_down_regulated_genecasp1tas1r3casp1_down_regulated_genecasp1cd247casp1_down_regulated_genecasp1cybrd1casp1_down_regulated_genecasp1pced1acasp1_down_regulated_genecasp1ap5m1casp1_down_regulated_genecasp1rmdn1casp1_down_regulated_genecasp1fbxo31casp1_down_regulated_genecasp1bloc1s6casp1_down_regulated_genecasp1atp10dcasp1_down_regulated_genecasp1fmo1casp1_down_regulated_genecasp1fkbp5casp1_down_regulated_genecasp1nntcasp1_down_regulated_geneil1badam17il1b_up_regulated_geneil1bslc11a2il1b_up_regulated_geneil1beregil1b_up_regulated_geneil1bcsf1il1b_up_regulated_geneil1besr1il1b_up_regulated_geneil1bbidil1b_up_regulated_geneil1bbach1il1b_up_regulated_geneil1btnfrsf1bil1b_up_regulated_geneil1bmapkapk3il1b_up_regulated_geneil1bifnar2il1b_up_regulated_geneil1bnfkb2il1b_up_regulated_geneil1bosmril1b_up_regulated_geneil1bbtn1a1il1b_up_regulated_geneil1birf5il1b_up_regulated_geneil1bgnaqil1b_up_regulated_geneil1bsulf2il1b_up_regulated_geneil1bslc7a11il1b_up_regulated_geneil1bslamf1il1b_up_regulated_geneil1bselpil1b_up_regulated_geneil1bnpy1ril1b_up_regulated_geneil1bprokr1il1b_up_regulated_geneil1bsod2il1b_up_regulated_geneil1bserpinb2il1b_up_regulated_geneil1brab32il1b_up_regulated_geneil1bptger4il1b_up_regulated_geneil1bstx11il1b_up_regulated_geneil1bigsf3il1b_up_regulated_geneil1barhgap27il1b_up_regulated_geneil1btbc1d9il1b_up_regulated_geneil1btnip1il1b_up_regulated_geneil1bslamf8il1b_up_regulated_geneil1bactr3bil1b_up_regulated_geneil1bpim1il1b_up_regulated_geneil1bmap3k8il1b_up_regulated_geneil1bpolr3kil1b_up_regulated_geneil1bbcl3il1b_up_regulated_geneil1bhoxd13il1b_up_regulated_geneil1bcdca2il1b_up_regulated_geneil1brnd1il1b_up_regulated_geneil1bcers5il1b_up_regulated_geneil1bgpr171il1b_up_regulated_geneil1bptgs2il1b_up_regulated_geneil1bnfatc2il1b_up_regulated_geneil1bb3gat1il1b_up_regulated_geneil1bch25hil1b_up_regulated_geneil1bil33il1b_up_regulated_geneil1bslc5a1il1b_up_regulated_geneil1bnfkbieil1b_up_regulated_geneil1bsocs3il1b_up_regulated_geneil1belf3il1b_up_regulated_geneil1bseleil1b_up_regulated_geneil1btnfaip2il1b_up_regulated_geneil1btlr2il1b_up_regulated_geneil1bchl1il1b_up_regulated_geneil1bccl2il1b_up_regulated_geneil1bsteap4il1b_up_regulated_geneil1bzc3h12ail1b_up_regulated_geneil1bil6il1b_up_regulated_geneil1bvcam1il1b_up_regulated_geneil1bnfkbizil1b_up_regulated_geneil1bcxcl1il1b_up_regulated_geneil1bccl20il1b_up_regulated_geneil1blacc1il1b_up_regulated_geneil1bznf608il1b_up_regulated_geneil1bgbp6il1b_up_regulated_geneil1blim2il1b_down_regulated_geneil1bhs3st2il1b_down_regulated_geneil1bcox5bil1b_down_regulated_geneil1bpde4bil1b_down_regulated_geneil1bascl2il1b_down_regulated_geneil1behd2il1b_down_regulated_geneil1bscn3ail1b_down_regulated_geneil18sc5dil18_up_regulated_geneil18dync2h1il18_up_regulated_geneil18bcl9lil18_up_regulated_geneil18alg9il18_up_regulated_geneil18tmem25il18_up_regulated_geneil18nxpe4il18_up_regulated_geneil18ift46il18_down_regulated_geneil18rnf214il18_down_regulated_genegsdmdcd226gsdmd_up_regulated_genegsdmdklrb1gsdmd_up_regulated_genegsdmdcxcr6gsdmd_up_regulated_genegsdmdthy1gsdmd_up_regulated_genegsdmdsamd3gsdmd_up_regulated_genegsdmdtxkgsdmd_up_regulated_genegsdmdc5orf28gsdmd_up_regulated_genegsdmdfaslggsdmd_up_regulated_genegsdmdrgs11gsdmd_up_regulated_genegsdmdctswgsdmd_up_regulated_genegsdmdmid1gsdmd_up_regulated_genegsdmdcamk2bgsdmd_down_regulated_genegsdmdcnbd2gsdmd_down_regulated_geneinflammasomenlrp1inflammasome_hubgeneinflammasomenlrp3inflammasome_hubgeneinflammasomecasp4inflammasome_hubgeneinflammasomecasp5inflammasome_hubgeneinflammasomenlrc5inflammasome_hubgeneinflammasomenlrp6inflammasome_hubgeneinflammasomenlrp12inflammasome_hubgeneinflammasomenlrp7inflammasome_hubgeneinflammasomenaipinflammasome_hubgeneinflammasomenlrc4inflammasome_hubgeneinflammasomeaim2inflammasome_hubgeneinflammasomeifi16inflammasome_hubgeneinflammasomemefvinflammasome_hubgeneinflammasomenlrp2inflammasome_hubgeneinflammasomepycardinflammasome_hubgene荟萃分析具体过程为:针对于收集到的具有分组信息的geo数据集,我们首先通过limma这个r包进行差异分析。然后,对于各geo数据集中的每个基因,我们使用metama这个r包中的效应大小函数计算效应大小。紧接着,我们使用metama包中的directescombi函数在多个geo数据集中合并了无偏效应大小及其方差,同时使用benjamini‑hochberg方法对p值进行校正。最后校正后p值小于0.05的基因被纳入最后的研究。37.差异基因分析过程:根据geo数据集样本分组信息构建比较矩阵,接着将比较矩阵和表达谱数据逐步代入limma包的lmfit和ebayes函数进行分析,最后通过toptable函数输出差异分析结果。38.图1示出了一种预测肿瘤炎性小体活性状态及治疗敏感性的系统的结构示意图,图中,这种采用所述基因集预测肿瘤炎性小体活性状态及治疗敏感性的系统包含数据输入模块、数据分析模块和输出模块,数据分析模块与数据输入模块和输出模块数据通信连接,数据输入模块用于输入训练样本数据集的基因表达数据、从肿瘤药敏数据库gdsc和ccle数据库获得的细胞系的基因表达数据和相关药敏筛选数据、从免疫治疗数据库imvigor210corebiologies获得的对应样本的基因表达和免疫治疗反应性数据、待测样本的基因表达数据。39.训练样本数据集包含肿瘤基因组图谱tcga数据库获得的33类肿瘤类型共9881例数据。数据分析模块包含炎性小体活性状态分类模块、靶向治疗分析模块和免疫治疗分析模块。40.炎性小体活性状态分类模块首先以训练样本数据集的基因表达数据为输入,采用ssgsea算法计算训练样本数据集中每例样本的炎性小体活性相关基因集irgs的评分,根据评分利用非监督k‑均值聚类对炎性小体活性状态进行分类,根据分类结果将炎性小体活性状态定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高,然后以待测样本的基因表达数据为输入,得到待测样本的炎性小体活性状态类型。41.靶向治疗分析模块首先以细胞系的基因表达数据和相关药敏筛选数据为输入,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到六类炎性小体活性状态类型中,比较每种靶向药的ic50值在六类炎性小体活性状态类型中的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否braf靶向药抵抗。42.免疫治疗分析模块首先以对应样本的基因表达和免疫治疗反应性数据为输入,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗,然后根据待测样本的炎性小体活性状态类型,确定待测样本是否免疫治疗抵抗。43.输出模块用于输出待测样本的炎性小体活性状态类型、是否braf靶向药抵抗和是否免疫治疗抵抗。44.数据输入模块、数据分析模块和输出模块均采用现有的用于输入、输出和分析装置。45.图2示出了一种预测肿瘤炎性小体活性状态及治疗敏感性的方法的流程示意图。图中,这种预测肿瘤炎性小体活性状态及治疗敏感性的方法包含以下步骤:步骤一:获取训练样本数据集,从肿瘤基因组图谱tcga数据库获得训练样本数据集,所述训练样本数据集包括33类肿瘤类型共9881例数据,所述9881例数据包含每例样本的基因突变数据、基因拷贝数变异数据、基因表达数据和临床信息数据。46.步骤二:构建炎性小体活性相关基因集,该炎性小体活性相关基因集采用上述构建的炎性小体活性相关基因集irgs。47.步骤三:以步骤二的五个irgs基因集的tcga基因表达数据为输入,利用ssgsea算法分别计算五个基因集的irg评分,基于五个基因集的irg评分,利用非监督k‑均值聚类,对训练样本数据集进行分类。参数如下:模拟次数=100;距离=欧几里得距离。聚类后根据一致性数据将聚类数定为6。对5个评分进行tumormap分析发现,聚类数为6时,可以很好地把各类患者分开。48.步骤四:6类炎性小体活性强弱及激活模式确定,根据五个irg评分在不同类型中分布情况,把样本定义为一类‑炎性小体活性低‑il1b低、二类‑炎性小体活性低‑il1b高、三类‑炎性小体活性中‑casp1高、四类‑炎性小体活性中‑il18高、五类‑炎性小体活性高‑il18低、六类‑炎性小体活性高‑il18高。49.步骤五:靶向治疗敏感性分析,从肿瘤药敏数据库gdsc及ccle数据库获得细胞系数据的基因表达数据和相关药敏筛选数据,利用ssgsea算法计算细胞系的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分将细胞系分类到步骤四所述的六类炎性小体活性状态类型中去,比较每种靶向药的ic50值在六类炎性小体活性状态类型的大小,确定二类‑炎性小体活性低‑il1b高倾向于braf靶向药抵抗。50.步骤六:免疫治疗敏感性分析,从免疫治疗数据库imvigor210corebiologies获得样本的基因表达和免疫治疗反应性数据,利用ssgsea算法计算对应样本的五个基因集的irg评分,通过svm机器学习算法,基于五个基因集的irg评分预测imvigor210corebiologies数据库中患者的炎性小体活性状态类型,比较炎性小体活性状态类型间的免疫治疗反应情况,确定炎性小体活性增强型为免疫治疗抵抗。51.步骤七:待测样本的炎性小体活性状态分析,获得待测样本的基因表达数据,利用ssgsea算法计算待测样本的五个基因集的irg评分,基于待测样本的五个基因集的irg评分和tcga样本六类炎性小体活性状态类型标签,预测待测样本的炎性小体活性状态类型,通过步骤五和步骤六的svm机器学习算法来预测待测样本是否braf靶向药抵抗和是否免疫治疗抵抗。52.为了通过五个炎性小体活性相关评分来预测外部数据集中样本的炎症小体活性状态类型,我们使用了两层验证策略来比较六种机器学习算法的预测准确性,这些算法包括分类和回归树(cart),逻辑回归(lr),线性判别分析(lda),kneighbors分类器(knn),高斯nb(nb)和支持向量机(svm)。简而言之,将tcga样本随机分为训练集(80%)和验证集(20%)。然后使用训练集通过五次交叉验证过程来比较六种算法的预测准确性,以克服过度拟合的问题。使用验证集作为外层评估进一步评估了六种算法的准确性。最后,两层验证策略中具有最高预测精度的是svm算法。53.实施例1从鼠自发瘤模型(sb模型)中提取原代鼠胶质瘤细胞(sb1),对鼠原代胶质瘤细胞sb1进行测序,获得其基因表达谱,按照具体实施方式中的步骤七对鼠原代胶质瘤细胞sb1的基因表达谱进行分析,确定鼠原代胶质瘤细胞sb1属于五类‑炎性小体活性高‑il18低。利用小鼠立体定向技术,将sb1原位种植于小鼠脑中,对其分别进行免疫检查点治疗和使用mb抑制五类‑炎性小体活性高‑il18低型中的炎性小体活性,一组对比不同治疗方法小鼠的存活期。另外一组,在15天时处死小鼠,将小鼠脑组织取出,多聚甲醛固定,石蜡包埋切片,采用苏木精—伊红染色法检测肿瘤大小。54.图3是鼠原代胶质瘤免疫检查点阻断联合炎性小体活性抑制剂治疗效果对比图,其中,图a是经治疗后生存期对比图,图b是治疗后肿瘤大小对比图,图中, pbs是加pbs的对照组, antipd‑l1ab是免疫检查点治疗组, antipd‑l1ab&mb是免疫检查点阻断联合炎性小体活性抑制剂治疗组。从图中可以看出,五类‑炎性小体活性高‑il18低型鼠原代胶质瘤经免疫检查点联合炎性小体活性抑制剂治疗后肿瘤明显缩小,小鼠的生存期延长。通过mb抑制五类‑炎性小体活性高‑il18低型中的炎性小体活性可以提高免疫检查点治疗的治疗效果。可见,这种预测肿瘤炎性小体活性状态及治疗敏感性的方法能够准确预测炎性小体的活性状态。55.实施例2我们通过cbioportal数据库(http://www.cbioportal.org/datasets)下载了168例乳腺癌基因表达数据,通过具体实施方式中的步骤七对其进行分析,可将168例乳腺癌预测为六种炎性小体活性状态类型中四种。同时,按照步骤四对分类后的四组炎性小体活性状态类型进行分析。56.图4是外部数据乳腺癌患者炎性小体活性状态分类预测结果,其中,a是炎性小体活性状态分类预测结果及生物功能相关进程及通路的评分在不同类型中分部情况,b是五个炎性小体活性相关的评分在不同分类中分布情况,c是免疫微环境相关的评分在不同类型中的分布情况。根据图4,外部数据乳腺癌患者被分在六种炎性小体活性状态类型中四种(二类、三类、四类及五类),我们发现三到五类属于炎性小体增强型,增强型的类型具有更强的免疫抑制状态。可以看出,168例乳腺癌患者的表达谱特征符合一、二类炎性小体活性弱,三、四类炎性小体活性中度增强,五、六类炎性小体活性高度增强,且符合炎性小体活性增强型具有更强的免疫抑制特征。57.gdsc是药敏数据库,从细胞系的表达谱数据,就可以计算对应的五个irg评分,然后将其分为六种炎性小体活性状态类型,比较每种药物在六种不同炎性小体活性状态类型中的敏感性情况,从而得到治疗敏感性。imvigor210corebiologies是免疫治疗数据库,从接受免疫治疗的患者的表达谱中计算对应的五个irg评分,将其分类,然后比较每类患者中,免疫治疗的反应率,从而得到每类间质化类型的免疫治疗(免疫检查点阻断治疗)敏感或抵抗。之后任意样本的数据代入模型中,得到分类。然后根据gdsc和imvigor210corebiologies数据库分析出来的特性,来预测这个样本的特性。58.imvigor210corebiologies数据库中患者信息中有抗pd‑l1的治疗反应结果,通过卡方检验不同炎性小体活性状态类型中抗pd‑l1治疗反应或抵抗分布情况,发现炎性小体活性越强的类型包括更多治疗无反应的患者。59.ic50是gdsc数据库自带的,就是评价某个药在某一个细胞系中的药物敏感性。通过wilcoxon检验来比较某一个药在某一类和其他所有类细胞系中药敏指标ic50的差异,某药ic50在某一类中的中位值越高,同时校正后p值小于0.05,说明这一类细胞系对该药更抵抗。其他类没找到典型明显抵抗或敏感的药。当前第1页12当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。