1.本发明涉及哺乳动物特别是人类的辅助生殖领域。具体的,本发明涉及哺乳动物包括人类的胚胎细胞的体外培育方法和培养基。
背景技术:
2.因年龄增加而导致生殖力下降的现象称为生殖衰老。生殖衰老导致卵巢皮质卵泡内卵母细胞数量和质量的逐渐下降。与年龄相关的生育能力下降不仅是因为卵母细胞池减少,也因为卵母细胞质量下降。卵母细胞来源于原始生殖细胞,在生发泡阶段(gv期)停滞,需要经历染色质浓缩和核膜分离进入生发囊泡破裂阶段才获得受精和胚胎发生的能力。染色体分离后,卵母细胞排出第一极体(pb1),然后停在第二次减数分裂中期ⅱ(mii)阶段,等待受精直至胚胎生成。然而,老年女性从卵母细胞gv阶段到mii阶段的卵母细胞成熟率非常低。尽管配子冷冻保存和卵巢组织技术可以帮助女性怀孕,但这些策略无法推迟更年期或改善卵巢功能。胚胎发育年龄相关影响根源于卵母细胞的成熟。因此,旨在改善卵母细胞成熟的新治疗策略将显著影响用于延迟卵巢衰老和延长生殖时间的方法。
3.在过去几十年中,体外受精-胚胎移植(ivf-et)为人类乃至其它物种的不孕问题提供了重要的解决手段。受精和胚胎移植之间需要对胚胎进行培养。现有的技术存在卵母细胞和胚胎的发育能力不足,引起早期胚胎移植后发育缓慢乃至怀孕失败的问题。
4.槲皮素(3,3
′
,4
′
,5、7-五羟基黄酮)是一种天然类黄酮化合物,主要存在于浆果,西兰花,苹果和洋葱中。据报道,槲皮素可通过激活daf-16的抗氧化能力使线虫的寿命延长15%,并在werner综合征和人类间充质干细胞中通过改善细胞增殖和恢复异染色质结构来减缓衰老。槲皮素和达沙替尼的联合使用已被证明具有延长寿命,改善身体机能,并且可以防止子宫衰老相关的功能障碍和纤维化。
5.纺锤体/染色体的形态和皮质颗粒的分布是评估卵母细胞成熟的重要预测指标。纺锤体/染色体和cgs异常率的增加导致卵母细胞成熟的阻止和劣质卵母细胞的形成。线粒体功能是卵母细胞成熟的决定因素,对于正常的细胞功能至关重要,例如能量产生,钙稳态,氧化磷酸化,信号转导和凋亡,可确定卵母细胞的发育潜能。衰老会削弱抗氧化防御系统并增加线粒体活性氧(ros)。
6.去乙酰化酶(sirtuins,sirt1-sirt7)家族蛋白提供nad
-依赖的脱乙酰基酶活性,并在哺乳动物的许多生理过程中显示出不同的功能。先前的研究表明,sirtins可以延长寿命并介导身体的抗衰老功效运动和热量限制。sirt3主要位于线粒体,可调节线粒体蛋白质乙酰化,与卵母细胞体外成熟和受精过程中的营养状况以及能量稳态相协调。线粒体sod2通过其乙酰化酶活性在降低ros的产生中起着至关重要的作用。已知sirt3可以增强foxo3a调节sod2和过氧化氢酶的活性。
7.本领域还需要对包括人在内的哺乳动物的胚胎和卵母细胞发育有更多更深的研究工作,也需要获得更好的在哺乳动物特别是人的胚胎的体外培育中能够增强卵母细胞体外成熟和胚胎发育潜力的方法的培养基,从而改善哺乳动物特别是老年哺乳动物的受精和
胚胎移植。
技术实现要素:
8.本发明首次证明了槲皮素对哺乳动物特别是老年哺乳动物的胚胎细胞的成熟和维持良好的质量非常重要,并且发现了槲皮素改善哺乳动物特别是老年哺乳动物的胚胎细胞的成熟和质量的机理,同时发现在培养基中补充槲皮素提高了哺乳动物特别是老年哺乳动物的胚胎细胞成熟和改善。由此,发明人提供了哺乳动物包括人类的用于胚胎细胞体外培植的方法,以及提供了哺乳动物包括人类的用于胚胎细胞体外培植的培养基。
9.具体的,本发明提供了一种体外培养哺乳动物胚胎细胞的培养基,其包含槲皮素。
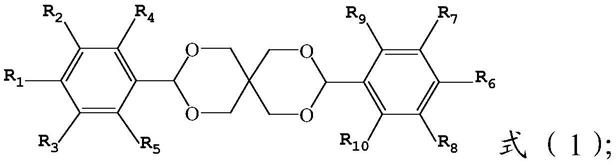
10.槲皮素,即3,3
′
,4
′
,5、7-五羟基黄酮,其具有如下分子式:
[0011][0012]
在本发明中,所述哺乳动物可以为任何哺乳动物,包括和不限于啮齿目(如小鼠和大鼠),兔形目(兔子)、食肉目(猫科动物和犬科动物)、偶蹄目(牛科动物和猪科动物)、奇蹄目(马科动物),或为灵长目和猿猴亚目(人或猴)。所述哺乳动物优选为人或小鼠或大鼠。
[0013]
本发明的胚胎细胞培养基可用于在体外培养或收集或操作卵母细胞、受精卵、胚胎和/或干细胞。
[0014]
在本发明的其中一个方面,本发明提供了一种用于体外培养哺乳动物胚胎细胞的培养基,其包含约1-50μm槲皮素。在本发明的其中又一个方面,所述细胞培养基中包含约5-20μm槲皮素。在本发明的其中又一个方面,所述细胞培养基中包含约10μm槲皮素。在本发明的其中一个方面,所述槲皮素的含量是指工作浓度,即在胚胎细胞培养环境中的浓度。在有些情况下,本发明的培养基中的槲皮素以工作浓度倍数的含量存在。例如,为了便于储存或操作,培养基以其含有的物质的5倍或10倍工作浓度提供,在使用时加入水/溶液/培养液进行稀释使用。
[0015]
在本文中,胚胎可具有宽泛的定义,包括卵母细胞(gv\mi\mii期)阶段,使卵母细胞受精,桑椹胚、囊泡阶段、孵化和植入的所有发育阶段。
[0016]
胚胎的发育一般包括以下阶段:卵母细胞、受精的卵母细胞、合子、2-细胞、4-细胞、8-细胞、16-细胞、紧贴(compaction)、桑椹胚、囊泡、扩张的囊泡和孵化囊泡,以及之间的阶段(如3-细胞或5-细胞)。
[0017]
在本文中,胚胎细胞可包括卵母细胞(gv\mi\mii期)、受精的卵母细胞、合子、2-细胞、4-细胞、8-细胞、16-细胞、桑椹胚、囊泡、扩张的囊泡和孵化囊泡,以及之间的阶段的细胞(如3-细胞或5-细胞)。
[0018]
在本发明的其中一个方面,所述胚胎细胞培养基适用于培养卵母细胞,包括gv期、mi期、mii期的卵母细胞。在本发明的其中一个方面,所述胚胎细胞培养基适用于培养gv期
卵母细胞。在本发明的其中一个方面,所述胚胎细胞培养基适用于培养mii期的卵母细胞。
[0019]
在本发明的其中一个方面,本发明的胚胎细胞培养基适用于培养早期胚胎,即到囊泡阶段的胚胎。例如包括合子、2-细胞期胚胎、4-细胞期胚胎、8-细胞期胚胎、16-细胞期胚胎、桑椹胚或囊泡。
[0020]
用于不同时期的胚胎的培养基的成分可以针对该时期的胚胎的发育特点和需要具有不同的营养物或促生长因子。
[0021]
在本发明的其中一个方面,所述胚胎细胞培养基适用于培养具有较高生育年龄的哺乳动物(包括人类)的胚胎细胞。对人类而言,所述胚胎细胞培养基适用于培养中育龄或高育龄甚至超高育龄的女性的胚胎细胞。人类的合适育龄一般是指15-49岁。中育龄或高育龄女性一般指28岁以上女性。
[0022]
本发明提供的胚胎培养基还含有以下的一种或多种其它化合物:无机盐、能量源、氨基酸、蛋白质、细胞因子、螯合剂、抗生素、透明质酸、生长因子、激素、维生素和gm-csf。
[0023]
其中,无机盐可以是在水溶液中解离成无机离子的无机盐。合适地,无机盐可以是包含一种或多种以下无机离子的无机盐:na
、k
、cl-、ca
2
、mg
2
、so
42-、或po
43-。
[0024]
其中,取决于胚胎的发育阶段,能量源可以是丙酮酸、乳酸或葡萄糖等。例如能量源需求从直至8-细胞阶段为止的胚胎为丙酮酸-乳酸偏好,逐步演化为在从8-细胞发育到囊泡的胚胎基因组激活之后的葡萄糖偏好。
[0025]
其中,蛋白质来源可以是白蛋白或合成血清。用于蛋白质补充的合适的来源包括人血清、人脐带血清(hcs)、人血清白蛋白(hsa)、胎牛血清(fcs)或牛血清白蛋白(bsa)。
[0026]
在本发明的其中一个方面,一种或多种另外的化合物可以是缓冲溶液。合适的缓冲溶液例如包括hepes缓冲液或mops缓冲液。
[0027]
在本发明的其中一个方面,一种或多种另外的化合物可以是背景培养基。即本发明提供的胚胎培养基是在背景培养基中增加槲皮素。背景培养基是指可用的适合于培养卵母细胞、配子、胚胎或干细胞的培养基,例如商业上提供的基本培养基、简单培养基或补充培养基,包括而不限于:卵母细胞培养基、配子处理培养基(包含配子收集培养基)、用于胞质内精子注射(icsi)的培养基、受精培养基、单一步骤胚胎培养基、胚胎转移培养基、精子制备和受精培养基,或用于合子或胚胎的任何其它合适的培养基。可以举出的例子包括g-1
tm
、g-2
tm
、hsa-solution tm
、g-mops tm plus、g-mops tm
、embryo glue tm
、icsi tm
或g-tl tm
或其组合,这些产品可从vitrolife ab,瑞典获得。
[0028]
在本发明的其中又一个方面,其中所述背景培养基是卵母细胞培养基。例如是m2培养基或m16培养基。所述培养基可购自sigma-aldrich,inc.。举例来说,所述背景培养基是m16培养基,其主要成分和含量如下:
[0029][0030]
在本发明的其中又一个方面,其中所述背景培养基是ivm培养基,例如199培养基。
[0031]
在本发明的其中又一个方面,其中所述背景培养基是ivf培养基,例如为g1-ivf培养基,包括g1-ivf或g2-ivf培养基等。所述培养基可购自vitrolife ab,瑞典。
[0032]
在本发明的另一方面,本发明提供了哺乳动物的胚胎细胞的体外培养方法,其中在培养基中加入槲皮素。在本发明的其中又一个方面,在所述体外培养方法中,在培养基加入约1-50μm槲皮素。在本发明的其中又一个方面,在培养基加入约5-20μm槲皮素。在本发明的其中又一个方面,在培养基加入约10μm槲皮素。
[0033]
在本发明的其中又一个方面,本发明的方法适用于培养卵母细胞,包括gv期、mi期、mii期的卵母细胞。所述方法包括在培养卵母细胞的培养基中加入槲皮素的步骤。在本发明的其中一个方面,所述方法适用于培养gv期卵母细胞。在本发明的其中一个方面,所述方法适用于培养mii期的卵母细胞。
[0034]
在本发明的其中又一个方面,本发明的方法适用于培养早期胚胎,即到囊泡阶段的胚胎,例如为合子、2-细胞期胚胎、4-细胞期胚胎、8-细胞期胚胎、桑椹胚或囊泡。在本发明的其中一个方面,所述方法包括在所述早期胚胎的培养基中加入槲皮素的步骤。在本发明的其中一个方面,所述方法包括在胚胎的合子、2-细胞期胚胎、4-细胞期胚胎、8-细胞期胚胎、桑椹胚或囊泡阶段加入槲皮素的步骤。在本发明的其中一个方面,所述早期胚胎是指合子或2-细胞期胚胎。
[0035]
在本发明的另一方面,本发明提供了槲皮素在用于制备体外培养哺乳动物的胚胎的组合物中的用途。在本发明的其中又一个方面,所述槲皮素的浓度为约1-50μm。在本发明的其中又一个方面,所述槲皮素的浓度为约5-20μm。在本发明的其中又一个方面,所述槲皮素的浓度为约10μm。在本发明的其中又一个方面,其中所述组合物用于培养卵母细胞(gv\mi\mii期)或早期胚胎,即到囊泡阶段的胚胎,例如为合子、2-细胞期胚胎、4-细胞期胚胎、8-细胞期胚胎、桑椹胚或囊泡。
[0036]
在本发明的另一方面,本发明提供了槲皮素用于提高具有较高生育年龄的哺乳动物包括人类的生育能力的方法。在所述方法中,包括让所述哺乳动物包括人类服用槲皮素。在本发明的另一方面,本发明提供了槲皮素在用于制备提高哺乳动物包括人类的生育能力
的药物中的用途。在本发明的其中一个方面,本发明特别适用于提高具有较高生育年龄的哺乳动物(包括人类)的的生育能力。对人类而言,本发明适用于中育龄或高育龄甚至超高育龄的女性的胚胎细胞。人类的合适育龄一般是指15-49岁。中育龄或高育龄女性一般指28岁以上女性。
[0037]
在本文中,在提供数值范围的情况下,应该理解,除非上下文清楚地另外指明,否则在所述范围内的任何规定值或中间值与该规定范围内的任何其他规定值或中间值之间的每个较小范围包含在本公开内。本文中的“约”表示其描述的数值包括了在其领域技术人员理解的范围内的正常浮动。一般而言,“约”表示
±
10%。在某些情况下,“约”表示
±
5%。在某些特定情况下,“约”表示
±
1%。
附图说明
[0038]
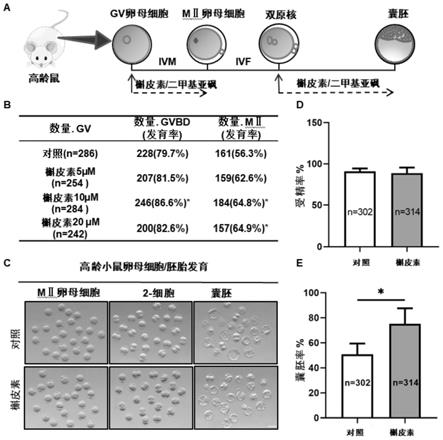
图1显示槲皮素可改善老年小鼠的卵母细胞成熟和早期胚胎发育。(a)实验流程和方法的示意图,显示在有或没有槲皮素处理的情况下卵母细胞到胚胎早期发育直至囊泡期的时间线。(b)在0、5、10和20μm槲皮素存在下对gvbd和mⅱ发育率分析。(c)卵母细胞和胚胎体外培养的代表性图像。比例尺,100μm。(d)有或没有10μm槲皮素处理的受精率的定量分析。(e)有或没有10μm槲皮素处理的囊泡形成率的定量分析。数据表示为来自三个独立实验的平均百分比
±
sd,其中分析了至少100个卵母细胞。n显示卵母细胞数。*,相对于对照,p<0.05;**,相对于对照,p<0.01。
[0039]
图2显示槲皮素改善衰老小鼠的卵母细胞质量。(a)在有或没有10μm槲皮素处理的老年小鼠卵母细胞中纺锤体/染色体组织的代表性图像。纺锤体用α微管蛋白抗体染色(绿色),染色体用dapi(4',6-二脒基-2-苯基吲哚)复染(蓝色)。比例尺,20μm。(b)有或没有槲皮素处理的皮质下颗粒(cg)分布。卵母细胞中的cgs用小扁豆凝集素(lca)-fitc(异硫氰酸荧光素:绿色)染色,染色体用dapi(蓝色)染色。比例尺,25μm。(c)定量有或没有槲皮素处理的异常纺锤体/染色体卵母细胞。(d)槲皮素处理后,cgs异常分布的卵母细胞比例。数据是至少3个独立实验的均值
±
sd。*,相对于对照,p<0.05;**,与对照相比,p<0.01;学生的t检验。
[0040]
图3显示使用或不用槲皮素处理的卵母细胞的全基因组转录分析。(a)槲皮素处理后卵母细胞mrna表达的热图,显示了一部分基因的变化。(b)槲皮素处理后差异基因表达的基因本体论(go)分析。(c)定量rt-pcr验证rna-seq数据。数据为来自三个独立实验的平均值
±
sd。*p<0.05。
[0041]
图4显示槲皮素改善老年小鼠卵母细胞的线粒体功能异常。(a)有或没有槲皮素处理的卵母细胞的线粒体的共焦显微照片。线粒体用mitotracker-red染色。(b)共焦图像显示有或没有槲皮素处理的卵母细胞的线粒体膜电位(mmp)jc-1染色强度。对同一个卵母细胞分别在tritc通道(红色荧光)和fitc通道(绿色荧光)中观察。比例尺,25μm。(c1)槲皮素处理组线粒体的代表性电子显微照片。箭头表示卵母细胞,其中平滑内质网(ser)囊泡明显肿胀。(c2)为c1的方框区域,更高放大倍数下的线粒体清晰可见线粒体嵴(mc),外膜(om)、内膜(im)和膜间空间(ims)的清晰结构。(c3)对照组线粒体的代表性显微照片。(c4)和(c5)为c3的方框区域,更高放大倍数下的线粒体的超微结构异常(包括线粒体液泡(mv),膜间空间(ims)变窄和髓磷脂。(d)卵母细胞中线粒体异常分布的百分比。(e)通过用特异性探针
jc-1染色定量分析mmp(红色/绿色荧光强度)。(f)有或没有槲皮素处理的小鼠卵母细胞内三磷酸腺苷(atp)含量。(g)ivm后使用或不用槲皮素处理的mii期卵母细胞异常线粒体的定量分析。数据表示为异常线粒体的平均百分比
±
sd。每组来自5只小鼠的10个卵母细胞。数据是至少3次独立实验的平均值
±
sd,n表示卵母细胞数。*,相对于对照,p<0.05;**,相对于对照,p<0.01。
[0042]
图5显示槲皮素减少老年小鼠的ros积累和卵母细胞凋亡。(a)对照和槲皮素处理的卵母细胞中cm-h2dcfda荧光的代表性图像(绿色)。比例尺=100μm。(b)共聚焦图像tunel实验,用于检查对照和槲皮素处理的卵母细胞。绿色荧光指示tunel阳性卵母细胞。(c)共聚焦图像显示对照和槲皮素处理的活性半胱天冬酶3的水平。(d)共聚焦图像,显示对照和槲皮素处理的卵母细胞的自噬体(lc3-ii,点状)。(e)蛋白质印迹分析显示,与年轻小鼠相比,老年小鼠卵母细胞中sirt3表达降低。微管蛋白用作内部对照。(f)确定sirt3敲低是否介导卵母细胞表型上sod2k68的乙酰化水平的实验方案的示意图。(f)通过免疫荧光测定的对照和槲皮素处理的卵母细胞的活性caspase-3的相对水平。(g)槲皮素可降低老年小鼠的sirt3表达,从而降低sod2k68的乙酰化水平。(h)在对照和槲皮素处理的卵母细胞中ros荧光强度。(i)在对照和槲皮素处理的卵母细胞中凋亡阳性卵母细胞的百分比。(j)通过免疫荧光在对照和槲皮素处理的卵母细胞中测定的半胱天冬酶3。(k)在使用或不用槲皮素处理的卵母细胞中lc3强度的定量。(l)蛋白质印迹分析显示,与年轻小鼠相比,老年小鼠卵母细胞中ssirt3表达降低。(m)显示sod2k68的乙酰化水平的荧光强度的定量分析。(n)注射sictrl,sisirt3和sisirt3 槲皮素后ros荧光强度的定量分析。比例尺=25μm。dna用dapi染色。数据是至少3次独立实验的平均值
±
sd,n表示卵母细胞数。*,相对于对照,p<0.05,**,相对于对照,p<0.01。
[0043]
图6显示槲皮素改善人体外胚胎发育。(a)实验流程和方法的示意图。给出了使用或不用槲皮素处理的人类卵母细胞和早期胚胎发育直至囊泡期的时间线。(b)槲皮素处理后改善了人类胚胎的gv卵母细胞的pb1挤出。(c)槲皮素处理后改善了人类胚胎的gvbd卵母细胞的pb1挤出。(d)槲皮素处理后提高了人类胚胎的受精率和囊泡形成。(e)在培养基中有或没有槲皮素的体外培养后胚胎的形态。比例尺,100微米。n显示卵母细胞/胚胎的数量。*,相对于对照,p<0.05。
具体实施方式
[0044]
下面将结合实施例进一步说明本发明的实质内容和有益效果,该实施例仅用于说明本发明而非对本发明的限制。
[0045]
实施例1
[0046]
患者征集和伦理审查
[0047]
本技术的研究获得山东大学生殖医学研究所审查委员会审批([2018]伦理审批#41)。本技术所述的所有方法均按照山东大学生殖医学研究所批准的指南和条例进行。与人类有关的实验前都获得每名病人签署了正式知情同意书。
[0048]
实施例2实验方法和试剂
[0049]
卵母细胞和胚胎的采集
[0050]
9-10个月的雌性昆明小鼠(此阶段生育力急速衰退)用作自然衰老小鼠模型;6-8
周龄的雌性小鼠也用于实验。在具有温控以及设置为12d:12l(黑暗与光明)的房间中饲养,自由饮用水和食物。为了获得完整的gv卵母细胞,给小鼠腹膜内注射10iu孕马血清促性腺激素(pmsg)(购自中国宁波三生生物科技有限公司)以刺激卵泡,46-48小时后破裂窦卵泡收集卵丘封闭的卵母细胞。然后将卵母细胞在6%co2、5%o2、90%n2,37℃下在m16培养基(sigma-aldrich)中培养,用矿物油覆盖,培养4h或16h,以确定gvbd比例和第一极体(pb1)排出速率。为了诱导超排卵,在腹膜内注射10iu pmsg的48小时后注射10iu人绒毛膜促性腺激素(hcg)(pmsg和hcg均购自中国宁波三生生物科技有限公司)。16小时后,杀死超排卵小鼠,破裂输卵管壶腹部释放卵丘-卵母细胞复合体(coc),随后将其与成年雄性昆明小鼠的精子结合。受精卵在6%co2、5%o2和90%n2,37℃下在g-ivf(vitrolife,sweden)培养基中培养,并用矿物油覆盖,以观察它们的胚胎发育潜能。
[0051]
卵母细胞和胚胎的槲皮素处理和微注射
[0052]
将槲皮素(q4951sigma-aldrich)溶解在dmso中,并稀释至5μm,10μm和20μm的终浓度。dmso的终浓度小于0.05%。对于体外成熟(ivm)实验,将gv卵母细胞洗涤至少3次,然后立即在添加不同浓度槲皮素或不包含槲皮素的m16中培养,以观察其卵母细胞在16小时后的成熟率。对于体外受精(ivf)实验,将胚胎在添加或不添加10μm槲皮素的g1-ivf和g2-ivf培养基(vitrolife,瑞典)中进行培养。受精卵母细胞在12h后发育至2细胞阶段,在4.5d后发育至囊泡阶段。用立体显微镜(nikon smz1500)检查胚胎的发育和形态。对于显微注射,在添加或不添加10μm槲皮素的敲除实验中,将约10μl靶向sirt3的sirna(10ng/μl)注入gv期卵母细胞,在对照加入等量的无rnase水,直至16小时后发育至mⅱ期。sirna从ribobio获得,序列如表1所示。
[0053]
人类受精卵的槲皮素处理和培养
[0054]
从57位22至42岁的患者中收集了多余的gv/gvbd卵母细胞,随机分为的两组,分别添加或不添加10μm槲皮素,在37℃,6%co2、5%o2和90%n2下培养。将它们在ivm培养基(199培养基,购自gibco/life technologies,美国)中培养24小时,同时补充0.29mmol/l丙酮酸钠(sigma,美国),10%人血清白蛋白(vitrolife,瑞典),0.075iu/ml重组卵泡刺激素(fsh,merck serono,瑞士),0.15iu/ml hcg和10ng/ml表皮生长因子(egf,sigma,美国)。对mⅱ期卵母细胞的数量进行计数,核成熟的标准是第一极体的排出。成熟后,mi卵母细胞用于卵胞浆内单精子显微注射技术(intracytoplasmic sperm injection,icsi)实验,icsi在倒置显微镜(日本尼康)上进行。合子顺序采用培养基g1-ivf和g2-ivf培养基(vitrolife,瑞典),并在6%co2、5%o2和90%n2中于37℃孵育。在发育的不同阶段对受精卵进行显微照相。在16-18小时后评估受精,在受精后第5-6天后评估囊胚形成;根据gardner标准评估囊泡期。
[0055]
卵内活性氧(reactive oxygen species,ros)的测量
[0056]
收集在有或没有10μm槲皮素处理的卵母细胞,然后在补充10mm羧基-h2dcf双乙酸盐(s0033,beyotime,中国)的m2中于37℃下培养30分钟。在m2培养液中洗涤至少3次后,在共聚焦显微镜(dragonfly,andor technology,uk)上以相同的设置通过在488nm激发对卵母细胞进行拍照。用image j软件(美国国立卫生研究院)对每个卵母细胞进行荧光强度分析。
[0057]
卵母细胞胞质atp含量的测定
[0058]
使用enspire multimode plate reader(perkinelmer,美国)和基于萤光素-萤光素酶反应的试剂盒(bioluminescent somatic cell assay kit,sigma)进行测量。首先生成标准曲线,其中包含从10fmol到10pmol的11种atp浓度。在检测卵母细胞中atp含量之前振荡5秒钟。对于每个实验,至少采用60个卵母细胞。使用从标准曲线的线性回归得出的公式计算出atp含量。
[0059]
免疫荧光显微镜
[0060]
根据已公开的方法(di emidio g等,2014)进行免疫荧光检测,主要步骤如下:用包含在pbs中的3.7%多聚甲醛固定卵母细胞30分钟,用0.5%的m2蛋白酶处理10秒以去除透明带,在含0.1%triton x-100的pbs中于37℃透化10分钟,用pbs中3%bsa在37.5℃封闭0.5h,然后用pbs中的1%bsa封闭。通过在4℃下在1%bsa中与一抗孵育过夜,对卵母细胞进行免疫荧光染色。抗体如下:抗lc3抗体(1:300,4108,cell signaling,美国),抗活性caspase-3(1:100,ab13847,abcam,英国)。在含有1%tween 20和0.01%triton-x 100的pbs中清洗3次,每次5分钟后,将卵母细胞与二抗(1:500,alexa fluor(anti-rabbit)488,4412s,cell signaling,美国)在室温下孵育1小时。
[0061]
对于微管蛋白染色,用抗α-微管蛋白-fitc抗体(1:800,05-661,millipore,德国)对卵母细胞进行检测。为了评估皮质颗粒(cortical granules,cgs)的分布,在室温下将卵母细胞与1:200小扁豆凝集素(lca)-fitc(fl-1041-5,vectorlabs,美国)培养2小时。在tunel方法中使用原位细胞死亡试剂盒(roche diagnostic gmbh,mannheim,11684795910,德国)。为了检测线粒体膜电位(mmp),将卵母细胞在含有2μmjc-1的m2培养基中于37℃下孵育30分钟。为了评估线粒体分布,将卵母细胞在含有200nm mitotracker red(m7512,invitrogen,美国)的m2培养基中于37℃下培养30分钟。为了使染色体可视化,用dapi(20mg/ml,c0060,索莱宝,中国)对卵母细胞复染10分钟。免疫荧光法始终在平行和相同条件下对对照和槲皮素处理的卵母细胞进行实验。
[0062]
洗涤3次后,将卵母细胞置于培养基(h-1200,vector,usa)中在激光扫描共聚焦显微镜(dragonfly,andor technology,uk)下进行观察。用image j软件(美国国立卫生研究院)测量每个卵母细胞的平均荧光强度。对于每个实验,始终使用相同的共聚焦显微镜设置获取图像。
[0063]
rna测序和qpcr
[0064]
将来自三只小鼠的每15个mii期卵母细胞设置为一组,每组3个重复。每组从接受或不接受10μm槲皮素处理的小鼠中收集。根据已公开的方法(guarente l.,2013)进行rna测序。然后将提取的总rna用于smart-seq ht kit(takara,japan),以生成测序文库,使用illumina novaseq 6000(illumina,usa)进行测序。数据读取使用grcm38.91软件,参照数据库使用hisat2软件。
[0065]
使用rneasy mini kit(74104,qiagen,德国)从样品中提取总rna。使用primescript逆转录酶(takara)通过rna逆转录获得cdna。在480(roche,德国)上进行定量实时pcr实验以验证了mrna的表达水平。通过使用microsoft excel将gapdh的内源性mrna水平标准化(内部对照)来计算mrna水平,通过primer premier 5.0软件设计其中特异性引物。(引物见表1)
[0066]
电子显微镜
[0067]
为了分析线粒体的超微结构,根据已公开的方法(sultana mr等,2016)采用透射电子显微镜(tem)观测卵母细胞,主要步骤包括:将卵母细胞切成70nm的超薄切片,然后用乙酸铀酰和柠檬酸铅染色,然后通过tem(jeol,日本)观测。线粒体超微结构的形态由电子显微镜在30,000放大倍数下确定。为了量化异常线粒体,以盲法对每个卵母细胞的十个不同视野进行计数。总共观察了来自有或没有10μm槲皮素处理的五只小鼠的10个卵母细胞。
[0068]
western blot分析
[0069]
对于总蛋白提取,将每组的100个卵母细胞裂解并通过sds page分离。在12%凝胶中电泳后,将样品转移至pvdf膜(millipore),在室温下用在pbst中稀释的5%脱脂奶封闭1h,然后将第一抗体在4℃下孵育过夜,然后通过hrp偶联的二抗进行化学发光检测(bio-rad)。抗体和用途见表2。
[0070]
本技术实施例涉及的引物如表1所示。
[0071]
表1引物和用途
[0072]
[0073][0074]
本技术实施例涉及的抗体如表2所示。
[0075]
表2抗体和用途
[0076][0077]
统计分析
[0078]
数据表示为来自至少三次独立实验的平均值
±
sem。统计比较采用单因素方差分析,统计学差异设为p<0.05。
[0079]
实施例3体外实验证明用槲皮素处理来自老龄小鼠的卵母细胞,改善了卵母细胞的成熟和早期胚胎发育
[0080]
图1a为实验流程和方法的示意图。
[0081]
收集了9-10个月大的雌性小鼠的1066个gv期卵母细胞,并在补充了不同浓度(0μm,5μm,10μm或20μm)槲皮素的m16培养基中培养16小时。结果显示,与对照相比,采用不同浓度的槲皮素处理都使得gvbd和pb1挤出率增加。其中,与对照相比,浓度为10μm的槲皮素处理卵母细胞的gvbd率(86.6%,n=284vs.79.7%,n=286,p<0.05)和pb1挤出率(64.8%,n=284vs.56.3%,n=286,p<0.05)显著提高(图1b),并且在各浓度处理组中最高。选择10μm槲皮素处理进行进一步研究。
[0082]
为了进一步确定槲皮素的作用,检查了槲皮素处理对ivf后老年小鼠的早期胚胎发育的影响。将mii期卵母细胞分别在补充了10μm槲皮素(n=314)和对照组(n=302)的培养基中与具有正常生育能力和生精能力的成年雄性精子杂交。结果发现槲皮素处理组的2-细胞期卵母细胞数目与对照组的相比无显着差异(图1d)。但是,槲皮素处理组的囊泡形成率约为75%,比对照组显着提高了24%(75.2
±
12.4%,n=314vs.50.8
±
8.7%,n=302,p<0.05;图1e)。因此,实验证明在体外培养过程中补充槲皮素可以显着改善卵母细胞的成熟和囊泡的形成。
[0083]
结果表明,槲皮素是年老小鼠ivm和植入前胚胎发育所必需的。在m16培养物中补充槲皮素可缓解与年龄相关的生育能力下降。
[0084]
实施例4槲皮素改善了老年小鼠的卵母细胞质量
[0085]
比较了ivm后10μm槲皮素处理组的和对照组的gv阶段卵母细胞的纺锤体形态,染色体配对和皮质颗粒(cgs)分布的百分比。已有的大量研究发现,随着年龄的增长,卵母细胞的纺锤体异常和非整倍性更有可能产生,这导致受精的机会减少,流产的风险增加,并导致有出生缺陷的后代。正常卵母细胞的纺锤体极点集中,染色体聚集,而异常卵母细胞具有带异常极体的纺锤体、延长的纺锤体,更破碎的纺锤体或分散的染色体。在实验中观察到对照组的卵母细胞出现各种异常,包括变长的纺锤体、缺乏明显的极点以及染色体配对异常(图2a)。而实验中发现,与对照组相比,槲皮素治疗组的卵母细胞具有显著改善的纺锤体形态和染色体配对(42.2
±
5.1%,n=95vs.58.7
±
4.2%,n=85,p<0.05;图2c)。
[0086]
同时,结果显示,槲皮素处理的老年小鼠的卵母细胞中具有显著增加的正常皮质颗粒cgs分布,体现在在卵膜下方一层薄和整齐排列的cgs,以及在纺锤体附近的无cg区域。在对照组中,超过52%的老年小鼠卵母细胞表现出更高的异常cgs分布百分比(38.2
±
8.1%n=79vs.54.7
±
4.6%,n=68,p<0.05;图2b,d)。
[0087]
实验证明,槲皮素处理改善老年小鼠的卵母细胞的质量,其减少了纺锤体异常的形成,改善了染色体配对和维持皮质颗粒(cgs)分布。
[0088]
实施例5全转录组分析证明槲皮素处理引起老年小鼠的基因表达差异
[0089]
为了研究在ivm中槲皮素处理衰老小鼠后卵母细胞基因表达的变化,对mii卵母细胞进行了单细胞rna测序。通过比较卵母细胞的转录组,根据调整后p值<0.05和倍数变化(folder change,fc)>2,与对照组相比,有124个上调的转录子和270个下调的转录子(图
3a)。基因本体论(go)分析显示差异基因表达的分布表明,与对照相比,槲皮素处理衰老小鼠后卵母细胞的多个生物学过程,细胞成分和分子功能发生了变化,特别是代谢活性和衰老(图3b)。qpcr分析进一步证明,许多上调的基因与抗氧化(sod2,cat,gpx4),卵母细胞/胚胎发育(hmga2,ube2e3,lhcgr,bmp15,gdf9),自噬(p62,nbr1),衰老(sirt3),线粒体呼吸链(mtch2,sdha1,uqcr10)相关,下调的基因与细胞凋亡(il6,caspase9)相关。这些发现与rna测序一致(图3c)。这些基因中表达的改变可能介导了老年小鼠卵母细胞中线粒体功能障碍的作用。
[0090]
实施例6槲皮素改善老年小鼠卵母细胞线粒体功能
[0091]
本领域已知哺乳动物的卵母细胞的质量下降与线粒体功能异常有关,这通常被认为是衰老引致的卵巢卵泡储备不足的原因。
[0092]
在本实验中检查了槲皮素处理的ivm后的mii期卵母细胞的线粒体分布,其中用mitotracker染色线粒体,并通过共聚焦显微镜进行评估。实验结果显示,对照组(无槲皮素处理)卵母细胞中超过60%的线粒体分布异常,包括核周分布和簇分布,而槲皮素处理组明显降低了该比率(60.5
±
5.7%,n=74vs.40.4
±
5.2%,n=81,p<0.05;图4a,d)。实验表明,通过槲皮素处理可以改善由衰老引起的卵母细胞线粒体动力学损害。
[0093]
线粒体膜电位是线粒体功能的指标,可以通过jc-1染色对聚体和单体的膜电位进行分析来测量。已有报道表明,在老年人的卵母细胞中,线粒体膜电位变化可能会受到破坏。
[0094]
本实验的结果显示,槲皮素处理组与对照组相比,聚体(红色荧光)和单体(绿色荧光)的比率显着降低(n=74vs.n=71,p<0.01;图4b,e)。线粒体功能异常会损害卵母细胞的代谢能力,从而降低老年小鼠的卵母细胞中的三磷酸腺苷(atp)含量。实验中还观察了各组中的atp水平,定量分析表明,槲皮素处理组的atp水平相对对照组显著地大大增加(30.7
±
15.8pmol,n=108vs.16.1
±
2.3pmol,n=108,p<0.05;图4f)。
[0095]
线粒体的超微结构改变被认为体现了体细胞中线粒体依赖的降解和凋亡。为了研究在m16培养物中补充槲皮素是否可以防止卵母细胞的线粒体超微结构的改变,通过透射电镜(tem)对对照组和槲皮素处理组ivm后老年小鼠的卵母细胞进行了检测评估。使用来自10只老年小鼠的20个卵母细胞,分别分为对照组和槲皮素处理组。形态计量学分析显示,与对照组相比,槲皮素处理组的线粒体超微结构异常明显减少(31.89
±
11.81%,n=10vs.50.47
±
13.49%,n=10,p<0.01;图4g)。另外发现槲皮素处理组的卵母细胞具有更多的正常线粒体超微结构,包括排列整齐的线粒体,外膜(om),内膜(im)和界限分明的膜间空间(ims)(图4c1,c2)。另外还观察到四种类型的异常电子超微结构:线粒体液泡(mv),膜间间隙变窄(ims),cr的缺失和髓鞘形态(图4c3,c4,c5)。同时,用槲皮素处理的卵母细胞在平滑内质网(ser)中的超微结构特征比对照组中的囊泡显示出具有较少囊泡。此外,槲皮素处理组的卵母细胞的线粒体中基质的电子密度比对照更高。因此,透射电镜分析结果表明槲皮素可以抵消年龄相关的对卵母细胞线粒体超微结构的有害作用。
[0096]
这些观察结果表明,槲皮素补充的m16培养物可以改善ivm后卵母细胞中与年龄相关的线粒体功能障碍。
[0097]
实施例7槲皮素减少老年小鼠的细胞内活性氧积累和卵母细胞凋亡
[0098]
与对照组相比,通过槲皮素处理的卵母细胞显示ros水平显着降低(n=78vs.n=
84,p<0.01;图5a,h)。细胞内活性氧(ros)的产生与线粒体功能有关。因此,槲皮素处理降低ros水平,提高了卵母细胞质量。
[0099]
另外,tunel分析证实,与对照相比,槲皮素处理的卵母细胞在ivm后的阳性率显着降低(21.4%
±
3.9%,n=77对53.0%
±
3.7%,n=66,p<0.05,图5b,i)。此外,槲皮素处理后,caspase3激活水平显着降低(n=77vs n=65,p<0.01;图5c,j)。
[0100]
实验结果表明槲皮素处理后,老年相关的卵母细胞凋亡指数显着降低。槲皮素能够通过清除ros并保持氧化还原稳态来改善老年相关卵母细胞的质量。
[0101]
自噬是一种防止细胞进一步凋亡的细胞生存机制,可以消除溶酶体对细胞器的破坏,并提高卵母细胞中线粒体的质量。lc3是一种位于自噬小体膜上的自噬标记蛋白。实验结果表明,与对照组相比,槲皮素处理组的lc3明显上调(n=111vs n=93,p<0.01;图5d,k)。因此,槲皮素处理可以通过增加自噬和减少凋亡来降低与年龄有关的卵母细胞质量下降。
[0102]
实施例8槲皮素通过sier3-介导的降低sod2k68乙酰化来增加抗氧化活性
[0103]
已报道赖氨酸(k)68是sod2上与卵母细胞ros稳态相关的关键乙酰化位点;sirt3能够使sod2k68脱乙酰化,从而增加其抗氧化活性。
[0104]
发明人在在qpcr分析中已检测到在老年和年幼小鼠的卵母细胞中sirt3表达增加(图3c)。western蛋白印迹实验发现,sir3在老年小鼠卵母细胞中相对年轻小鼠明显减少(图5e,l)。根据qpcr的结果,发现槲皮素处理卵母细胞后,sirt3的表达均上调,而sod2k68表达下调(图3c)。
[0105]
为了研究sod2k68(sod2k68ac)的脱乙酰基状态是否受sirt3调控,将来自年轻小鼠的完全发育gv卵母细胞注射外源sisirt3,或注射pbs作为阴性对照。将卵母细胞在补充有2.5mm米力农(milrinone)的m16培养基中培养,在gv卵母细胞阶段停滞约12小时,这会干扰sirt3蛋白的合成。在ivm过程中,将sisirt3卵母细胞在含10μm槲皮素(sisirt3 槲皮素)或不含槲皮素(sisirt3)的m16培养基中培养。收集mii卵母细胞并用抗sod2k68ac抗体和羧基-h2dcf双乙酸盐标记,以分别评估sod2k68ac的表达和ros水平(图5f)。共聚焦显微镜图像的定量分析表明,与对照卵母细胞相比,sisirt3处理的卵母细胞中sod2k68ac水平显着增加。相反,与sisirt3处理卵母细胞相比,sisirt3 槲皮素处理显着降低了卵母细胞中的sod2k68ac水平(图5g,m)。此外,对ros水平的分析表明,sisirt3卵母细胞具有显着升高的ros水平。与对照卵母细胞相比,sisirt3 槲皮素卵母细胞中的ros积累仍增加,但是与sisirt3卵母细胞相比,槲皮素的添加导致ros显着降低(图5g,n)。
[0106]
这些结果表明槲皮素可通过sirt3上调抵抗过量的ros产生,可恢复与年龄相关的卵母细胞中sod2k68的乙酰化水平。
[0107]
实施例9槲皮素补充可改善体外培养的人类胚胎的发育
[0108]
研究了补充10μm槲皮素对人类卵母细胞和胚胎的体外成熟(ivm)和卵胞浆内单精子注射(icsi,intracytoplasmic sperm injection)阶段中的影响(图6a,e)。结果表明,用10μm槲皮素处理人类卵母细胞的ivm百分率从51.79%到71.43%,有显着差异(n=112vs.n=95,p<0.05;图6b),对来自gvbd的胚胎用10μm槲皮素处理也改进了ivm百分率(图6c)。受精率和囊胚形成率比对照组高得多:受精率由对照胚胎的62.2%增加到槲皮素处理胚胎的76.2%。同时,槲皮素处理的囊泡形成率从17.78%增加到33.33%,几乎翻了一倍(图6d)。
可见,在培养基中添加槲皮素可以在人类的人工辅助生殖art中提高人类卵母细胞的成熟和早期胚胎发育和。
[0109]
本发明首次发现和证明了用槲皮素补充培养基可促进哺乳动物包括人类的卵母细胞成熟并改善卵母细胞质量,特别是对老年的哺乳动物或女性人类。本发明还意外地发现在培养基中加入特定含量的槲皮素能够特别有效地发挥其促进成熟和改善质量的作用,由此发现了在培养基中加入槲皮素的最佳浓度。申请人由此提供了哺乳动物特别是人类的卵母细胞的体外培养的方法和培养基。
[0110]
上面是对本发明进行的说明,不能将其看成是对本发明进行的限制。除非另外指出,本发明的实践将使用有机化学、聚合物化学、生物技术等的常规技术,显然除在上述说明和实施例中所特别描述之外,还可以别的方式实现本发明。其它在本发明范围内的方面与改进将对本发明所属领域的技术人员显而易见。根据本发明的教导,许多改变和变化是可行的,因此其在本发明的范围之内。
[0111]
以下论文作为参考,全文合并到本公开中:
[0112]
1.m.j.faddy,follicle dynamics during ovarian ageing.mol cell endocrinol 163,43-48(2000).
[0113]
2.m.mills,r.r.rindfuss,p.mcdonald,e.te velde,e.reproduction,f.society task,why do people postpone parenthood?reasons and social policy incentives.hum reprod update 17,848-860(2011).
[0114]
3.c.tatone,f.amicarelli,m.c.carbone,p.monteleone,d.caserta,r.marci,p.g.artini,p.piomboni,r.focarelli,cellular and molecular aspects of ovarian follicle ageing.hum reprod update 14,131-142(2008).
[0115]
4.a.h.handyside,m.montag,m.c.magli,s.repping,j.harper,a.schmutzler,k.vesela,l.gianaroli,j.geraedts,multiple meiotic errors caused by predivision of chromatids in women of advanced maternal age undergoing in vitro fertilisation.eur j hum genet 20,742-747(2012).
[0116]
5.m.zhang,y.lu,y.chen,y.zhang,b.xiong,insufficiency of melatonin in follicular fluid is a reversible cause for advanced maternal age-related aneuploidy in oocytes.redox biol 28,101327(2020).
[0117]
6.c.m.combelles,s.gupta,a.agarwal,could oxidative stress influence the in-vitro maturation of oocytes?reprod biomed online 18,864-880(2009).
[0118]
7.a.s.khatlab,a.p.del vesco,a.r.de oliveira neto,r.p.m.fernandes,e.gasparino,dietary supplementation with free methionine or methionine dipeptide mitigates intestinal oxidative stress induced by eimeria spp.challenge in broiler chickens.j anim sci biotechnol 10,58(2019).
[0119]
8.a.a.a.silva,m.n.p.silva,l.b.f.figueiredo,j.d.goncalves,m.j.s.silva,m.l.g.loiola,b.d.m.bastos,r.a.oliveira,l.g.m.ribeiro,r.s.barberino,b.b.gouveia,a.p.o.monte,d.m.nogueira,m.f.cordeiro,m.h.t.matos,e.s.lopes junior,quercetin influences in vitro maturation,apoptosis and metabolically active mitochondria of goat oocytes.zygote 26,465-470(2018).
[0120]
9.m.d.saenz-de-juano,e.ivanova,s.romero,f.lolicato,f.sanchez,h.van ranst,f.krueger,a.segonds-pichon,m.de vos,s.andrews,j.smitz,g.kelsey,e.anckaert,dna methylation and mrna expression of imprinted genes in blastocysts derived from an improved in vitro maturation method for oocytes from small antral follicles in polycystic ovary syndrome patients.hum reprod 34,1640-1649(2019).
[0121]
10.g.coticchio,m.dal canto,m.mignini renzini,m.c.guglielmo,f.brambillasca,d.turchi,p.v.novara,r.fadini,oocyte maturation:gamete-somatic cells interactions,meiotic resumption,cytoskeletal dynamics and cytoplasmic reorganization.hum reprod update 21,427-454(2015).
[0122]
11.m.t.sauerbrun-cutler,m.vega,m.keltz,p.g.mcgovern,in vitro maturation and its role in clinical assisted reproductive technology.obstet gynecol surv 70,45-57(2015).
[0123]
12.l.mostinckx,i.segers,f.belva,r.buyl,s.santos-ribeiro,c.blockeel,j.smitz,e.anckaert,h.tournaye,m.de vos,obstetric and neonatal outcome of art in patients with polycystic ovary syndrome:ivm of oocytes versus controlled ovarian stimulation.hum reprod 34,1595-1607(2019).
[0124]
13.m.j.liu,a.g.sun,s.g.zhao,h.liu,s.y.ma,m.li,y.x.huai,h.zhao,h.b.liu,resveratrol improves in vitro maturation of oocytes in aged mice and humans.fertil steril109,900-907(2018).
[0125]
14.s.l.p.regan,p.g.knight,j.l.yovich,f.arfuso,a.dharmarajan,growth hormone during in vitro fertilization in older women modulates the density of receptors in granulosa cells,with improved pregnancy outcomes.fertil steril 110,1298-1310(2018).
[0126]
15.e.n.usoltseva,e.v.bruhina,m.v.danilova,[melatonin in a woman's life:from birth to menopause].adv gerontol 28,701-707(2015).
[0127]
16.x.dou,y.sun,j.li,j.zhang,d.hao,w.liu,r.wu,f.kong,x.peng,j.li,short-term rapamycin treatment increases ovarian lifespan in young and middle-aged female mice.aging cell 16,825-836(2017).
[0128]
17.a.ben-meir,e.burstein,a.borrego-alvarez,j.chong,e.wong,t.yavorska,t.naranian,m.chi,y.wang,y.bentov,j.alexis,j.meriano,h.k.sung,d.l.gasser,k.h.moley,s.hekimi,r.f.casper,a.jurisicova,coenzyme q10 restores oocyte mitochondrial function and fertility during reproductive aging.aging cell 14,887-895(2015).
[0129]
18.m.andreucci,t.faga,a.pisani,r.serra,d.russo,g.de sarro,a.michael,quercetin protects against radiocontrast medium toxicity in human renal proximal tubular cells.j cell physiol 233,4116-4125(2018).
[0130]
19.m.r.de oliveira,s.m.nabavi,n.braidy,w.n.setzer,t.ahmed,s.f.nabavi,quercetin and the mitochondria:a mechanistic view.biotechnol adv 34,532-549
(2016).
[0131]
20.l.geng,z.liu,w.zhang,w.li,z.wu,w.wang,r.ren,y.su,p.wang,l.sun,z.ju,p.chan,m.song,j.qu,g.h.liu,chemical screen identifies a geroprotective role of quercetin in premature aging.protein cell 10,417-435(2019).
[0132]
21.a.kampkotter,c.timpel,r.f.zurawski,s.ruhl,y.chovolou,p.proksch,w.watjen,increase of stress resistance and lifespan of caenorhabditis elegans by quercetin.comp biochem physiol b biochem mol biol 149,314-323(2008).
[0133]
22.j.wang,x.qian,q.gao,c.lv,j.xu,h.jin,h.zhu,quercetin increases the antioxidant capacity of the ovary in menopausal rats and in ovarian granulosa cell culture in vitro.j ovarian res 11,51(2018).
[0134]
23.h.wang,y.j.jo,j.s.oh,n.h.kim,quercetin delays postovulatory aging of mouse oocytes by regulating sirt expression and mpf activity.oncotarget 8,38631-38641(2017).
[0135]
24.j.t.kang,d.k.kwon,s.j.park,s.j.kim,j.h.moon,o.j.koo,g.jang,b.c.lee,quercetin improves the in vitro development of porcine oocytes by decreasing reactive oxygen species levels.j vet sci 14,15-20(2013).
[0136]
25.l.ciancimino,a.s.lagana,b.chiofalo,r.granese,r.grasso,o.triolo,would it be too late?a retrospective case-control analysis to evaluate maternal-fetal outcomes in advanced maternal age.arch gynecol obstet 290,1109-1114(2014).
[0137]
26.m.de paola,m.p.miro,m.ratto,l.f.batiz,m.a.michaut,pleiotropic effects of alpha-snap m105i mutation on oocyte biology:ultrastructural and cellular changes that adversely affect female fertility in mice.sci rep 9,17374(2019).
[0138]
27.p.may-panloup,l.boucret,j.m.chao de la barca,v.desquiret-dumas,v.ferre-l'hotellier,c.moriniere,p.descamps,v.procaccio,p.reynier,ovarian ageing:the role of mitochondria in oocytes and follicles.hum reprod update 22,725-743(2016).
[0139]
28.f.h.lin,w.l.zhang,h.li,x.d.tian,j.zhang,x.li,c.y.li,j.h.tan,role of autophagy in modulating post-maturation aging of mouse oocytes.cell death dis 9,308(2018).
[0140]
29.n.senoo-matsuda,t.igaki,m.miura,bax-like protein drob-1 protects neurons from expanded polyglutamine-induced toxicity in drosophila.embo j 24,2700-2713(2005).
[0141]
30.z.nasheed hamad almohammed,f.moghani-ghoroghi,i.ragerdi-kashani,r.fathi,l.s.tahaei,m.naji,p.pasbakhsh,the effect of melatonin on mitochondrial function and autophagy in in vitro matured oocytes of aged mice.cell j 22,9-16(2020).
[0142]
31.m.sugiyama,r.kawahara-miki,h.kawana,k.shirasuna,t.kuwayama,
h.iwata,resveratrol-induced mitochondrial synthesis and autophagy in oocytes derived from early antral follicles of aged cows.j reprod dev 61,251-259(2015).
[0143]
32.l.zhang,l.han,r.ma,x.hou,y.yu,s.sun,y.xu,t.schedl,k.h.moley,q.wang,sirt3 prevents maternal obesity-associated oxidative stress and meiotic defects in mouse oocytes.cell cycle 14,2959-2968(2015).
[0144]
33.x.liu,l.zhang,p.wang,x.li,d.qiu,l.li,j.zhang,x.hou,l.han,j.ge,m.li,l.gu,q.wang,sirt3-dependent deacetylation of sod2 plays a protective role against oxidative stress in oocytes from diabetic mice.cell cycle 16,1302-1308(2017).
[0145]
34.y.li,h.liu,k.wu,h.liu,t.huang,z.j.chen,s.zhao,j.ma,h.zhao,melatonin promotes human oocyte maturation and early embryo development by enhancing clathrin-mediated endocytosis.j pineal res 67,e12601(2019).
[0146]
35.y.j.menezo,d.sakkas,l.janny,co-culture of the early human embryo:factors affecting human blastocyst formation in vitro.microsc res tech 32,50-56(1995).
[0147]
36.a.kolesarova,s.roychoudhury,b.klinerova,d.packova,k.michalcova,m.halenar,j.kopcekova,e.mnahoncakova,b.galik,dietary bioflavonoid quercetin modulates porcine ovarian granulosa cell functions in vitro.j environ sci health b 54,533-537(2019).
[0148]
37.j.datta,m.j.palmer,c.tanton,l.j.gibson,k.g.jones,w.macdowall,a.glasier,p.sonnenberg,n.field,c.h.mercer,a.m.johnson,k.wellings,prevalence of infertility and help seeking among 15 000 women and men.hum reprod 31,2108-2118(2016).
[0149]
38.s.d.spandorfer,o.m.avrech,l.t.colombero,g.d.palermo,z.rosenwaks,effect of parental age on fertilization and pregnancy characteristics in couples treated by intracytoplasmic sperm injection.hum reprod 13,334-338(1998).
[0150]
39.c.song,w.peng,s.yin,j.zhao,b.fu,j.zhang,t.mao,h.wu,y.zhang,melatonin improves age-induced fertility decline and attenuates ovarian mitochondrial oxidative stress in mice.sci rep 6,35165(2016).
[0151]
40.y.wang,l.li,l.h.fan,y.jing,j.li,y.c.ouyang,z.b.wang,y.hou,q.y.sun,n-acetyl-l-cysteine(nac)delays post-ovulatory oocyte aging in mouse.aging(albany ny)11,2020-2030(2019).
[0152]
41.m.de vos,j.smitz,t.k.woodruff,fertility preservation in women with cancer.lancet 384,1302-1310(2014).
[0153]
42.m.xu,t.pirtskhalava,j.n.farr,b.m.weigand,a.k.palmer,m.m.weivoda,c.l.inman,m.b.ogrodnik,c.m.hachfeld,d.g.fraser,j.l.onken,k.o.johnson,g.c.verzosa,l.g.p.langhi,m.weigl,n.giorgadze,n.k.lebrasseur,j.d.miller,
d.jurk,r.j.singh,d.b.allison,k.ejima,g.b.hubbard,y.ikeno,h.cubro,v.d.garovic,x.hou,s.j.weroha,p.d.robbins,l.j.niedernhofer,s.khosla,t.tchkonia,j.l.kirkland,senolytics improve physical function and increase lifespan in old age.nat med 24,1246-1256(2018).
[0154]
43.k.selesniemi,h.j.lee,a.muhlhauser,j.l.tilly,prevention of maternal aging-associated oocyte aneuploidy and meiotic spindle defects in mice by dietary and genetic strategies.proc natl acad sci u s a 108,12319-12324(2011).
[0155]
44.a.linkeviciute,g.boniolo,l.chiavari,f.a.peccatori,fertility preservation in cancer patients:the global framework.cancer treat rev 40,1019-1027(2014).
[0156]
45.j.k.kim,s.u.park,quercetin and its role in biological functions:an updated review.excli j 17,856-863(2018).
[0157]
46.t.hamatani,g.falco,m.g.carter,h.akutsu,c.a.stagg,a.a.sharov,d.b.dudekula,v.vanburen,m.s.ko,age-associated alteration of gene expression patterns in mouse oocytes.hum mol genet 13,2263-2278(2004).
[0158]
47.k.g.lyamzaev,a.v.tokarchuk,a.a.panteleeva,a.y.mulkidjanian,v.p.skulachev,b.v.chernyak,induction of autophagy by depolarization of mitochondria.autophagy 14,921-924(2018).
[0159]
48.m.fiorani,a.guidarelli,m.blasa,c.azzolini,m.candiracci,e.piatti,o.cantoni,mitochondria accumulate large amounts of quercetin:prevention of mitochondrial damage and release upon oxidation of the extramitochondrial fraction of the flavonoid.j nutr biochem 21,397-404(2010).
[0160]
49.m.kedhari sundaram,r.raina,n.afroze,k.bajbouj,m.hamad,s.haque,a.hussain,quercetin modulates signaling pathways and induces apoptosis in cervical cancer cells.biosci rep 39,(2019).
[0161]
50.s.someya,w.yu,w.c.hallows,j.xu,j.m.vann,c.leeuwenburgh,m.tanokura,j.m.denu,t.a.prolla,sirt3 mediates reduction of oxidative damage and prevention of age-related hearing loss under caloric restriction.cell 143,802-812(2010).
[0162]
51.j.camacho-pereira,m.g.tarrago,c.c.s.chini,v.nin,c.escande,g.m.warner,a.s.puranik,r.a.schoon,j.m.reid,a.galina,e.n.chini,cd38 dictates age-related nad decline and mitochondrial dysfunction through an sirt3-dependent mechanism.cell metab 23,1127-1139(2016).
[0163]
52.y.chen,j.zhang,y.lin,q.lei,k.l.guan,s.zhao,y.xiong,tumour suppressor sirt3 deacetylates and activates manganese superoxide dismutase to scavenge ros.embo rep 12,534-541(2011).
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。