1.本发明涉及光热试剂制备技术领域。更具体地,涉及一种硼量子点及其制备方法和应用。
背景技术:
2.癌症是威胁人类健康的重大疾病之一。如何能有效治疗癌症是一直在研究的热点,但是目前的传统治疗方法如手术切除、放射治疗、化学治疗等,具有创伤大,易复发,副作用大等问题。作为一种新型的癌症治疗方法,光热治疗由于毒副作用小、侵入性低、以及治疗效果优异而引起了广泛地关注,而作为光热治疗中关键材料的光热试剂一直是研究的重点(cn201910371146.x)。目前在光热试剂的研究中,合成出多种多样的光热试剂,而其中具有良好的光稳定性、强宽带吸收和低成本的量子点备受关注。比如黑磷量子点(sun,z.;xie,h.;tang,s.;yu,x.f.;guo,z.;shao,j.;zhang,h.;huang,h.;wang,h.;chu,p.k.ultrasmall black phosphorus quantum dots:synthesis and use as photothermal agents.angew.chem.int.ed.2015,54,11526
–
11530;cn201611207924.4)、锑烯量子点(tao,w.;ji,x.;xu,x.;islam,m.a.;li,z.;chen,s.;saw,p.e.;zhang,h.;bharwani,z.;guo,z.;shi,j.;farokhzad,o.c.antimonene quantum dots:synthesis and application as near-infrared photothermal agents for effective cancer therapy.angew.chem.int.ed.2017,129,12058-12062;cn201710484246.4)、以及化合物类量子点包括cdte量子点(cn201711400218.6)、pbs量子点(cn201611050553.3)以及mos2量子点(cn201610250811.6)、bi2s3量子点(cn201810939783.8)等。但是大多数量子点含有重金属,具有较高的细胞毒性,再加上制备工艺要求苛刻,价格昂贵且在空气中不稳定,很难实现大规模量化生产,限制了其在临床治疗方面的进一步应用。
3.因此,需要提供一个低细胞毒性,制备方法简单,低成本的光热试剂尤为重要。
技术实现要素:
4.本发明的第一个目的在于提供一种新的硼量子点的制备方法,该制备方法以硼粉为原材料利用冰盐浴超声法制备得到,工艺简单,设备要求低。
5.本发明的第二个目的在于提供上述制备方法得到的硼量子点及其应用,该硼量子点具有较好的生物相容性以及较优异的光热转化效率与光声成像性能。
6.为达到上述目的,本发明采用下述技术方案:
7.本发明首先提供了一种硼量子点的制备方法,包括如下步骤:
8.将硼粉末分散于水中,得到硼纳米片分散液;将所述硼纳米片分散液于冰盐浴中超声,得到混合液;将所述混合液离心取上清液,干燥后得到硼量子点。
9.本发明采用简单的冰盐浴超声的方式将二维的硼纳米片粉碎裂解为尺寸均一的硼量子点,由于量子限域效应,硼量子点的带隙相较于二维材料明显减小。另外,硼量子点表面由于存在许多不饱和硼原子而存在大量缺陷,这些缺陷进一步修饰了硼的电子结构,
10℃下冰盐浴超声10h后,得混合液;
34.3、将步骤2得到的混合液于转速为10000rpm/s的离心机下离心10min,取上清液置于干燥箱中除去水分,所得固体即为硼量子点。
35.将本实施例制备得到的硼量子点进行x射线衍射分析,得到的x射线衍射谱图如图1所示,将图1与xrd标准卡片对比,硼量子点的衍射峰与标准峰一致,说明由此方法制备硼量子点结构没有发生变化。
36.将本实施例制备得到的硼量子点分散在水中,滴加到铜网膜上,用透射电镜进行观察,透射电镜图如图2所示,显示硼量子点的尺寸均一,粒径大小为1~10nm,厚度为1.5nm,说明通过液相剥离制备的硼量子点与传统硼纳米材料相比尺寸大幅度减小。
37.将本实施例制备得到的硼量子点分散在水中,浓度为400ug/ml,用808nm激光器照射,探测其光热转化性能,结果如图3所示,显示随着照射时间的延长,照射下硼量子点的温度越来越高,当照射10分钟时,温度达到72.4℃,说明在近红外光的照射下硼量子点可有效的将光能转化为热能。进一步测量硼量子点的光热转化效率,结果如图4所示,得到硼量子点的光热转化效率达到了57%。
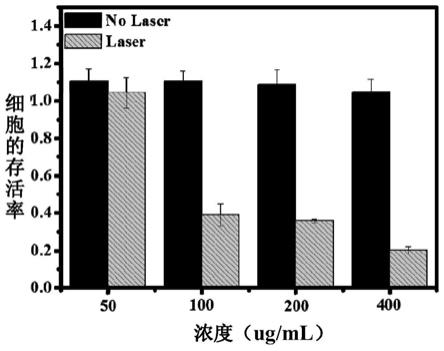
38.用不同浓度(50ug/ml、100ug/ml、200ug/ml、400ug/ml)的硼量子点分别在近红外光照射和无近红外光照射的条件下孵育hela细胞24小时后,计算细胞的存活率如图5所示,显示在无近红外光照射的条件(图中以“no laser”表示)下,硼量子点在较高浓度400ug/ml时的存活率为100%,表明了该材料的细胞毒性较低。但在近红外光照射下(图中以“laser”表示)大部分hela细胞被杀死,当硼量子点的浓度为100ug/ml时,细胞的存活率低于40%,表现出较好的抑制癌细胞生长的效果。随着该材料浓度的增加,细胞的存活率持续下降,说明硼量子点可作为一种潜在的光热试剂。
39.实施例2一种硼量子点的制备
40.液相剥离制备硼量子点的方法,包括如下步骤:
41.1、将200mg无定型硼粉溶解于100ml去离子水中,得到2mg/ml的硼纳米片分散液;
42.2、将步骤1得到的硼纳米片分散液置于频率为80khz,功率为400w的超声机中,在-10℃下冰盐浴超声10h后,得混合液;
43.3、将步骤2得到的混合液于转速为10000rpm/s的离心机下离心10min,取上清液置于干燥箱中除去水分,所得固体即为硼量子点。
44.利用实施例1所述的方法对硼量子点进行检测,结果显示本实施例制备得到的硼量子点尺寸均一,粒径大小为1~8nm,厚度为0.5~2nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,测得该硼量子点可有效的将光能转化为热能;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
45.实施例3一种硼量子点的制备
46.液相剥离制备硼量子点的方法,包括如下步骤:
47.1、将500mg无定型硼粉溶解于100ml去离子水中,得到5mg/ml的硼纳米片分散液;
48.2、将步骤1得到的硼纳米片分散液置于频率为80khz,功率为400w的超声机中,在-10℃下冰盐浴超声10h后,得混合液;
49.3、将步骤2得到的混合液于转速为10000rpm/s的离心机下离心10min,取上清液置
于干燥箱中除去水分,所得固体即为硼量子点。
50.利用实施例1所述的方法对硼量子点进行检测,将本实施例制备得到的硼量子点用透射电镜进行观察,透射电镜图如图6所示,显示硼量子点的尺寸均一,粒径大小为1~15nm,厚度为1~3nm,说明通过液相剥离制备的硼量子点与传统硼纳米材料相比尺寸大幅度减小。在近红外区吸收较强;将硼量子点分散在水中,用808nm激光器照射,测得该硼量子点可有效的将光能转化为热能;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
51.实施例4一种硼量子点的制备
52.重复实施例1,区别在于,将步骤2中的“功率为400w的超声机中,”换成“功率为300w的超声机中”,其余条件不变,制备得到硼量子点。
53.利用实施例1所述的方法对硼量子点进行检测,本实施例制备得到的硼量子点尺寸均一,粒径大小为1~12nm,厚度为1~2.5nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,测得该硼量子点可有效的将光能转化为热能;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
54.实施例5一种硼量子点的制备
55.重复实施例1,区别在于,将步骤2中的“功率为400w的超声机中,”换成“功率为500w的超声机中”,其余条件不变,制备得到硼量子点。
56.利用实施例1所述的方法对硼量子点进行检测,本实施例得到的硼量子点尺寸均一,粒径大小为1~8nm,厚度为0.5~1.5nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,该硼量子点具有较高的光热转化效率;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
57.实施例6一种硼量子点的制备
58.重复实施例1,区别在于,将步骤3中的“转速为10000rpm/s”换成“转速为11000rpm/s”。将步骤3中的“离心10min”换成“离心20min”,其余条件不变,制备得到硼量子点。
59.利用实施例1所述的方法对硼量子点进行检测,本实施例得到的硼量子点尺寸均一,粒径大小为1~10nm,厚度为0.5~2nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,该硼量子点具有较高的光热转化效率;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
60.实施例7一种硼量子点的制备
61.重复实施例1,区别在于,将步骤3中的“转速为10000rpm/s”换成“转速为12000rpm/s”,将步骤3中的“离心10min”换成“离心30min”,其余条件不变,制备得到硼量子点。
62.利用实施例1所述的方法对硼量子点进行检测,将本实施例制备得到的硼量子点用透射电镜进行观察,透射电镜图如图7所示,显示硼量子点的尺寸均一,粒径大小为1~8nm,厚度为0.5~1.5nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激
光器照射,该硼量子点具有较高的光热转化效率;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
63.实施例8一种硼量子点的制备
64.重复实施例7,区别在于,将步骤1中的“无定型硼粉”换成“晶体硼粉”,其余条件不变,制备得到硼量子点。
65.利用实施例1所述的方法对硼量子点进行检测,本实施例得到的硼量子点尺寸均一,粒径大小为1~10nm,厚度为0.5~3nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,该硼量子点具有较高的光热转化效率;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。.
66.实施例9一种硼量子点的制备
67.重复实施例7,区别在于,将步骤1)中的“无定型硼粉”换成“高纯硼粉”。其余条件不变,制备得到硼量子点。
68.利用实施例1所述的方法对硼量子点进行检测,本实施例得到的硼量子点尺寸均一,粒径大小为1~12nm,厚度为0.5~2nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,该硼量子点具有较高的光热转化效率;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
69.实施例10一种硼量子点的制备
70.重复实施例9,区别在于,将步骤1)中的“在-10℃下冰盐浴超声10h后”换成“在0℃下冰盐浴超声20h后”。其余条件不变,制备得到硼量子点。
71.利用实施例1所述的方法对硼量子点进行检测,本实施例得到的硼量子点尺寸均一,粒径大小为1~9nm,厚度为1~3.5nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,该硼量子点具有较高的光热转化效率;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
72.实施例11一种硼量子点的制备
73.重复实施例9,区别在于,将步骤1)中的“在-10℃下冰盐浴超声10h后”换成“在5℃下冰盐浴超声20h后”。其余条件不变,制备得到硼量子点。
74.利用实施例1所述的方法对硼量子点进行检测,本实施例得到的硼量子点尺寸均一,粒径大小为1~12nm,厚度为0.5~3nm,在近红外区具有较强的吸收;将硼量子点分散在水中,用808nm激光器照射,该硼量子点具有较高的光热转化效率;将硼量子点孵育hela细胞,测定硼量子点的细胞毒性较低,光热治疗效果较好且循环性良好,并展现出了优异的光声成像性能。
75.对比例1
76.制备方法基本与实施例1相同,只是将2)中的“在-15℃下冰盐浴超声10h”换成“在室温下超声10h”,其余条件不变,得到的硼量子点粒径较大,约20~50nm,厚度为1~5nm,在近红外区吸收较弱,光热转化效率较低,光热治疗效果不佳,且无法进行光声成像。
77.对比例2
78.制备方法基本与实施例1相同,只是直接将步骤1)中得到的硼纳米片分散液直接用于后续探究。硼纳米片的光热转化效率较低,光疗效果一般,且无法进行光声成像。
79.对比例3
80.制备方法基本与实施例1相同,只是将2)中的“在-15℃下冰盐浴超声10h”换成“在-15℃下冰盐浴超声5h”,其余条件不变,得到的硼量子点粒径较大,约20~30nm,厚度为1~5nm,在近红外区吸收较弱,光热转化效率较低,光热治疗效果不佳,且无法进行光声成像。
81.显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。