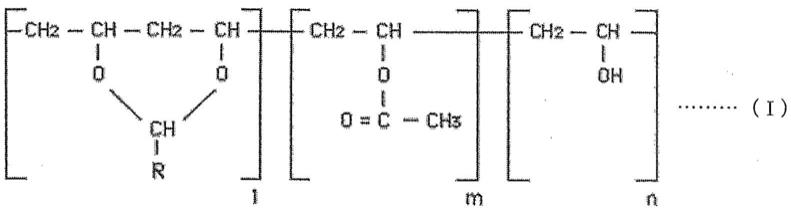
生物活性物偶联物及其制备方法和用途
1.本技术为cn国家申请号201880069543.5(进入中国国家阶段日期为2020年4月24日)的分案申请。
技术领域
2.本公开属于医药技术领域,涉及生物活性物偶联物,及其制备方法和在预防和/或治疗与细胞活动异常相关的疾病,包括但不限于在预防和/或治疗肿瘤疾病中的用途。
背景技术:
3.化疗一度是癌症的标准疗法,但高杀伤力的生物活性分子会误杀正常细胞,引起严重的副作用。靶向抗肿瘤药物由于同时具有靶向性和抗肿瘤活性,已成为当今肿瘤研究领域的热点。20世纪以来,生物大分子药物(例如治疗性抗体或抗体片段)和靶向小分子配体用于抗肿瘤药物的开发及肿瘤靶向治疗已取得突破性进展。然而,生物大分子药物虽然靶向性强,但对实体瘤的治疗效果有限;而生物活性分子虽然对癌细胞具有高度的杀伤效力,但往往缺乏靶向性,常常误伤正常细胞,从而引起严重毒副作用。
4.近年来研究发现,治疗性抗体可以与生物活性分子相连,形成抗体
‑
药物偶联物(adc)。adc融合了抗体的靶向作用和生物活性分子的活性,成为一种“生物导弹”。抗体引导adc结合到靶细胞,随后被细胞内化,释放药物,治疗疾病。由于抗体对肿瘤细胞相关靶点具有特异性和靶向性,其应用价值不仅体现在治疗方面,同时还成为药物靶向输送的理想载体,降低了药物的副作用。小分子药物偶联(smdc)和抗体
‑
药物偶联物(adc)的设计原理相同,即通过化学方法把生物活性分子和一些能选择性地结合肿瘤细胞表面受体的小分子配体偶联,借此提高效应分子对肿瘤细胞的靶向性。smdc和adc的不同之处在于smdc是采用小分子配体(ligand)替代抗体。
5.目前,尚无smdc上市。
6.目前,已经上市的adc有四种:mylotarg(gemtuzumab ozogamicin,吉妥珠单抗奥唑米星),adcetris(brentuximab vedotin,cd30单抗
‑
mmae),kadcyla(trastuzumab emtansine,曲妥珠单抗
‑
美登素生物碱)和besponsa(inotuzumab ozogamicin,cd22单抗
‑
卡奇霉素)。通常,adc药物由抗体、生物活性分子及连接体(linker)组成。生物活性分子通过连接体共价偶联到抗体上;抗体(例如单克隆抗体)能够特异性识别肿瘤细胞表面的特异性靶点,进而能够引导adc到达癌细胞表面,并使adc通过细胞内吞效应进入癌细胞;然后生物活性分子在癌细胞内释放,达到专一性杀灭癌细胞而不损伤正常组织细胞的作用。
7.赖氨酸是抗体中最常见的连接位点,其ε
‑
氨基可以与连接体的活化羧基反应,形成酰胺键。目前已有可以实现定点偶联的技术,即以活化基团活化连接体的羧基,再与抗体中特定的赖氨酸ε
‑
氨基形成酰胺键,完成偶联。但是此类酰胺键,在体内酶的作用下,易发生水解,导致生物活性分子与抗体在未达到靶细胞时即发生脱落,在丧失adc的靶向性的同时,增加了毒性。
8.通常,抗体半胱氨酸的硫基,都是以二硫键的形式存在。打开抗体中的二硫键,可
以提供多个自由的巯基作为偶联位点。与抗体巯基进行偶联,一种方法是抗体上自由的巯基与马来酰亚胺发生michael加成反应,也可以是特定的底物与抗体上自由的巯基通过两次michael加成反应,形成一个结构独特的硫桥键。但有较多文献报道,通过巯基michael加成方法得到的adc,会在体循环中发生逆michael加成,产生毒性反应。在专利wo2016142049中,公开了以鹅膏毒素为生物活性分子,包含甲磺酰基取代的苯联噁二唑结构的生物活性分子和连接体结构,但与抗体偶联内容无具体描述。
技术实现要素:
9.本发明发现了一类新颖的生物活性物偶联物,其通过改进adc或smdc药物中药物与靶向部分的偶联方式而获得。所述偶联物具有较高的稳定性,极高的偶联效率(90%)和较高的载药量(dar值为5
‑
8),本公开即是基于以上发现而完成。通过深入研究,我们惊奇的发现,本发明的adc,如bt001021(实施例三十二),通过静脉给药后,生物活性小分子毒素在肿瘤组织内暴露量显著高于血浆组织暴露量。而immu
‑
132adc在相同给药途径下,血浆暴露量显著高于肿瘤组织暴露量,本发明adc因此具有比immu
‑
132更好的治疗窗口。同时我们还惊奇的发现,在胃癌、乳腺癌和非小细胞肺癌肿瘤动物模型上本发明adc具有比immu
‑
132更好的治疗效果。
10.本公开的第一个方面提供式(i)所示化合物或其药学上可接受的盐,
11.t
‑
[l1‑
(l2)
m1
‑
(l3)
m2
‑
(l4)
m3
‑
e]
‑
g
[0012]
式(i)
[0013]
其中,t为生物活性分子片段,优选具有抗肿瘤生物活性的分子片段;
[0014]
l1选自氨基酸、2
‑
10个氨基酸组成的肽、寡糖、
‑
(ch2)
t1
‑
、
‑
(ch2ch2o)
t1
‑
(ch2)
t2
‑
、
[0015][0015]
其中,各r、r’、r1和r2各自独立地为h(氢)、d(氘)、卤素、羧酸、磺酸、氰基、c1‑6烷基、卤代c1‑6烷基(例如
‑
cf3)、氰基取代的c1‑6烷基(例如
‑
ch2cn)、c1‑6烷氧基、c2‑
10
烯基、c2‑
10
炔基、c3‑6环烷基、6
‑
10元芳基或5
‑
12元杂芳基,各z1各自独立地为氨基酸或2
‑
10个氨基酸组成的肽,各t1和t2各自独立地为0、1、2、3、4、5或6,各x1和x2各自独立地为0、1、2、3、4、5或6,各x3独立地为0、1、2、3或4,并且
l1的1位置处与t相连;
[0016]
l2选自氨基酸、2
‑
10个氨基酸组成的肽、寡糖、
‑
(ch2)
t1
‑
、
‑
(ch2ch2o)
t1
‑
(ch2)
t2
‑
、、其中,r3、r4、r5和r6各自独立地选自h(氢)、d(氘)、卤素、羧酸、磺酸、cn、c1‑6烷基、卤代c1‑6烷基、氰基取代的c1‑6烷基、c1‑6烷氧基、c2‑
10
烯基、c2‑
10
炔基和c3‑6环烷基,或者,r3、r4或r5、r6或r3、r5连同其所连接的碳原子形成3
‑
8元环,t1和t2各自独立地为0、1、2、3、4、5或6,y1和y2各自独立地为0、1、2、3、4、5、6、7、8、9或10,并且l2的1位置处与l1相连;
[0017]
l3选自任选地被一个或多个r7取代的下列基团:氨基、3
‑
8元环烷基、3
‑
8元脂杂环基、6
‑
12元桥杂环基、6
‑
12元螺杂环基、6
‑
12元稠杂环基、6
‑
10元芳基(例如苯基或萘基)、5
‑
12元杂芳基和3
‑
8元环烷基
‑
w
‑
;其中,w为氧或nr8,r7独立地选自h(氢)、d(氘)、卤素、=o、cn、羧基、磺酸基、c1‑6烷基、卤代c1‑6烷基、氰基取代的c1‑6烷基、c1‑6烷氧基、c2‑
10
烯基和c2‑
10
炔基,r8独立地选自h(氢)、d(氘)、c1‑6烷基、c3‑6环烷基、c1‑6烷氧基和氰基c1‑2烷基,并且l3的1位置处与l2相连;
[0018]
l4选自其中,z5优选自c2‑6亚烯烃、c2‑6亚炔烃、酰胺基、砜基、亚砜基、6
‑
10元芳基、5
‑
6元杂芳基;z2选自c1‑6亚烷基、c2‑
10
亚烯基、c2‑
10
亚炔基、c3‑8亚环烷基、6
‑
10元芳基和5
‑
14元杂芳基;r9选自h(氢)、c1‑6烷基;z3不存在或者选自c1‑6亚烷基、卤代c1‑6亚烷基和烷氧基取代的c1‑6亚烷基;或者,r9与z3连同其所连接的氮原子形成4
‑
8元杂环基;α独立地为0、1、2、3、4、5或6;并且l4的2位置处与e相连;
[0019]
e选自任选被一个或多个r
12
取代的下列基团:6
‑
10元芳基、5
‑
14元杂芳基;其中,r
12
独立地选自h(氢)、d(氘)、卤素、cn、硝基、c1‑6烷基和卤代c1‑6烷基;
[0020]
g为亲核取代反应的离去基团;如卤素、磺酰基、磺酸酯基、硝基,等等;
[0021]
m1、m2和m3各自独立地为0、1、2、3、4、5、6、7、8、9或10。
[0022]
在一些优选实施方案中,l1选自val、cit、phe、lys、d
‑
val、leu、gly、ala、asn、2
‑
5个氨基酸组成的肽、个氨基酸组成的肽、个氨基酸组成的肽、其中,各r、r’、r1和r2各自独立地为h(氢)、d(氘)、c1‑6烷基、c2‑
10
烯基、c2‑
10
炔基或c3‑6环烷基,z1为val、cit、
phe、lys、d
‑
val、leu、gly、ala、asn、val
‑
cit、cit
‑
val、cit
‑
ala、val
‑
ala、lys
‑
val、val
‑
lys(ac)、phe
‑
lys、phe
‑
lys(ac)、d
‑
val
‑
leu
‑
lys、gly
‑
gly
‑
arg或ala
‑
ala
‑
asn,x1为0、1、2或3,x3为0、1、2、3或4。
[0023]
在一些优选实施方案中,l1选自val、cit、phe、lys、d
‑
val、leu、gly、ala、asn、cit
‑
val、val
‑
ala、lys
‑
val、val
‑
lys(ac)、phe
‑
lys、phe
‑
lys(ac)、d
‑
val
‑
leu
‑
lys、gly
‑
gly
‑
arg、ala
‑
ala
‑
asn、其中,r、r’和r1各自独立地为h(氢)、d(氘)、c1‑6烷基、c2‑
10
烯基、c2‑
10
炔基或c3‑6环烷基,z1为val、cit、phe、lys、d
‑
val、leu、gly、ala、asn、val
‑
cit、cit
‑
val、cit
‑
ala、val
‑
ala、lys
‑
val、val
‑
lys(ac)、phe
‑
lys、phe
‑
lys(ac)、d
‑
val
‑
leu
‑
lys、gly
‑
gly
‑
arg或ala
‑
ala
‑
asn,x1和x3各自独立的为0、1、2或3。
[0024]
在一些优选实施方案中,l1选自lys、cit、cit
‑
val、val
‑
ala、lys
‑
val、val、其中,r、r’和r1各自独立地为h(氢)、d(氘)或c1‑4烷基,z1为cit、lys、cit
‑
val、cit
‑
ala、val
‑
ala或lys
‑
val,x1和x3各自独立的为0、1或2。
[0025]
在一些优选实施方案中,l1选自lys、cit、cit
‑
val、val
‑
ala、lys
‑
val、val、
[0026]
在一些优选实施方案中,l1选自
[0027]
在一些优选实施方案中,l2选自val、cit、phe、lys、d
‑
val、leu、gly、ala、asn、2
‑
5个氨基酸组成的肽、、、其中,r3、r4、r5和r6各自独立地选自h(氢)、d(氘)、卤素、羧酸、磺酸、cf3、cn、
ch2cn、c1‑4烷基、c1‑4烷氧基、c2‑6烯基、c2‑6炔基和c3‑6环烷基,y1和y2各自独立地为0、1、2、3、4、5、6、7或8,并且l2的1位置处与l1相连;
[0028]
m1为0、1、2或3。
[0029]
在一些优选实施方案中,l2选自val、cit、phe、lys、d
‑
val、leu、gly、ala、asn、val
‑
cit、cit
‑
val、val
‑
ala、lys
‑
val、val
‑
lys(ac)、phe
‑
lys、phe
‑
lys(ac)、d
‑
val
‑
leu
‑
lys、gly
‑
gly
‑
arg、ala
‑
ala
‑
asn、asn、其中,r3、r4、r5和r6各自独立地选自h(氢)、d(氘)、卤素、羧酸、磺酸、cf3、cn、ch2cn、c1‑4烷基、c1‑4烷氧基、c2‑6烯基、c2‑6炔基和c3‑6环烷基,y1和y2各自独立地为0、1、2、3、4、5、6、7或8,并且l2的1位置处与l1相连;
[0030]
m1为0、1或2。
[0031]
在一些优选实施方案中,l2选自选自其中,r3、r4、r5和r6各自独立地选自h(氢)、d(氘)和c1‑4烷基,y1和y2各自独立地为0、1、2、3、4、5、6、7或8,并且l2的1位置处与l1相连;
[0032]
m1为1。
[0033]
在一些优选实施方案中,l2选自选自
[0034]
在一些优选实施方案中,l2选自
[0035]
在一些优选实施方案中,l3选自任选地被一个或多个r7取代的下列基团:氨基、3
‑
8元环烷基、3
‑
8元脂杂环基、6
‑
12元桥杂环基、6
‑
12元螺杂环基、6
‑
12元稠杂环基、6
‑
10元芳基、5
‑
12元杂芳基和3
‑
8元环烷基
‑
w
‑
;其中,w为氧或nr8,r7独立地选自h(氢)、d(氘)、卤素、=o、cf3、cn、ch2cn、羧基、磺酸基、c1‑4烷基、c1‑4烷氧基、c2‑6烯基和c2‑6炔基;优选地,所述3
‑
8元脂杂环基、6
‑
12元桥杂环基、6
‑
12元螺杂环基或6
‑
12元稠杂环基含有一个或多个氮原子;优选地,所述3
‑
8元脂杂环基、6
‑
12元桥杂环基、6
‑
12元螺杂环基或6
‑
12元稠杂环基含有一个或多个季铵化的氮原子;优选地,所述3
‑
8元脂杂环基、6
‑
12元桥杂环基、6
‑
12元螺杂环基
或6
‑
12元稠杂环基含有一个或多个氮原子,其中,至少一个氮原子被=o取代;r8独立地选自h(氢)、d(氘)、c1‑6烷基、c2‑6烯基、c3‑6炔基、c3‑6环烷基、c1‑6烷氧基和氰基c1‑2烷基;
[0036]
m2为0、1、2或3。
[0037]
在一些优选实施方案中,l3选自任选地被一个或多个r7取代的下列基团:氨基、3
‑
6元脂杂环基和5
‑
10元杂芳基;其中,r7独立地选自h(氢)、d(氘)、卤素、=o、cf3、cn、ch2cn、羧基、磺酸基、c1‑4烷基、c1‑4烷氧基、c2‑6烯基和c2‑6炔基;优选地,所述3
‑
6元脂杂环基含有一个或多个氮原子;优选地,所述3
‑
6元脂杂环基含有一个或多个季铵化的氮原子;优选地,所述3
‑
6元脂杂环基含有一个或多个氮原子,其中,至少一个氮原子被=o取代;
[0038]
m2为0、1或2。
[0039]
在一些优选实施方案中,l3选自任选地被一个或多个r7取代的下列基团:氨基或5
‑
6元杂芳基;其中,r7独立地选自h(氢)、d(氘)、卤素、=o、cf3、cn、ch2cn、羧基、磺酸基、c1‑4烷基、c1‑4烷氧基、c2‑6烯基和c2‑6炔基;m2为0或1。
[0040]
在一些优选实施方案中,l3选自任选地被一个或多个r7取代的下列基团:氨基、n
‑
甲基哌啶、吡唑和三氮唑;其中,r7独立地选自h(氢)、d(氘)、卤素、=o、cf3、cn、ch2cn、羧基、磺酸基、c1‑4烷基、c1‑4烷氧基、c2‑6烯基和c2‑6炔基;m2为0或1。
[0041]
在一些优选实施方案中,l3选自三氮唑;m2为0或1。
[0042]
在一些优选实施方案中,l3选自m2为0或1;优选地,l3的1位置处与l2相连。
[0043]
在一些优选实施方案中,l3选自任选地被一个或多个r7取代的下列基团:氨基、
[0044][0045]
r7独立地选自h(氢)、d(氘)、=o、cn、ch2cn、甲基、cf3;
[0046]
w为nr8,r8选自h(氢)、d(氘)、c1‑6烷基、c2‑6烯基、c3‑6炔基和c3‑6环烷基。
[0047]
在一些优选实施方案中,l3选自
[0048][0049]
其中,r
q
各自独立地选自c1‑6烷基、c2‑6烯基、c3‑6炔基和c3‑8环烷基;β1为0、1或2;β2为1、2或3。
[0050]
在一些优选实施方案中,l3选自
[0051]
在一些优选实施方案中,l4选自选自其中z4为6
‑
10元芳基、5
‑
6元杂芳基;r
10
选自h(氢)、c1‑6烷基;z2选自c1‑6亚烷基、c2‑
10
亚烯基、c2‑
10
亚炔基、c3‑8亚环烷基;r9选自h(氢)、c1‑6烷基;z3不存在或者选自c1‑6亚烷基;或者,r9与z3连同其所连接的氮原子形成4
‑
8元杂环基;α独立地为0、1、2、3、4、5或6,并且l4的2位置处与e相连;
[0052]
m3选自0、1、2或3。
[0053]
在一些优选实施方案中,l4选自选自其中,z4为苯环,r
10
选自h(氢)、c1‑6烷基;z2选自c1‑6亚烷基、c2‑
10
亚烯基、c2‑
10
亚炔基、c3‑8亚环烷基;r9选自h(氢)、c1‑6烷基;z3不存在或者选自c1‑6亚烷基,或者,r9与z3连同其所连接的氮原子形成4
‑
8元杂环基;α独立地为0、1、2、3、4、5或6,并且l4的2位置处与e相连;
[0054]
m3选自0、1、2或3。
[0055]
在一些优选实施方案中,l4选自选自其中z4为5
‑
6元杂芳基;r
10
选自h(氢)、c1‑6烷基;z2选自c1‑6亚烷基、c2‑
10
亚烯基、c2‑
10
亚炔基、c3‑8亚环烷基;r9选自h(氢)、c1‑6烷基;z3不存在或者选自c1‑6亚烷基;或者,r9与z3连同其所连接的氮原子形成4
‑
8元杂环基;α独立地为0、1、2、3、4、5或6,并且l4的2位置处与e相连;
[0056]
m3选自0、1、2或3。
[0057]
在一些优选实施方案中,l4选自选自
[0058]
m3为1。
[0059]
在一些优选实施方案中,l4选自选自
[0060]
m3为1。
[0061]
在一些优选实施方案中,l4选自
[0062]
m3为1。
[0063]
在一些优选的实施方案中,e选自任选被一个或多个r
12
取代的5
‑
10元杂芳基;其中,r
12
独立地选自h(氢)、d(氘)、卤素、cn、硝基、c1‑4烷基和卤代c1‑4烷基。
[0064]
在一些优选的实施方案中,e选自任选被一个或多个r
12
取代的下列基团:嘧啶、喹唑啉和吡咯并[2,3
‑
d]嘧啶;其中,r
12
独立地选自h(氢)、d(氘)、卤素、cn、硝基、c1‑2烷基和卤代c1‑2烷基。
[0065]
在一些优选的实施方案中,e选自任选被一个或多个r
12
取代的嘧啶;其中,r
12
独立地选自h(氢)和d(氘)。
[0066]
在一些优选实施方案中,g选自卤素、oms、ots、otf、硝基、以及任选被一个或多个r
13
取代的下列基团:烷基硫醚基、芳基硫醚基、杂芳基硫醚基,烷基亚砜基、芳基亚砜基、杂芳基亚砜基,烷基磺酰基、芳基磺酰基、杂芳基磺酰基;其中,r
13
独立地选自h(氢)、d(氘)、卤素、cn、硝基、c1‑6烷基、卤代c1‑6烷基、c1‑6烷氧基、6
‑
10元芳基和5
‑
12元杂芳基。
[0067]
在一些优选实施方案中,g选自f、cl、br、i、oms、ots、otf、甲磺酰基、乙磺酰基、对甲苯磺酰基和萘磺酰基。
[0068]
在一些优选实施方案中,g选自f、cl、br、oms、ots、甲磺酰基和对甲苯磺酰基。
[0069]
在一些优选实施方案中,g选自cl和甲磺酰基。
[0070]
在一些优选实施方案中,中,g优选甲磺酰基,e优选嘧啶,m3为1。
[0071]
在一些优选实施方案中,为其中,m4优选0
‑
6的整数,甲磺酰基为嘧啶环
中与氮原子相邻的碳原子的取代基。
[0072]
在一些优选实施方案中,为其中,m5优选0
‑
6的整数,甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。
[0073]
在一些优选实施方案中,为其中,m6优选自0
‑
6的整数,甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。
[0074]
在一些优选实施方案中,为其中,m7选自1
‑
5的整数,甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。
[0075]
在一些优选实施方案中,为其中,m8选自1
‑
5的整数,甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。
[0076]
在一些优选实施方案中,为其中,m9选自1
‑
5的整数,r
13
选自氢、c1‑6烷基,甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。
[0077]
在一些优选实施方案中,为其中m
10
选自0
‑
6的整数,z4选自5
‑
6元杂芳基;甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。
[0078]
在一些优选实施方案中,为
z4自吡啶、嘧啶、吡唑、噻唑、噁唑和三氮唑,甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。更优选地,m
10
选自0
‑
6的整数。
[0079]
在一些优选实施方案中,为z4自吡啶、嘧啶、吡唑和三氮唑。更优选地,m
10
选自0
‑
6的整数。
[0080]
在一些优选实施方案中,为z4自噁唑和噻唑,甲磺酰基为嘧啶环中与氮原子相邻的碳原子的取代基。更优选地,m
10
选自0
‑
6的整数。
[0081]
在一些优选实施方案中,为其中m
10
选自0
‑
6的整数,z4选自6
‑
10元芳基;甲磺酰基为氮原子相邻的碳原子取代基。更优选地,m
10
选自0
‑
6的整数。
[0082]
在一些优选实施方案中,为其中m
10
选自0
‑
6的整数,z4为苯环。
[0083]
在一些优选的实施方案中,为为
[0084]
在一些优选地实施方案中,式(i)中选自下述结构片段:
[0085]
[0086]
[0087]
[0088][0089]
[0090]
在一些优选实施方案中,t为生物活性分子片段。在一些优选实施方案中,所述生物活性分子选自金属配合物,例如金属铂配合物(例如奥沙利铂)、金属金配合物;糖肽类抗生素,例如博来霉素或平阳霉素;dna拓扑异构酶抑制剂,例如拓扑异构酶i抑制剂(例如喜树碱、羟基喜树碱、9
‑
氨基喜树碱、sn
‑
38、伊立替康、拓扑替康、贝洛替康或卢比替康),拓扑异构酶ii抑制剂(例如放线菌素d、多柔比星、多卡米星,柔红霉素、米托蒽醌、鬼臼毒素或依托泊苷);干扰dna合成药物,例如甲氨蝶呤、5
‑
氟尿嘧啶、阿糖胞苷、吉西他滨、巯嘌呤、喷司他丁、氟达拉滨、克拉屈滨或奈拉滨;作用于结构蛋白的药物,例如微管蛋白抑制剂,长春花生物碱类、长春新碱、长春碱、紫杉醇、多西他赛或卡巴他赛;肿瘤信号通路抑制剂,例如丝氨酸/苏氨酸激酶抑制剂、酪氨酸激酶抑制剂、天冬氨酸激酶抑制剂或组氨酸激酶抑制剂;蛋白酶体抑制剂;组蛋白去乙酰化酶抑制剂;肿瘤新生血管生成抑制剂;细胞周期蛋白抑制剂;美登素衍生物;卡里奇霉素衍生物;奥瑞他汀衍生物;pyrrolobenzodiazepine dimers(pbd)衍生物;美法仑;丝裂霉素c;苯丁酸氮芥;以及其它抑制肿瘤细胞生长、促进肿瘤细胞凋亡或坏死的活性物质。
[0091]
在一些优选实施方案中,所述生物活性分子选自所述生物活性分子选自所述生物活性分子选自其中r
14
选自r
15
取代的酰基或者磺酰基,r
15
选自c1‑6烷基、卤代c1‑6烷基、6
‑
10元芳基和5
‑
12元杂芳基;r
16
选自h(氢)、d(氘)、c1‑6的烷基、r
17
取代的c1‑6的烷基,r
17
选自芳基、杂芳基,包括但不限于苯基、吡啶基,m
11
选自0、1、2。
[0092]
在一些优选实施方案中,所述生物活性分子选自在一些优选实施方案中,所述生物活性分子选自其中r
14
选自r
15
取代的酰基或者磺酰基,r
15
选自c1‑6烷基、卤代c1‑6烷基、6
‑
10元芳基和5
‑
12元杂芳基;r
16
选自h(氢)、d(氘)、c1‑6的烷基、r
17
取代的c1‑6的烷基,r
17
选自芳基、杂芳基,包括但不限于苯基、吡啶基,m
11
选自0、1、2。
[0093]
在一些优选实施方案中,所述生物活性分子选自
[0094]
在一些优选实施方案中,所述生物活性分子选自
[0095]
在一些优选实施方案中,所述生物活性分子选自所述生物活性分子选自
[0096]
在一些优选实施方案中,所述生物活性分子选自
[0097][0098]
在一些优选实施方案中,生物活性分子选自
[0099][0100]
在一些优选实施方案中,t选自
[0101][0102][0103]
在一些优选实施方案中,t选自
[0104][0105]
在一些优选实施方案中,t选自
[0106][0107]
[0108]
在一些优选实施方案中,t选自
[0109][0110]
在一些优选实施方案中,t选自
[0111][0112]
在一些优选实施方案中,式(i)所示化合物选自
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122][0123]
在一些优选实施方案中,所述化合物选自
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
[0131][0132]
在第二个方面,本公开提供一种偶联物,其含有生物活性分子、连接体和靶向部分。所述靶向部分通过其活性基团(例如巯基)与所述连接体连接形成偶联物。
[0133]
在一些优选实施方案中,所述偶联物结构如式(ii)所示:
[0134]
{t
‑
[l1‑
(l2)
m1
‑
(l3)
m2
‑
(l4)
m3
‑
e]}
γ
‑
a
[0135]
式(ii)
[0136]
其中,a为靶向部分(例如小分子配体、蛋白质、多肽、非蛋白质试剂(例如糖、rna或dna));γ选自1
‑
10之间的整数或小数;优选地,γ选自5
‑
8之间的整数或小数(例如5、6、7或8);
[0137]
其余基团如本公开第一方面所述。
[0138]
在一些优选实施方案中,a的靶标选自表皮生长因子、trop
‑
2、cd37、her2、cd70、egfrviii、mesothelin、folate receptor1、mucin 1、cd138、cd20、cd19、cd30、sltrk6、nectin 4、tissue factor、mucin16、endothelin receptor、steap1、slc39a6、guanylylcyclase c、psma、ccd79b、cd22、sodium phosphate cotransporter 2b、gpnmb、trophoblast glycoprotein、ags
‑
16、egfr、cd33、cd66e、cd74、cd56、pd
‑
l1、tacstd2、dr5、e16、0772p、mpf、napi3b、sema 5b、psca hlg、etbr、msg783、steap2、trpm4、cripto、cd21、cd79b、fcrh2、nca、mdp、il20rα、brevican、ephb2r、aslg659、psca、geda、baff
‑
r、cd79a、cxcr5、hla
‑
dob、p2x5、cd72、ly64、fcrh1、irta2、tenb2、整合素α5β6,α4β7、fgf2、fgfr2、her3、ca6、dll3、dll4、p
‑
cadherin、epcam、pcad、cd223、lypd3、ly6e、efna4、ror1、slitrk6、5t4、enpp3、claudin18.2、bmpr1b、tyro7、c
‑
met、apoe、cd1 lc、cd40、cd45(ptprc)、cd49d(itga4)、cd80、csf1r、ctsd、gzmb、ly86、ms4a7、pik3ap1、pik3cd、ccr5、ifng、il10ra1、il
‑
6、acta2、col7a1、lox、lrrc15、mcpt8、mmp10、nog、serpinel、stat1、tgfbr1、ctss、pgf、vegfa、c1qa、c1qb、angptl4、egln、egln3、bnip3、aif1、ccl5、cxcl10、cxcl11、ifi6、plod2、kiss1r、stc2、ddit4、pfkfb3、pgk1、pdk1、akr1c1、akr1c2、cadm1、cdh11、col6a3、ctgf、hmox1、krt33a、lum、wnt5a、igfbp3、mmp14、cdcp1、pdgfra、tcf4、tgf、tgfb1、tgfb2、cdllb、adgre1、emr2、tnfrsf21、upk1b、tnfsf9、mmp16、mfi2、igf
‑
1r、rnf43、napi2b和bcma。
[0139]
在一些优选实施方案中,a为小分子配体,例如叶酸衍生物、谷氨酸脲衍生物、生长
抑素衍生物、芳基磺酰胺类衍生物(例如碳酸酐酶ix抑制剂)、连接两个脂肪族吲哚的多烯,花青染料或ir
‑
783或其衍生物。
[0140]
在一些优选实施方案中,a选自
[0141][0142]
在一些优选实施方案中,a为抗体,例如单克隆抗体或其抗原结合片段,其中,所述单克隆抗体或其抗原结合片段包括fab、fab'、f(ab')2、fd、fv、dab、互补决定区片段、单链抗体(例如,scfv)、非人抗体、人源化抗体、嵌合抗体、全人抗体、前抗(probody)、双特异性抗体或多特异性抗体。
[0143]
在一些优选实施方案中,a为抗her 2的单克隆抗体,例如曲妥珠单抗、帕妥珠单抗(pertuzumab)或抗trop
‑
2的单克隆抗体,例如sacituzumab。
[0144]
在一些优选实施方案中,a为抗trop
‑
2的单克隆抗体,例如m1,m2,及m3。
[0145][0146]
氨基酸在各区域或结构域的分配可遵循chothia&lesk(1987)j.mol.biol.196:901
‑
917;chothia等人(1989)nature 342:878
‑
883的定义。
[0147]
1.疏水性改造抗体m1的重链和轻链序列
[0148]
m1重链可变区的氨基酸序列:(121aa)
[0149]
qvqlqqsgselkkpgasvkvsckasgytftnygmnwvkqapgqglkwmgwintdsgeptytddfkgrfafsldtsvstaylqisslkaddtavyfcarggfgssywyfdvwgqgslvtvss(seq id no.:11)
[0150]
m1轻链可变区的氨基酸序列:(107aa)
[0151]
diqltqspsslsasvgdrvsitckasqdvssavawyqqkpgkapklliysasyrytgvpdrfsgsgsgtdftltisslqpedfavyycqqhystpltfgagtkveik(seq id no.:12)
[0152]
2.疏水性改造抗体m2的重链和轻链序列
[0153]
m2重链可变区的氨基酸序列:(121aa)
[0154]
qvqlqqsgselkkpgasvkvsckasgytftnygmnwvkqapgqglkwmgwintdsgeptytddfkgrfafsldtsvstaylqisslkaddtavyfcarggfgssywyfdvwgqgslvtvss(seq id no.:13)
[0155]
m2轻链可变区的氨基酸序列:(107aa)
[0156]
diqltqspsslsasvgdrvsitckasqdvssavawyqqkpgkapklliysasyrytgvpdrfsgsgsgtdftltisslqpedfavyycqqhyitpltfgagtkveik(seqid no.:14)
[0157]
3.疏水性改造抗体m3的重链和轻链序列
[0158]
m3重链可变区的氨基酸序列:(121aa)
[0159]
qvqlqqsgselkkpgasvkvsckasgytftnygmnwvkqapgqglkwmgwintdsgeptytddfkgrfafsldtsvstaylqisslkaddtavyfcarggfgssywyfdvwgqgslvtvss(seq id no.:15)
[0160]
m3轻链可变区的氨基酸序列:(107aa)
[0161]
diqltqspsslsasvgdrvsitckasqdvsiavawyqqkpgkapklliysasyrytgvpdrfsgsgsgtdftltisslqpedfavyycqqhystpltfgagtkveik(seqid no.:16)
[0162]
m1,m2,m3轻链恒定区序列:(107aa)
[0163]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no.:9)
[0164]
m1,m2,m3重链恒定区序列:(330aa)
[0165]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no.:10)
[0166]
重链末位lys是容易缺失的,但这种缺失并不影响生物活性,参见dick,l.w.等人,biotechnol.bioeng.,100:1132
‑
1143。上述m1,m2,m3单抗及其重链末位lys缺失的序列或其片段均属于本发明所述的m1,m2,m3单抗。
[0167]
在一些优选实施方案中,a选自识别细胞表面整联蛋白受体的rgd肽;识别细胞表面生长因子受体的生长因子例如egf、pdgf或vegf;以及能识别功能性细胞表面纤溶酶原活化因子、蛙皮素、缓激肽、生长抑素或前列腺特异性膜抗原受体的肽。
[0168]
在一些优选实施方案中,a选自cd40配体、cd30配体、ox40配体、pd
‑
1配体、erbb配体、her2配体、tacstd2配体和dr5配体。
[0169]
在一些优选实施方案中,所述偶联物选自:
[0170]
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178][0179]
其中,γ选自1
‑
10之间的整数或小数,mab为抗trop
‑
2的单克隆抗体或抗her 2的单克隆抗体;优选地,抗trop
‑
2的单克隆抗体选自sacituzumab,m1,m2和m3抗体,抗her 2的单克隆抗体选自曲妥珠单抗、帕妥珠单抗;优选地,γ选自5
‑
8之间的整数或小数(例如5、6、7或8)。
[0180]
在一些优选实施方案中,所述偶联物选自:
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187][0188]
其中,γ选自1
‑
10之间的整数或小数,mab为抗trop
‑
2的单克隆抗体或抗her 2的单克隆抗体;优选地,抗trop
‑
2的单克隆抗体选自sacituzumab,抗her 2的单克隆抗体选自曲妥珠单抗、帕妥珠单抗;优选地,γ选自5
‑
8之间的整数或小数(例如5、6、7或8)。
[0189]
在一些优选实施方案中,所述偶联物为:
[0190]
[0191]
[0192]
[0193][0194]
其中,a1为sacituzumab抗体,γ选自1
‑
10之间的整数或小数;优选的γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0195]
在一些优选实施方案中,所述偶联物为:
[0196]
[0197][0198]
其中,a1为sacituzumab抗体,γ选自1
‑
10之间的整数或小数;优选的γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0199]
在一些优选实施方案中,所述偶联物为:
[0200][0201]
其中,a1为sacituzumab抗体,γ选自1
‑
10之间的整数或小数;优选的γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0202]
在一些优选实施方案中,所述的偶联物为:
[0203]
[0204]
其中,a1为sacituzumab抗体的片段,γ选自1
‑
10之间的整数或小数;优选的γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0205]
在一些优选实施方案中,所述偶联物为:
[0206]
[0207]
[0208][0209][0210]
其中,a2为曲妥珠单抗,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0211]
在一些优选实施方案中,所述偶联物为:
[0212]
[0213][0214]
其中,a2为曲妥珠单抗,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0215]
在一些优选实施方案中,所述偶联物为:
[0216][0217]
其中,a2为曲妥珠单抗,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0218]
在一些优选实施方案中,所述偶联物为:
[0219]
[0220]
[0221][0222]
[0223]
其中,a3为帕妥珠单抗,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0224]
在一些优选实施方案中,所述偶联物为:
[0225]
[0226][0227]
其中,a3为帕妥珠单抗,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0228]
在一些优选实施方案中,所述偶联物为:
[0229]
[0230]
[0231][0232][0233]
其中,a4为m1抗体,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0234]
在一些优选实施方案中,所述偶联物为:
[0235][0236]
其中,a4为m1抗体,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0237]
在一些优选实施方案中,所述偶联物为:
[0238]
[0239]
[0240]
[0241][0242]
其中,a5为m2抗体,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0243]
在一些优选实施方案中,所述偶联物为:
[0244][0245]
其中,a5为m2抗体,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0246]
在一些优选实施方案中,所述偶联物为:
[0247]
[0248]
[0249][0250]
其中,a6为m3抗体,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0251]
在一些优选实施方案中,所述偶联物为:
[0252][0253]
其中,a6为m3抗体,γ选自1
‑
10之间的整数或小数;优选的,γ选自5
‑
8之间的整数或小数,例如6
‑
7,6
‑
7.5,6
‑
8,6.5
‑
7,6.5
‑
7.5,6.5
‑
8,7
‑
8或7.5
‑
8之间的整数或小数。
[0254]
在另一个方面,本公开提供第二方面所述的偶联物的制备方法,其包括将式(i)化合物的连接体与靶向部分的活性基团进行偶联的步骤。
[0255]
在一些优选实施方案中,所述方法包括使用还原剂(例如tcep)打开靶向部分的二硫键,得到巯基。
[0256]
在一些优选实施方案中,所述方法包括将式(i)化合物的连接体与靶向部分的巯基形成c
‑
s键的步骤。
[0257]
在一些优选实施方案中,所述靶向部分为抗her 2的单克隆抗体(例如曲妥珠单抗、帕妥珠单抗(pertuzumab))或抗trop
‑
2的单克隆抗体(例如sacituzumab,m1,m2或m3),或其活性片段或变体。
[0258]
在一些优选实施方案中,所述靶向部分与式(i)化合物的物质的量之比为1:(1
‑
20);优选地,所述偶联在水和/或有机溶剂中进行;优选地,所述有机溶剂选自n,n
‑
二甲基甲酰胺、二甲基亚砜、n
‑
甲基吡咯烷酮、腈类(例如乙腈)、醇类(例如甲醇、乙醇)及其任意组合。
[0259]
在一些优选实施方案中,所述方法还包括将偶联产物进行纯化的步骤;优选地,通过层析方法(例如离子交换层析、疏水层析、反相层析或亲和层析中的一种或多种)对偶联产物进行纯化。
[0260]
在另一个方面,本公开提供一种药物组合物,其包含本公开第一方面所述的化合物或或其药学上可接受的盐,或第二方面所述的偶联物,以及一种或多种药用辅料。
[0261]
在另一个方面,本公开提供第一方面所述的化合物或其药学上可接受的盐或第二方面所述的偶联物在制备治疗与细胞活动异常相关的疾病(例如癌症疾病)的药物中的用途。
[0262]
在一些优选实施方案中,所述癌症疾病为实体瘤或非实体瘤,例如选自食管癌(例如食管腺癌和食管鳞状细胞癌)、脑瘤、肺癌(例如小细胞性肺癌和非小细胞性肺癌)、鳞状上皮细胞癌、膀胱癌、胃癌、卵巢癌、腹膜癌、胰腺癌、乳腺癌、头颈癌、子宫颈癌、子宫内膜癌、结直肠癌、肝癌、肾癌、非霍奇金淋巴瘤、中枢神经系统肿瘤(例如神经胶质瘤、多形性胶质母细胞瘤、胶质瘤或肉瘤)、前列腺癌和甲状腺癌。
[0263]
在另一方面,本公开提供第一方面所述的化合物或其药学上可接受的盐或第二方面所述的偶联物或药物组合物用于治疗与细胞活动异常相关的疾病(例如癌症疾病)中的用途。
[0264]
在另一方面,本公开提供治疗与细胞活动异常相关的疾病(例如癌症疾病)的方法,包括给有此需要的个体有效剂量的本公开提供第一方面所述的化合物或其药学上可接
受的盐或第二方面所述的偶联物或药物组合物。
[0265]
在本公开中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的细胞培养、分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本公开,下面提供相关术语的定义和解释。
[0266]
本公开中,所述药用辅料是指生产药品和调配处方时,使用的的赋形剂和附加剂,是指除活性成分外,在安全性方面已进行了合理的评估,并且包含在药物制剂中的物质。药用辅料除了赋型、充当载体、提高稳定性外,还具有增溶、助溶、缓控释等重要功能,是可能会影响到药品的质量、安全性和有效性的重要成分。根据其来源可分为天然物、半合成物和全合成物。根据其作用与用途可分为:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、湿润剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏着剂、抗氧剂、螯合剂、渗透促进剂、ph调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂等;根据其给药途径可分为口服、注射、黏膜、经皮或局部给药、经鼻或口腔吸入给药和眼部给药等。同一药用辅料可用于不同给药途径的药物制剂,且有不同的作用和用途。
[0267]
所述药物组合物可根据给药途径制成各种适宜的剂型。例如片剂、胶囊剂、颗粒剂、口服溶液剂、口服混悬剂、口服乳剂、散剂、酊剂、糖浆剂、注射剂、栓剂、软膏剂、乳膏剂、糊剂、眼用制剂、丸剂、植入剂、气雾剂、粉雾剂、喷雾剂等。其中,所述的药物组合物或适宜的剂型可以含有0.01mg至1000mg的本公开的化合物或其药学上可接受的盐或偶联物,适宜含有0.1mg至800mg,优选含有0.5
‑
500mg,优选含有0.5至350mg,特别优选1
‑
250mg。
[0268]
所述药物组合物可以注射剂形式用药,包括注射液、注射用无菌粉末与注射用浓溶液。其中,可使用的载体和溶剂包括水、林格氏溶液和等渗氯化钠溶液。另外,灭菌的非挥发油也可用作溶剂或悬浮介质,如单甘油酯或二甘油酯。
[0269]
在本公开中,术语“个体”包括人或非人动物。示例性人个体包括患有疾病(例如本文所述的疾病)的人个体(称为患者)或正常个体。本公开中术语“非人动物”包括所有脊椎动物,例如非哺乳动物(例如鸟类、两栖动物、爬行动物)和哺乳动物,例如非人灵长类、家畜和/或驯化动物(例如绵羊、犬、猫、奶牛、猪等)。
[0270]
本公开中,术语“有效剂量”指被给药后会在一定程度上缓解所治疗病症的一或多种症状的化合物的量。
[0271]
本公开中,术语“偶联物”是指生物活性分子与靶向部分连接得到的物质。在本公开的部分实施方案中,生物活性分子与靶向部分通过连接体相连。所述连接体在特定环境(例如胞内低ph值环境)中或特定作用(例如溶酶体蛋白酶的作用)下能够断裂,从而使生物活性分子与靶向部分分离。在本公开的部分实施方案中,所述连接体包含可切割或不可切割的单元,例如肽或二硫键。在本公开的部分实施方案中,生物活性分子与靶向部分直接通过共价键相连,所述共价键在特定环境或作用下能够断裂,从而使生物活性分子与靶向部分分离。
[0272]
本公开中,术语“生物活性物”和“生物活性分子”指抑制或防止细胞的功能和/或引起细胞死亡或破坏的物质,在本公开的部分实施方案中,偶联物中的生物活性物或生物
活性分子为具有抗肿瘤生物活性的分子。例如:放射性同位素,例如at
211
、i
131
、i
125
、y
90
、re
186
、re
188
、sm
153
、bi
212
、p
32
、pb
212
和lu的放射性同位素;金属配合物,例如金属铂配合物、金属金配合物,奥沙利铂等;糖肽类抗生素,例如博来霉素、平阳霉素;dna拓扑异构酶抑制剂,例如拓扑异构酶i抑制剂,喜树碱、羟基喜树碱、9
‑
氨基喜树碱、sn
‑
38、伊立替康、拓扑替康、贝洛替康、卢比替康,拓扑异构酶ii抑制剂,放线菌素d、多柔比星、多卡米星,柔红霉素、米托蒽醌、鬼臼毒素、依托泊苷等;干扰dna合成药物,例如甲氨蝶呤、5
‑
氟尿嘧啶、阿糖胞苷、吉西他滨、巯嘌呤、喷司他丁、氟达拉滨、克拉屈滨、奈拉滨等;作用于结构蛋白的药物,例如微管蛋白抑制剂,长春花生物碱类、长春新碱、长春碱、紫杉醇、多西他赛、卡巴他赛等;肿瘤信号通路抑制剂,例如丝氨酸/苏氨酸激酶抑制剂、酪氨酸激酶抑制剂、天冬氨酸激酶抑制剂或组氨酸激酶抑制剂等;还包括蛋白酶体抑制剂、组蛋白去乙酰化酶抑制剂、肿瘤新生血管生成抑制剂、细胞周期蛋白抑制剂、美登素衍生物、卡里奇霉素衍生物、奥瑞他汀衍生物、pyrrolobenzodiazepines(pbd)衍生物、美法仑、丝裂霉素c、苯丁酸氮芥、或其它抑制肿瘤细胞生长、促进肿瘤细胞凋亡和坏死的活性物质;酶及其片段,诸如核溶酶;抗生素;毒素,诸如小分子毒素或者细菌、真菌、植物或动物起源的酶活性毒素,包括其片段和/或变体;生长抑制剂;药物模块。术语“毒素”指能够对细胞的生长或增殖产生有害效果的物质。
[0273]
本公开中,术语“小分子”是指具有生物活性的小分子药物。
[0274]
本公开中,术语“连接体”是指将生物活性分子与靶向部分连接起来的片段。
[0275]
本公开中,术语“靶向部分”是指偶联物中能够与细胞表面的靶标(或靶标的部分)特异性结合的部分。通过靶向部分与靶标的相互作用,偶联物可以被递送至特定的细胞群。
[0276]
本公开中,当偶联物中的靶向部分为抗体时,偶联物可被称为“药物
‑
抗体偶联物”。本公开中,“药物
‑
抗体偶联物”与“免疫偶联物”可以互换使用。
[0277]
本公开中,术语“抗体”取其最广义的解释,包括完整的单克隆抗体、多克隆抗体以及由至少两个完整抗体形成的多特异性抗体(例如双特异性抗体),只要它们具有所需的生物学活性。在本公开中,“抗体”和“免疫球蛋白”可以互换使用。
[0278]
在本公开中,术语“单克隆抗体”指抗体来自一群基本均一的抗体,即构成该集群的各抗体完全相同,除了可能存在的少量天然突变。单克隆抗体具有针对抗原的一个决定簇(表位)的高特异性,而与其相对的多克隆抗体则包含针对不同决定簇(表位)的不同抗体。除了特异性之外,单克隆抗体的优点还在于合成时可以不受其他抗体的污染。此处修饰语“单克隆”表示该抗体的特征在于来自一个基本均一的抗体群,而不应理解成需由特殊方法制得。
[0279]
在本公开的部分实施方案中,单克隆抗体还特别包括嵌合抗体,即重链和/或轻链的一部分与某种、某类或某亚类抗体相同或同源,其余部分则与另一种、另一类或另一亚类抗体相同或同源,只要它们具有所需的生物学活性(参见例如us 4,816,567;和morrison等人,1984,pnas,81:6851
‑
6855)。可用于本公开的嵌合抗体包括灵长类化(primatized)抗体,其包含来自非人灵长类(例如古猴、猩猩等)的可变区抗原结合序列和人恒定区序列。
[0280]
术语“抗体片段”是指抗体的一部分,优选是抗原结合区或可变区。抗体片段的实例包括fab、fab
′
、f(ab
′
)2、fd、fv、dab和互补决定区片段,二抗体(diabody),线性抗体和单链抗体分子。
[0281]
术语“双特异性抗体”亦称为“双功能抗体偶联物”,是指由第一抗体(片段)和第二
抗体(片段)通过偶联臂所形成的偶联物,该偶联物保留了各自抗体的活性,故具有双功能和双特异性。
[0282]
术语“多特异性抗体”包括例如三特异性抗体和四特异性抗体,前者是具有三种不同抗原结合特异性的抗体,而后者是具有四种不同抗原结合特异性的抗体。
[0283]
术语“完整抗体”指包含抗原结合可变区和轻链恒定区(cl)、重链恒定区(ch1、ch2和ch3)的抗体。恒定区可以是天然序列(例如人天然恒定区序列)或其氨基酸序列变体。完整抗体优选是具有一种或多种效应功能的完整抗体。
[0284]
术语“前抗(probody)”是一种修饰的抗体,包括一种抗体或一种抗体片段,能专门与其靶点结合,能够与掩蔽基团耦合,其中掩蔽基团指对抗体或抗体片段与其靶点的结合能力的裂解常数比没有耦合掩蔽基团的抗体或抗体片段与其靶点的结合能力的裂解常数至少大100倍或1000倍、或者10000倍。
[0285]
在本公开中,非人(例如鼠)抗体的“人源化”形式指包含最少量非人免疫球蛋白序列的嵌合抗体。大多数人源化抗体是人接受者免疫球蛋白的超变区残基被置换成具有所需特异性、亲和力和功能的非人(例如小鼠、大鼠、兔或非人灵长类)超变区残基(供者抗体)。在一些实施方案中,人免疫球蛋白的框架区(fr)残基也被置换成非人残基。而且,人源化抗体还可以包含受者抗体或供者抗体中没有的残基。这些修饰是为了进一步优化抗体的性能。人源化抗体一般包含至少一个,通常是两个可变区,其中所有或几乎所有超变环(hypervanable loops)与非人免疫球蛋白的相对应,而fr则完全或几乎完全是人免疫球蛋白的序列。人源化抗体还可以包含免疫球蛋白恒定区(fc,通常是人免疫球蛋白fc)的至少一部分。有关细节参见例如jones等人,1986,nature,321:522
‑
525;riechmann等人,1988,nature,332:323
‑
329;和presta,1992,curr op struct bwl 2:593
‑
596。
[0286]
完整抗体可根据重链恒定区的氨基酸序列分为不同的“类”。主要的五类是iga、igd、ige、igg和igm,其中几类还可以分为不同的“亚类”(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。抗体不同类的重链恒定区分别称为α、β、ε、γ和μ。免疫球蛋白不同类的亚基结构和三维构型是本领域中公知的。
[0287]
在本公开中,尽管大多数情况下抗体中的氨基酸取代是被l
‑
氨基酸取代,但也不限于此。在一些实施方案中,抗体肽链中可以包括一个或多个d
‑
氨基酸。包含d
‑
氨基酸的肽在口腔、肠道或血浆中比仅包含l
‑
氨基酸的肽更加稳定而不易降解。
[0288]
本公开所用的单克隆抗体可以由许多方法生产。例如,用于本公开的单克隆抗体可以通过杂交瘤方法,使用许多物种(包括小鼠、仓鼠、大鼠和人的细胞)获得(参见例如kohler等人,1975,nature,256:495),或者通过重组dna技术制得(参见例如us 4,816,567),或者从噬菌体抗体库中分离得到(参见例如clackson等人,1991,nature,352:624
‑
628;和marks等人,1991,journal of molecular biology,222:581
‑
597)。可用于本公开的单克隆抗体包括但不限于:抗her 2的单克隆抗体、例如曲妥珠单抗、帕妥珠单抗(pertuzumab),或抗trop
‑
2的单克隆抗体,例如sacituzumab(即isactuzumab或hrs7抗体),m1,m2或m3。
[0289]
在本公开的部分实施方案中,所述靶向部分a的靶标选自:表皮生长因子、trop
‑
2、cd37、her2、cd70、egfrviii、mesothelin、folate receptor1、mucin 1、cd138、cd20、cd19、cd30、sltrk6、nectin 4、tissue factor、mucin16、endothelin receptor、steap1、
slc39a6、guanylylcyclase c、psma、ccd79b、cd22、sodium phosphate cotransporter 2b、gpnmb、trophoblast glycoprotein、ags
‑
16、egfr、cd33、cd66e、cd74、cd56、pd
‑
l1、tacstd2、dr5、e16、0772p、mpf、napi3b、sema 5b、psca hlg、etbr、msg783、steap2、trpm4、cripto、cd21、cd79b、fcrh2、nca、mdp、il20rα、brevican、ephb2r、aslg659、psca、geda、baff
‑
r、cd79a、cxcr5、hla
‑
dob、p2x5、cd72、ly64、fcrh1、irta2、tenb2、整合素α5β6,α4β7、fgf2、fgfr2、her3、ca6、dll3、dll4、p
‑
cadherin、epcam、pcad、cd223、lypd3、ly6e、efna4、ror1、slitrk6、5t4、enpp3、claudin18.2、bmpr1b、tyro7、c
‑
met、apoe、cd1 lc、cd40、cd45(ptprc)、cd49d(itga4)、cd80、csf1r、ctsd、gzmb、ly86、ms4a7、pik3ap1、pik3cd、ccr5、ifng、il10ra1、il
‑
6、acta2、col7a1、lox、lrrc15、mcpt8、mmp10、nog、serpinel、stat1、tgfbr1、ctss、pgf、vegfa、c1qa、c1qb、angptl4、egln、egln3、bnip3、aif1、ccl5、cxcl10、cxcl11、ifi6、plod2、kiss1r、stc2、ddit4、pfkfb3、pgk1、pdk1、akr1c1、akr1c2、cadm1、cdh11、col6a3、ctgf、hmox1、krt33a、lum、wnt5a、igfbp3、mmp14、cdcp1、pdgfra、tcf4、tgf、tgfb1、tgfb2、cdllb、adgre1、emr2、tnfrsf21、upk1b、tnfsf9、mmp16、mfi2、igf
‑
1r、rnf43、napi2b和bcma。
[0290]
在本公开的部分实施方案中,所述靶向部分a的靶标选自:识别细胞表面整联蛋白受体的rgd肽;识别细胞表面生长因子受体的生长因子例如egf、pdgf、vegf;以及能识别功能性细胞表面纤溶酶原活化因子、蛙皮素、缓激肽、生长抑素、前列腺特异性膜抗原受体的肽。
[0291]
在本公开的部分实施方案中,所述靶向部分a的靶标选自:cd40配体、cd30配体、ox40配体、pd
‑
1配体、erbb配体、her2配体、tacstd2配体和dr5配体。
[0292]
在本公开的部分实施方案中,所述靶向部分a为抗her 2的单克隆抗体,例如曲妥珠单抗、帕妥珠单抗(pertuzumab);或所述靶向部分为抗trop
‑
2的单克隆抗体,例如sacituzumab、m1、m2或m3。
[0293]
在本公开的部分实施方案中,靶向部分为曲妥珠单抗或帕妥珠单抗(pertuzumab)。曲妥珠单抗是抗her 2的单克隆抗体,其氨基酸序列是本领域技术人员已知的,其示意性序列可参见,例如cn103319599。
[0294]
在本公开的部分实施方案中,所述靶向部分的重链末位lys是容易缺失的但不影响生物活性,参见dick,l.w.等人,biotechnol.bioeng.,100:1132
‑
1143。例如,所述靶向部分为抗trop
‑
2的单克隆抗体,例如sacituzumab、m1、m2或m3重链末位lys缺失,例如,所述靶向部分为抗her 2的单克隆抗体,例如曲妥珠单抗、帕妥珠单抗(pertuzumab)重链末位lys缺失。
[0295]
曲妥珠单抗的示例性的重链序列和轻链序列可参见例如seq id no.:17和seq id no.:18。在本公开中,当提及或涉及曲妥珠单抗的重链序列和轻链序列时,其分别使用seq id no.:17和seq id no.:18所示的序列来进行描述。帕妥珠单抗的示例性的重链序列和轻链序列可参见us7560111的seq id no.:16和seq id no.:15。
[0296]
seq id no.:17(重链序列)
[0297]
evqlvesggglvqpggslrlscaasgfnikdtyihwvrqapgkglewvariyptngytryadsvkgrftisadtskntaylqmnslraedtavyycsrwggdgfyamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvep
kscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(k)
[0298]
seq id no.:18(轻链序列)
[0299]
diqmtqspsslsasvgdrvtitcrasqdvntavawyqqkpgkapklliysasflysgvpsrfsgsrsgtdftltisslqpedfatyycqqhyttpptfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0300]
在本公开的部分实施方案中,靶向部分抗trop
‑
2抗体为记载于美国专利第7,517,964号中的rs7(即本公开sacituzumab);以及记载于us2012/0237518中的hrs7(即本公开sacituzumab)。可用于本公开的抗trop
‑
2抗体还可以通过cn103476941a中公开的载体设计、构建和构建展示抗体的抗体库的方法筛选获得,也可以索伦托医疗公司(sorrento therapeutics,inc.)的文库进行筛选获得。
[0301]
sacituzumab单抗的的重链序列和轻链氨基酸序列分别可参见例如seq id no.:19和seq id no.:20。
[0302]
seq id no.:19(重链序列)
[0303]
qvqlqqsgselkkpgasvkvsckasgytftnygmnwvkqapgqglkwmgwintytgeptytddfkgrfafsldtsvstaylqisslkaddtavyfcarggfgssywyfdvwgqgslvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(k)
[0304]
重链末位k(或lys)是容易缺失的,但这种缺失并不影响生物活性,参见dick,l.w.等人,biotechnol.bioeng.,100:1132
‑
1143。
[0305]
seq id no.:20(轻链序列)
[0306]
diqltqspsslsasvgdrvsitckasqdvsiavawyqqkpgkapklliysasyrytgvpdrfsgsgsgtdftltisslqpedfavyycqqhyitpltfgagtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0307]
在本公开中,erbb2和her2/neu可互换使用,二者均表示天然序列的人her2蛋白(genebank登录号:x03363,参见例如semba等人,1985,pnas,82:6497
‑
6501;和yamamoto等人,1986,nature,319:230
‑
234)及其功能性衍生物,例如氨基酸序列变体。erbb2表示编码人her2的基因,neu表示编码大鼠p185neu的基因。在部分实施方案中,本公开的化合物或偶联物能够抑制或杀伤表达erbb2受体的细胞,例如乳腺癌细胞、卵巢癌细胞、胃癌细胞、子宫内膜癌细胞、唾液腺癌细胞、肺癌细胞、肾癌细胞、结肠癌细胞、甲状腺癌细胞、胰腺癌细胞、膀胱癌细胞或肝癌细胞。
[0308]
在本公开中trop
‑
2或trop2是指人滋养层细胞表面抗原
‑
2(human trophoblast cell
‑
surface antigens 2),又称为tacstd2、m1s1、ga733
‑
1、egp
‑
1,其是由许多人类肿瘤(如乳腺癌、结直肠癌、肺癌、胰腺癌、卵巢癌、前列腺癌、宫颈癌)细胞表达的细胞表面受体。
在部分实施方案中,本公开的化合物或偶联物能够抑制或杀伤表达trop2受体的细胞,例如乳腺癌细胞、结直肠癌细胞、肺癌细胞、胰腺癌细胞、卵巢癌细胞、前列腺癌细胞或宫颈癌细胞。
[0309]
在本文中,本发明偶联物中出现的表示靶向部分为抗体时,抗体中的巯基与连接体的具体连接方式。
[0310]
在本文中,术语“c1‑6烷基”表示直链或支链的含有1
‑
6个碳原子的烷基,包括例如“c1‑4烷基”、“c1‑3烷基”等,具体实例包括但不限于:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、2
‑
甲基丁基、新戊基、1
‑
乙基丙基、正己基、异己基、3
‑
甲基戊基、2
‑
甲基戊基、1
‑
甲基戊基、3,3
‑
二甲基丁基、2,2
‑
二甲基丁基、1,1
‑
二甲基丁基、1,2
‑
二甲基丁基、1,3
‑
二甲基丁基、2,3
‑
二甲基丁基、2
‑
乙基丁基、1,2
‑
二甲基丙基等。
[0311]
在本文中,术语“c2‑6烯基”是指含有至少一个双键且碳原子数为2
‑
6的直链、支链或环状的烯基,包括例如“c2‑4烯基”等。其实例包括但不限于:乙烯基、1
‑
丙烯基、2
‑
丙烯基、1
‑
丁烯基、2
‑
丁烯基、1,3
‑
丁二烯基、1
‑
戊烯基、2
‑
戊烯基、3
‑
戊烯基、1,3
‑
戊二烯基、1,4
‑
戊二烯基、1
‑
己烯基、2
‑
己烯基、3
‑
己烯基、1,4
‑
己二烯基、环戊烯基、1,3
‑
环戊二烯基、环己烯基、1,4
‑
环己二烯基等。
[0312]
在本文中,术语“c2‑6炔基”是指含有至少一个三键且碳原子数为2
‑
6的直链或支链的炔基,包括例如“c2‑4炔基”等。其实例包括但不限于:乙炔基、丙炔基、2
‑
丁炔基、2
‑
戊炔基、3
‑
戊炔基、4
‑
甲基
‑2‑
戊炔基、2
‑
己炔基、3
‑
己炔基、5
‑
甲基
‑2‑
己炔基等。
[0313]
在本文中,术语“卤素”包括氟、氯、溴、碘。
[0314]
在本文中,术语“3
‑
8元环烷基”或“c3‑8环烷基”是指含有3
‑
8个碳原子的饱和环状烷基,包括例如“3
‑
6元环烷基”、“4
‑
6元环烷基”、“5
‑
7元环烷基”或“5
‑
6元环烷基”等。具体实例包括但不限于:环丙烷基、环丁烷基、环戊烷基、环己烷基、环庚烷基、环辛烷基等。
[0315]
在本文中,术语“c1‑6烷氧基”是指具有c1‑6烷基
‑
o
‑
结构的基团,其中c1‑6烷基如前文中所定义。具体实例包括但不限于甲氧基、乙氧基、丙氧基、异丙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、戊氧基、己氧基等。
[0316]
在本文中,术语“3
‑
8元脂杂环基”是指含有3
‑
8个环原子(其中至少一个环原子为杂原子,例如氮原子、氧原子或硫原子)的环状基团。任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。“3
‑
8元脂杂环基”包括例如“3
‑
8元含氮脂杂环基”、“3
‑
8元含氧脂杂环基”、“3
‑
6元脂杂环基”、“3
‑
6元含氧脂杂环基”、“4
‑
7元脂杂环基”、“4
‑
6元脂杂环基”、“5
‑
7元脂杂环基”、“5
‑
6元脂杂环基”、“5
‑
6元含氮脂杂环基”,包括但不限于环氧乙烷基、氧代环丁烷基、吡咯烷基、四氢呋喃基、哌啶基、哌嗪基、四氢吡喃基、高哌嗪基等。
[0317]
在本文中,术语“6
‑
12元螺环基”是指由两个或两个以上环状结构彼此共用一个碳原子所形成的、含有6
‑
12个成环碳原子的环状结构。任选地,环状结构中的碳原子可以被氧代。“6
‑
12元螺环基”包括例如、“6
‑
11元螺环基”、“6
‑
10元螺环基”、“7
‑
10元螺环基”、“7
‑
9元螺环基”、“7
‑
8元螺环基”、“9
‑
10元螺环基”、“3
‑
10元螺环基”等。具体实例包括但不仅限于:、
等。
[0318]
在本文中,术语“6
‑
12元桥环基”是指由两个或两个以上环状结构彼此共用两个非相邻碳原子所形成的、含有6
‑
12个环碳原子的环状结构。任选地,环状结构中的碳原子可以被氧代。“6
‑
12元桥环基”包括例如“6
‑
11元桥环基”、“5
‑
10元桥环基”、“7
‑
10元桥环基”、“7
‑
9元桥环基”、“7
‑
8元桥环基”、“9
‑
10元桥环基”、“3
‑
10元桥环基”等。具体实例包括但不仅限于:于:于:等。
[0319]
在本文中,术语“6
‑
12元稠环基”是指由两个或两个以上环状结构彼此共用两个相邻的原子所形成的、含有6
‑
12个环碳原子的环状结构,包括“6
‑
11元稠环基”、“6
‑
10元稠环基”、“6
‑
8元稠环基”、“10
‑
12元稠环基”、“7
‑
10元稠环基”。其实例包括但不限于:。其实例包括但不限于:。其实例包括但不限于:等。
[0320]
在本文中,术语“6
‑
12元螺杂环基”是指由两个或两个以上环状结构彼此共用一个环原子所形成的、含有6
‑
12个环原子(其中至少一个环原子为杂原子,例如氮原子、氧原子或硫原子)的环状结构。任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。“6
‑
12元螺杂环基”包括例如“6
‑
11元螺杂环基”、“5
‑
10元螺杂环基”、“7
‑
11元螺杂环基”、“7
‑
10元螺杂环基”、“7
‑
9元螺杂环基”、“7
‑
8元螺杂环基”、“9
‑
10元螺杂环基”、“3
‑
10元螺杂环基”等。具体实例包括但不仅限于::
等。
[0321]
在本文中,术语“6
‑
12元桥杂环基”是指由两个或两个以上环状结构彼此共用两个非相邻的环原子所形成的、含有6
‑
12个环原子(其中至少一个环原子为杂原子,例如氮原子、氧原子或硫原子)的环状结构。任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。“6
‑
12元桥杂环基”包括例如“6
‑
11元桥杂环基”、“6
‑
9元桥杂环基”、“6
‑
10元桥杂环基”、“7
‑
10元桥杂环基”、“7
‑
9元桥杂环基”、“7
‑
8元桥杂环基”、“8元桥杂环基”、“9
‑
10元桥杂环基”、“3
‑
10元桥杂环基”等。具体实例包括但不仅限于:等。具体实例包括但不仅限于:等。具体实例包括但不仅限于:等。
[0322]
在本文中,术语“6
‑
12元稠杂环基”是指由两个或两个以上环状结构彼此共用两个相邻的原子所形成的、含有6
‑
12个环原子(其中至少一个环原子为杂原子,例如氮原子、氧原子或硫原子)的环状结构。任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。“6
‑
12元稠杂环基”包括例如“6
‑
11元稠杂环基”、“5
‑
10元稠杂环基”、“7
‑
10元稠杂环基”、“3
‑
10元稠杂环基”、“3
‑
10元含氮稠杂环基”、“9
‑
10元稠杂环基”、“9
‑
10元含氮稠杂环基”、“6
‑
12元含氧稠杂环基”等。具体实例包括但不仅限于:四氢咪唑并[4,5
‑
c]吡啶基、3,4
‑
二氢喹唑啉基、1,2
‑
二氢喹喔啉基、苯并[d][1,3]二氧杂环戊烯基、1,3
‑
二氢异苯并呋喃基、4h
‑
1,3
‑
苯并噁嗪基、4,6
‑
二氢
‑
1h
‑
呋喃并[3,4
‑
d]咪唑基、3a,4,6,6a
‑
四氢
‑
1h
‑
呋喃并[3,4
‑
d]咪唑基、4,6
‑
二氢
‑
1h
‑
噻吩并[3,4
‑
d]咪唑基、4,6
‑
二氢
‑
1h
‑
吡咯并[3,4
‑
d]咪唑基、苯并咪唑烷基、八氢
‑
苯并[d]咪唑基、十氢喹啉基、六氢噻吩并咪唑基、六氢呋喃并咪唑基、4,5,6,7
‑
四氢
‑
1h
‑
苯并[d]咪唑基、八氢环戊烯并[c]吡咯基、二氢吲哚基、二氢异吲哚基、苯并噁唑烷基、苯并噻唑烷基、1,2,3,4
‑
四氢异喹啉基、1,2,3,4
‑
四氢喹啉基、4h
‑
1,3
‑
苯并噁嗪基等。
[0323]
在本文中,术语“芳基”是指具有芳香性的单环或多环烃基,例如6
‑
20元芳基、6
‑
10元芳基、5
‑
8元芳基等。具体的实例包括但不限于苯基、萘基、蒽基、菲基等。所述“6
‑
20元芳基”是指含有6
‑
20个环原子的芳基。
[0324]
在本文中,术语“杂芳基”是指具有芳香性的环状基团,其中至少一个环原子为杂原子,例如氮原子、氧原子或硫原子。任选地,环状结构中的环原子(例如碳原子、氮原子或
硫原子)可以被氧代。具体实例包括但不限于5
‑
10元杂芳基、5
‑
10元含氮杂芳基、6
‑
10元含氧杂芳基、6
‑
8元含氮杂芳基、5
‑
8元含氧杂芳基等,例如呋喃基、噻吩基、吡咯基、噻唑基、异噻唑基、噻二唑基、噁唑基、异噁唑基、噁二唑基、咪唑基、吡唑基、1,2,3
‑
三唑基、1,2,4
‑
三唑基、1,2,3
‑
噁二唑基、1,2,4
‑
噁二唑基、1,2,5
‑
噁二唑基、1,3,4
‑
噁二唑基、吡啶基、2
‑
吡啶酮基、4
‑
吡啶酮基、嘧啶基、1,4
‑
二氧杂环己二烯基、2h
‑
1,2
‑
噁嗪基、4h
‑
1,2
‑
噁嗪基、6h
‑
1,2
‑
噁嗪基、4h
‑
1,3
‑
噁嗪基、6h
‑
1,3
‑
噁嗪基、4h
‑
1,4
‑
噁嗪基、哒嗪基、吡嗪基、1,2,3
‑
三嗪基、1,3,5
‑
三嗪基、1,2,4,5
‑
四嗪基、氮杂环庚三烯基、1,3
‑
二氮杂环庚三烯基、氮杂环辛四烯基等。
[0325]
发明的有益效果
[0326]
本公开通过改进adc或smdc中药物与靶向部分的偶联方式,获得一类新颖的生物活性分子偶联物。在本公开的一些实施方案中,所述生物活性分子偶联物通过将adc药物连接体上的杂芳环与抗体分子中自由的巯基进行亲核取代反应得到。利用上述偶联方式获得的偶联物,能够实现下述至少一种技术效果:
[0327]
(1)具有较高的稳定性;
[0328]
(2)具有较高的载药量,在一些实施方案中,所述偶联物的dar值能够达到5
‑
8;
[0329]
(3)具有极高的偶联效率,在一些实施方案中,所述偶联效率能够达到90%;
[0330]
(4)根据上述偶联方式得到的偶联物可有效提高药物分子在循环中的稳定性,减少了非目的性药物在非靶细胞的脱落;
[0331]
(5)所述偶联物还能增加生物活性分子在胞内的有效释放,达到增效减毒的目的;
[0332]
(6)所述偶联物,具有良好的肿瘤组织靶向性;以及
[0333]
(7)所述偶联物,在肿瘤动物模型上具有良好的治疗效果。
[0334]
另外,本公开所述的偶联方式具有较高的应用范围,可广泛用于生物活性分子与抗体或靶向小分子配体的偶联。
附图说明
[0335]
图1为bt001002的tic图(总离子流图)。
[0336]
图2为bt001002偶联轻链去卷积图。
[0337]
图3为bt001002偶联重链去卷积图。
[0338]
图4为bt001004的tic图(总离子流图)。
[0339]
图5为bt001004偶联轻链去卷积图。
[0340]
图6为bt001004偶联重链去卷积图。
[0341]
图7为bt001002的sec色谱图。
[0342]
图8为bt001002的分子量marker sec色谱图。
[0343]
图9为bt001004的sec色谱图。
[0344]
图10为bt001012偶联轻链去卷积图。
[0345]
图11为bt001012偶联重链去卷积图。
[0346]
图12为bt001013偶联轻链去卷积图。
[0347]
图13为bt001013偶联重链去卷积图。
[0348]
图14为bt001018偶联轻链去卷积图。
[0349]
图15为bt001018偶联重链去卷积图。
[0350]
图16为bt001021偶联轻链去卷积图。
[0351]
图17为bt001021偶联重链去卷积图。
[0352]
图18为bt001023偶联轻链去卷积图。
[0353]
图19为bt001023偶联重链去卷积图。
[0354]
图20为bt001040偶联轻链去卷积图。
[0355]
图21为bt001040偶联重链去卷积图。
[0356]
图22为bt001041偶联轻链去卷积图。
[0357]
图23为bt001041偶联重链去卷积图。
[0358]
图24为bt001042偶联轻链去卷积图。
[0359]
图25为bt001042偶联重链去卷积图。
[0360]
图26为bt001043偶联轻链去卷积图。
[0361]
图27为bt001043偶联重链去卷积图。
[0362]
图28为bt001044偶联轻链去卷积图。
[0363]
图29为bt001044偶联重链去卷积图。
[0364]
图30为bt001046偶联轻链去卷积图。
[0365]
图31为bt001046偶联重链去卷积图。
[0366]
图32为bt001047偶联轻链去卷积图。
[0367]
图33为bt001047偶联重链去卷积图。
[0368]
图34为bt001012的sec色谱图。
[0369]
图35为bt001013得sec色谱图。
[0370]
图36为bt001018得sec色谱图。
[0371]
图37为bt001021的sec色谱图。
[0372]
图38为bt001023的sec色谱图。
[0373]
图39为bt001042的sec色谱图。
[0374]
图40为bt001043的sec色谱图。
[0375]
图41为bt001044的sec色谱图。
[0376]
图42为bt001046的sec色谱图。
[0377]
图43为bt001047的sec色谱图。
[0378]
图44 nci
‑
n87人胃癌模型中各组小鼠肿瘤体积的生长变化情况。
[0379]
图45 nci
‑
n87人胃癌模型中各组小鼠体重的变化情况。
[0380]
图46 hcc1806人乳腺癌模型中各组小鼠肿瘤体积的生长变化情况。
[0381]
图47a hcc827人非小细胞肺癌移植瘤模型中各组小鼠肿瘤体积的生长变化情况。
[0382]
图47b hcc827人非小细胞肺癌移植瘤模型中各组小鼠体重的变化情况。
[0383]
图48a nci
‑
n87人胃癌移植瘤模型中各组小鼠肿瘤体积的生长变化情况。
[0384]
图48b nci
‑
n87人胃癌移植瘤模型中各组小鼠体重的变化情况。
[0385]
图49a.mda
‑
mb
‑
231人乳腺癌荷瘤鼠模型中各组小鼠肿瘤体积的生长变化情况。
[0386]
图49b.mda
‑
mb
‑
231人乳腺癌荷瘤鼠模型中各组小鼠体重的变化情况。
具体实施方式
[0387]
以下通过具体实施方式的描述对本公开作进一步说明,但这并非是对本公开的限制。本领域技术人员根据本公开的教导,可以做出各种修改或改进,而不脱离本公开的基本思想和范围。
[0388]
本发明中的缩写具有以下含义:
[0389][0390][0391]
制备方案
[0392]
以下的实施例中记载的化合物的结构通过核磁共振(1h nmr)或质谱(ms)来确定。
[0393]
核磁共振(1h nmr)的测定仪器使用bruker 400mhz核磁共振仪;测定溶剂为氘代甲醇(cd3od)、氘代氯仿(cdcl3)或六氘代二甲基亚砜(dmso
‑
d6);内标物质为四甲基硅烷(tms)。
[0394]
实施例中使用的核磁共振(nmr)图谱中的缩写示于以下。
[0395]
s:单峰(singlet)、d:二重峰(doublet)、t:三重峰(triplet)、q:四重峰(quartet)、dd:双二重峰(double doublet)、qd:四二重峰(quartet doublet)、ddd:双双二重峰(double double doublet)、ddt:双双三重峰(double double triplet)、dddd:双双双二重峰(double double double doublet)、m:多重峰(multiplet)、br:宽峰(broad)、j:偶合常数、hz:赫兹、dmso
‑
d6:氘化二甲基亚砜。δ值用ppm值表示。
[0396]
质谱(ms)的测定仪器使用agilent(esi)质谱仪,型号为agilent 6120b。
[0397]
制备液相色谱方法如下:
[0398]
方法a:
[0399]
色谱柱:daisogel c18 10μm 100x250mm
[0400]
流动相a:水;流动相b:乙腈
[0401][0402]
方法b:
[0403]
色谱柱:daisogel c18 10μm 50x250mm
[0404]
流动相a:水;流动相b:乙腈
[0405][0406]
方法c:
[0407]
色谱柱:daisogel c18 10μm 50x250mm
[0408]
流动相a:含有0.1%三氟乙酸的水;流动相b:乙腈
[0409][0410]
方法d:色谱柱:waters sunfire c18 5μm 19x250mm
[0411]
流动相a:乙腈;流动相b:含有0.05%甲酸的水
[0412]
时间:0min
‑
16min;流动相a:10%
‑
90%;流速:28ml/min
[0413]
一、生物活性分子的合成
[0414]
实施例一(2s)
‑
n
‑
((3r,4s,5s)
‑1‑
((2s)
‑2‑
((1r,2r)
‑3‑
((1
‑
((4
‑
氨基苄基)氨基)
‑1‑
氧代
‑3‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
丙酰基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
庚酰基
‑4‑
基)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺的合成(t001)
[0415][0416]
步骤一:(4
‑
((2
‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸叔丁酯的合成
[0417]
室温下,将1
‑
羟基苯并三唑(2.0mg,14.74μmol)溶于n,n
‑
二甲基甲酰胺(4ml)中,降温至0℃,依次加入(4
‑
甲氨基苄基)
‑
氨基甲酸叔丁酯(4.0mg,16.1μmol),n,n
‑
二异丙基乙胺(8.5mg,66.8μmol),((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨
基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰基)
‑
l
‑
苯丙氨酸(10.0mg,13.5μmol,商购),搅拌5min,加入1h
‑
苯并三唑
‑1‑
基氧三吡咯烷基六氟磷酸盐(10.0mg,20.1μmol),加毕0℃搅拌反应1h。用高效液相
‑
质谱联用色谱监测原料反应完全,反应液经制备液相色谱纯化(方法d)得标题化合物,为白色固体9.0mg。esi
‑
ms(m/z):950.5[m h]
。
[0418]
步骤二:(2s)
‑
n
‑
((3r,4s,5s)
‑1‑
((2s)
‑2‑
((1r,2r)
‑3‑
((1
‑
((4
‑
氨基苄基)氨基)
‑1‑
氧代
‑3‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
丙酰基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
庚酰基
‑4‑
基)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺的合成
[0419]
室温下,将(4
‑
((2
‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸叔丁酯(9.0mg,0.02mmol)溶于1,4
‑
二氧六环(0.5ml)中,降温至0℃,加入盐酸
‑
二氧六环溶液(1ml,4.0m),加毕室温搅拌反应3h。用高效液相
‑
质谱联用色谱监测原料反应完全,减压蒸除溶剂,粗品经制备液相色谱纯化(方法c),得标题化合物的三氟乙酸盐,为白色固体5.0mg。esi
‑
ms(m/z):850.5[m h]
。
[0420]
实施例二(s)
‑
n
‑
((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
((s)
‑1‑
((4
‑
氨基苄基)氨基)1
‑
氧代
‑3‑
苯基丙
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧代丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧代庚基
‑4‑
基)
‑2–
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰胺的合成(t011)
[0421][0422]
步骤一:(s)
‑
(4
‑
((2
‑
(((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸叔丁酯的合成
[0423]
在0℃下,将4
‑
氨基苄氨(222mg,1.0mmol)和n
‑
甲基吗啉(306mg,1.5mmol)加入(s)
‑2‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑3‑
苯基丙酸(387mg,1.0mmol)的n,n
‑
二甲基甲酰胺(5ml)的溶液中,依次加入1
‑
羟基苯并三唑(203mg,1.5mmol)、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(288mg,1.5mmol)。0℃反应过夜。将反应液倒入水(50ml)中,有白色固体析出,过滤,水洗滤饼(20ml
×
3),固体经硅胶柱层析纯化,得标题化合物,为白色固体380mg。esi
‑
ms(m/z):592.3[m h]
。
[0424]
步骤二:(s)
‑
(4
‑
((2
‑
氨基
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸叔丁酯的合成
[0425]
将一水合氢氧化锂(21mg,0.51mmol)溶于水(1ml)中,并加入至(s)
‑
(4
‑
((2
‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸叔丁酯(102mg,0.17mmol)的四氢呋喃(2ml)溶液中,室温反应2h。向反应液中加水(20ml),并用乙酸乙酯萃取(30ml
×
4)。合并有机相,有机相用饱和食盐水洗(30ml
×
2),无水硫酸钠干燥。滤除干燥剂,减压蒸除溶剂,残余物经制备液相纯化(方法d),得标题化合物,为白色固体65mg。esi
‑
ms(m/z):370.2[m h]
。
[0426]
步骤三:(4
‑
((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑3‑
(甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸酯的合成
[0427]
在0℃下,将(s)
‑
(4
‑
((2
‑
氨基
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸叔丁酯(15mg,0.04mmol)和n
‑
甲基吗啉(12mg,0.12mmol)加入(2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基
‑3‑
甲氧基
‑2‑
甲基丙酸(24mg,0.04mmol)的n,n
‑
二甲基甲酰胺(2ml)的溶液中,依次加入1
‑
羟基苯并三唑(8mg,0.06mmol)、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(12mg,0.06mmol)。0℃下反应过夜。反应液经制备液相色谱纯化(方法d),得标题化合物,为白色固体24mg。esi
‑
ms(m/z):950.6[m h]
。
[0428]
步骤四:(s)
‑
n
‑
((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
((s)
‑1‑
((4
‑
氨基苄基)氨基)
‑1‑
氧代
‑3‑
苯基丙
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧代丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧代庚基
‑4‑
基)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰胺的合成
[0429]
将三氟乙酸(0.5ml)加入(4
‑
((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
(3r,4s,5s)
‑4‑
((s)
‑3‑
(甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基甲酸酯(14.0mg,0.015mmol)的二氯甲烷(1.5ml)溶液中,室温反应1h。减压蒸除溶剂,残余物经制备液相色谱纯化(方法c),得标题化合物的三氟乙酸盐,为白色固体4.2mg。esi
‑
ms(m/z):850.6[m h]
。
[0430]
采用类似的合成方法可合成以下分子:
[0431][0432]
实施例三(s)
‑
n
‑
(2
‑
(4
‑
乙基
‑4‑
羟基
‑
3,14
‑
二酮
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑
11
‑
基)乙基)
‑
n
‑
异丙基乙酰胺的合成
[0433][0434]
室温下将盐酸贝洛替(1.0g,2.13mmol)与三乙胺(0.65g,0.9ml)溶于二氯甲烷中(50ml),缓慢滴加乙酸酐(0.22g,2.13mmol),室温反应1h。水洗有机相(10ml
×
2),无水硫酸钠干燥。滤除不溶物,蒸除溶剂,硅胶柱层析纯化(二氯甲烷/甲醇=50/1),得标题化合物1g。esi
‑
ms(m/z):476.2[m h]
。
[0435]
实施例四(s)
‑
n
‑
(2
‑
(4
‑
乙基
‑4‑
羟基
‑
3,14
‑
二酮
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑
11
‑
基)乙基)
‑
n
‑
异丙基甲磺酰胺的合成
[0436][0437]
将甲磺酰氯(462mg,12.77mmol,纯度70%左右)滴加入盐酸贝洛替康(3g,
6.38mmol)和三乙胺(2.58g,25.54mmol)的二氯甲烷(40ml)溶液中,室温条件下反应2h。抽滤,滤饼用二氯甲烷(3ml)洗三次,得到标题化合物,2.2g。
[0438]
结构表征数据如下:
[0439]1h nmr(400mhz,dmso
‑
d6)δ8.32(d,j=8.4hz,1h),8.20(dd,j=8.4,1.2hz,1h),7.93
‑
7.84(m,1h),7.79(t,j=7.6hz,1h),7.35(s,1h),6.56(s,1h),5.44(d,j=9.2hz,4h),3.98(p,j=6.7hz,1h),3.50(t,j=8.0hz,2h),3.42
‑
3.35(m,2h),3.00(s,3h),1.93
‑
1.82(m,2h),1.15(d,j=6.7hz,6h),0.88(t,j=7.3hz,3h).esi
‑
ms(m/z):512.2[m h]
.[α]
d20
为 28.19
°
(c=0.101g/100ml,ch3cn).
[0440]
其余未说明合成方法的生物活性分子商购可得或通过现有技术中公开的方法制备得到。
[0441]
二、包含细胞生物活性分子和连接体的化合物的合成
[0442]
实施例五(s)
‑2‑
((s)
‑2‑
(4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酰胺基)
‑3‑
甲基丁酰胺基)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲胺基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)
‑5‑
脲基戊酰胺的合成
[0443][0444]
步骤一:4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸叔丁酯(化合物1
‑
2)的合成
[0445]
室温下,将化合物1
‑
1(500mg,3.27mmol)溶于n,n
‑
二甲基甲酰胺(10ml)中,分批缓慢加入氢化钠(130mg,3.27mmol),室温搅拌10min。滴加4
‑
溴丁酸叔丁酯(725mg,3.27mmol),加毕,室温反应2h,饱和氯化铵水溶液淬灭,乙酸乙酯萃取(50ml
×
3),合并有机相,饱和食盐水洗涤(50ml
×
3),无水硫酸钠干燥,滤除干燥剂,减压蒸除溶剂,得标题化合物,500mg。esi
‑
ms(m/z):296.1[m h]
。
[0446]
步骤二:4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸(化合物1
‑
3)的合成
[0447]
室温下,将化合物1
‑
2(500mg,1.69mmol)溶于二氯甲烷(6ml)中,加入三氟乙酸
(3ml),加毕,室温反应4h,减压蒸除溶剂,得标题化合物,400mg。esi
‑
ms(m/z):240.1[m h]
。
[0448]
步骤三:(9h
‑
芴
‑9‑
基)
‑
甲基
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(((叔丁氧羰基)氨基)甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基戊基
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁基
‑2‑
基)
‑
氨基甲酸酯(化合物1
‑
5)的合成
[0449]
室温下,将4
‑
(n
‑
boc
‑
氨甲基)
‑
苯胺(6.0g,27mmol)、化合物1
‑
4(3.35g,6.75mmol)、2
‑
乙氧基
‑1‑
乙氧碳酰基
‑
1,2
‑
二氢喹啉(3.34g,13.5mmol)溶于二氯甲烷(140ml)与甲醇(70ml)的混合溶剂中,升温到45℃,保温反应8.0h。冷却至室温,有大量固体析出,抽滤得标题化合物,3.65g。esi
‑
ms(m/z):701.4[m h]
。
[0450]
步骤四:(9h
‑
芴
‑9‑
基)
‑
甲基
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(氨甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基戊基
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁基
‑2‑
基)
‑
氨基甲酸酯(化合物1
‑
6)的合成
[0451]
室温下,将三氟乙酸(15ml)加入化合物1
‑
5(3.0g,4.29mmol)中,室温搅拌1.0h。减压蒸除溶剂得黄色油状物,加入无水乙醚(20ml),有大量固体析出,剧烈搅拌0.5h,抽滤,得标题化合物的三氟乙酸盐,3.06g。esi
‑
ms(m/z):601.3[m h]
。
[0452]
步骤五:(9h
‑
芴
‑9‑
基)
‑
甲基
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(((r)
‑2‑
((叔丁氧羰基)氨基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基
‑1‑
氧代
‑5‑
脲基戊基
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁基
‑2‑
基)
‑
氨基甲酸酯(化合物1
‑
7)的合成
[0453]
室温下,将boc
‑
d
‑
苯丙氨酸(1.1g,4.2mmol)、化合物1
‑
6的三氟乙酸盐(3.0g,4.2mmol)溶于n,n
‑
二甲基甲酰胺(40ml)中,降温至0℃,然后依次加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(1.2g,6.3mmol)、1
‑
羟基苯并三唑(0.9g,6.3mmol)、n
‑
甲基吗啡啉(1.7g,16.8mmol),反应体系保温搅拌1.0h。将反应液逐滴滴入冰水中(400ml),剧烈搅拌0.5h,有大量固体析出,抽滤,得标题化合物,3.3g。esi
‑
ms(m/z):848.4[m h]
。
[0454]
步骤六:(9h
‑
芴
‑9‑
基)
‑
甲基
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(((r)
‑2‑
氨基
‑3‑
苯基丙酰胺基)甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基戊基
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁基
‑2‑
基)
‑
氨基甲酸酯(化合物1
‑
8)的合成
[0455]
室温下,将化合物1
‑
7(3.0g,3.3mmol)溶于三氟乙酸(30ml)中,室温搅拌1.0h。减压蒸除溶剂得黄色油状物,加入无水乙醚(100ml),剧烈搅拌0.5h,有大量固体析出,抽滤,得标题化合物的三氟乙酸盐,2.1g。esi
‑
ms(m/z):748.4[m h]
。
[0456]
步骤七:(9h
‑
芴
‑9‑
基)
‑
甲基
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲胺基)
‑3‑
丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯丙酰胺基)甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基戊
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁
‑2‑
基)氨基甲酸酯(化合物1
‑
9)的合成
[0457]
室温下,将(2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑
(二甲氨基)
‑3‑
丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酸(1.3g,2.17mmol)和化合物1
‑
8的三氟乙酸盐(1.8g,2.17mmol)溶于n,n
‑
二甲基甲酰胺(20ml)中,降温到0℃,依次加入1
‑
羟基苯并三唑(440mg,3.26mmol)和n
‑
甲基吗啉(658mg,6.51mmol)最后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(624mg,1.38mmol),加毕,反应液0℃搅拌5h。制备液相色谱纯化(方法d),得标题化合物,1.8g。esi
‑
ms(m/z):
1329.2[m h]
。
[0458]
步骤八:(s)
‑2‑
((s)
‑2‑
氨基
‑3‑
丁酰胺基)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲胺基)
‑3‑
丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯丙酰胺基)甲基)苯基)
‑5‑
脲基戊酰胺(化合物1
‑
10)的合成
[0459]
室温下,将化合物1
‑
9(500mg,0.38mmol)溶于n,n
‑
二甲基甲酰胺(5ml)中,加哌啶(324mg,3.8mmol),室温搅拌3h。制备液相色谱纯化(方法d),得标题化合物,350mg。esi
‑
ms(m/z):1107.2[m h]
。
[0460]
步骤九:(s)
‑2‑
((s)
‑2‑
(4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酰胺基)
‑3‑
甲基丁酰胺基)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲胺基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)
‑5‑
脲基戊酰胺(化合物tl001)的合成
[0461]
室温下,将化合物1
‑
10(60mg,0.054mmol)和4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸(26mg,0.066mmol)溶于n,n
‑
二甲基甲酰胺(3ml)中,降温到0℃,依次加入n,n
‑
二异丙基乙胺(105mg,0.81mmol)和1h
‑
苯并三唑
‑1‑
氧三吡咯啉嗡六氟磷酸盐(281mg,0.54mmol),加毕,反应体系室温搅拌3h。制备液相色谱纯化(方法d),得标题化合物,30mg。esi
‑
ms(m/z):664.5[m/2 h]
。
[0462]
实施例六(s)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基胺基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)
‑2‑
((s)
‑3‑
甲基
‑2‑
(4
‑
(4
‑
(甲磺酰基)
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)
‑
丁酰胺基)
‑
丁酰胺基)
‑5‑
脲基戊酰胺
[0463][0464]
步骤一:4
‑
(4
‑
(甲硫基)
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸(化合物2
‑
2)的合成
[0465]
室温下,将4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸(300mg,1.25mmol)溶于甲醇(8ml)中,一次性加入甲硫醇钠(351mg,5.02mmol),升温至50℃反应过夜。制备液相色谱纯化(方法d),得标题化合物,120mg。esi
‑
ms(m/z):252.1[m h]
。
[0466]
步骤二:(s)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基胺基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯
烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)
‑2‑
((s)
‑3‑
甲基
‑2‑
(4
‑
(4
‑
(甲硫基)
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)
‑
丁酰胺基)
‑
丁酰胺基)
‑5‑
脲基戊酰胺(化合物2
‑
3)的合成
[0467]
采用实施例五步骤九所描述的类似操作,以4
‑
(4
‑
(甲硫基)
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸代替4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸,制备液相色谱纯化(方法d),得标题化合物,20mg。esi
‑
ms(m/z):670.5[m/2 h]
。
[0468]
步骤三:(s)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基胺基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)
‑2‑
((s)
‑3‑
甲基
‑2‑
(4
‑
(4
‑
(甲磺酰基)
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)
‑
丁酰胺基)
‑
丁酰胺基)
‑5‑
脲基戊酰胺(化合物tl002)的合成
[0469]
室温下,将化合物2
‑
3(20mg,0.015mmol)溶于二氯甲烷(2ml)中,加入间氯过氧苯甲酸(4.0mg,0.022mmol),加毕,室温反应2h。制备液相色谱纯化(方法d),得标题化合物,5.0mg。esi
‑
ms(m/z):686.5[m/2 h]
。
[0470]
实施例七n
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基胺基)
‑3‑
甲基丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧基丁烷
‑2‑
基)
‑6‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺
[0471][0472]
步骤一:6
‑
(2
‑
(甲硫基)嘧啶
‑5‑
基)
‑5‑
己炔酸甲酯(化合物3
‑
2)的合成
[0473]
室温下,将5
‑
己炔酸甲酯(500mg,3.97mmol),5
‑
溴
‑2‑
甲硫基嘧啶溶于n,n
‑
二甲基甲酰胺(3ml)中,依次加入三乙胺(3ml),碘化亚铜(75mg,0.4mmol)和二三苯基膦二氯化钯(279mg,0.4mmol),氮气保护下升温至95℃搅拌反应6h,加水淬灭,乙酸乙酯萃取(20ml
×
3),合并有机相,饱和食盐水洗涤(20ml
×
2),无水硫酸钠干燥,滤除干燥剂,减压蒸除溶剂,制备液相色谱纯化(方法d),得标题化合物,300mg。esi
‑
ms(m/z):251.3[m h]
。
[0474]
步骤二:6
‑
(2
‑
(甲硫基)嘧啶
‑5‑
基)
‑5‑
己炔酸(化合物3
‑
3)的合成
[0475]
室温下,将化合物3
‑
2(200mg,0.8mmol)溶于四氢呋喃和水混合溶液中(4ml/4ml),加入氢氧化锂一水合物(235mg,5.6mmol),室温搅拌反应4h,加水稀释,乙酸乙酯萃取(20ml
×
2),水相用1n盐酸调ph=3,乙酸乙酯(20ml
×
3)萃取,合并有机相,饱和食盐水洗涤(20ml
×
2),无水硫酸钠干燥,滤除干燥剂,减压蒸除溶剂,得标题化合物120mg。
[0476]
步骤三:6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酸(化合物3
‑
4)的合成
[0477]
室温下,将化合物3
‑
3(20mg,0.085mmol)溶于二氯甲烷(4ml)中,加入间氯过氧苯甲酸(22mg,0.127mmol),加毕,室温搅拌反应过夜,制备液相色谱纯化(方法d),得标题化合物,20mg。esi
‑
ms(m/z):269.1[m h]
。
[0478]
步骤四:n
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰基氨基)
‑3‑
苯基丙酰胺基)甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧基丁烷
‑2‑
基)
‑6‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺(化合物tl003)的合成
[0479]
采用实施例五步骤九所描述的类似操作,以6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酸代替4
‑
(4
‑
氯
‑
7h
‑
吡咯[2,3
‑
d]嘧啶
‑7‑
基)丁酸,制备液相色谱纯化(方法d),得标题化合物,14mg。esi
‑
ms(m/z):679.0[m/2 h]
。
[0480]
实施例八(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺)
‑
乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]
‑
吲哚嗪并[1,2
‑
b]
‑
喹啉
‑4‑
基(4
‑
((s)
‑
42
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑2‑
(3
‑
脲基丙基)
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9,36
‑
氮杂二十四烷
‑
41
‑
酰胺基)苄基)碳酸酯
[0481][0482]
步骤一:(s)
‑
(1
‑
((4
‑
(羟甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基戊烷
‑2‑
基)
‑
(9h
‑
芴基)
‑
氨基甲酸甲酯(化合物19
‑
2)的合成
[0483]
室温下,将fmoc
‑
l
‑
瓜氨酸(5.0g,12.58mmol)、对氨基苯甲醇(6.20g,50.32mmol)、2
‑
乙氧基
‑1‑
乙氧碳酰基
‑
1,2
‑
二氢喹啉(6.22g,25.16mmol)溶于二氯甲烷(100ml)中,升温至45℃反应6h。反应液减压浓缩,无水乙醚(100ml)打浆得标题化合物,6.0g。esi
‑
ms(m/z):503.3[m h]
。
[0484]
步骤二:(s)
‑2‑
氨基
‑
n
‑
(4
‑
(羟甲基)苯基)
‑5‑
脲基戊酰胺(化合物19
‑
3)的合成
[0485]
室温下,将化合物19
‑
2(1.0g,1.99mmol)溶于n,n
‑
二甲基甲酰胺(8ml)中,滴加哌啶(339mg,3.98mmol),加毕,室温反应30min,加入二氯甲烷(10ml),继续搅拌10min。反应液
减压浓缩,快速硅胶柱纯化得标题化合物,400mg。esi
‑
ms(m/z):281.2[m h]
。
[0486]
步骤三:(s)
‑2‑
(32
‑
叠氮基
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧杂
‑6‑
氮杂三联乙酰胺基)
‑
n
‑
(4
‑
(羟甲基)苯基)
‑5‑
脲基戊酰胺(化合物19
‑
4)的合成
[0487]
将化合物19
‑
3(150mg,0.54mmol)、32
‑
叠氮基
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
氮杂三环十一烷酸(296mg,0.54mmol)溶于二氯甲烷(10ml)中,降温至0℃,加入2
‑
乙氧基
‑1‑
乙氧碳酰基
‑
1,2
‑
二氢喹啉(145mg,0.58mmol),移至室温反应过夜。反应液减压浓缩,快速硅胶柱纯化得标题化合物,200mg。esi
‑
ms(m/z):817.5[m h]
。
[0488]
步骤四:4
‑
((s)
‑
35
‑
叠氮基
‑
4,8
‑
二氧代
‑2‑
(3
‑
脲基丙基)
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
氮杂二十四烷)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰氨基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯(化合物19
‑
5)的合成
[0489]
室温下将(s)
‑
n
‑
(2
‑
(4
‑
乙基
‑4‑
羟基
‑
3,14
‑
二酮
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑
11
‑
基)乙基)
‑
n
‑
异丙基甲磺酰胺(200mg,0.39mmol)溶于二氯甲烷(10ml)中,降温至0℃,加入4
‑
二甲氨基吡啶(573mg,4.69mmol)的二氯甲烷(1.0ml)溶液,然后缓慢滴加三光气(116mg,0.39mmol)的二氯甲烷(1.0ml)溶液,加毕,0℃搅拌反应1h。向反应液中加入化合物19
‑
4(159mg,0.18mmol)的二氯甲烷(2.0ml)溶液,加毕,室温反应1h。制备高效液相色谱纯化(方法d)得标题化合物,160mg。esi
‑
ms(m/z):678.0[m/2 h]
。
[0490]
步骤五:4
‑
((s)
‑
35
‑
氨基
‑
4,8
‑
二氧代
‑2‑
(3
‑
脲基丙基)
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
氮杂二十四烷)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰氨基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯(化合物19
‑
6)的合成
[0491]
室温下将化合物19
‑
5(80mg,0.059mmol)溶于四氢呋喃(1.0ml)中,降温至0℃,加入4
‑
二甲氨基吡啶(573mg,4.69mmol)的二氯甲烷(1.0ml)溶液,氮气保护下一次性加入二氧化铂(15mg,0.059mmol),加毕,氢气置换空气三次,室温反应6h。反应液过滤,滤液浓缩得粗品,制备高效液相色谱纯化(方法d)得标题化合物,40mg。esi
‑
ms(m/z):665.0[m/2 h]
。
[0492]
步骤六:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((s)
‑
42
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑2‑
(3
‑
脲基丙基)
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9,36
‑
氮杂二十四烷
‑
41
‑
酰胺基)苄基)碳酸酯(化合物tl019)的合成
[0493]
将化合物19
‑
6(30mg,0.016mmol)和6
‑
(2
‑
甲基磺酰基嘧啶
‑5‑
基)
‑5‑
己炔酸(6.4mg,0.024mmol)溶于n,n
‑
二甲基甲酰胺(1ml)中,降温至0℃,依次加入苯并三唑
‑1‑
基
‑
氧基三吡咯烷基六氟磷酸盐(16.5mg,0.032mmol),n,n
‑
二异丙基乙胺(6.2mg,0.047mmol),加毕,室温反应2h。制备高效液相色谱纯化(方法d)得到标题化合物,10mg。esi
‑
ms(m/z):790.0[m/2 h]
。
[0494]
实施例九(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺)乙基)
‑
3,14二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基
‑
(4
‑
((s)
‑2‑
((s)
‑3‑
甲基
‑2‑
(6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基))
‑5‑
己炔酰胺基)丁酰胺基)
‑5‑
脲基戊酰胺基)苄基)碳酸酯
[0495][0496]
步骤一:((s)
‑1‑
(((s)
‑1‑
((4
‑
(羟甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基戊酰胺
‑2‑
基)氨基)
‑3‑
甲基
‑
丁酰胺基
‑2‑
基)
‑
(9h
‑
芴基)甲基
‑
氨基甲酸酯
[0497]
采用与实施例八步骤一类似的操作,以化合物28
‑
1替换化合物19
‑
1,得标题化合物,310mg。esi
‑
ms(m/z):602.3[m h]
。
[0498]
步骤二:(s)
‑2‑
((s)
‑2‑
氨基
‑3‑
甲基丁酰胺)
‑
n
‑
(4
‑
(羟甲基)苯基)
‑5‑
脲基戊酰胺(化合物28
‑
2)的合成
[0499]
采用与实施例八步骤二类似的操作,以化合物28
‑
2替换化合物19
‑
2,得标题化合物,150mg。esi
‑
ms(m/z):380.3[m h]
。
[0500]
步骤三:n
‑
((s)
‑1‑
(((s)
‑1‑
((4
‑
(羟甲基)苯基)氨基)
‑1‑
氧代
‑5‑
脲基戊
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)
‑6‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺(化合物28
‑
4)的合成
[0501]
室温下,将苯并三唑
‑1‑
基
‑
氧基三吡咯烷基六氟磷酸盐(313mg,0.6mmol)和n,n
‑
二异丙基乙胺(194mg,1.50mmol)加入6
‑
(2
‑
甲基磺酰基嘧啶
‑5‑
基)
‑5‑
己炔酸(135mg,0.5mmol)和(2s)
‑2‑
(((2s)
‑2‑
氨基
‑3‑
甲基
‑
丁酰基)氨基)
‑
n
‑
(4
‑
(羟甲基)苯基)
‑5‑
脲基
‑
戊酰胺(190mg,0.5mmol)的n,n
‑
二甲基甲酰胺(10ml)溶液中,室温搅拌反应3h。制备高效液相色谱纯化(方法d)得到标题化合物,78mg。esi
‑
ms(m/z):630.3[m h]
。
[0502]
步骤四:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基
‑
(4
‑
((s)
‑2‑
((s)
‑3‑
甲基
‑2‑
(6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基))
‑5‑
己炔酰胺基)丁酰胺基)
‑5‑
脲基戊酰胺基)苄基)碳酸酯(化合物tl028)的合成
[0503]
采用与实施例八步骤四类似的操作,以化合物28
‑
4替换化合物19
‑
4,得到标题化合物,1.76mg。esi
‑
ms(m/z):1167.4[m h]
。
[0504]
实施例十(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基
‑
(4
‑
((2s,5s)
‑5‑
异丙基
‑
38
‑
(4
‑
((6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,7,11
‑
三氧代
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12
‑
三氮杂三十三烷酰胺基)苄基)碳酸酯
[0505][0506]
步骤一:(s)
‑2‑
((s)
‑
35
‑
叠氮基
‑2‑
异丙基
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
氮杂二十四烷)
‑
n
‑
(4
‑
(羟甲基)苯基)
‑5‑
脲基戊酰胺(化合物29
‑
1)的合成
[0507]
采用与实施例八步骤三类似的操作,以化合物28
‑
3替换化合物19
‑
3,得标题化合物,180mg。esi
‑
ms(m/z):916.5[m h]
。
[0508]
步骤二:4
‑
((2s,5s)
‑
38
‑
叠氮基
‑5‑
异丙基
‑
4,7,11
‑
三氧代
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12
‑
三氮杂三十三烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯(化合物29
‑
2)的合成
[0509]
采用实施例八步骤四类似的操作,以化合物29
‑
1替换化合物19
‑
4,得标题化合物,30mg。esi
‑
ms(m/z):727.5[m/2 h]
。
[0510]
步骤三:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4',6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基
‑
(4
‑
((2s,5s)
‑5‑
异丙基
‑
38
‑
(4
‑
((6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,7,11
‑
三氧代
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12
‑
三氮杂三十三烷酰胺基)苄基)碳酸酯(化合物tl029)的合成
[0511]
室温下,将化合物29
‑
2(20mg,0.014mmol)、6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(2
‑
丙炔基
‑1‑
基)
‑5‑
己炔酰胺(4.3mg,0.014mmol)溶于二甲基亚砜与水的混合溶剂(1ml/0.25ml)中,加入溴化亚铜(3.95mg,0.027mmol)搅拌反应1h。制备高效液相色谱纯化(方法d)得标题化合物,15mg。esi
‑
ms(m/z):880.0[m/2 h]
。
[0512]
实施例十一(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((2s,5s)
‑5‑
异丙基
‑
45
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
4,7,11,40
‑
四氧代
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12,39
‑
四氮杂四十五烷
‑
44
‑
氨基甲酰基)苄基)碳酸酯
[0513][0514]
步骤一:(s)
‑2‑
((s)
‑
35
‑
氨基
‑2‑
异丙基
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)
‑
n
‑
(4
‑
(羟甲基)苯基)
‑5‑
脲基戊酰胺的合成
[0515]
20℃下,将化合物29
‑
1(400mg,0.44mmol)溶于甲醇和四氢呋喃(2.0ml:4.0ml)中,溶解完全后,氮气保护下一次性加入二氧化铂(40mg),氢气置换三次,20℃下氢化反应2h。过滤,滤饼甲醇洗涤,滤液减压浓缩,残余物经制备高效液相色谱纯化(方法d),得标题化合物,200mg。esi
‑
ms(m/z):890.4[m h]
。
[0516]
步骤二:n
‑
((6s,9s)
‑1‑
氨基
‑6‑
((4
‑
(羟甲基)苯基)氨基甲酰基)
‑9‑
异丙基
‑
1,8,11,15
‑
四氧代
‑
13,19,22,25,28,31,34,37,40
‑
壬氧基
‑
2,7,10,16
‑
四氮杂四十二烷
‑
42
‑
基)
‑6‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺的合成
[0517]
20℃下,将化合物22
‑
1(250mg,0.28mmol)溶于n,n
‑
二甲基甲酰胺(1.0ml)中,依次加入hatu(160mg,0.42mmol)、n,n
‑
二异丙基乙胺(109mg,0.84mmol),加毕,室温搅拌过夜。经制备高效液相色谱纯化(方法d)得标题化合物,250mg。
[0518]
步骤三:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((2s,5s)
‑5‑
异丙基
‑
45
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
4,7,11,40
‑
四氧代
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12,39
‑
四氮杂四十五烷
‑
44
‑
氨基甲酰基)苄基)碳酸酯(化合物tl022)的合成
[0519]
20℃下,将(s)
‑
n
‑
(2
‑
(4
‑
乙基
‑4‑
羟基
‑
3,14
‑
二酮
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑
11
‑
基)乙基)
‑
n
‑
异丙基甲磺酰胺(70mg,0.14mmol)溶于二氯甲烷(4.0ml)中,降温至0℃,加入对二甲氨基吡啶(200mg,1.64mmol)的二氯甲烷(1.0ml)溶液,然后缓慢滴加三光气(40.6mg,0.14mmol)的二氯甲烷(1.0ml)溶液,加毕,0℃搅拌反应1h。用氮气吹走未参与反应的光气,向反应液中加入化合物22
‑
2(139mg,012mmol)的二氯甲烷(2.0ml)溶液,0℃搅拌反应1h。经制备高效液相色谱纯化(方法d)得标题化合物,1.5mg。esi
‑
ms(m/z):839.5[m/2 h]
。
[0520]
实施例十二4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
炔酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡
喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯
[0521][0522]
步骤一:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯甲基)氨基)丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
炔酰胺基)苄基碳酸酯的合成
[0523]
室温下,将6
‑
(
‑2‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酸(12mg,0.045mmol)溶于二氯甲烷(2ml)中,加入2
‑
(7
‑
偶氮苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯(21.2mg,0.056mmol)和n,n
‑
二异丙基乙胺(8.6mg,0.067mmol),搅拌10min,加入化合物24
‑
1(35mg,0.022mmol),搅拌反应1h。经制备高效液相色谱纯化(方法b),得标题化合物,20mg。esi
‑
ms(m/z):1821.8[m h]
。
[0524]
步骤二:4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
炔酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯(化合物tl024)的合成
[0525]
室温下,将化合物24
‑
2(20mg,0.011mmol)溶于乙腈(1ml)中,滴加三氟乙酸(0.5ml)的乙腈(0.5ml)溶液,搅拌20min。经制备高效液相色谱纯化(方法c),得标题化合物的三氟乙酸盐,12mg。esi
‑
ms(m/z):1549.6[m h]
。
[0526]
实施例十三(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基
‑4‑
((2s,5s)
‑5‑
异丙基
‑2‑
甲基
‑
38
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)基)己
‑5‑
炔酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,7,11
‑
三氧代
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12
‑
三氮杂三十烷酰胺基)苄基碳酸酯的合成
[0527][0528]
步骤一:(s)
‑
(9h
‑
芴
‑9‑
基)
‑
甲基(1
‑
((4
‑
(羟甲基)苯基)氨基)
‑1‑
氧代丙
‑2‑
基)氨基甲酸酯的制备
[0529]
室温条件下,将2
‑
乙氧基
‑1‑
乙氧碳酰基
‑
1,2
‑
二氢喹啉(1.31g,5.30mmol)和对氨基苄醇(593mg,4.82mmol)加入化合物30
‑
1(1.5g,4.82mmol)的二氯甲烷(35ml)溶液中,搅拌反应3h。硅胶柱层析纯化,得到标题化合物,1.8g。esi
‑
ms(m/z):417.2[m h]
[0530]
步骤二:(s)
‑2‑
氨基
‑
n
‑
(4
‑
(羟甲基)苯基)丙酰胺的制备
[0531]
室温条件下,将乙二胺(5ml)加入化合物30
‑
2(1.8g,4.32mmol)的二氯甲烷(20ml)溶液中,反应2h。硅胶柱层析纯化,得到标题化合物,820mg。esi
‑
ms(m/z):195.1[m h]
[0532]
步骤三:(9h
‑
芴
‑9‑
基)
‑
甲基((s)
‑1‑
(((s)
‑1‑
((4
‑
(羟基甲基)苯基)氨基)
‑1‑
氧代丙烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁
‑2‑
基)
‑
氨基甲酸酯的制备
[0533]
室温条件下,将(2s)
‑2‑
(9h
‑
芴
‑9‑
基甲氧基羰基氨基)
‑3‑
甲基
‑
丁酸(875mg,2.58mmol)、o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸酯(1.45g,3.83mmol)、n,n
‑
二异丙基乙胺(1.00g,7.74mmol)和1
‑
羟基苯并三唑(525mg,3.89mmol)依次加入化合物30
‑
3(503mg,2.58mmol)的二氯甲烷(2ml)溶液中,搅拌反应4h。硅胶柱层析纯化,得到标题化合物,1.1g。esi
‑
ms(m/z):516.2[m h]
[0534]
步骤四:(s)
‑2‑
氨基
‑
n
‑
((s)
‑1‑
((4
‑
(羟甲基)苯基)氨基)
‑1‑
氧代丙烷
‑2‑
基)
‑3‑
甲基丁酰胺的制备
[0535]
室温条件下,将乙二胺(2ml)加入化合物30
‑
4(1.1g,2.13mmol)的二氯甲烷(8ml)溶液中。搅拌反应1h。硅胶柱层析纯化,得标题化合物,610mg。esi
‑
ms(m/z):294.2[m h]
[0536]
步骤五:(s)
‑2‑
(32
‑
叠氮基
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
二氮杂三十五烷酰胺基)
‑
n
‑
((s)
‑1‑
((4
‑
(羟基甲基)苯基)氨基)
‑1‑
氧代丙烷
‑2‑
基)
‑3‑
甲基丁
酰胺的制备
[0537]
室温条件下,将o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸酯(160mg,0.42mmol),1
‑
羟基苯并三唑(57mg,0.42mmol),n,n
‑
二异丙基乙胺(109mg,0.84mmol)和32
‑
叠氮基
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
氮杂三环癸烷
‑1‑
酸(156mg,0.28mmol)加入化合物30
‑
5(84mg,0.28mmol)的二氯甲烷(3ml)中,搅拌反应4h。硅胶柱层析纯化,得标题化合物,163mg。esi
‑
ms(m/z):830.4[m h]
[0538]
步骤六:4
‑
((2s,5s)
‑
38叠氮基
‑5‑
异丙基
‑2‑
甲基
‑
4,7,11
‑
三氧代
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12
‑
三氮杂三十烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰氨基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的制备
[0539]
氮气保护下,0℃中将三光气(16mg,0.05mmol)的二氯甲烷(0.3ml)溶液滴加入4
‑
二甲氨基吡啶(65mg,0.53mmol)和(s)
‑
n
‑
(2
‑
(4
‑
乙基
‑4‑
羟基
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑
11
‑
基)乙基)
‑
n
‑
异丙基甲磺酰胺(45mg,0.09mmol)的二氯甲烷(0.7ml)混合溶液中,0℃下反应1h。将化合物30
‑
6(73mg,0.09mmol)的二氯甲烷(1ml)滴加入反应液中,0℃下反应1h。硅胶柱层析纯化,得标题化合物,33mg。esi
‑
ms(m/z):1367.6[m h]
[0540]
步骤七:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基
‑4‑
((2s,5s)
‑5‑
异丙基
‑2‑
甲基
‑
38
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)基)己
‑5‑
炔酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,7,11
‑
三氧代
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12
‑
三氮杂三十烷酰胺基)苄基碳酸酯(化合物tl030)的制备
[0541]
室温条件下,将溴化亚铜(5mg,0.04mmol)和化合物30
‑
7(20mg,15umol)滴加入6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙
‑2‑
炔
‑1‑
基)
‑
己
‑5‑
炔酰胺(9mg,0.007mmol)的水和n,n
‑
二甲基甲酰胺(0.2ml:0.8ml)混合溶液中,搅拌反应4h。经制备高效液相色谱纯化(方法d),得标题化合物,4.15mg。esi
‑
ms(m/z):1672.7[m h]
[0542]
实施例十四4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯
[0543][0544]
步骤一:6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙
‑2‑
炔
‑1‑
基)己
‑5‑
炔酰胺的合成
[0545]
25℃下将丙
‑2‑
炔
‑1‑
胺(189mg,3.4mmol)和化合物3
‑
4(800mg,2.83mmol)溶于二氯甲烷(10ml)中,依次加入n,n
‑
二异丙基乙胺(738mg,5.67mmol),o
‑
(7
‑
氮杂苯并三唑
‑1‑
基)
‑
n,n,n
′
,n
′‑
四甲基脲六氟磷酸酯(1.63g,4.25mmol),搅拌反应2h。反应液减压浓缩,残余物经快速硅胶柱纯化(乙酸乙酯/石油醚=3/1)得标题化合物,700mg。esi
‑
ms(m/z):306.1[m h]
。
[0546]
步骤二:4
‑
((s)
‑
35
‑
叠氮基
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯甲基)氨基)丁基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷酰氨基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
2h
‑
吡喃并[2,3
‑
b]
‑
1h
‑
吡喃并[3',4':6,7]吲嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0547]
25℃氮气保护下,将t
‑
030(250mg,0.49mmol)溶于二氯甲烷(10ml)中,降温至0℃,加入4
‑
二甲氨基吡啶(478mg,3.91mmol)的二氯甲烷(3ml)溶液,然后缓慢滴加三光气(72mg,0.24mmol)的二氯甲烷(10ml)溶液,加毕,0℃搅拌反应20min,反应液用氮气吹20min。加入(s)
‑2‑
(32
‑
叠氮基
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
九氧杂
‑6‑
氮杂三联乙酰胺基)
‑
n
‑
(4
‑
(羟甲基)苯基)
‑
6(((4
‑
甲氧基苯基)二苯甲基)氨基)乙酰胺(518mg,0.49mmol)的二氯甲烷(7ml)溶液,加毕,0℃搅拌反应1h。反应液减压浓缩,残余物经制备高效液相色谱纯化(方法a)得标题化合物,500mg。esi
‑
ms(m/z):1597.5[m h]
。
[0548]
步骤三:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]吲嗪并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯基甲基)氨基)丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基)碳酸酯的合成
[0549]
室温下,将化合物33
‑
1(14mg,0.05mmol)溶于二甲基亚砜和水(2.0ml:0.5ml)中,
加入溴化亚铜(11mg,0.08mmol),搅拌反应1h。经制备高效液相色谱纯化(方法b),得标题化合物,30mg。esi
‑
ms(m/z):815.9[(m
‑
273)/2 h]
。
[0550]
步骤四:4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯(化合物tl033)的合成
[0551]
将化合物33
‑
2(30mg,0.02mmol)溶于二氯甲烷(1.0ml)反应液中加入三氟乙酸(0.2ml),室温反应30min。经制备高效液相色谱纯化(方法c),得标题化合物的三氟乙酸盐,20.0mg。其结构表征如下:
[0552]1h nmr(400mhz,dmso
‑
d6)δ10.18(s,1h),9.10(s,2h),8.38(t,j=5.56hz,1h),8.32(d,j=8.40hz,1h),8.22
–
8.20(m,2h),8.09(t,j=5.68hz,1h),7.91
–
7.87(m,2h),7.82
–
7.78(m,1h),7.69(brs,3h),7.61(d,j=8.56hz,2h),7.32(d,j=8.56hz,2h),7.06(s,1h),5.56(d,j=16.96hz,1h),5.51(d,j=16.96hz,1h),5.47(d,j=19.28hz,1h),5.42(d,j=19.28hz,1h),5.14(d,j=12.20hz,1h),5.07(d,j=12.16hz,1h),4.48(t,j=5.24hz,2h),4.46
–
4.43(m,1h),4.29(d,j=5.60hz,2h),4.08
–
3.95(m,5h),3.79(t,j=5.28hz,2h),3.51
–
3.43(m,32h),3.40(s,3h),3.39
–
3.35(m,2h),3.30
–
3.26(m,2h),3.00(s,3h),2.82
–
2.74(m,2h),2.56(t,j=7.08hz,2h),2.29(t,j=7.36hz,2h),2.23
–
2.13(m,2h),1.82(p,j=7.24hz,2h),1.78
–
1.63(m,2h),1.61
–
1.49(m,2h),1.42
–
1.27(m,2h),1.15(d,j=6.80hz,3h),1.13(d,j=6.76hz,3h),0.90(t,j=7.32hz,3h).esi
‑
ms(m/z):816.0[m/2 h]
。[α]
d20
为
‑
19.55
°
(c=1.000g/100ml,ch3cn).
[0553]
实施例十五4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑
11
‑
二乙基
‑9‑
羟基
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]吲嗪并[1,2
‑
b]喹啉
‑4‑
碳酸酯
[0554]
[0555]
步骤一:4
‑
((s)
‑
35
‑
叠氮基
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯基甲基)氨基)丁基)
‑
4,8
‑
二氧代6,12,15,18,21,24,27
‑
壬氧基
‑
((s)
‑9‑
((叔丁基二甲基甲硅烷基)氧基)
‑
4,11
‑
二乙基
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1,2,3,4
‑
四氢喹啉
‑
1h
‑
吡喃并[3',4':6,7]吲嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0556]
室温下将化合物34
‑
1(100mg,0.2mmol)溶于干燥的二氯甲烷(2ml)中氮气保护,降温至0℃,加入4
‑
二甲氨基吡啶(144mg,1.18mmol)的干燥二氯甲烷(0.5ml)溶液,然后缓慢滴加三光气(41mg,0.14mmol)的干燥二氯甲烷(0.5ml)溶液,加毕,0℃搅拌反应1h。向反应液中加入(s)
‑2‑
(32
‑
叠氮基
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
九氧杂
‑6‑
氮杂三联乙酰胺基)
‑
n
‑
(4
‑
(羟甲基)苯基)
‑
6(((4
‑
甲氧基苯基)二苯甲基)氨基)乙酰胺(160mg,0.15μmol)的干燥二氯甲烷(0.5ml)溶液,加毕,室温反应1h。制备高效液相色谱纯化(方法b)得标题化合物,60mg。esi
‑
ms(m/z):1592.7[m h]
。
[0557]
步骤二:(s)
‑9‑
(叔丁基二甲基硅烷基)氧基)
‑
4,11
‑
二乙基
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]吲嗪[1,2
‑
b]喹啉
‑4‑
基
‑4‑
((s)
‑2‑
(4
‑
(((6
‑2‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
35
‑
(4
‑
((6
‑2‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
二氧代6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)碳酸酯的合成
[0558]
室温下,将化合物34
‑
2(40mg,0.03mmol)和6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙
‑2‑
炔
‑1‑
基)己
‑5‑
炔酰胺(11.50mg,0.04mmol)溶于二甲基亚砜和水(0.5ml:0.1ml)中,加入溴化亚铜(9.01mg,0.06mmol)搅拌反应1h。经制备高效液相色谱纯化(方法b),得标题化合物,20mg。esi
‑
ms(m/z):1897.5[m h]。
[0559]
步骤三:4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑
11
‑
二乙基
‑9‑
羟基
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]吲嗪并[1,2
‑
b]喹啉
‑4‑
碳酸酯(化合物tl034)的合成
[0560]
室温下将化合物34
‑
3(30mg,0.018mmol)溶于乙腈和水(0.4ml:0.1ml)中,滴加三氟乙酸和乙腈(0.5ml:0.5ml)的混合溶液,室温搅拌2h。经制备高效液相色谱纯化(方法c),得标题化合物的三氟乙酸盐,12mg。esi
‑
ms(m/z):1511.5[m h]
。
[0561]
实施例十六4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰氨基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0562][0563]
步骤一:((s)
‑
35
‑
叠氮基
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯基甲基)氨基)丁基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰氨基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1,2,3,6
‑
三氮杂环庚烷
‑
1h
‑
吡喃并[3',4':6,7]吲嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0564]
采用与实施例十五步骤一类似的合成方法,以化合物35
‑
1代替化合物34
‑
1,得标题化合物,60mg。esi
‑
ms(m/z):1561.5[m h]
。
[0565]
步骤二:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰氨基)乙基)
‑
3,14
‑
二氧代3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)
‑4‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯基甲基)氨基)丁基)
‑
35
‑
(4
‑
((6
‑2‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基]碳酸酯的合成
[0566]
采用与实施例十五步骤二类似的合成方法,以化合物35
‑
2代替化合物34
‑
2,得标题化合物,20mg。esi
‑
ms(m/z):1866.5[m h]。
[0567]
步骤三:4
–
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰氨基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯(化合物tl035)的合成
[0568]
采用与实施例十五步骤三类似的合成方法,以化合物35
‑
3代替化合物34
‑
3,得标题化合物的三氟乙酸盐,4.9mg。esi
‑
ms(m/z):1594.5[m h]
。
[0569]
实施例十七4
‑
((s,z)
‑2‑
(4
‑
氨基丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
烯酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0570][0571]
步骤一:(z)
‑6‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)己
‑5‑
烯酸的合成
[0572]
20℃下,将化合物3
‑
4(200mg,0.67mmol)溶于甲醇(8.0ml)中,氮气保护下加入林德拉催化剂(20mg),氢气置换三次,20℃下氢化反应3h。过滤,滤液旋干,得标题化合物,150mg。esi
‑
ms(m/z):271.1[m h]
。
[0573]
步骤二:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((s,z)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯甲基)氨基)丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
烯酰胺基)苄基碳酸酯的合成
[0574]
室温下,将化合物45
‑
2(8mg,0.030mmol)溶于二氯甲烷(2ml)中,加入2
‑
(7
‑
偶氮苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯(14.9mg,0.039mmol)和n,n
‑
二异丙基乙胺(8.8mg,0.068mmol),反应液室温搅拌10min,加入化合物48
‑
1(30mg,0.020mmol),反应液室温下搅拌反应1h。制备高效液相色谱纯化(方法b)得标题化合物,30mg。esi
‑
ms(m/z):1787.8[m h]
。
[0575]
步骤三:4
‑
((s,z)
‑2‑
(4
‑
氨基丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
烯酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的(化合物tl045)合成
[0576]
室温下将化合物45
‑
3(30mg,0.017mmol)溶于乙腈(1ml)中,滴加三氟乙酸(0.5ml)的乙腈(0.5ml)溶液。反应液室温搅拌20min。制备高效液相色谱纯化(方法c)得标题化合物三氟乙酸盐,9mg。esi
‑
ms(m/z):1515.6[m h]
。
[0577]
实施例十八4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
炔酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯
[0578][0579]
步骤一:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯甲基)氨基)丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
炔酰胺基)苄基碳酸酯的合成
[0580]
采用实施例十二步骤一类似的合成方法,以化合物48
‑
1代替化合物24
‑
1。得标题化合物,15mg。esi
‑
ms(m/z):1785.8[m h]
。
[0581]
步骤二:4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
42
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
4,8,37
‑
三氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9,36
‑
三氮杂四十二烷基
‑
41
‑
炔酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基乙酰胺基)乙基)
‑
3,14
‑
二氧
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯(化合物tl048)的合成
[0582]
采用实施例十二步骤二类似的合成方法,以化合物48
‑
2代替化合物24
‑
2。得标题化合物的三氟乙酸盐,11.35mg。esi
‑
ms(m/z):1513.7[m h]
。
[0583]
实施例十九4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((2
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)噻唑
‑4‑
羧酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯
[0584][0585]
步骤一:2
‑
(2
‑
(甲硫基)嘧啶
‑5‑
基)噻唑
‑4‑
羧酸的合成
[0586]
将化合物49
‑
1(100mg,0.40mmol)、2
‑
溴
‑4‑
噻唑羧酸(99.01mg,0.48mmol)、碳酸钾(137.03mg,0.99mmol)和[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(29.02mg,0.04mmol)于n,n
‑
二甲基甲酰胺(4ml)和水(1ml)中,氮气保护,将反应体系加热到100℃搅拌4小时。反应液冷却到室温,滴入水中,抽滤,收集滤液,乙酸乙酯萃取(10ml
×
3),收集水相,稀盐酸调节ph=3,析出固体,抽滤,收集滤饼,得标题化合物,70mg。esi
‑
ms(m/z):254.0[m h]
。
[0587]
步骤二:2
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)噻唑
‑4‑
羧酸的合成
[0588]
将化合物49
‑
2(73mg,0.29mmol)溶于二氯甲烷(15ml)中,加间氯过氧苯甲酸(175.53mg,0.87mmol,85%),反应体系室温搅拌过夜。溶剂减压浓缩,制备高效液相色谱纯化(方法d),得标题化合物,20mg。esi
‑
ms(m/z):286.0[m h]
。
[0589]
步骤三:2
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙基
‑2‑
炔基
‑1‑
基)噻唑
‑4‑
甲酰胺的合成
[0590]
将化合物49
‑
3(20mg,0.07mmol)溶于二氯甲烷(2ml)中,加o
‑
(7
‑
氮苯并三氮唑)
‑
n,n,n,n
‑
四甲基脲六氟磷酸酯(39.98mg,0.11mmol),反应体系降温到0℃,加n,n
‑
二异丙基乙胺(22.65mg,0.18mmol)和丙炔胺(4.63mg,0.09mmol),反应液室温搅拌3h。制备高效液相色谱纯化(方法d),得标题化合物,10mg。esi
‑
ms(m/z):323.0[m h]
。
[0591]
步骤四:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基
‑
(4
‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯甲基)氨基)丁基)
‑
35
‑
(4
‑
((2
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)噻唑
‑4‑
羧酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基)碳酸酯的合成
[0592]
室温下,将化合物33
‑
1(30mg,0.02mmol)和化合物49
‑
4(9.08mg,0.03mmol)溶于二甲基亚砜和水中(2ml/0.5ml),加入溴化亚铜(5.39mg,0.04mmol)搅拌反应2h。过滤,滤液经制备高效液相色谱纯化(方法b)得标题化合物,20mg。esi
‑
ms(m/z):1647.3[m h
‑
273]
。
[0593]
步骤五:4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((2
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)噻唑
‑4‑
羧酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃酮[3',4':6,7]吲哚嗪并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0594]
室温下将化合物49
‑
5(20mg,0.01mmol)溶于二氯甲烷(2ml)中,滴加三氟乙酸(0.2ml)。反应液室温搅拌20min。反应液浓缩,残余物经制备高效液相色谱纯化(方法c)得标题化合物的三氟乙酸盐,8mg。esi
‑
ms(m/z):1647.9[m h]
。
[0595]
实施例二十4
‑
((s)
‑2‑
(4
‑
氨基丁酸)
‑
35
‑
(4
‑
((2
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
噁唑
‑4‑
甲酰氨基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯
[0596][0597]
步骤一:2
‑
(2
‑
(甲硫基)嘧啶
‑5‑
基)噁唑
‑4‑
羧酸乙酯的合成
[0598]
25℃下,将2
‑
溴噁唑
‑4‑
羧酸乙酯(100mg,0.45mmol)和化合物49
‑
1(126mg,0.50mmol)溶于1,4
‑
二氧六环和水的混合溶剂中(4ml/2ml),依次加入碳酸钾(125mg,0.9mmol)、[1,1'
‑
双(二苯基膦基)二茂铁]二氯化钯(33mg,0.05mmol),n2保护下,升温至90℃反应3h。反应液垫硅藻土过滤,滤液加水(50ml)稀释,乙酸乙酯萃取(30ml
×
3),合并有机相,干燥。滤除干燥剂,滤液减压浓缩,粗品用制备薄层色谱纯化(石油醚/乙酸乙酯=2/1)得标题化合物,40mg。esi
‑
ms(m/z):266.1[m h]
。
[0599]
步骤二:2
‑
(2
‑
(甲硫基)嘧啶
‑5‑
基)
‑
噁唑
‑4‑
羧酸的合成
[0600]
25℃下,将化合物50
‑
1(50mg,0.19mmol)溶于四氢呋喃和水的混合溶剂中(4ml/2ml),溶解完全后加入一水合氢氧化锂(40mg,0.94mmol),加毕,25℃下反应1h。反应液加水(15ml)稀释,乙酸乙酯萃取(20ml
×
2),水相用1n稀盐酸调ph=2
‑
3,二氯甲烷/甲醇混合溶
剂(v:v=10:1)萃取萃取(20ml
×
3),合并有机相,饱和食盐水洗涤(30ml
×
1),无水硫酸钠干燥。滤除干燥剂,滤液浓缩得标题化合物,40mg。未经纯化直接用于下一步反应。esi
‑
ms(m/z):238.1[m h]
。
[0601]
步骤三:2
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)噁唑
‑4‑
羧酸的合成
[0602]
25℃下,将化合物50
‑
2(40mg,0.17mmol)溶于二氯甲烷(6ml)中,溶解完全后,加入间氯过氧苯甲酸(29mg,0.17mmol),加毕,25℃搅拌反应14h。反应液浓缩,残余物经制备高效液相色谱纯化(方法d)得标题化合物,20mg。esi
‑
ms(m/z):269.9[m h]
。
[0603]
步骤四:2
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙
‑2‑
炔
‑1‑
基)
‑
噁唑
‑4‑
甲酰胺的合成
[0604]
25℃下,将化合物50
‑
3(20mg,0.07mmol)溶于二氯甲烷(4ml)中,依次加入o
‑
(7
‑
氮杂苯并三唑
‑1‑
基)
‑
n,n,n
′
,n
′‑
四甲基脲六氟磷酸酯(42mg,0.11mmol)和n,n
‑
二异丙基乙胺(19mg,0.15mmol),搅拌5min,加入丙炔胺(5.0mg,0.09mmol),加毕,室温搅拌30min。反应液浓缩,残余物经制备高效液相色谱纯化(方法d)得标题化合物,5.0mg。esi
‑
ms(m/z):306.9[m h]
。
[0605]
步骤五:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基4
‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯基甲基)氨基)丁基)
‑
35
‑
(4
‑
((2
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)噁唑
‑4‑
甲酰氨基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基)碳酸酯的合成
[0606]
25℃下,将化合物50
‑
4(6.0mg,0.02mmol)、化合物33
‑
1(30mg,0.02mmol)溶于二甲基亚砜和水的混合溶剂中(2ml/0.5ml),一次性加入溴化亚铜(5.0mg,0.04mmol),加毕,室温反应2h。反应液过滤,经制备高效液相色谱纯化(方法b)得标题化合物,25mg。esi
‑
ms(m/z):1631.3[(m
‑
273 h]
。
[0607]
步骤六:4
‑
((s)
‑2‑
(4
‑
氨基丁酸)
‑
35
‑
(4
‑
((2
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)噁唑
‑4‑
甲酰氨基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基
‑
((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0608]
25℃下,将化合物50
‑
5(20mg,0.01mmol)溶于二氯甲烷(2.0ml)中,溶解完全后向反应液中加入三氟乙酸(0.2ml),25℃反应10min。反应液浓缩,残余物经制备高效液相色谱纯化(方法c)得标题化合物的三氟乙酸盐,3.0mg。esi
‑
ms(m/z):816.5[m/2 h]
。
[0609]
实施例二十一n
‑
((1
‑
((6s,9s)
‑1‑
氨基
‑6‑
((4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨基)
‑3‑
甲基丁酰胺)
‑
n,3
‑
二甲基丁酰胺)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺)
‑3‑
苯丙酰胺)甲基)苯基)氨基甲酰基)
‑9‑
异丙基
‑
1,8,11,15
‑
四氧基
‑
13,19,22,25,28,31,34,37,40
‑
九氧杂
‑
2,7,10,16
‑
四氮杂蒽烷
‑
42
‑
基)
‑
1h
‑
1,2,3
‑
三氮唑
‑4‑
基)甲基)
‑6‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺
[0610][0611]
步骤一:((s)
‑1‑
(((s)
‑1‑
((4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨基)
‑3‑
丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯丙酰胺基)甲基)苯基)氨基)
‑1‑
氧代
‑5‑
戊基脲
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁
‑2‑
基)氨基
‑
(9h
‑
芴
‑
9基)甲基
‑
甲酸酯的合成
[0612]
室温下,将化合物51
‑
1(100mg,0.17mmol)和((s)
‑1‑
(((s)
‑1‑
((4
‑
(((s)
‑2‑
氨基
‑3‑
苯丙酰胺基)甲基)苯基)氨基)
‑1‑
氧代
‑5‑
戊基脲
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁
‑2‑
基)氨基
‑
(9h
‑
芴
‑
9基)甲基
‑
甲酸酯三氟乙酸盐(144mg,0.17mmol)溶于n,n
‑
二甲基甲酰胺(2ml)中,降温到0℃,依次加入1
‑
羟基苯并三唑(34mg,0.25mmol)和n
‑
甲基吗啉(51mg,0.51mmol)和1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(48mg,0.25mmol),加毕,反应液0℃搅拌5h。将反应液倒入水(20ml)中,析出白色固体,抽滤,滤饼水洗,干燥,得标题化合物,200mg。esi
‑
ms(m/z):1329.2[m h]
。
[0613]
步骤二:(s)
‑2‑
((s)
‑2‑
氨基
‑3‑
丁酰胺基)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨基)
‑3‑
丁酰胺基)
‑
n,3
‑
二甲基丁酰胺基)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)
‑3‑
苯丙酰胺基)甲基)苯基)
‑5‑
脲基戊酰胺的合成
[0614]
室温下,将化合物51
‑
2(200mg,0.12mmol)溶于n,n
‑
二甲基甲酰胺(5ml)中,加哌啶(0.5ml),反应液室温搅拌2h。反应液经制备高效液相色谱纯化(方法d)得标题化合物,65mg。esi
‑
ms(m/z):1107.2[m h]
。
[0615]
步骤三:(s)
‑2‑
((s)
‑
35
‑
叠氮
‑2‑
异丙基
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)
‑
n
‑
(4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨基)
‑3‑
甲基丁酰胺)
‑
n,3
‑
二甲基丁酰胺)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺)
‑3‑
苯丙酰胺)甲基)苯基)
‑5‑
脲基戊酰胺的合成
[0616]
将32
‑
叠氮
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
九氧杂
‑6‑
氮杂三甲酸(33.1mg,0.06mmol)于n,n
‑
二甲基甲酰胺中(5ml),加o
‑
(7
‑
氮苯并三氮唑)
‑
n,n,n,n
‑
四甲基脲六氟磷酸酯(38mg,0.10mmol)和n,n
‑
二异丙基乙胺(26mg,0.20mmol),反应液室温搅拌10min,降温到0℃,加化合物51
‑
3(55mg,0.05mmol),反应液室温搅拌2h。反应液经制备高效液相色谱
纯化(方法d)得标题化合物,56mg。esi
‑
ms(m/z):821.8[m/2 h]
。
[0617]
步骤四:n
‑
((1
‑
((6s,9s)
‑1‑
氨基
‑6‑
((4
‑
(((s)
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲氨基)
‑3‑
甲基丁酰胺)
‑
n,3
‑
二甲基丁酰胺)
‑3‑
甲氧基
‑5‑
甲基庚酰基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺)
‑3‑
苯丙酰胺)甲基)苯基)氨基甲酰基)
‑9‑
异丙基
‑
1,8,11,15
‑
四氧基
‑
13,19,22,25,28,31,34,37,40
‑
九氧杂
‑
2,7,10,16
‑
四氮杂蒽烷
‑
42
‑
基)
‑
1h
‑
1,2,3
‑
三氮唑
‑4‑
基)甲基)
‑6‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺的合成
[0618]
室温下,将化合物51
‑
4(56mg,0.04mmol)和6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙基
‑2‑
炔基
‑1‑
基)
‑5‑
己炔酰胺(16mg,0.05mmol)溶于二甲基亚砜和水的混合溶液中(2ml/0.5ml),加入溴化亚铜(10mg,68.17umol)搅拌反应2h。过滤,滤液经制备高效液相色谱纯化(方法d)得标题化合物,50mg。esi
‑
ms(m/z):974.3[m/2 h]
。
[0619]
实施例二十二4
‑
((2s,5s)
‑5‑
异丙基
‑
38
‑
(4
‑
((6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,7,11
‑
三氧
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
九氧杂
‑
3,6,12
‑
三氮杂四十二烷基)苄基
‑
((s)
‑1‑
(((s)
‑1‑
(((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((1s,2r)
‑1‑
羟基
‑1‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧庚烷
‑4‑
基)(甲基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)(甲基)氨基甲酸酯
[0620][0621]
步骤一:4
‑
((2s,5s)
‑
38
‑
叠氮基
‑5‑
异丙基
‑
4,7,11
‑
三氧
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
九氧杂
‑
3,6,12
‑
三氮杂四十二烷基)苄基
‑
((s)
‑1‑
(((s)
‑1‑
(((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((1s,2r)
‑1‑
羟基
‑1‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧庚烷
‑4‑
基)(甲基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)(甲基)氨基甲酸酯的合成
[0622]
室温下,将化合物53
‑
1(100mg,0.09mmol)溶于于n,n
‑
二甲基甲酰胺(3ml)中,加1
‑
羟基苯并三唑(13mg,0.09mmol)和n,n
‑
二异丙基乙胺(36mg,0.28mmol),然后加入化合物52
‑
1(67mg,0.09mol),反应液室温搅拌16h。反应液经制备高效液相色谱纯化(方法d)得标题化合物,120mg。esi
‑
ms(m/z):830.1[m/2 h]
。
[0623]
步骤二:4
‑
((2s,5s)
‑5‑
异丙基
‑
38
‑
(4
‑
((6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,7,11
‑
三氧
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
九氧杂
‑
3,6,12
‑
三氮杂四十二烷基)苄基
‑
((s)
‑1‑
(((s)
‑1‑
(((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((1s,2r)
‑1‑
羟基
‑1‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧
丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧庚烷
‑4‑
基)(甲基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)(甲基)氨基甲酸酯的合成
[0624]
室温下,将化合物52
‑
2(22mg,0.07mmol)溶于二甲基亚砜和水的混合溶液中(3ml/0.3ml),加入溴化亚铜(18mg,0.13mmol)搅拌反应1h。过滤,滤液经制备高效液相色谱纯化(方法d)得标题化合物,92mg。esi
‑
ms(m/z):982.8[m/2 h]
。
[0625]
实施例二十三(s)
‑2‑
((2r,3r)
‑3‑
((2s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑
n,3
‑
二甲基
‑2‑
((s)
‑3‑
甲基2
‑
(甲基(((4
‑
((s)
‑2‑
((s)
‑3‑
甲基
‑2‑
(32
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
氨基甲酰基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
氮杂三十烷酰胺基)丁酰氨基)
‑5‑
脲基戊酰氨基)苄基)氧基)羰基)氨基)丁酰氨基)丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰基)
‑
l
‑
苯丙氨酸的合成
[0626][0627]
步骤一:4
‑
((2s,5s)
‑
38
‑
叠氮基
‑5‑
异丙基
‑
4,7,11
‑
三氧代
‑2‑
(3
‑
脲基丙基)
‑
9,15,18,21,24,27,30,33,36
‑
壬氧基
‑
3,6,12
‑
三氮杂三十八烷酰胺基)苄基
‑
(4
‑
硝基苯基)
‑
碳酸酯的合成
[0628]
25℃下,将化合物29
‑
1(500mg,0.55mmol)溶于n,n
‑
二甲基甲酰胺(10ml)中,加入n,n
‑
二异丙基乙胺(141mg,1.09mmol),滴加二(对硝基苯)碳酸酯(332mg,1.09mmol)的二氯甲烷(1ml)溶液,加毕,25℃搅拌反应3h。反应液经反向柱(c18)层析纯化(乙腈/水=1:2)得标题化合物,400mg。esi
‑
ms(m/z):1081.9[m h]
。
[0629]
步骤二:(s)
‑2‑
((2r,3r)
‑3‑
((2s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
((((4
‑
((s)
‑2‑
((s)
‑2‑
(32
‑
叠氮基
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
氮杂三十烷酰胺基)
‑3‑
甲基丁酰氨基)
‑5‑
脲基戊酰氨基)苄基)氧基)羰基)(甲基)氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰基)
‑
l
‑
苯丙氨酸的合成
[0630]
25℃下,将化合物53
‑
1(60mg,0.06mmol),((2r)
‑3‑
((2s)
‑1‑
((3r,5s)
‑4‑
((s)
‑
n,3
‑
二甲基
‑2‑
((s)
‑3‑
甲基
‑2‑
(甲基氨基)丁酰氨基)丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰基)
‑
l
‑
苯丙氨酸(41mg,0.06mmol)溶于n,n
‑
二甲基甲酰胺(2ml)中,溶解完全后加入1
‑
羟基苯并三唑(8mg,0.06mmol),加毕,25℃搅拌反应16h。反
应液经制备高效液相色谱纯化(方法d)得标题化合物,38mg。esi
‑
ms(m/z):837.2[m/2 h]
。
[0631]
步骤三:(s)
‑2‑
((2r,3r)
‑3‑
((2s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑
n,3
‑
二甲基
‑2‑
((s)
‑3‑
甲基2
‑
(甲基(((4
‑
((s)
‑2‑
((s)
‑3‑
甲基
‑2‑
(32
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
氨基甲酰基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
氮杂三十烷酰胺基)丁酰氨基)
‑5‑
脲基戊酰氨基)苄基)氧基)羰基)氨基)丁酰氨基)丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰基)
‑
l
‑
苯丙氨酸的合成
[0632]
25℃下,将2
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙
‑2‑
炔
‑1‑
基)
‑
噁唑
‑4‑
甲酰胺(9mg,0.03mmol)和化合物53
‑
2(50mg,0.03mmol)溶于二甲基亚砜和水的混合溶剂中(1ml/0.25ml),溶解完全后加入溴化亚铜(11mg,0.08mmol),加毕,n2保护下搅拌反应1h。过滤,滤液经制备高效液相色谱纯化(方法d)得标题化合物,25mg。esi
‑
ms(m/z):989.9[m/2 h]
。
[0633]
实施例二十四4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基
‑
((s)
‑1‑
(((s)
‑1‑
(((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((1s,2r)
‑1‑
羟基
‑1‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧庚烷
‑4‑
基)(甲基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)(甲基)氨基甲酸酯
[0634][0635]
步骤一:(s)
‑4‑
(35
‑
叠氮基
‑2‑
(4
‑
(((4
‑
甲氧苯基)二苯甲基)氨基)丁酰基)
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基
‑
(4
‑
硝基苯基)
‑
碳酸酯的合成
[0636]
室温下,将化合物54
‑
1(1g,0.95mmol)溶于二氯甲烷(20ml)中,加n,n
‑
二异丙基乙胺(488mg,3.77mmol),然后滴加二
‑
(对硝基苯)
‑
碳酸酯(860mg,2.83mmol)的二氯甲烷
(10ml)溶液,反应液室温搅拌6h。硅胶柱纯化(二氯甲烷/甲醇=40/1),得标题化合物,900mg。esi
‑
ms(m/z):953.0[m h
‑
273]
。
[0637]
步骤二:4
‑
((s)
‑
35
‑
叠氮
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯甲基)氨基)丁酰基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基((s)
‑1‑
(((s)
‑1‑
(((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((1s,2r)
‑1‑
羟基
‑1‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧庚烷
‑4‑
基)(甲基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)(甲基)氨基甲酸酯的合成
[0638]
室温下,将化合物54
‑
2(2ml)中,加1
‑
羟基苯并三唑(33mg,0.25mmol)和n,n
‑
二异丙基乙胺(48mg,0.37mmol),然后加入化合物52
‑
1(88mg,0.12mmol),反应液室温搅拌16h。反应液经制备高效液相色谱纯化(方法b)得标题化合物,150mg。esi
‑
ms(m/z):1803.6[m h]
。
[0639]
步骤三:4
‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯甲基)氨基)丁酰基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基((s)
‑1‑
(((s)
‑1‑
(((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((1s,2r)
‑1‑
羟基
‑1‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧庚烷
‑4‑
基)(甲基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)(甲基)氨基甲酸酯的合成
[0640]
室温下,将化合物54
‑
3(100mg,0.06mmol)和6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙基
‑2‑
炔基
‑1‑
基)
‑5‑
己炔酰胺(26mg,0.08mmol)溶于二甲基亚砜(2ml)和水(0.5ml)中,加入溴化亚铜(16mg,0.11mmol),搅拌反应2h。过滤,滤液经制备高效液相色谱纯化(方法b)得标题化合物,70mg。esi
‑
ms(m/z):1936.6[m h
‑
273]
。
[0641]
步骤四:4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((6
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑5‑
己炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三氮唑
‑1‑
基)
‑
4,8
‑
二氧
‑
6,12,15,18,21,24,27,30,33
‑
九氧杂
‑
3,9
‑
二氮杂三十五烷基氨基)苄基
‑
((s)
‑1‑
(((s)
‑1‑
(((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((1s,2r)
‑1‑
羟基
‑1‑
苯基丙烷
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧庚烷
‑4‑
基)(甲基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)(甲基)氨基甲酸酯的合成
[0642]
室温下将化合物54
‑
4(70mg,0.04mmol)溶于二氯甲烷(2ml)中,滴加三氟乙酸(0.2ml)。反应液室温搅拌20min。反应液浓缩,残余物经制备高效液相色谱纯化(方法c)得标题化合物的三氟乙酸盐,55mg。esi
‑
ms(m/z):918.8[m/2 h]
。
[0643]
实施例二十五4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((4
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)苯甲酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0644][0645]
步骤一:4
‑
(2
‑
(甲硫基)嘧啶
‑5‑
基)苯甲酸甲酯的合成
[0646]
25℃下,将化合物49
‑
1(252mg,1.0mmol),水(3ml),pd(dppf)cl2(40mg,0.05mmol)和碳酸钾(277mg,2.0mmol)依次加入对溴苯甲酸甲酯(215mg,1.0mmol)的1,4
‑
二氧六环(5ml)溶液中,80℃搅拌反应4h。乙酸乙酯(30ml
×
3)萃取,合并有机相,干燥,滤除不溶物,残余物经硅胶柱层析纯化得标题化合物,220mg。esi
‑
ms(m/z):261.0[m h]
。
[0647]
步骤二:4
‑
(2
‑
(甲硫基)嘧啶
‑5‑
基)苯甲酸的合成
[0648]
25℃下,将一水合氢氧化锂(322mg,7.68mmol)和水(3ml)分别加入化合物55
‑
1(500mg,1.92mmol)的四氢呋喃(3ml)溶液中,搅拌反应4h。用1n的盐酸将反应液ph调至3
‑
4,乙酸乙酯(20ml
×
3)萃取,合并有机相,干燥,滤除不溶物,残余物经制备高效液相纯化(方法d)得标题化合物,430mg。esi
‑
ms(m/z):246.9[m h]
。
[0649]
步骤三:4
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)苯甲酸的合成
[0650]
25℃下,将间氯过氧苯甲酸(420mg,2.44mmol)加入化合物55
‑
2(200mg,0.81mmol)的二氯甲烷(5ml)溶液中,搅拌反应5h。硅胶柱层析纯化得标题化合物,180mg。esi
‑
ms(m/z):279.0[m h]
。
[0651]
步骤四:4
‑
(2
‑
(甲磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙
‑2‑
炔
‑1‑
基)苯甲酰胺的合成
[0652]
25℃下,将苯并三氮唑
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(100mg,0.26mmol)加入化合物55
‑
3(50mg,0.18mmol)的二氯甲烷(10ml)溶液中,搅拌反应30min,再将丙炔胺(10mg,0.2mmol)和n,n
‑
二异丙基乙胺(70mg,0.5mmol)加入反应液中,搅拌反应2.5h。硅胶柱层析纯化得标题化合物,20mg。esi
‑
ms(m/z):316.0[m h]
。
[0653]
步骤五:(s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基(4
‑
((s)
‑2‑
(4
‑
(((4
‑
甲氧基苯基)二苯基甲基)氨基)丁基)
‑
35
‑
(4
‑
((4
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)苯甲酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮
杂三十五烷酰胺基)苄基)碳酸酯的合成25℃,n2保护条件下,将碘化亚铜(10mg,0.05mmol)和水(2ml)依次加入化合物55
‑
4(16mg,0.05mmol),化合物33
‑
1(80mg,0.05mmol)的二甲基亚砜(2ml)溶液中,搅拌反应1h。纯化(方法b)得标题化合物,79mg。esi
‑
ms(m/z):1641.5[m
‑
273 h]
。
[0654]
步骤六:4
‑
((s)
‑2‑
(4
‑
氨基丁基)
‑
35
‑
(4
‑
((4
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)苯甲酰胺基)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑
4,8
‑
二氧代
‑
6,12,15,18,21,24,27,30,33
‑
壬氧基
‑
3,9
‑
二氮杂三十五烷酰胺基)苄基((s)
‑4‑
乙基
‑
11
‑
(2
‑
(n
‑
异丙基甲基磺酰胺基)乙基)
‑
3,14
‑
二氧代
‑
3,4,12,14
‑
四氢
‑
1h
‑
吡喃并[3',4':6,7]中氮茚并[1,2
‑
b]喹啉
‑4‑
基)碳酸酯的合成
[0655]
25℃下,将化合物55
‑
5(55mg,0.029mmol)加入三氟乙酸(0.5ml)的水/乙腈(0.1ml/0.5ml)混合溶剂中。搅拌反应15min,反应液经制备高效液相色谱纯化(方法c)得标题化合物的三氟乙酸盐,42mg。esi
‑
ms(m/z):821.0[m/2 h]
。
[0656]
实施例二十六n
‑
((1
‑
((6s,9s)
‑1‑
氨基
‑6‑
((4
‑
((s)
‑3‑
叠氮基
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)丙基)苯基)氨基甲酰基)
‑9‑
异丙基
‑
1,8,11,15
‑
四氧代
‑
13,19,22,25,28,31,34,37,40
‑
壬氧基
‑
2,7,10,16
‑
四氮杂四十二烷
‑
42
‑
基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)甲基)
‑6‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺
[0657][0658]
步骤一:32
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
氮杂三十二烷酸的合成
[0659]
20℃下,将化合物56
‑
1(750mg,1.28mmol)和6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)
‑
n
‑
(丙
‑2‑
炔
‑1‑
基)己
‑5‑
炔酰胺(496mg,1.54mmol)溶于二甲基亚砜(10ml)中,一次性加入溴化亚铜(465mg,3.21mmol),加毕,搅拌反应12h。反应液过滤,滤液经制备高效液相色谱纯化(方法d)得标题化合物,500mg。esi
‑
ms(m/z):860.4[m h]
。
[0660]
步骤二:(9h
‑
芴
‑9‑
基)甲基((s)
‑1‑
(((s)
‑1‑
((4
‑
((s)
‑3‑
叠氮基
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)丙基)苯基)氨
基)
‑1‑
氧代
‑5‑
脲基戊酰氨基
‑2‑
基)氨基)
‑3‑
甲基
‑1‑
氧代丁烷
‑2‑
基)氨基甲酸酯的合成
[0661]
25℃下,将(s)
‑
n
‑
((3r,4s,5s)
‑1‑
((s)
‑2‑
((1r,2r)
‑3‑
(((s)
‑1‑
(4
‑
氨基苯基)
‑3‑
叠氮基丙基
‑2‑
基)氨基)
‑1‑
甲氧基
‑2‑
甲基
‑3‑
氧代丙基)吡咯烷
‑1‑
基)
‑3‑
甲氧基
‑5‑
甲基
‑1‑
氧代庚基
‑4‑
基)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基(185mg,0.24mmol)溶于n,n
‑
二甲基甲酰胺(5ml)中,加入hatu(137mg,0.36mmol),搅拌反应5min,加入(s)
‑2‑
((s)
‑2‑
((((9h
‑
芴
‑9‑
基)甲氧基)羰基)氨基)
‑3‑
甲基丁酰氨基)
‑5‑
脲基戊酸(131mg,0.26mmol),室温搅拌30min。反应液直接用于下一步反应。esi
‑
ms(m/z):626.0[m/2 h]
。
[0662]
步骤三:(s)
‑2‑
((s)
‑2‑
氨基
‑3‑
甲基丁酰氨基)
‑
n
‑
(4
‑
((s)
‑3‑
叠氮基
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)丙基)苯基)
‑5‑
脲基戊酰氨的合成
[0663]
25℃下,向步骤二反应液中加入二乙胺(0.5ml),加毕,搅拌反应30min。反应液经制备高效液相色谱纯化(方法d)得标题化合物,70mg。esi
‑
ms(m/z):515.0[m/2 h]
。
[0664]
步骤四:n
‑
((1
‑
((6s,9s)
‑1‑
氨基
‑6‑
((4
‑
((s)
‑3‑
叠氮基
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)丙基)苯基)氨基甲酰基)
‑9‑
异丙基
‑
1,8,11,15
‑
四氧代
‑
13,19,22,25,28,31,34,37,40
‑
壬氧基
‑
2,7,10,16
‑
四氮杂四十二烷
‑
42
‑
基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)甲基)
‑6‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺的合成
[0665]
25℃下,将(s)
‑2‑
((s)
‑2‑
氨基
‑3‑
甲基丁酰氨基)
‑
n
‑
(4
‑
((s)
‑3‑
叠氮基
‑2‑
((2r,3r)
‑3‑
((s)
‑1‑
((3r,4s,5s)
‑4‑
((s)
‑2‑
((s)
‑2‑
(二甲基氨基)
‑3‑
甲基丁酰氨基)
‑
n,3
‑
二甲基丁酰氨基)
‑3‑
甲氧基
‑5‑
甲基庚基)吡咯烷
‑2‑
基)
‑3‑
甲氧基
‑2‑
甲基丙酰胺基)丙基)苯基)
‑5‑
脲基戊酰氨(95mg,0.092mmol),32
‑
(4
‑
((6
‑
(2
‑
(甲基磺酰基)嘧啶
‑5‑
基)己
‑5‑
炔酰胺)甲基)
‑
1h
‑
1,2,3
‑
三唑
‑1‑
基)
‑5‑
氧代
‑
3,9,12,15,18,21,24,27,30
‑
壬氧基
‑6‑
氮杂三十二烷酸(79mg,0.092mmol)溶于n,n
‑
二甲基甲酰胺(4ml)中,一次性加入hatu(70mg,0.184mmol),室温搅拌反应1h。反应液经制备高效液相色谱纯化(方法d)得标题化合物,30mg。esi
‑
ms(m/z):935.8[m/2 h]
。
[0666]
三、包含细胞生物活性分子和连接体的化合物与抗体的偶联
[0667]
实施例二十七bt001002的制备
[0668]
取0.3ml sacituzumab抗体(抗trop
‑
2,33.5mg/ml),用0.25ml含有20mm pb、150mm nacl和20mm依地酸钠的溶液(ph 7.6)稀释,后加入0.45ml含有20mm pb和150mm nacl溶液(ph 7.6)混匀,以1m k2hpo4溶液调ph至7.4,加入10mm tcep(三(2
‑
羧乙基)膦)溶液混匀,室温放置30min。向上述溶液体系加入15倍物质的量的溶解在二甲基亚砜中的tl003,混匀,室温静置2h,完毕后加入100mm半胱氨酸6.1μl终止反应。最后采用g
‑
25凝胶柱将缓冲液置换为ph6.44的20mm pb缓冲溶液,得到tl003与sacituzumab抗体偶联的产物,命名为bt001002。
[0669][0670]
实施例二十八bt001004的制备
[0671]
取0.285ml sacituzumab抗体(抗trop
‑
2,17.6mg/ml),用0.095ml稀释液(含有20mm pb、150mm nacl和20mm依地酸钠的溶液,ph 7.6)稀释;然后用1m na2hpo4溶液调节ph至7.4,加入10mm tcep溶液混匀,室温放置30min;向上述溶液体系加入9倍物质的量的溶解在二甲基亚砜中的tl019,混匀,室温静置2h。最后采用g
‑
25凝胶柱将缓冲液置换为ph 6.5的pbs缓冲溶液,得到tl019与sacituzumab抗体偶联的产物,命名为bt001004。
[0672][0673]
实施例二十九bt001012的制备
[0674]
采用与实施例二十七类似的方法,将tl003替换为tl024的三氟乙酸盐,得到tl024与sacituzumab抗体偶联的产物,命名为bt001012。
[0675][0676]
实施例三十bt001013的制备
[0677]
采用与实施例二十七类似的方法,将tl003替换为tl048的三氟乙酸盐,得到tl048与sacituzumab抗体偶联的产物,命名为bt001013。
[0678]
[0679]
实施例三十一bt001018的制备
[0680]
采用与实施例二十七类似的方法,将tl003替换为tl030,得到tl030与sacituzumab抗体偶联的产物,命名为bt001018。
[0681][0682]
实施例三十二bt001021的制备
[0683]
取0.3mlsacituzumab抗体(抗trop
‑
2,33.5mg/ml),用0.25ml含有20mm pb、150mm nacl和20mm依地酸钠的溶液(ph7.6)稀释,后加入0.45ml含有20mm pb和150mm nacl的溶液(ph 7.6)混匀,以1m na2hpo4溶液调ph至7.4,加入10mm tcep(三(2
‑
羧乙基)膦)溶液混匀,室温放置30min。向上述溶液体系加入10倍物质的量的溶解在二甲基亚砜中的tl033三氟乙酸盐,混匀,室温静置2h,完毕后加入100mm半胱氨酸6.1μl终止反应。最后采用g
‑
25凝胶柱将缓冲液置换为ph6.5的pbs缓冲溶液,得到tl033与sacituzumab抗体偶联的产物,命名为bt001021。
[0684][0685]
实施例三十三bt001022的制备
[0686]
采用与实施例二十七类似的方法,将tl003替换为tl034的三氟乙酸盐,得到tl034与sacituzumab抗体偶联的产物,命名为bt001022。
[0687][0688]
实施例三十四bt001023的制备
[0689]
采用与实施例二十七类似的方法,将tl003替换为tl035的三氟乙酸盐,得到tl035与sacituzumab抗体偶联的产物,命名为bt001023。
[0690][0691]
实施例三十五bt001032的制备
[0692]
采用与实施例二十七类似的方法,将tl003替换为tl045的三氟乙酸盐,得到tl045与sacituzumab抗体偶联的产物,命名为bt001032。
[0693][0694]
实施例三十六bt001033的制备
[0695]
采用与实施例二十七类似的方法,将tl003替换为tl033的三氟乙酸盐,sacituzumab抗体替换为m1抗体,得到tl033与m1抗体偶联的产物,命名为bt001033。
[0696][0697]
实施例三十七bt001034的制备
[0698]
采用与实施例二十七类似的方法,将tl003替换为tl033的三氟乙酸盐,sacituzumab抗体替换为m2抗体,得到tl033与m2抗体偶联的产物,命名为bt001034。
[0699][0700]
实施例三十八bt001035的制备
[0701]
取0.3ml m3抗体(抗trop
‑
2,33.5mg/ml),用0.25ml含有20mm pb、150mm nacl和20mm依地酸钠的溶液(ph7.6)稀释,后加入0.45ml含有20mm pb和150mm nacl的溶液(ph 7.6)混匀,以1m na2hpo4溶液调ph至7.4,加入10mm tcep(三(2
‑
羧乙基)膦)溶液混匀,室温放置30min。向上述溶液体系加入10倍物质的量的溶解在二甲基亚砜中的tl033的三氟乙酸盐,混匀,室温静置2h,完毕后加入100mm半胱氨酸6.1μl终止反应。最后采用g
‑
25凝胶柱将
缓冲液置换为ph6.5的pbs缓冲溶液,得到tl033与m3抗体偶联的产物,命名为bt001035。
[0702][0703]
实施例三十九bt001036的制备
[0704]
采用与实施例二十七类似的方法,将tl003替换为tl033的三氟乙酸盐,sacituzumab抗体替换为曲妥珠抗体,得到tl033与曲妥珠抗体偶联的产物,命名为bt001036。
[0705][0706]
实施例四十bt001040的制备
[0707]
采用与实施例二十七类似的方法,将tl003替换为tl049的三氟乙酸盐,得到tl049与sacituzumab抗体偶联的产物,命名为bt001040。
[0708][0709]
实施例四十一bt001041的制备
[0710]
采用与实施例二十七类似的方法,将tl003替换为tl050的三氟乙酸盐,得到tl050与sacituzumab抗体偶联的产物,命名为bt001041。
[0711][0712]
实施例四十二bt001042的制备
[0713]
采用与实施例二十七类似的方法,将tl003替换为tl051,得到tl051与
sacituzumab抗体偶联的产物,命名为bt001042。
[0714][0715]
实施例四十三bt001043的制备
[0716]
采用与实施例二十七类似的方法,将tl003替换为tl052,得到tl052与sacituzumab抗体偶联的产物,命名为bt001043。
[0717][0718]
实施例四十四bt001044的制备
[0719]
采用与实施例二十七类似的方法,将tl003替换为tl053,得到tl053与sacituzumab抗体偶联的产物,命名为bt001044。
[0720][0721]
实施例四十五bt001045的制备
[0722]
采用与实施例二十七类似的方法,将tl003替换为tl054的三氟乙酸盐,得到tl054与sacituzumab抗体偶联的产物,命名为bt001045。
[0723][0724]
实施例四十六bt001046的制备
[0725]
采用与实施例二十七类似的方法,将tl003替换为tl055的三氟乙酸盐,得到tl055与sacituzumab抗体偶联的产物,命名为bt001046。
[0726][0727]
实施例四十七bt001047的制备
[0728]
采用与实施例二十七类似的方法,将tl003替换为tl056,得到tl056与sacituzumab抗体偶联的产物,命名为bt001047。
[0729][0730]
实施例四十八lc
‑
ms测定bt001002分子量
[0731]
对偶联后的bt001002进行lcms分子量分析。
[0732]
色谱测定条件:
[0733]
液相色谱柱:acquituprotein beh c4 1.7μm,2.1mm x 100mm;
[0734]
流动相a:0.1%fa/98%h2o/2%acn;流动相b:0.1%fa/2%h2o/98%acn;
[0735]
流速:0.25ml/min;样品室温度:8℃;柱温:60℃;进样量:1μg;
[0736]
时间(分钟)178913流动相a(体积%)9020209090流动相b(体积%)1080801010
[0737]
质谱测定条件:
[0738]
质谱型号:triple tof 5600 ;
[0739]
gs1 60;gs2 60;cur30;tem600;isvf5000;dp300;ce10 m/z600
‑
5000;
[0740]
结果如图1
‑
3所示。
[0741]
bt001002理论分子量及实测分子量
[0742][0743]
表中,mab表示单克隆抗体;lc代表抗体轻链;hc表示抗体重链;dar1表示包含一条抗体轻链/重链和一个细胞生物活性分子的偶联物;dar2表示包含一条抗体轻链/重链和两个细胞生物活性分子的偶联物;dar3表示包含一条抗体轻链/重链和三个细胞生物活性分
子的偶联物;dar4表示包含一条抗体轻链/重链和四个细胞生物活性分子的偶联物;糖型表示两条重链上的糖链结构:g0f表示岩藻糖化无半乳糖。下文中mab、lc、hc、dar1、dar2、dar3、dar4和g0f如上说明。
[0744]
由图1
‑
3可知,抗体与tl003偶联后,轻重链分子量均发生变化,其中轻链偶联1个细胞生物活性分子、重链偶联3个细胞生物活性分子,由此推知整个抗体与细胞生物活性分子的偶联比(dar)为8。
[0745]
实施例四十九lc
‑
ms测定bt001004分子量
[0746]
对偶联后的bt001004进行lc
‑
ms分子量分析。
[0747]
色谱测定条件:
[0748]
液相色谱柱:acquituprotein beh c18 1.7μm,2.1mm
×
100mm;
[0749]
流动相a:0.1%fa/98%h2o/2%acn;流动相b:0.1%fa/2%h2o/98%acn;
[0750]
流速:0.25ml/min;样品室温度:8℃;柱温:60℃;进样量:1μg;
[0751]
时间(分钟)22022252630流动相a(体积%)806010108080流动相b(体积%)204090902020
[0752]
质谱测定条件:
[0753]
质谱型号:triple tof 5600 ;
[0754]
gs1 60;gs2 60;cur30;tem 350;isvf5500;dp300;ce10;m/z 600
‑
5000;
[0755]
结果如图4
‑
6所示。
[0756]
bt001004理论分子量及实测分子量
[0757][0758]
lc代表抗体轻链、hc表示抗体重链。
[0759]
由图4
‑
6可知,bt001004中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为14%,86%)、重链偶联1~3个细胞生物活性分子(dar1,dar2,dar3比例分别为13%,19%,68%),由此计算整个抗体与细胞生物活性分子的偶联比(dar)为7.0。
[0760]
实施例五十lc
‑
ms测定bt001012分子量
[0761]
采用与实施例四十八类似的方法,结果如图10和11所示。
[0762]
tl024与抗体偶联后得到的bt001012轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0763][0764]
由图10和11可知,bt001012中抗体轻链偶联0~1个毒素(lc,dar1比例分别为12.9%,87.1%)、重链偶联1~3个毒素(dar1,dar2,dar3比例分别为13.4%,10.8%,75.8%),由此计算抗体与毒素的偶联比(dar)为7.0。
[0765]
实施例五十一lc
‑
ms测定bt001013分子量
[0766]
采用与实施例四十八类似的方法,结果如图12和13所示。
[0767]
tl048与抗体偶联后得到的bt001013轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0768][0769]
由图12和13可知,bt001013中抗体轻链偶联0~1个毒素(lc,dar1比例分别为6.8%,93.2%)、重链偶联1~4个毒素(dar1,dar2,dar3,dar4比例分别为12.8%,12.8%,64.9%,9.5%),由此计算抗体与毒素的偶联比(dar)为7.3。
[0770]
实施例五十二lc
‑
ms测定bt001018分子量
[0771]
采用与实施例四十八类似的方法,结果如图14和15所示。
[0772]
tl030与抗体偶联后得到的bt001018轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0773][0774]
由图14和15可知,bt001018中抗体轻链偶联0~1个毒素(lc,dar1比例分别为55.3%,44.7%)、重链偶联1~3个毒素(dar1,dar2,dar3比例分别为19.6%,23.3%,49.6%),由此计算抗体与毒素的偶联比(dar)为5.2。
[0775]
实施例五十三lc
‑
ms测定bt001021分子量
[0776]
对偶联后的bt001021进行lcms分子量分析。
[0777]
色谱测定条件:
[0778]
液相色谱柱:acquituprotein beh c4 1.7μm,2.1mm x 100mm;
[0779]
流动相a:0.1%fa/98%h2o/2%acn;流动相b:0.1%fa/2%h2o/98%acn;
[0780]
流速:0.25ml/min;样品室温度:8℃;柱温:60℃;进样量:1μg;
[0781]
时间(分钟)178913流动相a(体积%)9020209090流动相b(体积%)1080801010
[0782]
质谱测定条件:
[0783]
质谱型号:triple tof 5600 ;
[0784]
gs1 60;gs2 60;cur30;tem600;isvf5000;dp300;ce10 m/z600
‑
5000;
[0785]
结果如图16和17所示。
[0786]
tl033与抗体偶联后得到的bt001021轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0787][0788][0789]
由图16和17可知,bt001021中抗体轻链偶联0~1个毒素(lc,dar1比例分别为4.5%,95.5%)、重链偶联1~3个毒素(dar1,dar2,dar3比例分别为15.3%,17.6%,67.1%),由此计算抗体与毒素的偶联比(dar)为6.9。
[0790]
实施例五十四lc
‑
ms测定bt001023分子量
[0791]
采用与实施例四十八类似的方法,结果如图18和19所示。
[0792]
tl035与抗体偶联后得到的bt001023轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0793][0794]
由图18和19可知,bt001023中抗体轻链偶联0~1个毒素(lc,dar1比例分别为15%,85%)、重链偶联0~3个毒素(hc,dar1,dar2,dar3比例分别为6.7%,16.7%,12.7%,63.9%),由此计算抗体与毒素的偶联比(dar)为6.4。
[0795]
实施例五十五lc
‑
ms测定bt001040分子量
[0796]
对偶联后的bt001040进行lc
‑
ms分子量分析
[0797]
液相色谱柱:thermo mabpactm rp 4μm,3.0mm*100mm
[0798]
流动相a:0.1%fa/98%h2o/2%acn;流动相b:0.1%fa/2%h2o/98%acn
[0799]
流速:0.25ml/min;样品室温度:8℃;柱温:60℃;进样量:1μg
[0800]
时间(分钟)22022252630流动相a(体积%)806010108080流动相b(体积%)204090902020
[0801]
质谱测定条件:
[0802]
质谱型号:triple tof 5600
[0803]
gs1 35;gs2 35;cur30;tem 350;isvf5000;dp250;m/z 600
‑
5000
[0804]
tl049与抗体偶联后得到的bt001040轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0805][0806]
由图20和21可知,bt001040中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为4.9%,95.1%)、重链偶联1~4个细胞生物活性分子(dar1,dar2,dar3,dar4比例分别为16.5%,14.3%,52.6%,16.6%),由此计算抗体与细胞生物活性分子的偶联比(dar)为7.3。
[0807]
实施例五十六lc
‑
ms测定bt001041分子量
[0808]
采用与实施例五十五类似的方法,结果如图22和23所示。
[0809]
tl050与抗体偶联后得到的bt001041轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0810]
[0811]
由图22和23可知,bt001041中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为10.5%,89.5%)、重链偶联1~4个细胞生物活性分子(dar1,dar2,dar3,dar4比例分别为21.3%,14.8%,57.9%,6.0%),由此计算抗体与细胞生物活性分子的偶联比(dar)为6.8。
[0812]
实施例五十七lc
‑
ms测定bt001042分子量
[0813]
采用与实施例五十五类似的方法,结果如图24和25所示。
[0814]
tl051与抗体偶联后得到的bt001042轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0815][0816]
由图24和25可知,bt001042中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为14.9%,85.1%)、重链偶联1~3个细胞生物活性分子(dar1,dar2,dar3比例分别为19.7%,9.4%,70.9%),由此计算抗体与细胞生物活性分子的偶联比(dar)为6.7。
[0817]
实施例五十八lc
‑
ms测定bt001043分子量
[0818]
采用与实施例五十五类似的方法,结果如图26和27所示。
[0819]
tl052与抗体偶联后得到的bt001043轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0820][0821][0822]
由图26和27可知,bt001043中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为9.1%,90.9%)、重链偶联1~3个细胞生物活性分子(dar1,dar2,dar3比例分别为20.1%,11.4%,68.4%),由此计算抗体与细胞生物活性分子的偶联比(dar)为6.8。
[0823]
实施例五十九lc
‑
ms测定bt001044分子量
[0824]
采用与实施例五十五类似的方法,结果如图28和29所示。
[0825]
tl053与抗体偶联后得到的bt001044轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0826][0827]
由图28和29可知,bt001044中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为23.0%,77.0%)、重链偶联1~3个细胞生物活性分子(dar1,dar2,dar3比例分别为19.4%,11.4%,69.3%),由此计算抗体与细胞生物活性分子的偶联比(dar)为6.5。
[0828]
实施例六十lc
‑
ms测定bt001046分子量
[0829]
采用与实施例五十五类似的方法,结果如图30和31所示。
[0830]
tl055与抗体偶联后得到的bt001046轻链、重链理论分子量及实测分子量(以主要糖型g0f计算)见下表:
[0831][0832][0833]
由图30和31可知,bt001046中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为33.8%,66.2%)、重链偶联0~3个细胞生物活性分子(dar0,dar1,dar2,dar3比例分别为21.9%,6.1%,9.6%,62.3%),由此计算抗体与细胞生物活性分子的偶联比(dar)为5.6。
[0834]
实施例六十一lc
‑
ms测定bt001047分子量
[0835]
采用与实施例五十五类似的方法,结果如图32和33所示。
[0836]
tl056与抗体偶联后得到的bt001047轻链、重链理论分子量及实测分子量(以主要
糖型g0f计算)见下表:
[0837][0838]
由图32和33可知,bt001047中抗体轻链偶联0~1个细胞生物活性分子(lc,dar1比例分别为13.7%,86.3%)、重链偶联1~3个细胞生物活性分子(dar1,dar2,dar3比例分别为22.2%,13.5%,64.3%),由此计算抗体与细胞生物活性分子的偶联比(dar)为6.6。
[0839]
实施例六十二体积排阻色谱分析
[0840]
通过sec
‑
hplc监测偶联反应,对偶联物进行sec检测。
[0841]
色谱条件:
[0842]
液相色谱柱:tosoh tskgel supersw mab,4μm,7.8mm x 300mm;
[0843]
流动相:100mmol/l na2hpo4,100mmol/l nacl,5%异丙醇,ph7.0;
[0844]
流速:0.5ml/min;检测波长:280nm;柱温:室温;样品室温度:8℃;
[0845]
进样量:30μg;等度运行:30min。
[0846]
抗体与tl003与抗体偶联得到的bt001002的sec色谱图和分子量marker sec色谱图分别如图7和8所示,根据分子量marker分子量标记,确认偶联产物主峰对应分子量约为150kd,即抗体与tl003与抗体偶联得到的bt001002,轻重链未分离,抗体仍然保持整体结构。
[0847]
tl019与抗体偶联得到的bt001004的sec色谱图如图9所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl019与抗体偶联得到的bt001004,仍然保持抗体的完整结构。
[0848]
tl024与抗体偶联得到的bt001012的sec色谱图如图34所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl024与抗体偶联得到的bt001012,仍然保持抗体的完整结构。
[0849]
tl048与抗体偶联得到的bt001013的sec色谱图如图35所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl048与抗体偶联得到的bt001013,仍然保持抗体的完整结构。
[0850]
tl030与抗体偶联得到的bt001018的sec色谱图如图36所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl030与抗体偶联得到的bt001018,仍然保持抗体的完整结构。
[0851]
tl033与抗体偶联得到的bt001021的sec色谱图如图37所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl033与抗体偶联得到的bt001021,仍
然保持抗体的完整结构。
[0852]
tl035与抗体偶联得到的bt001023的sec色谱图如图38所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl035与抗体偶联得到的bt001023,仍然保持抗体的完整结构。
[0853]
tl051与抗体偶联得到的bt001042的sec色谱图如图39所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl051与抗体偶联得到的bt001042,仍然保持抗体的完整结构。
[0854]
tl052与抗体偶联得到的bt001043的sec色谱图如图40所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl052与抗体偶联得到的bt001043,仍然保持抗体的完整结构。
[0855]
tl053与抗体偶联得到的bt001044的sec色谱图如图41所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl053与抗体偶联得到的bt001044,仍然保持抗体的完整结构。
[0856]
tl055与抗体偶联得到的bt001046的sec色谱图如图42所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl055与抗体偶联得到的bt001046,仍然保持抗体的完整结构。
[0857]
tl056与抗体偶联得到的bt001047的sec色谱图如图43所示,根据sec保留时间及峰面积比例,确认主要偶联产物分子量约为150kd,即tl056与抗体偶联得到的bt001047,仍然保持抗体的完整结构。
[0858]
实施例六十三检测生物活性分子及抗体药物偶联物对体外细胞活性的抑制作用
[0859]
首先培养肿瘤细胞mda
‑
mb
‑
468(trop
‑
2阳性细胞系)和hcc1806(trop
‑
2阳性细胞系);将本公开的生物活性分子及adc分子与肿瘤细胞进行共培养,然后添加cck8试剂(东仁化学科技有限公司,cat:ck04,lot:jj744),用酶标仪(厂家:molecular devices,型号:spectramax m2)读数(检测波长为450nm),检测线粒体内的脱氢酶的活性,以评价adc对细胞增殖的抑制作用。肿瘤细胞来源见表1。
[0860]
表1.
[0861]
细胞名称肿瘤类型来源mda
‑
mb
‑
468乳腺癌康诺泰hcc1806乳腺癌南京科佰生物
[0862]
体外细胞活性检测:用对应检测培养基(含2%fbs)稀释生物活性分子或adc(12个浓度梯度)。使用胰酶通过常规方法对肿瘤细胞进行消化,收集细胞并计数,用对应的检测培养基(含2%fbs)重悬。将稀释的生物活性分子或adc加入96孔板中,再加入细胞。然后每孔加入cck8试剂20μl,反应至4小时,酶标仪读数(检测波长为450nm)。实验条件和检测结果如表2和表3所示。
[0863]
表2.生物活性分子细胞杀伤结果
[0864]
[0865][0866]
测试结果表明,生物活性分子均具有肿瘤细胞杀伤作用。
[0867]
表3.偶联物(adc)细胞系杀伤结果
[0868][0869]
测试结果表明,利用新偶联方法得到的adc分子具有肿瘤细胞杀伤作用。说明利用新的偶联方法形成的adc,可对肿瘤细胞产生杀伤作用,新的偶联方法应用于adc分子中是行之有效的。
[0870]
实施例六十四抗体药物偶联物和活性生物分子对体内药效测试
[0871]
受试药物
[0872]
药物名称、来源、配置方法:
[0873]
bt001021,液体浓度为5.44mg/ml,分装于
‑
20℃保存,使用时用生理盐水根据剂量稀释,得到测试溶液;
[0874]
immu
‑
132(参照wo2015/012904a2实施例2制备,dar=5.4,也可表述为immu
‑
132),液体浓度为13.158mg/ml,分装于
‑
20℃保存,使用时用生理盐水根据剂量稀释,得到测试溶液;
[0875]
t
‑
030,固体粉末,用100%dmso(sigma)配制成浓度为5.2mg/ml,分装于
‑
20℃保存,使用时用生理盐水根据剂量稀释,得到测试溶液;
[0876]
sn
‑
38(也可表述为sn38),固体粉末,用100%dmso(sigma)配制成浓度为3.23mg/ml,分装于
‑
20℃保存,使用时用生理盐水根据剂量稀释,得到测试溶液。
[0877]
备注:毒素给药剂量,根据adc样品等摩尔比配制。
[0878]
t
‑
030、sn
‑
38、immu
‑
132的结构如下:
[0879][0880]
实验动物及细胞系
[0881]
balb/c
‑
nu小鼠(北京维通利华实验动物技术有限公司,生产许可证号:scxk(京)2016
‑
0011);胃癌细胞株nci
‑
n87(atcc)、乳腺癌细胞株hcc1806(南京科佰)。
[0882]
实验分组及评价方法
[0883]
选择随机分组(根据样品数量决定分组数)的肿瘤体积在100~200mm3的荷瘤鼠,6只/组。给药体积为10ml/kg,给药途径为尾静脉注射,每周给药2次同时用游标卡尺测量肿瘤直径,并按如下计算公式计算肿瘤体积:v=0.5a
×
b2,其中a和b分别表示肿瘤的长径和短径。每天观察记录动物死亡情况。
[0884]
采用以下公式计算肿瘤生长抑制率tgi(%),用于评价抗体药物偶联物的抑瘤疗效:
[0885]
tgi(%)=[1
‑
(v
t末
‑
v
t始
)/(v
c末
‑
v
c始
)]*100%
[0886]
其中v
t末
:处理组实验结束时肿瘤体积均值
[0887]
v
t始
:处理组给药开始时肿瘤体积均值
[0888]
v
c末
:溶剂对照组实验结束时肿瘤体积均值
[0889]
v
c始
:溶剂对照组给药开始时肿瘤体积均值
[0890]
下述实验例1和2评价抗体偶联物bt001021对皮下移植人肿瘤细胞构建荷瘤鼠肿瘤增殖的抑制。具体而言,在本实验例1和2中,皮下移植人胃癌细胞株nci
‑
n87、人三阴性乳腺癌细胞株hcc1806构建荷瘤鼠模型,待肿瘤体积生长至100mm3左右,后随机分组,分组后静脉给予bt001021,每周给药2次,共6次。每周2次测定肿瘤体积和动物体重变化,评价抗体药物偶联物对荷瘤小鼠的药效(抑瘤疗效)。
[0891]
实验例1.抗体药物偶联物和活性生物分子对nci
‑
n87的抑制
[0892]
实验方法:
[0893]
用含10%胎牛血清的1640培养液,在37℃,5%co2的条件下培养nci
‑
n87细胞。收集指数生长期的nci
‑
n87细胞,pbs重悬至适合浓度,接种于雌性balb/c
‑
nu小鼠皮下建立胃癌模型。待肿瘤平均体积约90mm3时,根据肿瘤大小随机分组,分别为生理盐水组、bt001021(3mg/kg,静脉注射,每周给药两次
×
3周)、阳性药immu
‑
132(3mg/kg,静脉注射,每周给药两次
×
3周)组、t030组、sn38组,分组后尾静脉注射对应药物,每周给药2次,共6次。给药后观察并定期测量小鼠肿瘤体积及体重,具体结果见表4,图44和45。
[0894]
实验结论:
[0895]
本实验例采用人胃癌细胞株nci
‑
n87,构建人胃癌皮下移植瘤模型,评价了bt001021在nci
‑
n87人胃癌荷瘤鼠模型中的药效。
[0896]
由实验结果可知bt001021(3mg/kg,静脉注射,每周给药两次
×
3周),可以显著抑制nci
‑
n87胃癌移植瘤模型小鼠肿瘤生长,且给药终点出现肿瘤消退,抗肿瘤活性优于阳性immu
‑
132,所有治疗组在观察期内均无动物死亡及显著动物体重降低,表明bt001021没有明显毒性。
[0897]
表4.胃癌nci
‑
n87模型
[0898][0899]
实验例2.抗体药物偶联物对hcc1806的抑制
[0900]
实验方法:
[0901]
用含10%胎牛血清的1640培养液,在37℃,5%co2的条件下培养hcc1806细胞。收集指数生长期的hcc1806,pbs重悬至适合浓度,接种于雌性balb/c
‑
nu小鼠皮下建立乳腺癌模型。待肿瘤平均体积约130mm3时,根据肿瘤大小随机分组,分别为生理盐水组、bt001021(10mg/kg,静脉注射,每周给药两次
×
3周)、阳性药immu
‑
132(10mg/kg,静脉注射,每周给药两次
×
3周)组,分组后尾静脉注射对应药物,每周给药2次,共5次。给药后观察并定期测量小鼠肿瘤体积,具体结果见表5,图46。
[0902]
实验结论:
[0903]
本实验例采用的人乳腺癌细胞株hcc1806,构建人乳腺癌皮下移植瘤模型,评价了bt001021用药在hcc1806人乳腺癌荷瘤鼠模型中的药效。
[0904]
由实验结果可知bt001021(10mg/kg,静脉注射,每周给药两次
×
3周)显著抑制hcc1806乳腺癌移植瘤模型小鼠肿瘤生长,抗肿瘤活性优于阳性immu
‑
132。
[0905]
表5:乳腺癌hcc1806模型
[0906][0907][0908]
从表4、表5和图44
‑
46可以看出,本发明的抗体药物,bt001021在小鼠nci
‑
n87模型中,可以显著地抑制肿瘤生长,相同剂量下显著优于immu
‑
132,且无明显体重下降和无明显药物毒性。在小鼠hcc1806模型中,由于肿瘤恶性程度高,剂量提高到10mg/kg时,immu
‑
132并没有表现出明显的抑制活性,而bt001021可以显著地抑制肿瘤生长。以上结果表明本发明bt001021具有良好的药效和优良的安全性。
[0909]
在实验例1和2的皮下移植瘤模型中,相同剂量下bt001021的抗肿瘤活性显著优于immu
‑
132,推测bt001021具有治疗实体瘤的潜能,相比immu
‑
132在临床上bt001021有望使更多患者获益。
[0910]
实验例3.抗体药物偶联物对hcc827的抑制
[0911]
实施例3评价bt001021和bt001035对hcc827非小细胞肺癌皮下移植人肿瘤细胞构建荷瘤鼠模型增殖抑制的作用。具体而言,在本实验中,皮下移植人非小细胞肺癌细胞株hcc827构建荷瘤鼠模型,待肿瘤体积生长至100mm3左右后随机分组,分组后静脉给予bt001021和bt001035,每周给药2次,共6次,每周2次测量肿瘤体积和动物体重变化,计算bt001021和bt001035对荷瘤小鼠的药效(抑瘤疗效)。
[0912]
实验方法:
[0913]
用含10%胎牛血清的1640培养液,在37℃,5%co2的条件下培养hcc827细胞。收集指数生长期的hcc827细胞,pbs重悬至适合浓度,接种于雌性balb/c
‑
nu小鼠皮下建立肺癌移植瘤模型。待肿瘤平均体积约80mm3时,根据肿瘤大小随机分组,分为生理盐水组、阳性药immu
‑
132(10mg/kg,iv,biw
×
3w)组、bt001021(10mg/kg,iv,biw
×
3w)、bt001035(10mg/kg,iv,biw
×
3w)组,分组后尾静脉注射对应药物,每周给药2次,共6次。给药后观察并定期测量小鼠肿瘤体积及体重,具体结果见表6,图47a,图47b。
[0914]
实验结论:
[0915]
由实验结果可知bt001021、bt001035可以显著抑制hcc827非小细胞肺癌移植瘤模型小鼠肿瘤生长,且给药终点出现肿瘤消退,抗肿瘤活性优于阳性组immu
‑
132,所有治疗组在观察期内均无动物死亡及显著动物体重降低,没有表现出明显的药物毒性,治疗期间小鼠对各评价药物耐受性良好。
[0916]
表6.肺癌hcc827模型
[0917][0918]
从表6、图47a和图47b可以看出,bt001021和bt001035在评价周期内均有显著抑制肿瘤生长的活性,相同剂量下,其对肿瘤的抑制活性显著优于immu
‑
132。给药期间,各组动物无明显体重下降和明显的药物毒性,以上结果表明bt001021和bt001035具有优良的抗肿瘤活性。
[0919]
在该皮下移植瘤模型中,相同剂量下bt001021和bt001035的抗肿瘤活性均显著优于immu
‑
132,推测bt001021和bt001035具有治疗实体瘤的潜能,相比immu
‑
132在临床上bt001021和bt001035有望使更多患者获益。
[0920]
实验例4.抗体药物偶联物对nci
‑
n87的抑制
[0921]
实验例4评价抗体偶联物bt001036对皮下移植人肿瘤细胞构建荷瘤鼠肿瘤增殖的抑制。具体而言,在本实验中,皮下移植人胃癌细胞株nci
‑
n87构建荷瘤鼠模型,待肿瘤体积生长至140mm3左右,后随机分组,分组后静脉给予bt001036,每周给药2次,共6次。每周2次测定肿瘤体积和动物体重变化,评价抗体药物偶联物对荷瘤小鼠的药效(抑瘤疗效)。
[0922]
实验方法:
[0923]
用含10%胎牛血清的1640培养液,在37℃,5%co2的条件下培养nci
‑
n87细胞。收集指数生长期的nci
‑
n87细胞,pbs重悬至适合浓度,接种于雌性balb/c
‑
nu小鼠皮下建立胃癌移植瘤模型。待肿瘤平均体积约140mm3时,根据肿瘤大小随机分组,分为生理盐水组、bt001036(1.5mg/kg,iv,biw
×
3w)组、bt001036(3mg/kg,iv,biw
×
3w)组,分组后尾静脉注射对应药物,每周给药2次,共6次。给药后观察并定期测量小鼠肿瘤体积及体重,具体结果见表7,图48a,图48b。
[0924]
表7.胃癌nci
‑
n87模型
[0925][0926]
实验结论:
[0927]
本实验例采用皮下移植人胃癌细胞株nci
‑
n87,构建人胃癌皮下移植瘤模型,评价bt001036用药在nci
‑
n87人胃癌荷瘤鼠模型中的药效。
[0928]
由实验结果可知bt001036高低剂量(1.5mg/kg,3mg/kg)均可以显著抑制nci
‑
n87胃癌移植瘤模型小鼠肿瘤生长,且给药终点出现肿瘤消退,抗肿瘤活性优显著,所有治疗组
在观察期内均无动物死亡及显著动物体重降低,没有表现出明显的药物毒性,治疗期间小鼠对各评价药物耐受性良好。
[0929]
实验例5.抗体药物偶联物对mda
‑
mb
‑
231的抑制
[0930]
实验例5评价bt001021对mda
‑
mb
‑
231乳腺癌皮下移植人肿瘤细胞构建荷瘤鼠模型增殖抑制的作用。具体而言,在本实验中,皮下移植人乳腺癌细胞株mda
‑
mb
‑
231构建荷瘤鼠模型,待肿瘤体积生长至130mm3左右后随机分组,分组后静脉给予bt001021,每周给药2次,共6次,同时测量肿瘤体积和动物体重变化,计算bt001021对荷瘤小鼠的药效(抑瘤疗效)。
[0931]
实验方法:
[0932]
用含10%胎牛血清的rpmi1640培养液,在37℃,5%co2的条件下培养nci
‑
mda
‑
mb
‑
231细胞。收集指数生长期的mda
‑
mb
‑
231细胞,pbs重悬至适合浓度,接种于雌性balb/c
‑
nu小鼠皮下建立乳腺癌移植瘤模型。待肿瘤平均体积约130mm3时,根据肿瘤大小随机分组,分为生理盐水组、bt001021(3mg/kg)组,分组后尾静脉注射对应药物,每周给药2次,共6次。给药后观察并定期测量小鼠肿瘤体积及体重,具体结果见表8,图49a和49b。
[0933]
实验结论:
[0934]
由实验结果可知bt001021可以显著抑制mda
‑
mb
‑
231乳腺癌移植瘤模型小鼠肿瘤生长,且给药终点出现肿瘤消退,所有治疗组在观察期内均无动物死亡及显著动物体重降低,没有表现出明显的药物毒性,治疗期间小鼠对各评价药物耐受性良好。
[0935]
表8.乳腺癌mda
‑
mb
‑
231模型
[0936][0937]
在皮下移植瘤模型中,bt001021抗肿瘤活性显著,所有治疗组在观察期内均无动物死亡及显著动物体重降低,没有表现出明显的药物毒性,治疗期间小鼠对各评价药物耐受性良好。
[0938]
实施例六十五抗体药物偶联物和活性生物分子对体内药代测试
[0939]
实验例6评价抗体药物偶联物和活性生物分子的体内药代。具体而言,在本实验中,皮下移植人胃癌细胞株nci
‑
n87至balb/c
‑
nu小鼠构建荷瘤鼠模型,待肿瘤体积生长至100
‑
200mm3,后随机分组,分组后单次静脉给予bt001021和t
‑
030。测定肿瘤组织和血清中t
‑
030浓度,评价抗体偶联药物bt001021和活性生物分子t
‑
030对荷瘤小鼠的体内药代行为。
[0940]
受试药物
[0941]
药物名称、配置方法:
[0942]
bt001021,液体浓度为20mg/ml,分装于
‑
20℃保存,使用时用生理盐水根据剂量稀释,得到测试溶液;
[0943]
t
‑
030用二甲基亚砜配制成1mg/ml,用生理盐水根据剂量稀释,得到测试溶液。
[0944]
实验动物及细胞系:
[0945]
balb/c
‑
nu小鼠(北京维通利华实验动物技术有限公司,生产许可证号:scxk(京)
2016
‑
0011);胃癌细胞株nci
‑
n87(atcc)。
[0946]
实验分组及评价方法:
[0947]
选择随机分组(根据样品数量决定分组数)的肿瘤体积在100~200mm3的荷瘤鼠,4只/组,给药途径为尾静脉注射单次给药。
[0948]
实验例6.bt001021和t
‑
030对荷瘤小鼠体的体内药代测试
[0949]
实验方法:
[0950]
用含10%热灭活胎牛血清的1640培养液,在37℃,5%co2的条件下培养nci
‑
n87细胞。收集指数生长期的nci
‑
n87细胞,pbs重悬至适合浓度,接种于balb/c
‑
nu小鼠皮下建立胃癌移植瘤模型。待肿瘤平均体积约100
‑
200mm3时,根据肿瘤大小随机分组,分为生理盐水组、t
‑
030(0.23mg/kg,静脉注射,单次给药)组、bt001021(10mg/kg,静脉注射,单次给药)组,分组后尾静脉注射对应药物。t
‑
030组于给药后1h、2h、4h、8h、24h和72h采集血清和肿瘤组织(给药后72h,血清和肿瘤组织中均已检测不到t
‑
030,因此未在给药后168h采集血清及肿瘤组织),bt001021组于给药后1h、2h、4h、8h、24h、72h和168h采集血清和肿瘤组织,用lc
‑
ms/ms方法检测血清和肿瘤中t
‑
030浓度,具体结果见表9。t
‑
030给药剂量(0.23mg/kg)根据bt001021给药剂量(10mg/kg)等摩尔换算。
[0951]
表9.荷瘤小鼠静脉给予t
‑
030和bt001021后肿瘤及血清中t
‑
030药动学参数
[0952][0953]
实验结论:
[0954]
bt001021(10mg/kg)给药组在肿瘤和血清中的auc
last
分别为850.1h*ng/ml和174.97h*ng/ml,t
‑
030给药组在肿瘤和血清中的auc
last
分别为3.85h*ng/ml和5.58h*ng/ml,三者对比可知,bt001021给药组中t
‑
030的暴露量较t
‑
030给药组中t
‑
030的暴露量显著增加。并且,bt001021给药组肿瘤中活性生物分子t
‑
030暴露量显著高于血清中暴露量,t
‑
030给药组活性生物分子在血清和肿瘤中暴露量基本一致,表明抗体药物偶联物(bt001021)具有较强肿瘤组织靶向性。
[0955]
bt001021(10mg/kg)给药组在肿瘤和血清中活性生物分子t
‑
030的c
max
分别为7.82ng/ml和11.7ng/ml,t
‑
030给药组在肿瘤和血清中活性生物分子t
‑
030的c
max
分别为1.20ng/ml和1.81ng/ml,表明抗体药物偶联物(bt001021)在肿瘤组织和血清中具有更高的活性生物分子(t
‑
030)浓度。
[0956]
bt001021(10mg/kg)给药组在肿瘤中活性生物分子t
‑
030的t
1/2
为93.14h,t
‑
030给药组在肿瘤中活性生物分子t
‑
030的t
1/2
为2.55h。表明抗体药物偶联物(bt001021)在肿瘤组织中具有更长的半衰期。
[0957]
综上,bt001021与对应的活性生物分子(t
‑
030)相比,具有显著的肿瘤组织靶向性和良好的药代动力学性质。
[0958]
实验例7.抗体药物偶联物bt001021和immu
‑
132的体内药代测试。
[0959]
在本实验中,皮下移植人胃癌细胞株nci
‑
n87至balb/c
‑
nu小鼠构建荷瘤鼠模型,待肿瘤体积生长至100
‑
200mm3,后随机分组,分组后单次静脉给予bt001021和immu
‑
132。测定肿瘤组织和血清中bt001021和immu
‑
132分别对应的活性生物分子t
‑
030及sn
‑
38浓度,评价抗体偶联药物bt001021和immu
‑
132对荷瘤小鼠的体内药代行为。
[0960]
受试药物
[0961]
药物名称、配置方法:
[0962]
bt001021,液体浓度为20mg/ml,分装于
‑
20℃保存,使用时用生理盐水根据剂量稀释,得到测试溶液;
[0963]
immu
‑
132,用生理盐水根据剂量稀释,得到测试溶液。
[0964]
实验动物及细胞系:
[0965]
balb/c
‑
nu小鼠(北京维通利华实验动物技术有限公司,生产许可证号:scxk(京)2016
‑
0011);胃癌细胞株nci
‑
n87(atcc)。
[0966]
实验分组及评价方法:
[0967]
选择随机分组(根据样品数量决定分组数)的肿瘤体积在100~200mm3的荷瘤鼠,4只/组,给药途径为尾静脉注射单次给药。
[0968]
实验方法:
[0969]
用含10%热灭活胎牛血清的1640培养液,在37℃,5%co2的条件下培养nci
‑
n87细胞。收集指数生长期的nci
‑
n87细胞,pbs重悬至适合浓度,接种于balb/c
‑
nu小鼠皮下建立胃癌移植瘤模型。待肿瘤平均体积约100
‑
200mm3时,根据肿瘤大小随机分组,分为bt001021(5mg/kg,静脉注射,单次给药)组和immu
‑
132(5mg/kg,静脉注射,单次给药)组,分组后尾静脉注射对应药物,分别于给药后2h、24h、48h和72h采集血清和肿瘤组织,用lc
‑
ms/ms方法检测血清和肿瘤中t
‑
030或sn
‑
38浓度。
[0970]
表10.荷瘤小鼠静脉给予bt001021和immu
‑
132后肿瘤及血清中t
‑
030和sn
‑
38药动学参数
[0971][0972]
实验结论:
[0973]
bt001021给药组毒素小分子在肿瘤和血清中的auc
last
分别为427.2h*ng/ml和115.3h*ng/ml,immu
‑
132给药组毒素小分子在肿瘤和血清中的auc
last
分别为116.8h*ng/ml和422.7h*ng/ml。bt001021给药组毒素小分子在肿瘤中的c
max
为6.8ng/ml,immu
‑
132给药组毒素小分子在肿瘤中的c
max
别2.8ng/ml。上述结果表明,与immu
‑
132相比,bt001021具有更好的肿瘤组织靶向性和更好的药代性质,具有更好的治疗窗口。
[0974]
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公布的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部分为由所附权利要求及其任何等同物给出。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。