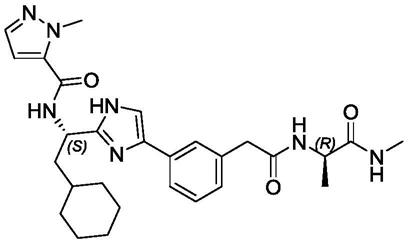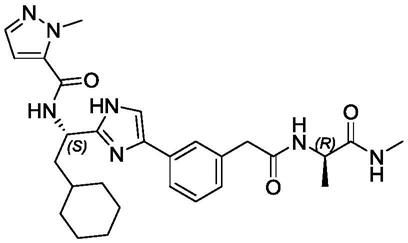
1.本发明涉及一种免疫调节剂及其在制备药物中的用途。
背景技术:
2.il
‑
17(白细胞介素
‑
17)是促炎性细胞因子,在诱导其他炎性细胞因子、趋化因子和粘附因子中发挥作用。il
‑
17家族由参与急性和慢性炎症反应的细胞因子组成,包括il
‑
17a(ctla
‑
8)、il
‑
17b、il
‑
17c、il
‑
17d、il
‑
17e(il
‑
25)和il
‑
17f。il
‑
17a由th17细胞表达,其参与炎症和自身免疫性疾病的病理发生。人类il
‑
17a是分子量约为17000道尔顿的糖蛋白。il
‑
17a通过il
‑
17受体复合物(il
‑
17ra和il
‑
17rc)将信号传送至细胞内(wright,et al.journal of immunology,2008,181:2799
‑
2805)。il
‑
17a的主要功能是通过促炎和嗜中性粒细胞迁移细胞因子和趋化因子(包括il
‑
6,g
‑
csf,tnf
‑
α,il
‑
1,cxcl1,ccl2,cxcl2)的上调来协调局部组织炎症,以及基质金属蛋白酶来允许活化的t细胞穿透细胞外基质。有研究表明il
‑
17a在严重哮喘和慢性阻塞性肺疾病(copd)中发挥重要作用,那些患者通常对目前可用的药物无响应或响应不良(al
‑
ramli et al.j allergy clin immunol,2009,123:1185
‑
1187)。il
‑
17a水平上调涉及许多疾病,包括类风湿性关节炎(ra)、骨侵蚀、腹膜内脓肿、炎性肠病、同种异体移植物排斥反应、牛皮癣、动脉粥样硬化、哮喘和多发性硬化症(gaffen,sl et al.arthritis research&therapy,2004,6:240
‑
247)。
3.靶向il
‑
17a与il
‑
17ra的结合是治疗il
‑
17a介导的自身免疫性炎性疾病的有效策略。通过il
‑
17a中和抗体治疗动物在自身免疫性脑脊髓炎中降低疾病发病率和严重性(komiyama y et al.j.immunol.,2006,177:566
‑
573)。已有il
‑
17a抗体的临床试验在il
‑
7a介导的炎性疾病(包括哮喘、牛皮癣、类风湿性关节炎、强直性脊柱炎和多发性硬化症)上显示出良好的结果。il
‑
17a抗体(novartis的cosentyx/secukinumab)在2015年1月已被fda批准用于牛皮癣的治疗。
4.尽管存在多种il
‑
17a抗体,但很少有对具有口服生物利用度的il
‑
17的小分子特异性抑制剂进行研究。鉴于产生抗体的成本考虑和给药途径的限制,开发il
‑
17a小分子抑制剂药物具有良好的研发前景。
技术实现要素:
5.本发明提供了式i所示的化合物、或其立体异构体、或其药学上可接受的盐:
6.7.其中,
8.r1选自
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环)、
‑
c
0~2
亚烷基
‑
c(o)r
11
、
‑
c
0~2
亚烷基
‑
c(o)nr
11
r
12
、
‑
c
0~2
亚烷基
‑
c(o)or
11
、
‑
c
0~2
亚烷基
‑
s(o)r
11
、
‑
c
0~2
亚烷基
‑
s(o)nr
11
r
12
、
‑
c
0~2
亚烷基
‑
s(o)or
11
、
‑
c
0~2
亚烷基
‑
s(o)2r
11
、
‑
c
0~2
亚烷基
‑
s(o)2nr
11
r
12
、
‑
c
0~2
亚烷基
‑
s(o)2or
11
、
‑
c
0~2
亚烷基
‑
p(o)r
11
r
12
、
‑
c
0~2
亚烷基
‑
p(o)(or
11
)r
12
、
‑
c
0~2
亚烷基
‑
p(o)(or
11
)(or
12
);其中亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
9.r
11
、r
12
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
10.每个r
1a
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
11.r2选自氢、
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基);
12.r3选自
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~12元螺环)、
‑
c
0~2
亚烷基
‑
(5~12元螺杂环)、
‑
c
0~2
亚烷基
‑
(5~12元桥环)、
‑
c
0~2
亚烷基
‑
(5~12元桥杂环)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);其中亚烷基可进一步被一个或两个r
31
取代;其中环烷基、杂环烷基、螺环、螺杂环、桥环、桥杂环、芳环、芳杂环可进一步被一个、两个或三个r
3a
取代;
13.每个r
31
分别独立选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);或者,当两个r
31
连接在同一个原子时,两个r
31
可以相连形成3~10元环烷基、3~10元杂环烷基;其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
3a
取代;
14.每个r
3a
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
15.x选自n或cr
x
;r
x
选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
16.r5选自氢、
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基);
17.z选自c
2~4
亚烯基、c
2~4
亚炔基、3~10元环烷烃、3~10元杂环烷烃、5~10元芳环、5~10元芳杂环;其中亚烯基、亚炔基、环烷烃、杂环烷烃、芳环、芳杂环可进一步被一个、两个或三个r
z
取代;
18.每个r
z
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
or
z1
、
‑
nr
z1
r
z2
、3~10元环烷基、3~10元杂环烷基、5~10元芳环、5~10元芳杂环、5~12元螺环、5~12元螺杂环;其中环烷基、杂环烷基、芳环、芳杂环、螺环、螺杂环可进一步被一个、两个或三个r
za
取代;
19.r
z1
、r
z2
分别独立选自氢、c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基);
20.每个r
za
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
21.r4选自
‑
c
0~2
亚烷基
‑
c(o)r
42
、
‑
c
0~2
亚烷基
‑
c(o)nr
42
r
43
、
‑
c
0~2
亚烷基
‑
nr
42
c(o)r
43
、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);其中亚烷基可进一步被一个或两个r
41
取代;其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
44
取代;
22.每个r
41
分别独立选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
or
4b
、
‑
c
0~2
亚烷基
‑
nr
4b
r
4c
、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);或者,当两个r
41
连接在同一个原子时,两个r
41
可以相连形成3~10元环烷基、3~10元杂环烷基;其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
4a
取代;
23.r
4b
、r
4c
分别独立选自氢、c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基);
24.r
42
、r
43
分别独自选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
c(o)r
46
、
‑
c
0~2
亚烷基
‑
c(o)nr
46
r
47
、
‑
c
0~2
亚烷基
‑
or
46
、
‑
c
0~2
亚烷基
‑
nr
46
r
47
、
‑
c
0~2
亚烷基
‑
nr
46
c(o)r
47
、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
45
取代;
25.每个r
44
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);
26.每个r
45
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
or
48
、
‑
c
0~2
亚烷基
‑
c(o)r
48
、
‑
c
0~2
亚烷基
‑
c(o)nr
48
r
49
、
‑
c
0~2
亚烷基
‑
nr
48
r
49
、
‑
c
0~2
亚烷基
‑
nr
48
c(o)r
49
、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环);其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
4a
取代;
27.r
46
、r
47
、r
48
、r
49
分别独自选自氢、c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基);
28.每个r
4a
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
(3~10元环烷基)、
‑
c
0~2
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~10元芳环)、
‑
c
0~2
亚烷基
‑
(5~10元芳杂环)。
29.进一步地,
30.r1选自
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环)、
‑
c
0~1
亚烷基
‑
c(o)r
11
、
‑
c
0~1
亚烷基
‑
c(o)nr
11
r
12
、
‑
c
0~1
亚烷基
‑
c(o)or
11
、
‑
c
0~1
亚烷基
‑
s(o)r
11
、
‑
c
0~1
亚烷基
‑
s(o)nr
11
r
12
、
‑
c
0~1
亚烷基
‑
s(o)or
11
、
‑
c
0~1
亚烷基
‑
s(o)2r
11
、
‑
c
0~1
亚烷基
‑
s(o)2nr
11
r
12
、
‑
c
0~1
亚烷基
‑
s(o)2or
11
;其中亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
31.r
11
、r
12
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环);其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
32.每个r
1a
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
33.r2选自氢、
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基);
34.r3选自
‑
c
0~1
亚烷基
‑
(3~10元环烷基)、
‑
c
0~1
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~12元螺环)、
‑
c
0~1
亚烷基
‑
(5~12元螺杂环)、
‑
c
0~1
亚烷基
‑
(5~12元桥环)、
‑
c
0~1
亚烷基
‑
(5~12元桥杂环)、
‑
c
0~1
亚烷基
‑
(5~10元芳环)、
‑
c
0~1
亚烷基
‑
(5~10元芳杂环);其中亚烷基可进一步被一个或两个r
31
取代;其中环烷基、杂环烷基、螺环、螺杂环、桥环、桥杂环、芳环、芳杂环可进一步被一个、两个或三个r
3a
取代;
35.每个r
31
分别独立选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~10元环烷基)、
‑
c
0~1
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~10元芳环)、
‑
c
0~1
亚烷基
‑
(5~10元芳杂环);或者,当两个r
31
连接在同一个原子时,两个r
31
可以相连形成3~6元环烷基、3~6元杂环烷基;其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
3a
取代;
36.每个r
3a
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
37.x选自n或cr
x
;r
x
选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
38.r5选自氢、
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基);
39.z选自亚乙烯基、亚乙炔基、3~10元环烷烃、3~10元杂环烷烃、5~10元芳环、5~10元芳杂环;其中亚烯基、亚炔基、环烷烃、杂环烷烃、芳环、芳杂环可进一步被一个、两个或三个r
z
取代;
40.每个r
z
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
or
z1
、
‑
nr
z1
r
z2
、3~6元环烷基、3~6元杂环烷基、5~6元芳环、5~6元芳杂环;其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
za
取代;
41.r
z1
、r
z2
分别独立选自氢、c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基);
42.每个r
za
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
43.r4选自
‑
c
0~1
亚烷基
‑
c(o)r
42
、
‑
c
0~1
亚烷基
‑
c(o)nr
42
r
43
、
‑
c
0~1
亚烷基
‑
nr
42
c(o)r
43
、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环);其中亚烷基可进一步被一个或两个r
41
取代;其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
44
取代;
44.每个r
41
分别独立选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
or
4b
、
‑
c
0~2
亚烷基
‑
nr
4b
r
4c
、
‑
c
0~2
亚烷基
‑
(3~6元环烷基)、
‑
c
0~2
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~6元芳环)、
‑
c
0~2
亚烷基
‑
(5~6元芳杂环);或者,当两个r
41
连接在同一个原子时,两个r
41
可以相连形成3~7元环烷基、3~7元杂环烷基;其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
4a
取代;
45.r
4b
、r
4c
分别独立选自氢、c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基);
46.r
42
、r
43
分别独自选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
c(o)r
46
、
‑
c
0~2
亚烷基
‑
c(o)nr
46
r
47
、
‑
c
0~2
亚烷基
‑
or
46
、
‑
c
0~2
亚烷基
‑
nr
46
r
47
、
‑
c
0~2
亚烷基
‑
nr
46
c(o)r
47
、
‑
c
0~2
亚烷基
‑
(3~6元环烷基)、
‑
c
0~2
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~6元芳环)、
‑
c
0~2
亚烷基
‑
(5~6元芳杂环);其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可
进一步被一个、两个或三个r
45
取代;
47.每个r
44
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环);
48.每个r
45
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
or
48
、
‑
c
0~2
亚烷基
‑
c(o)r
48
、
‑
c
0~2
亚烷基
‑
c(o)nr
48
r
49
、
‑
c
0~2
亚烷基
‑
nr
48
r
49
、
‑
c
0~2
亚烷基
‑
nr
48
c(o)r
49
、
‑
c
0~2
亚烷基
‑
(3~6元环烷基)、
‑
c
0~2
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~6元芳环)、
‑
c
0~2
亚烷基
‑
(5~6元芳杂环);其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
4a
取代;
49.r
46
、r
47
、r
48
、r
49
分别独自选自氢、c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基);
50.每个r
4a
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环)。
51.更进一步地,
52.r1选自
‑
c
0~1
亚烷基
‑
(5~6元芳杂环)、
‑
c
0~1
亚烷基
‑
c(o)r
11
、
‑
c
0~1
亚烷基
‑
c(o)nr
11
r
12
、
‑
c
0~1
亚烷基
‑
c(o)or
11
、
‑
c
0~1
亚烷基
‑
s(o)2r
11
;其中亚烷基、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
53.r
11
、r
12
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环);其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
54.每个r
1a
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
55.进一步具体地,
56.r1选自
‑
c
0~1
亚烷基
‑
5元芳杂环、
‑
c
0~1
亚烷基
‑
c(o)r
11
、
‑
c
0~1
亚烷基
‑
c(o)nr
11
r
12
、
‑
c
0~1
亚烷基
‑
c(o)or
11
、
‑
c
0~1
亚烷基
‑
s(o)2r
11
;其中亚烷基、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
57.r
11
、r
12
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环);其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个独立的r
1a
取代;
58.每个r
1a
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基)。
59.在本发明的一些具体实施方案中,所述r1选自
60.更进一步地,
61.r3选自
‑
c
0~1
亚烷基
‑
(3~10元环烷基)、
‑
c
0~1
亚烷基
‑
(3~10元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~12元螺环)、
‑
c
0~1
亚烷基
‑
(5~12元螺杂环)、
‑
c
0~1
亚烷基
‑
(5~12元桥环)、
‑
c
0~1
亚烷基
‑
(5~12元桥杂环)、
‑
c
0~1
亚烷基
‑
(5~10元芳环)、
‑
c
0~1
亚烷基
‑
(5~10元芳杂环);其中亚烷基可进一步被一个或两个r
31
取代;其中环烷基、杂环烷基、螺环、螺杂环、桥环、桥杂环、芳环、芳杂环可进一步被一个、两个或三个r
3a
取代;
62.每个r
31
分别独立选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、3~6元环烷基、3~6元杂环烷基、5~6元芳环、5~6元芳杂环;或者,当两个r
31
连接在同一个原子时,两个r
31
可以相连形成3~6元环烷基、3~6元杂环烷基;其中烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
3a
取代;
63.每个r
3a
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基);
64.在本发明的一些具体实施方案中,所述r3选自
65.更进一步地,
66.z选自亚乙烯基、5~10元环烷烃、5~10元杂环烷烃、5~10元芳环、5~10元芳杂环;其中亚乙烯基、环烷烃、杂环烷烃、芳环、芳杂环可进一步被一个、两个或三个r
z
取代;
67.每个r
z
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
or
z1
、
‑
nr
z1
r
z2
、3~6元环烷基、3~6元杂环烷基、5~6元芳环、5~6元芳杂环;其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
za
取代;
68.r
z1
、r
z2
分别独立选自氢、c
1~6
烷基;
69.每个r
za
分别独立选自氢、c
1~6
烷基、卤素取代的c
1~6
烷基、卤素、氰基、羰基、硝基、
‑
oh、
‑
o(c
1~6
烷基)、
‑
nh2、
‑
nh(c
1~6
烷基)、
‑
n(c
1~6
烷基)(c
1~6
烷基)。
70.在本发明的一些具体实施方案中,所述z选自在本发明的一些具体实施方案中,所述z选自在本发明的一些具体实施方案中,所述z选自
71.所述r
z
选自氢、c
1~6
烷基、
72.更进一步地,
73.r4选自
‑
c
0~1
亚烷基
‑
c(o)r
42
、
‑
c
0~1
亚烷基
‑
c(o)nr
42
r
43
、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环);其中亚烷基可进一步被一个或两个r
41
取代;其中芳杂环可进一步被一个、两个或三个r
44
取代;
74.每个r
41
分别独立选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
or
4b
、
‑
c
0~2
亚烷基
‑
(3~6元环烷基)、
‑
c
0~2
亚烷基
‑
(3~6元杂环烷基);或者,当两个r
41
连接在同一个原子时,两个r
41
可以相连形成3~6元环烷基、3~6元杂环烷基;其中环烷基、杂环烷基可进一步被一个、两个或三个r
4a
取代;
75.r
4b
选自氢、c
1~6
烷基;
76.r
42
、r
43
分别独自选自氢、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
c(o)r
46
、
‑
c
0~2
亚烷基
‑
c(o)nr
46
r
47
、
‑
c
0~2
亚烷基
‑
or
46
、
‑
c
0~2
亚烷基
‑
nr
46
r
47
、
‑
c
0~2
亚烷基
‑
nr
46
c(o)r
47
、
‑
c
0~2
亚烷基
‑
(3~6元环烷基)、
‑
c
0~2
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~6元芳环)、
‑
c
0~2
亚烷基
‑
(5~6元芳杂环);其中烷基、亚烷基、环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
45
取代;
77.每个r
44
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基);
78.每个r
45
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~2
亚烷基
‑
or
48
、
‑
c
0~2
亚烷基
‑
c(o)r
48
、
‑
c
0~2
亚烷基
‑
c(o)nr
48
r
49
、
‑
c
0~2
亚烷基
‑
nr
48
r
49
、
‑
c
0~2
亚烷基
‑
nr
48
c(o)r
49
、
‑
c
0~2
亚烷基
‑
(3~6元环烷基)、
‑
c
0~2
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~2
亚烷基
‑
(5~6元芳环)、
‑
c
0~2
亚烷基
‑
(5~6元芳杂环);其中环烷基、杂环烷基、芳环、芳杂环可进一步被一个、两个或三个r
4a
取代;
79.r
46
、r
47
、r
48
、r
49
分别独自选自氢、c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基);
80.每个r
4a
分别独自选自氢、卤素、氰基、羰基、硝基、
‑
c
1~6
烷基、卤素取代的
‑
c
1~6
烷基、
‑
c
0~1
亚烷基
‑
(3~6元环烷基)、
‑
c
0~1
亚烷基
‑
(3~6元杂环烷基)、
‑
c
0~1
亚烷基
‑
(5~6元芳环)、
‑
c
0~1
亚烷基
‑
(5~6元芳杂环)。
81.进一步具体地,r4选自选自
82.在本发明的一些具体实施方案中,r
42
选自氢、
‑
c
1~6
烷基;r
43
选自
甲基、乙基、正丙基、异丙基、环丙基。
83.在本发明的一些具体实施方案中,r
44
选自
84.在本发明的一些优选实施方案中,式i所述化合物具体为:
85.86.87.88.[0089][0090]
本发明还提供了前述化合物、或其立体异构体、或其药学上可接受的盐在制备治疗il
‑
17a介导的疾病的药物中的用途。
[0091]
进一步地,所述il
‑
17a介导的疾病是与炎症、自身免疫性疾病、感染性疾病、癌症、癌前期综合征相关的疾病中的一种或几种。
[0092]
本发明还提供了一种药物组合物,它是以前述化合物、或其立体异构体、或其药学上可接受的盐,加上药学上可接受的辅料制备而成的制剂。
[0093]
本发明还提供了前述的化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物、或其前体药物、或其代谢产物在制备治疗il
‑
17a介导的疾病的药物中的用途。
[0094]
本发明所定义的il
‑
17a介导的疾病是il
‑
17a在该疾病的病理发生中起重要作用的疾病。il
‑
17a的主要功能是协调局部组织炎症,从而在各种疾病中起作用。il
‑
17a介导的
疾病包括炎症、自身免疫性疾病、感染性疾病、癌症、癌前期综合征相关的疾病中的一种或几种。。
[0095]“癌症”或“恶性肿瘤”是指以不受控制的细胞异常增殖为特征的多种疾病中的任何一种,受影响的细胞在局部或通过血流和淋巴系统扩散到其他部位的能力的身体(即转移)以及许多特征结构和/或分子特征中的任何一个。“癌细胞”是指经历多步骤肿瘤进展的早期,中期或晚期阶段的细胞。癌症包括肉瘤、乳腺癌、肺癌、脑癌、骨癌、肝癌、肾癌、结肠癌和前列腺癌。在一些实施方案中,式i的化合物用于治疗选自结肠癌、脑癌、乳腺癌、纤维肉瘤和鳞状细胞癌的癌症。在一些实施方案中,癌症选自黑素瘤、乳腺癌、结肠癌、肺癌和卵巢癌。在一些实施方案中,所治疗的癌症是转移性癌症。
[0096]
自身免疫性疾病是由身体对体内正常存在的物质和组织的免疫反应引起的。自身免疫疾病的例子包括心肌炎、狼疮性肾炎、原发性胆汁性肝硬化、牛皮癣、1型糖尿病、格雷夫氏病、腹腔疾病、克罗恩病、自身免疫性中性白细胞减少症、幼年型关节炎、类风湿性关节炎、纤维肌痛、吉兰巴利综合征、多发性硬化症和自身免疫性视网膜病变。本发明的一些实施方案涉及治疗自身免疫疾病如牛皮癣或多发性硬化症。
[0097]
炎症疾病包括以组织病理性炎症为特征的多种病症。炎性疾病的例子包括寻常性痤疮、哮喘、腹腔疾病、慢性前列腺炎、肾小球性肾炎、炎症性肠病、盆腔炎、再灌注损伤、类风湿性关节炎、结节病、血管炎、房尘螨引起的气道炎症和间质性膀胱炎。炎性疾病与自身免疫性疾病之间存在显著重叠。本发明的一些实施方案涉及炎性疾病哮喘的治疗。免疫系统通常涉及炎症性疾病,在过敏反应和一些肌病中都有表现,许多免疫系统疾病导致异常炎症。il
‑
17a介导的疾病也包括自身免疫性炎症性疾病。
[0098]
本发明中提供的化合物和衍生物可以根据iupac(国际纯粹与应用化学联合会)或cas(化学文摘服务社,columbus,oh)命名系统命名。
[0099]
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
[0100]“取代”是指分子中的氢原子被其它不同的原子或分子所替换。
[0101]
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀c
a~b
烷基表明任何含“a”至“b”个碳原子的烷基。因此,例如,“c
1~4
烷基”是指包含1~4个碳原子的烷基。
[0102]“烷基”是指具有指定数目的成员原子的饱和烃链。例如,c1~c6烷基是指具有1至6个成员原子,例如1至4个成员原子的烷基基团。烷基基团可以是直链或支链的。代表性的支链烷基基团具有一个、两个或三个支链。烷基基团可任选地被一个或多个如本文所定义的取代基取代。烷基包括甲基、乙基、丙基(正丙基和异丙基)、丁基(正丁基、异丁基和叔丁基)、戊基(正戊基、异戊基和新戊基)和己基。烷基基团也可以是其他基团的一部分,所述其他基团为例如c1~c6烷氧基。
[0103]“环烷基”是指具有3至14个碳原子且没有环杂原子且具有单个环或多个环(包括稠合、桥连和螺环体系)的饱和或部分饱和的环状基团。对于具有不含环杂原子的芳族和非芳族环的多环体系,当连接点位于非芳族碳原子时,适用术语“环烷基”(例如5,6,7,8,
‑
四氢化萘
‑5‑
基)。术语“环烷基”包括环烯基基团,诸如环己烯基。环烷基基团的实例包括例如,金刚烷基、环丙基、环丁基、环己基、环戊基、环辛基、环戊烯基和环己烯基。包括多双环
烷基环体系的环烷基基团的实例是双环己基、双环戊基、双环辛基等。下面例举并命名两种此类双环烷基多环结构:双环己基和双环己基。
[0104]“烯基”是指具有2至10个碳原子和在一些实施方案中2至6个碳原子或2至4个碳原子且具有至少1个乙烯基不饱和位点(>c=c<)的直链或支链烃基基团。例如,(ca
‑
cb)烯基是指具有a至b个碳原子的烯基基团并且意在包括例如乙烯基、丙烯基、异丙烯基、1,3
‑
丁二烯基等。
[0105]“炔基”是指含有至少一个三键的直链一价烃基或支链一价烃基。术语“炔基”还意在包括具有一个三键和一个双键的那些烃基基团。例如,(c2
‑
c6)炔基意在包括乙炔基、丙炔基等。
[0106]“卤素”为氟、氯、溴或碘。
[0107]“卤素烷基”指烷基中的氢原子可被一个或多个卤素原子取代。例如c
1~4
卤素烷基指氢原子被一个或多个卤素原子取代的包含1~4个碳原子的烷基。
[0108]“杂环”、“杂环烷基”指包含至少一个杂原子的饱和环或非芳香性的不饱和环;其中杂原子指氮原子、氧原子、硫原子;
[0109]“芳杂环”指包含至少一个杂原子的芳香性不饱和环;其中杂原子指氮原子、氧原子、硫原子;
[0110]“立体异构体”包括对映异构体和非对映异构体;
[0111]
术语“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
[0112]
术语“盐”和“可药用的盐”是指上述化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将上述化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。本发明中所述盐可以是化合物的盐酸盐、硫酸盐、枸橼酸盐、苯磺酸盐、氢溴酸盐、氢氟酸盐、磷酸盐、乙酸盐、丙酸盐、丁二酸盐、草酸盐、苹果酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐或三氟乙酸盐。
[0113]
在某些实施方式中,本发明的一种或多种化合物可以彼此联合使用。也可选择将本发明的化合物与任何其它的活性试剂结合使用,用于制备调控细胞功能或治疗疾病的药物或药物组合物。如果使用的是一组化合物,则可将这些化合物同时、分别或有序地对受试对象进行给药。
[0114]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0115]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0116]
化合物的结构是通过核磁共振(nmr)和质谱(ms)来确定的。nmr位移(δ)以10
‑
6(ppm)的单位给出。nmr的测定是用(bruker avanceiii 400和bruker avance 300)核磁仪,测定溶剂为氘代二甲基亚砜(dmso
‑
d6),氘代氯仿(cdcl3),氘代甲醇(cd3od),内标为四甲基硅烷(tms)。
[0117]
lc
‑
ms的测定使用岛津液质联用仪(shimadzu lc
‑
ms 2020(esi))。hplc的测定使用岛津高压液相色谱仪(shimadzu lc
‑
20a)。mplc(中压制备色谱)使用gilson gx
‑
281反相制备色谱仪。薄层层析硅胶板用烟台黄海hsgf254或青岛gf254硅胶板,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm。柱层析一般使用烟台黄海硅胶200~300目硅胶为载体。
[0118]
本发明的已知的起始原料可以采用或按照本领域已知的方法来合成,或可购买于安耐吉化学、成都科龙化工、韶远化学科技、百灵威科技等公司。
[0119]
实施例中无特殊说明,反应在氮气氛围下进行。实施例中无特殊说明,溶液是指水溶液。实施例中无特殊说明,反应的温度为室温。实施例中无特殊说明,m是摩尔每升。
[0120]
本发明中给出某些缩写的含义。tea或et3n:三乙胺;dipea:n,n
‑
二异丙基乙胺;hobt:1
‑
羟基苯并三唑;dcm:二氯甲烷;pe:石油醚;ea或etoac:乙酸乙酯;thf:四氢呋喃;dmf:n,n
‑
二甲基甲酰胺;nmp:n
‑
甲基吡咯烷酮;nmo:n
‑
甲基吗啉氧化物;meoh:甲醇;etoh:乙醇;dmso:二甲亚砜;tfa:三氟乙酸;nabh4:硼氢化钠;mscl:甲基磺酰氯;dibal:二异丁基氢化铝;nbs:n
‑
溴代丁二酰亚胺;ncs:n
‑
氯代丁二酰亚胺;cbzosu:苯甲氧羰酰琥珀酰亚胺;znet2:二乙基锌;pd/c:钯碳;diad:偶氮二甲酸二异丙酯;dead:偶氮二甲酸二乙酯;pph3:三苯基磷;(cocl)2:草酰氯;n
‑
buli:正丁基锂;ti(oet)4:钛酸乙酯;tmscn:三甲基氰硅烷;csf:氟化铯;mtbe:甲基叔丁基醚;h2o2:双氧水;(boc)2o:二碳酸二叔丁酯;semcl:2
‑
(三甲基硅烷基)乙氧甲基氯;nah:钠氢;ich2cl:氯碘甲烷;pbr3:三溴化磷;(ch2o)n:多聚甲醛;tfa.prnh:二异丙胺三氟乙酸盐;hatu:2
‑
(7
‑
偶氮苯并三氮唑)
‑
四甲基脲六氟磷酸酯;hoat:1
‑
羟基
‑7‑
偶氮苯并三氮唑;hbtu:苯并三氮唑
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐;cdi:n,n'
‑
羰基二咪唑;t3p:1
‑
丙基磷酸酐;pybop:1h
‑
苯并三唑
‑1‑
基氧三吡咯烷基六氟磷酸盐;dcc:二环己基碳二亚胺;edc或edci:1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐;fmoc
‑
osu:9
‑
芴甲基
‑
n
‑
琥珀酰亚胺基碳酸酯。
[0121]
中间体1的制备
[0122][0123]
步骤1中间体1
‑
1的制备
[0124][0125]
冰浴下,将boc
‑
l
‑
环己基丙氨酸(15g,55.28mmol)溶于dcm(200ml),依次加入hobt(9.71g,71.86mmol),edci(13.73g,71.86mmol),diea(35.65g,276.39mmol)和甲氧基甲基胺(5.06g,82.92mmol),随后反应于室温搅拌反应2小时,反应完毕,饱和氯化铵水溶液(200ml*3)洗涤,有机相无水硫酸钠干燥,过滤,减压浓缩,经硅胶柱层析分离纯化即可得到中间体1
‑
1(15g,47.71mmol,86.30%yield),ms m/z:259(m
‑
55)
。
[0126]
步骤2中间体1
‑
2的制备
[0127][0128]
冰浴下,将lialh4(1m thf,83.01ml)缓慢加至中间体1
‑
1(17.4g,55.34mmol)的thf(40ml)溶液中,加毕,反应于室温继续反应1小时,lc
‑
ms显示反应完毕,将反应液倾入结晶硫酸钠中,经硅藻土过滤,甲醇洗涤,滤液减压浓缩即可得到中间体1
‑
2的粗品,粗品不经纯化直接用于下一步反应。
[0129]
步骤3中间体1
‑
3的制备
[0130][0131]
冰浴下,将中间体1
‑
2的粗品(16g,62.66mmol)溶于甲醇中,依次加入氨水(100ml)和乙二醛(45.46g,313.29mmol),反应于室温搅拌反应10小时,lc
‑
ms跟踪反应完毕,反应液减压浓缩除去大部分有机溶剂,加入乙酸乙酯和水各100ml,搅拌片刻,分层,水层再经乙酸乙酯(2*100ml)萃取,合并有机相,饱和氯化钠洗涤,无水硫酸钠干燥,过滤,减压浓缩,粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯1:1),即可得到中间体1
‑
3(500mg,1.70mmol,2.72%yield),ms m/z:294(m 1)
。
[0132]
步骤4中间体1
‑
4的制备
[0133]
[0134]
室温下,将中间体1
‑
3溶于(480mg,1.64mmol)5ml二氯甲烷中,加入三乙胺(496.63mg,4.91mmol,684.54ul)和三苯基氯甲烷(592.89mg,2.13mmol),室温搅拌反应5小时,lc
‑
ms显示原料反应完毕,分别加入二氯甲烷和水20ml洗涤,水相经二氯甲烷(20ml*3)萃取,合并有机相,无水硫酸钠干燥,过滤,减压浓缩,粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯3:1)即可得到中间体1(700mg,1.31mmol,79.87%yield),ms m/z:536(m 1)
。
[0135]
步骤5中间体1的制备
[0136][0137]
室温下,向中间体1
‑
4的(520mg,970.66μmol)的dmf(10ml)溶液中加入碳酸钾(2.68g,19.41mmol)和nbs(1.73g,9.71mmol),室温搅拌反应5小时,lc
‑
ms监测反应完毕,反应减压浓缩除去大部分有机溶剂,加入二氯甲烷100ml,加入水洗涤(2*100ml),有机相饱和氯化钠洗涤后经无水硫酸钠干燥,过滤,减压浓缩,粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯3:1)即可得到中间体1(330mg,536.92μmol,55.32%yield),ms m/z:614、616(m 1)
。
[0138]
中间体z
‑
1的制备
[0139][0140]
步骤1,z
‑1‑
a的制备
[0141]
于1l三口瓶中加入boc
‑
l
‑
环己基甘氨酸(10g,38.86mmol),干燥四氢呋喃(195ml),室温搅拌下加入n
‑
甲基吗啉(4.32g,42.75mmol),冷却至
‑
10℃,滴加入氯甲酸异丁酯(5.84g,42.75mmol)。加毕,继续保温
‑
10℃搅拌反应30分钟。反应液过滤,少量四氢呋喃洗涤。滤液转入1l三口瓶中,降温至
‑
10℃,滴加入硼氢化钠(4.41g,116.58mmol)的冰水溶液(117ml)。滴毕,继续保温
‑
10℃搅拌反应1小时。用冰水(100ml)萃灭反应,乙酸乙酯(2*100ml)萃取。合并有机相,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩至干。残留物过硅胶柱得z
‑1‑
a(9.0g,36.98mmol,收率95.17%)。ms(esi)m/z=244[m 1]
。
[0142]
步骤2,z
‑1‑
b的制备
[0143]
于500ml三口瓶中加入草酰氯(5.44g,43.15mmol)和二氯甲烷(100ml),氮气保护
下冷却至
‑
70℃,滴加入二甲基亚砜(4.49g,57.53mmol,4.09ml)的二氯甲烷(46ml)溶液。滴毕,反应液于
‑
70℃搅拌反应10分钟。于
‑
70℃滴加入z
‑1‑
a(7g,28.77mmol)的二氯甲烷(46ml)溶液。滴毕,反应液于
‑
70℃继续搅拌反应20分钟。于
‑
70℃滴加入三乙胺(11.62g,115.06mmol)并搅拌反应5分钟,逐渐升温至
‑
35℃,用饱和柠檬酸溶液萃灭(150ml),静置分层。有机相饱和食盐水(150ml*2),无水硫酸钠干燥,过滤,30℃减压浓缩至干得z
‑1‑
b粗品(6.8g,28.18mmol,收率97.95%),直接用于下一步。
[0144]
步骤3,z
‑1‑
c的制备
[0145]
于500ml三口瓶中加入z
‑1‑
b粗品(7.0g,29.01mmol)和meoh(70ml),降温至0℃,一次性加入氨水(29.01mmol,42ml)。于0℃搅拌反应10分钟,加入乙二醛(8.42g,145.03mmol),然后逐渐升至室温搅拌反应1小时。降温至0℃搅拌状态下加入水(50ml)萃灭反应,大量固体析出,过滤,少量水洗涤,滤饼减压干燥得z
‑1‑
c(4.2g,15.03mmol,收率51.83%)。ms(esi)m/z=280[m 1]
。
[0146]
步骤4,z
‑1‑
d的制备
[0147]
于250ml单口瓶中加入z
‑1‑
c(4.8g,17.18mmol)和二氯甲烷(150ml),室温下加入三乙胺(5.22g,51.54mmol,7.19ml)。冷却至0℃,搅拌状态下分批加入三苯基氯甲烷(5.27g,18.90mmol)。加毕,升至室温搅拌反应1小时,加入水(50ml)萃灭反应,大量固体析出,过滤,少量水洗涤,滤饼减压干燥得z
‑1‑
d(10g,15.33mmol,收率89.25%,80%purity),直接用于下一步。ms(esi)m/z=522[m 1]
。(结构式中trt为三苯基保护基的缩写)
[0148]
步骤5,z
‑
1的制备
[0149]
于500ml单口瓶中加入z
‑1‑
d(10g,15.33mmol)和dmf(64ml),冷却至0℃,加入碳酸钾(12.70g,92.01mmol),然后分批加入n
‑
溴代丁二酰亚胺(3.28g,18.40mmol),室温搅拌反应过夜。加入水(100ml)萃灭反应,乙酸乙酯(2*100ml)萃取。合并有机相,饱和食盐水(2*100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩至干。残留物过硅胶柱得z
‑
1(6g,9.99mmol,收率65.15%)。ms(esi)m/z=600[m 1]
。
[0150]
中间体z
‑
2的制备
[0151]
参照中间体z
‑
1步骤3到步骤5的制备方法,步骤3起始原料相同,只是用丙酮醛代替乙二醛,其余操作相同,可得到表中相应结构的中间体z
‑
2。
[0152][0153]
中间体z
‑
3的制备
[0154][0155]
步骤1,z
‑3‑
a的制备
[0156]
于1l单口瓶中加入4
‑
溴
‑3‑
甲基苯乙酸(20g,87.31mmol)和dmf(300ml),于室温搅
拌状态下加入无水碳酸钾(18.07g,130.96mmol),冰浴下滴加入苄溴(17.92g,104.77mmol)。滴毕,逐渐升至室温搅拌反应过夜,tlc监测反应完全。加入水(1000ml)萃灭反应,乙酸乙酯(2*500ml)萃取。合并有机相,饱和食盐水(2*800ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩至干。残留物过硅胶柱得z
‑3‑
a(22.49g,70.46mmol,收率80.70%)。ms(esi)m/z=319[m 1]
。
[0157]
步骤2,z
‑3‑
b的制备
[0158]
于500ml三口瓶中加入z
‑3‑
a(22.49g,70.46mmol)和dmf(200ml),降温至0℃,分批加入nah(60%)(4.23g,176.15mmol),搅拌30分钟,再滴加入碘甲烷(30.00g,211.38mmol)。滴毕,逐渐升至室温搅拌反应过夜,tlc监测反应完全。加入水(300ml)萃灭反应,乙酸乙酯(300ml)萃取。合并有机相,饱和食盐水(2*300ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩至干。残留物过硅胶柱得z
‑3‑
b(17.45g,50.25mmol,收率71.32%)。ms(esi)m/z=347[m 1]
。
[0159]
步骤3,z
‑
3的制备
[0160]
于500ml单口瓶中加入z
‑3‑
b(5g,14.40mmol),联硼酸频那醇酯(10.97g,43.20mmol),乙酸钾(5.65g,57.60mmol)和1,4
‑
二氧六环(100ml),加入pd(dppf)cl2(1.05g,1.44mmol)。搅拌状态抽真空氮气置换三次,氮保加热至90℃反应过夜。tlc监测反应完全。加入水(300ml)萃灭反应,乙酸乙酯(100ml*2)萃取。合并有机相,饱和食盐水(2*100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩至干。残留物过硅胶柱得z
‑
3(3.2g,8.12mmol,收率56.36%)。ms(esi)m/z=395[m 1]
。
[0161]
中间体z
‑
4和z
‑
5的制备
[0162]
参照中间体z
‑
3步骤1到步骤3的制备方法,用表中相应步骤1原料代替4
‑
溴
‑3‑
甲基苯乙酸,其余操作相同,可得到表中相应结构的中间体z
‑
4和z
‑
5。
[0163][0164]
中间体z
‑
6的制备
[0165]
[0166]
步骤1,z
‑
6的制备
[0167]
于250ml单口瓶中依次加入3
‑
(4
‑
氨基苯基)四氢呋喃
‑3‑
乙酸乙酯(12.5g,53.13mmol)和乙腈(150ml),搅拌状态下室温加入联硼酸频那醇酯(16.19g,63.75mmol)和亚硝酸叔丁酯(8.21g,79.69mmol)。氮气置换三次,升温至80℃搅拌反应3小时。减压浓缩至干,残留物过硅胶柱纯化得z
‑
6(9.8g,28.31mmol,收率53.28%)。ms(esi)m/z=347[m 1]
。
[0168]
中间体z
‑
7的制备
[0169][0170]
步骤1,z
‑
7的制备
[0171]
于100ml单口瓶中依次加入3
‑
(4
‑
溴苯基)吡咯
‑1‑
羧酸苄酯
‑3‑
羧酸乙酯(2g,4.63mmol),联硼酸频那醇酯(1.76g,6.94mmol),二氧六环(50ml),koac(1.36g,13.88mmol)和pd(dppf)cl2(338.51mg,462.63μmol),氮气保护抽真空置换三次,升温至80℃反应过夜。反应液冷却,硅藻土过滤,少量乙酸乙酯洗涤,滤液减压浓缩至干,残留物过硅胶柱纯化得z
‑
7(1.18g,2.46mmol,收率53.16%)。ms(esi)m/z=380[m 1]
。
[0172]
中间体z
‑
8的制备
[0173]
参照中间体z
‑
7的制备方法,用2
‑
(4
‑
溴苯基)吡咯
‑1‑
羧酸苄酯
‑2‑
羧酸乙酯替换3
‑
(4
‑
溴苯基)吡咯
‑1‑
羧酸苄酯
‑3‑
羧酸乙酯,其余操作相同,可得到表中相应结构的中间体z
‑
8。
[0174][0175]
中间体z
‑
9的制备
[0176][0177]
步骤1,z
‑
9的制备
[0178]
于50ml单口瓶中依次加入2
‑
(3
‑
氰基苯基)
‑2‑
甲基丙酸甲酯(1.2g,5.90mmol)和无水甲醇(10ml),冰浴条件下滴加入乙酰氯(4.6g,59.0mmol)。滴毕,反应液逐渐升至室温搅拌反应过夜。反应液减压浓缩至干,残留物过硅胶柱纯化得z
‑
9(160mg,680.05μmol,收率
11.52%)。ms(esi)m/z=236[m 1]
。
[0179]
中间体z
‑
10到z
‑
14的制备
[0180]
参照中间体z
‑
9的制备方法,以下表中不同氰基化合物为原料,通过同样的操作条件和方法可得到表中相应结构的中间体z
‑
10到z
‑
14。
[0181][0182][0183]
中间体z
‑
15的制备
[0184]
步骤1中间体z
‑
15
‑
1的制备
[0185][0186]
向配备有机械搅拌和氮气保护的10l三口烧瓶中加入thf(3500ml),依次加入邻氯苯甲醛(341g,2.43mol)和硝基乙酸乙酯(323g,2.43mol),随后冰盐浴冷却至內温
‑
10℃,机械搅拌下缓慢滴加ticl4(920g,4.85mol),滴加时控制內温不超过0℃,滴毕,维持0℃继续反应0.5h,随后逐滴加入n
‑
甲基吗啉(981.51g,9.70mol),滴加时控制內温不超过15℃,滴
毕,允许升至室温并搅拌1h,最后加入饱和氯化铵500ml淬灭,乙酸乙酯(1000ml
×
3)萃取,经饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,经硅胶柱层析分离得中间体z
‑
15
‑
1(580g,2.27mol,93.52%yield)。
[0187]
步骤2中间体z
‑
15
‑
2的制备
[0188][0189]
向配备有机械搅拌和氮气保护的10l三口烧瓶中加入1m的氯化锌四氢呋喃溶液(5.5mol,5.5l),冰浴降温至0℃,缓慢滴加2m的异丙基氯化镁四氢呋喃溶液(5.5mol,2.75l),控制内温低于5℃,滴毕,0
‑
5℃继续反应30分钟。随后,缓慢滴加中间体z
‑
15
‑
1(702g,2.75mol)的无水thf(500ml)溶液,滴加时控制内温低于5℃,滴毕,0
‑
5℃继续反应1小时。反应完毕,取500g氯化铵配置成饱和水溶液,缓慢加入上述反应液中淬灭反应,乙酸乙酯(5l
×
2)萃取,合并有机相并水洗,饱和氯化钠水洗,无水硫酸钠干燥,过滤,减压浓缩,粗品经硅胶柱层析分离,得到中间体z
‑
15
‑
2(377g,1.26mol,45.80%yield)。
[0190]
步骤3中间体z
‑
15
‑
3的制备
[0191][0192]
向配备有机械搅拌的10l三口烧瓶加入中间体z
‑
15
‑
2(730g,2.44mol)和冰醋酸(6l),冰浴降温至0℃,机械搅拌下分批加入锌粉(796.24g,12.18mol),加入时控制內温低于60℃。加毕,继续搅拌反应1小时,反应完毕,抽滤,乙酸乙酯100ml淋洗滤饼,滤液减压浓缩除去冰醋酸,粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯50:1~10:1)得中间体z
‑
15
‑
3(对映异构体,2s,3s和2r,3r构型混合物),黄色粘稠状液体(280g,1.04mol,42.65%yield),ms m/z:270(m 1)
。
[0193]
步骤4中间体z
‑
15
‑
4的制备
[0194][0195]
向中间体z
‑
15
‑
3(60g,222.41mmol)的四氢呋喃(200ml)和水(100ml)的悬浊液中依次加入碳酸氢钠(37.37g,444.83mmol)和boc
‑
酸酐(53.34g,244.66mmol),加毕,室温搅拌过夜。反应完毕,加水300ml,乙酸乙酯(300ml
×
2)萃取,合并有机相,饱和氯化钠水洗,无水硫酸钠干燥,过滤,减压浓缩,粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯100:1~50:1),得到中间体z
‑
15
‑
4(39.4g,106.52mmol,47.89%yield),ms m/z:270[m
‑
99]
,314[m
‑
55]
。
[0196]
步骤5中间体z
‑
15
‑
5的制备
[0197][0198]
向中间体z
‑
15
‑
4(20.00g,54.07mmol)的甲醇(100ml)和水(10ml)的混悬液中加入naoh(6.49g,162.21mmol),升温至50℃反应3小时,反应完毕,将反应液浓缩,加水100ml,乙酸乙酯(100ml)萃取一次,水相降温至0~5℃,用1m的hcl调ph=3
‑
4,然后乙酸乙酯(100ml)萃取,有机相减压浓缩,得到中间体2
‑
5的一对对映异构体形式(17.8g,52.07mmol,96.30%yield),黄色油状物,该对映异构体经sfc手性拆分分离,得其(2s,3s)的单一构型z
‑
15
‑
5,6.5g,ms m/z:242[m
‑
99]
,286[m
‑
55]
。
[0199]
步骤6
‑
10中间体z
‑
15的制备
[0200][0201]
可参照中间体1步骤1~4的方法,以中间体z
‑
15
‑
5为原料即可得到中间体z
‑
15,ms m/z:684[m 1]
.
[0202]
中间体z
‑
16
‑
a和z
‑
16
‑
b的制备
[0203][0204]
步骤1中间体z
‑
16
‑
1的制备
[0205][0206]
参照中间体z
‑
15
‑
2的制备方法,由中间体z
‑
15
‑
1与异丙烯基溴化镁反应制备得到,收率37%,ms m/z:298(m 1)
。
[0207]
步骤2中间体z
‑
16
‑
2的制备
[0208][0209]
参照中间体z
‑
15
‑
3的制备方法,由锌粉
‑
醋酸体系还原z
‑
16
‑
1的硝基得到,收率85%,ms m/z:268(m 1)
。其四个手性异构体未拆分直接用于下一步。
[0210]
步骤3中间体z
‑
16
‑
3的制备
[0211][0212]
参照中间体z
‑
15
‑
4的制备方法,由boc酸酐保护z
‑
16
‑
2的氨基得到,ms m/z:368[m 1]
,312[m
‑
55]
。
[0213]
步骤4中间体z
‑
16
‑
4的制备
[0214][0215]
非对映异构体混合物中间体z
‑
16
‑
3(四个手性异构体的混合物)经硅胶柱层析分离纯化(石油醚/甲基叔丁基醚100:1)得中间体z
‑
16
‑
3的一对映异构体混合物(2s,3s和2r,3r构型),取该对映异构体(1.7g,4.62mmol),氮气保护下,溶于20ml干燥的dcm中,冷却內温至
‑
30℃,加入znet2(1m的四氢呋喃溶液,27.73ml),
‑
30℃搅拌反应1小时后滴加二碘甲烷(9.90g,36.97mmol),滴加时维持內温不高于
‑
20℃,滴毕,允许内温缓慢升至室温并搅拌过夜,lc
‑
ms显示有约30%的起始原料z
‑
16
‑
3脱boc后的副产物,加水5ml淬灭反应,有机相减压浓缩至干,得粗品1g,粗品此时为z
‑
16
‑
4的脱boc形式和起始原料z
‑
16
‑
3的脱boc后的混合物,将其混合物溶于10ml的thf中,依次加入tea(897.78mg,8.87mmol,1.24ml)和(boc)2o(1.16g,5.32mmol),于室温搅拌过夜,减压浓缩至干,粗品经硅胶柱分离纯化(石油醚/甲基叔丁基醚100:3)得boc保护的环丙甲基乙酯z
‑
16
‑
4粗品和前一步未反应完的中间体z
‑
16
‑
3的混合物0.5g,将该粗品溶于四氢呋喃(5ml)和乙腈(5ml)及5ml水的混合液中,加入二水合锇酸钾(44.3mg,0.12mmol)和n
‑
甲基
‑
n
‑
氧化吗啉(111mg,0.96mmol),通过双键双羟化除去未反应的z
‑
16
‑
3,室温搅拌过夜,lc
‑
ms监测显示已无未反应的中间体z
‑
16
‑
3,减压浓缩除去大部分有机溶剂,乙酸乙酯15ml萃取,有机相浓缩,粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯20:1)得中间体z
‑
16
‑
4(0.5g,1.31mmol,28%产率),ms m/z:382[m 1]
.
[0216]
步骤5中间体z
‑
16
‑
5的制备
[0217]
[0218]
参照中间体z
‑
15
‑
5的制备方法,由z
‑
16
‑
4经氢氧化钠水解得到,ms m/z:298[m
‑
55]
。
[0219]
步骤6中间体z
‑
16
‑
a、z
‑
16
‑
b的制备
[0220][0221]
中间体z
‑
16
‑
5(一对映体混合物)经sfc手性柱拆分分离制备后可分别得到单一手性异构体z
‑
16
‑
a(2r,3r),z
‑
16
‑
b(2s,3s),ms m/z:354[m 1]
。
[0222]
实施例1的制备
[0223][0224]
步骤1,1
‑
1的制备
[0225]
于100ml单口瓶中依次加入z
‑
1(200.14mg,333.24μmol),z
‑
3(197.1mg,499.86μmol),碳酸钠(88.31mg,833.10μmol),1,4
‑
二氧六环(8ml)和水(2ml),最后加入pd(dppf)cl2(24.36mg,33.32μmol)。抽真空氮气置换三次,逐渐升温至90℃反应过夜。液质监测反应完全,加水(30ml)萃灭反应,乙酸乙酯(30ml*2)萃取。合并有机相,饱和食盐水(2*60ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩至干。残留物硅胶柱分离得1
‑
1(62mg,78.68μmol,收率23.61%)。ms(esi)m/z=788[m 1]
。
[0226]
步骤2,1
‑
2的制备
[0227]
于50ml单口瓶中依次加入1
‑
1(62mg,78.68μmol)和二氯甲烷(5ml),冰浴条件下加入三氟乙酸(1ml)。逐渐升至室温搅拌反应1小时,液质监测反应完全,反应液直接浓缩至干得1
‑
2(33.23mg,74.57μmol,收率94.78%)。ms(esi)m/z=446[m 1]
。
[0228]
步骤3,1
‑
3的制备
[0229]
于50ml单口瓶中依次加入1
‑
2(33.23mg,74.57μmol),hbtu(43.23mg,114.00μmol),1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸(9.40mg,74.57mmol),dipea(36.83mg,285.00μmol,49.64ul)和dmf(2ml)。氮气保护室温搅拌反应1小时,液质监测反应完全。反应液直接浓缩至干,粗品用mplc分离纯化得1
‑
3(35mg,0.063mmol,收率84.75%)。ms(esi)m/z=554[m 1]
。
[0230]
步骤4,1
‑
4的制备
[0231]
于50ml单口瓶中依次加入1
‑
3(35mg,0.063mmol)和甲醇(10ml),加入pd/c(10mg,w/w 30%),抽真空氢气置换三次,室温搅拌反应1小时。液质监测反应完全,反应液直接硅
藻土过滤,甲醇洗涤,滤液减压浓缩至干得1
‑
4(29mg,0.063mmol,收率98.98%)。ms(esi)m/z=464[m 1]
。
[0232]
步骤5,1的制备
[0233]
于50ml单口瓶中依次加入1
‑
4(29mg,0.063mmol),hbtu(28.49mg,0.076mmol),环丙基甲基胺(5.40mg,0.076mmol),dipea(24.51mg,0.19mmol)和dmf(2ml)。氮气保护室温搅拌反应1小时,液质监测反应完全。反应液直接浓缩至干,粗品用pre.hplc(mecn/h2o,0.05%nh4hco3)分离纯化得实施例1(19.39mg,0.038mmol,收率60%)。ms(esi)m/z=517[m 1]
。1h nmr(400mhz,methanol
‑
d4)δ7.60(s,1h),7.55
–
7.47(m,2h),7.44
–
7.36(m,4h),7.09(d,j=2.1hz,1h),5.09(d,j=8.9hz,1h),4.34
–
4.22(m,1h),4.08(s,3h),3.61(q,j=7.1hz,1h),3.00
–
2.90(m,2h),2.46
–
2.37(m,5h),2.01
–
1.74(m,8h),1.71(s,3h),1.57(s,3h),1.50
–
1.31(m,8h),0.98(s,3h).
[0234]
实施例2到实施例5的制备
[0235]
参照实施例1步骤1到步骤5的制备方法,其中实施例2到4,在步骤1中溴代物相同,表中起始原料硼酯替代z
‑
3,其余操作相同,可得表中相应实施例2到4。实施例5起始原料用表中起始原料溴代物替代,表中起始原料硼酯替代z
‑
3,其余操作相同,可得表中相应实施例5。
[0236]
[0237][0238][0239]
实施例6的制备
[0240][0241]
步骤1到步骤5到制备,参照实施例1步骤1到步骤5的合成方法,步骤1中z
‑
1不变,中间体z
‑
5替换中间体z
‑
3;步骤5中(r)
‑
(2
‑
氨基
‑2‑
(1
‑
甲基环丁基)乙基)碳酸叔丁酯替换环丙基甲基胺。其余操作相同,可得相应中间体6
‑
5。
[0242]
步骤6,6的制备
[0243]
于50ml单口瓶中依次加入6
‑
5(77mg,116.69μmol)和dcm(3ml),冰浴条件下加入三氟乙酸(2ml)。加毕,室温搅拌反应1小时液质lc
‑
ms监测反应完全。反应液直接浓缩至干,粗品用pre
‑
hplc(mecn/h2o,0.05%nh4hco3)分离纯化,得实施例6(15mg,0.026mmol,收率22.51%)。ms(esi)m/z=517[m 1]
。1h nmr(400mhz,methanol
‑
d4)δ7.68(d,j=8.1hz,2h),7.50
–
7.38(m,4h),7.34(s,1h),6.91
–
6.86(m,1h),4.99(d,j=9.0hz,1h),4.94(s,3h),4.08(s,3h),3.99(dd,j=10.5,3.3hz,1h),2.61(dd,j=13.3,3.3hz,1h),2.41(dd,j=13.3,10.4hz,1h),2.05
–
1.80(m,6h),1.84
–
1.64(m,2h),1.59(d,j=8.7hz,7h),1.48
–
1.38(m,2h),1.40
–
1.19(m,3h),1.18
–
0.93(m,2h),0.94(s,3h).
[0244]
实施例7到实施例11的制备
[0245]
参照实施例6步骤1到步骤6的制备方法,用表格相应的起始原料溴代物和起始原料硼酯,其余操作相同,可得表中相应实施例7到实施例11化合物。
[0246]
[0247]
[0248][0249]
实施例12的制备
[0250][0251]
步骤1到步骤3,步骤5的制备,参照实施例1的步骤1到步骤3,步骤5的合成方法,步骤1中z
‑
1不变,中间体z
‑
7替换中间体z
‑
3,其余操作相同。
[0252]
步骤4,12
‑
4的制备
[0253]
于50ml单口瓶中依次加入12
‑
3(90mg,140.90μmol)和乙醇(5ml),室温搅拌状态下加入氢氧化钠(112.71mg,2.82mmol),升温至70℃搅拌反应过夜,加水(30ml)萃灭反应,1m hcl调ph值至4,乙酸乙酯(30ml*2)萃取。合并有机相,饱和食盐水(2*30ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩至干得12
‑
4(84mg,0.137mmol,收率97.62%)。ms(esi)m/z=611[m 1]
。
[0254]
步骤5,12
‑
5的制备
[0255]
参照实施例1的步骤5方法,中间体12
‑
4与环丁基甲胺缩合即可得到中间体12
‑
5.
[0256]
步骤6,实施例12的制备
[0257]
于50ml单口瓶中依次加入12
‑
5(93mg,137.20μmol)和异丙醇(10ml),加入pd/c(28mg,w/w 30%),抽真空氢气置换三次,室温搅拌反应2小时。液质监测反应完全,反应液直接硅藻土过滤,甲醇洗涤,滤液减压浓缩至干,粗品pre.hplc(mecn/h2o,0.05%nh4hco3)纯化得实施例12(12mg,0.021mmol,收率15.44%)。ms(esi)m/z=544[m 1]
。1h nmr(400mhz,methanol
‑
d4)δ7.69(d,j=8.0hz,2h),7.47(d,j=2.2hz,1h),7.41
–
7.33(m,3h),6.89(d,j=2.2hz,1h),4.99(d,j=9.0hz,1h),4.95(s,7h),4.08(s,3h),3.81(d,j=11.5hz,1h),3.18
–
3.01(m,5h),2.69
–
2.55(m,1h),2.47
–
2.27(m,2h),2.07
–
1.89(m,2h),1.93
–
1.64(m,3h),1.58(dt,j=10.6,7.9hz,2h),1.46
–
1.35(m,1h),1.38
–
1.15(m,3h),1.09(dtd,j=28.1,12.4,3.4hz,2h).
[0258]
实施例13的制备
[0259][0260]
中间体13
‑
1到13
‑
4的制备方法参照实施例1的步骤1到步骤4的合成方法,步骤1中z
‑
1不变,上述所示硼酯替换中间体z
‑
3,其余操作相同。
[0261]
步骤5,实施例13的制备
[0262]
于50ml单口瓶中依次加入13
‑
4(20mg,56.11μmol)和dcm(2ml),室温下加入异氰酸甲酯基环丙烷(5.45mg,56.11μmol),室温搅拌反应2小时。液质监测反应完全,滤液减压浓缩至干,粗品pre.hplc(mecn/h2o,0.05%nh4hco3)纯化得实施例13(3mg,6.61μmol,收率11.79%)。ms(esi)m/z=454[m 1]
。1h nmr(400mhz,methanol
‑
d4)δ7.50(d,j=2.1hz,1h),7.42(s,1h),6.99(d,j=2.2hz,1h),5.05
–
4.98(m,1h),4.07(d,j=2.5hz,3h),3.68(d,j=6.9hz,1h),3.60
–
3.52(m,1h),3.50
–
3.39(m,1h),3.10(d,j=7.0hz,1h),3.05
–
3.02(m,1h),2.19
–
2.08(m,1h),2.07
–
1.99(m,1h),1.86
–
1.71(m,3h),1.47
–
1.29(m,5h),1.17
–
0.99(m,5h),0.51
–
0.48(m,2h),0.38
–
0.35(m,1h),0.24
–
0.20(m,2h).
[0263]
实施例14的制备
[0264][0265]
步骤1,14
‑
1的制备
[0266]
于100ml单口瓶中依次加入z
‑
11(742mg,2.36mmol),(s)
‑
(1
‑
环己基
‑2‑
肼基
‑2‑
羰乙基)碳酸叔丁基(770.02mg,2.84mmol)和meoh(10ml),再加入tea(2.39g,23.65mmol,3.30ml),逐渐升温至回流反应过夜。液质lc
‑
ms监测反应完全,滤液减压浓缩至干,粗品mplc纯化得14
‑
1(490mg,982.73μmol,收率41.56%)。ms(esi)m/z=499[m 1]
。
[0267]
实施例14中中间体14
‑
2、14
‑
3、14
‑
4的制备方法可分别参考实施例12中步骤12
‑
2到12
‑
4的合成方法,实施例14中14
‑
5到实施例14的合成方法参考实施例6中步骤6
‑
5到实施例6的合成。由此可得实施例14。ms(esi)m/z=589[m 1]
。1h nmr(400mhz,methanol
‑
d4)δ8.08
–
7.89(m,2h),7.59
–
7.37(m,3h),6.92(dd,j=6.4,2.2hz,1h),5.11(d,j=8.9hz,1h),4.67(dd,j=18.4,8.9hz,1h),4.28
–
4.11(m,2h),4.08(d,j=3.2hz,3h),4.04
–
3.89(m,2h),3.18
–
3.03(m,1h),2.91
–
2.80(m,2h),2.78
–
2.67(m,1h),2.57(m,0.6h),2.23(m,
0.4h),2.11
–
1.93(m,3h),1.88
–
1.66(m,9h),1.37
–
1.23(m,4h),1.22
–
1.05(m,4h).
[0268]
实施例15到18的制备
[0269]
参照实施例14的制备方法,用表格相应的起始原料替换实施例14合成路线中相应的原料即可,其余操作相同,可得表中相应实施例15到实施例18。
[0270][0271][0272]
实施例19的制备
[0273][0274]
实施例19中间体19
‑
1、19
‑
2、19
‑
3、19
‑
4的制备方法可分别参考实施例14中步骤14
‑
1到14
‑
4的合成方法,步骤1中用z
‑
12替换z
‑
11,其余合成方法相同。实施例19中19
‑
5到实施例19的合成方法参考实施例12中步骤12
‑
5到实施例12的合成。由此可得实施例19。ms(esi)m/z=545[m 1]
。1h nmr(400mhz,methanol
‑
d4)δ8.17
–
7.96(m,2h),7.55
–
7.47(m,3h),6.97
–
6.81(m,1h),5.12(d,j=8.8hz,1h),4.36(d,j=11.5hz,1h),4.09(s,3h),3.62
–
3.53(m,1h),3.42
–
3.35(m,1h),3.24
–
3.19(m,1h),3.16
–
3.12(m,1h),2.84
–
2.77(m,1h),2.73
–
2.65(m,1h),2.45
–
2.37(m,1h),2.13
–
2.04(m,1h),2.01
–
1.95(m,1h),1.86
–
1.76(m,5h),1.61
–
1.53(m,3h),1.35
–
1.07(m,8h).
[0275]
实施例20的制备
[0276][0277]
实施例20的合成方法参照实施例19,起始原料用z
‑
13替换z
‑
11,其余合成方法相同。由此可得实施例20。ms(esi)m/z=545[m 1]
。1h nmr(400mhz,methanol
‑
d4),δ8.28
–
8.05(d,j=8.6,2h),7.73
–
7.56(d,j=8.6,2h),7.47(s,1h),6.91(s,1h),5.10(m,1h),4.07(s,3h),3.54(m,1h),3.29
–
3.23(m,1h),3.14(m,1h),2.87
–
2.68(m,2h),2.43(m,1h),2.31(m,1h),2.16
–
1.93(m,4h),1.93
–
1.79(m,4h),1.73(m,3h),1.65
–
1.54(m,2h),1.42
–
1.22(m,7h),1.18
–
1.01(m,2h),0.95
–
0.84(m,2h).
[0278]
实施例21的制备
[0279][0280]
实施例21的合成方法参照实施例14,起始原料相同,步骤5中由中间体14
‑
4与(r)
‑
(
‑
)
‑2‑
氨基
‑1‑
丁醇缩合反应,其余合成方法操作相同。由此可得实施例21。ms(esi)m/z=550[m 1]
。1h nmr(400mhz,methanol
‑
d4)δ7.98(d,j=8.0hz,2h),7.51(d,j=8.1hz,2h),7.48
–
7.44(m,1h),6.90(d,j=1.7hz,1h),5.11(d,j=8.9hz,1h),4.57(d,j=9.6hz,2h),4.08(s,2h),4.02
–
3.92(m,3h),3.83
–
3.75(m,1h),3.44(t,j=5.3hz,2h),2.92
–
2.81(m,1h),2.48
–
2.36(m,1h),2.09
–
2.02(m,1h),2.00
–
1.92(m,1h),1.84
–
1.66(m,3h),1.61
–
1.53
(m,1h),1.52
–
1.46(m,1h),1.36
–
1.09(m,6h),0.76(t,j=7.4hz,3h).
[0281]
实施例22化合物22的制备
[0282]
步骤1中间体22
‑
a1的制备
[0283][0284]
将中间体1(150mg,244.06μmol)溶于1,4
‑
二氧六环与水的4:1的10ml混合溶液中,加入碳酸钾(101.04mg,732.17μmol)和3
‑
(乙酸乙酯)苯基硼酸频哪醇酯(92.06mg,317.27μmol),随后加入pd(dppf)cl2(17.84mg,24.41μmol),超声氮气置换后升温至80℃反应3小时,lc
‑
ms显示反应完毕,减压浓缩,加入二氯甲烷50ml,水洗(2*10ml),有机相无水硫酸钠干燥,过滤,减压浓缩,粗品经硅胶柱层析分离纯化(石油醚/乙酸乙酯4:1)即可得到中间体22
‑
a1(150mg,214.93μmol,88.07%yield),ms m/z:698(m 1)
。
[0285]
步骤2中间体22
‑
a2的制备
[0286][0287]
冰浴下,将三氟乙酸(1ml)缓慢滴加至中间体22
‑
a1(150mg,214.93μmol)的3ml二氯甲烷溶液中,加毕,于冰浴下继续搅拌反应3小时,lc
‑
ms显示反应完毕,减压浓缩,得中间体22
‑
a2的三氟乙酸盐粗品,未经纯化直接用于下一步反应,ms m/z:356(m 1)
。
[0288]
步骤3中间体22
‑
a3的制备
[0289][0290]
室温下,将上一步所得中间体22
‑
a2(211.45μmol)粗品的3ml二氯甲烷溶液加至hbtu(64.42mg,253.74μmol),diea(136.39mg,1.06mmol)和1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸(32mg,253.74μmol)的3ml二氯甲烷溶液中,于室温搅拌2小时,lc
‑
ms显示原料反应完毕,减压浓缩,加入乙酸乙酯20ml,饱和氯化铵水溶液洗涤,无水硫酸钠干燥,过滤,减压浓缩,粗品经硅胶柱层析分离纯化(二氯甲烷/甲醇20:1)即可得到中间体22
‑
a3(0.1g,204.93μmol,96.92%yield),ms m/z:464(m 1)
。
[0291]
步骤4中间体22
‑
a4的制备
[0292][0293]
向中间体22
‑
a3(106mg,228.66μmol)的thf/etoh/h2o=4/1/1(5ml)混合液中加入lioh(28.75mg,684.55μmol),随后,反应液于室温反应12小时,lc
‑
ms显示原料已反应完毕,经1n hcl调ph~4,ea(15ml*3)萃取,合并有机相,经饱和食盐水洗,无水硫酸钠干燥,过滤,减压浓缩得到中间体22
‑
a4的粗品(98mg,225.02μmol,98.41%yield),ms m/z:436[m 1]
,未经纯化直接用于下一步反应。
[0294]
步骤5化合物22的制备
[0295][0296]
将hbtu(31.48mg,123.99μmol),dipea(66.64mg,516.63μmol),依次加至步骤4中间体22
‑
a4(45mg,103.33μmol)的dcm(1ml)溶液中,15min后加入(r)
‑
n
‑
甲基丙氨酰胺(12.66mg,123.99μmol),室温反应3h,lc
‑
ms显示原料已反应完毕,减压浓缩,粗品经mplc反相c18柱层析纯化分离(乙腈/0.05%水0~60%)即可得到化合物22(19mg,35.47μmol,34.33%yield),ms m/z:520(m 1)
。1h nmr(400mhz,meod):δ7.65(s,1h),7.59(d,j=7.6hz,1h),7.49(d,j=2.4hz,1h),7.37
‑
7.32(m,2h),7.21(d,j=7.6hz,1h),6.89(d,j=2hz,1h),5.40
‑
5.36(m,1h),4.35
‑
4.30(m,1h),4.12(s,3h),3.61(s,2h),2.73(s,3h),1.96
‑
1.91(m,2h),1.89
‑
1.86(m,2h),1.76
‑
1.74(m,2h),1.69
‑
1.62(m,1h),1.35(d,j=7.2hz,6h),1.27
‑
1.20(m,2h),1.12
‑
0.97(m,2h)。
[0297]
实施例23化合物23的制备
[0298][0299]
参考实施例22的方法,由中间体z
‑
15经偶联、脱保护、与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸缩合、酯水解,最后与(r)
‑
n
‑
甲基环丁基甘氨酰胺缩合即可得到化合物23,ms m/z:590(m 1)
.
[0300]
实施例24化合物24的制备
[0301][0302]
参照实施例22的制备方法,以中间体22
‑
a4为原料,与(r)
‑
n
‑
甲基环丁基甘氨酰胺缩合即可得到化合物24,ms m/z:560(m 1)
.
[0303]
实施例25化合物25的制备
[0304][0305]
参照实施例22的制备方法,以中间体22
‑
a4为原料,与(r)
‑
n
‑
乙基环丁基甘氨酰胺缩合即可得到化合物25,ms m/z:574(m 1)
.
[0306]
实施例26化合物26的制备
[0307][0308]
参照实施例22的制备方法,以中间体z
‑
15为原料,与2
‑
甲基
‑2‑
(3
‑
硼酸频哪醇酯
‑
苯基)丙酸乙酯偶联,脱保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,酯水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物26,ms m/z:618(m 1)
.
[0309]
实施例27化合物27的制备
[0310][0311]
参照实施例22的制备方法,以中间体z
‑
15为原料,与3
‑
甲氧基
‑2‑
甲基
‑2‑
(3
‑
硼酸频哪醇酯
‑
苯基)丙酸乙酯偶联,脱保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,酯水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物27,ms m/z:648(m 1)
.
[0312]
实施例28化合物28的制备
[0313][0314]
参照实施例22的制备方法,以中间体z
‑
15为原料,与3
‑
(3
‑
(硼酸频哪醇酯
‑
苯基)四氢呋喃)
‑3‑
羧酸乙酯偶联,脱保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,酯水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物28,ms m/z:646(m 1)
.
[0315]
实施例29化合物29的制备
[0316][0317]
参照实施例22的制备方法,以中间体z
‑
15为原料,与4
‑
(3
‑
(苯基硼酸频哪醇酯)四氢
‑
2h
‑
吡喃)
‑4‑
羧酸乙酯偶联,脱保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,酯水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物29,ms m/z:660(m 1)
.
[0318]
实施例30化合物30的制备
[0319][0320]
参照实施例22的制备方法,以中间体z
‑
15为原料,与3
‑
(3
‑
(苯基硼酸频哪醇酯)苯基)
‑
氧杂环丁烷)
‑3‑
羧酸乙酯偶联,脱保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,酯水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物30,ms m/z:632(m 1)
.
[0321]
实施例31化合物31的制备
[0322][0323]
参照中间体1和实施例22中的方法,以中间体z
‑
16
‑
b为原料,经过酰胺化、还原、成咪唑环、nh上trityl保护基、溴代、再与3
‑
(乙酸乙酯)苯基硼酸频哪醇酯偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化
合物31,ms m/z:602(m 1)
.
[0324]
实施例32化合物32的制备
[0325][0326]
参照中间体1和实施例22中的方法,以中间体z
‑
16
‑
b为原料,经过酰胺化、还原、成咪唑环、nh上trityl保护基、溴代、与2
‑
甲基
‑2‑
(3
‑
硼酸频哪醇酯
‑
苯基)丙酸乙酯偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物32,ms m/z:630(m 1)
.
[0327]
实施例33化合物33的制备
[0328][0329]
参照中间体1和实施例22中的方法,以中间体z
‑
16
‑
b为原料,经过酰胺化、还原、成咪唑环、nh上trityl保护基、溴代、与2
‑
甲基
‑2‑
(3
‑
硼酸频哪醇酯
‑
苯基)丙酸乙酯偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物33,ms m/z:660(m 1)
.
[0330]
实施例34化合物34的制备
[0331][0332]
参照中间体1和实施例22中的方法,以中间体z
‑
16
‑
b为原料,经过酰胺化、还原、成咪唑环、nh上trityl保护基、溴代、与3
‑
(3
‑
(硼酸频哪醇酯
‑
苯基)四氢呋喃)
‑3‑
羧酸乙酯偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物34,ms m/z:658(m 1)
.
[0333]
实施例35化合物35的制备
[0334][0335]
参照中间体1和实施例22中的方法,以中间体z
‑
16
‑
b为原料,经过酰胺化、还原、成咪唑环、nh上trityl保护基、溴代、与4
‑
(3
‑
(苯基硼酸频哪醇酯)四氢
‑
2h
‑
吡喃)
‑4‑
羧酸乙酯偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物35,ms m/z:672(m 1)
.
[0336]
实施例36化合物36的制备
[0337][0338]
参照中间体1和实施例22中的方法,以中间体z
‑
16
‑
b为原料,经过酰胺化、还原、成咪唑环、nh上trityl保护基、溴代、与3
‑
(3
‑
(苯基硼酸频哪醇酯)苯基)
‑
氧杂环丁烷)
‑3‑
羧酸乙酯偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,水解,最后与(r)
‑
n
‑
甲基丙氨酰胺缩合即可得到化合物36,ms m/z:644(m 1)
.
[0339]
实施例37化合物37的制备
[0340][0341]
参照实施例22中的方法,以中间体4为原料,与3
‑
乙氧羰基苯硼酸偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合,水解,最后与环丙基甲胺缩合即可得到化合物37,ms m/z:461(m 1)
.
[0342]
实施例38化合物38的制备
[0343]
步骤1中间体38
‑
a1的制备
[0344][0345]
参照实施例13、实施例22中的方法,以中间体z
‑
1为原料,与3
‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二恶英
‑2‑
基)
‑
5,6
‑
二氢吡啶
‑
1(2h)
‑
羧酸苄酯偶联,脱trityl保护,与1
‑
甲基
‑
1h
‑
吡唑
‑5‑
羧酸酯缩合即可得到中间体38
‑
a1,ms m/z:503(m 1)
.
[0346]
步骤2化合物17的制备
[0347][0348]
将中间体17
‑
a1(50mg,0.1mmol)溶于乙酸乙酯,加入10mg钯炭催化剂(含量10%),在氢气中搅拌过夜。过滤,除去催化剂。加入环丙甲基异氰酸酯(15mg,0.15mmol)和三乙胺(20mg,0.2mmol),室温反应2小时。减压浓缩,pre
‑
hplc纯化,得到化合物17(9.3mg,0.02mmol),ms m/z:468(m 1)
。
[0349]
为了说明本发明的有益效果,本发明提供以下试验例。
[0350]
试验例1 il
‑
17a酶联免疫吸附测定(elisa)实验
[0351]
通过竞争性elisa对人il
‑
17a抑制剂对受体
‑
配体结合的抑制情况进行了定量检测。将0.2μg/ml il
‑
17a(sino biological lnc.cat#12047
‑
h07b)以100μl每孔在96孔板中37度孵育30分钟。用pbst(pbs,0.05%tween
‑
20)洗板4次,每次200μl每孔,加入200μl 5%脱脂牛奶于25度摇床上孵育30分钟。准备100x浓度待测化合物,浓度从0.003μm到30μm。用pbst(pbs,0.05%tween
‑
20)洗板4次后加入89μl pbst和1μl 100x浓度待测化合物混匀后于25度预孵育10分钟。加入10μl 16nm il
‑
17r于25度摇床上孵育30分钟。洗板4次后,加入100μl抗fc标签hrp偶联抗体于25度摇床上孵育30分钟。洗板4次后,加入100μl tmb底物溶液25度避光孵育。加入20%hcl后,采用酶标仪于450nm波长检测光吸收值。
[0352]
按照上述方法对实施例制备的化合物进行去il
‑
17a抑制活性检测,试验结果见表1,其中测定各化合物的ic
50
按照说明分类,表1中:
[0353]“ ”表示ic
50
测定值小于100μm大于1μm;
[0354]“ ”表示ic
50
测定值小于1μm大于100nm;
[0355]“ ”表示ic
50
测定值小于100nm;
[0356]
表1、化合物对il
‑
17a的抑制活性
[0357]
[0358][0359]
试验表明,本发明实施例的化合物具有良好的il
‑
17a抑制活性,可以有效用于与il
‑
17a活性异常疾病的治疗。
[0360]
综上所述,本发明公开的式i所示的新化合物,表现出了良好的il
‑
17a抑制活性,为临床治疗与il
‑
17a活性异常相关的疾病提供了一种新的药用可能。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。