基于3
′‑
oh的生成诱导多色荧光编码及高通量检测dna中不同糖苷酶的荧光分析方法
技术领域
1.本发明属于生物检测技术领域,具体涉及一种基于3
′‑
oh的生成诱导多色荧光编码及高通量检测dna中不同糖苷酶的荧光分析方法。
背景技术:
2.dna损伤是生命过程中的一个自发过程,将会导致基因组不稳定、发育障碍、过早衰老和/或癌症。不同dna糖苷酶可发起异常碱基切除修复(base excision repair,ber),从dna链中剪除受损碱基,维持基因组的稳定性,预防人类疾病。然而,异常活性的dna糖苷酶会干扰修复过程,导致各种疾病,如人类免疫缺陷、bloom综合征和癌症。因此,dna糖苷酶是一类有价值的疾病标志物。最近,越来越多的证据表明,某种特定dna糖苷酶的异常表达可能与各种疾病有关,或一种疾病可能与几种dna糖苷酶活性异常有关,例如,dna糖苷酶在多种人类癌细胞中都有过表达,如人类宫颈癌hela、肝癌hepg2、乳腺癌细胞(mcf
‑
7)。具体而言,人类细胞尿嘧啶dna糖苷酶(udg)活性异常,可能导致尿嘧啶切除修复功能异常,导致衰老、神经退行性变、癌症等。另一方面,尿嘧啶dna糖苷酶(udg)和人类烷基腺嘌呤dna糖苷酶(haag)在a549细胞和hela细胞中的活性较高。因此,有必要同时对多种dna糖苷酶进行分析,为癌症的早期诊断和疗效监测提供有力证据。
3.近年来,已发展了多种检测dna糖苷酶活性的新方法,如比色法、荧光法和电化学发光法。但方法的灵敏度低,且涂覆电极的过程比较复杂。为提高检测灵敏度,发展了多种等温级联信号扩增方法,如t7外切酶介导信号扩增、tdt聚合酶辅助信号扩增、滚环扩增(rca)等检测方法,但这些方法只能检测单一dna糖苷酶。到目前为止,科学家已经开发了几种同时检测多种dna糖苷酶的方法。例如,zhang等报道了分别同时检测hogg1和haag、hogg1和udg、haag和udg糖苷酶的单分子方法。虽然单分子方法可以同时高灵敏检测多种dna糖基酶,但单分子仪器价格昂贵,难以大规模推广。现有的荧光分析方法虽然能够同时检测两种dna糖苷酶的活性,但核酸链设计复杂,引入的lambda核酸外切酶存在非特异性消解,且荧光信号猝灭不完全,导致背景信号高。
4.为此,我们提出一种经济、简单、特异、灵敏的高通量检测dna中不同糖苷酶的荧光分析方法。
技术实现要素:
5.本发明的目的是提供一种基于3
′‑
oh的生成诱导多色荧光编码及高通量检测dna中不同糖苷酶的荧光分析方法,以解决现有dna糖基酶检测中核酸链设计复杂,引入的lambda核酸外切酶存在非特异性消解,荧光信号猝灭不完全,导致背景信号高的问题。
6.为实现上述目的,本发明提供如下技术方案:
7.所述3
′‑
oh的生成以及诱导多色荧光编码方法包括以下步骤:
8.s1:发夹底物dna、udg信号探针、haag信号探针dna的选取:
9.s2:对步骤s1中选取的发夹底物进行dna的退火;
10.s3:利用udg和haag分别对退火后的发夹底物中尿嘧啶和次黄嘌呤的特异性识别,切断n
‑
糖苷键从而释放受损碱基,生成ap位点;ap位点被核酸内切酶endo iv切割后分别形成两条3
′‑
oh末端的dna单链;
11.s4:利用tdt末端转移酶和dttp对步骤s3中形成的两条dna单链末端进行延伸,生成聚t核酸链;
12.s5:endo iv辅助循环:将步骤s4中形成的两条dna单链分别与udg信号探针和haag信号探针杂交形成部分互补双链,随后利用endo iv识别并切割双链上信号探针的ap位点。
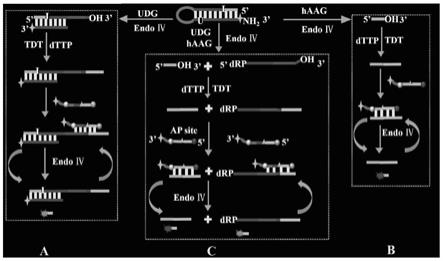
13.进一步地,所述步骤s1中,发夹底物的茎部含有21对完全互补的碱基,环部由12个碱基组成;距离5
′
端7个碱基的位置为haag识别的次黄嘌呤碱基,距离3
′
末端17个碱基的位置为udg识别的尿嘧啶碱基。
14.优选地,所述发夹底物的3
′
末端用nh2修饰,udg信号探针的两端分别用fam和bhq1标记,中间位置含有ap位点,由于发生荧光共振能量转移,信号探针以单链存在时,荧光猝灭,信号探针可与其对应的延伸产物杂化形成部分互补双链。
15.优选地,所述haag信号探针的两端分别用cy5和bhq3标记,中间位置具有ap位点,由于发生荧光共振能量转移,信号探针以单链存在时,荧光猝灭,且信号探针与其对应的延伸产物杂化形成部分互补的双链。
16.进一步地,所述步骤s5中,对双链上信号探针的ap位点切割后使得fam和cy5荧光信号恢复,且释放出与荧光探针互补的dna延伸产物,释放出的dna延伸产物继续与新的信号探针杂交形成双链,发生杂交
‑
剪切
‑
释放的循环过程,使得荧光信号增强。
17.进一步地,所述发夹底物的dna序列为:cga ttc gig gca gca aca gtg gtg cat agt gga cac ugt tgc tgc ctc gaa tcg,其中u和i分别代表尿嘧啶
‑
dna糖苷酶udg和人类烷基腺嘌呤dna糖苷酶haag的识别位点。
18.进一步地,所述udg信号探针的dna序列为:fam
‑
aaaaaaaaaxgtgtccac
‑
bhq1,其中x为ap位点。
19.进一步地,所述haag信号探针的dna序列为:cy5
‑
aaaaaaaaaxcgaatcg
‑
bhq3,其中x为ap位点。
20.进一步地,所述高通量检测dna中不同糖苷酶的荧光分析方法,包括以下步骤:
21.d1:通过退火制备发夹底物,将发夹底物、thermopol缓冲、udg缓冲、bsa、endo iv、不同浓度的udg和haag进行混合,在37℃反应90min;
22.d2:将步骤d1中的部分产物与末端转移酶tdt缓冲、cocl2、dttps、tdt、endo iv、udg信号探针和haag信号探针进行混合,在37℃反应90min;
23.d3:将d2中得到的产物分别在490nm和640nm的激发波长下测定荧光强度。
24.优选地,所述步骤d1中发夹底物dna的终浓度为100
‑
1000nm,udg信号探针在缓冲溶液中的终浓度为0.25
‑
0.75μm,且保证haag1信号探针在缓冲溶液中的最终浓度为0.75
‑
1.25μm。
25.优选地,所述步骤d2中,末端转移酶tdt在缓冲液中的最终浓度为100
‑
500u/ml,dttps在缓冲液中的最终浓度为500μm,endo iv在缓冲液中的最终浓度为150
‑
350u/ml。
26.优选地,所述步骤d2中,末端转移酶tdt催化脱氧核苷酸添加到dna分子的3
′‑
oh末
端,且催化作用不需要模板,udg催化dna底物链上的尿嘧啶然后释放尿嘧啶,haag催化dna底物双链上受损碱基位点,haag催化n
‑
糖苷键的水解断裂,释放受损碱基,endo iv是一个脱嘌呤/脱嘧啶(ap)核酸内切酶,endo iv切割双链dna上完整ap位点的5
′
端的第一个磷酸二酯键,产生3
′
羟基和5
′
脱氧核糖磷酸末端。
27.进一步地,所述的受损碱基位点包括3
‑
甲基腺嘌呤、7
‑
甲基鸟嘌呤、1,n6
‑
乙烯基腺嘌呤和次黄嘌呤。
28.综上所述,由于采用了上述技术方案,本发明的有益技术效果是:
29.本发明的有益效果在于检测过程操作简单,可同时高灵敏检测两种dna糖苷酶。
附图说明
30.图1:基于tdt激活的endoiv
‑
辅助的信号扩增方法同时检测udg和haag活性的原理示意图;(a)udg;(b)haag;(c)udg和haag。
31.图2:可行性分析:非变性聚丙烯酰胺凝胶电泳表征分析udg和haag糖苷酶活性:(a):条带1:发夹底物;条带2:发夹底物 haag endo iv;条带3:发夹底物 udg endo iv;条带4:发夹底物 haag udg endo iv;(b):条带1:发夹底物;条带2:发夹底物 haag endo iv tdt dttps;条带3:发夹底物 udg endo iv tdt dttps;条带4:发夹底物 haag udg endo iv tdt dttps;(c)不同条件下检测udg糖苷酶的荧光光谱图:红线:存在udg;黑线:不存在udg;(d)不同条件下检测haag糖苷酶的荧光光谱图:红线:存在haag;黑线:不存在haag;(e)不同条件下检测udg haag糖苷酶的荧光光谱图:红线:存在udg haag;黑线:不存在udg haag。
32.图3:实验条件优化:(a)末端转移酶tdt用量对f/f0的影响;(b)endo iv用量对f/f0的影响;(c)扩增反应时间对f/f0的影响(黑线和蓝线表明没有udg和haag;红线和紫线表明存在udg和haag);(d)udg信号探针浓度对f/f0的影响;(e)haag信号探针浓度对f/f0的影响。
33.图4:检测udg和haag糖苷酶活性的荧光变化图:(a)不同浓度的udg对应的荧光光谱图;(b)荧光强度与udg浓度对数值之间的线性关系;(c)不同浓度的haag对应的荧光光谱图;(d)荧光强度与haag浓度对数值之间的线性关系。
34.图5:不同的糖苷酶以及其它蛋白对荧光强度的影响。
35.图6:酶动力学参数的评价(a)在4u/ml udg存在下,起始反应速率与底物浓度之间的关系;(b)在8u/ml haag存在下,起始反应速率与底物浓度之间的关系。
36.图7:检测实际样品中udg和haag荧光强度图;(a)检测不同细胞样品中udg和haag糖苷酶活性;(b)荧光强度与hela细胞核蛋白提取液中总蛋白浓度对数值的线性关系(udg);(c)荧光强度与hela细胞核蛋白提取液中总蛋白浓度对数值的线性关系(haag)。
具体实施方式
37.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
38.本实验中用到的试剂和仪器:尿嘧啶
‑
dna糖苷酶(udg)、人类烷基腺嘌呤dna糖苷
酶(haag)、核酸内切酶iv(endo iv)、10
×
bsa、10
×
thermopol缓冲(200mm tris
‑
hcl,100mm(nh4)2so4,100mm kcl,20mm mgso4,1%triton x
‑
100,ph 8.8),10
×
tdt缓冲、10
×
udg缓冲(200mm tris
‑
hcl,10mm dtt,10mm edta,ph 8.0)均从neb购买,脱氧核苷酸dttp和所有的寡核苷酸(见表1)从上海生工购买,sybr gold购买于赛默飞世尔科技,实验所需的超纯水都来自于纯水净化系统18202v axl(重庆,中国),rf
‑
5301pc型荧光分光光度计(岛津,日本)。
39.尿嘧啶
‑
dna糖苷酶udg和人类烷基腺嘌呤dna糖苷酶haag活性分析:
40.底物dna链用95℃水浴退火5min,然后自然冷却至室温,最终形成浓度为5μm的双功能发夹底物;在20μl的剪切反应体系中分别加入0.5μm发夹底物,包括1.0mg/ml bsa、10
×
thermopol缓冲、10
×
udg缓冲、5u endo iv、不同浓度的udg和haag,在37℃反应90min。然后在20μl的反应体系中,加入4μl的上述剪切产物,包括2μl 10
×
tdt缓冲、cocl2、0.55μm udg信号探针、1.15μm haag信号探针、4u endo iv、10u tdt、dttps,在37℃下反应90min。最后在490nm和640nm的激发波长下测定荧光强度。
41.凝胶电泳分析:
42.凝胶电泳用于验证该实验方法的可性行。在凝胶电泳分析中,除了4u/ml的udg和20u/ml的haag,剪切反应产物和延伸反应产物样品中所有的成分和上述实验相同。用15%非变性聚丙烯酰胺凝胶电泳(page)(15%丙烯酰胺,1
×
tbe缓冲,0.1%过硫酸铵和0.2%n,n,n’,n
’‑
四甲基乙二胺)在1
×
tbe缓冲液(9mmtris
‑
hcl,9mm硼酸和0.2mm edta,ph7.9)中对剪切反应产物和延伸反应产物样品分别进行分离。在室温条件下恒压120v进行40min,以1
×
sybr gold为荧光指示剂染色10min。
43.选择性和特异性分析:
44.为了考察该分析方法的选择性,选择fpg和fen1作为干扰物质。选择性实验中除了使用20u/ml的fpg和2.0u/ml的fen1代替尿嘧啶
‑
dna糖苷酶udg和人类烷基腺嘌呤dna糖苷酶haag,其余的步骤与上述操作相同。
45.细胞培养:
46.hela细胞和正常人肾脏上皮细胞293t在dmem培养基中培养(invitrogen公司,美国),然后添加15%胎牛血清(sigma
‑
aldrich公司,美国);最后将细胞在含5%co2、37℃的环境中培养。培养后用核蛋白提取试剂盒提取总核蛋白(中国solarbio r0050),用ripa裂解缓冲液裂解细胞,获得总蛋白,所得上清液可用于同时检测udg和haag的活性。然后通过bca蛋白检测试剂盒定量蛋白含量(p0009,beyotime biotech,上海,中国),在提取的蛋白中加入不同体积的无菌水稀释至所需浓度。最后,将2μl不同浓度的蛋白质与反应液混合进行反应,对真实复杂样品中udg和haag活性进行测定。
47.实验原理:
48.(1)所提出的udg活性检测的原理如图1a所示,分析的过程主要包括3个部分:a.udg特异性识别发夹底物中的尿嘧啶并切断n
‑
糖苷键,生成ap位点;b.3
′‑
oh端的延伸;c.延伸产物诱导的荧光探针被循环剪切。首先,udg特异性识别发夹底物双链部分的u碱基,切断n
‑
糖苷键释放出受损碱基,生成ap位点,ap位点被endo iv特异性识别并切割,产生3
′‑
oh末端的核酸链。其次,在末端转移酶tdt和dttp的共同作用下,3
′‑
oh末端的核酸进行延伸反应。最后,延伸产物与udg信号探针杂交形成双链,endo iv识别并切割双链上udg信号探针
的ap位点,释放fam荧光信号。该过程反复循环,使得荧光信号不断增强。
49.(2)所提出的haag活性检测的原理如图1b所示,分析过程主要包括3个部分:a.haag特异性识别发夹底物中次黄嘌呤并切断n
‑
糖苷键,生成ap位点;b.3
′‑
oh端的延伸;c.延伸产物诱导的荧光探针被循环剪切。首先,haag特异性识别发夹底物双链部分的次黄嘌呤i碱基,切断n
‑
糖苷键释放出受损碱基,生成ap位点,ap位点被endo iv特异性识别并切割,产生3
′‑
oh末端的核酸链。其次,在末端转移酶tdt和dttp的共同作用下,3
′‑
oh末端的核酸进行延伸反应。最后,延伸产物与haag信号探针杂交形成双链,endo iv识别并切割双链上haag信号探针的ap位点,释放cy5荧光信号。该过程反复循环,使得荧光信号不断增强。
50.所提出的udg和haag活性同时检测的原理如图1c所示,分析过程主要包括3个部分:a.udg和haag同时分别识别发夹底物上的异常碱基u和i,并切断n
‑
糖苷键,生成ap位点;b.3
′‑
oh端的延伸;c.延伸产物诱导的荧光探针被循环剪切。首先,udg和haag分别特异性识别发夹底物双链上的尿嘧啶和次黄嘌呤,切断n
‑
糖苷键从而释放受损碱基,生成ap位点,ap位点被核酸内切酶endo iv切割后形成两条不同的3
′‑
oh末端的核酸单链。其次,在末端转移酶tdt和dttp的共同作用下,3
′‑
oh末端的核酸单链分别进行延伸反应。最后,两条延伸产物分别与udg信号探针和haag信号探针杂交形成双链,endo iv识别并切割双链上udg信号探针和haag信号探针的ap位点,释放fam和cy5荧光信号。该过程反复循环,使得两种荧光信号不断增强。
51.可行性分析:
52.为了证明该分析方法的可行性,采用15%的非变性聚丙烯酰胺凝胶电泳分析了剪切反应和延伸反应的产物,如图2a所示,当udg和haag都不存在时(条带1),除了发夹底物没有新的条带出现,表明没有发生反应;单独加入haag时,有新条带出现(条带2),表明切除次黄嘌呤碱基后,endo iv发生了切割反应;单独加入udg时,又有新条带出现(条带3),表明切除尿嘧啶碱基后,endo iv发生了切割反应;加入udg和haag时(条带4),同时出现两条新条带,表明同时切除尿嘧啶和次黄嘌呤碱基后,endo iv发生了切割反应。如图2b所示,当udg和haag都不存在时(条带1),除了发夹底物没有新的条带出现,表明没有发生反应;加入haag、endo iv、tdt和dttp时,有一条新条带出现(条带2),表明在tdt和dttp的共同作用下,剪切产物发生延伸聚合反应;加入udg、endo iv、tdt和dtt,有一条新条带出现(条带3),表明在tdt和dttp的共同作用下,剪切产物发生延伸聚合反应;加入haag、udg、endo iv、tdt和dttp,有两条新条带出现(条带4),表明在tdt和dttp的共同作用下,两条剪切产物分别进行延伸聚合反应。表明该方法是可行的。我们也通过荧光光谱法考察了该方法的可行性,如图2c所示,当没有加入udg(黑线),在494nm的激发波长下基本没有荧光信号,当加入udg之后(红线),荧光信号明显增强,表明该方法是可行的;如图2d所示,当没有加入haag(黑线),在640nm的激发波长下基本没有荧光信号,当加入haag之后(红线),荧光信号明显增强,表明该方法是可行的;如图2e所示,当没有加入udg和haag(黑线),在494nm和640nm的激发波长下基本没有荧光信号,当加入udg和haag之后(红线),荧光信号明显增强,表明该方法是可行的。这些结果表明,udg和haag能够有效地从发夹底物上剪切尿嘧啶和次黄嘌呤碱基,且彼此之间不干扰,进而分别启动tdt激活
‑
endo iv辅助的信号扩增。
53.分析性能的评估:
54.为了评估该方法的分析性能,最优的条件下测定了不同浓度的udg和haag糖苷酶
活性。图4a体现了不同浓度的udg糖苷酶的荧光光谱。在0.1
‑3×
10
‑4u ml
‑1的浓度范围内,随着udg糖苷酶浓度的增大,荧光强度不断增强。图4b表明荧光强度与udg糖苷酶浓度的对数呈线性关系,其检测限为5.5
×
10
‑5u ml
‑1。图4c体现了不同浓度的haag糖苷酶的荧光光谱。在0.01
‑
20u ml
‑1的浓度范围内,随着haag糖苷酶浓度的增大,荧光强度不断增强。图4d表明荧光强度与haag糖苷酶浓度的对数呈线性关系,其检测限为3.3
×
10
‑3u ml
‑1。该方法的高灵敏度主要归结于:(1)udg和haag特异性切除修复诱导的扩增反应的非特异性扩增被抑制,背景降低;(2)tdt
‑
激活endo iv
‑
辅助扩增反应的效率高
55.选择性和特异性分析:
56.为了考察该方法的选择性,选择甲酰胺嘧啶糖苷酶(fpg)和热稳定flap核酸内切酶1(fen1)作为干扰物质。fpg糖苷酶能特异性识别和切除底物dna中8
‑
oxog/c碱基对中的8
‑
羟基鸟嘌呤(8
‑
oxog)碱基。fen1酶可催化切除分叉双链dna底物中的flap结构。如图5所示,只有udg或haag或udg和haag存在时,所对应的荧光信号强于fpg、fen1存在时对应的荧光强度,说明该方法的选择性好。
57.酶动力学参数考察:
58.为了考察该方法的实际应用性能,用该方法考察了udg和haag的酶动力学参数,如图6a所示,udg的初始反应速率随着底物浓度(0
‑
300nm)的增加而增大,udg的v
max
为1.906s
‑1,km值为147.87nm;如图6b所示,haag的初始反应速率随着底物浓度(0
‑
250nm)的增加而增大,haag的v
max
为1.125s
‑1,km值为16.15nm。上述这些结果证明该方法可用于考察udg和haag的酶动力学参数。
59.实际样品分析:
60.为了考察该方法在实际样品分析中的性能,用该方法考察了hela细胞和正常人肾脏上皮细胞293t中的udg和haag糖苷酶。如图7a所示,udg和haag糖苷酶在hela细胞中的含量大于正常人肾脏上皮细胞293t中的含量,与文献报道的癌细胞中糖苷酶含量异常相符合,因此我们测定了hela细胞中两种糖苷酶的含量。如图7b所示,在494nm的激发波长下,荧光强度随着总蛋白浓度的增加而增强,且荧光强度和总蛋白浓度的对数呈线性相关。如图7c所示,在640nm的激发波长下,荧光强度随着总蛋白浓度的增加而增强,且荧光强度和总蛋白浓度的对数呈线性相关。因此,方法能够用于复杂生物样品中的udg和haag糖苷酶活性的检测。
61.以上所述为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。