先兆子痫特异性的循环rna标记
技术领域
1.本发明整体涉及用于对妊娠并发症先兆子痫进行检测和早期风险评估的方法和材料。
2.继续申请数据
3.本技术要求2019年11月22日提交的美国临时申请序列号62/939,324的权益,该临时申请以引用方式并入本文。
背景技术:
4.先兆子痫是仅在妊娠期间发生的病症,影响所有妊娠的5%至8%。它是10%至15%的母体死亡和40%的胎儿死亡的直接原因。先兆子痫的三种主要症状可以包括在妊娠第20周之后发生的高血压、手足肿胀和尿中蛋白质过量(蛋白尿)。先兆子痫的其他病征和症状可以包括由肺中的流体引起的严重头痛、视力变化(包括视力暂时丧失、视力模糊或光敏感性)、恶心或呕吐、尿排出量减少、血小板水平降低(血小板减少症)、肝功能受损和呼吸短促。
5.先兆子痫越严重并且在妊娠中发生得越早,对母亲和胎儿的风险就越大。先兆子痫可能需要引产分娩或剖腹产分娩。若不治疗,先兆子痫可能导致母亲和胎儿双方的严重、甚至致命的并发症。先兆子痫的并发症包括胎儿生长受限、出生体重低、早产、胎盘早剥、hellp综合征(溶血、肝酶升高和低血小板计数综合症)、子痫(导致癫痫发作的严重形式的先兆子痫)、器官损害(包括肾、肝、肺、心脏或眼损害)、卒中或其他脑损伤。参见例如,2018年4月3日的“preeclampsia
‑
symptoms and causes
‑
mayo clinic”,该文献可在万维网上以链接mayoclinic.org/diseases
‑
conditions/preeclampsia/symptoms
‑
causes/syc
‑
20355745获得。
6.就早期检测和治疗而言,如果早期检测到先兆子痫并且用常规的产前护理进行治疗,则大多数妇女可以分娩健康的婴儿。虽然各种蛋白质生物标志物在症状发生前阶段显示母体血清中的水平变化,但是这些生物标志物在个体患者中缺乏辨别力和预测力(karumanchi和granger,2016,hypertension;67(2):238
–
242)。因此,用于先兆子痫早期检测的生物标志物的识别对于先兆子痫的早期诊断和治疗至关重要。
技术实现要素:
7.本发明包括在怀孕女性中检测先兆子痫和/或确定先兆子痫风险升高的方法,该方法包括:
8.在从所述怀孕妇女获得的生物样品中识别多个循环rna(c
‑
rna)分子;
9.其中选自下列的多个c
‑
rna分子指示所述怀孕妇女中的先兆子痫和/或先兆子痫风险升高:
10.(a)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八
者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、至多全部七十五者的蛋白质的至少一部分的多个c
‑
rna分子:arrdc2、jun、skil、atp13a3、pde8b、gsta3、pappa2、tiparp、lep、rgp1、usp54、clec4c、mrps35、arhgef25、cux2、heatr9、fstl3、ddi2、zmym6、st6galnac3、gbp2、nes、etv3、adam17、atoh8、slc4a3、traf3ip1、ttc21a、heg1、aste1、tmem108、enc1、scamp1、arrdc3、slc26a2、slit3、clic5、tnfrsf21、ppp1r17、tpst1、gatsl2、spdye5、hipk2、mtrnr2l6、clcn1、gins4、crh、c10orf2、trub1、prg2、acy3、far2、cd63、ckap4、tpcn1、rnf6、thtpa、fos、parn、orai3、elmo3、smpd3、serpinf1、tmem11、psmd11、ebi3、clec4m、ccdc151、cpamd8、cnfn、lilra4、ada、c22orf39、pi4kap1和arfgap3;或者
11.(b)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、或全部二十七者的蛋白质的至少一部分的多个c
‑
rna分子:timp4、flg、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、clec4c、krt5、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes和vsig4;或者
12.(c)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、至多全部一百二十二者的蛋白质的至少一部分的多个c
‑
rna分子:cyp26b1、irf6、myh14、podxl、ppp1r3c、sh3rf2、tmc7、znf366、adcy1、c6、fam219a、hao2、igip、il1r2、ntrk2、sh3pxd2a、ssuh2、sult2a1、fmo3、fstl3、gata5、htra1、c8b、h19、mn1、nfe2l1、prdm16、ap3b2、emp1、flnc、stag3、cpb2、tenc1、rp1l1、a1cf、npr1、tek、errfi1、arhgef15、cd34、rspo3、alpk3、samd4a、zcchc24、leap2、myl2、nrg3、zbtb16、serpina3、aqp7、srpx、uaca、ano1、fkbp5、scn5a、ptpn21、cacna1c、erg、sox17、wwtr1、aif1l、ca3、hrg、tat、aqp7p1、adra2c、synpo、fn1、gpr116、krt17、azgp1、bcl6b、kif1c、clic5、gpr4、gja5、olah、c14orf37、zeb1、jag2、kif26a、apold1、pnmt、myom3、pitpnm3、timp4、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes、vsig4、hbg2、cadm2、lamp5、ptgdr2、nomo1、nxf3、pld4、bpifb3、pacsin1、cux2、flg、clec4c和krt5;
或者
13.(d)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、或全部三十者的蛋白质的至少一部分的多个c
‑
rna分子:vsig4、adamts2、nes、fam107a、lep、daam2、arhgef25、timp3、prx、alox15b、hspa12b、igfbp5、clec4c、slc9a3r2、adamts1、sema3g、krt5、amph、prg2、pappa2、tead4、crh、pitpnm3、timp4、pnmt、zeb1、apold1、pld4、cux2和htra4;或者
14.(e)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、或全部二十六者的蛋白质的至少一部分的多个c
‑
rna分子:adamts1、adamts2、alox15b、amph、arhgef25、celf4、daam2、fam107a、hspa12b、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、pacsin1、pappa2、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4;或者
15.(f)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、或全部二十二者的蛋白质的至少一部分的多个c
‑
rna分子:adamts1、adamts2、alox15b、arhgef25、celf4、daam2、fam107a、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4;或者
16.(g)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、或全部十一者的蛋白质的至少一部分的多个c
‑
rna分子:clec4c、arhgef25、adamts2、lep、arrdc2、skil、pappa2、vsig4、arrdc4、crh和nes(在一些实施方案中,包括:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2和vsig4这七者;adamts2、arhgef25、arrdc2、clec4c、lep、pappa2、skil和vsig4这八者;adamts2、arhgef25、arrdc4、clec4c、lep、nes、skil和vsig4这八者;adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、pappa2、skil和vsig4这十者;adamts2、arhgef25、arrdc2、clec4c、lep和skil这六者;或adamts2、arhgef25、arrdc2、arrdc4、clec4c、lep、
pappa2和skil这八者);或者
17.(h)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、或全部二十四者的蛋白质的至少一部分的多个c
‑
rna分子:lep、pappa2、kcna5、adamts2、myom3、atp13a3、arhgef25、ada、htra4、nes、crh、acy3、pld4、sct、nox4、pacsin1、serpinf1、skil、sema3g、tiparp、lrrc26、phex、lilra4和per1;或者
18.(i)编码选自实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者的蛋白质的至少一部分的多个c
‑
rna分子;或者
19.(j)编码选自下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者的蛋白质的至少一部分的多个c
‑
rna分子:akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768。
20.本发明包括在怀孕女性中检测先兆子痫和/或确定先兆子痫风险升高的方法,该方法包括:
21.从所述怀孕女性获得生物样品;
22.从所述生物样品中纯化循环rna(c
‑
rna)分子群;
23.识别由经纯化的c
‑
rna分子群内的所述c
‑
rna分子编码的蛋白质编码序列;
24.其中编码选自下列的蛋白质的至少一部分的由所述c
‑
rna分子编码的蛋白质编码序列指示所述怀孕妇女中的先兆子痫和/或先兆子痫风险升高:
25.(a)arrdc2、jun、skil、atp13a3、pde8b、gsta3、pappa2、tiparp、lep、rgp1、usp54、clec4c、mrps35、arhgef25、cux2、heatr9、fstl3、ddi2、zmym6、st6galnac3、gbp2、nes、etv3、adam17、atoh8、slc4a3、traf3ip1、ttc21a、heg1、aste1、tmem108、enc1、scamp1、arrdc3、
slc26a2、slit3、clic5、tnfrsf21、ppp1r17、tpst1、gatsl2、spdye5、hipk2、mtrnr2l6、clcn1、gins4、crh、c10orf2、trub1、prg2、acy3、far2、cd63、ckap4、tpcn1、rnf6、thtpa、fos、parn、orai3、elmo3、smpd3、serpinf1、tmem11、psmd11、ebi3、clec4m、ccdc151、cpamd8、cnfn、lilra4、ada、c22orf39、pi4kap1和arfgap3中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何五十者或更多者、任何七十者或更多者、或全部七十五者;或者
26.(b)timp4、flg、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、clec4c、krt5、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、或全部二十七者;或者
27.(c)cyp26b1、irf6、myh14、podxl、ppp1r3c、sh3rf2、tmc7、znf366、adcy1、c6、fam219a、hao2、igip、il1r2、ntrk2、sh3pxd2a、ssuh2、sult2a1、fmo3、fstl3、gata5、htra1、c8b、h19、mn1、nfe2l1、prdm16、ap3b2、emp1、flnc、stag3、cpb2、tenc1、rp1l1、a1cf、npr1、tek、errfi1、arhgef15、cd34、rspo3、alpk3、samd4a、zcchc24、leap2、myl2、nrg3、zbtb16、serpina3、aqp7、srpx、uaca、ano1、fkbp5、scn5a、ptpn21、cacna1c、erg、sox17、wwtr1、aif1l、ca3、hrg、tat、aqp7p1、adra2c、synpo、fn1、gpr116、krt17、azgp1、bcl6b、kif1c、clic5、gpr4、gja5、olah、c14orf37、zeb1、jag2、kif26a、apold1、pnmt、myom3、pitpnm3、timp4、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes、vsig4、hbg2、cadm2、lamp5、ptgdr2、nomo1、nxf3、pld4、bpifb3、pacsin1、cux2、flg、clec4c和krt5中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何五十者或更多者、任何七十五者或更多者、任何一百者或更多者、或全部一百二十二者;或者
28.(d)vsig4、adamts2、nes、fam107a、lep、daam2、arhgef25、timp3、prx、alox15b、hspa12b、igfbp5、clec4c、slc9a3r2、adamts1、sema3g、krt5、amph、prg2、pappa2、tead4、crh、pitpnm3、timp4、pnmt、zeb1、apold1、pld4、cux2和htra4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、或全部三十者;或者
29.(e)adamts1、adamts2、alox15b、amph、arhgef25、celf4、daam2、fam107a、hspa12b、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、pacsin1、pappa2、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、或全部二十六者;或者
30.(f)adamts1、adamts2、alox15b、arhgef25、celf4、daam2、fam107a、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、或全部二十二者;或者
31.(g)clec4c、arhgef25、adamts2、lep、arrdc2、skil、pappa2、vsig4、arrdc4、crh和nes中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、或全部十一者(在一些实施方案中,包括:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2和vsig4这七者;adamts2、arhgef25、arrdc2、clec4c、lep、pappa2、skil和vsig4这八者;adamts2、arhgef25、arrdc4、clec4c、lep、nes、skil和vsig4这八者;adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、pappa2、skil和vsig4这十者;adamts2、arhgef25、arrdc2、clec4c、lep和skil这六者;或adamts2、arhgef25、arrdc2、arrdc4、clec4c、lep、pappa2和skil这八者);或者
32.(h)lep、pappa2、kcna5、adamts2、myom3、atp13a3、arhgef25、ada、htra4、nes、crh、acy3、pld4、sct、nox4、pacsin1、serpinf1、skil、sema3g、tiparp、lrrc26、phex、lilra4和
per1中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、或全部二十四者;或者
33.(i)实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者;或者
34.(j)akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者。
35.在一些方面,识别由生物样品内的c
‑
rna分子编码的蛋白质编码序列包括杂交、逆转录酶pcr、微阵列芯片分析或测序。
36.在一些方面,识别由生物样品内的c
‑
rna分子编码的蛋白质编码序列包括测序,包括例如克隆扩增分子的大规模平行测序和/或rna测序。
37.在一些方面,该方法还包括从生物样品中去除完整细胞;用脱氧核酸酶(dna酶)处理所述生物样品以去除无细胞dna(cfdna);由所述生物样品中的c
‑
rna分子合成互补dna(cdna);以及/或者在识别由所述循环rna(c
‑
rna)分子编码的蛋白质编码序列之前,通过外显子组富集来富集所述cdna序列中的编码蛋白质的dna序列。
38.本发明包括在怀孕女性中检测先兆子痫和/或确定先兆子痫风险升高的方法,该方法包括:
39.从所述怀孕女性获得生物样品;
40.从所述生物样品中去除完整细胞;
41.用脱氧核酸酶(dna酶)处理所述生物样品以去除无细胞dna(cfdna);
42.由所述生物样品中的rna分子合成互补dna(cdna);
43.富集所述cdna序列中的编码蛋白质的dna序列(外显子组富集);
44.对所得的富集的cdna序列进行测序;以及
45.识别由富集的c
‑
rna分子编码的蛋白质编码序列;
46.其中编码选自下列的蛋白质的至少一部分的由所述c
‑
rna分子编码的蛋白质编码序列指示所述怀孕妇女中的先兆子痫和/或先兆子痫风险升高:
47.(a)arrdc2、jun、skil、atp13a3、pde8b、gsta3、pappa2、tiparp、lep、rgp1、usp54、clec4c、mrps35、arhgef25、cux2、heatr9、fstl3、ddi2、zmym6、st6galnac3、gbp2、nes、etv3、adam17、atoh8、slc4a3、traf3ip1、ttc21a、heg1、aste1、tmem108、enc1、scamp1、arrdc3、slc26a2、slit3、clic5、tnfrsf21、ppp1r17、tpst1、gatsl2、spdye5、hipk2、mtrnr2l6、clcn1、gins4、crh、c10orf2、trub1、prg2、acy3、far2、cd63、ckap4、tpcn1、rnf6、thtpa、fos、parn、orai3、elmo3、smpd3、serpinf1、tmem11、psmd11、ebi3、clec4m、ccdc151、cpamd8、cnfn、lilra4、ada、c22orf39、pi4kap1和arfgap3中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、至多全部七十五者;或者
48.(b)timp4、flg、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、clec4c、krt5、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、或全部二十七者;或者
49.(c)cyp26b1、irf6、myh14、podxl、ppp1r3c、sh3rf2、tmc7、znf366、adcy1、c6、fam219a、hao2、igip、il1r2、ntrk2、sh3pxd2a、ssuh2、sult2a1、fmo3、fstl3、gata5、htra1、c8b、h19、mn1、nfe2l1、prdm16、ap3b2、emp1、flnc、stag3、cpb2、tenc1、rp1l1、a1cf、npr1、tek、errfi1、arhgef15、cd34、rspo3、alpk3、samd4a、zcchc24、leap2、myl2、nrg3、zbtb16、serpina3、aqp7、srpx、uaca、ano1、fkbp5、scn5a、ptpn21、cacna1c、erg、sox17、wwtr1、aif1l、ca3、hrg、tat、aqp7p1、adra2c、synpo、fn1、gpr116、krt17、azgp1、bcl6b、kif1c、clic5、gpr4、gja5、olah、c14orf37、zeb1、jag2、kif26a、apold1、pnmt、myom3、pitpnm3、timp4、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes、vsig4、hbg2、cadm2、lamp5、ptgdr2、nomo1、nxf3、pld4、bpifb3、pacsin1、cux2、flg、clec4c和krt5中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更
多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、至多全部一百二十二者;或者
50.(d)vsig4、adamts2、nes、fam107a、lep、daam2、arhgef25、timp3、prx、alox15b、hspa12b、igfbp5、clec4c、slc9a3r2、adamts1、sema3g、krt5、amph、prg2、pappa2、tead4、crh、pitpnm3、timp4、pnmt、zeb1、apold1、pld4、cux2和htra4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、或全部三十者;或者
51.(e)adamts1、adamts2、alox15b、amph、arhgef25、celf4、daam2、fam107a、hspa12b、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、pacsin1、pappa2、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、或全部二十六者;或者
52.(f)adamts1、adamts2、alox15b、arhgef25、celf4、daam2、fam107a、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、或全部二十二者;或者
53.(g)clec4c、arhgef25、adamts2、lep、arrdc2、skil、pappa2、vsig4、arrdc4、crh和nes中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、或全部十一者(在一些实施方案中,包括:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2和vsig4这七者;adamts2、arhgef25、arrdc2、clec4c、lep、pappa2、skil和vsig4这八者;adamts2、arhgef25、arrdc4、clec4c、lep、nes、skil和vsig4这
八者;adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、pappa2、skil和vsig4这十者;adamts2、arhgef25、arrdc2、clec4c、lep和skil这六者;或adamts2、arhgef25、arrdc2、arrdc4、clec4c、lep、pappa2和skil这八者);或者
54.(h)lep、pappa2、kcna5、adamts2、myom3、atp13a3、arhgef25、ada、htra4、nes、crh、acy3、pld4、sct、nox4、pacsin1、serpinf1、skil、sema3g、tiparp、lrrc26、phex、lilra4和per1中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、或全部二十四者;或者
55.(i)实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者;或者
56.(j)akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者。
57.本发明包括识别与先兆子痫风险升高相关联的循环rna标记的方法,该方法包括从所述怀孕女性获得生物样品;从所述生物样品中去除完整细胞;用脱氧核酸酶(dna酶)处理所述生物样品以去除无细胞dna(cfdna);由所述生物样品中的rna分子合成互补dna(cdna);富集所述cdna序列中的编码蛋白质的dna序列(外显子组富集);对所得的富集的cdna序列进行测序;以及识别由富集的c
‑
rna分子编码的蛋白质编码序列。
58.本发明包括一种方法,该方法包括:
59.从所述怀孕女性获得生物样品;
60.从所述生物样品中去除完整细胞;
61.用脱氧核酸酶(dna酶)处理所述生物样品以去除无细胞dna(cfdna);
62.由所述生物样品中的rna分子合成互补dna(cdna);
63.富集所述cdna序列中的编码蛋白质的dna序列(外显子组富集);
64.对所得的富集的cdna序列进行测序;以及
65.识别由所述富集的c
‑
rna分子编码的蛋白质编码序列;
66.其中所述蛋白质编码序列包括选自如下的蛋白质的至少一部分:
67.(a)arrdc2、jun、skil、atp13a3、pde8b、gsta3、pappa2、tiparp、lep、rgp1、usp54、clec4c、mrps35、arhgef25、cux2、heatr9、fstl3、ddi2、zmym6、st6galnac3、gbp2、nes、etv3、adam17、atoh8、slc4a3、traf3ip1、ttc21a、heg1、aste1、tmem108、enc1、scamp1、arrdc3、slc26a2、slit3、clic5、tnfrsf21、ppp1r17、tpst1、gatsl2、spdye5、hipk2、mtrnr2l6、clcn1、gins4、crh、c10orf2、trub1、prg2、acy3、far2、cd63、ckap4、tpcn1、rnf6、thtpa、fos、parn、orai3、elmo3、smpd3、serpinf1、tmem11、psmd11、ebi3、clec4m、ccdc151、cpamd8、cnfn、lilra4、ada、c22orf39、pi4kap1和arfgap3中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者、至多全部七十五者;或者
68.(b)timp4、flg、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、clec4c、krt5、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、或全部二十七者;或者
69.(c)cyp26b1、irf6、myh14、podxl、ppp1r3c、sh3rf2、tmc7、znf366、adcy1、c6、fam219a、hao2、igip、il1r2、ntrk2、sh3pxd2a、ssuh2、sult2a1、fmo3、fstl3、gata5、htra1、c8b、h19、mn1、nfe2l1、prdm16、ap3b2、emp1、flnc、stag3、cpb2、tenc1、rp1l1、a1cf、npr1、tek、errfi1、arhgef15、cd34、rspo3、alpk3、samd4a、zcchc24、leap2、myl2、nrg3、zbtb16、serpina3、aqp7、srpx、uaca、ano1、fkbp5、scn5a、ptpn21、cacna1c、erg、sox17、wwtr1、aif1l、ca3、hrg、tat、aqp7p1、adra2c、synpo、fn1、gpr116、krt17、azgp1、bcl6b、kif1c、clic5、gpr4、gja5、olah、c14orf37、zeb1、jag2、kif26a、apold1、pnmt、myom3、pitpnm3、timp4、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes、vsig4、hbg2、cadm2、lamp5、ptgdr2、nomo1、nxf3、pld4、bpifb3、pacsin1、cux2、flg、clec4c和krt5中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何
五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、至多全部一百二十二者;或者
70.(d)vsig4、adamts2、nes、fam107a、lep、daam2、arhgef25、timp3、prx、alox15b、hspa12b、igfbp5、clec4c、slc9a3r2、adamts1、sema3g、krt5、amph、prg2、pappa2、tead4、crh、pitpnm3、timp4、pnmt、zeb1、apold1、pld4、cux2和htra4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、或全部三十者;或者
71.(e)adamts1、adamts2、alox15b、amph、arhgef25、celf4、daam2、fam107a、hspa12b、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、pacsin1、pappa2、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、或全部二十六者;或者
72.(f)adamts1、adamts2、alox15b、arhgef25、celf4、daam2、fam107a、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、或全部二十二者;或者
73.(g)clec4c、arhgef25、adamts2、lep、arrdc2、skil、pappa2、vsig4、arrdc4、crh和nes中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、或全部十一者(在一些实施方案中,包括:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2和vsig4这七者;adamts2、arhgef25、arrdc2、clec4c、lep、
pappa2、skil和vsig4这八者;adamts2、arhgef25、arrdc4、clec4c、lep、nes、skil和vsig4这八者;adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、pappa2、skil和vsig4这十者;adamts2、arhgef25、arrdc2、clec4c、lep和skil这六者;或adamts2、arhgef25、arrdc2、arrdc4、clec4c、lep、pappa2和skil这八者);或者
74.(h)lep、pappa2、kcna5、adamts2、myom3、atp13a3、arhgef25、ada、htra4、nes、crh、acy3、pld4、sct、nox4、pacsin1、serpinf1、skil、sema3g、tiparp、lrrc26、phex、lilra4和per1中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、或全部二十四者;或者
75.(i)实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者;或者
76.(j)akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者。
77.在一些方面,该生物样品包括血浆。
78.在一些方面,该生物样品是从妊娠期不足16周或妊娠期不足20周的怀孕女性获得的。
79.在一些方面,该生物样品是从妊娠期超过20周的怀孕女性获得的。
80.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码arrdc2、jun、skil、atp13a3、pde8b、gsta3、pappa2、tiparp、lep、rgp1、usp54、clec4c、mrps35、arhgef25、cux2、heatr9、fstl3、ddi2、zmym6、st6galnac3、gbp2、nes、etv3、adam17、atoh8、slc4a3、traf3ip1、ttc21a、heg1、aste1、tmem108、enc1、scamp1、arrdc3、slc26a2、
slit3、clic5、tnfrsf21、ppp1r17、tpst1、gatsl2、spdye5、hipk2、mtrnr2l6、clcn1、gins4、crh、c10orf2、trub1、prg2、acy3、far2、cd63、ckap4、tpcn1、rnf6、thtpa、fos、parn、orai3、elmo3、smpd3、serpinf1、tmem11、psmd11、ebi3、clec4m、ccdc151、cpamd8、cnfn、lilra4、ada、c22orf39、pi4kap1和arfgap3中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何五十者或更多者、任何七十者或更多者、至多全部七十五者的至少一部分。
81.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码timp4、flg、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、clec4c、krt5、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、或全部二十七者的至少一部分。
82.本发明包括针对先兆子痫风险升高的循环rna(c
‑
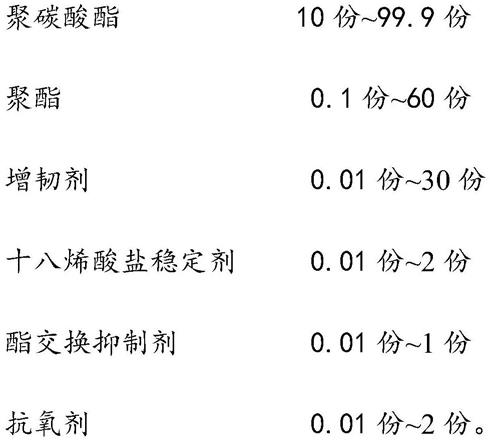
rna)标记,该c
‑
rna标记编码cyp26b1、irf6、myh14、podxl、ppp1r3c、sh3rf2、tmc7、znf366、adcy1、c6、fam219a、hao2、igip、il1r2、ntrk2、sh3pxd2a、ssuh2、sult2a1、fmo3、fstl3、gata5、htra1、c8b、h19、mn1、nfe2l1、prdm16、ap3b2、emp1、flnc、stag3、cpb2、tenc1、rp1l1、a1cf、npr1、tek、errfi1、arhgef15、cd34、rspo3、alpk3、samd4a、zcchc24、leap2、myl2、nrg3、zbtb16、serpina3、aqp7、srpx、uaca、ano1、fkbp5、scn5a、ptpn21、cacna1c、erg、sox17、wwtr1、aif1l、ca3、hrg、tat、aqp7p1、adra2c、synpo、fn1、gpr116、krt17、azgp1、bcl6b、kif1c、clic5、gpr4、gja5、olah、c14orf37、zeb1、jag2、kif26a、apold1、pnmt、myom3、pitpnm3、timp4、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes、vsig4、hbg2、cadm2、lamp5、ptgdr2、nomo1、nxf3、pld4、bpifb3、pacsin1、cux2、flg、clec4c和krt5中的多者的至少一部分。
83.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码vsig4、adamts2、nes、fam107a、lep、daam2、arhgef25、timp3、prx、alox15b、hspa12b、igfbp5、clec4c、slc9a3r2、adamts1、sema3g、krt5、amph、prg2、pappa2、tead4、crh、pitpnm3、timp4、pnmt、zeb1、apold1、pld4、cux2和htra4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、
任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、或全部三十者的至少一部分。
84.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码adamts1、adamts2、alox15b、amph、arhgef25、celf4、daam2、fam107a、hspa12b、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、pacsin1、pappa2、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、或全部二十六者的至少一部分。
85.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码adamts1、adamts2、alox15b、arhgef25、celf4、daam2、fam107a、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、或全部二十二者的至少一部分。
86.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码下列中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、或全部十一者的至少一部分:clec4c、arhgef25、adamts2、lep、arrdc2、skil、pappa2、vsig4、arrdc4、crh和nes,在一些实施方案中,包括:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2和vsig4这七者;adamts2、arhgef25、arrdc2、clec4c、lep、pappa2、skil和vsig4这八者;adamts2、arhgef25、arrdc4、clec4c、lep、nes、skil和vsig4这八者;adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、pappa2、skil和vsig4这十者;adamts2、arhgef25、arrdc2、clec4c、lep和skil这六者;或adamts2、arhgef25、arrdc2、arrdc4、clec4c、lep、pappa2和skil这八者。
87.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码lep、pappa2、kcna5、adamts2、myom3、atp13a3、arhgef25、ada、htra4、nes、crh、acy3、pld4、sct、nox4、pacsin1、serpinf1、skil、sema3g、tiparp、lrrc26、phex、lilra4和per1中的任何
一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、或全部二十四者的至少一部分。
88.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者的至少一部分。
89.本发明包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记编码akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者的至少一部分。
90.本发明包括固体载体阵列,该固体载体阵列包括多种能够结合和/或识别如本文所述的c
‑
rna标记的试剂。
91.本发明包括试剂盒,该试剂盒包括多种能够结合和/或识别如本文所述的c
‑
rna标记的探针。
92.本发明包括试剂盒,该试剂盒包括多种用于选择性地扩增如本文所述的c
‑
rna标记的引物。
93.如本文所用,术语“核酸”旨在与其在本领域中的用途一致,并且包括天然存在的核酸或其功能类似物。特别有用的功能类似物能够以序列特异性方式与核酸杂交或能够用作复制特定核苷酸序列的模板。天然存在的核酸通常具有包含磷酸二酯键的主链。类似结构可具有替代的主链键,包括本领域已知的多种主链键中的任一种。天然存在的核酸通常具有脱氧核糖(例如存在于脱氧核糖核酸(dna)中)或核糖(例如存在于核糖核酸(rna)中)。核酸可包含本领域已知的这些糖部分的多种类似物中的任一种。核酸可包括天然的或非天然的碱基。就这一点而言,天然脱氧核糖核酸可以具有选自由腺嘌呤、胸腺嘧啶、胞嘧啶或
鸟嘌呤组成的组的一个或多个碱基,并且核糖核酸可以具有选自由尿嘧啶、腺嘌呤、胞嘧啶或鸟嘌呤组成的组的一个或多个碱基。可包含在核酸中的有用的非天然碱基是本领域已知的。术语“模板”和“靶”当用于提及核酸时,旨在作为本文所示的方法或组合物的上下文中核酸的语义标识符,并且不一定限制核酸的结构或功能,除非另有明确指示。
94.如本文所用,“扩增”或“扩增反应”及其派生词通常是指核酸分子的至少一部分借以被复制或拷贝到至少一个另外的核酸分子中的任何动作或过程。另外的核酸分子任选地包含与靶核酸分子的至少一些部分基本上相同或基本上互补的序列。靶核酸分子可以为单链的或双链的,并且另外的核酸分子可以独立地为单链的或双链的。扩增任选地包括线性或指数复制核酸分子。在一些实施方案中,这种扩增可使用等温条件进行;在其他实施方案中,这种扩增可包括热循环。在一些实施方案中,扩增是多重扩增,其包括在单个扩增反应中同时扩增多个靶序列。在一些实施方案中,“扩增”包括单独或组合扩增基于dna和rna的核酸的至少一些部分。扩增反应可包括本领域普通技术人员已知的任何扩增过程。在一些实施方案中,扩增反应包括聚合酶链反应(pcr)。
95.如本文所用,“扩增条件”及其派生词通常是指适于扩增一个或多个核酸序列的条件。这种扩增可以是线性的或指数的。在一些实施方案中,扩增条件可以包括等温条件,或者替代性地可以包括热循环条件,或者等温条件和热循环条件的组合。在一些实施方案中,适用于扩增一个或多个核酸序列的条件包括聚合酶链反应(pcr)条件。通常,扩增条件是指足以扩增核酸(诸如一个或多个靶序列)、或者足以扩增与一个或多个衔接子连接的扩增靶序列(例如衔接子连接的扩增靶序列)的反应混合物。一般来讲,扩增条件包括用于扩增或用于核酸合成的催化剂,例如聚合酶;与待扩增核酸具有一定程度互补性的引物;以及核苷酸,诸如脱氧核糖核苷酸三磷酸(dntp),从而一旦与核酸杂交就促进引物的延伸。扩增条件可能需要引物与核酸的杂交或退火、引物的延伸和其中延伸的引物与经历扩增的核酸序列分离的变性步骤。通常,但不是必须的,扩增条件可包括热循环;在一些实施方案中,扩增条件包括多个循环,其中重复退火、延伸和分离的步骤。通常,扩增条件包括阳离子诸如mg
或mn
,并且还可以包括各种离子强度调节剂。
96.如本文所用,术语“聚合酶链反应”(pcr)是指k.b.mullis的美国专利号4,683,195和4,683,202的方法,其描述了用于在不进行克隆或纯化的情况下增加基因组dna的混合物中感兴趣的多核苷酸的片段的浓度的方法。该扩增所关注多核苷酸的方法包括将大量过量的两种寡核苷酸引物引入包含所需所关注多核苷酸的dna混合物中,然后在存在dna聚合酶的情况下进行一系列热循环。这两种引物与感兴趣的双链多核苷酸的它们相应的链互补。首先将混合物在较高温度下变性,然后将引物与所关注多核苷酸分子内的互补序列退火。退火后,用聚合酶延伸引物以形成一对新的互补链。变性、引物退火和聚合酶延伸的步骤可重复多次(称为热循环),以获得高浓度的期望的所关注多核苷酸的扩增片段。期望的所关注多核苷酸(扩增子)的扩增片段的长度由引物相对于彼此的相对位置确定,因此,该长度是可控参数。由于重复该过程,该方法被称为“聚合酶链反应”(下文的“pcr”)。因为感兴趣的多核苷酸的期望扩增片段成为混合物中的主要核酸序列(就浓度而言),所以它们据称是“pcr扩增的”。在上述方法的修改形式中,可使用多个不同的引物对(在一些情况下,每个所关注的靶核酸分子一个或多个引物对)pcr扩增靶核酸分子,从而形成多重pcr反应。
97.如本文所用,术语“引物”及其派生词通常是指可以与感兴趣的靶序列杂交的任何
多核苷酸。通常,引物用作底物,核苷酸可以通过聚合酶聚合到该底物上;然而,在一些实施方案中,引物可掺入合成的核酸链中并提供另一引物可与之杂交的位点,以引发与合成的核酸分子互补的新链的合成。引物可包括核苷酸或其类似物的任何组合。在一些实施方案中,引物是单链寡核苷酸或多核苷酸。术语“多核苷酸”和“寡核苷酸”在本文中可互换使用,是指任何长度的核苷酸的聚合形式,并且可以包括核糖核苷酸、脱氧核糖核苷酸、它们的类似物或它们的混合物。这些术语应当理解为包括由核苷酸类似物制成的dna或rna的类似物作为等同物,并且适用于单链(诸如有义或反义)多核苷酸和双链多核苷酸。如本文所用,该术语还涵盖cdna,即由rna模板例如通过逆转录酶的作用产生的互补dna或拷贝dna。该术语仅是指分子的主要结构。因此,该术语包括三链、双链和单链脱氧核糖核酸(“dna”),以及三链、双链和单链核糖核酸(“rna”)。
98.如本文所用,术语“文库”和“测序文库”是指在其5'末端共用共同序列并且在其3'末端共用共同序列的模板分子集合或多个模板分子。在其3'末端和5'末端含有已知的共同序列的模板分子集合也可以称为3'和5'修饰文库。
99.如本文所用,术语“流通池”是指包括固体表面的室,一种或多种流体试剂可流过该固体表面。可以容易地用于本公开的方法中的流通池以及相关流体系统和检测平台的示例描述于例如以下文献中:bentley等人,nature 456:53
‑
59(2008);wo 04/018497;us 7,057,026;wo 91/06678;wo 07/123744;us 7,329,492;us 7,211,414;us 7,315,019;us 7,405,281和us 2008/0108082。
100.如本文所用,术语“扩增子”当用于提及核酸时,意指复制该核酸的产物,其中该产物具有与该核酸的核苷酸序列的至少一部分相同或互补的核苷酸序列。扩增子可以通过使用核酸或其扩增子作为模板的多种扩增方法中的任一种产生,所述扩增方法包括例如pcr、滚环扩增(rca)、连接延伸或连接链反应。扩增子可以是具有特定核苷酸序列的单拷贝(例如,pcr产物)或该核苷酸序列的多拷贝(例如,rca的串联产物)的核酸分子。靶核酸的第一扩增子通常为互补拷贝。后续的扩增子是在生成第一扩增子后,由靶核酸或由第一扩增子形成的拷贝。后续的扩增子可具有与靶核酸基本上互补或与靶核酸基本上相同的序列。
101.如本文所用,术语“阵列”是指可根据相对位置彼此区分的一组位点。位于阵列的不同位点处的不同分子可根据位点在阵列中的位置而彼此区分。阵列的单个位点可包含一种或多种特定类型的分子。例如,位点可包含具有特定序列的单个靶核酸分子,或者位点可包含具有相同序列(和/或其互补序列)的若干核酸分子。阵列的位点可以是位于同一基板上的不同特征。示例性特征包括但不限于基板中的孔、基板中或基板上的小珠(或其他颗粒)、基板的突出部、基板上的脊或基板中的通道。阵列的位点可以是各自带有不同分子的单独的基板。可根据基板在与基板相关联的表面上的位置,或者根据基板在液体或凝胶中的位置,来识别附接到单独基板的不同分子。其中单独的基板位于表面上的示例性阵列包括但不限于在孔中具有小珠的那些阵列。
102.本文中术语“下一代测序(ngs)”是指允许对克隆扩增分子和单个核酸分子进行大规模平行测序的测序方法。ngs的非限制性实例包括边连接边测序和使用可逆染料终止子的边合成边测序。
103.如本文所用,术语“灵敏度”等于真阳性的数目除以真阳性和假阴性的总和。
104.如本文所用,术语“特异性”等于真阴性的数目除以真阴性和假阳性的总和。
105.本文中的术语“富集”是指扩增样品的一部分中所包含的核酸的过程。富集包括靶向特定序列(例如多态性序列)的特异性富集,以及扩增样品dna片段的全基因组的非特异性富集。
106.如本文所用,术语“每个”当用于提及参考项目的集合时,旨在识别集合中的单个项目,但不一定是指集合中的每个项目,除非文中另外明确指出。
107.如本文所用,在组合物、制品、核酸或细胞核的上下文中,“提供”意指制备组合物、制品、核酸或细胞核,购买组合物、制品、核酸或细胞核,或以其他方式获得化合物、组合物、制品或细胞核。
108.术语“和/或”意指所列要素中的一个或全部,或所列要素中的任何两个或更多个的组合。
109.词语“优选的”和“优选地”是指在某些情况下可提供某些益处的本公开的实施方案。然而,在相同或其他情况下,其他实施方案也可以是优选的。此外,对一个或多个优选实施方案的表述并不暗示其他实施方案是不可用的,并且并非旨在将其他实施方案排除在本公开的范围之外。
110.术语“包括”及其变型在说明书和权利要求书中出现这些术语时不具有限制的含义。
111.应当理解,在本文以语言“包括”、“包含”或“含有”等描述实施方案的任何地方,还提供了以“由
…
组成”和/或“基本上由
…
组成”描述的其他类似实施方案。
112.除非另外指明,否则“一个”、“一种”、“该”和“至少一个”可互换使用,表示一个或多于一个。
113.同样在本文中,通过端点表述的数值范围包括该范围内所包含的所有数值(例如,1至5包括1、1.5、2、2.75、3、3.80、4、5等)。
114.本说明书通篇提及的“一个实施方案”、“实施方案”、“某些实施方案”或“一些实施方案”等意指结合该实施方案描述的特定特征、构型、组成或特性包括在本公开的至少一个实施方案中。因此,本说明书通篇的多处出现的此类短语不一定指本公开的相同实施方案。此外,在一个或多个实施方案中,特定特征、构型、组成或特性可以任何合适的方式组合。
115.对于本文所公开的包括离散步骤的任何方法,这些步骤可以任何可行的顺序进行。并且,视情况而定,两个或更多个步骤的任何组合可同时进行。
116.本公开的上述发明内容并非旨在描述本公开的每个所公开的实施方案或每种实施方式。以下描述更具体地举例说明了例示性实施方案。在本技术通篇的若干个位置,通过实施例的列表提供指导,这些实施例能够以各种组合来使用。在每种情况下,所列举的列表仅用作代表性的组,并且不应被理解为排他性列表。
附图说明
117.图1:胎盘健康、母体反应和胎儿反应之间的关系的示意图。
118.图2:循环rna(c
‑
rna)的起源。
119.图3:c
‑
rna的文库制备工作流程。
120.图4:通过比较妊娠第3孕期样品和非妊娠样品对c
‑
rna方法进行验证。
121.图5:使用纵向妊娠样品对c
‑
rna方法进行验证。
122.图6:临床研究的描述。
123.图7:测序数据特征。
124.图8:没有任何基因选择的pe分类,依赖于整个数据集。
125.图9:自举法(bootstrapping)的描述。
126.图10:用自举法对先兆子痫样品进行分类。
127.图11:过剩先兆子痫基因的检查。
128.图12:标准adaboost模型。
129.图13:独立队列允许进一步验证先兆子痫标记。
130.图14:标准adaboost模型在先兆子痫分类中的表现。
131.图15:用标准dex treat分析对先兆子痫进行分类。
132.图16:基因的选择和用刀切法(jackknifing)对先兆子痫进行分类。
133.图17:在独立pearl生物样品库队列中验证treat方法、自举法和刀切法。
134.图18:建立adaboost精简模型的生物信息学方法的示意图。
135.图19:adaboost精简模型所利用的基因的相对丰度及其对独立数据集的预测能力。
136.图20:使用标准treat分析和刀切法在nextera flex产生的文库中识别对于先兆子痫具有特异性的c
‑
rna标记。
137.图21:adaboost精简模型在nextera flex产生的文库上利用的基因的相对丰度及其在rgh14数据集中的预测能力。
138.图22a至图22d:临床友好的全外显子组c
‑
rna分析方法的验证。图22a为测序文库制备方法的示意图;血液收集后的所有步骤均可以在集中式处理实验室中进行。在整个妊娠过程中改变的转录物的时间变化(图22b)。在c
‑
rna妊娠进程研究中识别的基因重叠(图22c)。表达针对妊娠时间过程研究独特的91种基因的组织(图22d)。
139.图23a至图23c:pe临床研究的样品收集。分图展示了ipc研究(图23a)和pearl研究(图23b)中每位个体的血液收集时间(三角形)和出生时的胎龄(正方形)。红线指示足月出生的阈值。早产率在早发型pe队列中显著升高(图23c)。***p<0.001,通过fisher精确检验得出。
140.图24a至图24g:c
‑
rna的差异分析对先兆子痫生物标志物进行识别。pe中改变的转录物的倍数变化和丰度(图24a)。在对通过标准分析方法检测的每个基因进行刀切法之后计算单侧置信p值区间(图24b)。通过全外显子组测序和通过qpcr测定(21)个基因的转录物丰度倍数变化(图24c)。*p<0.05,通过学生t检验得出。受影响基因的组织分布(图24d)。ipc样品的分层聚类(平均连锁,平方欧几里德距离)(图24e)。来自pearl研究的早发型pe样品(图24f)和晚发型pe样品(图24g)的聚类。
141.图25a至图25e:adaboost对所有队列的先兆子痫样品进行分类。热图展示了每个队列中由机器学习所使用的转录物的相对丰度(图25a)。每个区块的高度反映每个基因的重要性。每个数据集的roc曲线(图25b)。adaboost评分的分布(kde)。橙色线指示用于区分pe和对照样品的最佳边界(图25c)。通过差异分析识别的基因与adaboost中所使用的那些基因的一致性(图25d)。adaboost基因的组织分布(图25e)。
142.图26a至图26c:当血液储存在不同的收集试管中时,c
‑
rna数据的完整性。比较先
前在不同类型的试管中储存过夜的血液中检测到的c
‑
rna妊娠标志物相对于收集在edta试管中后立即处理的丰度(图26a)。散点图比较由相同个体在不同的血液储存持续时间后制备的c
‑
rna的转录物fpkm值(图26b)。使用edta试管时,皮尔逊相关系数r更具可变性(参见无细胞)(图26c)。
143.图27a和图27b:血浆体积对c
‑
rna数据质量的影响。用来自九项独立研究的数据进行了荟萃分析,以确定该方案的适当血浆输入量。噪声(生物学变异系数,edger)由每项研究中的生物学平行测定计算得出(图27a)。计算每个样品的文库复杂度(结合群体,preseq)(图27b)。**p<0.01,***p<0.001,通过anova,进行tukey hsd校正得出,其中研究作为区组变量。
144.图28a至图28c:妊娠标志物组织特异性。饼状图示出了通过三项独立研究,使用整套改变的基因(图28a)、针对每项研究独特的转录物(图28b)或相交的基因集(图28c)在妊娠中检测到的基因的组织特异性。
145.图29a至图29e:刀切法排除了先兆子痫中未普遍改变的基因。用于确定pe样品之间转录物变化的一致性的刀切法的示意图(图29a)。每种差异丰度基因的平均丰度和噪声(图29b)。每种受影响的转录物的曲线下roc面积值提供了对照和pe样品的分离的c
‑
rna转录物的丰度分布的量度(图29c)。*p<0.05,通过曼
‑
惠特尼u检验(mann
‑
whitney u test)得出。使用刀切法后排除的基因对ipc样品进行分层聚类(图29d)。排除的转录物的组织分布(图29e)。胎儿和胎盘的贡献减少可能表明pe的母体组分在个体之间变化最大。
146.图30a至图30d:adaboost模型开发策略。将rgh014数据集分成6个部分(图30a)。“保留子集”含有10%的样品(随机选择)以及3个样品,这3个样品在使用差异丰度基因时不正确地聚类(如图24c所示),因而被完全排除在模型构建之外。将剩余的样品随机分成5个大小均匀的“测试子集”。对于每个测试子集,训练数据均由所有的非保留和非测试样品组成。将训练和测试数据的基因计数在edger中进行tmm归一化,然后标准化为对于每个基因的平均值为0且标准偏差为1。对于每个训练/测试样品集,从训练数据构建10次adaboost模型(估计量为90,学习率为1.6)(图30b)。执行特征修剪,删除低于递增重要性阈值的基因,并且在预测测试数据时通过matthew相关系数评估性能。保留了具有最佳性能(如果是平局,则基因最少)的模型。将来自所有50个独立模型的估计量合并为单个adaboost模型(图30c)。对所得的集合进行特征修剪,这次采用使用基因的模型百分比来设置阈值,以及通过测试子集的平均对数损失值测量的性能。将最终adaboost模型应用于保留数据后的roc曲线(图30d)。除了三个样品中的两个样品也通过hca被错误聚类之外,所有样品均被正确分离。
147.图31a至图31e:超参数选择和特征修剪对机器学习性能的影响。网格搜索的热图,以识别adaboost的最佳超参数(图31a)。matthew相关系数被用作性能量度。每个超参数性能的展平图(图31b)。箭头指示为模型构建所选择的值。图31c示出了修剪单个adaboost模型对性能的影响(如图30b中所示)。实线是所有10个模型的平均值,并且阴影区域示出了标准偏差。使用在预修剪的集合中观察到的每个基因的adaboost模型的数量(图31d)。修剪组合的adaboost集合时的模型性能(图31e)。图31d和图31e中的橙色线示出了用于生成最终adaboost模型的阈值。
148.图32a至图32c:c
‑
rna转录组跟踪随妊娠进程的变化。图32a示出了在整个妊娠过
程中显著改变的转录物的时间变化。每行对应于一种转录物,其丰度在聚类之前在所有样品(n=152)之间归一化。橙色指示丰度升高;紫色指示丰度降低。图32b示出了在三个独立的c
‑
rna妊娠进程分析中识别的转录物的重叠。n=从队列中的怀孕妇女收集的血浆样品的数目。图32c示出了表达仅在pearl hcc队列中检测到的91种基因的组织。
149.图33a至图33c:将对照和pe样品的样品收集而不是临床结果进行匹配。分图展示了ipec研究(图33a)和pearl pec研究(图33b)中每位个体的血液收集时间(三角形)和出生时的胎龄(正方形)。红线指示37周时足月出生的阈值。如图33c所示,早产率在早发型pe队列中显著升高。***p<0.001,通过fisher精确检验得出。ipec,对照n=73,pe n=40;pearl pec,每个组的n=12。
150.图34a至图34f:应用刀切法进行差异表达分析排除了用于识别pe样品的灵敏度较低的基因。图34a示出了pe中改变的转录物的倍数变化和丰度。图34b示出了通过标准分析被检测为改变的每种转录物的p值的单侧、基于正态分布的95%置信区间。图34c为刀切法的示意图,其中随机选择90%的样品用于在多次迭代中进行分析,以量化p值稳定性。图34d示出了每种差异丰度基因的平均丰度和噪声(两个变量的p>0.05,通过曼
‑
惠特尼u检验得出;n=30,12)。图34e示出,每个受影响的转录物的曲线下roc面积值反映了对照和pe样品的分离的c
‑
rna转录物的丰度分布的量度(*p<0.05,通过曼
‑
惠特尼u检验得出;纳入,n=30;排除,n=12)。图34f示出了使用刀切法后排除的基因对ipec样品进行分层聚类(灵敏度=73%;特异性=99%;n=113)。对于图34a、图34b、图34d和图34e,橙色数据点和蓝色数据点反映了通过标准差异表达分析被认为在pe中发生了统计学改变的转录物,但通过刀切法仅识别了橙色数据点。样品状态由沿热图右侧的蓝色矩形(pe)和灰色矩形(对照)示出。
151.图35a至图35e:遍在改变的c
‑
rna转录物将早发型pe样品与对照分离。图35a示出,通过测序(橙色)和通过qpcr(紫色)这两者针对20种转录物评估了pe与对照妊娠之间的倍数变化(*p<0.05,通过学生t检验得出;对照和pe的n=19)。图35b示出了受影响基因的组织表达。图35c示出了ipec样品的分层聚类(平均连锁,平方欧几里德距离;pe,n=40;对照,n=73)。来自pearl pec的早发型pe样品(图35d)、晚发型pe样品(图35e)以及对照妊娠样品的聚类(每个组的n=12)。
152.图36a至图36e:机器学习准确地对所有独立队列中的pe进行分类。图36a示出了ipec验证样品的平均roc曲线(虚线=sd;n=10)。图36b示出了ipec保留样品和独立的pearl pec样品(n=10)的准确度、灵敏度和特异性测量值。图36c为adaboost模型所使用的基因在ipec队列中的相对转录物丰度的热图。右侧的图指示给定转录物出现在多少个交叉验证模型中。图36d示出了通过差异分析和adaboost识别的转录物的一致性。图36e示出了由adaboost模型选择的表达升高水平的转录物的组织。
153.图37a和图37b:c
‑
rna样品制备工作流程。图37a示出了用于测序文库制备的方法。先将血液过夜运输,之后进行血浆处理和核酸提取。用dna酶消化cfdna,然后由所有rna合成cdna。在测序之前进行全转录组富集。在图37b中,针对c
‑
rna转录组分析评估了三种方法。rrna消耗并非一致地富集外显子的c
‑
rna部分;许多文库含有多个未对齐的读段。同样地,rrna在未被去除时将测序数据集淹没。富集产生了具有来自外显子c
‑
rna的最高比例的读段的文库。对于所有柱形图,橙色示出与人类基因组对齐的读段,灰色示出与rrna序列对齐的读段,并且粉红色示出不与人类基因组对齐的读段(包括非人类rna和低质量序列两
者)。
154.图38a至图38c:血浆体积对c
‑
rna数据质量的影响。图38a示出了使用quant
‑
it ribogreen测定法(thermo fisher)定量来自122个样品的血浆中的c
‑
rna产量。来自23个样品的测量值低于检测阈值并且从图中排除。柱条示出来自两次技术平行测定的平均值
±
sd。将来自9个独立实验的数据用于荟萃分析,从而评价血浆输入量对数据质量的影响。图38b示出了由每项研究中的生物学平行测定计算得出的噪声(生物学变异系数,edger)。图38c示出了每个样品的文库复杂度(结合群体,preseq)。**p<0.01,***p<0.001,通过anova,进行tukey hsd校正得出,使用研究作为区组变量。0.5ml,n=8、95;1ml,n=7、83;2ml,n=7、33;4ml,n=17、267,分别针对图38b和图38c。
155.图39a至图39e:在不同的bct中储存后c
‑
rna妊娠信号的完整性。图39a为在4个bct中储存过夜后,与由edta bct立即处理相比,已知c
‑
rna妊娠标志物的丰度的热图。图39b示出,通过对图39a中的转录物丰度求和而获得的妊娠信号的综合量度将妊娠样品与非妊娠样品区分开。**p<0.01,***p<0.001,通过anova,进行tukey hsd校正得出。edta立即,n=4、8;edta过夜,n=7、7;acd过夜,n=16、16;无细胞rna过夜,n=10、9;无细胞dna过夜,n=8、8;分别针对非妊娠组和妊娠组。图39c示出了收集自同一个体并且在处理前在无细胞dna bct(streck,inc)中储存0天、1天或5天的血液样品的转录组学图谱的相关性。柱条示出平均值
±
范围;n=2。分配给对照样品(图39d)或来自ipec队列的pe样品(图39e)的adaboost评分与血浆处理前血液在室温处储存的天数的关系。adaboost评分被归一化为
‑
1至 1的范围,其中预期对照样品具有<0的评分,并且pe样品具有>0的评分。未观察到adaboost评分的显著差异(anova,针对对照;t检验,针对pe)。对照1天,n=60;2天,n=4;3天,n=1,5天,n=2。pe 1天,n=37;2天,n=3。
156.图40a至图40d:c
‑
rna转录物可以在妊娠的特定阶段期间发生改变。转录物的动力学变化主要在妊娠早期(图40a,约14周)、整个妊娠期(图40b)或主要在妊娠晚期(图40c,约33周)变化。注意从第一孕期到第二孕期变化的转录物如何不返回基线水平,而是在妊娠期的剩余时间内保持在改变的丰度。图40d为在健康妊娠期间变化的转录物的本体和途径富集分析。每个填充的框均表示对应的术语或途径的显著富集。“所有基因”示出了对所有156种差异丰度转录物的分析。妊娠晚期改变的基因过少,以致于不能进行本体分析。
157.图41a至图41c:比较了三项独立c
‑
rna研究的妊娠相关转录物组织特异性。图41a示出了在每项研究中检测到的整组基因的组织特异性。图41b示出了针对每项研究独特的转录物。图41c示出了相交的基因集。
158.图42a和图42b:adaboost超参数优化。通过matthew相关系数衡量的性能与估计量的数目的关系(图42a)或与学习率的关系(图42b)。每个点示出在随机搜索期间从3倍交叉验证获得的平均值。
159.图43a至图43d:adaboost训练策略。在图43a中,将训练样品分成5个大小均匀的子集,对应于模型构建的五次迭代。对于第一次迭代,子集1中的样品用于修剪,而子集2、3、4和5中的样品被组合用于adaboost拟合;对于第二次迭代,子集2中的样品用于修剪,而子集1、3、4和5中的那些样品用于adaboost拟合;剩余的三次迭代以此类推。如图43b所示,对于每次迭代,将adaboost模型拟合到“拟合样品”。然后用“修剪样品”评估删除低于递增重要性阈值的基因对分类性能的影响。保留了具有最佳性能和最少的基因的模型。在图43c中,
对于每组拟合样品和修剪样品,将图43b中的过程重复10次,从而生成总共50个模型。在图43d中,然后将来自所有模型的估计量聚集成单个adaboost集合。对聚集模型进行特征修剪,以识别最佳分类所需的最小基因集。
160.图44a至图44d:adaboost输出受到样品选择的显著影响。图44a示出了由每个adaboost子集生成的单独模型的分类性能(对数损失值)(*p<0.05,***p<0.001,通过anova,进行tukey hsd校正得出;每个子集的n=10)。在图44b中,每种转录物的频率包括在50个单独的adaboost模型之一中。图44c为结合到每个训练子集模型中的转录物的维恩图。虽然在来自所有子集的模型中利用了5种转录物,但是其中40种针对单个子集是独特的。图44d示出了修剪估计量对最终完全聚集的adaboost模型的分类性能(对数损失值)的影响,还示出了每组样品的独特行为。当考虑到用于拟合adaboost模型的75%的数据由用于拟合adaboost的任何两组样品共享时,这些趋势尤其引人注目。需注意,这些数据与图41中呈现的最终机器学习分析分开生成。
161.示意图未必按比例绘制。附图中使用的类似标号可以指代类似的部件。然而,应当理解,在给定附图中使用数字来指代部件并非旨在限制在另一附图中用相同数字标记的部件。此外,使用不同的数字来指代部件并非旨在指示不同编号的部件不能与其他编号的部件相同或类似。
具体实施方式
162.本文提供了在母体循环中发现的对于先兆子痫具有特异性的循环rna的标记,以及此类标记在用于诊断先兆子痫和识别有患上先兆子痫的风险的怀孕妇女的非侵入性方法中的用途。
163.虽然体内的大部分dna和rna位于细胞内,但是也可能发现细胞外核酸在血液中自由循环。循环rna,在本文中也称为“c
‑
rna”,是指存在于血流中的rna的细胞外片段。c
‑
rna分子主要来自两种来源:一种是从正经历凋亡的濒死细胞释放到循环中,另一种是包含在由活细胞脱落到循环中的外来体内。外来体是从许多细胞类型释放到细胞外空间中的直径约30nm至150nm的小膜状囊泡,并且存在于多种多样的体液(包括血清、尿液和母乳)中并携带蛋白质、mrna和微rna。外来体的脂质双层结构保护内含的rna不被rna酶降解,从而提供血液中的稳定性。参见例如,huang等人,2013,bmc genomics;14:319;以及li等人,2017,mol cancer;16:145)。越来越多的证据表明,外来体具有特殊的功能,并且在诸如凝血、细胞间信号传导和废物管理等的过程中发挥作用(van der pol等人,2012,pharmacol rev;64(3):676
–
705)。还可参见samos等人,2006,ann n y acad sci;1075:165
–
173;zernecke等人,2009,sci signal;2:ra81;ma等人,2012,j exp clin cancer res;31:38;以及sato
‑
kuwabara等人,2015,int j oncol;46:17
–
27。
164.用本文所述的方法,在母体循环中发现的c
‑
rna分子充当胎儿、胎盘和母体健康的生物标志物,并且提供了进入妊娠进程的窗口。本文描述了指示怀孕的母体循环内的c
‑
rna标记、与怀孕的妊娠阶段在时间上相关联的母体循环内的c
‑
rna标记,以及指示妊娠并发症先兆子痫的母体循环内的c
‑
rna标记。
165.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的多种蛋白质的至少一部分的多个c
‑
rna分子:arrdc2、jun、skil、atp13a3、pde8b、gsta3、pappa2、tiparp、lep、
rgp1、usp54、clec4c、mrps35、arhgef25、cux2、heatr9、fstl3、ddi2、zmym6、st6galnac3、gbp2、nes、etv3、adam17、atoh8、slc4a3、traf3ip1、ttc21a、heg1、aste1、tmem108、enc1、scamp1、arrdc3、slc26a2、slit3、clic5、tnfrsf21、ppp1r17、tpst1、gatsl2、spdye5、hipk2、mtrnr2l6、clcn1、gins4、crh、c10orf2、trub1、prg2、acy3、far2、cd63、ckap4、tpcn1、rnf6、thtpa、fos、parn、orai3、elmo3、smpd3、serpinf1、tmem11、psmd11、ebi3、clec4m、ccdc151、cpamd8、cnfn、lilra4、ada、c22orf39、pi4kap1和arfgap3。该c
‑
rna标记是用下表1(本文中也称为“列表(a)”或“(a)”)中所示的truseq文库制备方法获得的adaboost通用标记。
166.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的多种蛋白质的至少一部分的多个c
‑
rna分子:timp4、flg、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、clec4c、krt5、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes和vsig4。该c
‑
rna标记是用下表1(本文中也称为“列表(b)”或“(b)”)中所示的truseq文库制备方法获得的自举标记。
167.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的多个c
‑
rna分子:cyp26b1、irf6、myh14、podxl、ppp1r3c、sh3rf2、tmc7、znf366、adcy1、c6、fam219a、hao2、igip、il1r2、ntrk2、sh3pxd2a、ssuh2、sult2a1、fmo3、fstl3、gata5、htra1、c8b、h19、mn1、nfe2l1、prdm16、ap3b2、emp1、flnc、stag3、cpb2、tenc1、rp1l1、a1cf、npr1、tek、errfi1、arhgef15、cd34、rspo3、alpk3、samd4a、zcchc24、leap2、myl2、nrg3、zbtb16、serpina3、aqp7、srpx、uaca、ano1、fkbp5、scn5a、ptpn21、cacna1c、erg、sox17、wwtr1、aif1l、ca3、hrg、tat、aqp7p1、adra2c、synpo、fn1、gpr116、krt17、azgp1、bcl6b、kif1c、clic5、gpr4、gja5、olah、c14orf37、zeb1、jag2、kif26a、apold1、pnmt、myom3、pitpnm3、timp4、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes、vsig4、hbg2、cadm2、lamp5、ptgdr2、nomo1、nxf3、pld4、bpifb3、pacsin1、cux2、flg、clec4c和krt5。该c
‑
rna标记是用下表1(本文中也称为“列表(c)”或“(c)”)中所示的truseq文库制备方法获得的标准dex treat标记。
168.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的多个c
‑
rna分子:vsig4、adamts2、nes、fam107a、lep、daam2、arhgef25、timp3、prx、alox15b、hspa12b、igfbp5、clec4c、slc9a3r2、adamts1、sema3g、krt5、amph、prg2、pappa2、tead4、crh、pitpnm3、timp4、pnmt、zeb1、apold1、pld4、cux2和htra4。该c
‑
rna标记是用下表1(本文中也称为“列表(d)”或“(d)”)中所示的truseq文库制备方法获得的刀切标记。
169.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的多个c
‑
rna分子:adamts1、adamts2、alox15b、amph、arhgef25、celf4、daam2、fam107a、hspa12b、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、pacsin1、pappa2、prx、ptgdr2、sema3g、slc9a3r2、timp3和vsig4。该c
‑
rna标记是用下表1(本文中也称为“列表(e)”或“(e)”)中所示的nextera flex for enrichment文库制备方法获得的标准dex treat标记。
170.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的多个c
‑
rna分子:adamts1、adamts2、alox15b、arhgef25、celf4、daam2、fam107a、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、prx、ptgdr2、sema3g、slc9a3r2、timp3和
vsig4。该c
‑
rna标记是用下表1(本文中也称为“列表(f)”或“(f)”)中所示的nextera flex for enrichment文库制备方法获得的刀切标记。
171.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的多个c
‑
rna分子:clec4c、arhgef25、adamts2、lep、arrdc2、skil、pappa2、vsig4、arrdc4、crh和nes。该c
‑
rna标记是用下表1(本文中也称为“adaboost精简版1”、“列表(g)”或“(g)”)中所示的truseq文库制备方法获得的adaboost精简版truseq标记。
172.在一些实施方案中,母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的c
‑
rna分子:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2和vsig4(本文中也称为“adaboost精简版2”)、adamts2、arhgef25、arrdc2、clec4c、lep、pappa2、skil和vsig4(本文中也称为“adaboost精简版3”)、adamts2、arhgef25、arrdc4、clec4c、lep、nes、skil和vsig4(本文中也称为“adaboost精简版4”)、adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、pappa2、skil和vsig4(本文中也称为“adaboost精简版5”)、adamts2、arhgef25、arrdc2、clec4c、lep和skil(本文中也称为“adaboost精简版6”),或者adamts2、arhgef25、arrdc2、arrdc4、clec4c、lep、pappa2和skil(本文中也称为“adaboost精简版7”)。
173.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的多个c
‑
rna分子:lep、pappa2、kcna5、adamts2、myom3、atp13a3、arhgef25、ada、htra4、nes、crh、acy3、pld4、sct、nox4、pacsin1、serpinf1、skil、sema3g、tiparp、lrrc26、phex、lilra4和per1。该c
‑
rna标记是用下表1(本文中也称为“列表(h)”或“(h)”)中所示的nextera flex for enrichment文库制备方法获得的adaboost精简版nextera flex标记。
174.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自实施例7的表s9所示出的那些(本文中也称为“列表(i)”或“(i)”)中的任一种的蛋白质的至少一部分的多个c
‑
rna分子。
175.母体循环内指示先兆子痫的c
‑
rna标记包括编码选自下列的蛋白质的至少一部分的多个c
‑
rna分子:akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768(本文中也称为“列表(j)”或“(j)”)。
176.在一些实施方案中,母体循环内指示先兆子痫的c
‑
rna标记包括编码选自(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)、(i)和/或(j)中的任何一者或多者与(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)、(i)和/或(j)中的任何一者或多者的组合的蛋白质的至少一部分的多个c
‑
rna分子。
177.此处提供的实施例描述了以上概述的八个基因列表,其将先兆子痫妊娠与对照妊娠区分开。每个列表都通过使用不同的分析方法和/或不同的数据集来识别。然而,这些基因集中的许多之间存在高度的一致性。用多种方法识别在先兆子痫c
‑
rna中改变的转录物,表明所述转录物对该疾病的分类具有较高的预测价值。因此,将通过所有差异表达分析和通过所有adaboost模型识别的转录物的重要性进行了合并和排名。被分配较低排名的基因并非无关紧要或信息不足,但它们对于在所有队列和样品制备中的先兆子痫分类可能不那么可靠。
178.首先,将在对两种文库制备方法(truseq和nextera flex for enrichment)使用所有差异表达分析(标准dex treat、自举法和刀切法)时所识别的转录物合并。下表2示出
了通过不同分析方法识别的所有125种转录物的相对重要性。在每种分析方法和两种文库制备方法中识别的转录物是最强的分类模型,并且指定其重要性排名为1。通过三种或更多种分析方法识别并且用两种文库制备方法检测到的转录物被给予重要性排名2。通过最严格的分析方法(即刀切法)但仅为其中一种文库制备方法所识别的转录物被指定重要性排名3。在这五种分析方法中的两种中识别的转录物被给予重要性排名4仅在标准dex treat方法(最广泛且最包容的分析)中识别的转录物被给予最低的重要性排名5。
179.然后,将在所有adaboost模型(adaboost普通版和adaboost精简版)和两种文库制备方法(下表3)中识别的91种转录物合并。当为每种文库制备方法生成精简版adaboost模型时,每次由相同数据构建模型时,都在所获得的基因集中观察到所观察到的细微变化。这是adaboost用于搜索大型全外显子组c
‑
rna数据的随机性的自然结果。为了获得代表性的基因列表,用于精简版adaboost的模型构建进行了最少9次独立运行,并且报告了一个或多个模型使用的所有基因。表3(adaboost使用的频率)报告了包括每种转录物的模型的百分比。adaboost为每种转录物分配其自身的“重要性”值,该值反映了该转录物的丰度对确定样品是否来自先兆子痫患者有多大影响。这些adaboost重要性值在使用给定转录物的每个精简版adaboost模型中取平均值(表3,平均adaboost模型重要性)。
180.在所有adaboost分析方法和文库制备方法中识别的转录物被指定最高的重要性排名1。在adaboost使用频率超过90%的情况下,在用于单一文库制备方法的精简版adaboost模型中识别的转录物被指定重要性排名2。一般来讲,这些转录物也具有较高的adaboost模型重要性,与增加的预测能力相一致。在用于单一文库制备方法的精简版adaboost模型中识别但被不到90%的adaboost模型使用的转录物被指定重要性排名3。仅在用于单一文库制备方法的普通版adaboost模型中识别的转录物被给予最低的重要性排名4。
181.表2列出了在所有分析方法和文库制备中通过dex分析所识别的每个基因。排名1=在每种分析方法和文库制备方法中识别的转录物。排名2=由两种文库制备方法和3/5的分析方法识别的转录物。排名3=在一种文库制备方法和刀切法(最严格的分析)中识别的。排名4=在2/5的分析方法中识别的。并且,排名5=仅在标准dex treat方法(我们最轻松的分析方法)中识别的。
182.表3列出了在两种文库制备方法中通过adaboost分析识别的每个基因。排名1=在两种文库制备方法和精简版adaboost模型中识别的。排名2=在一种文库制备方法中识别的,以高模型重要性和频率存在于精简版adaboost模型中。排名3=在一种文库制备方法中识别的,以中等模型重要性和频率存在于精简版adaboost模型中。并且,排名4=在一种文库制备方法中识别的,不存在于精简版adaboost模型中。
183.下表4为本文所列举的所有各种基因的词汇表。该信息是从欧洲生物信息研究所的hugo基因命名委员会获得的。
184.表1:复合基因列表
185.186.187.188.[0189][0190]
表2:dex分析
[0191]
[0192]
[0193]
[0194]
[0195][0196]
表3:adaboost分析
[0197]
[0198]
[0199]
[0200][0201]
表4:基因词汇表
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
[0208]
[0209]
[0210][0211]
术语“多个”是指多于一个元件。例如,该术语在本文中用于指充当先兆子痫的指示标记的许多c
‑
rna分子。
[0212]
多个可以包括本文所述列表中所列举的分子中的任何两者、任何三者、任何四者、任何五者、任何六者、任何七者、任何八者、任何九者、任何十者、任何十一者、任何十二者、任何十三者、任何十四者、任何十五者、任何十六者、任何十七者、任何十八者、任何十九者、任何二十者、任何二十一者、任何二十二者、任何二十三者、任何二十四者、任何二十五者、任何二十六者、任何二十七者、任何二十八者、任何二十九者、任何三十者、任何三十一者、任何三十二者、任何三十三者、任何三十四者、任何三十五者、任何三十六者、任何三十七者、任何三十八者、任何三十九者、任何四十者、任何四十一者、任何四十二者、任何四十三者、任何四十四者、任何四十五者、任何四十六者、任何四十七者、任何四十八者、任何四十九者、任何五十者、任何五十一者、任何五十二者、任何五十三者、任何五十四者、任何五十五者、任何五十六者、任何五十七者、任何五十八者、任何五十九者、任何六十者、任何六十一者、任何六十二者、任何六十三者、任何六十四者、任何六十五者、任何六十六者、任何六十七者、任何六十八者、任何六十九者、任何七十者、任何七十一者、任何七十二者、任何七十三者、任何七十四者、任何七十五者、任何七十六者、任何七十七者、任何七十八者、任何七十九者、任何八十者、任何八十一者、任何八十二者、任何八十三者、任何八十四者、任何八十五者、任何八十六者、任何八十七者、任何八十八者、任何八十九者、任何九十者、任何
九十一者、任何九十二者、任何九十三者、任何九十四者、任何九十五者、任何九十六者、任何九十七者、任何九十八者、任何九十九者、任何一百者、任何一百零一者、任何一百零二者、任何一百零三者、任何一百零四者、任何一百零五者、任何一百零六者、任何一百零七者、任何一百零八者、任何一百零九者、任何一百一十者、任何一百一十一者、任何一百一十二者、任何一百一十三者、任何一百一十四者、任何一百一十五者、任何一百一十六者、任何一百一十七者、任何一百一十八者、任何一百一十九者、任何一百二十者、任何一百二十一者、或任何一百二十二者。多个可以包括以上列举的数中的至少任何一个。多个可以包括多于以上列举的数中的任何一个。多个可以包括以上列举的那些数中的任何一个的范围。在一些实施方案中,指示先兆子痫的c
‑
rna标记仅包括以上列举的生物标志物中的一种。
[0213]
从受试者获得的样品中的这些c
‑
rna标记之一的识别和/或定量可以用于确定受试者患有先兆子痫或有患上先兆子痫的风险。
[0214]
样品可以是生物样品,包括但不限于血液、血清、血浆、汗液、泪液、尿液、痰液、淋巴液、唾液、羊水、组织活检物、拭子或涂片,包括例如但不限于胎盘组织样品。在一些优选的实施方案中,生物样品是无细胞血浆样品。生物样品可以是从怀孕女性受试者获得的母体样品。
[0215]
如本文所用,术语“受试者”是指人类受试者以及非人类哺乳动物受试者。虽然本文的实施例涉及人类,并且该语言主要针对人类问题,但是本公开的概念适用于任何哺乳动物,并且可用于兽医、动物科学、研究实验室等领域。
[0216]
受试者可以是怀孕女性,包括处于怀孕的任何妊娠阶段的怀孕女性。怀孕的妊娠阶段可以是例如第一孕期、第二孕期(包括第二孕期的晚期)或第三孕期(包括第三孕期的早期)。怀孕的妊娠阶段可以是例如妊娠16周前、妊娠20周前或妊娠20周后。怀孕的妊娠阶段可以是例如妊娠8周至18周、妊娠10周至14周、妊娠11周至14周、妊娠11周至13周,或妊娠12周至13周。
[0217]
在母体血浆中发现无细胞胎儿核酸为非侵入性产前诊断开辟了新的可能性。在过去几年中,已经证明许多方法可以将此类循环胎儿核酸用于产前检测染色体的非整倍性。在例如下列文献中所述的任一种方法可以用于本文所述的方法中:poon等人,2000,clin chem;1832
‑
4;poon等人,2001,ann n y acad sci;945:207
‑
10;ng等人,2003,clin chem;49(5):727
‑
31;ng等人,2003,proc natl acad sci u s a.;100(8):4748
‑
53;tsui等人,2004,j med genet;41(6):461
‑
7;go等人,2004,clin chem;50(8):1413
‑
4;smets等人,2006,clin chim acta;364(1
‑
2):22
‑
32;tsui等人,2006,methods mol biol;336:123
‑
34;purwosunu等人,2007,clin chem;53(3):399
‑
404;chim等人,2008,clin chem;54(3):482
‑
90;tsui和lo,2008,methods mol biol;444:275
‑
89;lo,2008,ann n y acad sci;1137:140
‑
143;miura等人,2010,prenat diagn;30(9):849
‑
61;li等人,2012,clin chim acta;413(5
‑
6):568
‑
76;williams等人,2013,proc natl acad sci u s a;110(11):4255
‑
60;tsui等人,2014,clin chem;60(7):954
‑
62;tsang等人,2017,proc natl acad sci u s a;114(37):e7786
‑
e7795和美国专利公布us 2014/0243212。
[0218]
母体循环内指示先兆子痫或有患上先兆子痫的风险的c
‑
rna标记的生物标志物的检测和识别可能涉及多种技术中的任一种。例如,可以通过放射性免疫测定在血清中检测生物标志物,或者可以使用聚合酶链反应(pcr)技术。
[0219]
在各种实施方案中,母体循环内指示先兆子痫或有患上先兆子痫的风险的c
‑
rna标记的生物标志物的识别可能涉及对c
‑
rna分子进行测序。可以利用多种测序技术中的任一种,包括但不限于多种高通量测序技术中的任一种。
[0220]
在一些实施方案中,母体生物样品内的c
‑
rna群体可以在测序之前进行rna序列的富集,所述rna序列包括蛋白质编码序列。可以使用可用于全外显子组富集和测序的多种平台中的任一种,包括但不限于agilent sureselect human all exon平台(chen等人,2015a,cold spring harb protoc;2015(7):626
‑
33.doi:10.1101/pdb.prot083659);roche nimblegen seqcap ez exome library sr平台(chen等人,2015b,cold spring harb protoc;2015(7):634
‑
41.doi:10.1101/pdb.prot084855);或illumina truseq exome enrichment平台(chen等人,2015c,cold spring harb protoc;2015(7):642
‑
8.doi:10.1101/pdb.prot084863)。还可参见“truseq
tm
exome enrichment guide,”目录号fc
‑
930
‑
1012部件号15013230rev.b,2010年11月和illumina的“truseq
tm
rna sample preparation guide,”目录号rs
‑
122
‑
9001doc部件号15026495rev.f,2014年3月。
[0221]
在特定实施方案中,可以使用微阵列技术来检测和识别母体循环内指示先兆子痫或有患上先兆子痫的风险的c
‑
rna标记的生物标志物。在该方法中,将感兴趣的多核苷酸序列铺板或排列在微芯片基底上。然后将排列的序列与母体生物样品或者其纯化和/或富集部分杂交。微阵列可以包括多种固体载体,包括(但不限于)珠粒、玻璃显微镜载片、玻璃晶片、金、硅、微芯片以及其他塑料、金属、陶瓷或生物表面。可以通过可商购获得的设备,按照制造商的方案(诸如通过使用illumina的技术)进行微阵列分析。
[0222]
对于获取、运输、储存和/或处理血液样品以制备循环rna,可以采取多个步骤来稳定样品和/或防止细胞膜破裂,从而导致细胞rna释放到样品中。例如,在一些实施方案中,在处理成血浆之前,可以在具有细胞和dna稳定特性的试管(诸如streck无细胞dna血液收集试管)中收集、运输和/或储存血液样品。在一些实施方案中,血液样品不暴露于edta。参见例如,qin等人,2013,bmc research notes;6:380以及medina diaz等人,2016,plos one;11(11):e0166354。
[0223]
在一些实施方案中,在抽血的约24小时至约72小时内,并且在一些实施方案中,在抽血的约24小时内,将血液样品处理成血浆。在一些实施方案中,在处理成血浆之前,在室温处保持、储存和/或运输血液样品。
[0224]
在一些实施方案中,在处理成血浆之前,在没有暴露于冷却(例如,在冰上)或冷冻的情况下,保持、储存和/或运输血液样品。
[0225]
本公开包括用于诊断先兆子痫和识别有患上先兆子痫的风险的怀孕妇女的试剂盒。试剂盒是任何包括至少一种试剂(例如,探针)的制品(例如,包装或容器),该试剂用于特异性地检测如本文所述的母体循环内指示先兆子痫或有患上先兆子痫的风险的c
‑
rna标记。该试剂盒可以作为用于执行本公开的方法的单元来促销、分发或出售。
[0226]
在母体循环中发现的对于先兆子痫具有特异性的循环rna的标记在用于诊断先兆子痫和识别有患上先兆子痫的风险的怀孕妇女的非侵入性方法中的用途可以与适当的监测和医疗管理相结合。例如,可能需要进一步的测试。这种测试可以包括例如用于测量肝功能、肾功能和/或血小板和各种凝血蛋白的血液测试,用于测量蛋白质或肌酸酐水平的尿液分析,用于测量监测胎儿生长、体重和羊水的胎儿超声,用于通过胎儿运动来测量胎儿心率
的无应激测试,以及/或者使用超声来测量胎儿的呼吸、肌肉张力和运动以及可能需要的羊水体积的胎儿生理活动评估。治疗干预措施可以包括例如增加产前就诊的频率、抗高血压药物以降低血压、皮质类固醇药物、抗惊厥药物、卧床休息、住院和/或提前分娩。参见例如,townsend等人,2016“current best practice in the management of hypertensive disorders in pregnancy,”integr blood press control;9:79
–
94。
[0227]
治疗干预措施可以包括向被识别为有患上先兆子痫的风险的怀孕妇女施用低剂量阿司匹林。最近的一项多中心、双盲、安慰剂对照试验证明,与安慰剂相比,用低剂量阿司匹林治疗早产型先兆子痫高风险女性导致该诊断的发生率较低(rolnik等人,2017,“"aspirin versus placebo in pregnancies at high risk for preterm preeclampsia,”n engl j med;377(7):613
‑
622)。低剂量阿司匹林的剂量包括但不限于每天约50mg至约150mg、每天约60mg至约80mg、每天约100mg或更多mg,或每天约150mg。施用可以例如在妊娠16周或之前,或者从妊娠11周至14周开始。施用可以持续到妊娠36周。
[0228]
本发明在权利要求书中限定。然而,下文提供了非限制性实施方案的不完全列表。这些实施方案的任何一个或多个特征可以与本文所述的另一个实施例、实施方案或方面的任何一个或多个特征组合。
[0229]
实施方案1包括在怀孕女性中检测先兆子痫和/或确定先兆子痫风险升高的方法,该方法包括:
[0230]
在从所述怀孕妇女获得的生物样品中识别多个循环rna(c
‑
rna)分子;
[0231]
其中选自下列的多个c
‑
rna分子指示所述怀孕妇女中的先兆子痫和/或先兆子痫风险升高:
[0232]
编码选自实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者的蛋白质的至少一部分的多个c
‑
rna分子;或者
[0233]
编码选自akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者的蛋白质的至少一部分的多个c
‑
rna分子。
[0234]
实施方案2包括在怀孕女性中检测先兆子痫和/或确定先兆子痫风险升高的方法,该方法包括:
[0235]
从所述怀孕女性获得生物样品;
[0236]
从所述生物样品中纯化循环rna(c
‑
rna)分子群;
[0237]
识别由经纯化的c
‑
rna分子群内的所述c
‑
rna分子编码的蛋白质编码序列;
[0238]
其中编码选自下列的蛋白质的至少一部分的由所述c
‑
rna分子编码的所述蛋白质编码序列指示所述怀孕妇女中的先兆子痫和/或先兆子痫风险升高:
[0239]
实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者;或者
[0240]
akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者。
[0241]
实施方案3包括根据实施方案1或2所述的方法,其中识别由所述生物样品内的c
‑
rna分子编码的蛋白质编码序列包括杂交、逆转录酶pcr、微阵列芯片分析或测序。
[0242]
实施方案4包括根据实施方案1或2所述的方法,其中识别由所述生物样品内的所述c
‑
rna分子编码的蛋白质编码序列包括测序。
[0243]
实施方案4包括根据实施方案4所述的方法,其中测序包括对克隆扩增分子的大规模平行测序。
[0244]
实施方案6包括根据实施方案4或5所述的方法,其中测序包括rna测序。
[0245]
实施方案7包括根据实施方案1至6中任一项所述方法,所述方法还包括:
[0246]
从所述生物样品中去除完整细胞;
[0247]
用脱氧核酸酶(dna酶)处理所述生物样品以去除无细胞dna(cfdna);
[0248]
由所述生物样品中的c
‑
rna分子合成互补dna(cdna);并且/或者
[0249]
在识别由所述循环rna(c
‑
rna)分子编码的蛋白质编码序列之前,
[0250]
通过外显子组富集来富集所述cdna序列中的编码蛋白质的dna序列。
[0251]
实施方案8包括在怀孕女性中检测先兆子痫和/或确定先兆子痫风险升高的方法,该方法包括:
[0252]
从所述怀孕女性获得生物样品;
[0253]
从所述生物样品中去除完整细胞;
[0254]
用脱氧核酸酶(dna酶)处理所述生物样品以去除无细胞dna(cfdna);
[0255]
由所述生物样品中的rna分子合成互补dna(cdna);
[0256]
富集所述cdna序列中的编码蛋白质的dna序列(外显子组富集);
[0257]
对所得的富集的cdna序列进行测序;以及
[0258]
识别由富集的c
‑
rna分子编码的蛋白质编码序列;
[0259]
其中编码选自下列的蛋白质的至少一部分的由所述c
‑
rna分子编码的蛋白质编码序列指示所述怀孕妇女中的先兆子痫和/或先兆子痫风险升高:
[0260]
实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者;或者
[0261]
akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者。
[0262]
实施方案9包括一种方法,该方法包括:
[0263]
从所述怀孕女性获得生物样品;
[0264]
从所述生物样品中去除完整细胞;
[0265]
用脱氧核酸酶(dna酶)处理所述生物样品以去除无细胞dna(cfdna);
[0266]
由所述生物样品中的rna分子合成互补dna(cdna);
[0267]
富集所述cdna序列中的编码蛋白质的dna序列(外显子组富集);
[0268]
对所得的富集的cdna序列进行测序;以及
[0269]
识别由所述富集的c
‑
rna分子编码的蛋白质编码序列;
[0270]
其中由所述c
‑
rna分子编码的所述蛋白质编码序列包括选自下列的蛋白质的至少
一部分:
[0271]
实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者;或者
[0272]
akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者。
[0273]
实施方案10包括根据实施方案1至9中任一项所述的方法,其中所述生物样品包括血浆。
[0274]
实施方案11包括根据实施方案1至10中任一项所述的方法,其中所述生物样品是从妊娠期不足16周或妊娠期不足20周的怀孕女性获得的。
[0275]
实施方案12包括根据实施方案1至10中任一项所述的方法,其中所述生物样品是从妊娠期超过20周的怀孕女性获得的。
[0276]
实施方案13包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记包括实施例7的表s9所列出的那些中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者、任何十三者或更多者、任何十四者或更多者、任何十五者或更多者、任何十六者或更多者、任何十七者或更多者、任何十八者或更多者、任何十九者或更多者、任何二十者或更多者、任何二十一者或更多者、任何二十二者或更多者、任何二十三者或更多者、任何二十四者或更多者、任何二十五者或更多者、任何二十六者或更多者、任何二十七者或更多者、任何二十八者或更多者、任何二十九者或更多者、任何三十者或更多者、任何三十一者或更多者、任何三十二者或更多者、任何三十三者或更多者、任何三十四者或更多者、任何三十五者或更多者、任何三十六者或更多者、任何三十七者或更多者、任何三十八者或更多者、任何三十九者或更多者、任何四十者或更多者、任何四十一者或更多者、任何四十二者或更多者、任何四十三者或更多者、任何四十四者或更多者、任何四十五者或更多者、任何四十六者或
更多者、任何四十七者或更多者、任何四十八者或更多者、或全部四十九者。
[0277]
实施方案14包括针对先兆子痫风险升高的循环rna(c
‑
rna)标记,该c
‑
rna标记包括akap2、arrb1、cpsf7、ino80c、jag1、msmp、nr4a2、plek、rap1gap2、speg、trps1、ube2q1和znf768中的任何一者或更多者、任何两者或更多者、任何三者或更多者、任何四者或更多者、任何五者或更多者、任何六者或更多者、任何七者或更多者、任何八者或更多者、任何九者或更多者、任何十者或更多者、任何十一者或更多者、任何十二者或更多者、或全部十三者。
[0278]
实施方案15包括固体载体阵列,该固体载体阵列包括多种能够结合和/或识别实施方案13或14所述的c
‑
rna标记的试剂。
[0279]
实施方案16包括试剂盒,该试剂盒包括多种能够结合和/或识别实施方案13或14所述的c
‑
rna标记的探针。
[0280]
实施方案17包括试剂盒,该试剂盒包括多种用于选择性地扩增实施方案13或14所述的c
‑
rna标记的引物。
[0281]
实施方案18包括实施方案1至12中任一项所述的方法,其中样品是血液样品,并且在将所述血液样品处理成血浆之前,在具有细胞和dna稳定特性的试管中收集、运输和/或储存所述血液样品。
[0282]
实施例19包括根据实施方案18所述的方法,其中所述试管包括streck无细胞dna血液收集试管。
[0283]
通过以下实施例对本发明进行举例说明。应当理解,应当根据如本文所述的本发明的范围和实质广义地解释特定的实施例、材料、量和程序。
[0284]
实施例
[0285]
实施例1
[0286]
针对妊娠独特的c
‑
rna标记
[0287]
母体血浆中循环核酸的存在为了解胎儿和胎盘的进展和健康提供了窗口(图1)。循环rna(c
‑
rna)在母体循环中被检测到,并且来源于两个主要来源。c
‑
rna的很大一部分来源于凋亡细胞,这些凋亡细胞将含有c
‑
rna的囊泡释放到血流中。c
‑
rna还通过活性信号传导囊泡(诸如外来体和微囊泡)从多种细胞类型的脱落而进入母体循环。如图2所示,c
‑
rna因此由细胞死亡的副产物以及活性信号传导产物组成。c
‑
rna的特征包括通过常见的过程产生、从全身的细胞释放、稳定,以及包含在囊泡中。它代表循环转录组,其反映了基因表达、信号传导和细胞死亡的组织特异性变化。
[0288]
出于至少以下原因,c
‑
rna可能成为出色的生物标志物:
[0289]
1)所有c
‑
rna都包含在膜结合的囊泡内,这些囊泡保护c
‑
rna免于降解,使其在血液中非常稳定。
[0290]
2)c
‑
rna来源于所有细胞类型。例如,已证实c
‑
rna含有来自胎盘和发育中的胎儿这两者的转录物。各种不同来源的c
‑
rna使其可能成为获取关于胎儿和母亲整体健康状况这两者的信息的丰富信息库。
[0291]
使用标准的illumina文库制备和全外显子组富集技术,由血浆样品制备c
‑
rna文库。这在图3中示出。具体地讲,使用了illumina truseq
tm
文库制备和rna获取富集。使用这种方法,生成的文库中90%的读段与人类编码区对齐(图3和图7)。将样品缩减采样至50m读
段,并且将≥40m的映射读段用于下游分析。使用图3所示的c
‑
rna工作流程处理样品。双指数文库。在hiseq2000上进行50x50测序
[0292]
如图4所示,将来自第三孕期的怀孕妇女的血浆样品的结果与来自非妊娠妇女的血浆样品的结果进行比较,得到针对妊娠独特的清晰标记。该标记的前20个差异丰度基因为cshl1、csh2、kiss1、cga、plac4、psg1、gh2、psg3、psg4、psg7、psg11、csh1、psg2、hsd3b1、grhl2、lgals14、fcgr1c、psg5、lgals13和gcm1。妊娠标记中识别的大多数基因都是胎盘表达的,并且也与已公布的数据相关。这些结果还证实胎盘rna可以在母体循环中获取。
[0293]
实施例2
[0294]
跨胎龄的c
‑
rna标记
[0295]
该实施例表征了整个妊娠期跨不同胎龄的c
‑
rna标记。可以预料,贯穿整个妊娠期的不同时间点的c
‑
rna标记的变化将比实施例1中指出的妊娠样品和非妊娠样品的c
‑
rna标记之间的差异更加微妙。如图5所示,随着妊娠的进行,观察到标记基因的c
‑
rna谱图随时间明显变化,其中有一组清晰的基因在第一孕期上调,并且一组清晰的基因在第三孕期增加。
[0296]
这些基因包括如图5中所列出的cgb8、cgb5、zscan23、hspa1a、pmaip1、c8orf4、itm2b、ifit2、cd74、hspa6、tfap2a、trpv6、exph5、capn6、aldh3b2、rab3b、muc15、gsta3、grhl2和cshl1。
[0297]
这些基因还可以包括cshl1、csh2、kiss1、cga、plac4、psg1、gh2、psg3、psg4、psg7、psg11、csh1、psg2、hsd3b1、grhl2、lgals14、fcgr1c、psg5、lgals13和gcm1。
[0298]
整个妊娠过程中的这些变化与来自steve quake和dennis lo这两者的发表数据相关联。参见例如,maron等人,2007,“gene expression analysis in pregnant women and their infants identifies unique fetal biomarkers that circulate in maternal blood,”j clin invest;117(10):3007
–
3019;koh等人,2014,“noninvasive in vivo monitoring of tissue
‑
specific global gene expression in humans,”proc natl acad sci u s a;111(20):7361
‑
6;以及ngo等人,2018,“noninvasive blood tests for fetal development predict gestational age and preterm delivery,”science;360(6393):1133
‑
1136。发现了与胎盘的基因表达模式相关联的c
‑
rna标记。因此,该方法能够检测出妊娠期内的细微变化,并且提供了非侵入性手段来监测胎盘健康。
[0299]
实施例3
[0300]
先兆子痫的c
‑
rna标记
[0301]
在该实施例的情况下,识别了针对先兆子痫独特的c
‑
rna标记。将在从两项研究即rgh14研究(在clinical trials.gov中注册为nct0208494)和pearl研究(在本文中也称为pearl生物库;在clinical trials.gov中注册为nct02379832)中被诊断为患有先兆子痫的怀孕妇女收集的样品中确定c
‑
rna标记,并且进行分析(图6)。在诊断先兆子痫时收集两管血液。收集了80个根据胎龄匹配的对照样品,以使与先兆子痫疾病状态无关的转录可变性最小化,并且以控制c
‑
rna标记的胎龄差异。来自rgh14研究的样品用于识别一组生物学相关基因,并且这些生物标志物的预测价值在来自pearl生物库的独立样品队列中得到了验证。
[0302]
在rgh14数据分析中,针对先兆子痫(pe)独特的c
‑
rna标记是使用treat方法、自举法、刀切法和adaboost方法这四种不同的方法识别的。实施例3专注于前3种分析方法,并且
实施例4专注于adaboost方法。
[0303]
利用edgr程序的相对于阈值(treat)统计方法的t检验使研究人员能够正式地检验(用相关的p值)微阵列实验中的差异表达是否大于给定的(生物学上有意义的)阈值。关于treat统计方法的更详细描述,参见mccarthy和smyth,2009“testing significance relative to a fold
‑
change threshold is a treat,”bioinformatics;25(6):765
‑
71,而关于edgr程序的更详细描述,参见robinson等人,2010,“edger:a bioconductor package for differential expression analysis of digital gene expression data,”bioinformatics;26:139
‑
140。关于adaboost方法的更详细描述,参见freund和schapire,1997,“a decision
‑
theoretic generalization of on
‑
line learning and an application to boosting,”journal of computer and systems sciences;55(1):119
‑
139以及pedregosa等人,2011,“scikit
‑
learn:machine learning in python,”jmlr;12:2825
‑
2830。adaboost方法将在实施例4中进行讨论。
[0304]
在第一种方法中,使用标准统计检验(treat方法)来识别与匹配对照的子集(40名患者)相比,在40名患者的rgh14先兆子痫队列中具有统计学差异的基因。与匹配对照的子集(40名患者)相比,122个基因在先兆子痫队列(40名患者)中被识别为具有统计学差异(图8,右图)。这些基因包括cyp26b1、irf6、myh14、podxl、ppp1r3c、sh3rf2、tmc7、znf366、adcy1、c6、fam219a、hao2、igip、il1r2、ntrk2、sh3pxd2a、ssuh2、sult2a1、fmo3、fstl3、gata5、htra1、c8b、h19、mn1、nfe2l1、prdm16、ap3b2、emp1、flnc、stag3、cpb2、tenc1、rp1l1、a1cf、npr1、tek、errfi1、arhgef15、cd34、rspo3、alpk3、samd4a、zcchc24、leap2、myl2、nrg3、zbtb16、serpina3、aqp7、srpx、uaca、ano1、fkbp5、scn5a、ptpn21、cacna1c、erg、sox17、wwtr1、aif1l、ca3、hrg、tat、aqp7p1、adra2c、synpo、fn1、gpr116、krt17、azgp1、bcl6b、kif1c、clic5、gpr4、gja5、olah、c14orf37、zeb1、jag2、kif26a、apold1、pnmt、myom3、pitpnm3、timp4、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes、vsig4、hbg2、cadm2、lamp5、ptgdr2、nomo1、nxf3、pld4、bpifb3、pacsin1、cux2、flg、clec4c和krt5。
[0305]
treat方法未识别出一组将先兆子痫患者100%准确地分类到单独的组中的基因(图15)。然而,与使用所有测得基因的整个数据集相比,专注于这些识别出的基因确实改善了分类(图8,左图)。这突出了专注于基因子集用于预测的价值。然而,在treat方法的情况下,根据所选择的对照,在识别出的基因中观察到了很大的可变性。为了解决这种生物学可变性并且进一步提高我们的基因列表的预测价值,开发了第二种自举方法。
[0306]
在rgh14研究中,可以利用比先兆子痫患者样品(40)更多的对照样品(80)。因此,将40个先兆子痫患者样品的rgh14队列与40个对照样品(仍根据胎龄匹配)的随机选择进行了比较,并且识别了先兆子痫队列中具有统计学差异的基因列表。如图9所示,然后将该操作重复1000次,以鉴定一组基因被识别的频率。在1000次迭代中,基因的显著子集仅出现不到10次(不到1000次迭代的1%)。这些低频基因很可能是由于生物噪声引起的,并且可能无法反映出对于先兆子痫普遍具有特异性的基因。因此,通过仅当在进行的1000次迭代中有50%被识别时,才需要认为该基因在先兆子痫队列中具有统计学差异,从而进一步缩减选择基因列表(图9,右图)。如图10所示,差异转录物丰度和额外的自举选择将先兆子痫样品
与健康对照区分开。使用该额外的要求有助于解决生物学可变性,并且进一步提高了对先兆子痫样品正确分类的能力。
[0307]
使用该自举方法,识别出27个与先兆子痫在统计学上相关联的基因。这些基因包括timp4、flg、htra4、amph、lcn6、crh、tead4、arms2、pappa2、sema3g、adamts1、alox15b、slc9a3r2、timp3、igfbp5、hspa12b、clec4c、krt5、prg2、prx、arhgef25、adamts2、daam2、fam107a、lep、nes和vsig4。用这种自举方法识别的基因与已公布的数据具有极佳的一致性。这些基因中的约75%由胎盘表达。如图11所示,存在与先兆子痫的已知标志物(包括pappa和crh)重叠。并且,这些基因中的大量参与胚胎发育、细胞外基质重塑、免疫调节和心血管功能,所有这些途径已知在先兆子痫中均失调。
[0308]
还开发了第三种刀切法,用于捕获具有最高预测价值的基因子集。该方法类似于自举法。对来自先兆子痫组和对照组两者的患者进行随机二次采样,并且1000次识别出差异丰度基因。不同于使用基因被识别为具有统计学差异的频率,刀切法计算每种转录物的p值的置信区间(95%,单侧)。将该置信区间超过0.05的基因排除。(图16,左图)。
[0309]
使用刀切法,识别了30个基因作为先兆子痫的预测基因:vsig4、adamts2、nes、fam107a、lep、daam2、arhgef25、timp3、prx、alox15b、hspa12b、igfbp5、clec4c、slc9a3r2、adamts1、sema3g、krt5、amph、prg2、pappa2、tead4、crh、pitpnm3、timp4、pnmt、zeb1、apold1、pld4、cux2、htra4。
[0310]
如图16的右图所示,该方法在rgh14数据集中对先兆子痫患者进行了很好的分类(比较图15(treat)、图10(自举)和图16(刀切))。每个识别的基因列表还用于在独立的pearl生物库数据集中对先兆子痫样品进行分类。如图17所示,每个基因列表都能够对先兆子痫样品进行分类。
[0311]
通过自举法和刀切法识别的所有基因均以122个treat方法基因表示(表2,dex分析,truseq文库制备方法)。自举法和刀切法的基因列表高度一致,其中共有基因超过70%。通过任何方法识别出的转录物的近90%在先兆子痫患者中表现出增加的转录物丰度,这与该疾病中的信号传导和/或细胞死亡升高一致。
[0312]
实施例4
[0313]
用adaboost识别c
‑
rna标记
[0314]
在该实施例中,使用替代性方法(称为adaboost的可公开获得的机器学习算法)来识别与先兆子痫相关联的特异性c
‑
rna标记。如图12所示,该方法识别出一组具有最大预测能力以将样品分类为先兆子痫(pe)或正常的基因。使用该基因列表,观察到先兆子痫队列与健康对照的最清晰分离。然而,该方法也可能很容易过度训练用于构建模型的样品。因此,使用来自pearl研究的完全独立的数据集验证了预测模型(图13)。使用该adaboost基因列表,以85%特异性准确地将85%的先兆子痫样品分类(图14)。总而言之,adaboost机器学习方法为先兆子痫构建了最准确的预测模型。
[0315]
使用adaboost方法,识别出75个与先兆子痫在统计学上相关联的基因(表3,adaboost分析,truseq文库制备方法)。这些基因包括arrdc2、jun、skil、atp13a3、pde8b、gsta3、pappa2、tiparp、lep、rgp1、usp54、clec4c、mrps35、arhgef25、cux2、heatr9、fstl3、ddi2、zmym6、st6galnac3、gbp2、nes、etv3、adam17,atoh8、slc4a3、traf3ip1、ttc21a、heg1、aste1、tmem108、enc1、scamp1、arrdc3、slc26a2、slit3、clic5、tnfrsf21、ppp1r17、tpst1、
gatsl2、spdye5、hipk2、mtrnr2l6、clcn1、gins4、crh、c10orf2、trub1、prg2、acy3、far2、cd63、ckap4、tpcn1、rnf6、thtpa、fos、parn、orai3、elmo3、smpd3、serpinf1、tmem11、psmd11、ebi3、clec4m、ccdc151、cpamd8、cnfn、lilra4、ada、c22orf39、pi4kap1和arfgap3。
[0316]
还开发了精简版adaboost模型来对pe样品进行可靠的分类。为了创建可以准确地预测新样品的通用机器学习模型,我们使用了严格的方法来避免过度拟合到单个数据集,并且用未用于模型构建的样品来验证最终的分类模型。如图18所展示,将rgh14数据集通过随机选择分成6个部分:一个保留子集,其中12%的样品被排除在模型构建之外,和5个大小均匀的测试子集。对于每次迭代,将子集指定为训练数据或测试样品。该过程从构建adaboost模型开始,对该数据子集最少重复10次。在为5个测试训练子集构建了50个高性能模型后,将来自所有模型的估计量合并到单个adaboost模型中。
[0317]
使用精简版adaboost模型,识别出11个与先兆子痫在统计学上相关联的基因。这些基因包括clec4c、arhgef25、adamts2、lep、arrdc2、skil、pappa2、vsig4、arrdc4、crh和nes。使用来自rgh14的保留数据集以及在完全独立的pearl生物库队列中验证了该预测模型的性能(图19)。
[0318]
adaboost模型创建说明。通过以下方法对adaboost分类方法进行了精简,以获得更具特异性的基因集(adaboost精简版1
‑
7),也如图18所展示。将rgh14数据集通过随机选择分成6个部分:一个保留子集,其中12%的样品被排除在模型构建之外,和5个大小均匀的测试子集。
[0319]
对于每个测试子集,将训练数据指定为保留样品或测试样品中的所有样品。将测试样品和训练样品的基因计数在edger中进行tmm归一化,然后进行标准化,使得训练数据对于每个基因的平均值为0并且标准偏差为1。然后将具有90估计量和1.6学习率的adaboost模型拟合到训练数据。然后通过确定模型中每个基因的特征重要性并且使用重要性低于阈值的基因测试消除估计量的影响来执行特征修剪。选择以最少的基因获得最佳性能(如通过关于测试数据分类的matthew相关系数所测量)的阈值,并且保留该模型。该过程从构建adaboost模型开始,对该数据子集最少重复10次。
[0320]
在为5个测试训练子集构建了所有50个以上的模型后,将来自所有模型的估计量合并到单个adaboost模型中。再次进行特征修剪,这次使用将基因纳入阈值的模型的百分比,并且使用平均负对数损失值来评估性能,以对每个测试子集进行分类。选择以最少基因获得最大负对数损失值的模型作为最终adaboost模型。
[0321]
adaboost基因列表。重复此过程后,由于adaboost算法具体实施中固有的随机性,因此在最终模型所选择的基因中观察到了微小变化,然而,在预测测试数据、保留数据和独立(pearl)数据集方面保持高性能。
[0322]
在生成的14个adaboost精简版模型的至少一个中观察到总共11个基因:adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、nes、pappa2、skil、vsig4(adaboost精简版1),尽管未生成同时包含所有基因的模型。
[0323]
观察到的两个基因集对分类独立数据提供了最高性能。这些是adaboost精简版2:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2、vsig4和adaboost精简版3:adamts2、arhgef25、arrdc2、clec4c、lep、pappa2、skil、vsig4。
[0324]
另外四个基因集的表现与adaboost精简版2至3几乎一样高。这些是adaboost精简
版4:adamts2、arhgef25、arrdc4、clec4c、lep、nes、skil、vsig4;adaboost精简版5:adamts2、arhgef25、arrdc2、arrdc4、clec4c、crh、lep、pappa2、skil、vsig4;adaboost精简版6:adamts2、arhgef25、arrdc2、clec4c、lep、skil;以及adaboost精简版7:adamts2、arhgef25、arrdc2、arrdc4、clec4c、lep、pappa2、skil。
[0325]
实施例5
[0326]
用基于转座体的文库制备对c
‑
rna标记进行识别
[0327]
rgh14样品还通过illumina nextera flex for enrichment方案进行处理,富集全外显子组,并且测序至>4000万个读段。对于低输入量,该方法更敏感且更可靠,因此可能识别出预测先兆子痫的另外的基因。该数据集通过以下三种分析方法运行:标准差异表达分析(treat)、刀切法和精简版adaboost模型。有关这些分析方法的详细描述,参见实施例3和实施例4。
[0328]
改变用于产生文库的方法改变了在所有三种分析方法中检测到的基因。对于treat方法,识别出26个在先兆子痫中具有差异丰度的基因,而其中大多数又在先兆子痫中表现出升高的丰度(参见表2,dex分析,nextera flex for enrichment文库制备方法)。这些基因包括adamts1、adamts2、alox15b、amph、arhgef25、celf4、daam2、fam107a、hspa12b、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、pacsin1、pappa2、prx、ptgdr2、sema3g、slc9a3r2、timp3、vsig4。图20示出了具有该基因列表的rgh14样品的分类。
[0329]
应用刀切分析法将treat列表缩减选择为22个被识别为在先兆子痫中具有差异丰度的基因。这些基因包括adamts1、adamts2、alox15b、arhgef25、celf4、daam2、fam107a、htra4、igfbp5、kcna5、krt5、lcn6、lep、lrrc26、nes、olah、prx、ptgdr2、sema3g、slc9a3r2、timp3、vsig4。该列表的改进性能在图20中示出。
[0330]
如实施例4中所述,将精简版adaboost模型方法应用于该数据。使用该方法,识别出24个与先兆子痫在统计学上相关联的基因(表3,adaboost分析,nextera flex for enrichment文库制备方法)。这些基因包括lep、pappa2、kcna5、adamts2、myom3、atp13a3、arhgef25、ada、htra4、nes、crh、acy3、pld4、sct、nox4、pacsin1、serpinf1、skil、semag3、tiparp、lrrc26、phex、lilra4和per1。该预测模型的性能在图21中指出。
[0331]
实施例6
[0332]
来自母体血液的循环转录组测量值检测早发型先兆子痫标记
[0333]
非侵入性地监测从受孕到出生的妊娠健康状况的分子工具将能够准确地检测有不良结果风险的妊娠。循环rna(c
‑
rna)被所有组织释放到血流中,从而对胎盘、胎儿和母体的健康状况进行方便、全面的测量(koh等人,2014,proceedings of the national academy of sciences;111:7361
‑
7366;以及tsui等人,2014,clinical chemistry;60:954
‑
962)。先兆子痫(pe)是一种普遍且可能致命的妊娠并发症,起源于胎盘,但随着疾病的发展而获得大量的母体组分(staff等人,2013,hypertension;61:932
‑
942;以及chaiworapongsa等人,2014,nature reviews nephrology;10,466
‑
480)。然而声称的生物标志物已显示出临床效用受限(poon和nicolaides,2014,obstetrics and gynecology international;2014:1
‑
11;zeisler等人,2016,n engl j med;374:13
‑
22;以及duhig等人,2018,f1000research;7:242)。假设对循环转录组的表征可以识别更好的生物标志物,对113名孕妇分析c
‑
rna,其中40名在早发型pe诊断时分析。使用新颖的工作流程,识别了30
种转录物的丰度的差异,其与pe的生物学一致并且代表胎盘、胎儿和母体的贡献。另外,开发了机器学习模型,证明仅需要七种c
‑
rna转录物就将pe分成两个独立队列(准确度为92%至98%)。在该实施例中公开的c
‑
rna的全局测量突出了在监测母体和胎儿两者的健康状况中的实用性,并且为高危妊娠的诊断和预测提供了广阔的前景。
[0334]
若干项研究已开始调查和识别在c
‑
rna中针对一系列妊娠并发症的潜在生物标志物(pan等人,2017,clinical chemistry;63:1695
‑
1704;whitehead等人,2016,prenatal diagnosis;36:997
‑
1008;tsang等人,2017,proc natl acad sci usa;114:e7786
‑
e7795;以及ngo等人,2018,science;360:1133
‑
1136)。然而,这些研究涉及的患者很少,并且仅限于监测少量基因—几乎仅仅是胎盘和胎儿衍生的转录物。整个循环转录组的测量很难进行,因为它们需要进行特异性的前期样品收集和处理,以最大程度地减小细胞裂解产生的可变性和污染(chiu等人,2001,clinical chemistry;47:1607
‑
1613;以及page等人,2013,plos one;8:e77963)。这种复杂的工作流程使得大量临床样品收集难以实现,因为对于许多诊所而言,立即处理血液样品所需的人力是不可行的(marton和weiner,2013,biomed research international;2013:891391)。因此,在该实施例的情况下,建立了一种方法,该方法允许将血液过夜运输到处理实验室,在该实验室中,样品制备的每个步骤都在受控的环境中进行,从而为临床试验水平的评估提供了可扩展的平台(图22a)。
[0335]
这种方法的关键是能够将血液过夜运输至处理实验室。在若干种试管类型中,在室温下过夜运输后评估了c
‑
rna妊娠信号(图26a至图26c)。储存在edta试管中的血液,先前的c
‑
rna研究所使用的黄金标准,显示出妊娠相关联转录物的丰度降低和转录组学图谱的总体不稳定(qin等人,2013,bmc research notes;6:380)。相比之下,用于非侵入性产前检查(nipt)的主要试管类型即无细胞dna bct(streck)保留了来自胎盘转录物的信号,并且提高了技术再现性(图26b)(medina diaz等人,2016,plos one;11:e0166354)。
[0336]
运输血液使我们能够轻松地从单管血液中平均获得每位患者的5ml血浆。当使用不同的血浆体积时,评估了c
‑
rna数据质量的差异,并且确定使用<2ml血浆显著增加了噪声并降低了文库复杂性(图27a和图27b)。因此,将4ml血浆用于本实施例的研究,以最大化数据质量的置信度。
[0337]
通过重述从第一孕期到第三孕期监测每例健康妊娠>10000种转录物的c
‑
rna动力学的先前工作,验证了这种新颖的工作流程。使用从45例健康妊娠中连续收集的152个样品(先兆子痫和生长受限纵向研究对照队列
‑
pearl;nct02379832;表5),识别出156种显著改变的转录物,其中大多数的丰度随着妊娠进行而增加(图22b)。在先前的c
‑
rna研究中识别出42%的改变基因(图22c)(koh等人,2014,proceedings of the national academy of sciences;111:7361
‑
7366;以及tsui等人,2014,clinical chemistry;60:954
‑
962)。仅在本研究中识别出的91种转录物中,64%由胎盘组织和/或胎儿组织表达(图22d和图28a至图28c)。据推测,其余的基因反映了母体对妊娠的反应。
[0338]
研究设计
[0339]
对于下一阶段的调查,将工作流程应用于临床样品,以测量pe中c
‑
rna的变化(ipc,illumina先兆子痫队列)。pe是异质性障碍,并且基于其是在妊娠34周之前(早发型)还是之后(晚发型)显现而与不同的严重程度和患者结果相关联(staff等人,2013,hypertension;61:932
‑
942;chaiworapongsa等人,2014,nature reviews nephrology;10,
466
‑
4803;以及dadelszen等人,2003,hypertension in pregnancy;22:143
‑
148)。这项研究专注于更严重的早发型pe,并且定义了具有明确的纳入要求和排除要求的严格诊断标准—最关键的是排除了任何具有慢性高血压病史的个体—为了获得干净的队列(表6)(nakanishi等人,2017,pregnancy hypertension;7:39
‑
43;以及hiltunen等人,2017,plos one;12:e0187729)。在整个研究中记录了母体特征、妊娠结果和所用药物(表7)。在8个地点收集了113个样品(表8),40个样品在pe诊断时收集,并且73个对照的胎龄匹配度只相差1周(图23a)。与9.5%的对照相比,除一名患有pe的妇女外,所有其他妇女均早产,证实这些诊断标准识别了受该疾病严重影响的个体(图23c)。
[0340]
将所有样品随机分布在多个处理批次中,然后测序至≥40m读段。使用完整队列的标准差异表达分析识别了42种改变的转录物,其中37种在pe中增加(图24a,蓝色和橙色)。然而,值得关注的是,当选择不同的对照子集进行分析时,在检测到变化的基因中观察到高可变性。
[0341]
为了解决这种差异,结合了刀切法,该方法允许识别出最一致改变的基因(图24a和图24b,橙色)。用随机选择的样品子集进行了1000次差异分析迭代,这允许构建与每种推定变化的转录物相关联的p值的置信区间(图29a)。排除了置信区间超过0.05的12个基因(图24b)。仅通过设置基线丰度或生物学差异的阈值就不会排除这些基因(图29b),然而,观察到这些转录物的预测价值较低(图29c)。分层聚类表明这些基因在pe队列中并未普遍改变,因此缺乏对该条件的准确分类的灵敏性(73%)(图29d)。
[0342]
然后,分析专注于精简的30个基因集,其中60%以前与pe相关联(namli等人,2018,hypertension in pregnancy;37:9
‑
17;than等人,2018,frontiers in immunology;9:1661;kramer等人,2016,placenta;37:19
‑
25;winn等人,2008,endocrinology;150:452
‑
462;以及liu等人,2018,molecular medicine reports;18:2937
‑
2944)。qpcr分析证实了20个基因中的19个在pe中发生了显著改变(图24c,表9)。令人惊讶的是,40%的这些基因编码细胞外或分泌的蛋白质产物。此外,几乎所有基因都参与了pe相关过程,包括细胞外基质(ecm)重塑、妊娠持续时间、胎盘/胎儿发育、血管新生和缺氧反应(表10)。67%的这些转录物由胎盘和/或胎儿表达(图24d)。在其余母体表达的转录物中,心血管功能和免疫功能得到了很好的体现(表10)。这些基因的分层聚类有效地分离了pe样品和对照样品,灵敏度为98%,特异性为97%(图24e)。有意思的是,这两种错误识别的对照的临床数据表明健康问题可能令人困惑,如他们使用高血压药物所表明的那样(表7)。
[0343]
使用在ipc中识别的基因,评估了对从独立生物库获得的样品队列进行聚类的能力—先兆子痫和生长受限纵向研究(pearl;nct02379832;图23b和图23c,表11)。该队列由下列各项组成:早发型pe(在<34周被诊断出)和晚发型pe,以及胎龄匹配的对照。早发型pe样品与匹配的对照分别聚类,灵敏度为83%,并且特异性为92%,进一步验证了这些转录物的相关性(图24f)。相比之下,对于晚发型pe和匹配的对照样品没有观察到聚类(图24g)。
[0344]
然后,将ipc数据用于构建adaboost模型,以对pe样品进行可靠的分类。为了创建可以准确地预测新样品的通用机器学习模型,使用了一种严格的方法,该方法避免过度拟合到单个数据集,并且用未用于模型构建的样品来验证最终的分类模型(图30a至图30d,以及图31a至图31e)。出乎意料的是,最终模型仅利用了7个基因,其中3个基因以前没有被报道过(图25a)。对于整个ipc队列,该模型以极高的准确性对样品进行了分类(auc=0.99,灵
敏度=98%,特异性=99%;图25b和图25c,蓝色)。还对早发型pe pearl样品进行了准确分类(auc=0.88,灵敏度=100%,特异性=83%;图25b和图25c,粉红色)。出乎意料的是,还以合理的准确性对晚发型pe pearl样品进行了分类(auc=0.74,灵敏度=75%,特异性=67%;图25b和图25c,绿色)。
[0345]
该基因集与通过差异丰度分析识别的转录物高度一致(图25d;表10)。分类模型依赖于胎盘和母体表达的转录物(图25e)。该模型使用的所有基因形成细胞外或膜结合的蛋白质产物。尽管adaboost选择的基因数量很少,但是观察到多种多样与pe相关的功能,特别是心血管功能和血管新生、免疫调节、胎儿发育和ecm重塑。
[0346]
方法
[0347]
前瞻性临床样品收集。怀孕患者被招募到illumina赞助的符合国际协调会议优良临床试验规范的临床研究方案中。知情同意后,从40名妊娠34周前以其严重特征符合acog指南定义而诊断为先兆子痫的怀孕妇女中收集20ml全血样品(表6)。还收集了来自76例健康妊娠的样品,并且根据其胎龄与先兆子痫组进行匹配。三个对照样品在收集血液后出现足月先兆子痫,并且从数据分析中排除。详细的纳入标准和排除标准参见表6。还记录了患者的临床病史、治疗和出生结果信息(表7)。
[0348]
在8个不同的临床地点招募患者,包括university of texas medical branch(galveston,texas)、tufts medical center(boston,ma)、columbia university irving medical center(new york,ny)、winthrop university hospital(mineola,ny)、st.peter’s university hospital(new brunswick,nj)、christiana care(newark,de)、rutgers university robert wood johnson medical school(new brunswick,nj)和new york presbyterian/queens(new york,ny)。该临床方案和知情同意书已获得每个临床地点的机构审查委员会的批准。有关患者在临床地点的分布,参见表8。
[0349]
pearl验证队列研究设计。illumina从先兆子痫和生长受限纵向研究(pearl;nct02379832)获得的血浆样品将用作独立的验证队列。在研究已完成后获得了血浆样品。在centre hospitalier universitaire de qu
é
bec(chu de qu
é
bec)处与主要调查人员医学硕士emmanual bujold一起收集pearl样品。在这项研究中招募了一组45例对照妊娠和45例妊娠,并且获得了所有患者的书面知情同意。只有超过18岁的参与者才有资格,并且所有妊娠者均为单胎。
[0350]
先兆子痫组。先兆子痫的标准是基于加拿大妇产科医生学会(sogc)2014年6月版先兆子痫标准定义的,且胎龄要求介于20周与41周之间。诊断时取一次血液样品。
[0351]
对照组。在11周与13周胎龄之间招募了45名预期正常妊娠的怀孕妇女。在整个妊娠至出生期间的4个时间点,对每位招募患者进行纵向抽血。将对照妇女分成三个子组,并且后续的随访抽血被错开以覆盖整个妊娠期的整个胎龄范围(表5)。
[0352]
将pearl对照样品用于两个目的。来自45名女性个体的153个纵向样品用于监测整个妊娠期的胎盘动力学。此外,选择对照样品以与先兆子痫队列进行比较,将其根据胎龄进行匹配并且用于验证模型。
[0353]
研究样品处理。不了解疾病状态的调查人员对来自illumina前瞻性收集的所有样品和pearl样品进行了相同的处理。按照制造商的说明,每位患者在无细胞dna bct试管(streck)中收集两管血液。在室温处储存和过夜运输血液样品,并且在72小时内处理。在室
温处将血液以1600
×
g离心20分钟,将血浆转移至新试管中,并且以16000
×
g再离心10分钟以去除残留细胞。将血浆在
‑
80℃处储存,直至使用。使用循环核酸试剂盒(qiagen)从4.5ml血浆中提取循环rna,之后根据制造商的说明进行dna酶i消化(thermofisher)。
[0354]
cdna合成和文库制备。使用illumina trusight tumor 170文库制备试剂盒(illumina)在94℃处将循环rna片段化8分钟,之后进行随机六聚体引发的cdna合成。根据用于rna的tst170肿瘤文库制备试剂盒进行illumina测序文库制备,并进行了以下修改以适应低rna输入量。将所有反应物减少至原始体积的25%,并且以1:10稀释度使用连接衔接子。使用高灵敏度dna分析试剂盒,通过agilent bioanalzyer 2100(agilent)评估了文库质量。
[0355]
全外显子组富集。使用quant
‑
it picogreen dsdna试剂盒(thermofisher scientific)对测序文库进行定量,归一化至200ng输入量,并且每个富集反应合并到4个样品中。根据truseq rna获取文库制备指南(illumina)进行全外显子组富集。富集反应中还包括缺少针对血红蛋白基因hba1、hba2和hbb设计的5’生物素的另外的阻断寡核苷酸,以减少测序文库中这些基因的富集。使用quant
‑
it picogreen dsdna试剂盒(thermofisher scientific)对最终富集文库进行定量,归一化并合并,以在illumina hiseq 2000平台上进行配对末端50
×
50测序,每个样品的最小深度为4000万个读段。
[0356]
数据分析。除非另有说明,否则所有统计测试都是双侧的。当数据不是正态分布时,使用非参数测试。将测序读段用tophat(v2.0.13)映射到人类参考基因组(hg19),并且用featurecounts(subread
‑
1.4.6)相对于refgene坐标(10/27/2014获得)量化转录物丰度。组织表达数据获自body atlas(correlationengine,basespace,illumina,inc)(kupershmidt等人,2010,plos one 5;10.1371/journal.pone.0013066)。将在胎盘或任何胎儿组织(脑、肝、肺和甲状腺)中的所有组织中表达≥中值表达2倍的v基因分配到该组中。亚细胞定位获自uniprot。
[0357]
在排除<25%样品中cpm≤0.5的基因之后,使用edger(v3.20.9)在r(v3.4.2)中进行差异表达分析。通过tmm方法对数据集进行归一化,并且通过对于对数倍数变化≥1进行glmtreat测试识别出差异丰度基因,之后进行bonferroni
‑
holm p值校正。对每次刀切迭代使用相同的过程,使用每组中90%的样品(通过随机取样选择而无需替换)。经过1000次刀切迭代后,用统计模型(v0.8.0)计算基因水平p值的单侧95%置信区间。用平方欧几里德距离和平均连锁进行分层聚类分析。
[0358]
adaboost用scikit
‑
learn(v0.19.1,sklearn.ensemble.adaboostclassifier)在python中执行。通过网格搜索确定最佳超参数值(估计量为90,学习率为1.6),使用matthew相关系数来量化性能。总体adaboost模型开发策略在图31a至图31e中进行了说明。在拟合分类模型之前,先对数据集(<25%样品中cpm≤0.5的基因的tmm归一化对数cpm值)进行标准化(sklearn.preprocessing.standardscaler)。将拟合于训练数据的相同缩放器应用于相应的测试数据集;将用于5个训练数据集的所有5个缩放器平均后用于最终模型。将决策函数评分用于构建roc曲线并且确定样品分类。
[0359]
rt
‑
qpcr验证测定和分析。从随机选择的19个先兆子痫(pe)样品和19个匹配的对照样品中的2ml血浆分离c
‑
rna并且转化为cdna。使用taqman preamp主混合物(目录号4488593)将cdna预扩增16个循环,并且稀释10倍至500μl的最终体积。对于qpcr,使用制造
商的说明,反应混合物含有5μl稀释的预扩增cdna、10μl taqman基因表达主混合物(目录号4369542)、1μl taqman探针和4μl水。对于每个taqman探针(表9),每个稀释的cdna样品均进行三个qpcr反应,并且使用bio
‑
rad cfx管理器软件来确定cq值。为了确定每个靶基因的基因丰度,使用五个参考基因探针之间的平均cq值(参考cq
avg
)计算δδcq=2^
‑
(靶标cq
–
参考cq
avg
)。为了确定每个探针的倍数变化(pe/ctrl),将每个样品的δδcq值除以匹配对照组的平均δδcq值。
[0360]
试管类型研究。为了评估试管类型和过夜运输对循环rna品质的影响,将血液从怀孕女性和非怀孕女性中抽取在以下试管类型中:k2 edta(beckton dickinson)、acd(beckton dickinson)、无细胞rna bct试管(streck)和1无细胞dna bct试管(streck)。将8ml血液抽取到每根试管中,并且在冰袋上(edta和acd)运输过夜,或者在室温处(无细胞rna试管和dna bct试管)运输。抽血后24小时内将所有运输的血液试管处理成血浆。作为参考,还将8ml血液抽取到k2 edta试管中,并在4小时内就地处理成血浆,并且作为血浆在干冰上运输。如方法部分中所述进行所有血浆处理和循环rna提取。每个条件使用3ml血浆以生成测序文库,以便如所述使用illumina方案进行富集。
[0361]
再现性研究。从10位个体获得血浆并且将其分成4ml、1ml和0.5ml体积,每个体积进行3次平行测定。如前所述,对所有样品进行循环rna提取(qiagen循环核酸试剂盒)和随机引发的cdna合成。对于使用4.5ml血浆输入量的文库,如上所述使用tst170肿瘤文库制备试剂盒生成测序文库。对于1ml和0.5ml的输入量,使用accel
‑
ngs 1s plus dna文库试剂盒(swift biosciences)生成文库。如上所述对所有样品进行了全外显子组富集和测序。
[0362]
讨论
[0363]
这项研究专注于识别早发型pe普遍的差异、支持临床可行的生物标志物发现的最终目标。这需要调整分析方法以解决数据中观察到的可变性。这种可变性源于c
‑
rna测量中的大量生物学噪声以及pe的表型多样性。c
‑
rna本质上比单组织转录组学更具可变性,因为它代表了细胞死亡、信号传导和所有器官中的基因表达的组合。此外,pe表现出广泛范围的母体和胎儿结果,这可能与不同的潜在分子原因相关联。尽管被消除的基因可能在pe中具有生物学相关性,但它们在队列中并不普遍。有趣的是,被排除的转录物在可能代表pe的分子子集的特定女性中升高。较大的队列将有助于阐明c
‑
rna是否能够描述pe亚型,这对于了解该病症的多种病理生理学是至关重要的。
[0364]
通过adaboost识别出最普遍的转录物集。该方法的成功通过对独立的早发型pe队列(pearl)的高度准确分类来强调。这些样品是从具有明显宽松的纳入标准和排除标准的不同群体中收集的,例如,包括对照组中的妇女患有慢性高血压、妊娠期糖尿病或alport综合征—没有一个被误认为患有pe。与分层聚类相比,通过该实施例的机器学习模型对来自晚发型pe队列的24位个体中的17位进行了正确分类,在表明早发型pe和晚发型pe是不同病症的情况下,这是令人惊讶的。该实施例的发现表明,在所有pe中可能存在一些普遍改变的途径。
[0365]
在每次评估中,c
‑
rna揭示了胎盘、胎儿和母体表达的转录物的变化。在pe样品中观察到的最引人注目的趋势之一是大量ecm重塑和细胞迁移/侵袭蛋白(fam107a、slc9a3r2、timp4、adamts1、prg2、timp3、lep、adamts2、zeb1、hspa12b)的丰度增加,并伴有功能失调性绒毛外滋养层浸润和这种疾病特征性的母体血管重塑。早发型pe的母本侧表现
为心血管功能障碍、炎症和早产(pnmt、zeb1、crh),在该实施例的数据中,所有这些均示出异常行为的分子迹象。
[0366]
表5:45例健康妊娠的pearl对照队列胎龄分布
[0367][0368]
表6:具有严重特征的先兆子痫的诊断标准和纳入/排除标准
[0369]
[0370][0371]
表7:先兆子痫队列的研究特征
[0372]
[0373][0374]
*定义为出生体重<男性或女性胎儿群体的10%
[0375]
表8:医疗中心收集地点患者分布
[0376][0377]
表9:通过taqman qpcr验证的基因
[0378]
[0379]
[0380][0381]
表11:先兆子痫队列的研究特征
[0382][0383][0384]
*定义为出生体重<男性或女性胎儿群体的10%
[0385]
实施例7
[0386]
来自母体血液的循环转录组测量检测早发型先兆子痫的分子标记
[0387]
循环rna(c
‑
rna)不断地从全身的组织释放到血流中,从而提供非侵入性地监测从受孕到出生的妊娠健康状况的所有方面的机会。该实施例确定,c
‑
rna分析可以检测被诊断为患有先兆子痫(pe)(一种普遍且可能致命的妊娠并发症)的患者中的异常。作为初始检查,在严重的早发型pe诊断时对来自40例妊娠的循环转录组连同73例胎龄匹配的对照进行测序。与pe的生物学一致的30种转录物发生了改变,并且很可能代表胎盘、胎儿和母体对该疾病的贡献。另外,机器学习识别了c
‑
rna转录物的组合,这些转录物将pe患者可靠地分类为两个独立的队列(准确性为85%至89%)。c
‑
rna反映母体、胎盘和胎儿健康的能力为改善高危妊娠的诊断和识别提供了广阔的前景。概括地说,循环转录组反映了早发型严重先兆子痫患者的生物学相关变化,并且可以用于对患者状态进行准确地分类。
[0388]
先兆子痫(pe)是最常见和最严重的妊娠并发症之一,在世界范围内影响估计4%至5%的妊娠(abalos等人,2013,eur j obstet gynecol reprod biol;170:1
–
7;以及ananth等人,2013,bmj;347:f6564),并且与母体和围产期的高发病率和高死亡率相关联(kuklina等人,2009,obstet gynecol;113:1299;basso等人,2006,jama;296:1357
–
1362)。在美国,pe的发病率由于母亲年龄增长和共病(诸如肥胖症)患病率增加而增大(spradley等人,2015,biomolecules;5:3142
–
3176),美国保健系统在pe上每年估计花费20亿美元(stevens等人,2017,am j obstet gynecol;217:237
‑
248.e16)。
[0389]
pe被诊断为新发病的高血压,伴有妊娠20周后出现的母体终末器官损伤(hypertension in pregnancy:executive summary,2013,obstet gynecol;122:1122;以及tranquilli等人,2014,pregnancy hypertens;4(2):97
–
104)。然而,在pe的呈现和进展中存在显著的异质性,包括疾病发作的特定时间、症状严重程度、临床表现,以及母亲和新生儿的结果(lisonkova和joseph,2013,am j obstet gynecol;209:544.e1
‑
544.e12)。pe主要基于其是在34周之前显现(早发型)还是之后显现(晚发型),以及其是否表现出严重特征(诸如血压持续升高≥160/110mmhg)、神经症状和/或严重的肝或肾损伤来描述(american college of obstetricians and gynecologists,task force on hypertension in pregnancy,2013,obstet gynecol;122:1122
–
1131)。
[0390]
早发型pe的病理生理学尚未完全了解,但被认为以两个阶段发生(phipps等人,2019,nature reviews nephrology;15:275)。早发型pe起源于第一孕期的异常植入和胎盘形成,与以下各项有关:母体免疫功能障碍有关(hiby等人,2010,j clin invest;120:4102
–
4110;等人,2015,reproduction;149:r91
–
r102;以及girardi,2018,semin immunopathol;40:103
–
111)、细胞滋养层分化不完全(zhou等人,1997,j clin invest;99:2152
–
2164),和/或母体
‑
胎盘界面处的氧化应激(burton和jauniaux,2011,best pract res clin obstet gynaecol;25:287
–
299),从而导致母体螺旋动脉重塑不完全并且不能建立最终的子宫胎盘循环(lyall等人,2013,hypertension;62:1046
–
1054)。这导致胎盘在妊娠20周后灌注不充分。所产生的胎盘失调触发第二阶段,其主要表现为对胎儿具有负面后果的母体系统性血管功能障碍,这些负面后果包括胎儿生长受限和医源性早产(hecht等人,2017,hypertens pregnancy;36:259
–
268;young等人,2010,annu rev pathol;5:173
–
192;以及backes等人,2011,j pregnancy;2011:doi:10.1155/2011/214365)。相比之下,晚发型pe中的胎盘功能障碍被认为不是由于异常胎盘形成、而是由于母体血管疾病引起的胎
盘灌注紊乱所导致的,诸如在患有以下疾病的患者中所见:慢性高血压、孕前糖尿病(vambergue和fajardy,2011,world j diabetes;2:196
–
203),以及胶原血管障碍(“placental pathology in maternal autoimmune diseases
‑
new insights and clinical implications,”2017,international journal of reproduction,contraception,obstetrics and gynecology;6:4090
–
4097)。
[0391]
该疾病的异质性和复杂性使得难以诊断、预测风险和开发治疗。此外,不能容易地探究原发性患病器官胎盘具有有限的疾病进展分子表征。循环rna(c
‑
rna)已显示出在妊娠期间非侵入性地监测母体、胎盘和胎儿动力学的广阔前景(tsui等人,2014,clin chem;60:954
–
962;以及koh等人,2014,proc natl acad sci u s a;111:7361
–
7366)。许多组织经由细胞凋亡、微囊泡脱落和外来体信号传导的多种细胞过程将c
‑
rna释放到血流中(van niel等人,2018,nat rev mol cell biol;19:213
–
228)。由于这些不同的来源,c
‑
rna测量反映了基因表达、细胞间信号传导以及全身的不同组织内发生的细胞死亡程度的组织特异性变化。因此,c
‑
rna具有阐明pe的分子基础并且最终识别该疾病的预测性、预后性和诊断性生物标志物的潜力(hahn等人,2011,placenta;32:s17
‑
20)。
[0392]
若干项研究已开始调查和识别一系列妊娠并发症(包括早产、pe和感染性疾病)的潜在的基于c
‑
rna的生物标志物(pan等人,2017,clin chem;63:1695
‑
1704;ngo等人,2019,science;360:1133
–
1136;以及whitehead等人,2016,prenat diagn;36:997
–
1008)。然而,该样品类型中显著的个体间可变性具有将疾病特异性生物标志物的细微变化掩盖的危险(meder等人,2014,clin chem;60:1200
–
1208)。因此,许多专注于pe的c
‑
rna研究已经测量了先前识别的血清蛋白生物标志物(包括可溶性flt1、可溶性内皮糖蛋白,以及氧化应激和血管生成标志物)的rna(nakamura等人,2009,prenat diagn;29:691
–
696;purwosunu等人,2009,reprod sci;16:857
–
864;以及paiva等人,2011,j clin endocrinol metab;96:e1807
‑
1815)。虽然已知这些血清标志物的蛋白质测量值在pe中发生改变(maynard等人,2003,j clin invest;111:649
–
658;venkatesha等人,2006,nat med;12:642
–
649;以及rana等人,2018,pregnancy hypertens;13:100
–
106),但是还不知道它们是否将在c
‑
rna中充当最有效的预测因子,因此保证更广泛的发现方法。
[0393]
在该实施例中,循环转录组的全局测量检测对于早发型严重pe具有特异性的独特分子标记。为了便于发现,优化了用于高通量测序的全转录组富集的性能,从而允许以高置信度测量每个样品>14000种c
‑
rna转录物。然后从113例妊娠的预备队列中全面表征c
‑
rna谱图,其中40例被诊断为早发型严重pe。所有分析方法被调整为解决c
‑
rna固有的高生物学差异,并且识别出与pe生物学一致的改变的转录物,所述pe生物学能够以高准确性对所有队列进行分类,从而强调该样品类型提供了开发用于评估先兆子痫的可靠测试的途径。
[0394]
结果
[0395]
建立c
‑
rna的可再现的全转录组工作流程。
[0396]
c
‑
rna以相对低的丰度存在于血浆中,由核糖体rna(rrna)和珠蛋白rna支配,并且是片段化转录物和全长转录物的混合物(crescitelli等人,2013,j extracell vesicles;2:doi:10.3402/jev.v2i0.20677),所有这些都可能影响文库制备方法用于下一代测序的效率。因此,优化工作流程以使可变性最小化并且使外显子c
‑
rna信号最大化(图37a)。
[0397]
高丰度珠蛋白和rrna不告知生物标志物发现,因此必须被去除。然而,标准的消耗
hum reprod;17:702
–
9;grammatopoulos和hillhouse,1999,lancet;354:1546
–
1549;以及marshall等人,2017,reprod sci;24:342
–
354)。来自pearl cc的结果与文献高度一致,因为在先前的c
‑
rna研究中,42%的改变的基因被识别出来(图32b)(tsui等人,2014,clin chem;60:954
–
962;以及koh等人,2014,proc natl acad sci u s a;111:7361
–
7366)。仅在本研究中识别出的91种转录物中,64%由胎盘组织和/或胎儿组织表达(组织特异性被定义为比body atlas中所有组织的中值高2倍)(图32c和图17)(kupershmidt等人,2010,plos one;5:e13066)。假设其余的基因反映母体组织对妊娠的反应(表14)。
[0401]
早发型严重pe的临床研究设计
[0402]
在确认该工作流程可靠地检测妊娠相关c
‑
rna动力学之后,然后识别与妊娠并发症相关联的c
‑
rna的变化。将该工作流程应用于从两个独立的pe队列即illumina先兆子痫队列(ipec;nct02808494)和pearl先兆子痫队列(pearl pec;nct02379832)收集的样品。ipec用于生物标志物识别,而pearl pec用于独立地确认我们的发现。重要的是,将两个队列中的所有样品均收集在streck无细胞dna bct中,并且以与先前部分中所讨论的方式相同的方式生成文库。
[0403]
ipec研究专注于具有严重特征的早发型pe,并且排除被诊断为患有附加的健康并发症(诸如慢性高血压或糖尿病)的女性,以防止附加的异质性将一致的pe相关联c
‑
rna信号掩盖(表15)。在8个地点收集了113个样品(表17),40个样品在早发型pe诊断时收集,并且73个对照的胎龄匹配度只相差1周(图33a)。在整个研究中记录了母体特征、妊娠结果和药物(表12和表16)。pe组与对照组之间的胎儿性别、母亲年龄和未产妇没有显著差异。相比之下,在pe队列中bmi显著较高(p值=0.0007)(o’brien等人,2003,epidemiology;14:368
–
374)。与9.5%的对照相比,除一名pe患者外,所有其他患者均早产,证实我们的诊断标准识别了受该疾病严重影响的个体(图33c)。
[0404]
pearl pec样品由独立的机构(chu de qu
é
bec
‑
universit
é
laval)收集,并且由12例早发型pe妊娠和12例晚发型pe妊娠与相等数目的胎龄匹配对照组成(图33b)。在整个研究中记录了母体特征、妊娠结果和所用药物(表18)。如在ipec中,100%的早发型患者提前分娩,而晚发型队列中的75%足月分娩,证实了与早发型pe和晚发型pe相关联的严重程度的差异。慢性高血压、糖尿病和其他母体健康状况不是排除的理由,使得该队列更能代表怀孕群体固有的异质性。
[0405]
识别在早发型pe中一致改变的转录物
[0406]
使用完整ipec队列的标准差异表达分析(robinson等人,2010,bioinformatics;26:139
–
140)识别了42种在血浆中丰度改变的转录物,其中37种在pe中增加(图34a,蓝色和橙色)。然而,当选择不同的样品子集进行分析时,观察到差异丰度转录物的可变性。因此结合了刀切法(library,1958,ann math statist;29:614
–
623),使得能够识别当将pe与对照样品比较时最一致地改变的转录物丰度(图34a和图34b,橙色)。用随机选择的pe样品子集和对照样品子集进行了一千次差异分析迭代,这导致构建了与每种推定变化的转录物相关联的p值的置信区间(图34c)。随后排除了p值置信区间超过0.05的12种转录物(图34b)。仅通过设置基线丰度或生物学差异的阈值就不会排除这些转录物(图34d),然而,观察到这些转录物的预测价值较低(图34e)。分层聚类表明这些转录物在pe队列中并未普遍改变,因此缺乏对该条件的准确分类的灵敏性(73%)(图34f)。
[0407]
在受影响的ipec患者样品和对照ipec患者样品的子集中,通过qpcr独立地定量在pe中改变的20种转录物的代表性组。通过qpcr测得的倍数变化与测序数据高度一致,从而验证了我们的发现(图35a和表19)。该精简列表中58%的转录物先前已与pe相关联(表20)。此外,几乎所有基因都可能与pe相关过程有关系,这些过程包括细胞外基质(ecm)重塑、妊娠持续时间、胎盘/胎儿发育、血管新生和缺氧反应(表20)。67%的这些基因由胎盘和/或胎儿表达(图35b)。在其余母体表达的基因中,心血管功能和免疫功能得到了很好的体现,这两种功能在pe中均被改变(表20)(phipps等人,2019,nature reviews nephrology;15:275)。
[0408]
这些转录物的分层聚类有效地将pe样品和对照样品与ipec分离,灵敏度为98%,特异性为97%(图35c)。用独立的pearl pec验证30种转录物的精简列表。早发型pe样品与匹配的对照分别聚类,灵敏度为83%,并且特异性为92%,进一步验证了这些转录物的相关性(图35d)。相比之下,对于晚发型pe样品和匹配的对照样品没有观察到聚类,表明晚发型pe具有可能较弱或者更可能不同的c
‑
rna标记(图35e)(redman,2017,an international journal of women’s cardiovascular health;7:58;以及hahn等人,2015,expert rev mol diagn;15:617
–
629)。
[0409]
在更仔细地检查三个被错误聚类的ipec样品的临床数据后,发现两种对照遭受潜在混杂的健康问题,包括高血压以及在一种情况下伴随早产。由于我们的严格排除标准,这些对照应当未入选于ipec中,因此它们被排除在进一步的分析之外。被错误聚类的pe样品未表现出临床异常,因此保留在我们的ipec数据集中。
[0410]
开发用于早发型pe的可靠机器学习分类模型
[0411]
差异表达分析证实,c
‑
rna检测pe患者中的生物学相关变化。为了评估c
‑
rna标记是否能够可靠地将pe分类,使用来自ipec队列的数据构建了adaboost模型(freund和schapire,1997,j comp sys sci;55:119
–
139;mcpherson等人,2011,plos comput biol;7:doi:10.1371/journal.pcbi.1001138;以及lu等人,2015,plos one;10:e0130622)。随机选择的10%的样品作为保留集从整个机器学习过程中排除,以评估最终模型性能。然后,将嵌套交叉验证方法用于超参数优化(图42)和adaboost模型构建(图43)(cawley和talbot,2010,j machine learning res;11:2079
–
2107)。
[0412]
在开发该机器学习方法的同时,在adaboost性能和根据训练中包括哪些样品而选择的基因中观察到高度可变性(图44)。这些观察结果表明,不同的样品子集显著影响模型构建(assessing and improving the stability of chemometric models in small sample size situations|springerlink(可在万维网上以链接link.springer.com/article/10.1007%2fs00216
‑
007
‑
1818
‑
6获得)),这可能部分归因于pe的异质性。为了解释这种多样性,将adaboost模型拟合到训练样品的多种组合。然后将来自这些正交产生的模型的估计量组合成单个聚集体并且修剪以获得最小基因集(图43)(和su
á
rez,2007,pattern recognition letters;28:156
–
165;以及aveboost2:boosting for noisy data|springerlink((可在万维网上以链接link.springer.com/chapter/10.1007/978
‑3‑
540
‑
25966
‑
4_3获得)))。这允许在具有对来自广泛的妊娠群体的独立样品进行准确分类的潜力的精简机器学习模型中捕集各种各样的pe表现。
[0413]
在交叉验证的每个倍数内,识别了阈值adaboost评分,用于区分灵敏度和特异性
均最大化的pe样品和对照样品。在所有的十倍中,我们获得了0.964( /
‑
0.068sd)的平均roc(图36a)。首先在保留ipec样品中评估性能,获得89%( /
‑
5%sd)准确性,灵敏度为88%( /
‑
13%sd)且特异性为92%( /
‑
6%sd)(图36b,蓝色)。adaboost分类性能不受血浆处理前的时间量的影响,这进一步支持我们的样品制备方案和分析的可靠性(图40d和图40e)。随后调查该模型对独立的pearl pec队列进行分类的能力。早发型pearl pec样品实现了85%( /
‑
4%sd)准确性,灵敏度为77%( /
‑
9%sd)且特异性为92%( /
‑
7%sd)(图36b,粉红色)。出乎意料的是,还以合理的准确性72%( /
‑
6%sd)、灵敏度59%( /
‑
10%sd)和特异性80%( /
‑
10%sd)对晚发型pearl pec样品进行了分类(图36b,绿色)。
[0414]
adaboost使用了49种总转录物,在至少2轮模型构建中选择了63%(图36c)。用先前的分析观察一致性,因为在刀切分析中识别的基因的40%也用于机器学习中(图36d,表21)。分类模型所使用的转录物的38%在胎盘和/或胎儿中的表达升高(图36e)。观察到反映pe相关途径多样性的转录物,尤其是与免疫调节和胎儿发育相关联的基因(表21)。
[0415]
讨论
[0416]
全转录组c
‑
rna分析揭示了有效发现生物标志物所必需的广泛的网络,从而捕获了妊娠期在单个时间点的多种多样且复杂的相互作用的分子快照。调整工作流程和分析以使技术噪声最小化、获得高质量c
‑
rna测量值,并且最终检测生物学相关改变。重要的是,在诊断时检测到对于早发型严重pe的复杂病理生理学具有特异性的分子变化,从而支持对所有队列的可靠分类。所识别的改变的c
‑
rna转录物表示来自母体组织、胎盘组织和胎儿组织的贡献,其中许多在关注于分娩后收集的胎盘组织的研究中将不会被捕获。这些发现突出了c
‑
rna在怀孕期间全面监测由不同来源组织贡献的信号的能力。
[0417]
为了识别能够检测妊娠中的全面变化和潜在细微变化的最佳方法,确定血浆输入量、文库制备方法和bct对c
‑
rna数据质量的影响。由于大多数转录物似乎以低丰度存在于血浆中,所以在方案中选择使用4ml血浆输入量,以使得由于取样误差和差的文库转化(这两者均困扰着低输入量测序应用)所引起的噪声最小化。大量rna的前期消耗并未消除所有污染rna种类,这些种类在我们的样品群体中是众多且多样的。这使得靶向消耗不可行,因此我们选择全转录组富集方法来一致地分离感兴趣的外显子c
‑
rna信号。过夜运输是该方案的后勤要求,但存在引入由于c
‑
rna降解所引起的信号损失以及被细胞裂解所产生的附加rna污染的风险。选择了streck无细胞dna bct,其在室温处抑制细胞裂解(zhao等人,2019,j clin lab anal;33:e22670)。该bct不是为rna稳定而专门设计的,但在储存数天后几乎观察不到c
‑
rna降解的证据。先前的研究已显示,c
‑
rna具有充分的内源性保护,免受细胞外核酸酶的影响(tsui等人,2002,clin chem;48:1647
–
1653),因此不需要额外的预防措施来保护该rna。这些优化一起确定了使c
‑
rna转录组学信号最大化并且使技术可变性最小化的工作流程,如通过在全部健康妊娠和pe妊娠中观察到的许多生物学相关改变所展示的。
[0418]
分析接下来将我们的分析专注于识别对于该疾病(即具有严重特征的早发型pe)的最极端表型普遍存在的循环转录组中的差异。这需要调整我们的方法来考虑在我们的数据中观察到的可变性,这种可变性源于c
‑
rna测量中的大量生物学噪声以及pe的表型多样性。c
‑
rna本质上比单组织转录组学更具可变性,因为它询问来自各种各样的组织和生物学过程的rna,不仅检测基因表达的变化,而且还检测细胞死亡速率和细胞间信号传导速率的
差异。此外,pe表现出广泛范围的母体和胎儿的表现和结果,这可能与不同的潜在分子原因和反应相关联。虽然在刀切法之后被消除的基因可能在pe中具有生物学相关性,但它们在受影响的队列中未被普遍改变。这些转录物可以指示该疾病的分子子集,并且较大的队列将有助于阐明c
‑
rna是否能够进一步描述pe亚型,这对于了解该综合征的多种病理生理学是至关重要的。
[0419]
由刀切法识别的转录物表示跨越母胎界面的多种多样的功能。大多数所识别的变化与胎盘功能障碍和胎儿发育改变相关。最引人注目的趋势之一是ecm重塑和细胞迁移蛋白(n=10)的丰度增加,并伴有早发型pe的功能失调性绒毛外滋养层浸润特征(yang等人,2019,gene;683:225
–
232;zhu等人,2012,rev obstet gynecol;5:e137
–
e143;以及wang等人,2019,scientific reports;9:2728)。20%的识别出的失调基因编码血管生成蛋白,这与许多观察结果一致,即血管生成因子的平衡在调节胎盘血管发育中起关键作用(cerdeira等人,2012,cold spring harbor perspectives in medicine;2:a006585
–
a006585)并且可以识别具有严重特征的早发型pe(zeisler等人,2016,nengl j med;374:13
–
22)。这里呈现的数据表明,在早发型严重pe中胎儿的生长和发育也受到扰乱,如通过4种编码igf信号传导调节因子的转录物的丰度增加所证实的(argente等人,2017,embo mol med;9:1338
–
1345;以及weyer和glerup,2011,biol.reprod;84:1077
–
1086),其中igf信号传导是胎儿发育的关键途径(forbes和westwood,2008,horm res;69(3):129
–
137)。其余的转录物捕获pe的母体组分,即免疫系统和心血管系统失调。母体免疫失衡(pe的特点)的证据表现为免疫耐受性以及促炎因子和抗炎因子的丰度改变(chistiakov等人,2014,front physiol;5(2014),doi:10.3389/fphys.2014.00279;kumar等人,2012,cancers(basel);4:1252
–
1299;qi等人,2003,nature medicine;9:407;以及yang等人,2014,biochim biophys acta;1840:3483
–
3493)。还将对血压调节以及与动脉粥样硬化相关的若干基因重要的转录物识别为在pe c
‑
rna图谱中发生改变,这与母体血管疾病作为使一些患者易患pe的潜在机制一致(cal
ò
等人,2014,j hypertens;32:331
–
338;以及magnusson等人,2012,plos one;7:e43142)。所识别的转录物捕获了多种多样的pe相关功能,并且突出了c
‑
rna同时监测复杂疾病中所涉及的许多分子过程的能力。
[0420]
接下来,确定c
‑
rna是否不仅能够检测生物学相关变化,而且还能够准确地对受到早发型严重pe影响的妊娠进行分类。本文所述的建立adaboost模型的仔细方法识别了可以对不同的患者子集进行分类的转录物组合,同时排除了可能导致我们的模型中的过度拟合和偏差的特征。虽然由adaboost使用的76%的转录物未被识别为具有差异丰度,但它们仍然反映了在我们的刀切分析中捕获的相同pe相关途径。该策略的成功通过对独立的早发型pearl pec的高度准确分类来展示。在诊断时从与用于训练的群体(纳入标准和排除标准不太严格)不同的群体收集这些样品。例如,该队列包括5名患有慢性高血压或妊娠糖尿病的妇女,其中只有1名被几个adaboost模型错误分类,表明机器学习中利用的c
‑
rna变化对于pe具有高度特异性。
[0421]
该实施例提供了改善对pe的理解和诊断的重要步骤。我们的规模有限的临床队列并未捕获全球怀孕群体的表型多样性,并且这反映在分类分析中获得的灵敏度值比特异性值低中。较大的队列将更好地涵盖pe的异质性,从而识别疾病的不同表现的信号。第二个限制是全转录组富集的靶向性质,因此,不捕获血浆中存在的全范围的非编码或非人类转录
物。某些感染和mirna一直与pe相关联(nourollahpour shiadeh等人,2017,infection;45:589
–
600;以及skalis等人,2019,microrna;8:28
–
35)。因此,未来的研究应当旨在将这些测量值与c
‑
rna转录组学数据结合。尽管该实施例的发现与文献中报道的高度一致,但并未观察到广泛报道的血清蛋白生物标志物诸如可溶性flt1(sflt)、血管内皮生长因子(vegf)或胎盘生长因子(pigf)的转录物中的改变(phipps等人,2019,nature reviews nephrology;15:275)。考虑到基因表达并不总是与蛋白质丰度或释放到循环中相关,该结果是意料之中的。
[0422]
ipec样品收集特别关注在诊断时具有严重特征的早发型pe。虽然这是该疾病的最极端表型,但它代表pe病例的一小部分,因而有必要进一步深入探究临床pe谱。作为初步检查,将adaboost模型应用于晚发型pearl pec队列,并且实现了相当好的准确性(72%)。考虑到早发型pe和晚发型pe尽管具有胎盘功能障碍的最终共同表型,但却是不同病症的实质性证据,该结果是令人惊讶的(burton等人,2019,bmj;366:l2381)。因此,由adaboost识别的一些转录物很可能反映了对子宫胎盘功能不全而不是其来源的反应,因此在疾病进展早期可能不具有预测价值。相比之下,观察到涉及血管新生和滋养层浸润的转录物的改变(xie等人,2018,res commun;506:692
–
697;hunkapiller等人,2011,development;138:2987
–
2998;以及chrzanowska
‑
wodnicka,2017,curr opin hematol;24;248:255),这是pe起始的已知分子驱动因素,并且这些改变可以在疾病进展早期具有预测价值。无论检测到的改变是代表原因、影响,还是甚至代表它们的组合,本文所述的方法和发现都表明c
‑
rna提供了独特的机会来建立可靠的诊断算法并且研究以前从未考虑过的疾病机制。
[0423]
诊断时对pe患者的成功分类展示了可以如何使用c
‑
rna图谱来实时可靠地监测母体、胎儿和胎盘的功能。未来的研究应当在妊娠中更早地专注于评价该方法改善pe妇女的预后结果和预测结果的潜力。实际上,此类研究对于以下各项提供了广阔的前景:揭示预测性生物标志物用于对所有高危妊娠进行早期分层,告知妊娠的预防性干预措施,或以更高的警惕性对妊娠进行监测。c
‑
rna的应用将最终在整个妊娠过程中提供对母体和胎儿健康状况的全面分子监测。
[0424]
材料和方法
[0425]
研究设计
[0426]
该实施例的目标是确定c
‑
rna是否可以检测与具有严重特征的早发型pe相关联的分子标志物。该目标通过以下方式实现:(i)优化方案以获得可靠的全转录组c
‑
rna测量值,(ii)分析来自pe诊断时的患者和胎龄匹配的对照妊娠的血浆c
‑
rna图谱,以及(iii)用从独立队列生成的c
‑
rna数据验证我们的发现。用于ipec研究的临床方案和知情同意书已获得每个临床地点的机构审查委员会的批准;纳入标准和排除标准规定于表15中。调查人员在对测序数据进行生物信息学处理的整个过程中对样品状态不知情。
[0427]
临床样品收集
[0428]
ipec。怀孕患者被招募到illumina赞助的符合国际协调会议优良临床试验规范的临床研究方案(nct02808494)中。在以下8个不同的临床地点招募参与者:university of texas medical branch(galveston,texas)、tufts medical center(boston,ma)、columbia university irving medical center(new york,ny)、winthrop university hospital(mineola,ny)、st.peter’s university hospital(new brunswick,nj)、
christiana care(newark,de)、rutgers university robert wood johnson medical school(new brunswick,nj)和new york presbyterian/queens(new york,ny)。
[0429]
在获得知情同意后,从40例妊娠34周前以其严重特征符合acog指南定义而诊断为pe的单胎妊娠中收集20ml全血样品(表15)(hypertension in pregnancy:executive summary,2013,obstet gynecol;122:1122)。还收集了来自76例健康妊娠的样品,并且根据其胎龄与pe组进行匹配。三个对照样品在收集血液后出现足月pe,并且从该研究中排除。母体特征、出生结果(表32)和所用药物(表16)均在研究期间记录。
[0430]
pearl。将来自pearl研究(nct02379832)的血浆样品用作独立验证队列。在centre hospitalier universitaire de qu
é
bec(chu de qu
é
bec)处收集pearl样品。只有超过18岁的参与者才有资格,并且所有妊娠者均为单胎。在这项研究中招募了一组45例对照妊娠(pearl健康对照队列;pearl hcc)和45例妊娠(pearl先兆子痫队列;pearl pec),并且获得了所有患者的书面知情同意。在研究已完成后获得了一系列血浆样品。
[0431]
pe的标准是基于加拿大妇产科医生学会(sogc)2014年6月版pe标准定义的,且胎龄要求介于20周与41周之间,从而涵盖了早发型pe(诊断时<34周;n=12)和晚发型pe(诊断时>34周,n=12)。诊断时从pearl pec样品中取一次血液样品。pearl hcc包括45名怀孕妇女,预期她们正常妊娠并且在妊娠11周与妊娠13周之间被招募。在整个妊娠至出生期间的4个时间点,对每位招募患者进行纵向抽血。将对照妇女分成三个子组,并且后续的随访抽血被错开以覆盖整个妊娠期的整个胎龄范围(表13)。除了使用pearl hcc样品来评估健康妊娠中的c
‑
rna之外,还选择来自pearl hcc中的24个独特个体的样品来充当早发型pe队列和晚发型pe队列两者的胎龄匹配对照。
[0432]
样品制备
[0433]
血浆处理。不了解疾病状态的调查人员以随机批次处理来自ipec队列和pearl队列的所有样品。每位患者在无细胞dna bct试管(streck,inc.)中收集两管血液。在室温处储存和过夜运输收集在ipec中的血液样品,并且在120小时内处理。收集pearl血液样品,在24小时内处理成血浆并且储存在
‑
80℃处,直到在干冰上运输到illumina。在室温处将所有血液以1600
×
g离心20分钟,将血浆转移至新试管中,并且以16000
×
g再离心10分钟。将血浆上清液在
‑
80℃处储存,直至使用。
[0434]
测序文库制备。使用循环核酸试剂盒(qiagen)根据制造商的说明从4.5ml血浆中提取c
‑
rna,之后进行dna酶i消化(thermo fisher scientific)。使用illumina trusight tumor 170文库制备试剂盒(tst170;illumina,inc.)在94℃处将c
‑
rna片段化8分钟,之后进行随机六聚体引发的cdna合成。根据用于rna的tst170试剂盒进行illumina测序文库制备,进行了两处修改:将所有反应物减少至原始体积的25%,并且以1:10稀释度使用连接衔接子。使用高灵敏度dna分析芯片,通过agilent bioanalyzer 2100(agilent technologies)评估了文库质量。
[0435]
全转录组富集。使用quant
‑
it picogreen dsdna试剂盒(thermo fisher scientific)对测序文库进行定量,归一化至200ng输入量,并且每个富集反应合并4个样品。使用illumina truseq rna富集试剂盒(illumina,inc)进行全外显子组富集。简而言之,将靶向外显子组的生物素化寡核苷酸与测序文库杂交,并且通过磁性链霉抗生物素蛋白珠粒进行免疫沉淀,以富集文库中的外显子rna。将该过程进行两次,以使外显子富集最
大化。然后通过pcr再扩增最终的富集文库,以提供足够大的产量用于测序。富集反应中包括缺少针对血红蛋白基因hba1、hba2和hbb设计的5’生物素的阻断寡核苷酸,以使来自高丰度血红蛋白的贡献最小化。使用quant
‑
it picogreen dsdna试剂盒(thermo fisher scientific)对最终富集文库进行定量,归一化并合并,以在illumina hiseq 2000平台上进行配对末端50
×
50测序,每个样品的最小深度为4000万个读段。
[0436]
测序数据分析
[0437]
测序数据的生物信息学处理。将含有超过5000万个读段的fastq文件用seqtk(v1.2
‑
r102
‑
dirty)缩小采样至5000万个读段。将测序读段用tophat2(v2.0.13)映射到人类参考基因组(hg19)(yang等人,2014,biochim biophys acta;1840:3483
–
3493),并且用featurecounts(subread
‑
1.4.6)相对于refgene坐标(10/27/2014获得)量化转录物丰度(cal
ò
等人,2014,j hypertens;32:331
–
338)。组织表达数据获自body atlas(关联引擎,base space,illumina,inc)(whittle等人,2019,front microbiol;9:doi:10.3389/fmicb.2018.03266)。将在胎盘或任何胎儿组织(脑、肝、肺和甲状腺)中的所有组织中表达≥中值表达2倍的基因分配到该组中。亚细胞定位获自uniprot(magnusson等人,2012,plos one;7:e43142)。使用gprofiler(v e97_eg44_p13_d22abce)执行功能富集分析(raudvere等人,2019,nucleic acids res;47:w191
–
w198)。
[0438]
差异表达分析。在排除>25%样品中每百万个测序读段的计数(cpm)≤0.5的基因之后,使用edger(v3.20.9)在r(v3.4.2)中进行差异表达分析。通过tmm方法对数据集进行归一化(debieve等人,2011,mol hum reprod;17:702
–
9),并且通过对于对数倍数变化≥1进行glmtreat测试识别出差异丰度基因(shiadeh等人,2017,infection;45:589
–
600),之后进行bonferroni
‑
holm p值校正。对于ipec数据,对每次刀切迭代使用该相同的过程,其使用每组中90%的样品(通过随机取样选择而无需替换)。经过1000次刀切迭代后,用统计模型(v0.8.0)计算基因水平p值的单侧、基于正态分布的95%置信区间(skalis等人,2019,microrna;8:28
–
35)。使用单侧计算,因为只有p值<0.05的转录物才是感兴趣的转录物。用平方欧几里德距离和平均连锁进行分层聚类分析。
[0439]
adaboost。adaboost用scikit
‑
learn(v0.19.1,sklearn.ensemble.adaboostclassifier)在python中执行(burton等人,2019,bmj;366:l2381)。ipec样品的10%保留子集从全部机器学习活动中排除。过滤可用于训练机器学习的剩余样品,以去除在>25%的样品中cpm≤0.5的基因,并且进行tmm归一化。然后在拟合分类模型之前,先将转录物的log(cpm)值标准化(sklearn.preprocessing.standardscaler)为平均值为0且标准偏差为1。
[0440]
通过随机搜索1000次迭代并使用3倍分层交叉验证以及使用matthew相关系数量化性能来确定最佳超参数值(图42)(bergstra等人,2012,jmachine learning res;13:281
–
305)。从几何分布(scipy.stats.geom,p=0.004,loc=7)对估计量的数目进行采样,而从指数分布(scipy.stats.expon,loc=0.08,标度=2)对学习率进行采样。搜索的三次迭代显示出最高的性能,并且选择每个超参数的中值以供进一步使用(估计量为500,学习率为1.6)。
[0441]
用10倍分层交叉验证来训练adaboost模型,以获得pe分类能力的可靠估计值。完整的adaboost模型训练策略在图43中展示。该策略遵循两步方法。在第一步中,由训练数据创建五个样品子集。将四个子集(训练数据的80%)组合并用于拟合adaboost,并且将一个
子集(训练数据的20%)用于评估特征修剪期间的性能。在特征修剪期间,性能的量度为matthew相关系数,并且保留具有最高值的模型。就平局而言,保留了具有最少转录物的模型。由于adaboost的概率性质,每当拟合模型时,模型组成就发生变化。因此,为了增加最可靠的估计量被高度表示的可能性,将拟合和特征修剪重复十次,从而为子集生成十个模型。将该过程重复五次,每轮保留一个子集用于修剪和组合,另外四个子集用于拟合。该步骤最终产生总共50个模型。
[0442]
在第二步中,将来自所有50个模型的估计量组合,以产生单个聚集体adaboost模型。然后对该集合进行特征修剪,其中每种转录物的重要性量度是该转录物在其中出现的模型的数目,并且性能量度是对数损失值。选择在所有修剪子集上具有最佳对数标度的平均性能的模型作为最终的集合。
[0443]
在每个倍数内,验证样品被完全排除在模型训练之外,但用于构建roc曲线并且确定使灵敏度和特异性两者最大化的评分阈值。然后用来自交叉验证的10个adaboost模型中的每一个对ipec保留样品和pearl pec独立队列的状态进行分类。
[0444]
rt
‑
qpcr
[0445]
选择25个taqman探针(表19;thermo fisher scientific)来验证来自ipec队列的患者子集(pe n=19,对照n=19)中的测序结果。使用5个参考探针来将倍数变化差值归一化。这些探针靶向在对照样品与pe样品之间未改变的一组转录物,并且覆盖从0.2cpm至20cpm的丰度范围。表20示出了被选择用于跨越外显子接头的探针。
[0446]
分离c
‑
rna并且将其从2ml血浆转化为cdna。使用taqman preamp主混合物(thermo fisher scientific)将cdna预扩增16个循环,然后稀释10倍。根据制造商的方案(thermo fisher scientific)对所有探针进行一式三份的taqman qpcr反应。使用bio
‑
rad cfx管理软件测定cq值。为了确定转录物丰度,使用参考探针的平均cq值来计算δδcq。为了确定对于每个探针而言,pe样品中的倍数变化,将pe样品的平均δδcq值除以匹配对照样品的平均δδcq值。
[0447]
样品制备方案优化
[0448]
rrna和珠蛋白消耗。从2ml血浆中提取c
‑
rna并且用dna酶处理,然后进行消耗。具有ribozero的truseq总rna文库试剂盒(illumina,inc.)的使用遵循制造商的方案。rna酶消耗遵循先前公布的方案(crescitelli等人,2013,j extracell vesicles;2:doi:10.3402/jev.v2i0.20677),不同的是杂交在6μl总体积中进行,且消耗寡核苷酸的最终浓度为125pm/寡核苷酸。
[0449]
c
‑
rna定量。从4.5ml血浆中提取c
‑
rna并且用dna酶处理。使用十分之一的所提取c
‑
rna用quant
‑
it ribogreen rna试剂盒(thermo fisher scientific)进行定量。将c
‑
rna稀释100倍,并且根据制造商推荐的低范围标准曲线进行定量。
[0450]
血浆输入量比较。尽管没有单个实验同时评估0.5ml、1ml、2ml和4ml血浆输入量的使用,但是在方案优化期间生成了利用不同血浆输入量的多个数据集。对来自八个独立实验的数据进行了荟萃分析,以评估该变量的影响。使用生物学变异系数(bcv,edger)来量化噪声(debieve等人,2011,mol hum reprod;17:702
–
9)。对于每个实验,获得了组成生物学不同的组的每个样品集的bcv测量值。来自preseq的结合群体函数为每个单独的样品提供了文库复杂性估计值(v2.0.0)(xie等人,2018,res commun;506:692
–
697)。所有样品制备
均如先前所述进行,但有一个例外:对于1ml和0.5ml的输入量,使用accel
‑
ngs 1s plus dna文库试剂盒(swift biosciences),按照制造商的说明生成文库。
[0451]
bct比较。将8ml血液从怀孕妇女和非怀孕妇女中抽取在以下试管类型中:k2 edta(beckton dickinson)、acd(beckton dickinson)、无细胞rna bct试管(streck)和无细胞dna bct试管(streck,inc.)。在冰袋上(edta和acd)或者在室温处(无细胞rna试管和无细胞dna bct试管)将血液运输过夜。作为参考,将8ml血液收集在k2 edta试管中,并在4小时内就地处理成血浆,并且作为血浆在干冰上运输。所有其他血液样品在运输后,在优选温度处储存1天或5天后进行处理。每个条件使用3ml血浆以生成测序文库,以便如前所述使用illumina方案进行富集。为了比较妊娠样品和非妊娠样品,使用先前的c
‑
rna妊娠研究中报道的155种转录物来对妊娠信号进行定量(tsui等人,2014,clin chem;60:954
–
962;以及koh等人,2014,proc natl acad sci u s a;111:7361
–
7366),采用了以下公式:
[0452][0453]
其中i表示单种转录物,x是感兴趣样品的log(cpm)值,并且m和s分别是在相同bct中收集的非妊娠样品的平均值和标准偏差。
[0454]
妊娠时间过程分析。如前所述进行差异表达分析,不使用刀切法。在妊娠特定阶段期间改变的转录物如下进行识别。使用第一孕期样品(11周至14周胎龄)作为基线,对每个患者体内的每种转录物的cpm值进行归一化。通过lowess平滑化获得所有患者的一致性值(statsmodels.nonparametric.smoothers_lowess.lowess)。如果lowess曲线的斜率在14周胎龄时的绝对量比34周胎龄时的绝对量高≥2倍,则将转录物分类为在第一孕期改变;如果lowess曲线的斜率在34周胎龄时的绝对量比14周胎龄时的绝对量高≥2倍,则将转录物分类为在妊娠晚期改变。其余的转录物被归类为在整个妊娠期发生改变。
[0455]
统计分析
[0456]
除非另有说明,否则所有统计测试都是双侧的。当数据不是正态分布时,使用非参数测试。经由bonferroni
‑
holm或tukey hsd计算,调整p值用于多重比较。
[0457]
表12:illumina先兆子痫队列(ipec)的研究特征。连续测量值以平均值 /
‑
sd表示。
[0458][0459]
*sga,小于胎龄儿,定义为出生体重<男性或女性新生儿群体的10%。
[0460]
表13:pearl hcc胎龄分布。将45名健康妊娠妇女分成三个组,并且在4个时间点收集血液。
[0461][0462]
*表示为从最小胎龄到最大胎龄的范围,单位均为[周数
天数/7
]。
[0463]
1样品未通过文库制备
[0464]
2样品未通过文库制备
[0465]
§
3样品未通过文库制备
[0466]
表14:pearl hcc妊娠进程转录物。
[0467]
[0468]
[0469]
[0470]
[0471]
[0472][0473]
*报告在年龄组的任何成对比较之间观察到的最大倍数变化。所有变化都是相对于较低ga组的变化
‑
阳性变化指示在妊娠晚期丰度增加。
[0474]
**如果在14周ga时的转录物log2(倍数变化)的斜率比在34周ga时高>2倍,则认为在第一孕期发生改变;如果在34周时比在14周时高>2倍,则认为在怀孕晚期发生改变;如果两个倍数变化都<2,则被认为在整个妊娠期发生改变。
[0475]
表15:具有严重特征的pe的ipec诊断和纳入/排除标准。
[0476]
[0477]
[0478][0479]
表16:用于ipec中的药物。
[0480][0481][0482]
*药物类别针对大多数药物列出,而不是枚举所有特定的药物。
[0483]
表17:ipec的医疗中心收集地点患者分布。
[0484][0485]
表18:pearl pec的研究特征。连续测量值以平均值 /
‑
sd表示。
[0486]
[0487][0488]
*sga,小于胎龄儿,定义为出生体重<男性或女性新生儿群体的10%。
[0489]
表19:用于qpcr验证的taqman探针。
[0490]
[0491][0492]
*由ipec测序数据计算得到
[0493]
表20:在具有严重特征的早发型pe中的c
‑
rna丰度发生改变的转录物。描述了通过用刀切法(dex)进行差异表达分析从ipec样品中识别的基因的蛋白质表达、功能特征和pe相关文献。
[0494]
[0495]
[0496][0497]
*将所有的“膜”分类折叠成单个类别。
[0498]
表21:adaboost用于对具有严重特征的早发型pe进行分类的转录物。描述了用ipec模型样品识别的基因的蛋白质表达、功能特征和pe相关文献。
[0499]
[0500]
[0501]
[0502]
[0503][0504]
*当被包括在adaboost模型中时的平均值。
[0505]
本文引用的所有专利、专利申请和出版物的完整公开内容,以及以电子方式获得的材料(包括,例如,在例如genbank和refseq中的核苷酸序列提交,在例如swissprot、pir、prf、pdb中的氨基酸序列提交,以及来自genbank和refseq中的注释编码区的翻译)全文以引用方式并入。出版物中引用的补充材料(诸如补充表、补充图、补充材料和方法和/或补充实验数据)同样全文以引用方式并入。在本技术的公开内容与以引用方式并入本文的任何文献的公开内容之间存在任何不一致性的情况下,应以本技术的公开内容为准。上述详细描述和实施例仅为了清楚地理解本发明而给出。不应将其理解为不必要的限制。本公开不限于所示和所述的确切细节,因为对本领域技术人员显而易见的变型将包括在由权利要求所限定的公开内容内。
[0506]
除非另外指明,否则本说明书和权利要求书中所用的表示组分的量、分子量等的所有数字在所有情况下均应理解为由术语“约”修饰。因此,除非有相反的说明,否则本说明书和权利要求书中列出的数值参数均为近似值,这些近似值可根据本公开寻求获得的期望性质而变化。至少,并非试图将等同原则限制在权利要求的范围之内,每个数值参数应至少根据所报告的有效数位的数目并通过应用惯常的四舍五入法来解释。
[0507]
尽管阐述本公开的广义范围的数值范围和参数是近似值,但是在具体实施例中所列出的数值被尽可能精确地报告。然而,所有数值固有地包含一个范围,该范围必然是由存在于其相应测试测量中的标准偏差引起。
[0508]
除非另外指明,否则所有标题都是为了方便读者,而不应当用于限制该标题后面的文本的含义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。