一种电化学合成非天然氨基酸类衍生物的方法
(一)技术领域
1.本发明涉及一种电化学合成非天然氨基酸类衍生物的方法,具体涉及一种由n
‑
芳基甘氨酸酯和活性羧酸酯在电化学的条件下,一步制备非天然氨基酸衍生物的方法。
(二)
背景技术:
2.氨基酸广泛存在于天然产物和药物分子中,在人类生活中扮演着极其重要的作用。从自然环境衍生出来的或者化学家们合成的非天然氨基酸由于其结构及用途多,受到了广泛关注。非天然氨基酸不仅在不对称合成方面起到了重要作用,而且在制备生物活性的多肽方面有着广泛应用,可以显著改善药代动力学性质。近年来,随着氨基酸药品以及多肽生物制剂被批准上市,新型α
‑
氨基酸化合物的开发受到了越来越多化学家们的青睐。(acc.chem.res.2016,49,635
‑
645;chem.rev.2016,116,11654
‑
11684;acs med.chem.lett.2012,3,850
‑
855;j.org.chem.2015,80,4201
‑
4203;acs appl.mater.interfaces.2013,5,6484
‑
6493;j.med.chem.2015,58,7719
‑
7733;j.med.chem.2016,59,10807
‑
10836)。
3.近年来,电化学作为一种绿色合成方法正蓬勃发展,利用阳极氧化或者阴极还原驱动反应的进行,从而避免使用过量的氧化剂、还原剂或者金属,规避一些苛刻的反应条件,符合绿色化学的要求。成对电解,即阳极氧化和阴极还原反应生成的中间体相结合生成目标化合物,此过程电子转移没有损失,提高了能源利用率。但由于其反应难度大,目前报道少。
4.目前,c
‑
h键官能团化反应是构建c
‑
c键、c
‑
x键的有效合成策略,利用α
‑
氨基酸衍生物与其他试剂在过渡金属催化条件下交叉偶联可以直接构建α取代的非天然氨基酸。过去几十年中,通过过渡金属催化或者光催化实现了α
‑
芳基化、α
‑
芳基化、炔基化以及c
‑
p、c
‑
n、c
‑
s键的构建。从合成的角度讲,传统的方法需要使用过渡金属以及过量的氧化剂,有的反应条件比较苛刻,需要高温。因此,如果能以n
‑
芳基甘氨酸酯和氧化还原活性酯作为原料,在电化学的条件下利用成对电解构筑结构多样的非天然氨基酸,不仅绿色环保,而且可以提高能源利用率。由于本合成方法的简洁高效性,因此具有一定的应用价值。
(三)
技术实现要素:
5.为了解决现有技术存在的合成法需要高温、过量氧化剂的问题,本发明提供一种n
‑
芳基甘氨酸酯和氧化还原活性酯在电化学的条件下合成非天然氨基酸的方法。
6.为了实现上述目的,本发明的技术方案如下:
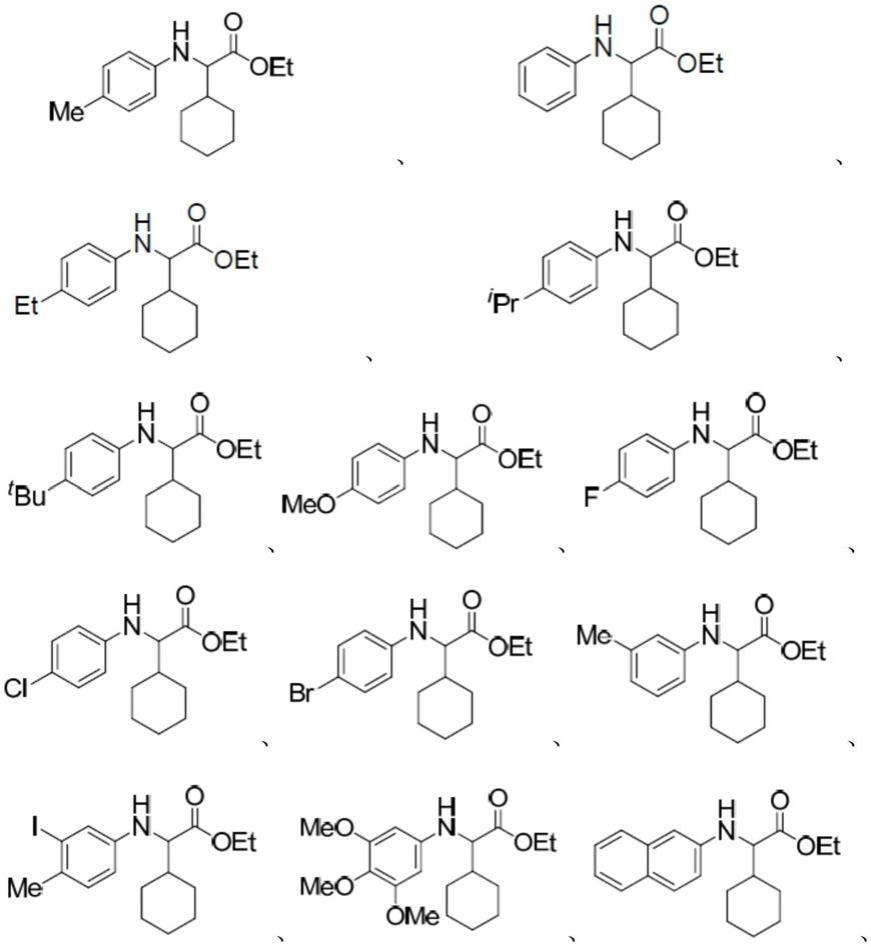
7.一种电化学合成非天然氨基酸类衍生物的方法,所述的方法为:将式(i)所示的n
‑
芳基甘氨酸酯类化合物、式(ii)所示的氧化还原活性酯、电解质和碱性物质溶解于溶剂中,0~60℃搅拌溶解,得到电解液,以碳毡电极作为阳极、泡沫镍电极作为阴极,保护氛围(惰性气体或氮气)下接通电源,室温下搅拌,4~10ma恒电流反应(优选8ma),反应完全后,停止通电,所得混合物经后处理,得到式(viii)化合物;式(i)所示的n
‑
芳基甘氨酸酯类化合物、
式(ii)所示的氧化还原活性酯、电解质与碱性物质的物质的量之比为1:1
‑
2:1
‑
3:1
‑
3(优选1:1.5:1
‑
3:1
‑
3);
[0008][0009]
其中,r1为苯基、萘基或被c1‑
c4烷基、c1‑
c4烷氧基、卤素、苯基中的一个或多个基团取代的苯基;优选r1为苯基、萘基、被c1‑
c4烷基取代的苯基、被甲氧基取代的苯基、被氟、氯、溴、碘取代的苯基或萘基等;
[0010]
r2为c1‑
c4烷氧基、苯基、苄氧基或被c1‑
c4烷基取代的苯基,优选r2为乙氧基、叔丁氧基、苯基、对甲苯基、苄氧基等;
[0011]
r3为未取代或取代的c
l
‑
c
20
链烷基、未取代或取代的c3‑
c
20
环烷基、四氢呋喃基、c1‑
c4烷氧羰基或苄氧羰基保护的哌啶基或被苯基取代的c1‑
c4烷氧基,所述取代的c
l
‑
c
20
链烷基的取代基为苯基、c1‑
c4烷基取代的苯基、邻苯二甲酰基保护的氨基、c1‑
c
20
烷氧基、吲哚基;所述取代的c3‑
c
20
环烷基的取代基为苯基、c1‑
c4烷基取代的苯基、c2‑
c
10
酯基;优选r3为为丙基、叔丁基、戊基、环丁基、环戊基、环己基、金刚烷基、苯丙基、吲哚丙基、2
‑
四氢呋喃基;
[0012]
所述电解质为四丁基四氟硼酸铵、四乙基四氟硼酸铵、四丁基六氟磷酸铵、四乙基六氟磷酸铵、四丁基醋酸铵、四丁基溴化铵、碘化铵、溴化铵或高氯酸锂等电解质,其中优选高氯酸锂;所述碱性物质为碳酸钠、叔丁醇钾、三乙胺、三乙烯二胺、1,8
‑
二氮杂二环十一碳
‑7‑
烯或2,4,6
‑
三甲基吡啶等,其中优选三乙烯二胺;所述溶剂可为乙腈、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或二甲基亚砜等常见溶剂,其中优选二甲基亚砜。
[0013]
优选地,所述电解液中还加入催化剂,所述式(i)所示的n
‑
芳基甘氨酸酯类化合物与催化剂的物质的量之比为1:0.05
‑
0.2(优选1:0.1);所述催化剂为氯化亚铜、碘化亚铜、溴化亚铜、氯化锌、氯化铁、六水合氯化镍、高氯酸镍、溴化镍或二乙酰丙酮镍等路易斯酸,也可不加,其中优选六水合氯化镍。
[0014]
优选地,所述电解液中还加入配体,所述式(i)所示的n
‑
芳基甘氨酸酯类化合物与配体的物质的量之比为1:0.055
‑
0.22(优选1:0.11);所述配体可为2,2'
‑
联吡啶、4,4'
‑
二甲基
‑
2,2'
‑
联吡啶或4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶等双齿配体,也可不加,其中优选4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶。
[0015]
优选地,所述电解液中还加入添加剂,所述式(i)所示的n
‑
芳基甘氨酸酯类化合物与添加剂的物质的量之比为1:0.2
‑
0.5;所述添加剂为2,2,6,6
‑
四甲基哌啶氧化物、三苯基胺、三(4
‑
溴苯基)胺、三(2,4
‑
二溴苯基)胺或二茂铁(添加剂的加入可以进一步提高产率),其中优选二茂铁。
[0016]
本发明尤其推荐如下方法:
[0017]
将式(i)所示的n
‑
芳基甘氨酸酯类化合物、式(ii)所示的氧化还原活性酯、电解质、催化剂、配体、添加剂和碱性物质溶解于溶剂中,0~60℃搅拌溶解,得到电解液,以碳毡电极作为阳极、泡沫镍电极作为阴极,保护氛围(惰性气体或氮气保护)下接通电源,室温下
搅拌,4~10ma恒电流反应(优选8ma),反应完全后,停止通电,所得混合物经后处理,得到式(viii)化合物;式(i)所示的n
‑
芳基甘氨酸酯类化合物、式(ii)所示的氧化还原活性酯、电解质、催化剂、配体、添加剂与碱性物质的物质的量之比为1:1
‑
2:1
‑
3:0.05
‑
0.2:0.055
‑
0.22:0.2
‑
0.5:1
‑
3(优选1:1.5:1
‑
3:0.1:0.11:0.2
‑
0.5:1
‑
3);
[0018][0019]
r1、r2、r3定义同上;
[0020]
所述电解质可为四丁基四氟硼酸铵、四乙基四氟硼酸铵、四丁基六氟磷酸铵、四乙基六氟磷酸铵、四丁基醋酸铵、四丁基溴化铵、碘化铵、溴化铵或高氯酸锂等电解质,其中优选高氯酸锂;所述催化剂可为氯化亚铜、碘化亚铜、溴化亚铜、氯化锌、氯化铁、六水合氯化镍、高氯酸镍、溴化镍或二乙酰丙酮镍等路易斯酸,也可不加,其中优选六水合氯化镍;所述配体可为2,2'
‑
联吡啶、4,4'
‑
二甲基
‑
2,2'
‑
联吡啶或4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶等双齿配体,也可不加,其中优选4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶;所述添加剂可为2,2,6,6
‑
四甲基哌啶氧化物、三苯基胺、三(4
‑
溴苯基)胺、三(2,4
‑
二溴苯基)胺或二茂铁(添加剂的加入可以进一步提高产率),其中优选二茂铁;所述碱性物质可为碳酸钠、叔丁醇钾、三乙胺、三乙烯二胺、1,8
‑
二氮杂二环十一碳
‑7‑
烯或2,4,6
‑
三甲基吡啶等,其中优选三乙烯二胺;所述溶剂可为乙腈、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或二甲基亚砜等常见溶剂,其中优选二甲基亚砜。
[0021]
进一步优选地,所述式(viii)化合物为下列之一:
[0022]
[0023][0024]
进一步,所述溶剂的体积以n
‑
芳基甘氨酸酯类化合物(i)的物质的量计为10
‑
50ml/mmol(优选20ml/mmol)。
[0025]
进一步,所述后处理的方法为:反应结束后,所述混合物水洗后用乙酸乙酯萃取(三次),合并有机相,无水硫酸钠干燥,浓缩后,以石油醚与乙酸乙酯体积比3
‑
150:1的混合液作为洗脱剂进行柱层析,收集含目标化合物的洗脱液,蒸除溶剂得到所述式(viii)化合
物(非天然氨基酸类衍生物)。
[0026]
反应式如下:
[0027][0028]
与现有技术相比,本发明具有以下有益效果:反应条件温和,底物适用性广,原料n
‑
芳基甘氨酸酯类化合物、氧化还原活性酯容易得到,底物无需多步制备,总收率较高。本发明的创新点在于电化学将活性羧酸酯脱羧后与n
‑
芳基甘氨酸酯类化合物反应一步就能得到非天然氨基酸类衍生物。本发明所得的非天然氨基酸类衍生物收率最高为80%。
(四)具体实施方式
[0029]
下面通过具体实施例对本发明作进一步的说明,但本发明的保护范围并不仅限于此。
[0030]
实施例1
[0031][0032]
将2
‑
(对甲苯胺基)乙酸乙酯(58mg,0.3mmol),环己基氧化还原活性酯cas:126812
‑
30
‑
4(123mg,0.45mmol)、高氯酸锂(106mg,1.0mmol)、六水合氯化镍(7mg,0.03mmol)、4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶(9mg,0.033mmol)、二茂铁(11mg,0.06mmol)、三乙烯二胺(74mg,0.66mmol)溶解在6ml二甲基亚砜中,得到电解液,以碳毡电极作为阳极、泡沫镍电极作为阴极,氮气保护下接通电源,室温下磁力搅拌,设置电流为8ma(3
‑
5v),tlc监测反应完全后,停止通电。将混合物用水洗涤并用乙酸乙酯(3
×
20ml)萃取,合并有机溶液,无水硫酸钠干燥并减压浓缩,以石油醚:乙酸乙酯(150:1)为洗脱剂进行硅胶柱色谱纯化,收集含目标化合物的洗脱液,旋蒸并干燥得到57mg产物,收率为70%,产物为无色液体。r
f
=0.3(pe:ea=30:1).1h nmr(400mhz,cdcl3)δ7.00(d,j=8.2hz,2h),6.61
–
6.56(m,2h),4.19(q,j=7.1hz,2h),3.85(d,j=6.1hz,1h),2.25(s,3h),1.93
–
1.85(m,1h),1.85
–
1.75(m,3h),1.75
–
1.67(m,2h),1.27(t,j=7.1hz,6h),1.21
–
1.15(m,2h);
13
c nmr(101mhz,cdcl3)δ174.0,145.2,129.8,127.4,113.8,62.5,60.8,41.3,29.7,29.2,26.2,20.4,14.3.
[0033]
实施例2
[0034]
按实施例1所述的方法,不同的是不加催化剂、配体、添加剂,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到12mg产物,收率为14%,产物为无色液体。r
f
=0.3(pe:ea=30:1)
[0035]
实施例3
[0036]
按实施例1所述的方法,不同的是不加添加剂,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到45mg产物,收率为55%,产物为无色液体。r
f
=0.3(pe:ea=30:1).
[0037]
实施例4
[0038]
按实施例1所述的方法,不同的是不加添加剂,用二乙酰丙酮镍(8mg)代替六水合氯化镍,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到34mg产物,收率为42%,产物为无色液体。
[0039]
实施例5
[0040]
按实施例1所述的方法,不同的是不加添加剂,溴化镍(7mg)代替六水合氯化镍,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到30mg产物,收率为36%,产物为无色液体。
[0041]
实施例6
[0042]
按实施例1所述的方法,不同的是不加添加剂,用氯化亚铜(3mg)代替六水合氯化镍,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到20mg产物,收率为25%,产物为无色液体。
[0043]
实施例7
[0044]
按实施例1所述的方法,不同的是不加添加剂,用氯化锌(4mg)代替六水合氯化镍,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到19mg产物,收率为24%,产物为无色液体。
[0045]
实施例8
[0046]
按实施例1所述的方法,不同的是不加入添加剂,用三乙胺(67mg)代替三乙烯二胺,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到37mg产物,收率为45%,产物为无色液体。r
f
=0.3(pe:ea=30:1).
[0047]
实施例9
[0048]
按实施例1所述的方法,不同的是不加入添加剂,用二异丙基乙基胺(85mg)代替三乙烯二胺,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到16mg产物,收率为20%,产物为无色液体。
[0049]
实施例10
[0050]
按实施例1所述的方法,不同的是用2,2,6,6
‑
四甲基哌啶氮氧化物(9mg)代替二茂铁,溶剂用n,n
‑
二甲基甲酰胺(6ml)代替二甲基亚砜,得到48mg产物,收率为59%,产物为无色液体。
[0051]
实施例11
[0052]
按实施例1所述的方法,不同的是n,n
‑
二甲基乙酰胺(6ml)代替二甲亚砜,得到49mg产物,收率为60%,产物为无色液体。
[0053]
实施例12
[0054]
按实施例1所述的方法,不同的是阳极选用碳棒电极,得到38mg产物,收率为46%,产物为无色液体。r
f
=0.3(pe:ea=30:1).
[0055]
实施例13
[0056]
[0057]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
(苯氨基)乙酸乙酯(54mg),得产物2
‑
环己基
‑2‑
(苯基氨基)乙酸乙酯(56mg),收率为72%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.21
–
7.15(m,2h),6.74(tt,j=7.4,1.1hz,1h),6.68
–
6.62(m,2h),4.19(q,j=7.1hz,3h),3.89(d,j=6.1hz,1h),1.92
–
1.85(m,1h),1.83
–
1.75(m,3h),1.71(dddd,j=14.4,11.3,4.5,2.5hz,2h),1.30
–
1.21(m,6h),1.21
–
1.16(m,2h);
13
c nmr(126mhz,cdcl3)δ173.6,147.5,129.2,118.1,113.5,62.0,60.8,41.3,29.6,29.2,26.2,26.10,26.06,14.3.
[0058]
实施例14
[0059][0060]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((4
‑
乙基苯基)氨基)乙酸乙酯(62mg),得产物2
‑
环己基
‑2‑
((4
‑
乙基苯基)氨基)乙酸乙酯(63mg),收率为73%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.08
–
6.99(m,2h),6.66
–
6.58(m,2h),4.20(q,j=7.1hz,2h),3.87(d,j=6.1hz,1h),2.56(q,j=7.6hz,2h),1.96
–
1.86(m,1h),1.85
–
1.75(m,3h),1.72(dt,j=3.5,1.7hz,2h),1.34
–
1.25(m,6h),1.24
–
1.16(m,5h);
13
c nmr(126mhz,cdcl3)δ173.8,145.3,133.9,128.5,113.7,62.4,60.7,41.3,29.6,29.2,27.9,26.2,26.1,26.0,15.8,14.3.hrms m/z(esi)calcd for c
18
h
27
no2[m h]
:290.2115,found:290.2113.
[0061]
实施例15
[0062][0063]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((4
‑
异丙基苯基)氨基)乙酸乙酯(66mg),得产物2
‑
环己基
‑2‑
((4
‑
异丙基苯基)氨基)乙酸乙酯(64mg),收率为70%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.10
–
7.02(m,2h),6.66
–
6.57(m,2h),4.20(q,j=7.1hz,2h),3.86(d,j=6.1hz,1h),2.83(hept,j=6.9hz,1h),1.88(d,j=12.1hz,1h),1.80(dq,j=11.8,3.1hz,3h),1.71(dd,j=14.3,10.3hz,2h),1.28(t,j=7.1hz,5h),1.23(dd,j=7.0,0.7hz,7h),1.21
–
1.14(m,2h);
13
c nmr(126mhz,cdcl3)δ173.8,145.4,138.6,127.1,113.6,62.4,60.7,41.4,33.1,29.6,29.2,26.2,26.10,26.06,24.17,24.16,14.3.hrms m/z(esi)calcd for c
19
h
29
no2[m h]
:304.2271,found:304.2266.
[0064]
实施例16
[0065][0066]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((4
‑
(叔丁基)苯基)氨基)乙酸乙酯(71mg),得产物2
‑
((4
‑
(叔丁基)苯基)氨基)
‑2‑
环己基乙酸乙酯(65mg),收率为68%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.26
–
7.18(m,2h),6.65
–
6.59(m,2h),4.20(q,j=7.1hz,2h),3.87(d,j=6.1hz,1h),1.95
–
1.85(m,1h),1.84
–
1.76(m,3h),1.75
–
1.66(m,2h),1.30(s,9h),1.30
–
1.17(m,8h);
13
c nmr(126mhz,cdcl3)δ173.8,145.0,126.0,113.2,62.3,60.7,41.3,33.8,31.5,29.6,29.1,26.2,26.1,26.0,14.3.
[0067]
实施例17
[0068][0069]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((4
‑
甲氧基苯基)氨基)乙酸乙酯(63mg),得产物2
‑
环己基
‑2‑
((4
‑
甲氧基苯基)氨基)乙酸乙酯(45mg),收率为52%,产物为白色固体。1h nmr(500mhz,cdcl3)δ6.81
–
6.74(m,2h),6.67
–
6.60(m,2h),4.16(qd,j=7.1,1.2hz,2h),3.77(d,j=6.2hz,1h),3.75(s,3h),1.88(ddt,j=11.3,3.7,1.9hz,1h),1.83
–
1.72(m,3h),1.72
–
1.65(m,2h),1.31
–
1.22(m,6h),1.21
–
1.11(m,2h);
13
c nmr(126mhz,cdcl3)δ173.9,152.7,141.5,115.3,114.8,63.5,60.7,55.7,41.3,29.7,29.2,26.2,26.10,26.07,14.3.
[0070]
实施例18
[0071][0072]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((4
‑
氟苯基)氨基)乙酸乙酯(59mg),得产物2
‑
环己基
‑2‑
((4
‑
氟苯基)氨基)乙酸乙酯(51mg),收率为61%,产物为无色液体。1h nmr(500mhz,cdcl3)δ6.91
–
6.84(m,2h),6.61
–
6.55(m,2h),4.17(qd,j=7.1,1.3hz,2h),3.78(d,j=6.2hz,1h),1.87(dt,j=12.6,1.8hz,1h),1.83
–
1.73(m,3h),1.73
–
1.66(m,2h),1.25(q,j=7.1,6.4hz,6h),1.21
–
1.14(m,2h);
13
c nmr(126mhz,cdcl3)δ173.6,156.2(d,j c
‑
f
=234.5hz),143.8,115.7(d,j c
‑
f
=22.8hz),114.7(d,j c
‑
f
=7.5hz),63.1,60.8,41.3,29.7,29.2,26.2,26.09,26.06,14.3.
[0073]
实施例19
[0074][0075]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((4
‑
氯苯基)氨基)乙酸乙酯(64mg),得产物2
‑
((4
‑
氯苯基)氨基)
‑2‑
环己基乙酸乙酯(52mg),收率为59%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.15
–
7.08(m,2h),6.58
–
6.53(m,2h),4.18(q,j=7.1hz,2h),3.82(d,j=6.1hz,1h),1.85(ddt,j=12.6,3.4,1.8hz,1h),1.82
–
1.74(m,3h),1.72
–
1.66(m,2h),1.31
–
1.23(m,6h),1.20
–
1.15(m,2h);
13
c nmr(126mhz,cdcl3)δ173.4,146.1,129.1,122.7,114.7,62.2,60.9,41.2,29.6,29.2,26.2,26.1,26.0,14.3.
[0076]
实施例20
[0077][0078]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((4
‑
溴苯基)氨基)乙酸乙酯(77mg),得产物2
‑
((4
‑
溴苯基)氨基)
‑2‑
环己基乙酸乙酯(58mg),收率为57%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.27
–
7.22(m,2h),6.54
–
6.49(m,2h),4.18(q,j=7.1hz,2h),3.81(d,j=6.1hz,1h),1.89
–
1.82(m,1h),1.81
–
1.73(m,3h),1.69(ddd,j=14.4,3.6,1.8hz,2h),1.26(t,j=7.1hz,6h),1.19
–
1.13(m,2h);
13
c nmr(126mhz,cdcl3)δ173.3,146.4,132.0,115.1,109.8,62.1,60.9,41.2,29.6,29.2,26.14,26.05,26.0,14.3.hrms m/z(esi)calcd for c
16
h
22
brno2[m na]
:362.0726,found:362.0716.
[0079]
实施例21
[0080][0081]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
(间甲苯基氨基)乙酸乙酯(58mg),得产物2
‑
环己基
‑2‑
(间甲苯胺基)乙酸乙酯(52mg),收率为63%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.07(t,j=7.7hz,1h),6.59
–
6.55(m,1h),6.50
–
6.44(m,2h),4.20(dd,j=7.1,2.0hz,2h),3.89(d,j=6.2hz,1h),2.29(s,3h),1.88(dpd,j=10.2,3.3,2.0,1.4hz,1h),1.83
–
1.76(m,3h),1.71(dddd,j=12.8,9.5,5.5,2.5hz,2h),1.32
–
1.25(m,6h),1.20(dddd,j=12.7,9.5,3.1,1.8hz,2h);
13
c nmr(126mhz,cdcl3)δ173.7,147.5,139.0,129.1,119.0,114.4,110.6,62.0,60.7,41.3,29.6,29.2,26.2,26.10,26.06,21.6,14.3.hrms m/z(esi)calcd for c
17
h
25
no2[m h]
:276.1958,found:276.1953.
[0082]
实施例22
[0083][0084]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((3
‑
碘
‑4‑
甲基苯基)氨基)乙酸乙酯(96mg),得产物2
‑
环己基
‑2‑
((3
‑
碘
‑4‑
甲基苯基)氨基)乙酸乙酯(65mg),收率为54%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.13(d,j=2.5hz,1h),7.00(dd,j=8.2,0.7hz,1h),6.54(dd,j=8.2,2.5hz,1h),4.19(p,j=7.2hz,2h),3.79(d,j=6.2hz,1h),2.31(s,3h),1.87
–
1.82(m,1h),1.82
–
1.74(m,3h),1.72
–
1.65(m,2h),1.28(t,j=7.1hz,6h),1.19
–
1.12(m,2h);
13
c nmr(126mhz,cdcl3)δ173.4,146.3,130.5,129.7,123.7,113.8,101.6,62.1,60.9,41.2,29.6,29.1,26.7,26.2,26.05,26.02,14.3.hrms m/z(esi)calcd for c
17
h
24
ino2[m h]
:402.0924,found:402.0921.
[0085]
实施例23
[0086][0087]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
((3,4,5
‑
三甲氧基苯基)氨基)乙酸乙酯(81mg),得产物2
‑
环己基
‑2‑
((3,4,5
‑
三甲氧基苯基)氨基)乙酸乙酯(43mg),收率为41%,产物为白色固体。1h nmr(500mhz,cdcl3)δ5.91(s,2h),4.19(qd,j=7.1,0.8hz,2h),3.82(s,6h),3.80(d,j=6.4hz,1h),3.76(s,3h),1.92
–
1.86(m,1h),1.82
–
1.75(m,3h),1.72
–
1.66(m,2h),1.27(t,j=7.1hz,6h),1.22
–
1.16(m,2h);
13
c nmr(126mhz,cdcl3)δ173.7,153.9,143.8,130.8,100.0,91.5,62.8,61.0,60.9,55.9,41.3,29.7,29.3,26.2,26.1,26.0,14.4.hrms m/z(esi)calcd for c
19
h
29
no5[m h]
:352.2118,found:352.2112.
[0088]
实施例24
[0089][0090]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
(萘
‑2‑
基氨基)乙酸乙酯(69mg),得产物2
‑
环己基
‑2‑
(萘
‑2‑
基氨基)乙酸乙酯(49mg),收率为53%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.72
–
7.60(m,3h),7.38(ddd,j=8.2,6.8,1.3hz,1h),7.29
–
7.20(m,1h),6.96(dd,j=8.8,2.4hz,1h),6.85(d,j=2.4hz,1h),4.50
–
4.29(m,1h),4.22(qd,j=7.1,5.0hz,2h),4.05(d,j=6.2hz,1h),1.99
–
1.91(m,1h),1.90
–
1.80(m,3h),1.81
–
1.69(m,2h),1.29(t,j=7.1hz,6h),1.27
–
1.21(m,2h);
13
c nmr(126mhz,cdcl3)δ173.6,145.0,135.0,129.0,127.9,127.6,126.3,126.0,122.3,118.3,105.6,62.1,60.9,41.3,29.6,29.3,26.2,26.12,26.07,14.3.hrms m/z(esi)calcd for c
20
h
25
no2[m h]
:
312.1958,found:312.1949.
[0091]
实施例25
[0092][0093]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
(对甲苯胺基)乙酸叔丁酯(66mg),得产物2
‑
环己基
‑2‑
(对甲苯胺基)乙酸叔丁酯(50mg),收率为55%,产物为淡黄色固体。1h nmr(500mhz,cdcl3)δ6.98(d,j=8.2hz,2h),6.59(d,j=8.3hz,2h),3.73(d,j=5.7hz,1h),2.24(s,3h),1.87
–
1.82(m,1h),1.77(dddd,j=16.4,13.6,7.4,4.2hz,4h),1.71
–
1.65(m,1h),1.44(s,9h),1.30
–
1.17(m,5h);
13
c nmr(126mhz,cdcl3)δ172.9,145.3,129.7,127.2,113.9,81.4,63.0,41.4,29.6,29.2,28.1,26.3,26.22,26.16,20.4.
[0094]
实施例26
[0095][0096]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:2
‑
(对甲苯胺基)乙酸苄酯(77mg),得产物2
‑
环己基
‑2‑
(对甲苯胺基)乙酸苄酯(63mg),收率为62%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.38
–
7.35(m,2h),7.34
–
7.26(m,2h),7.00(d,j=8.1hz,2h),6.68
–
6.53(m,2h),5.17(d,j=2.6hz,2h),4.13
–
3.98(m,1h),3.94(d,j=6.2hz,1h),2.27(s,3h),1.93
–
1.84(m,1h),1.83
–
1.72(m,3h),1.70(dt,j=14.3,3.2hz,2h),1.33
–
1.14(m,6h);
13
c nmr(126mhz,cdcl3)δ173.7,145.1,135.6,129.7,128.5,128.25,128.21,127.4,113.8,66.5,62.6,41.3,29.6,29.2,26.2,26.04,26.01,20.4.
[0097]
实施例27
[0098][0099]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:1
‑
苯基
‑2‑
(对甲苯胺基)乙酮(66mg),得产物2
‑
环己基
‑1‑
苯基
‑2‑
(对甲苯胺基)乙酮(40mg),收率为43%,产物为黄色固体。1h nmr(500mhz,cdcl3)δ8.05
–
7.93(m,2h),7.69
–
7.55(m,1h),7.53
–
7.48(m,2h),7.03
–
6.92(m,2h),6.71
–
6.59(m,2h),4.86(d,j=4.5hz,1h),2.22(s,3h),1.85(dd,j=7.6,3.9hz,1h),1.81
–
1.70(m,3h),1.65
–
1.61(m,2h),1.42
–
1.29(m,2h),1.14(m,3h);
13
c nmr(126mhz,cdcl3)δ201.5,146.0,136.3,133.4,129.8,128.8,128.3,127.2,114.2,63.6,42.0,30.9,27.8,26.4,26.2,26.1,20.3.
[0100]
实施例28
[0101][0102]
按实施例1所述的方法,不同的是所用n
‑
芳基甘氨酸酯类化合物为:1
‑
(对甲苯基)
‑2‑
(对甲苯胺基)乙酮(72mg),得产物2
‑
环己基
‑1‑
(对甲苯基)
‑2‑
(对甲苯胺基)乙酮(38mg),收率为40%,产物为黄色液体。1h nmr(500mhz,cdcl3)δ7.95
–
7.84(m,2h),7.36
–
7.28(m,2h),7.06
–
6.92(m,2h),6.73
–
6.57(m,2h),4.85(d,j=4.5hz,1h),2.44(s,3h),2.23(s,3h),1.86(tdd,j=8.2,5.8,2.4hz,1h),1.81
–
1.69(m,3h),1.64(tdd,j=10.7,5.6,2.8hz,2h),1.37(qd,j=13.5,13.1,3.9hz,2h),1.14(ddt,j=9.7,7.8,3.3hz,3h);
13
c nmr(126mhz,cdcl3)δ201.0,146.0,144.3,133.7,129.7,129.5,128.4,127.1,114.2,63.4,42.1,30.8,27.9,26.4,26.2,26.1,21.7,20.3.hrms m/z(esi)calcd for c
22
h
27
no[m h]
:322.2165,found:322.2157.
[0103]
实施例29
[0104][0105]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基丁酸酯(105mg),得产物2
‑
(对甲苯胺基)戊酸乙酯(35mg),收率为50%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.10
–
6.87(m,2h),6.69
–
6.47(m,2h),4.19(q,j=7.1hz,2h),4.04(dd,j=7.0,6.2hz,1h),2.25(s,3h),1.90
–
1.69(m,2h),1.55
–
1.43(m,2h),1.26(t,j=7.1hz,3h),0.97(t,j=7.4hz,3h);
13
c nmr(126mhz,cdcl3)δ174.3,144.5,129.8,127.6,113.8,60.9,57.0,35.2,20.4,18.9,14.2,13.8.hrms m/z(esi)calcd for c
14
h
21
no2[m h]
:236.1645,found:236.1638.
[0106]
实施例30
[0107][0108]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基4
‑
甲基戊酸酯(117mg),得产物5
‑
甲基
‑2‑
(对甲苯胺基)己酸乙酯(40mg),收率为51%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.04
–
6.96(m,2h),6.63
–
6.52(m,2h),4.19(q,j=7.1hz,2h),4.01(t,j=6.5hz,1h),2.25(s,3h),1.91
–
1.71(m,2h),1.58(dq,j=13.3,6.7hz,1h),1.36
–
1.30(m,2h),1.26(t,j=7.1hz,3h),0.92(dd,j=6.6,3.8hz,6h);
13
c nmr(126mhz,cdcl3)δ174.4,144.7,129.8,127.5,113.7,60.9,57.3,34.6,31.0,27.9,22.5,22.4,20.4,14.3.hrms m/z(esi)calcd for c
16
h
25
no2[m h]
:264.1958,found:264.1954.
[0109]
实施例31
[0110][0111]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基3
‑
苯基丙酸酯(133mg),得产物4
‑
苯基
‑2‑
(对甲苯胺基)丁酸乙酯(40mg),收率为45%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.32(t,j=7.5hz,2h),7.29
–
7.13(m,3h),7.01(d,j=8.1hz,2h),6.56(d,j=8.4hz,2h),4.20(q,j=7.1hz,2h),4.07(dd,j=7.2,5.7hz,1h),2.81(t,j=7.9hz,2h),2.27(s,3h),2.23
–
2.13(m,1h),2.13
–
2.01(m,1h),1.28(t,j=7.1hz,3h);
13
c nmr(126mhz,cdcl3)δ174.1,144.6,141.0,129.8,128.51,128.46,127.6,126.1,113.8,61.0,56.5,34.7,31.8,20.4,14.3.
[0112]
实施例32
[0113][0114]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基6
‑
(1,3
‑
二氧异吲哚
‑2‑
基)己酸酯(183mg),得产物7
‑
(1,3
‑
二氧异吲哚
‑2‑
基)
‑2‑
(对甲苯基氨基)庚酸乙酯(65mg),收率为53%,产物为黄色液体。1h nmr(500mhz,cdcl3)δ7.84(dd,j=5.4,3.1hz,2h),7.71(dd,j=5.5,3.0hz,2h),7.05
–
6.88(m,2h),6.59
–
6.49(m,2h),4.17(q,j=7.1hz,2h),4.00(dd,j=6.9,6.0hz,1h),3.71
–
3.66(m,2h),2.22(s,3h),1.84
–
1.66(m,4h),1.48(tdd,j=13.0,6.8,3.2hz,2h),1.44
–
1.34(m,2h),1.24(t,j=7.1hz,3h);
13
c nmr(126mhz,cdcl3)δ174.2,168.39,168.36,144.5,133.82,133.76,132.2,132.1,129.7,127.5,123.12,123.08,113.7,60.9,57.0,37.8,32.9,28.3,26.5,25.1,20.3,14.2.hrms m/z(esi)calcd for c
24
h
28
n2o4[m h]
:409.2121,found:409.2113.
[0115]
实施例33
[0116][0117]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基4
‑
(1h
‑
吲哚
‑2‑
基)丁酸酯(157mg),得产物5
‑
(1h
‑
吲哚
‑3‑
基)
‑2‑
(对甲苯胺基)戊酸乙酯(57mg),收率为54%,产物为黄色液体。1h nmr(500mhz,cdcl3)δ8.01(s,1h),7.65(d,j=7.8hz,1h),7.36(d,j=8.1hz,1h),7.25(tt,j=8.1,1.3hz,1h),7.21
–
7.13(m,1h),7.07
–
7.01(m,2h),6.96(d,j=2.2hz,1h),6.65
–
6.55(m,2h),4.27
–
4.16(m,2h),4.16
–
4.10(m,
1h),2.87(td,j=6.9,3.0hz,2h),2.30(s,3h),2.00
–
1.83(m,4h),1.26(td,j=7.1,1.3hz,3h);
13
c nmr(151mhz,cdcl3)δ174.6,144.7,136.4,129.9,127.7,127.5,121.9,121.5,119.2,118.9,115.9,113.9,111.2,61.1,57.2,32.9,26.1,24.9,20.5,14.3.hrms m/z(esi)calcd for c
22
h
26
n2o2[m h]
:351.2067,found:351.2062.
[0118]
实施例34
[0119][0120]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基环丁烷羧酸酯(110mg),得产物2
‑
环丁基
‑2‑
(对甲苯胺基)乙酸乙酯(47mg),收率为64%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.04
–
6.97(m,2h),6.62
–
6.52(m,2h),4.17(qq,j=6.9,3.7hz,2h),3.96(d,j=8.1hz,1h),2.69(qd,j=8.1,1.6hz,1h),2.25(s,3h),2.11
–
2.01(m,3h),1.97
–
1.84(m,3h),1.25(t,j=7.1hz,3h);
13
c nmr(126mhz,cdcl3)δ173.5,145.1,129.7,127.5,113.7,61.5,60.8,38.4,25.4,24.8,20.4,18.1,14.3.hrms m/z(esi)calcd for c
15
h
21
no2[m h]
:248.1645;found:248.1637.
[0121]
实施例35
[0122][0123]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基环戊烷羧酸酯(116mg),得产物2
‑
环戊基
‑2‑
(对甲苯胺基)乙酸乙酯(51mg),收率为65%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.05
–
6.94(m,2h),6.62
–
6.54(m,2h),4.17(q,j=7.1hz,2h),3.85(d,j=7.9hz,1h),2.24(s,3h),1.90
–
1.80(m,1h),1.77
–
1.63(m,3h),1.62
–
1.53(m,2h),1.52
–
1.40(m,2h),1.26(q,j=7.7,7.1hz,4h);
13
c nmr(126mhz,cdcl3)δ174.3,145.1,129.7,127.4,113.7,61.3,60.7,43.2,29.4,29.1,25.4,25.1,20.4,14.3.hrms m/z(esi)calcd for c
16
h
23
no2[m h]
:262.1802,found:262.1794.
[0124]
实施例36
[0125][0126]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基四氢呋喃
‑2‑
羧酸酯(117mg),得产物2
‑
(四氢呋喃
‑2‑
基)
‑2‑
(对甲苯胺基)乙酸乙酯(47mg),收率为60%(1:1d.r.),产物为无色液体。1h nmr(600mhz,cdcl3)δ7.01(d,j=8.2hz,2h),6.68
–
6.63(m,1h),6.62
–
6.57(m,1h),4.37
–
4.25(m,1h),4.22(qd,j=7.1,4.9hz,2h),4.08(dd,j=20.0,4.4hz,1h),3.94(ddt,j=34.4,8.3,6.6hz,1h),3.82(dddd,j=10.9,8.2,7.2,6.0hz,1h),2.26(s,3h),2.09
–
1.88(m,4h),1.27(td,j=7.1,1.6hz,3h);
13
c nmr
(151mhz,cdcl3)δ172.7,172.3,145.2,144.6,129.8,129.7,127.8,127.6,114.1,113.9,79.9,79.4,69.2,68.7,61.24,61.15,60.2,28.4,28.1,26.1,25.6,20.42,20.41,14.3,14.2.
[0127]
实施例37
[0128][0129]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1
‑
苄基4
‑
(1,3
‑
二氧异吲哚
‑2‑
基)哌啶
‑
1,4
‑
二羧酸酯(184mg),得产物4
‑
(2
‑
乙氧基
‑2‑
氧代
‑1‑
(对甲苯胺基)乙基)哌啶
‑1‑
甲酸苄酯(70mg),收率为57%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.38(d,j=4.0hz,4h),7.35
–
7.31(m,1h),7.08
–
6.94(m,2h),6.64
–
6.52(m,2h),5.15(s,2h),4.40
–
4.21(m,2h),4.19(q,j=7.1hz,2h),3.90(d,j=6.3hz,1h),2.79(s,2h),2.26(s,3h),1.94(dt,j=17.2,8.6hz,1h),1.86(dt,j=13.2,2.7hz,1h),1.68(d,j=11.2hz,1h),1.49
–
1.35(m,2h),1.26(t,j=7.1hz,3h);
13
c nmr(126mhz,cdcl3)δ173.1,155.1,144.6,136.8,129.8,128.4,127.9,127.8,113.9,67.0,61.6,61.0,43.9,43.8,39.6,20.3,14.2.hrms m/z(esi)calcd for c
24
h
30
n2o4[m h]
:411.2278,found:411.2270.
[0130]
实施例38
[0131][0132]
按实施例1所述的方法,不同的是所用活性羧酸酯为:4
‑
(1,3
‑
二氧异吲哚
‑2‑
基)1
‑
叔丁基哌啶
‑
1,4
‑
二羧酸酯(168mg),得产物4
‑
(2
‑
乙氧基
‑2‑
氧代
‑1‑
(对甲苯胺基)乙基)哌啶
‑1‑
甲酸叔丁酯(59mg),收率为52%,产物为无色液体。1hnmr(500mhz,cdcl3)δ7.03
–
6.95(m,2h),6.61
–
6.52(m,2h),4.18(q,j=7.1hz,4h),3.88(d,j=6.3hz,1h),2.69(s,2h),2.24(s,3h),1.97
–
1.85(m,1h),1.82(dt,j=13.3,2.8hz,1h),1.64(tt,j=13.1,2.6hz,1h),1.46(s,9h),1.42
–
1.33(m,2h),1.25(t,j=7.1hz,3h);
13
c nmr(126mhz,cdcl3)δ173.2,154.6,144.7,129.8,127.8,113.9,79.4,61.7,61.0,39.7,28.4,20.3,14.2.hrms m/z(esi)calcd for c
21
h
32
n2o4[m na]
:399.2254,found:399.2256.
[0133]
实施例39
[0134][0135]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基新戊酸酯(111mg),得产物3,3
‑
二甲基
‑2‑
(对甲苯胺基)丁酸乙酯(49mg),收率为72%,产物为无
nmr(126mhz,cdcl3)δ172.9,145.5,145.2,129.7,128.1,127.7,126.54,126.48,114.2,66.7,60.5,41.5,25.7,25.1,20.4,13.9.hrms m/z(esi)calcd for c
20
h
25
no2[m h]
:312.1958,found:312.1954.
[0145]
实施例43
[0146][0147]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基
‑1‑
苯基环丙烷羧酸酯(138mg),得产物2
‑
(1
‑
苯基环丙基)
‑2‑
(对甲苯胺基)乙酸乙酯(39mg),收率为42%,产物为无色液体。1h nmr(500mhz,cdc
l3
)δ7.45
–
7.38(m,2h),7.38
–
7.32(m,2h),7.32
–
7.28(m,1h),7.01(d,j=8.2hz,2h),6.63
–
6.52(m,2h),4.16(qd,j=7.1,4.8hz,2h),3.91(s,1h),2.27(s,3h),1.29(ddd,j=10.0,5.7,4.2hz,1h),1.22(t,j=7.1hz,3h),1.04(ddd,j=9.0,6.0,4.6hz,1h),0.98(ddd,j=10.2,5.7,4.6hz,1h),0.93(ddd,j=9.1,5.9,4.2hz,1h);
13
c nmr(126mhz,cdcl3)δ172.3,144.6,141.3,130.4,129.7,128.1,127.5,127.2,113.9,63.7,60.8,28.7,20.3,14.1,11.6,11.0.hrms m/z(esi)calcd for c
20
h
23
no2[m h]
:310.1802,found:310.1797.
[0148]
实施例44
[0149][0150]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基
‑1‑
苯基环戊烷羧酸酯(151mg),得产物2
‑
(1
‑
苯基环戊基)
‑2‑
(对甲苯胺基)乙酸乙酯(41mg),收率为41%,产物为无色液体。1h nmr(500mhz,cdc
l3
)δ7.35(d,j=4.6hz,4h),7.30
–
7.25(m,1h),7.00
–
6.93(m,2h),6.58
–
6.50(m,2h),4.14(s,1h),4.05
–
3.93(m,2h),2.45
–
2.26(m,2h),2.23(s,3h),2.07(dtd,j=12.8,7.6,1.9hz,2h),1.97
–
1.85(m,1h),1.84
–
1.75(m,1h),1.73
–
1.63(m,2h),1.08(t,j=7.1hz,3h);
13
c nmr(126mhz,cdcl3)δ172.7,145.2,143.4,129.7,127.9,127.8,127.6,126.6,114.1,63.4,60.5,54.8,35.4,35.3,22.9,22.7,20.3,14.0.hrms m/z(esi)calcd for c
22
h
27
no2[m h]
:338.2114,found:338.2108.
[0151]
实施例45
[0152][0153]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧代异吲哚啉
‑2‑
基1
‑
甲基环己烷羧酸酯(129mg),得产物2
‑
(1
‑
甲基环己基)
‑2‑
(对甲苯胺基)乙酸乙酯(46mg),收率为53%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.01
–
6.97(m,2h),6.63
–
6.60(m,2h),4.15(qd,j=7.1,2.2hz,2h),3.92(s,1h),2.25(s,3h),1.51(ddd,j=16.1,
5.7,3.5hz,8h),1.35
–
1.31(m,2h),1.25(t,j=7.1hz,3h),1.06(s,3h);
13
c nmr(126mhz,cdcl3)δ173.5,145.5,129.8,127.5,114.1,65.0,60.4,37.1,35.0,26.1,21.8,21.7,20.4,14.3.hrms m/z(esi)calcd for c
18
h
27
no2[m h]
:290.2115,found:290.2108.
[0154]
实施例46
[0155][0156]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1,3
‑
二氧异吲哚
‑2‑
基2,2,5
‑
三甲基
‑
1,3
‑
二恶烷
‑5‑
羧酸酯(144mg),得产物2
‑
(对甲苯胺基)
‑2‑
(2,2,5
‑
三甲基
‑
1,3
‑
二恶烷
‑5‑
基)乙酸乙酯(38mg),收率为39%,产物为无色液体。1h nmr(500mhz,cdcl3)δ7.06
–
6.96(m,2h),6.81
–
6.59(m,2h),4.37(s,1h),4.27
–
4.13(m,2h),3.99(dd,j=11.8,1.8hz,1h),3.92(dd,j=12.0,1.8hz,1h),3.61(dd,j=24.2,11.9hz,2h),2.25(s,3h),1.63
–
1.48(m,3h),1.47(s,3h),1.26(t,j=7.1hz,3h),0.93(s,3h);
13
c nmr(126mhz,cdcl3)δ173.0,145.6,129.8,128.1,114.8,98.3,66.9,66.7,61.1,60.1,37.1,25.8,21.8,20.4,16.0,14.3.hrms m/z(esi)calcd for c
18
h
27
no4[m h]
:322.2012,found:322.2011.
[0157]
实施例47
[0158][0159]
按实施例1所述的方法,不同的是所用活性羧酸酯为:(3r,5r,7r)
‑
1,3
‑
二氧异吲哚
‑2‑
基金刚烷
‑1‑
羧酸盐(146mg),得产物2
‑
((3r,5r,7r)
‑
金刚烷
‑1‑
基)
‑2‑
(对甲苯基氨基)乙酸乙酯(78mg),收率为80%,产物为无色液体。1hnmr(500mhz,cdcl3)δ7.03
–
6.96(m,2h),6.64
–
6.58(m,2h),4.17(q,j=7.1hz,2h),3.65(s,1h),2.26(s,3h),1.84(dt,j=12.3,2.6hz,3h),1.76(dt,j=12.3,2.8hz,3h),1.72
–
1.66(m,3h),1.65
–
1.60(m,3h),1.27(t,j=7.1hz,3h);
13
cnmr(126mhz,cdcl3)δ172.9,145.6,129.7,127.3,114.0,66.9,60.4,39.0,36.9,36.3,28.4,20.3,14.3.hrms m/z(esi)calcd for c
21
h
29
no2[m h]
:328.2271,found:328.2268.
[0160]
实施例48
[0161][0162]
按实施例1所述的方法,不同的是所用活性羧酸酯为:1
‑
(1,3
‑
二氧异吲哚
‑2‑
基)4
‑
甲基双环[2.2.2]辛烷
‑
1,4
‑
二羧酸(161mg),得产物4
‑
(2
‑
乙氧基
‑2‑
氧
‑1‑
(对甲苯胺基)乙基)双环[2.2.2]辛烷
‑1‑
羧酸甲酯(79mg),收率为73%,产物为黄色固体。1h nmr
(500mhz,cdcl3)δ7.02
–
6.95(m,2h),6.62
–
6.54(m,2h),4.14(q,j=7.1hz,2h),3.70(s,1h),3.66(s,3h),2.24(s,3h),1.87
–
1.73(m,9h),1.57
–
1.49(m,3h),1.24(t,j=7.1hz,3h);
13
c nmr(126mhz,cdcl3)δ178.0,172.9,145.0,129.8,127.9,114.2,64.8,60.7,51.7,38.7,35.0,28.1,27.3,20.4,14.3.hrms m/z(esi)calcd for c
21
h
29
no4[m h]
:360.2169,found:360.2163.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。