1.本发明涉及如抗体等新型双特异性多肽及其在治疗癌症中的用途。
背景技术:
2.癌症免疫疗法
3.癌症是发达国家过早死亡的主要原因。癌症的免疫疗法旨在对肿瘤细胞产生有效的免疫反应。这可以通过例如打破对肿瘤抗原的耐受性、增强抗肿瘤免疫反应和刺激肿瘤部位的局部细胞因子反应来实现。持久抗肿瘤免疫反应的关键效应细胞是活化的肿瘤特异性效应t细胞。活化的肿瘤特异性效应t细胞的有效扩增可以将免疫反应重定向到肿瘤。在这种情况下,由肿瘤微环境诱导的各种免疫抑制机制会抑制效应t细胞的活性。几种免疫抑制介质 (mediator)由肿瘤细胞表达。此类介质通过诱导例如调节性t细胞(treg)或髓源性抑制细胞直接或间接地抑制t细胞活化。因此,耗竭、抑制、恢复或灭活此类调节性细胞可以提供抗肿瘤作用并恢复肿瘤微环境中的免疫抑制。进一步地,例如,树突状细胞(dc)对效应t 细胞的不完全活化会导致次优活化的或无反应性t细胞,从而导致抗肿瘤反应效率低下。相比之下,dc的充分诱导可以产生活化的效应t细胞的有效扩增,从而将免疫反应重定向到肿瘤。此外,自然杀伤(nk)细胞通过攻击人类白细胞抗原(hla)表达下调的肿瘤细胞并通过诱导抗体依赖性细胞毒性(adcc)而在肿瘤免疫学中发挥重要作用。因此,刺激nk 细胞也可以减少肿瘤的生长。
4.肿瘤细胞相关抗原
5.肿瘤细胞相关抗原(taa)是在肿瘤细胞上选择性表达的细胞表面蛋白质。术语肿瘤细胞相关表明taa并非完全具有肿瘤特异性,而是在肿瘤上过度表达。大量taa已被描述并用于各种治疗原理,包含单克隆抗体、使用taa
‑
cd3双特异性抗体的t细胞重定向疗法、免疫细胞因子和抗体
‑
药物偶联物。一些经过充分研究的taa包含egfr家族分子(her2、 her3和egfr/her1)、vegfr、epcam、cea、psa、psma、epha2、gp100、gd2、 muc1、cd20、cd19、cd22和cd33,总结在(cheever等人,2009,《临床癌症研究(clincancer res)》)。
6.5t4(也被称为滋养层糖蛋白、tpbg、m6p1和waif1)是一种定义明确的taa,最初由曼彻斯特大学的peter stern教授鉴定(hole和stern,1988,《英国癌症杂志(br j cancer)》)。其是一种癌胚抗原,在各种恶性肿瘤的高比例患者中表达,所述恶性肿瘤包含非小细胞肺癌、肾癌、胰腺癌、前列腺癌、乳腺癌、结肠直肠癌、胃癌、卵巢癌和宫颈癌以及急性淋巴细胞白血病,并且也被证明在肿瘤起始细胞中表达(castro等人,2012,《白血病(leukemia)》; damelin等人,2011,《癌症研究(cancer res)》;elkord等人,2009,《抗癌疗法专家评论(expertrev anticancer ther)》;southall等人,1990,《英国癌症杂志》)。
7.5t4表达具有肿瘤选择性,在大多数正常组织中不表达或表达很低。在非恶性组织中, 5t4主要在胎盘(滋养层和羊膜上皮)中表达,并且在一些特殊的上皮细胞中表达处于低水平(hole和stern,1988,《英国癌症杂志》),在其它正常组织中表达水平也较低(参见us2010/0021483)。然而,尽管在一些健康组织中检测到低水平,但与此相关的安全风险被认
为是低的,因为肿瘤中的表达水平要高得多。这得到了以下事实的支持,即针对5t4的iii期临床项目anyara和trovax未报告严重的5t4相关毒性。
8.来自stern等人的数据证明,5t4调节cxcr4的功能活性(castro等人,2012,《白血病》; southgate等人,2010,《美国科学公共图书馆(plos one)》)。5t4结合抗体或5t4敲低导致抑制cxcr4介导的细胞迁移。cxcr4通路参与肿瘤生长和转移。因此,以cxcr4抑制方式靶向5t4可能会减少肿瘤的生长和/或扩散。
9.epcam(替代名称:berep4、cd326、co
‑
171a、17
‑
1a、epcam/ep
‑
am、esa、egp、 egp
‑
2、egp34、egp40、ga733
‑
2、hea125、ksa、ks1/4、mh99、mk
‑
1、moc31、trop 1、vu
‑
1d9、323/a3)在恶性癌中过度表达(patriarca等人,2012,《癌症治疗评论(cancertreatment reviews)》)(yao等人2013,《国际癌症杂志(int j cancer)》)(lund等人,2014, 《mabs》)(schnell等人,2013,《生物化学与生物物理学报(biochim biophys acta)》)。epcam 是一种i型、跨膜、39
–
42kda糖蛋白,其可用作上皮特异性细胞间粘附分子(patriarca等人, 2012,《癌症治疗评论)》)。
10.egfr在几种癌症类型中被扩增和失调。egfr以不同的构象表达,这些构象在功能上有活性或无活性,并且可通过特异性抗体加以区分。egfr调节细胞生长、凋亡、迁移、粘附和分化(yarden,2001,《欧洲癌症杂志(eur j cancer)》;yarden和sliwkowski,2001,《分子细胞生物学自然评论(nat rev mol cell biol)》)。通过该受体的过度表达或持续信号传导在癌中很常见。
11.her2,也被称为cd340(分化簇340)、原癌基因neu、erbb2(啮齿动物)或erbb2,在许多肿瘤类型中被扩增和失调,具体地说,在乳腺癌中(yarden,2001,《欧洲癌症杂志》)。这种致癌基因的过度表达已被证明在癌症的发展和进展中起重要作用。
12.cd40
13.cd40是一种细胞表面表达的糖蛋白,其属于肿瘤坏死因子受体(tnfr)超家族,在免疫系统中发挥核心作用。其在各种免疫细胞(如b细胞、dc、单核细胞和巨噬细胞)上表达,但也在其它正常组织(包含上皮细胞、内皮细胞和成纤维细胞)以及几种肿瘤类型(例如,在b细胞淋巴瘤和癌)上表达。dc上cd40的活化通过肿瘤特异性t效应细胞导致抗肿瘤免疫反应。cd40激动剂在临床前模型中触发有效的抗肿瘤反应。这些反应通过两种不同的机制介导:(i)肿瘤特异性免疫活化,和(ii)直接杀肿瘤作用,例如通过细胞凋亡、抗体依赖性细胞毒性(adcc)和补体依赖性细胞毒性(cdc)。抗肿瘤免疫效应与肿瘤的cd40状态无关,与肿瘤特异性细胞毒性t淋巴细胞(ctl)的活化有关,并且可能与某些肿瘤类型中的巨噬细胞有关。另一方面,直接杀肿瘤作用高度依赖于肿瘤的cd40表达,并且被认为通过释放肿瘤抗原来增强抗肿瘤免疫反应。
14.临床前研究已经证明了用激动性抗cd40抗体治疗几种癌症类型的概念,所述癌症类型包含淋巴瘤、黑色素瘤、肝癌、骨肉瘤、肾细胞癌、乳腺癌和膀胱癌。此外,人源化或人抗 cd40抗体已在许多临床前模型中进行了评估,并一致证明了抗肿瘤作用。值得注意的是, sgn
‑
40,一种具有部分激动作用的人源化cd40单克隆抗体,在严重联合免疫缺陷(scid) 小鼠中使用b细胞淋巴瘤模型(raji和ramos)进行了评估,并证明了在大约50%的治疗小鼠中表现出对肿瘤生长和存活的影响(具有完全反应)。cp
‑
870,893,一种人类激动性抗cd40 抗体,在scid小鼠中显示出对b细胞淋巴瘤、乳腺癌、结肠癌、前列腺癌和胰腺癌的抗肿瘤作
用。在cd40阳性和cd40阴性肿瘤中均观察到了疗效,从而证明了cp
‑
870,893增强抗肿瘤免疫的能力。
15.尽管在过去十年中用于治疗各种癌症的免疫疗法的发展取得了进展,但仍然需要新的有效药物。
16.因此,本发明寻求提供用于治疗癌症的改进的基于多肽的疗法。
技术实现要素:
17.本发明的第一方面提供了一种双特异性多肽,其包括能够特异性结合cd40的被称为b1 的第一结合结构域和能够特异性结合肿瘤细胞相关抗原的被称为b2的第二结合结构域。
18.包括一个肿瘤靶向部分(例如epcam结合剂)和一个免疫活化部分(例如cd40激动剂)的这种双特异性化合物可用于建立高效且安全的癌症免疫疗法。
19.各种类型的肿瘤定位免疫治疗分子,如免疫细胞因子和双特异性抗体,已在临床前研究和临床中显示出有益的免疫活化和肿瘤生长抑制(kiefer和neri,2016)。
20.迄今为止,免疫细胞因子的临床进展并不引人瞩目,并且副作用仍然存在,因为肿瘤结合实体仅赋予有限的肿瘤定位,大部分免疫细胞因子最终进入其它区域。本发明中描述的将活性限制于肿瘤的双特异性抗体将提供优于免疫细胞因子的明显优势,因为所述双特异性抗体在不存在肿瘤时是无活性的。
21.为了避免影响免疫系统的与诱导肿瘤免疫无关的部分并避免cd40活化剂的全身毒性,同时在肿瘤区域获得高疗效,可以优化cd40激动剂的分子格式的设计。例如,通过cd40
‑
taa 双特异性抗体可以获得良好的疗效/安全性,所述双特异性抗体需要通过与taa结合来交联,才能发生cd40活化。因此,驻留在肿瘤组织中的cd40表达细胞(如树突状细胞)将优先被活化,而其它组织中的cd40表达细胞则不会优先被活化,在所述其它组织中,taa低表达或不表达。这将允许在肿瘤组织中特异性地集中活化cd40表达细胞,同时限制由广泛的 cd40活化诱导的毒性。
22.双特异性多肽的结构
[0023]“多肽”在本文中以其最广泛的含义使用,以指代两个或更多个亚基氨基酸、氨基酸类似物或其它肽模拟物的化合物。因此,术语“多肽”包含短肽序列以及更长的多肽和蛋白质。如本文所使用的,术语“氨基酸”是指天然和/或非天然或合成的氨基酸,包含d或l光学异构体两者以及氨基酸类似物和肽模拟物。
[0024]
如本文所使用的,术语“双特异性”是指多肽能够特异性结合至少两个靶实体。
[0025]
在一个优选的实施例中,所述多肽是双特异性抗体(其众多实例在下文中详细描述)。
[0026]
因此,所述第一结合结构域和/或第二结合结构域可以选自由抗体及其抗原结合片段组成的组。
[0027]“抗体或其抗原结合片段”包含基本上完整的抗体分子,以及嵌合抗体、人源化抗体、分离的人抗体、单链抗体、双特异性抗体、抗体重链、抗体轻链、抗体重链和/或轻链的同源二聚体和异源二聚体及其抗原结合片段和衍生物。合适的抗原结合片段和衍生物包含fv片段 (例如单链fv和二硫键结合的fv)、fab样片段(例如fab片段、fab'片段和f(ab)2片
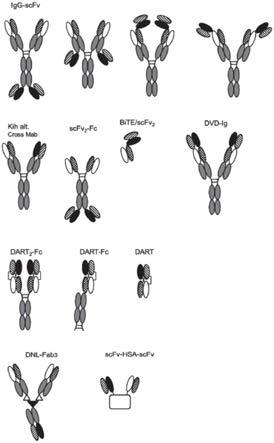
段)、单可变结构域(例如vh结构域和vl结构域)和单结构域抗体(dab,包含单和双格式[即dab
‑
接头
‑
dab]以及纳米抗体)。使用抗体片段而不是完整抗体的潜在优势是多方面的。较小尺寸的片段可引起改善的药理学性质,如更好的实体组织渗透。此外,抗原结合片段(如fab、 fv、scfv和dab抗体片段)可以在大肠杆菌中表达和分泌,从而允许容易地产生大量的所述片段。
[0028]
在一个实施例中,所述抗原结合片段选自由以下组成的组:fv片段(如单链fv片段或二硫键结合的fv片段)、fab样片段(如fab片段;fab'片段或f(ab)2片段)和单结构域抗体。
[0029]
短语“抗体或其抗原结合片段”也旨在涵盖抗体模拟物(例如,具有高度稳定性但允许在某些位置引入可变性的非抗体支架结构)。生物化学领域的技术人员将熟悉许多此类分子,如gebauer和skerra,2009(其公开内容通过引用并入本文)中所讨论的。示例性抗体模拟物包含:亲和体(也被称为trinectins;nygren,2008,《欧洲生化学会联合会杂志(febs j)》, 275,2668
‑
2676);ctld(也被称为tetranectins;《药学与制药学创新(innovationspharmac.technol.)》(2006),27
‑
30);adnectins(也被称为monobodies;《分子生物学方法 (meth.mol.biol.)》,352(2007),95
‑
109);anticalins(《今日药物发现(drug discovery today)》 (2005),10,23
‑
33);darpins(锚蛋白;《自然生物技术(nat.biotechnol.)》(2004),22,575
‑
582); avimers(《自然生物技术》(2005),23,1556
‑
1561);微抗体(《欧洲生化学会联合会杂志》,(2007), 274,86
‑
95);肽适体(生物疗法专家意见(expert.opin.biol.ther.)》(2005),5,783
‑
797);kunitz 结构域(《药理学与实验治疗学杂志(j.pharmacol.exp.ther.)》(2006)318,803
‑
809);affilins (《生物技术趋势(trends.biotechnol.)》(2005),23,514
‑
522);affimers(avacta生命科学公司,韦瑟比,英国)。
[0030]
本发明范围内还包含嵌合t细胞受体(也被称为嵌合免疫受体和嵌合抗原受体或car) (参见pule等人,2003,其公开内容通过引用并入本文)。这些是将任意特异性移植到免疫效应细胞上的工程化受体。通常,car用于将单克隆抗体的特异性移植到t细胞上;通过逆转录病毒载体促进其编码序列的转移。此类分子的最常见形式是融合体,其包括源自与cd3
‑
ζ跨膜和胞内结构域融合的单克隆抗体的单链可变片段(scfv)。当t细胞表达这种融合分子时,它们会识别并杀死表达转移的单克隆抗体特异性的靶细胞。
[0031]
本领域技术人员将进一步理解,本发明还涵盖抗体及其抗原结合片段的修饰形式,无论是现在存在的还是将来存在的,例如通过聚乙二醇或其它合适的聚合物的共价连接修饰(见下文)。
[0032]
产生抗体和抗体片段的方法是本领域众所周知的。例如,抗体可以通过几种方法中的任何一种产生,这些方法采用诱导体内产生抗体分子、筛选免疫球蛋白文库(orlandi等人,1989; winter等人,1991,其公开内容通过引用并入本文)或通过培养物中的细胞系产生单克隆抗体分子。这些方法包含但不限于杂交瘤技术、人b细胞杂交瘤技术和epstein
‑
barr病毒(ebv)
ꢀ‑
杂交瘤技术(kohler等人,1975,kozbor等人,1985;cote等人,1983;cole等人,1984,其公开内容通过引用并入本文)。
[0033]
生产单克隆抗体的合适方法也公开在以下文献中:“单克隆抗体:技术手册(monoclonalantibodies:a manual of techniques)”,h zola(crc出版社,1988,其公开
内容通过引用并入本文)以及“单克隆杂交瘤抗体:技术与应用(monoclonal hybridoma antibodies:techniques andapplications)”,j g r hurrell(crc出版社,1982,其公开内容通过引用并入本文)。
[0034]
同样,可以使用本领域众所周知的方法获得抗体片段(参见例如,harlow和lane,1988,
ꢀ“
抗体:实验室手册(antibodies:a laboratory manual)”,冷泉港实验室出版社(cold springharbor laboratory),纽约,其公开内容通过引用并入本文)。例如,根据本发明的抗体片段可以通过抗体的蛋白水解或通过在大肠杆菌或哺乳动物细胞(例如中国仓鼠卵巢细胞培养物或其它蛋白质表达系统)中表达编码该片段的dna来制备。可替代地,可以通过常规方法通过完整抗体的胃蛋白酶或木瓜蛋白酶消化获得抗体片段。
[0035]
本领域技术人员将理解,对于人类治疗或诊断,优选使用人类或人源化抗体。非人(例如鼠)抗体的人源化形式是工程化嵌合抗体或抗体片段,其优选地具有源自非人抗体的最小部分。人源化抗体包含这样的抗体,其中人抗体(受体抗体)的互补决定区被来自具有所需功能的非人物种(供体抗体)(如小鼠、大鼠或兔)的互补决定区的残基替换。在一些情况下,人抗体的fv框架残基被对应的非人残基替换。人源化抗体还可以包括既未在受体抗体中发现也未在输入的互补决定区或框架序列中发现的残基。一般而言,人源化抗体将包括至少一个 (通常为两个)可变结构域中的基本上所有可变结构域,其中所有或基本上所有的互补决定区对应于非人抗体的互补决定区,并且所有或基本上所有的框架区对应于相关人类共有序列的框架区。人源化抗体最好还包含抗体恒定区的至少一部分,如通常源自人抗体的fc区(参见例如,jones等人,1986,riechmann等人,1988,presta,1992,其公开内容通过引用并入本文)。
[0036]
用于将非人抗体人源化的方法是本领域众所周知的。通常,人源化抗体具有从非人来源引入的一个或多个氨基酸残基。这些非人氨基酸残基通常被称为输入残基,所述输入残基通常取自输入可变结构域。通过用对应的啮齿动物互补决定区取代人类互补决定区,可以基本上按所描述的进行人源化(参见例如,jones等人,1986,reichmann等人,1988,verhoeyen等人,1988,us 4,816,567,其公开内容通过引用并入本文)。因此,此类人源化抗体是嵌合抗体,其中基本上少于完整的人可变结构域已被来自非人物种的对应序列取代。实际上,人源化抗体通常可以是人抗体,其中一些互补决定区残基和可能的一些框架残基被来自啮齿动物抗体中的类似位点的残基取代。
[0037]
还可以使用本领域已知的各种技术来鉴定人抗体,所述技术包含噬菌体展示文库(参见例如,hoogenboom和winter,1991,marks等人,1991,cole等人,1985,boerner等人,1991,其公开内容通过引用并入本文)。
[0038]
本领域技术人员将理解,本发明的双特异性多肽(例如抗体)可以呈任何合适的结构格式。
[0039]
因此,在本发明的双特异性抗体的示例性实施例中:
[0040]
(a)结合结构域b1和/或结合结构域b2是完整的igg抗体(或一起形成完整的igg抗体);
[0041]
(b)结合结构域b1和/或结合结构域b2是fv片段(例如scfv);
[0042]
(c)结合结构域b1和/或结合结构域b2是fab片段;和/或
[0043]
(d)结合结构域b1和/或结合结构域b2是单结构域抗体(例如结构域抗体和纳米抗
体)。
[0044]
本领域技术人员将理解,所述双特异性抗体可以包括人fc区或所述区域的变体,其中所述区域为igg1区、igg2区、igg3区或igg4区,优选为igg1区或igg4区。
[0045]
对治疗性单克隆抗体或fc融合蛋白的fc区进行工程化允许产生更适合其所需药理学活性的分子(strohl,2009,其公开内容通过引用并入本文)。
[0046]
(a)用于增加半衰期的工程化fc区
[0047]
提高治疗性抗体疗效的一种方法是增加其血清持久性,从而允许更高的循环水平、更少的施用频率和减少的剂量。
[0048]
igg的半衰期取决于其与新生儿受体fcrn的ph依赖性结合。在内皮细胞表面表达的 fcrn以ph依赖性方式结合igg并保护其免于降解。
[0049]
在ph 6.0而非ph 7.4下选择性结合fcrn的一些抗体在各种动物模型中表现出更高(换句话说,更长)的半衰期。另外,在ph 6.0下以更高的亲和力结合fcrn但在ph 7.4下仍保持低亲和力的一些抗体显示出更长的半衰期。
[0050]
定位在ch2结构域和ch3结构域之间界面处的几种突变,如t250q/m428l(hinton等人,2004,其公开内容通过引用并入本文)和m252y/s254t/t256e h433k/n434f(vaccaro 等人,2005,其公开内容通过引用并入本文),已显示可增加与fcrn的结合亲和力和igg1的体内半衰期。
[0051]
(b)用于改变效应子功能的工程化fc区
[0052]
为了确保在不存在肿瘤抗原的情况下cd40活化不存在,双特异性抗体的fc部分应与 fcγr无亲和力或以非常低的亲和力结合,因为fcγr介导的cd40抗体交联可能会诱导活化。“非常低的亲和力”包含:与野生型igg1相比,fc部分对fcγri、fcγrii和iii的亲和力降低了至少10倍,如通过在fcγr表达细胞的流式细胞术分析中达到一半最大结合时的浓度所确定的(hezareh等人,2001)或通过fcγr elisa所确定的(shields等人,2001)。
[0053]
另一个需要考虑的因素是,fcγr的参与还可能诱导抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)和抗体包被细胞的补体依赖性细胞毒性(cdc)。在一个实施例中,为了增强肿瘤依赖性cd40活化以及避免cd40表达细胞的耗竭,cd40
‑
taa双特异性抗体的同种型应该优选地是沉默的。
[0054]
四种人igg同种型以不同的亲和力结合活化性fcγ受体(fcγri、fcγriia、fcγriiia)、抑制性fcγriib受体和补体的第一组分(c1q),从而产生非常不同的效应子功能(bruhns等人,2009,其公开内容通过引用并入本文)。igg1分子具有最高的亲和力和诱导效应子功能的能力,而igg2、igg3和igg4的效果较差(bruhns,2012;hogarth和pietersz,2012;stewart 等人,2014)(wang等人2015;vidarson等人2014)。另外,igg1的fc区中的某些突变会显著降低fcγr亲和力和效应子功能,同时保留新生儿fcr(fcrn)相互作用(ju和jung,2014; leabman等人,2013;oganesyan等人,2008;sazinsky等人,2008)。
[0055]
最广泛使用的igg1突变体是n297a(单独或与d265a组合),以及位置l234和l235 处的突变,包含所谓的“lala”双突变体l234a/l235a。被描述成通过突变进一步使igg1 沉默的另一个位置是p329(参见us 2012/0251531)。
[0056]
因此,选择具有低效应子功能但保留与fcrn结合的突变的igg1格式可能会产生具有 taa依赖性cd40活化的双特异性抗体,并表现出良好的疗效/安全性和良好的pk性质。
[0057]
有利地,所述多肽无能力诱导抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬作用 (adcp)和/或补体依赖性细胞毒性(cdc)。“无能力”包含:多肽诱导adcc等的能力比野生型igg1低至少10倍,如通过例如hezareh等人(2001)描述的单核细胞依赖性adcc 或cdc测定法所示。
[0058]
在一个实施例中,所述fc区可以是在以下位置中的一个或多个位置处包括突变的人igg1 fc区的变体:
[0059]
l234、l235、p239、d265、n297和/或p329。
[0060]
有利地,丙氨酸可以存在于一个或多个突变位置处。
[0061]
任选地,igg1变体可以是包括突变l234a和l235a的人igg1 fc区的变体(即lala 双突变体;参见seq id no:161)。
[0062]
本领域技术人员将理解,本发明的双特异性多肽可以具有几种不同的结构格式(例如,参见chan和carter,2016,其公开内容通过引用并入本文)。
[0063]
在示例性实施例中,所述双特异性抗体选自由以下组成的组:
[0064]
(a)二价双特异性抗体,如igg
‑
scfv双特异性抗体(例如,其中b1是完整的igg并且 b2是在igg的轻链的n端和/或在轻链的c端和/或在重链的n端和/或在重链的c端连接到 b1的scfv,反之亦然);
[0065]
(b)单价双特异性抗体,如(genmab as,哥本哈根,丹麦)或“杵臼式 (knob
‑
in
‑
hole)”双特异性抗体(例如,scfv
‑
kih、scfv
‑
kih
r
、bite
‑
kih或bite
‑
kih
r
(参见xu等人,2015,《mabs》7(1):231
‑
242));
[0066]
(c)scfv2‑
fc双特异性抗体(如来自emergent biosolutions inc的adaptir
tm
双特异性抗体);
[0067]
(d)bite/scfv2双特异性抗体;
[0068]
(e)dvd
‑
ig双特异性抗体;
[0069]
(f)基于dart的双特异性抗体(例如,dart2‑
fc或dart);
[0070]
(g)dnl
‑
fab3双特异性抗体;以及
[0071]
(h)scfv
‑
hsa
‑
scfv双特异性抗体。
[0072]
例如,所述双特异性抗体可以是igg
‑
scfv抗体。所述igg
‑
scfv抗体可以处于vh
‑
vl取向或vl
‑
vh取向。在一个实施例中,可以通过vh和vl之间的s
‑
s桥来稳定scfv。
[0073]
在一个实施例中,结合结构域b1和结合结构域b2彼此直接融合。
[0074]
在替代实施例中,结合结构域b1和结合结构域b2通过多肽接头连接。例如,多肽接头可以是介于约10到约25个氨基酸之间的短接头肽。所述接头通常富含甘氨酸以提高灵活性,以及丝氨酸或苏氨酸以提高溶解度,并且可以将vh的n端与vl的c端连接起来,反之亦然。
[0075]
因此,所述接头可以选自由以下氨基酸序列组成的组:sggggsggggs(seq id no: 162)、sggggsggggsap(seq id no:163)、nfsqp(seq id no:164)、krtva(seq idno:165)、gggsgggg(seq id no:166)、ggggsggggs(seq id no:167)、 ggggsggggsggggs(seq id no:168)、gstsgsgkpgsgegstkg(seq id no:169) (whitlow等人1993)thtcppcpepkssdk(seq id no:170)、gggs(seq id no:171)、 eaakeaakggggs(seq id no:172)、eaakeaak(seq id no:173)或(sg)m,其中m =1到7。
[0076]
在一个优选的实施例中,所述接头可以选自由以下组成的组:seq id no:166、seq idno:168和seq id no:169。
[0077]
如本文所使用的,术语“氨基酸”包含标准的二十种基因编码的氨基酸及其对应的“d”型立体异构体(与天然“l”型相比)、ω
‑
氨基酸、其它天然存在的氨基酸、非常规氨基酸(例如α,α
‑
二取代氨基酸、n
‑
烷基氨基酸等)和化学衍生的氨基酸(见下文)。
[0078]
当具体列举氨基酸时,如“丙氨酸”或“ala”或“a”,除非另有明确说明,否则该术语是指l
‑
a丙氨酸和d
‑
丙氨酸两者。其它非常规氨基酸也可为本发明多肽的合适的组分,只要多肽保留所需的功能特性即可。对于示出的肽,在适当的情况下,每个编码的氨基酸残基由对应于常规氨基酸俗名的单字母名称表示。
[0079]
在一个实施例中,本文定义的多肽包括l
‑
氨基酸或由其组成。
[0080]
本领域技术人员将理解,本发明的多肽可以包括一个或多个已被修饰或衍生的氨基酸或由所述一个或多个氨基酸组成。
[0081]
一个或多个氨基酸的化学衍生物可通过与官能侧基反应来实现。此类衍生分子包含例如这样的分子,其中游离氨基已被衍生以形成胺盐酸盐、对甲苯磺酰基、羧基苯氧基、叔丁氧基羰基、氯乙酰基或甲酰基。游离羧基可被衍生以形成盐、甲酯和乙酯或其它类型的酯和酰肼。游离羟基可被衍生以形成o
‑
酰基或o
‑
烷基衍生物。含有二十种标准氨基酸的天然存在的氨基酸衍生物的肽也被包含作为化学衍生物。例如:4
‑
羟脯氨酸可以取代脯氨酸;5
‑
羟基赖氨酸可以取代赖氨酸;3
‑
甲基组氨酸可以取代组氨酸;高丝氨酸可以取代丝氨酸并且鸟氨酸可以取代赖氨酸。衍生物还包含含有一个或多个添加或缺失的肽,只要保持必要的活性即可。其它包含的修饰是酰胺化、氨基末端酰化(例如乙酰化或巯基乙酸酰胺化)、末端羧基酰胺化 (例如用氨或甲胺进行)和类似的末端修饰。
[0082]
本领域的技术人员应进一步了解,拟肽化合物也可为适用的。术语
‘
拟肽’是指模拟特定肽作为治疗剂的构象和所需特征的化合物。
[0083]
例如,所述多肽不仅包含其中氨基酸残基通过肽(
‑
co
‑
nh
‑
)键连接的分子,还包含其中肽键反转的分子。例如,这种逆反型肽模拟物可以使用本领域已知的方法制备,如在meziere 等人(1997)中描述的方法,所述文献通过引用并入本文。这种方法涉及制作假肽,所述假肽含有涉及骨架的变化,而不是侧链的取向。含有nh
‑
co键而不是co
‑
nh肽键的逆反肽对蛋白水解具有更强的抗性。可替代地,所述多肽可以是肽模拟物化合物,其中一个或多个氨基酸残基通过
‑
y(ch2nh)
‑
键代替常规酰胺键进行连接。
[0084]
在另外的替代方案中,可以完全省去肽键,其限制条件是使用保留氨基酸残基的碳原子之间的间隔的适当接头部分;接头部分具有与肽键基本上相同的电荷分布和基本上相同的平面度可能是有利的。
[0085]
还应理解,所述多肽可以方便地在其n端或c端被封闭,以帮助降低对外蛋白酶解消化的敏感性。
[0086]
多种未编码或修饰的氨基酸(如d
‑
氨基酸和n
‑
甲基氨基酸)也已被用于修饰哺乳动物肽。另外,假定的生物活性构象可以通过共价修饰稳定,如环化或通过引入内酰胺或其它类型的桥,例如参见veber等人(1978)和thursell等人(1983),二者通过引用并入本文。
[0087]
在本发明的一个实施例中,结合结构域b1或结合结构域b2之一是免疫球蛋白分子,并且结合结构域b1或结合结构域b2之一是fab片段,其中所述fab片段通过所述fab片段
的轻链融合至所述免疫球蛋白的重链的c端。
[0088]
例如,所述多肽可以具有如图2所示的格式。这种格式被称为ruby
tm
格式(如未决的英国专利申请1820556.7中所述)。
[0089]
所述双特异性多肽可以包括一个或多个突变以促进所述免疫球蛋白的重链多肽与所述免疫球蛋白的轻链多肽的缔合和/或促进所述fab的重链多肽与所述fab的轻链多肽的缔合。
[0090]
在一个实施例中,所述一个或多个突变可防止聚集体和fab副产物的形成。
[0091]
本领域技术人员将理解,在一个实施例中,突变可以通过产生空间位阻和/或电荷之间的不相容性来防止聚集体和/或fab副产物的形成。
[0092]“空间位阻”是指由于空间体积而导致的反应减慢,即氨基酸分子的尺寸防止两个蛋白质表面的缔合,如果存在较小的氨基酸,则可能以其它方式发生这种缔合。
[0093]“电荷之间的不相容性”是指不会形成不需要的产物,因为电荷不相容并防止产物形成,例如可能存在两个带负电的部分,其可以排斥和防止形成不需要的产物。
[0094]
如上所述,所述突变通过例如产生限制聚集体或副产物fab片段形成的表面来限制fab 副产物和/或聚集体的形成。在一个实施例中,突变通过产生空间位阻和/或电荷之间的不相容性(从而导致错误链的电荷不相容性)来防止形成fab副产物。突变还可以通过例如产生盐或二硫桥来促进正确链之间(即第一重链多肽和第一轻链多肽之间,和/或第二重链多肽和第二轻链多肽之间)的相互作用。
[0095]
因此,突变可能有利于双特异性多肽的形成。
[0096]
在一个实施例中,在制造过程中形成的聚集体的百分比小于或等于25%。任选地,聚集体的百分比小于或等于20%、17.5%、15%、13.5%或10%。优选地,聚集体的百分比小于10%。任选地,当在生产过程中使用3条链时,在双特异性多肽的链以相等的比率(例如以1:1:1 的比率)转染时进行这些测量。
[0097]
可替代地,可以优化链转染比率。任选地,当链转染比率被优化时,聚集体的百分比可以小于或等于3.5%、3%、2.5%或2%。
[0098]
在一个实施例中,双特异性多肽包括一个或多个突变对,每个突变对包括两个功能相容的突变。
[0099]“功能相容的突变”是指突变具有互补功能,例如该对中的一个突变(在一条链中)可以是形成带正电区域的突变,而另一个突变(在另一条链中)形成带负电区域。这些突变一起以功能相容的方式起作用,从而促进各自链的缔合。
[0100]
在一个实施例中,所述双特异性多肽在以下区域组中的一个或多个区域组中包括一个或多个突变对:
[0101]
(a)免疫球蛋白的ch1和cκ或cλ区;和/或
[0102]
(b)fab的ch1和cκ或cλ区;和/或
[0103]
(c)免疫球蛋白的vl和vh区;和/或
[0104]
(d)fab的vl和vh区。
[0105]
因此,在一个实施例中,突变对位于fab和/或免疫球蛋白的ch1和cκ或cλ区中,并且所述突变对选自:
[0106]
(a)空腔和突出表面突变(即空间突变);和/或
[0107]
(b)疏水交换突变;和/或
[0108]
(c)带电突变(即盐突变);和/或
[0109]
(d)导致形成二硫桥的突变。
[0110]
可替代地或另外地,突变对可以位于fab和/或免疫球蛋白的vh和vl区中,vh和vl 区中的突变对选自:
[0111]
(a)带电突变(即盐突变);和/或
[0112]
(b)双重带电突变;和/或
[0113]
(c)导致形成二硫桥的突变。
[0114]
在本发明的一个实施例中,突变位于选自由以下组成的组的位置处:
[0115]
(a)ch1结构域中的以下一个或多个位置:h168、f170、l145、s183和t187(根据欧盟编号);和/或
[0116]
(b)选自cκ或cλ结构域中的以下一个或多个位置范围的位置:位置132到138、位置 173到179、位置130到136、位置111到117和位置134到140(根据欧盟编号);和/或
[0117]
(c)选自vl中的以下一个或多个位置范围的位置:位置41到47、位置117到123和位置46到52(根据imgt编号);和/或
[0118]
(d)选自vh中的以下一个或多个位置范围的位置:位置41到47、位置46到52和位置117到123(根据imgt编号)。
[0119]
在本发明的一个实施例中,突变位于选自由以下组成的组的位置处:
[0120]
(a)ch1结构域中的以下一个或多个位置:h168、f170、l145、s183和t187(根据欧盟编号);和/或
[0121]
(b)选自cκ或cλ结构域中的以下一个或多个位置范围的位置:位置132到138、位置 173到179、位置130到136、位置111到117和位置134到140(根据卡巴特编号);和/或
[0122]
(c)选自vl中的以下一个或多个位置范围的位置:位置41到47、位置117到123和位置46到52(根据imgt编号);和/或
[0123]
(d)选自vh中的以下一个或多个位置范围的位置:位置41到47、位置46到52和位置117到123(根据imgt编号)。
[0124]
上面给出的每个范围中的一个突变将是相关的功能突变,因为其将是与对应结构域/链中的氨基酸接触的位置,因此是链之间的相关接口。
[0125]
因此本领域技术人员将理解,上述给出的位置范围中的突变是合适的,因为相关的功能特征是该位置是否接触另一条链上的对应位置,即vh链中与vl链中的对应位置接触的位置是相关位置,或者cλ中与ch1链中的位置接触的位置是相关位置。
[0126]
在一个实施例中,突变选自由以下组成的组:
[0127]
vhx44r/e/d/k、x49c、x120kvlx44r/e/d/k、x49d x120cch1h168a/g、f170g/a、l145q、s183v、t187e/d,cκ/cλs/t114a、v133t、l135y/w、n/s137k/r/h、s176w/v/y
[0128]
*vh/vl结构域根据imgt系统进行编号,并且恒定结构域根据欧盟编号系统进行编号
[0129]
*x是指任何氨基酸
[0130]
在一个实施例中,突变选自由以下组成的组:
[0131]
vhx44r/e/d/k、x49c、x120kvlx44r/e/d/k、x49d x120cch1h168a/g、f170g/a、l145q、s183v、t187e/d,cκ/cλs/t114a、v133t、l135y/w、n/s137k/r/h、s176w/v/y
[0132]
*vh/vl结构域根据imgt系统进行编号,并且恒定结构域根据卡巴特编号系统进行编号
[0133]
*x是指任何氨基酸
[0134]
在本发明的一个实施例中,突变位于选自由以下组成的组的位置处:
[0135]
(a)ch1结构域中的以下一个或多个位置:h168、f170、l145、s183和t187(根据欧盟编号);和/或
[0136]
(b)cκ或cλ结构域中的以下一个或多个位置:l135、s176、v133、s114和n137(根据欧盟编号);和/或
[0137]
(c)vl中的以下一个或多个位置:q44、q120和a49(根据imgt编号);和/或
[0138]
(d)vh中的以下一个或多个位置:q44、g49和q120(根据imgt编号)。
[0139]
在本发明的一个实施例中,突变位于选自由以下组成的组的位置处:
[0140]
(a)ch1结构域中的以下一个或多个位置:h168、f170、l145、s183和t187(根据欧盟编号);和/或
[0141]
(b)cκ或cλ结构域中的以下一个或多个位置:l135、s176、v133、s114和n137(根据卡巴特编号);和/或
[0142]
(c)vl中的以下一个或多个位置:q44、q120和a49(根据imgt编号);和/或
[0143]
(d)vh中的以下一个或多个位置:q44、g49和q120(根据imgt编号)。
[0144]
例如,突变可以选自由以下组成的组:
[0145]
(a)ch1结构域中的以下一个或多个突变:h168a、f170g、l145q、s183v和t187e (根据欧盟编号);和/或
[0146]
(b)cκ或cλ结构域中的以下一个或多个突变:l135y、s176w、v133t、s176v、s114a 和n137k(根据欧盟编号);和/或
[0147]
(c)vl中的以下一个或多个突变:q44r、q44e、q120c、q44d和a49d(根据imgt 编号);和/或
[0148]
(d)vh中的以下一个或多个突变:q44e、q44r、g49c、q44k和q120k(根据imgt 编号)。
[0149]
例如,突变可以选自由以下组成的组:
[0150]
(a)ch1结构域中的以下一个或多个突变:h168a、f170g、l145q、s183v和t187e (根据欧盟编号);和/或
[0151]
(b)cκ或cλ结构域中的以下一个或多个突变:l135y、s176w、v133t、s176v、s114a 和n137k(根据卡巴特编号);和/或
[0152]
(c)vl中的以下一个或多个突变:q44r、q44e、q120c、q44d和a49d(根据imgt 编号);和/或
[0153]
(d)vh中的以下一个或多个突变:q44e、q44r、g49c、q44k和q120k(根据imgt 编
号)。
[0154]
在一个实施例中,一个或多个fab片段通过接头连接到免疫球蛋白的c端末端。
[0155]
在本发明第一方面的一个实施例中,所述双特异性多肽是四价的,其能够与两种抗原中的每一种抗原进行二价结合。
[0156]
在一个实施例中,所述双特异性多肽包括排列为抗体的免疫球蛋白,所述抗体具有两个臂并因此具有针对第一抗原的两个结合位点,以及两个fab片段,每个都fab片段提供针对第二抗原的结合位点。因此,所述第一抗原有两个结合位点,并且所述第二抗原有两个结合位点。
[0157]
在一个实施例中,结合结构域b1是免疫球蛋白并且结合结构域b2是fab。
[0158]
因此,在一个实施例中,所述第一抗原(被免疫球蛋白靶向)可以是cd40并且第二抗原(被fab靶向)可以是epcam。
[0159]
在一个实施例中,所述双特异性多肽可以调节靶标免疫系统细胞的活性,其中所述调节是增加或降低所述细胞的活性。此类细胞包含t细胞、树突状细胞和自然杀伤细胞。
[0160]
免疫系统细胞(例如,靶标免疫细胞)通常是树突状细胞。例如,所述双特异性多肽可能能够诱导树突状细胞的活化,然后所述树突状细胞能够内化含有肿瘤细胞相关抗原和肿瘤新抗原的肿瘤相关碎片或细胞外囊泡。
[0161]
例如,所述多肽可能能够诱导:
[0162]
(a)肿瘤特异性免疫活化;和/或
[0163]
(b)树突状细胞的活化;和/或
[0164]
(c)含有肿瘤细胞相关抗原以及肿瘤新抗原的相关肿瘤碎片和/或细胞外囊泡的内化;和 /或
[0165]
(d)mhc上源自内化肿瘤抗原的肽的交叉呈递;和/或
[0166]
(e)效应t细胞的引发和活化;和/或
[0167]
(f)直接杀肿瘤作用,其选自由以下组成的列表:细胞凋亡、抗体依赖性细胞毒性(adcc) 和补体依赖性细胞毒性(cdc)。
[0168]
本领域技术人员将理解,所述树突状细胞的活化可以是增加共刺激分子cd40、cd80或 cd86的表达,或增加il
‑
12产生。可替代地,树突状细胞的活化可以通过在mhc i类或ii 类到t细胞上交叉呈递抗原(例如肿瘤新抗原)的能力增加来确定,从而通过抗原呈递细胞产生识别所述抗原的t细胞的增强活化。
[0169]
在一个实施例中,所述双特异性抗体诱导抗原呈递细胞(如树突状细胞)对肿瘤碎片或肿瘤细胞外囊泡的摄取增加。本领域技术人员将理解,所述摄取增加可以通过抗原呈递细胞对肿瘤碎片或肿瘤细胞外囊泡的共定位或内化来测量。
[0170]
抗原呈递细胞对肿瘤碎片或肿瘤细胞外囊泡的摄取增加,随后将导致更广泛的t细胞库,从而更有效地根除t细胞介导的肿瘤。用于确定肿瘤抗原特异性t细胞扩增的方法是众所周知的,并且包含例如使用mhc
‑
肽多聚体,例如四聚体或五聚体。可以通过给小鼠接种表达特定肿瘤抗原的肿瘤或用肿瘤模型抗原(例如卵清蛋白)转染的肿瘤来测量这种扩增,可替代地通过给小鼠接种已被热休克以诱导坏死的相同细胞,然后通过基于流式细胞术的方法使用各种mhc
‑
肿瘤(模型)抗原肽四聚体或五聚体测量肿瘤抗原特异性t细胞的扩增。
[0171]
本发明的多肽或结合结构域也可以通过它们的结合能力来表征和定义。评估配体对靶标的结合能力的标准测定法是本领域众所周知的,包含例如elisa、蛋白质印迹、ria和流式细胞术分析。多肽的结合动力学(例如,结合亲和力)也可以通过本领域已知的标准测定法来评估,如通过表面等离子共振分析或生物层干涉测量法。
[0172]
术语“结合活性”和“结合亲和力”旨在指多肽分子结合或不结合靶标的趋势。结合亲和力可以通过确定多肽及其靶标的解离常数(kd)来量化。较低的kd表明对目标的亲和力较高。类似地,多肽与其靶标结合的特异性可以根据多肽对其靶标的解离常数(kd)与多肽和另一个非靶标分子的解离常数相比较来定义。
[0173]
该解离常数的值可以通过众所周知的方法直接确定,并且甚至对于复杂的混合物也可以通过例如在caceci等人,1984(其公开内容通过引用并入本文)中阐述的方法进行计算。例如,kd可以使用双滤器硝化纤维素滤器结合测定法建立,如由wong和lohman,1993公开的测定法。评估配体(如抗体)对靶标的结合能力的其它标准测定法是本领域已知的,包含例如,elisa、蛋白质印迹、ria和流式细胞术分析。多肽的结合动力学(例如,结合亲和力)也可以通过本领域已知的标准测定法来评估,如通过表面等离子体共振(通过使用例如 biacore
tm
系统分析)或通过生物层干涉测量法(通过使用例如系统分析)。
[0174]
可以进行竞争性结合测定,其中将多肽与靶标的结合与该靶标的另一种已知配体(如另一种多肽)对靶标的结合进行比较。发生50%抑制时的浓度被称为ki。在理想条件下,ki 等于kd。ki值永远不会小于kd,因此可以方便地取代ki的测量以提供kd的上限。
[0175]
结合亲和力的替代测量包含ec50或ic50。在此上下文中,ec50表示多肽达到其与固定数量的靶标的最大结合的50%时的浓度。ic50表示多肽抑制固定数量的竞争剂与固定数量的靶标的最大结合的50%时的浓度。在这两种情况下,较低水平的ec50或ic50表明对目标的亲和力较高。配体对其靶标的ec50和ic50值都可以通过众所周知的方法确定,例如elisa。评估多肽的ec50和ic50的合适的测定法在实例中列出。
[0176]
本发明的多肽优选地能够以比其结合另一非靶标分子的亲和力高至少两倍、10倍、50倍、100倍或更高的亲和力与其靶标结合。
[0177]
cd40结合结构域
[0178]
本发明的双特异性多肽包括能够特异性结合cd40的结合结构域(b1)。
[0179]
结合结构域b1与cd40特异性结合,即其与cd40结合但不与其它分子结合或以较低的亲和力结合其它分子。如本文所使用的,术语cd40通常是指人cd40。人cd40的序列在 genbank:x60592.1中列出。结合结构域b1可能对来自其它哺乳动物的cd40,如来自非人灵长类动物(例如食蟹猴(macaca fascicularis)、猕猴(macaca mulatta))的cd40,具有一定的结合亲和力。结合结构域b1优选地不结合鼠cd40和/或不结合其它人tnfr超家族成员,例如人cd137或ox40。
[0180]
有利地,结合结构域b1以小于100x10
‑9m或小于50x10
‑9m或小于25x10
‑9m,优选地小于10、9、8、7或6x10
‑9m,更优选地小于5、4、3、2或1x10
‑9m,最优选地小于9x10
‑
10
m 的k
d
结合人cd40。
[0181]
例如,结合结构域b1优选地不结合鼠cd40或任何其它tnfr超家族成员,如cd137 或ox40。因此,典型地,结合结构域相对于人cd40的kd将比相对于其它非靶标分子(如鼠cd40、其它tnfr超家族成员或环境中的任何其它无关材料或伴随材料)的kd小2倍,优选地5
倍,更优选地10倍。更优选地,kd将小50倍,甚至更优选地小100倍,并且还更优选地小200倍。
[0182]
结合结构域b1优选地能够以比其结合另一非靶标分子的亲和力高至少两倍、10倍、50 倍、100倍或更高的亲和力与其靶标结合。
[0183]
因此,总而言之,结合结构域b1优选地表现出以下功能特性中的至少一项:
[0184]
a)以小于100x10
‑9m,更优选地小于10x10
‑9m的k
d
值结合人cd40;
[0185]
b)不结合鼠cd40;
[0186]
c)不结合其它人tnfr超家族成员,例如人cd137或ox40。
[0187]
在一个实施例中,结合结构域b1包括一个或多个选自表c(2)中的轻链cdr序列,和 /或一个或多个选自表c(1)中的重链cdr序列。因此,结合结构域b1可以包括选自由以下组成的组的一个或多个cdr序列:
[0188]
(a)cd40重链cdr,seq id no:73到89;和/或
[0189]
(b)cd40轻链cdr,seq id no:90到104。
[0190]
在一个实施例中,结合结构域b1包括来自表c(2)中单个抗体参考的特定行的一个、两个或三个轻链cdr序列,和/或来自表c(1)中具有相同参考的抗体的对应行的一个、两个或三个重链cdr序列。例如,结合结构域b1可能包括1132的轻链cdr序列中的一个或多个(seq id no:90、91和92)和1132的重链cdr序列中的一个或多个(seq id no:73、 74和75)。
[0191]
优选的cd40结合结构域可以至少包括表c(1)的任何单独行中定义的重链cdr3和/ 或表c(2)的任何单独行中定义的轻链cdr3。
[0192]
因此,在一个实施例中,结合结构域b1包括给定抗体(vh/vl)参考的所有六个cdr 序列,例如结合结构域b1可能包括抗体1132的所有六个cdr序列。
[0193]
在一个实施例中,结合结构域b1包括如表a中给出的vh和/或vl氨基酸序列。在一个实施例中,结合结构域b1包括如表a中给出的用于特定抗体参考的vh和vl氨基酸序列。例如,结合结构域b1可以包括1132的vh序列(seq id no:3)和/或1132的vl序列 (seq id no:1)。
[0194]
在一个实施例中,b1的cd40结合结构域选自:1132;1150、1140、1107、adc
‑
1013、 apx005和21.4.1。
[0195]
因此,结合结构域b1的cdr或vh和vl序列可以选自来自由以下组成的组的抗体:
[0196]
(a)1132(重链cdr:seq id no:73、74和75;轻链cdr:seq id no:90、91和92; vl:seq id no:1;vh:seq id no:3)
[0197]
(b)1150(重链cdr:seq id no:73、76和77;轻链cdr:seq id no:90、91和93; vl:seq id no:5;vh:seq id no:7)
[0198]
(c)1140(重链cdr:seq id no:73、78和79;轻链cdr:seq id no:90、91和94; vl:seq id no:9;vh:seq id no:11)
[0199]
(d)1107(重链cdr:seq id no:73、78和80;轻链cdr:seq id no:90、91和95; vl:seq id no:13;vh:seq id no:15)
[0200]
(e)adc
‑
1013(重链cdr:seq id no:81、82和83;轻链cdr:seq id no:96、97 和98;vl:seq id no:17;vh:seq id no:19)
[0201]
(f)apx005(重链cdr:seq id no:84、85和86;轻链cdr:seq id no:99、100 和101;
vl:seq id no:21;vh:seq id no:23)
[0202]
(g)21.4.1(重链cdr:seq id no:87、88和89;轻链cdr:seq id no:102、103 和104;vl:seq id no:25,vh:seq id no:27)
[0203]
抗体的编号(例如抗体x/y)分别定义了重链可变区(x)和轻链可变区(y)(或者,在指示单个数字的情况下,仅定义重链可变区[x])。如上所述,所述序列可以是一个或多个cdr序列,或vh和/或vl序列。如上所述,所述双特异性多肽的序列可以包括特定的突变。
[0204]
在一个实施例中,结合结构域b1对cd40(通常为人cd40)具有特异性,并且可以包括独立地选自以下各项的任何一个、两个、三个、四个、五个或所有六个特征:
[0205]
(a)由序列“g、f、t、f、s、s、y、a”组成的重链cdr1序列;
[0206]
(b)长度为8个氨基酸并且包括以下共有序列的重链cdr2序列:“i、g/s、s/g、y/s、g/s、g/s、g/y/s、t”;
[0207]
(c)长度为9到12个氨基酸并且包括以下共有序列的重链cdr3序列:“a、r、y/r/g、 y/p/v/
‑
、n/s/v、f/y/w、g/h/s、
‑
/s、
‑
/v、m/f、d、y”[0208]
(d)由以下序列组成的轻链cdr1序列:“q、s、i、s、s、y”;
[0209]
(e)由以下序列组成的轻链cdr2序列:“a、a、s”;
[0210]
(f)长度为9个氨基酸并且包括以下共有序列的轻链cdr3序列:“q,q、y/s、g/y、r/s/v、 n/a/y/t、p、p/f/y、t”。
[0211]
结合结构域b1可以至少包括(c)中定义的重链cdr3和/或(f)中定义的轻链cdr3。结合结构域b1可以包括(a)、(b)和(c)的所有三个重链cdr序列和/或(d)、(e)和(f) 的所有三个轻链cdr序列。
[0212]
表a中示出了结合结构域b1的完整重链和轻链可变区氨基酸序列的实例。还示出了编码每个氨基酸序列的示例性核酸序列。表a中所述vh和vl区的编号对应于表c(1)和c (2)中使用的编号系统。因此,例如,“1132,轻链vl(也被称为1133)”的氨基酸序列是包括表c(2)所示vl编号1132(1133)的所有三个cdr的完整vl区序列的实例,并且“1132,重链vh”的氨基酸序列是包括表c(1)所示vh编号1132的所有三个cdr的完整 vh区序列的实例。
[0213]
在示例性实施例中,结合结构域b1包括:
[0214]
(a)抗体1132/1133的重链的三个cdr和/或轻链的三个cdr(seq id no:73、74和 75;和/或seq id no:90、91和92);
[0215]
(b)抗体1150/1151的重链的三个cdr和/或轻链的三个cdr(seq id no:73、76和 77;和/或seq id no:90、91和93);
[0216]
(c)抗体1140/1135的重链的三个cdr和/或轻链的三个cdr(seq id no:73、78和 79;和/或seq id no:90、91和94);
[0217]
(d)抗体1107/1108的重链的三个cdr和/或轻链的三个cdr(seq id no:73、78和 80;和/或seq id no:90、91和95);
[0218]
(e)抗体adc
‑
1013的重链的三个cdr和/或轻链的三个cdr(seq id no:81、82和 83;和/或seq id no:96、97和98);
[0219]
(f)抗体apx005的重链的三个cdr和/或轻链的三个cdr(seq id no:84、85和86;和/或seq id no:99、100和101);或
[0220]
(g)抗体21.4.1的重链的三个cdr和/或轻链的三个cdr(seq id no:87、88和89;
和/或seq id no:102、103和104)。
[0221]
因此,结合结构域b1可以包括:
[0222]
(a)抗体1132/1133的重链可变区和/或轻链可变区(seq id no:3和/或seq id no:1);
[0223]
(b)抗体1150/1151的重链可变区和/或轻链可变区(seq id no:7和/或seq id no:5);
[0224]
(c)抗体1140/1135的重链可变区和/或轻链可变区(seq id no:11和/或seq id no:9);
[0225]
(d)抗体1107/1108的重链可变区和/或轻链可变区(seq id no:15和/或seq id no:13);
[0226]
(e)抗体adc
‑
1013的重链可变区和/或轻链可变区(seq id no:19和/或seq id no: 17);
[0227]
(f)抗体apx005的重链可变区和/或轻链可变区(seq id no:23和/或seq id no:21);或
[0228]
(g)抗体21.4.1的重链可变区和/或轻链可变区(seq id no:27和/或seq id no:25)。
[0229]
在示例性实施例中,结合结构域b1包括:
[0230]
抗体1132/1133的重链的三个cdr和/或轻链的三个cdr(seq id no:73、74和75和/ 或seq id no:90、91和92)或示例性重链和轻链可变区(seq id no:3和seq id no:1) 或包括所述cdr的抗体重链和轻链,如上文详述。
[0231]
抗体的编号(例如抗体x/y)分别定义了重链可变区(x)和轻链可变区(y)(或者,在指示单个数字的情况下,仅定义重链可变区[x])。
[0232]
本领域技术人员将理解,本发明的双特异性多肽可以可替代地包括以上定义的可变区的变体(或以上cdr序列的变体)。
[0233]
本文所述的任何重链或轻链氨基酸序列或cdr序列的变体可以是所述序列的取代、缺失或添加变体。变体可以包括来自所述序列的1个、2个、3个、4个、5个、最多10个、最多 20个、最多30个或更多个氨基酸取代和/或缺失。“缺失”变体可以包括单个氨基酸的缺失、小组氨基酸(如2个、3个、4个或5个氨基酸)的缺失或较大氨基酸区域的缺失,如特定氨基酸结构域或其它特征的缺失。“取代”变体优选地涉及用相同数目的氨基酸替换一个或多个氨基酸并进行保守氨基酸取代。例如,氨基酸可以被具有相似性质的替代氨基酸取代,例如,另一个碱性氨基酸、另一个酸性氨基酸、另一个中性氨基酸、另一个带电氨基酸、另一个亲水性氨基酸、另一个疏水性氨基酸、另一个极性氨基酸、另一个芳香族氨基酸或另一种脂肪族氨基酸。可用于选择合适取代基的20种主要氨基酸的一些性质如下:
[0234][0235]
本文中的氨基酸可以指全名、三字母代码或单字母代码。
[0236]
优选的“衍生物”或“变体”包含这样的衍生物或变体,其中出现在序列中的氨基酸是其结构类似物而不是天然存在的氨基酸。序列中使用的氨基酸也可以被衍生或修饰,例如标记,前提是多肽的功能没有受到显著的不利影响。
[0237]
如上所述的衍生物和变体可以在多肽合成期间或通过生产后修饰制备,或者当多肽为重组形式时,使用已知的定点诱变、随机诱变或酶切和/或核酸连接来制备。
[0238]
优选地,变体的氨基酸序列与本文公开的序列中所示的序列具有超过60%或超过70%(例如75或80%),优选地超过85%,例如超过90%或95%的氨基酸同一性。这种氨基酸同一性水平可以在相关seq id no序列的全长或序列的一部分上看到,如在20个、30个、50个、 75个、100个、150个、200个或更多个氨基酸上看到,这取决于全长多肽的大小。
[0239]
就氨基酸序列而言,“序列同一性”是指当使用clustalw(thompson等人,1994;其公开内容通过引用并入本文)用以下参数评估时具有所述值的序列:
[0240]
配对比对参数
‑
方法:准确,矩阵:pam,空位开放罚分:10.00,空位延伸罚分:0.10;
[0241]
多个比对参数
‑
矩阵:pam,空位开放罚分:10.00,延迟的同一性百分比:30,惩罚末端空位:开,空位分离距离:0,负矩阵:无,空位延伸罚分:0.20,残基特异性空位罚分:开,亲水性空位罚分:开,亲水性残基:gpsndqekr。特定残基处的序列同一性旨在包含简单衍生的相同残基。
[0242]
因此,在一个实施例中,结合结构域b1可以包括上文定义的轻链可变区和/或与其具有至少90%序列同一性的所述重链可变区的一个或多个变体。结合结构域b1还可以包括本文指定的cdr序列的变体,例如与指定的参考序列相比,最多一个、两个、三个、四个或五个氨基酸残基被取代、缺失或添加的变体。
[0243]
在一个实施例中,结合结构域b1包括抗体1132/1133的轻链(seq id no:182)和/或抗体1132/1133的重链(seq id no:181)。
[0244]
肿瘤细胞靶向结构域
[0245]
本发明的双特异性多肽进一步包括能够特异性结合肿瘤细胞相关抗原的结合结构域 (b2)。
[0246]“肿瘤细胞相关抗原”(也称为“肿瘤抗原”或“taa”)包含这样的蛋白质,其在肿瘤细胞的细胞外表面可接近,使得在施用到体内后,所述蛋白质可被本发明的双特异性多肽接近。在一个实施例中,肿瘤细胞相关抗原是肿瘤特异性的,即其只存在于肿瘤细胞上,而不存在于正常的健康细胞上。然而,本领域技术人员将理解,肿瘤细胞相关抗原可以优先在
肿瘤细胞上表达,即其在肿瘤细胞上的表达水平高于在正常、健康细胞上的表达水平(因此,抗原在肿瘤细胞上的表达可以是正常、健康细胞上的至少五倍,例如肿瘤细胞上的表达水平为至少十倍、二十倍、五十倍或更高)。
[0247]
在一个实施例中,结合结构域b2结合选自由以下组成的组的肿瘤细胞相关抗原:
[0248]
(a)突变的致癌基因和抑癌基因的产物;
[0249]
(b)过表达或异常表达的细胞蛋白;
[0250]
(c)致癌病毒产生的肿瘤抗原;
[0251]
(d)癌胚抗原;
[0252]
(e)改变的细胞表面糖脂和糖蛋白;
[0253]
(f)细胞类型特异性分化抗原;
[0254]
(g)缺氧诱导的抗原;
[0255]
(h)mhc i类呈递的肿瘤肽;
[0256]
(i)上皮肿瘤抗原;
[0257]
(j)血液肿瘤相关抗原;
[0258]
(k)癌睾丸抗原;以及
[0259]
(l)黑色素瘤抗原。
[0260]
因此,所述肿瘤细胞相关抗原可以选自由以下组成的组:5t4、cd20、cd19、muc
‑
1、癌胚抗原(cea)、ca
‑
125、co17
‑
1a、epcam、her2、her3、epha2、epha3、dr4、 dr5、fap、ogd2、vegfr、egfr、ny
‑
eso
‑
1、存活蛋白、trop2和wt
‑
1。
[0261]
在一个实施例中,所述肿瘤细胞相关抗原选自由以下组成的组:5t4、cd20、epcam、 egfr和her2。
[0262]
在一个实施例中,所述肿瘤细胞相关抗原是epcam。
[0263]
在替代实施例中,所述肿瘤细胞相关抗原不是rsv、ror1、psma或间皮素。
[0264]
在一个实施例中,所述肿瘤细胞相关抗原是癌胚抗原。例如,所述肿瘤细胞相关抗原可以是5t4。
[0265]
在一个实施例中,所述肿瘤细胞是实体瘤细胞。
[0266]
例如,所述实体瘤可以选自由以下组成的组:肾细胞癌、结直肠癌、肺癌、前列腺癌、乳腺癌、黑色素瘤、膀胱癌、脑/cns癌、宫颈癌、食道癌、胃癌、头/颈癌、肾癌、肝癌、淋巴瘤、卵巢癌、胰腺癌和肉瘤。
[0267]
有利地,结合结构域b2以小于100x10
‑9m,例如小于10x10
‑9m或小于5x10
‑9m的k
d
结合肿瘤细胞相关抗原。
[0268]
结合结构域b2的示例性cdr序列在表d(1)和d(2),seq id no:90、91和105到 160中列举。
[0269]
在一个实施例中,结合结构域b2包括一个或多个选自表d(2)中的轻链cdr序列,和/或一个或多个选自表d(1)中的重链cdr序列。
[0270]
优选的taa结合结构域可以至少包括表d(1)的任何单独行中定义的重链cdr3和/或表d(2)的任何单独行中定义的轻链cdr3。结合结构域b2可以包括表d(1)的任何单独行中示出的所有三个重链cdr序列(即,给定“抗体参考”的所有三个重链cdr)和/或表 d(2)的单独行中示出的所有三个轻链cdr序列(即,给定“抗体参考”的所有三个轻链 cdr)。
[0271]
因此,在一个实施例中,结合结构域b2包括来自表d(2)中单个抗体参考的特定行的一个、两个或三个轻链cdr序列,和/或来自表d(1)中具有相同参考的抗体的对应行的一个、两个或三个重链cdr序列。例如,结合结构域b2可能包括索利托单抗(solitomab)的轻链cdr序列中的一个或多个(seq id no:136、137和138)和索利托单抗的重链cdr序列中的一个或多个(seq id no:105、106和107)。
[0272]
因此,在一个实施例中,结合结构域b2包括给定抗体(vh/vl)参考的所有六个cdr 序列,例如结合结构域b2可能包括
‘
索利托单抗’抗体的所有六个cdr序列。
[0273]
表b中示出了完整重链和轻链可变区氨基酸序列的实例。还示出了编码每个氨基酸序列的示例性核酸序列。表b中所述vh和vl区的编号对应于表d(1)和d(2)中使用的编号系统。因此,例如,“索利托单抗,轻链vl”的氨基酸序列是包括表d(2)所示抗体参考索利托单抗的所有三个cdr的完整vl区序列的实例,并且“索利托单抗,重链vh”的氨基酸序列是包括表d(1)所示抗体参考索利托单抗的所有三个cdr的完整vh区序列的实例。
[0274]
在一个实施例中,结合结构域b2包括如表b中给出的vh和/或vl氨基酸序列。在一个实施例中,结合结构域b2包括如表b中给出的用于特定抗体参考的vh和vl氨基酸序列。例如,结合结构域b2可以包括索利托单抗的vh序列(seq id no:31)和/或索利托单抗的 vl序列(seq id no:29)。
[0275]
在一个实施例中,结合结构域b2结合epcam。在一个实施例中,结合结构域b2对 epcam具有特异性并且包括选自由以下组成的组的一个或多个cdr序列:
[0276]
(a)epcam重链cdr,seq id no:105到120;和/或
[0277]
(b)epcam轻链cdr,seq id no:90、91和136到147。
[0278]
在一个实施例中,b2的epcam结合结构域选自:索利托单抗、005025、005038、阿德木单抗(adecatumumab)、4d5mocb和3
‑
17i。
[0279]
因此,结合结构域b2的cdr或vh和vl序列可以选自来自由以下组成的组的抗体:
[0280]
(a)索利托单抗(重链cdr:seq id no:105、106和107;轻链cdr:seq id no:136、 137和138;vl:seq id no:29;vh:seq id no:31)
[0281]
(b)005025(重链cdr:seq id no:108、109和110;轻链cdr:seq id no:90、91 和139;vl:seq id no:35;vh:seq id no:36)
[0282]
(c)005038(重链cdr:seq id no:108、109和111;轻链cdr:seq id no:90、91 和140;vl:seq id no:39;vh:seq id no:40)
[0283]
(d)阿德木单抗(重链cdr:seq id no:112、113和114;轻链cdr:seq id no:90、 137和141;vl:seq id no:41;vh:seq id no:43)
[0284]
(e)4d5mocb(重链cdr:seq id no:115、116和117;轻链cdr:seq id no:142、 143和144;vl:seq id no:45;vh:seq id no:47)
[0285]
(f)3
‑
17i(重链cdr:seq id no:118、119和120;轻链cdr:seq id no:145、146 和147;vl:seq id no:49;vh:seq id no:51)
[0286]
如上所述,所述序列可以是一个或多个cdr序列,或vh和/或vl序列。在示例性实施例中,结合结构域b2包括选自以下的抗体的轻链的三个cdr和/或重链的三个cdr:索利托单抗、005025、005038、阿德木单抗(adecatumumab)、4d5mocb和3
‑
17i。
[0287]
在替代实施例中,结合结构域b2不结合epcam。
[0288]
在一个实施例中,结合结构域b2结合her2。在一个实施例中,结合结构域b2对her2 具有特异性并且包括选自由以下组成的组的一个或多个cdr序列:
[0289]
(a)her2重链cdr,seq id no:121到126;和/或
[0290]
(b)her2轻链cdr,seq id no:148到152。
[0291]
在一个实施例中,b2的her2结合结构域选自:曲妥珠单抗(trastuzumab)和帕妥株单抗(pertuzumab)。
[0292]
因此,结合结构域b2的cdr或vh和vl序列可以选自来自由以下组成的组的抗体:
[0293]
(a)曲妥珠单抗(重链cdr:seq id no:121、122和123;轻链cdr:seq id no:148、 149和150;vl:seq id no:53;vh:seq id no:55)
[0294]
(b)帕妥珠单抗(重链cdr:seq id no:124、125和126;轻链cdr:seq id no:151、 149和152;vl:seq id no:57;vh:seq id no:59)
[0295]
如上所述,所述序列可以是一个或多个cdr序列,或vh和/或vl序列。
[0296]
在一个实施例中,结合结构域b2结合5t4,例如结合结构域b2可以是2992的5t4结合结构域。因此,结合结构域b2可以包括2992的任何序列,如下:重链cdr:seq id no: 127、128和129;轻链cdr:seq id no:153、91和154;vl:seq id no:61;vh:seqid no:63)。
[0297]
在一个实施例中,结合结构域b2结合cd20,例如结合结构域b2可以是利妥昔单抗 (rituximab)的cd20结合结构域。因此,结合结构域b2可以包括利妥昔单抗的任何序列,如下:重链cdr:seq id no:130、131和132;轻链cdr:seq id no:155、156和157; vl:seq id no:65;vh:seq id no:67)。
[0298]
在一个实施例中,结合结构域b2结合egfr,例如结合结构域b2可以是西妥昔单抗 (cetuximab)的egfr结合结构域。因此,结合结构域b2可以包括西妥昔单抗的任何序列,如下:重链cdr:seq id no:133、134和135;轻链cdr:seq id no:158、159和160; vl:seq id no:69;vh:seq id no:71)。
[0299]
如上所述,所述序列可以是一个或多个cdr序列,或vh和/或vl序列。
[0300]
在替代实施例中,b2可以包括选自针对肿瘤相关抗原的已知抗体的cdr。例如,b2可以包括针对epcam的抗体的cdr,如依决洛单抗(edrecolomab)(如us 7,557,190中所公开,其公开内容通过引用并入本文)。可替代地,b2可以包括针对egfr的抗体的cdr,如帕尼单抗(panitumumab)(如us 6,235,883中所公开,其公开内容通过引用并入本文)。在另外的实施例中,b2可以包括针对cd20的抗体的cdr,如奥法木单抗(ofatumumab)(药物库,登记号:db 06650,其公开内容通过引用并入本文)。在另外的实施例中,b2可以包括针对her2的市售抗体的cdr。
[0301]
可替代地,b2可以包括重链可变区和/或轻链可变区,其选自针对肿瘤相关抗原的已知抗体,例如针对cd20、epcam、egfr和her2的抗体,如上所述。
[0302]
技术人员将理解,结合结构域b2可以可替代地包括所述轻链可变区和/或所述重链可变区的变体,例如与其具有至少90%的序列同一性的变体。结合结构域b2还可以包括本文指定的cdr序列的变体,例如与指定的参考序列相比,最多一个、两个、三个、四个或五个氨基酸残基被取代、缺失或添加的变体。变体如上文关于结合结构域b1所述。
[0303]
可替代地,b2可以包括重链和/或轻链,其选自针对肿瘤相关抗原的已知抗体,例如针对cd20、epcam、egfr和her2的抗体,如上所述。
[0304]
作为参考,本技术中使用的抗体参考、相同抗体/结合结构域的可能替代名称以及抗体/ 结合结构域的靶标在下表1中列出。
[0305]
表1:特定抗体/结合结构域的替代名称,以及每个抗体/结合结构域的相靶标。
[0306][0307]
示例性cd40
‑
肿瘤细胞相关抗原双特异性抗体
[0308]
在本发明的双特异性多肽的一个实施例中,结合结构域b1是igg并且结合结构域b2是 scfv。相反,结合结构域b1可以是scfv并且结合结构域b2可以是igg。
[0309]
在一个实施例中,结合结构域b1是免疫球蛋白并且结合结构域b2是fab。相反,结合结构域b1可以是fab并且结合结构域b2可以是免疫球蛋白。所述双特异性多肽可以任选地呈ruby
tm
格式。所述双特异性多肽格式如上所述并如图2所示,并且所述双特异性多肽可以包括如上所述的某些突变。
[0310]
本发明的双特异性多肽可以包括上述任何b1结构域的轻链的cdr(如下表c(2)所示) 和/或上述任何b1结构域的重链的cdr(如下表c(1)所示),与上述任何b2结构域的轻链的cdr(如下表d(2)所示)和/或上述任何b2结构域的重链的cdr(如下表d(1)所示)的组合。
[0311]
因此,在某些实施例中,b1和b2包括各自的可变区,所述可变区包括上述确定的cdr。例如,b1可以包括抗体1132/1133的重链可变区和/或轻链可变区(seq id no:3和/或seq idno:1)并且b2可以包括抗体索利托单抗的重链可变区和/或轻链可变区(seq id no:31和/ 或seq id no:29)。
[0312]
例如,在本发明的一个实施例中,b2包括抗体索利托单抗的轻链的3个cdr和/或抗体索利托单抗的重链的3个cdr(seq id no:136、137和138和/或seq id no:105、106和 107)或对应的重链可变区和/或轻链可变区(seq id no:31和seq id no:29),并且b1包括选自表c(1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0313]
在本发明的另外的实施例中,b2包括抗体005025的轻链的3个cdr和/或抗体
005025 的重链的3个cdr(seq id no:90、91和139;和/或seq id no:108、109和110)或对应的重链可变区和/或轻链可变区(seq id no:36和seq id no:35);并且b1包括选自表c (1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0314]
在本发明的另外的实施例中,b2包括抗体005038的轻链的3个cdr和/或抗体005038 的重链的3个cdr(seq id no:90、91和140和/或seq id no:108、109和111)或对应的重链可变区和/或轻链可变区(seq id no:40和seq id no:39);并且b1包括选自表c (1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0315]
在本发明的另外的实施例中,b2包括抗体2992/2993的轻链的3个cdr和/或抗体2992/2993的重链的3个cdr(seq id no:153、91和154和/或seq id no:127、128和129) 或对应的重链可变区和/或轻链可变区(seq id no:63和seq id no:61),并且b1包括选自表c(1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0316]
在本发明的另外的实施例中,b2包括如上所述的针对cd20的市售抗体的轻链的3个 cdr,和/或相同抗体的重链的3个cdr,或对应的重链可变区和/或轻链可变区;并且b1 包括选自表c(1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0317]
在本发明的另外的实施例中,b2包括如上所述的针对epcam的市售抗体的轻链的3个 cdr,和/或相同抗体的重链的3个cdr,或对应的重链可变区和/或轻链可变区;并且b1 包括选自表c(1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0318]
在本发明的另外的实施例中,b2包括如上所述的针对egfr的市售抗体的轻链的3个cdr,和/或相同抗体的重链的3个cdr,或对应的重链可变区和/或轻链可变区;并且b1 包括选自表c(1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0319]
在本发明的另外的实施例中,b2包括如上所述的针对her2的市售抗体的轻链的3个 cdr,和/或相同抗体的重链的3个cdr,或对应的重链可变区和/或轻链可变区;并且b1 包括选自表c(1)的抗体的重链cdr序列和/或选自表c(2)的抗体的轻链cdr序列或对应的重链可变区和/或轻链可变区,如表a所示。
[0320]
在一个实施例中,本发明的双特异性多肽结合cd40和epcam。例如,在本发明的双特异性多肽的一个实施例中:b1包括抗体1132的重链的三个cdr和/或轻链的三个cdr(seqid no:73、74和75和/或seq id no:90、91和92)并且b2包括抗体索利托单抗的重链的三个cdr和/或轻链的三个cdr(seq id no:105、106和107和/或seq id no:136、137 和138)。
[0321]
这种cd40
‑
epcam双特异性多肽可以任选地呈ruby
tm
格式。因此,所述cd40结合结构域b1是免疫球蛋白,并且所述epcam结合结构域b2是fab片段。所述双特异性多肽格式如上所述并如图2所示,并且所述双特异性多肽可以包括如上所述的某些突变。
[0322]
在一个实施例中,所述双特异性多肽不结合cd40和epcam。
[0323]
在一个实施例中,本发明的双特异性多肽结合cd40和5t4。因此,在本发明的双特
异性多肽的一个实施例中,b1包括抗体1132的重链的三个cdr和/或轻链的三个cdr(seq idno:73、74和75和/或seq id no:90、91和92)并且b2包括抗体2992的重链的三个cdr 和/或轻链的三个cdr(seq id no:127、128和129和/或seq id no:153、91和154)。
[0324]
这种cd40
‑
5t4双特异性多肽可以任选地呈ruby
tm
格式。因此,所述cd40结合结构域b1是免疫球蛋白,并且所述5t4结合结构域b2是fab片段。所述双特异性多肽格式如上所述并如图2所示,并且所述双特异性多肽可以包括如上所述的某些突变。
[0325]
在一个实施例中,本发明的双特异性多肽结合cd40和her2。因此,在本发明的双特异性多肽的一个实施例中,b1包括抗体1132的重链的三个cdr和/或轻链的三个cdr(seq idno:73、74和75和/或seq id no:90、91和92)并且b2包括抗体曲妥珠单抗的重链的三个cdr和/或轻链的三个cdr(seq id no:121、122和123和/或seq id no:148、149和 150)。
[0326]
这种cd40
‑
her2双特异性多肽可以任选地呈ruby
tm
格式。因此,所述cd40结合结构域b1是免疫球蛋白,并且所述her2结合结构域b2是fab片段。所述双特异性多肽格式如上所述并如图2所示,并且所述双特异性多肽可以包括如上所述的某些突变。
[0327]
b1结构域可以包括上述任何b1结构域的轻链可变区和/或重链可变区,并且b2结构域可以包括上述任何b2结构域的轻链可变区和/或重链可变区,或所述轻链可变区和/或所述重链可变区的与其具有至少90%序列同一性的变体。
[0328]
通常,除了以上定义的可变区序列之外,本发明的双特异性多肽将包括恒定区序列。本发明的双特异性多肽可以呈任何合适的格式。例如,所述双特异性多肽可以呈ruby
tm
格式 (如上所述,并在图2中示出),或呈morrison格式。
[0329]
可以与本文公开的任何vh区序列组合(以形成完整重链)的示例性重链恒定区氨基酸序列是以下igg1重链恒定区序列:
[0330]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssgl yslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvf lfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyr vvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknq vsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvf scsvmhealhnhytqkslslspgk
[0331]
[seq id no:174]
[0332]
同样,可以与本文公开的任何vl区序列组合(以形成完整轻链)的示例性轻链恒定区氨基酸序列是此处复制的κ链恒定区序列:rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqds kdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0333]
[seq id no:175]
[0334]
其它轻链恒定区序列是本领域已知的并且也可以与本文公开的任何vl区组合。
[0335]
在一个实施例中,多肽可以包括以下恒定区氨基酸序列:
[0336]
(a)参考序列ch1(seq id no:179):
[0337][0338]
(其中粗体和下划线部分是铰链区的一部分,但存在于fab片段中)
[0339]
和/或
[0340]
(b)参考序列cκ(seq id no:180):
[0341]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqds kdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0342]
如上所述,这些参考序列可以包括一个或多个突变以防止聚集体和/或fab副产物的形成。可以相对于上述恒定区序列中的任一个给出此类突变位置(在说明书中较早地鉴定)。
[0343]
在一个实施例中,双特异性多肽呈ruby
tm
格式,包括免疫球蛋白和fab片段,其中所述fab片段通过所述fab片段的轻链融合至所述免疫球蛋白的重链的c端。
[0344]
因此,在一个实施例中,结合结构域b1是免疫球蛋白而结合结构域b2是fab片段,并且所述fab片段通过所述fab片段的轻链融合至所述免疫球蛋白的重链的c端。另外,所述双特异性多肽包括一个或多个选自由以下组成的组的突变:
[0345]
vhx44r/e/d/k、x49c、x120kvlx44r/e/d/k、x49d、x120cch1h168a/g、f170g/a、l145q、s183v、t187e/d,cκ/cλs/t114a、v133t、l135y/w、n/s137k/r/h、s176w/v/y
[0346]
*vh/vl结构域根据imgt系统进行编号,并且恒定结构域根据欧盟编号系统进行编号
[0347]
*x是指任何氨基酸
[0348]
vhx44r/e/d/k、x49c、x120kvlx44r/e/d/k、x49d、x120cch1h168a/g、f170g/a、l145q、s183v、t187e/d,cκ/cλs/t114a、v133t、l135y/w、n/s137k/r/h、s176w/v/y
[0349]
*vh/vl结构域根据imgt系统进行编号,并且恒定结构域根据卡巴特编号系统进行编号
[0350]
*x是指任何氨基酸
[0351]
在本发明的一个实施例中,b1结合cd40,并且b1包括:重链,所述重链包括seqidno:181的序列;和/或轻链,所述轻链包括seq id no:182的序列。这些序列是1132的完整链序列。
[0352]
在一个实施例中,b2结合epcam,并且包括:重链,所述重链包括seq id no:183的序列;和/或轻链,所述轻链包括seq id no:184的序列。这些序列是索利托单抗的完整链序列。
[0353]
因此,在一个实施例中,双特异性多肽是cd40
‑
epcam双特异性多肽,其中b1包括 ruby
tm
格式的1132的重链序列(seq id no:181)和ruby
tm
格式的1132的轻链序列(seqid no:182),并且b2包括ruby
tm
格式的索利托单抗的重链序列(seq id no:183)和 ruby
tm
格式的索利托单抗的轻链序列(seq id no:184)。因此,组合的seq id no:181 到184代表ruby
tm
格式的1132
‑
索利托单抗lala突变的bsab,其中b1是1132igg并且 b2是索利托单抗fab片段。
[0354]
示例性完整重链和轻链序列
[0355]
结合结构域b1:
[0356]
重链(seq id no:181):
[0357]
evqllesggglvqpggslrlscaasgftfssyamswvrrapgkglewvsgigsygggtyy adsvkgrftisrdnskntlylqmnslraedtavyycaryvnfgmdywgqgtlvtvssast kgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvatgpavlqssglysls svvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaaggpsvflfpp kpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv ltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvslt clvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsv mhealhnhytqkslslspgk
[0358]
轻链(seq id no:182):
[0359]
diqmtqspsslsasvgdrvtitcrasqsissylnwyqekpgkapklliyaasslqsgvpsrfs gsgsgtdftltisslqpedfatyycqqygrnpptfgqgtkleikrtvaapsvfifppsdeqlks gtasvvcylnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslwstltlskadye khkvyacevthqglsspvtksfnrgec
[0360]
结合结构域b2:
[0361]
重链(seq id no:183):
[0362]
evqlleqsgaelvrpgtsvkisckasgyaftnywlgwvkerpghglewigdifpgsgnihy nekfkgkatltadkssstaymqlssltfedsavyfcarlrnwdepmdywgqgttvtvssa stkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglys lssvvevpssslgtqtyicnvnhkpsntkvdkkvepksc
[0363]
轻链(seq id no:184):
[0364]
elvmtqspssltvtagekvtmsckssqsllnsgnqknyltwyqrkpgqppklliywastre sgvpdrftgsgsgtdftltissvqaedlavyycqndysypltfgagtkleikrtvaapavfif ppsdeqlksgtasvvcllknfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstl tlskadyekhkvyacevthqglsspvtksfnrgec
[0365]
如上所述,生产本发明多肽的方法是本领域众所周知的。
[0366]
便利地,所述多肽是或包括重组多肽。用于生产此类重组多肽的合适方法是本领域众所周知的,如在原核或真核宿主细胞中表达(例如,参见green和sambrook,2012,《分子克隆实验手册(molecular cloning,a laboratory manual)》,第四版,冷泉港出版社,纽约,其相关公开内容通过引用并入本文)。
[0367]
本发明的多肽也可以使用市售的体外翻译系统产生,如兔网织红细胞裂解物或小麦胚芽裂解物(可从promega获得)。优选地,所述翻译系统是兔网织红细胞裂解物。便利地,所述翻译系统可以与转录系统偶联,如tnt转录
‑
翻译系统(promega)。该系统的优点是在与翻译相同的反应中由编码dna多核苷酸产生合适的mrna转录物。
[0368]
本领域技术人员将理解,本发明的多肽可替代地被人工合成,例如使用众所周知的液相或固相合成技术(如t
‑
boc或fmoc固相肽合成)。
[0369]
多核苷酸、载体和细胞
[0370]
本发明的第二方面提供了一种分离的核酸分子,其编码根据前述权利要求中任一项所述的双特异性多肽或其组分多肽链。例如,所述核酸分子可以包括表a和b中提供的任何核苷酸序列。
[0371]
因此,本发明的多核苷酸可以编码本文所述的任何多肽,或b1的全部或部分或b2的全部或部分。术语“核酸分子”和“多核苷酸”在本文中可互换使用,并且是指任何长度的
核苷酸的聚合形式,脱氧核糖核苷酸或核糖核苷酸,或其类似物。多核苷酸的非限制性实例包含基因、基因片段、信使rna(mrna)、cdna、重组多核苷酸、质粒、载体、任何序列的分离的dna、任何序列的分离的rna、核酸探针和引物。本发明的多核苷酸可以以分离的或基本上分离的形式提供。基本上分离是指多肽可以从任何周围介质中基本上分离,但不是完全分离。多核苷酸可以与载剂或稀释剂混合,所述载剂或稀释剂不会干扰多核苷酸的预期用途并且仍被认为是基本上分离的。
[0372]“编码”所选多肽的核酸序列是当置于适当调节序列的控制下时在体内转录(在dna的情况下)和翻译(在mrna的情况下)成多肽的核酸分子。编码序列的边界由5'(氨基)末端处的起始密码子和3'(羧基)末端处的翻译终止密码子决定。出于本发明的目的,此类核酸序列可以包含但是不限于来自病毒、原核或真核mrna的cdna、来自病毒或原核dna 或rna的基因组序列,以及甚至合成dna序列。转录终止序列可以位于相对于编码序列的 3'端。
[0373]
编码抗体重链或轻链氨基酸序列的实例的代表性多核苷酸可以包括本文公开的任何一种核苷酸序列或由其组成,例如表a和b中列出的序列。
[0374]
合适的多核苷酸序列也可以是这些特定多核苷酸序列之一的变体。例如,变体可以是任何上述核酸序列的取代、缺失或添加变体。变体多核苷酸可以包括来自序列列表中给出的序列的1个、2个、3个、4个、5个、最多10个、最多20个、最多30个、最多40个、最多 50个、最多75个或更多个核酸取代和/或缺失。
[0375]
合适的变体可以与本文公开的任何一种核酸序列的多核苷酸具有至少70%同源性,优选地,与其具有至少80%或90%(并且更优选地,至少95%、97%或99%)同源性。优选地,至少在多核苷酸的编码区域方面存在这些水平的同源性和同一性。测量同源性的方法是本领域众所周知的,并且本领域技术人员将理解在本上下文中,基于核酸同一性计算同源性。这种同源性可以存在于至少15个,优选地至少30个,例如至少40个、60个、100个、200个或更多个连续核苷酸的区域内。这种同源性可以存在于未经修饰的多核苷酸序列的整个长度上。
[0376]
测量多核苷酸同源性或同一性的方法是本领域已知的。例如,uwgcg程序包提供了 bestfit程序,所述程序可用于计算同源性(例如,按其默认设置使用)(devereux等人,1984;其公开内容通过引用并入本文)。
[0377]
pileup和blast算法也可用于计算同源性或排列序列(通常根据其默认设置),例如 altschul,1993;altschul等人,1990,其公开内容通过引用并入本文)。
[0378]
用于执行blast分析的软件可通过美国国家生物技术信息中心 (http://www.ncbi.nlm.nih.gov/)公开获得。该算法首先通过鉴定查询序列中长度为w的短字来鉴定高评分序列对(hsp),当与数据库序列中相同长度的字进行比对时,所述短字匹配或满足某个正值阈值评分t。t被称为邻域字评分阈值(altschul等人,同上)。这些初始邻域字命中充当用于启动搜索以查找含有所述初始邻域字命中的hsp的种子。字命中沿每个序列在两个方向上扩展,直到累积比对评分可以增加为止。在以下情况下,在每个方向上的字命中扩展将停止:由于一个或多个负评分残基比对的累积,累积比对评分变为零或更低;或到达任一序列的末尾。blast算法参数w、t和x决定比对的灵敏度和速度。blast程序使用以下默认值:字长(w)为11,blosum62评分矩阵(参见henikoff和henikoff,1992;其公开内容通过引用并入本文)比对(b)为50,期望值(e)为10,m=5,n=4,以及两条链的比较。
[0379]
blast算法对两个序列之间的相似性进行统计分析;参见例如karlin和altschul,1993;其公开内容通过引用并入本文。blast算法提供的一种相似性度量是最小总和概率(p(n)),其提供了两个核苷酸或氨基酸序列之间偶然发生匹配的概率的指示。例如,如果将第一序列与第二序列进行比较的最小总和概率小于约1,优选第小于约0.1,更优选第小于约0.01,并且最优选第小于约0.001,则认为一个序列与另一个序列相似。
[0380]
同源物与相关多核苷酸中的序列的不同之处可以在于,少于3个、5个、10个、15个、 20个或更多个突变(每个突变可以是取代、缺失或插入)。可以在同源物的至少30个,例如至少40个、60个或100个或更多个连续核苷酸的区域上测量这些突变。
[0381]
在一个实施例中,由于遗传密码中的冗余,变体序列可以不同于序列表中给出的特定序列。dna密码具有4个主要的核酸残基(a、t、c和g),并使用这些残基“拼写”三个字母的密码子,这些密码子代表生物体基因中编码的蛋白质的氨基酸。沿着dna分子的密码子的线性序列被翻译成由这些基因编码的一种或多种蛋白质中氨基酸的线性序列。密码高度简并,61个密码子编码20个天然氨基酸,并且3个密码子代表“停止”信号。因此,大多数氨基酸由不止一个密码子编码
‑
事实上,有几个氨基酸是由四个或更多不同密码子编码的。因此,本发明的变体多核苷酸可以编码与本发明的另一多核苷酸相同的多肽序列,但是由于使用不同的密码子来编码相同的氨基酸,因此本发明的变体多核苷酸可以具有不同的核酸序列。
[0382]
因此,本发明的多肽可以由编码并能够表达它的多核苷酸的形式产生或以所述多核苷酸的形式递送。
[0383]
本发明的多核苷酸可以根据本领域众所周知的方法合成,如在green和sambrook(2012, 《分子克隆
‑
实验室手册(molecular cloning
‑
a lab manual)》,第4版;冷泉港出版社;其公开内容通过引用并入本文)中以实例方式描述的。
[0384]
本发明的核酸分子可以以表达盒的形式提供,所述表达盒包含与插入序列可操作地连接的控制序列,从而允许本发明的多肽在体内表达。这些表达盒进而通常在载体(例如,质粒或重组病毒载体)中提供。这种表达盒可以直接施用于宿主受试者。可替代地,可以将包括本发明多核苷酸的载体施用于宿主受试者。优选地,使用遗传载体制备和/或施用多核苷酸。合适的载体可以是能够携带足够量的遗传信息并允许表达本发明的多肽的任何载体。
[0385]
因此,本发明包含包括此类多核苷酸序列的表达载体。此类表达载体是分子生物学领域中常规构建的,并且可以例如涉及使用质粒dna和适当的起始子、启动子、增强子和其它元件,如例如聚腺苷酸化信号,其可能是必要的,并且以正确的取向定位,以允许表达本发明的肽。其它合适的载体对本领域技术人员来说是显而易见的(参见green和sambrook,同上)。
[0386]
本发明还包含已被修饰以表达本发明多肽的细胞。此类细胞包含瞬时的或优选地稳定的高等真核细胞系(如哺乳动物细胞或昆虫细胞)、低等真核细胞(如酵母)或原核细胞(如细菌细胞)。可通过插入编码本发明多肽的载体或表达盒进行修饰的细胞的具体实例包含哺乳动物hek293t、cho、hela、ns0和cos细胞。优选地,所选择的细胞系不仅稳定,而且还允许多肽的成熟糖基化和细胞表面表达。
[0387]
本发明的此类细胞系可使用常规方法培养以产生本发明的多肽,或可出于治疗或
预防目的用于将本发明的抗体递送至受试者。可替代地,本发明的多核苷酸、表达盒或载体可以施用于来自受试者的离体细胞,然后该细胞返回所述受试者的身体。
[0388]
在一个实施例中,所述核酸分子编码抗体重链或其可变区。
[0389]
在一个实施例中,所述核酸分子编码抗体轻链或其可变区。
[0390]“核酸分子”包含dna(例如基因组dna或互补dna)和mrna分子,它们可以是单链或双链的。“分离的”是指核酸分子不位于或以其它方式提供在细胞内。
[0391]
在一个实施例中,所述核酸分子是cdna分子。
[0392]
本领域技术人员将理解,可以对核酸分子进行密码子优化以在特定宿主细胞中表达抗体多肽,例如用于在人类细胞中表达(例如,参见angov,2011,其公开内容通过引用并入本文)。
[0393]
本发明的范围内还包含以下内容:
[0394]
(a)本发明的第三方面提供了一种载体(如表达载体),其包括根据本发明的第二方面所述的核酸分子;
[0395]
(b)本发明的第四方面提供了一种宿主细胞(如哺乳动物细胞,例如人细胞,或中国仓鼠卵巢细胞,例如chok1sv细胞),其包括根据本发明的第二方面所述的核酸分子或根据本发明的第三方面所述的载体;并且
[0396]
(c)本发明的第五方面提供了一种制备根据本发明的第一方面所述的多肽的方法,所述方法包括在表达所述多肽的条件下培养根据本发明的第四方面所述的宿主细胞的群体,并从中分离出所述多肽。
[0397]
生产方法
[0398]
在第六方面,本发明提供了一种组合物,其包括本发明的分子,如本文所述的抗体、双特异性多肽、多核苷酸、载体和细胞。例如,本发明提供了一种组合物,其包括一种或多种本发明的分子,如一种或多种本发明的抗体和/或双特异性多肽,以及至少一种药学上可接受的载剂。
[0399]
本领域技术人员将理解,药物组合物中还可以包含另外的化合物,所述另外的化合物包含螯合剂,如edta、柠檬酸盐、egta或谷胱甘肽。
[0400]
药物组合物可以以本领域已知的方式制备,所述方式具有足够的储存稳定性并且适合施用于人和动物。例如,可以将药物组合物冻干,例如通过冷冻干燥、喷雾干燥、喷雾冷却或通过使用超临界粒子形成的粒子形成。
[0401]“药学上可接受的”是指不降低本发明双特异性多肽的cd40和taa结合活性的有效性的无毒材料。此类药学上可接受的缓冲液、载剂或赋形剂是本领域众所周知的(参见《雷明顿药物科学(remington's pharmaceutical sciences)》,第18版,编者:a.r gennaro,麦克出版公司(mack publishing company)(1990)和《药物赋形剂手册(handbook of pharmaceuticalexcipients)》,第3版,编者:a.kibbe,药物出版公司(pharmaceutical press)(2000),其公开内容通过引用并入本文)。
[0402]
术语“缓冲剂”旨在表示含有酸
‑
碱混合物的水溶液,目的是稳定ph。缓冲液的实例为氨基丁三醇(trizma)、二甘氨酸(bicine)、麦黄酮(tricine)、mops、mopso、mobs、三羟甲基氨基甲烷(tris)、hepes、hepbs、mes、磷酸盐、碳酸盐、乙酸盐、柠檬酸盐、乙醇酸盐、乳酸盐、硼酸盐、aces、ada、酒石酸盐、amp、ampd、ampso、bes、cabs、二甲胂酸盐、ches、dipso、
epps、乙醇胺、甘氨酸、heppso、咪唑、咪唑乳酸、pipes、ssc、 sspe、popso、taps、tabs、tapso和tes。
[0403]
术语“稀释剂”旨在表示水溶液或非水溶液,目的是稀释药物制剂中的多肽。稀释剂可为盐水、水、聚乙二醇、丙二醇、乙醇或油(如红花油、玉米油、花生油、棉籽油或芝麻油) 中的一种或多种。
[0404]
术语“佐剂”旨在表示添加到调配物中以增加本发明的多肽的生物学效应的任何化合物。佐剂可为具有不同阴离子的锌盐、铜盐或银盐中的一种或多种,例如但不限于氟化物、氯化物、溴化物、碘化物、硫氰酸盐、亚硫酸盐、氢氧化物、磷酸盐、碳酸盐、乳酸盐、乙醇酸盐、柠檬酸盐、硼酸盐、酒石酸盐和具有不同酰基组成的醋酸盐。佐剂也可为阳离子聚合物,如阳离子纤维素醚、阳离子纤维素酯、脱乙酰化透明质酸、壳聚糖、阳离子树枝状聚合物、阳离子合成聚合物(如聚(乙烯基咪唑))和阳离子多肽(如聚组氨酸、聚赖氨酸、聚精氨酸) 和含有这些氨基酸的肽。
[0405]
赋形剂可为碳水化合物、聚合物、脂质和矿物质中的一种或多种。碳水化合物的实例包含乳糖、葡萄糖、蔗糖、甘露醇和环状糊精,它们被添加到该组合物中,例如用于促进冷冻干燥。聚合物的实例是淀粉、纤维素醚、纤维素羧甲基纤维素、羟丙甲基纤维素、羟乙基纤维素、乙基羟乙基纤维素、藻酸盐、鹿角菜胶、透明质酸及其衍生物、聚丙烯酸、聚磺酸盐、聚乙二醇/聚氧化乙烯、聚氧化乙烯/聚氧化丙烯共聚物、不同水解度的聚乙烯醇/聚乙烯乙酸酯,以及聚乙烯吡咯烷酮,所有都是不同的分子量,它们被添加到该组合物中,例如用于控制粘度、用于实现生物粘附或用于保护脂质免于化学和蛋白质降解。脂质的实例是脂肪酸、磷脂、甘油单酯、甘油二酯和甘油三酯、神经酰胺、鞘脂和糖脂,其酰基链长度和饱和度都不同,蛋卵磷脂、大豆卵磷脂、氢化蛋卵磷脂和大豆卵磷脂,其出于与聚合物类似的原因被添加到组合物中。矿物质的实例是滑石、氧化镁、氧化锌和氧化钛,其被添加到组合物中以获得益处,如减少液体积聚或有利的颜料性质。
[0406]
本发明的多肽可以被配制成本领域已知的适合其递送的任何类型的药物组合物。
[0407]
在一个实施例中,本发明的药物组合物可以呈脂质体的形式,其中除了其它药学上可接受的载剂外,多肽还与两亲性试剂(如脂质)组合,所述两亲性试剂以聚集形式作为胶束、不可溶单分子层和液晶存在。用于脂质体调配物的合适的脂质包含但不限于甘油单酯、甘油二酯、硫脂、溶血卵磷脂、磷脂、皂苷、胆汁酸等。合适的脂质还包含在极性头基中被聚(乙二醇)修饰以便延长血流循环时间的脂质。这种脂质体调配物的制备可在例如us 4,235,871中找到,其公开内容通过引用并入本文。
[0408]
本发明的药物组合物也可以呈可生物降解的微球形式。脂肪族聚酯,如聚(乳酸)(pla)、聚(乙醇酸)(pga)、pla和pga(plga)或聚(己内酯)(pcl)的共聚物和聚酸酐已在微球生产中被广泛用作可生物降解聚合物。这种微球的制备可以在us 5,851,451和ep 0 213 303 中找到,其公开内容通过引用并入本文。
[0409]
在另外的实施例中,本发明的药物组合物以聚合物凝胶的形式提供,其中聚合物(如淀粉、纤维素醚、纤维素羧甲基纤维素、羟丙基甲基纤维素、羟乙基纤维素、乙基羟乙基纤维素、藻酸盐、鹿角菜胶、透明质酸及其衍生物、聚丙烯酸、聚乙烯咪唑、聚磺酸盐、聚乙二醇/聚氧化乙烯、聚氧化乙烯/聚氧化丙烯共聚物、不同水解度的聚乙烯醇/聚乙酸乙烯酯以及聚乙烯吡咯烷酮)用于含药剂的溶液的增稠。聚合物还可以包括明胶或胶原。
[0410]
可替代地,多肽可以简单地溶解在盐水、水、聚乙二醇、丙二醇、乙醇或油(如红花油、玉米油、花生油、棉籽油或芝麻油)、黄蓍胶和/或各种缓冲液中。
[0411]
应当理解,本发明的药物组合物可以包含离子和用于增强活性多肽作用的确定的ph。另外,组合物可以进行常规的药物操作,如灭菌,和/或可以含有常规的佐剂,如防腐剂、稳定剂、润湿剂、乳化剂、缓冲剂、填充剂等。
[0412]
本发明的药物组合物可以通过本领域技术人员已知的任何合适的途径施用。因此,可能的施用途径包含肠胃外(静脉内、皮下和肌肉内)、局部、眼、鼻、肺、口腔、口腔、肠胃外、阴道和直肠。同样,从植入物施用也是可能的。
[0413]
在一个优选的实施例中,药物组合物通过肠胃外施用,例如,静脉内、脑室内、关节内、动脉内、腹膜内、鞘内、心室内、胸骨内、颅内、肌肉内或皮下施用,或者药物组合物可以通过输注技术施用。药物组合物可以方便地以无菌水溶液的形式使用,所述无菌水溶液可以含有其它物质,例如足够的盐或葡萄糖,以使溶液与血液等渗。如有必要,应适当缓冲所述水溶液(优选地,缓冲到ph为3到9)。在无菌条件下制备合适的肠胃外调配物可通过本领域的技术人员熟知的标准制药技术容易地实现。
[0414]
适合用于肠胃外给药的调配物包含水性和非水性无菌注射溶液,这些注射溶液可以含有抗氧化剂、缓冲剂、抑菌剂以及使该调配物与预期接受者的血液等渗的溶质;以及水性和非水性无菌悬浮液,这些悬浮液可以包含悬浮剂和增稠剂。所述调配物可以存在于单位剂量或多剂量容器(例如,密封的安瓿瓶和小瓶)中,并且可以在仅需要在使用前一刻添加无菌液体载剂(例如,注射用水)的冷冻干燥(冻干)条件下储存。可以由前述种类的无菌粉末、颗粒和片剂制备临时注射溶液和悬浮液。
[0415]
因此,本发明的药物组合物特别适用于肠胃外(例如静脉内)施用。
[0416]
可替代地,药物组合物还可以鼻内或通过吸入施用(例如,以气雾剂喷雾呈现形式使用合适的推进剂(例如,二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、氢氟烷烃(如1,1,1,2
‑ꢀ
四氟乙烷(hfa 134a3)或1,1,1,2,3,3,3
‑
七氟丙烷(hfa 227ea3))、二氧化碳或其它合适的气体)从加压容器、泵、喷雾器或雾化器中施用)。在加压气雾剂的情况下,剂量单位可以通过提供阀门来递送计量的量来确定。加压容器、泵、喷雾器或雾化器可以含有活性多肽(例如,使用乙醇和推进剂的混合物作为溶剂)的溶液或悬浮液,所述溶液或悬浮液可以另外含有润滑剂(例如,脱水山梨糖醇三油酸酯)。可以将用于吸入器或吹入器的胶囊和药筒(例如,由明胶制成)配置成含有本发明的化合物和合适的粉末基质(如乳糖或淀粉)的粉末混合物。
[0417]
药用组合物可以以药学上有效的剂量施用给患者。如本文所使用的,
‘
治疗有效量’或
‘
有效量’或
‘
治疗有效’是指针对给定病况和施用方案提供治疗效果的量。这是经计算与所需的添加剂和稀释剂(即载剂或施用媒剂)缔合产生期望的治疗效果的活性材料的预定量。进一步地,其旨在意指足以减少并且最优选地预防宿主的活性、功能和反应的临床显著缺陷的量。可替代地,治疗有效量足以引起宿主的临床显著病况的改善。如本领域的技术人员所理解的,化合物的量可根据其比活性而变化。合适的剂量可含有经计算与所需的稀释剂缔合产生期望的治疗效果的活性组合物的预定量。在制造本发明组合物的方法和用途中,提供治疗有效量的活性组分。如本领域所众所周知的,普通技术医务人员或兽医工作者可根据患者特征(如年龄、体重、性别、病况、并发症、其它疾病等)来确定治疗有效量。药
抗体或其抗原结合片段(例如,纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、兰博利珠单抗(lambrolizumab)、pdr
‑
001、medi
‑
0680和amp
‑
224)。可替代地,所述pd
‑
1抑制剂可以包括能够抑制pd
‑
1功能的抗pd
‑
l1抗体或其抗原结合片段(例如,德瓦鲁单抗 (durvalumab)、阿特珠单抗(atezolizumab)、阿维鲁单抗(avelumab)和mdx
‑
1105)或由其组成。
[0434]
在另一个实施例中,所述另外的免疫治疗剂是ctla
‑
4抑制剂,如抗ctla
‑
4抗体或其抗原结合部分。
[0435]
在另外的实施例中,所述另外的免疫治疗剂活化cd137,如激动性抗cd137抗体或其抗原结合部分。
[0436]
在另外的实施例中,所述另外的免疫治疗剂活化ox40,如激动性抗ox40抗体或其抗原结合部分。
[0437]
在另外的实施例中,所述另外的免疫治疗剂抑制lag3、tim3或vista的功能(lines 等人2014)。
[0438]
本领域技术人员将理解,两种活性剂(如上文详述)的存在可以在受试者的肿瘤治疗中提供协同益处。“协同”包含:两种药剂组合的治疗效果(例如,通过参考肿瘤的生长速率或大小来确定)大于单独施用的两种药剂的相加治疗效果。这种协同作用可以通过在实体瘤的相关细胞系模型中单独和以组合形式测试活性剂来鉴定。
[0439]
包括本发明的多肽或其它组合物和使用说明的试剂盒也在本发明的范围内。所述试剂盒可以进一步含有一种或多种另外的试剂,如上文所述的另外的治疗剂或预防剂。
[0440]
医疗用途和方法
[0441]
本发明的多肽可用于治疗或预防。在治疗性应用中,将多肽或组合物以足以治愈、减轻或部分阻止病况或其一种或多种症状的量施用于已经患有病症或病况的受试者。这种治疗性治疗可导致疾病症状严重程度降低,或无症状期的频率或持续时间增加。足以实现这一点的量被定义为“治疗有效量”。在预防性应用中,将多肽或组合物以足以预防或延迟症状发展的量施用于尚未表现出病症或病况的症状的受试者。这样的量被定义为“预防有效量”。受试者可能已经通过任何合适的方式被鉴定为处于发展疾病或病况的风险中。
[0442]
因此,本发明的第七方面提供了根据本发明的第一方面所述的双特异性多肽,其用于医学中。
[0443]
本发明的第八方面提供了根据本发明的第一方面所述的双特异性多肽,其用于治疗受试者的肿瘤病症。
[0444]“治疗”包含对患者的治疗性和预防性治疗。术语“预防性”用于涵盖本文所述的药剂或其调配物用于预防或降低肿瘤病症的可能性或癌细胞在患者或受试者中的扩散、传播或转移的用途。术语“预防性”还涵盖本文所述的药剂或其调配物用于防止先前已接受肿瘤病症治疗的患者的肿瘤病症复发的用途。
[0445]
在一个实施例中,所述肿瘤病症与受试者体内实体瘤的形成有关。
[0446]
因此,所述实体瘤可以选自由以下组成的组:前列腺癌、乳腺癌、肺癌、结直肠癌、黑色素瘤、膀胱癌、脑/cns癌、宫颈癌、食道癌、胃癌、头/颈癌、肾癌、肝癌、淋巴瘤、卵巢癌、胰腺癌和肉瘤。
[0447]
例如,所述实体瘤可以选自由以下组成的组:肾细胞癌、结直肠癌、肺癌、前列腺癌
和乳腺癌。
[0448]
在一个实施例中,所述肿瘤病症选自由以下组成的组:上皮癌、膀胱癌、乳腺癌、宫颈癌、结直肠癌、胃癌、食道癌、头癌、颈癌、头颈癌、非小细胞肺癌、间皮瘤、肺癌、宫颈癌、子宫内膜癌、卵巢癌、胃癌、胰腺癌、前列腺癌、胃肠癌和肾癌。
[0449]
在一个实施例中,所述肿瘤病症选自由以下组成的组:膀胱癌、乳腺癌、宫颈癌、结直肠癌、胃癌、头癌、颈癌、头颈癌、非小细胞肺癌、间皮瘤、卵巢癌、胰腺癌、前列腺癌和肾癌;并且
[0450]
taa是5t4。
[0451]
在一个实施例中,所述肿瘤病症选自由以下组成的组:上皮癌;食管癌、胃癌、结直肠癌、胃癌、胰腺癌、乳腺癌、肺癌、卵巢癌、胃肠癌、膀胱癌;并且
[0452]
taa是epcam。
[0453]
在一个实施例中,所述肿瘤病症选自由以下组成的组:乳腺癌、食道癌、肺癌、宫颈癌、子宫内膜癌、卵巢癌、膀胱癌、胰腺癌、胃癌;
[0454]
taa是her2。
[0455]
在一个实施例中,所述实体瘤选自由以下组成的组:上皮、膀胱、乳腺、宫颈、结直肠、胃、食道、头、颈、头颈、非小细胞肺、间皮瘤、肺、宫颈、子宫内膜、卵巢、胃、胰腺、前列腺、胃肠和肾。
[0456]
在一个实施例中,所述实体瘤选自由以下组成的组:膀胱、乳腺、宫颈、结直肠、胃、头、颈、头颈、非小细胞肺、卵巢、胰腺、前列腺和肾;并且
[0457]
taa是5t4。
[0458]
在一个实施例中,所述实体瘤选自由以下组成的组:上皮;食道、胃、结直肠、胃、胰腺、乳腺、肺、卵巢、胃肠和膀胱;并且
[0459]
taa是epcam。
[0460]
在一个实施例中,所述实体瘤选自由以下组成的组:乳腺、食道、肺、宫颈、子宫内膜、卵巢、膀胱、胰腺、胃;
[0461]
taa是her2。
[0462]
本发明的第九方面提供了一种根据本发明的第一方面所述的双特异性多肽在制备用于治疗或预防受试者的肿瘤病症的药物中的用途。
[0463]
在一个实施例中,所述肿瘤病症与受试者体内实体瘤的形成有关(例如,如上文详述)。
[0464]
本发明的第十方面提供了一种用于治疗或预防受试者的肿瘤病症的方法,所述方法包括以下步骤:向受试者施用有效量的根据本发明的第一方面所述的双特异性多肽。
[0465]
在一个实施例中,所述肿瘤病症与受试者体内实体瘤的形成有关(例如,如上文详述)。
[0466]
在一个实施例中,所述受试者是人类。
[0467]
在一个实施例中,所述方法包括全身施用双特异性多肽。
[0468]
在一个实施例中,所述方法进一步包括向所述受试者施用一种或多种另外的治疗剂。
[0469]
在本说明书中对于一份显然在前公开的文件的列举或者讨论不应必然地被视为
是承认所述文件是现有技术的一部分或者是公知常识。
[0470]
当结合术语“包括(comprising)”用在权利要求书和/或说明书中时,用词语“一个/种(a 或an)”可意指“一个”,但其还与“一个或多个”、“至少一个”和“一个或多于一个”的含义一致。
[0471]
当结合以上描述和附图考虑时,将更好地理解和理解本发明的这些实施例和其它实施例。然而,应当理解,以上描述虽然表明了本发明的各个实施例及其许多其许多特定细节,但是其是以说明而非限制的方式给出的。在不脱离本发明的精神的情况下,可以在本发明的范围内进行许多替换、修改,添加和/或重新布置,并且本发明包含所有此类替换、修改、添加和 /或重新布置。
[0472]
以下附图形成本说明书的一部分,并且包含在内以进一步展示本发明的某些方面。通过参考这些附图中的一个或多个并结合本文呈现的具体实施例的详细描述,可以更好地理解本发明。
附图说明
[0473]
现在,将参考以下附图描述体现本发明的某些方面的优选的非限制性实例:
[0474]
图1示出了本发明的双特异性抗体的示例性格式的结构的示意图。在每种格式中,恒定区显示为填充的浅灰色;可变重链区vh1显示为黑白格子;可变轻链区vl1显示为实心白色;可变重链区vh2显示为实心黑色;并且可变轻链区vl2显示为带有对角线的白色。cd40 结合结构域(结合结构域1)通常表示为一对黑白格子结构域和填充的白色结构域 (vh1/vl1);肿瘤细胞相关抗原结合结构域(结合结构域2)通常表示为一对填充的黑色结构域和带有对角线的白色结构域(vh2/vl2)。然而,在所示的所有格式中,应当理解,可以交换结合结构域1和2。即,cd40结合结构域可能出现在该图所示的肿瘤细胞相关抗原结合结构域的位置,反之亦然。
[0475]
图2示出了双特异性抗体构建体的示例组成。图2的双特异性抗体由三种类型的多肽链构成:(1)igg重链(白色)通过多肽接头融合至fab轻链(格子)。(2)igg轻链(砖块) 和(3)fab重链(黑色)。在重链和轻链之间的界面中引入了突变。
[0476]
图3.示出bsab与人epcam的结合的elisa分析。单elisa(顶部框架)显示,与 1132
‑
3174.m相比,1132
‑
005025.m、1132
‑
005038.m和1132
‑
3188.m与epcam的结合更强。双elisa(底部框架)显示,与1132
‑
3174.m(morrison格式)相比,1132
‑
3174.r(ruby
tm
格式)获得了更高的最大信号。
[0477]
图4.cd40
‑
epcam双特异性抗体与细胞上表达的epcam的结合。将1132
‑
005025.m、 1132
‑
005038.m、1132
‑
3174.m和1132
‑
3188.m与表达epcam的细胞系一起孵育。使用抗人igg检测抗体通过流式细胞术分析抗体与细胞的结合。
[0478]
图5.cd40
‑
epcam双特异性抗体1132
‑
3174.r和cd40单特异性抗体1132.m2与epcam 转染的和对照转染的cho细胞的结合。使用荧光染料偶联的链霉亲和素通过流式细胞术检测生物素化抗体的结合。在两个代表性实验中的一个代表性实验中汇总来自两次重复的结果。
[0479]
图6.cd40
‑
epcam双特异性抗体1132
‑
3174.r和cd40单特异性抗体1132.m2与表达 epcam的肿瘤细胞系ht29、jeg、jar和bxpc3的结合。使用荧光染料偶联的链霉亲和素通过流
式细胞术检测生物素化抗体的结合。在两个代表性实验中的一个代表性实验中汇总来自两次重复的结果。
[0480]
图7.cd40
‑
epcam双特异性抗体1132
‑
3174.r和cd40单特异性抗体1132.m2与pbmc、单核细胞、b细胞、t细胞和nk细胞中的细胞群的结合。将pbmc与生物素化的1132
‑
3174.r 和1132.m2以及针对cd19、cd14、cd3和cd56的荧光染料偶联抗体一起孵育。使用荧光染料偶联的链霉亲和素通过流式细胞术检测生物素化抗体与不同细胞群的结合。在两个代表性实验中的一个代表性实验中汇总来自三个供体的结果。
[0481]
图8.cd40
‑
epcam双特异性抗体1132
‑
3174.m、1132
‑
005038.m、1132
‑
005025.m和 1132
‑
3188.m对b细胞活化的影响。在存在或不存在cho细胞上表达的epcam的情况下,用滴定的抗体培养原代人b细胞。2天后,通过facs分析b细胞上cd86的表达。该图示出了来自3个供体(1132
‑
3174.m、1132
‑
005038.m和1132
‑
005025.m)或2个供体(1132
‑
3188.m) 的汇总结果。
[0482]
图9.cd40
‑
epcam双特异性抗体1132
‑
3174.r对b细胞活化的影响。在存在或不存在 cho细胞上表达的epcam的情况下,用滴定的抗体培养原代人b细胞。2天后,通过facs 分析b细胞上cd86的表达。该图示出了在两个代表性实验中的一个代表性实验中来自三个供体的汇总结果。
[0483]
图10.cd40
‑
5t4双特异性抗体1132
‑
1210.m对b细胞增殖的影响。在存在或不存在5t4 的情况下,用滴定的抗体培养原代人b细胞。2天后,使用promega的celltiter
‑
glo荧光细胞活力测定法分析b细胞增殖。
[0484]
图11.cd40
‑
epcam双特异性抗体1132
‑
3174.m和1132
‑
3174.r对dc活化的影响。在存在或不存在cho细胞上表达的epcam的情况下,用滴定的抗体培养人单核细胞衍生的dc。 2天后,通过facs分析cd14
‑
cd1a dc上cd86和hla
‑
dr的表达。该图示出了在四个实验中来自六个供体的汇总结果。
[0485]
图12.cd40
‑
epcam双特异性抗体1132
‑
3174.m和1132
‑
3174.r对dc产生il
‑
12p40的影响。在存在或不存在cho细胞上表达的epcam的情况下,用滴定的抗体培养人单核细胞衍生的dc。2天后,收集上清液并通过elisa分析il
‑
12p40含量。该图示出了在四个实验中来自六个供体的汇总结果。
[0486]
图13.cd40
‑
epcam双特异性抗体1132
‑
3174.m和1132
‑
3174.r对cd40 细胞系中 epcam 肿瘤细胞碎片内化的影响。将荧光标记的epcam 肿瘤细胞碎片与荧光标记的 cd40 raji细胞和滴定的抗体一起孵育。使用活细胞成像系统捕获图像并分析位于cd40 细胞中的肿瘤细胞碎片的数量。该图示出了在三个代表性实验中的一个代表性实验中孵育三小时后两次重复的平均值。
[0487]
图14.通过cd80和cd86的表达确定的抗cd40单克隆抗体1132/1133、1140/1135和 1150/1151对抗原呈递细胞活化的影响。在实验开始时和三天后向hcd40tg小鼠给药100μg 指定的治疗。在最后一次给药后一天收集脾脏,并通过流式细胞术分析树突状细胞(cd11c mhcii )和b细胞(cd19 mhcii )上cd80和cd86的表达。
[0488]
图15.通过人igg(higg)阳性细胞的频率确定的抗体对肿瘤组织的定位。在接种后第 10天,向接种了mb49
‑
hepcam肿瘤的hcd40tg或非hcd40tg c57bl/6小鼠给药指定的治疗。一天后收集肿瘤,用抗higg抗体染色并通过流式细胞术进行分析。
[0489]
图16.通过人igg(higg)阳性细胞的频率确定的抗体对肿瘤组织的定位。在接种后第 16天和第19天,向接种了b16肿瘤(h5t4阳性或阴性)的hcd40tg小鼠给药指定的治疗。在第20天收集肿瘤,用抗higg抗体染色并通过流式细胞术进行分析。
[0490]
图17.mb49肿瘤生长。在接种后第7天、第10天和第13天,向接种了mb49肿瘤 (hepcam阳性或阴性)的hcd40tg小鼠给药指定的治疗。经常测量肿瘤,直到任何治疗组中的第一只小鼠的肿瘤体积达到伦理极限以上。
[0491]
图18.mb49肿瘤生长。在接种后第10天、第13天和第16天,向接种了mb49肿瘤 (hepcam阳性或阴性)的hcd40tg小鼠给药指定的治疗。经常测量肿瘤,直到任何治疗组中的第一只小鼠的肿瘤体积达到伦理极限以上。
[0492]
图19.单个mb49
‑
wt和mb49
‑
hepcam肿瘤生长。幼稚hcd40tg小鼠,或先前从 mb49
‑
hepcam肿瘤中治愈的小鼠(再次攻击),在侧腹的每一侧接种了两个mb49肿瘤,一个hepcam阳性,一个hepcam阴性(wt)。经常测量肿瘤,并随时间绘制肿瘤体积。
[0493]
图20.1132、1132.m2、1132
‑
3174.r和抗cd40参考抗体对脾脏重量的影响。向hcd40tg 小鼠接种mb49
‑
hepcam肿瘤并在接种后第10天、第13天和第16天施用指定的治疗剂量。在最后一次给药后四天收集脾脏并称重。
[0494]
图21.1132、1132.m2、1132
‑
3174.r和抗cd40参考抗体对il
‑
6血浆水平的影响。向 hcd40tg小鼠接种mb49
‑
hepcam肿瘤并在接种后第10天、第13天和第16天施用指定的治疗剂量。在第10天和第13天治疗后4小时收集血液,并从血液中获得血浆。通过elisa 测量血浆样品中的il
‑
6水平。
[0495]
图22.单个mb49
‑
wt和panc02肿瘤生长。幼稚hcd40tg小鼠,或先前从mb49
‑
hepcam 肿瘤中治愈的小鼠(再次攻击),在侧腹的每一侧接种了mb49
‑
wt肿瘤和panc02肿瘤。经常测量肿瘤,并随时间绘制肿瘤体积。
[0496]
图23.1132
‑
3174.r对体外ova特异性t细胞增殖的影响。在存在1132
‑
3174.r或培养基对照的情况下,将ctv标记的ot
‑
1t细胞与hcd40tg dc和坏死的mb49
‑
hepcam
‑
ova或 mb49
‑
wt细胞一起培养。在培养三天后分析cd8 t细胞中增殖细胞(ctv低)的频率。
[0497]
图24.1132
‑
3174.r对ova特异性t细胞增殖频率的影响。用热休克的 mb49
‑
hepcam
‑
ova细胞对接受了从ot
‑
1小鼠分离的ctv标记的cd8 t细胞的hcd40tg 小鼠进行免疫接种,并施用167μg 1132
‑
3174.r。四天后,通过流式细胞术分析脾脏和腹股沟淋巴结,以评估增殖的ova特异性t细胞的频率。
[0498]
图25.1132
‑
3174.r对ova特异性t细胞频率的影响。向接受了从ot
‑
1小鼠分离的ctv 标记的cd8 t细胞的mb49
‑
hepcam
‑
ova荷瘤hcd40tg小鼠施用417μg 1132
‑
3174.r和20 ug fty720,以防止在肿瘤引流淋巴结中引发的ot
‑
1t细胞外流。在接种后第21天,通过流式细胞术分析肿瘤引流(腹股沟)淋巴结,以评估ova特异性t细胞的频率。
[0499]
图26.转染的鼠ct26细胞系上的人5t4的定量。鉴定了具有低、中和高密度人5t4的三个克隆。
[0500]
图27.cd40
‑
5t4双特异性抗体1132
‑
1210.m对cd40 细胞系中5t4 肿瘤细胞碎片内化的影响。将荧光标记的ct26
‑
wt或ct26
‑
h5t4(低、中或高)肿瘤细胞碎片与荧光标记的cd40 raji细胞和滴定的双特异性和/或单克隆抗体一起孵育。使用活细胞成像系统捕获图像并分析位于cd40 细胞中的肿瘤细胞碎片的数量。该图示出了在三个代表性实验中的
一个代表性实验中孵育12小时后两次重复的平均值。与单克隆抗体1132.m2(a)相比,双特异性抗体 1132
‑
1210.m证明ct26
‑
5t4
hi
肿瘤细胞碎片到cd40 细胞的定位增加。如针对1132
‑
1210.m (b)所示,将肿瘤碎片有效定位到cd40 细胞需要每个细胞至少0.15x106‑
1x106个分子的5t4 密度。
[0501]
图28.肿瘤细胞系bxpc3、mcf7、jar和jeg上的人epcam的定量。
[0502]
图29.cd40
‑
epcam双特异性抗体1132
‑
3174.r对cd40 细胞系中epcam 肿瘤细胞碎片内化的影响。将荧光标记的bxpc3、mcf7、jar或jeg肿瘤细胞碎片与荧光标记的cd40 raji细胞和滴定的双特异性和/或单克隆抗体一起孵育。使用活细胞成像系统捕获图像并分析位于cd40 细胞中的肿瘤细胞碎片的数量。该图示出了在三个代表性实验中的一个代表性实验中孵育12小时后两次重复的平均值。与单克隆抗体1132.m2(a)相比,双特异性抗体 1132
‑
3174.r证明epcam
int
和epcam
hi
肿瘤细胞碎片到cd40 细胞的定位增加。如针对 1132
‑
3174.r(b)所示,将肿瘤碎片有效定位到cd40 细胞需要每个细胞至少2.5x105‑
1.5x106个分子的epcam密度。
[0503]
图30.肿瘤细胞系bxpc3、ht29、mcf7、ls174t和sk
‑
ov
‑
3上的her2的定量。
[0504]
图31.cd40
‑
her2双特异性抗体1132
‑
曲妥珠单抗.r对cd40 细胞系中her2 肿瘤细胞碎片内化的影响。将荧光标记的bxpc3、ht29、mcf7、ls174t、ls174t
‑
her2 ko和sk
‑
ov
‑
3 肿瘤细胞碎片与荧光标记的cd40 raji细胞和滴定的双特异性和/或单克隆抗体一起孵育。使用活细胞成像系统捕获图像并分析位于cd40 细胞中的肿瘤细胞碎片的数量。该图示出了在三个代表性实验中的一个代表性实验中孵育12小时后两次重复的平均值。与单克隆抗体 1132.m2相比,双特异性抗体1132
‑
曲妥珠单抗.r证明her2
hi
肿瘤细胞碎片到cd40 细胞的定位增加。
[0505]
图32.如针对1132
‑
曲妥珠单抗.r所示,有效定位需要每个肿瘤细胞至少1x105‑
3x106个分子的her2密度
[0506]
图33.dec
‑
205
‑
epcam双特异性抗体3g9
‑
3174.r对dec
‑
205 细胞系中epcam 肿瘤细胞碎片内化的影响。将荧光标记的bxpc3(epcam
low
)、mcf7(epcam
int
)或jar(epcam
hi
) 肿瘤细胞碎片与荧光标记的dec
‑
205 raji细胞和1.2nm的3g9
‑
3174.r或1188
‑
3174.r(同种型
‑
epcam双特异性抗体)一起孵育。使用活细胞成像系统捕获图像并分析位于dec
‑
205 细胞中的肿瘤细胞碎片的数量。该图示出了在两个实验中的一个实验中孵育0
‑
12小时后两次重复的平均值。与1188
‑
3174.r相比,双特异性抗体3g9.3174.r证明来自mcf7(a)的 epcam
int
肿瘤细胞碎片和来自jar细胞(b)的epcam
hi
肿瘤细胞碎片到dec
‑
205 细胞的定位增加。来自bxpc3细胞(c)的epcam
low
肿瘤细胞碎片未观察到这种效应。
[0507]
图34.分离的mb49
‑
epcam
‑
ova衍生外泌体的动态光散射(dls)曲线。使用uncle 通过dls分析从mb49
‑
epcam
‑
ova的培养物上清液中分离的外泌体。
[0508]
图35.1132
‑
3174.r对体外ova特异性t细胞增殖的影响。在存在1132
‑
3174.r或 1188
‑
3174的情况下,将ctv标记的ot
‑
1t细胞与hcd40tg dc和mb49
‑
hepcam
‑
ova衍生外泌体一起培养。在培养三天后分析cd8 t细胞中增殖细胞(ctv低)的频率。
[0509]
图36.mb49荷瘤小鼠的存活率。在接种后第10天、第13天和第16天,向接种了mb49 肿瘤(hepcam阳性或阴性)的hcd40tg小鼠给药受指定的治疗。将小鼠留在研究中直到它们的肿瘤体积达到2000mm3的伦理极限,此时处死小鼠。
[0510]
表(序列)
[0511]
表a
‑
结合结构域b1的vl和vh氨基酸(aa)序列和核苷酸(nt)序列
[0512]
[0513]
[0514]
[0515][0516]
表b
‑
结合结构域b2的vl和vh氨基酸(aa)序列和核苷酸(nt)序列
[0517]
[0518]
[0519]
[0520]
[0521]
[0522]
[0523][0524]
表c(1)
–
示例性重链cdr序列(结合结构域b1)
[0525]
抗体参考(vh)seqh cdr1seqh cdr2seqh cdr3113273gftfssya74igsygggt75aryvnfgmdy115073gftfssya76iggsssyt77aryysyhmdy114073gftfssya78isgsggst79argpvyssvfdy110773gftfssya78isgsggst80arrvwgfdyadc
‑
101381gftfstyg82isggssyi83arilrggsgmdlapx00584gfsfssty85iytgdgtn86arpditygfainf21.4.187gytftgyy88inpdsggt89ardqplgyctngvcsyfdy
[0526]
表c(2)
–
示例性轻链cdr序列(结合结构域b1)
[0527]
抗体参考(vl)seql cdr1seql cdr2seql cdr31132(1133)90qsissy91aas92qqygrnppt1150(1151)90qsissy91aas93qqygsappt1140(1135)90qsissy91aas94qqsystpyt1107(1108)90qsissy91aas95qqygvypftadc
‑
101396ssnigagyn97gni98aawdksisglvapx00599qsissr100ras101qctgygiswp21.4.1102qgiysw103tas104qqanifplt
[0528]
表d(1)
–
示例性重链cdr序列(结合结构域b2)
[0529][0530]
表d(2)
–
示例性轻链cdr序列(结合结构域b2)
[0531]
抗体参考(vl)seql cdr1seql cdr2seql cdr3索利托单抗136qsllnsgnqkny137was138qndysyplt00502590qsissy91aas139pgssspy00503890qsissy91aas140synlf阿德木单抗90qsissy137was141qqsydipyt4d5mocb142ksllhsngity143qms144aqnleiprt3
‑
17i145qsvssn146gas147qqynnwppayt曲妥珠单抗148qdvnta149sas150qqhyttppt帕妥株单抗151qdvsig149sas152qqyyiypyt2992(2993)153qsirsa91aas154qqtygylht利妥昔单抗155asssvsy156ats157qqwtsnppt西妥昔单抗158qsigtn159yas160qqnnnwptt
[0532]
突变的igg1抗体序列
[0533]
igg1 lala
‑
序列:
[0534]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssgl yslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaaggpsvf lfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyr vvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknq vsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvf scsvmhealhnhytqkslslspgk(seq id no:161)
[0535]
接头序列
[0536]
sggggsggggs(seq id no:162)
[0537]
sggggsggggsap(seq id no:163)
[0538]
nfsqp(seq id no:164)
[0539]
krtva(seq id no:165)
[0540]
gggsgggg(seq id no:166)
[0541]
ggggsggggs(seq id no:167)
[0542]
ggggsggggsggggs(seq id no:168)
[0543]
gstsgsgkpgsgegstkg(seq id no:169)
[0544]
thtcppcpepkssdk(seq id no:170)
[0545]
gggs(seq id no:171)
[0546]
eaakeaakggggs(seq id no:172)
[0547]
eaakeaak(seq id no:173)
[0548]
(sg)m,其中m=1到7。
[0549]
igg恒定区序列
[0550]
igg1重链恒定区序列:
[0551]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssgl yslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvf lfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyr vvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknq vsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvf scsvmhealhnhytqkslslspgk
[0552]
[seq id no:174]
[0553]
igg1轻链恒定区序列:
[0554]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqds kdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0555]
[seq id no:175]
[0556]
经修饰的igg4重链恒定区序列:
[0557]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssgly slssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppk pkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvl tvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltc lvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvm healhnrytqkslslslgk
[0558]
[seq id no:176]
[0559]
经修饰的igg4重链恒定区序列:
[0560]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssgly slssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppk pkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvl tvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltc lvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvm healhnhytqkslslslgk
[0561]
[seq id no:177]
[0562]
野生型igg4重链恒定区序列:
[0563]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssgly slssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcpscpapeflggpsvflfppk pkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvl tvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltc lvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvm healhnhytqkslslslgk
[0564]
[seq id no:178]
[0565]
参考序列ch1(seq id no:179):
[0566][0567]
(其中粗体和下划线部分是铰链区的一部分,但存在于fab片段中)
[0568]
参考序列cκ(seq id no:180):
[0569]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqds kdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0570]
示例性完整重链和轻链序列
[0571]
结合结构域b1:
[0572]
重链(seq id no:181):
[0573]
evqllesggglvqpggslrlscaasgftfssyamswvrrapgkglewvsgigsygggtyy adsvkgrftisrdnskntlylqmnslraedtavyycaryvnfgmdywgqgtlvtvssast kgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvatgpavlqssglysls svvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaaggpsvflfpp kpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv ltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvslt clvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsv mhealhnhytqkslslspgk
[0574]
轻链(seq id no:182):
[0575]
diqmtqspsslsasvgdrvtitcrasqsissylnwyqekpgkapklliyaasslqsgvpsrfs gsgsgtdftltisslqpedfatyycqqygrnpptfgqgtkleikrtvaapsvfifppsdeqlks gtasvvcylnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslwstltlskadye khkvyacevthqglsspvtksfnrgec
[0576]
结合结构域b2:
[0577]
重链(seq id no:183):
[0578]
evqlleqsgaelvrpgtsvkisckasgyaftnywlgwvkerpghglewigdifpgsgnihy nekfkgkatltadkssstaymqlssltfedsavyfcarlrnwdepmdywgqgttvtvssa stkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglys lssvvevpssslgtqtyicnvnhkpsntkvdkkvepksc
[0579]
轻链(seq id no:184):
[0580]
elvmtqspssltvtagekvtmsckssqsllnsgnqknyltwyqrkpgqppklliywastre sgvpdrftgsgsgtdftltissvqaedlavyycqndysypltfgagtkleikrtvaapavfif ppsdeqlksgtasvvcllknfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstl tlskadyekhkvyacevthqglsspvtksfnrgec
[0581]
实例
[0582]
实例1:cd40
‑
epcam bsab对hepcam的elisa结合
[0583]
背景和目的
[0584]
用elisa分析结合。分析了双特异性抗体1132
‑
005025.m、1132
‑
005038.m、1132
‑
3188.m、 1132
‑
3174.m(呈morrison格式)和1132
‑
3174.r(呈ruby
tm
格式)对人epcam的结合。
[0585]
材料和方法
[0586]
将板用0.5μg/ml hepcam(r&d systems公司,#9277
‑
ep)在pbs中在4℃下包被过夜。在pbs/0.05%tween 20(pbst)中洗涤后,将板用pbs/0.2%bsa在室温下封闭至少30 分
钟,然后再次洗涤。然后加入在pbs/0.02%bsa中从50nm连续稀释的样品,并使其在室温下结合至少1小时。洗涤后,将板用0.5μg/ml生物素化的hcd40(504
‑
030,来自ancell 公司)或hrp标记的山羊抗h
‑
κ轻链(abd serotec公司,#star127p)在室温下孵育至少1 小时。用hrp标记的链霉亲和素检测双抗原络合的bsab。supersignal pico luminescent用作底物,并使用fluostar optima测量发光信号。
[0587]
结果和结论
[0588]
数据(图3中示出)证明,1132
‑
005025.m、1132
‑
005038.m、1132
‑
3188.m、1132
‑
3174.m 和1132
‑
3174.r结合人epcam。
[0589]
实例2:epcam结合结构域的亲和力测量
[0590]
背景和目的
[0591]
通过octet测量结合。分析了双特异性抗体1132
‑
005025.m、1132
‑
005038.m、1132
‑
3188.m、 1132
‑
3174.m(呈morrison格式)或1132
‑
3174.r(呈ruby
tm
格式)对人epcam的结合。
[0592]
材料和方法
[0593]
使用octet red96平台(fortebio)进行动力学测量。用3种不同的测定法进行亲和力评估;测定法1用偶联的bsab和二聚体抗原epcam
‑
fc(sino hepcam_fc(0.25mg/ml,于 pbs中)#10694
‑
h02h)在溶液中进行;测定法2用偶联的bsab和单体抗原epcam
‑
his(r&dhepcam_his(500ug/ml,于pbs中)#9277
‑
ep)在溶液中进行;测定法3用偶联的抗原(sinohepcam_fc(0.25mg/ml,于pbs中)#10694
‑
h02h)和bsab在溶液中进行。
[0594]
测定法1和2
[0595]
将1.0或1.5ug/ml的bsab与抗人fab
‑
ch1第2代(fab2g)生物传感器(部件号#18
‑
5125 (托盘))偶联。将抗原在1x动力学缓冲液(fortebio)中按1/2连续稀释至100nm、50nm、 25nm、12.5nm、6.25nm、3.125nm、1.56nm或0nm。然后进行缔合,持续300秒,并在 1x动力学缓冲液中解离300秒。使用10mm甘氨酸(ph 1.5)使传感器尖端再生。生成的数据通过减去平行缓冲液空白作为参考,基线与y轴对齐,通过针对解离对齐进行步间相关,通过数据分析软件中的savitzky
–
golay过滤器对数据进行平滑处理(v.9.0.0.14)。使用1:1 langmuir结合模型拟合处理后的数据,其中x2作为拟合精度的度量。
[0596]
测定法3
[0597]
将抗原以0.4、1.5、0.25或0.5μg/ml的抗原浓度与胺反应性第二代传感器(浸渍和读取胺反应性第二代(ar2g)生物传感器(部件号#18
‑
5092(托盘))偶联。分析bsab(在1x 动力学缓冲液(fortebio)中按1/2连续稀释,起始浓度为20、15、10 25nm)与抗原偶联传感器的结合。然后进行缔合,持续300秒,并在1x动力学缓冲液中解离300秒。使用10mm 甘氨酸(ph 2.2)使传感器尖端再生。生成的数据通过减去平行缓冲液空白作为参考,基线与y轴对齐,通过针对解离对齐进行步间相关,通过数据分析软件中的savitzky
–
golay过滤器对数据进行平滑处理(v.9.0.0.14)。使用1:1langmuir结合模型拟合处理后的数据,其中 x2作为拟合精度的度量。
[0598]
结果和结论
[0599]
所有双特异性抗体都与人epcam结合,如下表1
‑
3所示。正如预期的那样,在二价设置中测量更高的表观亲和力(测定法1测量)。在呈morrison或ruby
tm
构建体形式的构建体之间观察到类似的亲和力。
[0600]
表1:测定法1
[0601]
bsabkd(m)kon(1/ms)kdis(1/s)完整x^21132
‑
005025.m4e
‑
093e 051e
‑
030.081132
‑
005038.m6e
‑
093e 052e
‑
030.041132
‑
3188.m<1.0e
‑
123e 05<1.0e
‑
070.031132
‑
3174.m5e
‑
102e 058e
‑
050.02
[0602]
表2:测定法2
[0603]
bsabkd(m)kon(1/ms)kdis(1/s)完整x^21132
‑
005025.m3e
‑
073e 041e
‑
020.011132
‑
005038.m1e
‑
068e 031e
‑
020.011132
‑
3188.m3e
‑
081e 054e
‑
030.051132
‑
3174.m5e
‑
072e 041e
‑
020.01
[0604]
表3:测定法3
[0605]
bsabkd(m)kon(1/ms)kdis(1/s)完整x^21132
‑
3174.r.v98e
‑
91e 51e
‑
30.011132
‑
3174.m1e
‑
102e 52e
‑
30.00
[0606]
实例3:cd40
‑
epcam双特异性抗体与表达epcam的细胞系的结合
[0607]
背景和目的
[0608]
1132
‑
3174.m、1132
‑
005025.m、1132
‑
005038.m和1132
‑
3188.m是morrison格式的 cd40
‑
epcam双特异性抗体,其中1132是指cd40激动剂结构域并且3174、005025、005038 和3188是指epcam结合(肿瘤靶向)结构域。这些抗体已经过lala突变,以使fcγ受体结合沉默。
[0609]
本研究的目的是评估cd40
‑
epcam双特异性抗体与细胞上表达的epcam的结合。
[0610]
材料和方法
[0611]
将人epcam基因克隆到pcdna3.1中,随后将载体稳定转染到cho细胞中。将表达高水平epcam的肿瘤细胞系jeg、表达低水平epcam的bxpc3和cho
‑
epcam细胞与1μg/ml 的1132
‑
3174.m、1132
‑
005025.m、1132
‑
005038.m或1132
‑
3188.m一起孵育。使用荧光染料偶联的抗人igg检测抗体的结合,并使用流式细胞术进行分析。
[0612]
结果和结论
[0613]
数据(图4中示出)证明,所有测试的cd40
‑
epcam双特异性抗体都与在所有测试细胞系上表达的epcam结合。
[0614]
实例4:ruby
tm
格式的cd40
‑
epcam双特异性抗体1132
‑
3174.r与epcam转染的 cho细胞的结合
[0615]
背景和目的
[0616]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0617]
本研究的目的是评估1132
‑
3174.r与用人epcam转染的cho细胞的结合。
[0618]
材料和方法
[0619]
使用ez
‑
link sulfo
‑
nhs
‑
lc
‑
生物素(赛默飞世尔(thermofisher)#a39257)将 cd40
‑
epcam双特异性抗体1132
‑
3174.r和cd40单特异性抗体1132.m2生物素化。将人 epcam基因克隆到pcdna3.1中,随后将载体稳定转染到cho细胞中。将对照cho细胞用空pcdna3.1载体稳定转染。将cho细胞与滴定浓度的生物素化1132
‑
3174.r或1132.m2 一起孵育。用荧光染料偶联的链霉亲和素检测生物素化抗体的结合,并使用流式细胞术进行分析。
[0620]
结果和结论
[0621]
数据(图5中示出)证明,1132
‑
3174.r与epcam转染的cho细胞结合,但不与对照 cho细胞结合。1132.m2不与任一细胞系结合。
[0622]
实例5:ruby
tm
格式的cd40
‑
epcam双特异性抗体1132
‑
3174.r与表达epcam的肿瘤细胞系的结合
[0623]
背景和目的
[0624]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0625]
本研究的目的是评估1132
‑
3174.r与表达不同水平epcam的不同来源的肿瘤细胞系的结合。
[0626]
材料和方法
[0627]
使用ez
‑
link sulfo
‑
nhs
‑
lc
‑
生物素(赛默飞世尔(thermofisher)#a39257)将 cd40
‑
epcam双特异性抗体1132
‑
3174.r和cd40单特异性抗体1132.m2生物素化。将表达高水平epcam( )的肿瘤细胞系ht29、jeg和jar以及表达低水平epcam( )的 bxpc3与滴定浓度的生物素化1132
‑
3174.r或1132.m2一起孵育。用荧光染料偶联的链霉亲和素检测生物素化抗体的结合,并使用流式细胞术进行分析。
[0628]
结果和结论
[0629]
数据(图6中示所示)证明,1132
‑
3174.r(但不是1132.m2)与所有测试的epcam 肿瘤细胞系结合。
[0630]
实例6:ruby
tm
格式的cd40
‑
epcam双特异性抗体1132
‑
3174.r与人外周血单核细胞的结合
[0631]
背景和目的
[0632]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0633]
本研究的目的是评估1132
‑
3174.r与人外周血单核细胞中cd40 和cd40
‑
细胞群的结合。
[0634]
材料和方法
[0635]
使用ez
‑
link sulfo
‑
nhs
‑
lc
‑
生物素(赛默飞世尔(thermofisher)#a39257)将 cd40
‑
epcam双特异性抗体1132
‑
3174.r和cd40单特异性抗体1132.m2生物素化。将人外周血单核细胞(pbmc)与滴定浓度的生物素化1132
‑
3174.r或1132.m2以及针对b细胞标志物cd19、t细胞标志物cd3、nk细胞标志物cd56和单核细胞标志物cd14的荧光染料偶联抗体一
起孵育。用荧光染料偶联的链霉亲和素检测生物素化抗体的结合,并使用流式细胞术进行分析。
[0636]
结果和结论
[0637]
数据(图7中示出)证明,1132
‑
3174.r和1132.m2都与pbmc中的cd40 细胞群特异性结合,其中b细胞具有相对较高的cd40表达而单核细胞具有较低的cd40表达。 1132
‑
3174.r和1132.m2不与不表达cd40的t细胞或nk细胞结合。
[0638]
实例7:cd40
‑
epcam双特异性抗体在b细胞增殖测定中的激动作用
[0639]
背景和目的
[0640]
1132
‑
3174.m、1132
‑
005038.m、1132
‑
005025.m和1132
‑
3188.m是morrison格式的cd40
‑
epcam双特异性抗体,其中1132是指cd40激动剂结构域并且3174、005038、005025 和3188是指epcam结合(肿瘤靶向)结构域。这些抗体已经过lala突变,以使fcγ受体结合沉默。
[0641]
本研究的目的是在存在或不存在epcam的情况下评估cd40
‑
epcam双特异性抗体对体外b细胞活化的影响。cd40交联将由在b细胞上表达的cd40和在中国仓鼠卵巢(cho) 细胞上表达的epcam的同时结合介导。
[0642]
材料和方法
[0643]
在b细胞测定中基于原代人b细胞评估1132
‑
3174.m、1132
‑
005038.m、1132
‑
005025.m 和1132
‑
3188.m的激动作用。简而言之,根据制造商的方案(miltenyi biotec#130
‑
091
‑
151) 通过macs从人外周血单核细胞中分离b细胞。对人epcam转染的cho细胞或用空载体转染的cho细胞进行uv照射,并接种在用组织培养物处理过的96孔平底板(eppendorf) 中。在存在il
‑
4(10ng/ml,gibco#phc0045)和滴定浓度的1132
‑
3174.m、1132
‑
005038.m、 1132
‑
005025.m或1132
‑
3188.m的情况下,将b细胞与cho细胞一起共培养。2天后,收获 b细胞并通过facs分析活化标志物cd86的表达水平。
[0644]
结果和结论
[0645]
数据(图8中示出)证明,所有测试的cd40
‑
epcam双特异性抗体都在存在epcam的情况下诱导b细胞上cd86的上调。与1132
‑
005038.m、1132
‑
005025.m和1132
‑
3188.m相比, 1132
‑
3174.m在不存在epcam的情况下没有观察到b细胞活化。
[0646]
实例8:cd40
‑
epcam双特异性抗体1132
‑
3174.r在b细胞增殖测定中的激动作用
[0647]
背景和目的
[0648]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指cd40激动剂结构域,并且3174是指epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0649]
本研究的目的是在存在或不存在epcam的情况下评估1132
‑
3174.r对体外b细胞活化的影响。cd40交联将由在b细胞上表达的cd40和在中国仓鼠卵巢(cho)细胞上表达的 epcam的同时结合介导。
[0650]
材料和方法
[0651]
在b细胞测定中基于原代人b细胞评估1132
‑
3174.r的激动作用。简而言之,根据制造商的方案(miltenyi biotec#130
‑
091
‑
151)通过macs从人外周血单核细胞中分离b细胞。对人epcam转染的cho细胞或用空载体转染的cho细胞进行uv照射,并接种在用组织培养物
处理过的96孔平底板(eppendorf)中。在存在il
‑
4(10ng/ml,gibco#phc0045)和滴定浓度的1132
‑
3174.r的情况下,将b细胞与cho细胞一起共培养。2天后,收获b细胞并通过facs分析活化标志物cd86的表达水平。
[0652]
结果和结论
[0653]
数据(图9中示出)证明,1132
‑
3174.r在存在epcam的情况下诱导b细胞上cd86的上调,在不存在epcam的情况下观察到最小b细胞活化。
[0654]
实例9:cd40
‑
5t4双特异性抗体1132
‑
1210.m在b细胞增殖测定中的激动作用
[0655]
背景和目的
[0656]
1132
‑
1210.m是morrison格式的cd40
‑
5t4双特异性抗体,其中1132是指其cd40激动剂结构域,并且1210是指其5t4结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0657]
本研究的目的是在存在或不存在5t4的情况下评估1132
‑
1210.m对体外b细胞增殖的影响。cd40交联将由在b细胞上表达的cd40和包被在塑料上的5t4抗原的同时结合介导。
[0658]
材料和方法
[0659]
在b细胞测定中基于原代人b细胞评估1132
‑
1210.m的激动作用。简而言之,根据制造商的方案(miltenyi biotec#130
‑
091
‑
151)通过macs从人外周血单核细胞中分离b细胞。将5t4
‑
fc包被到无菌白色96孔平底板(greiner#655074)的塑料上,然后用含有10%fbs 的培养基封闭。将对照未包被的孔用含有10%fbs的培养基封闭。在存在il
‑
4(10ng/ml, gibco#phc0045)和滴定浓度的1132
‑
1210.m、1132.m2(lala突变的激动性单克隆cd40 抗体)或1188
‑
1210.m(lala突变的同种型对照
‑
5t4双特异性抗体)存在的情况下,将b 细胞培养2天。使用celltiter
‑
glo luminescent细胞活力测定法(promega#g7571)进行增殖读数。
[0660]
为了能够汇集来自不同供体的结果,将数据标准化为培养基(r10)对照的平均值。
[0661]
结果和结论
[0662]
数据(图10中示出)证明,1132
‑
1210.m在存在5t4的情况下诱导b细胞增殖,然而在不存在5t4的情况下其也诱导b细胞增殖,尽管程度不同。在该测定中,lala突变的cd40 mab 1132.m2也诱导了一些b细胞增殖。
[0663]
实例10:cd40
‑
epcam双特异性抗体1132
‑
3174.m和1132
‑
3174.r在树突状细胞活化测定中的激动作用
[0664]
背景和目的
[0665]
1132
‑
3174.m是morrison格式的cd40
‑
epcam双特异性抗体,其中1132是指cd40激动剂结构域,并且3174是指epcam结合(肿瘤靶向)结构域。1132
‑
3174.r具有相同的cd40 和epcam结合结构域,但以ruby
tm
格式生产。这些抗体已经过lala突变,以使fcγ受体结合沉默。
[0666]
本研究的目的是评估1132
‑
3174.m和1132
‑
3174.r在存在或不存在epcam的情况下对体外树突状细胞(dc)活化的影响。cd40交联将由在dc上表达的cd40和在中国仓鼠卵巢 (cho)细胞上表达的epcam的同时结合介导。
[0667]
材料和方法
[0668]
在dc活化测定中基于源自原代人单核细胞的dc评估1132
‑
3174.m和1132
‑
3174.r的激动作用。简而言之,根据制造商的方案(miltenyi biotec#130
‑
050
‑
201)通过macs从人
外周血单核细胞中分离单核细胞。通过在存在gm
‑
csf(150ng/ml,gibco)和il
‑
4(50ng/ml, gibco)的情况下将单核细胞培养7天,产生dc。对人epcam转染的cho细胞或用空载体转染的cho细胞进行uv照射,并接种在用组织培养物处理过的96孔平底板(eppendorf) 中。在存在gm
‑
csf、il
‑
4和滴定浓度的1132
‑
3174.m或1132
‑
3174.r的情况下,将dc与 cho细胞一起共培养。2天后,收获dc并通过facs分析cd14
‑
cd1a dc上hla
‑
dr和共刺激分子cd86的表达。
[0669]
结果和结论
[0670]
数据(图11中示出)证明,1132
‑
3174.m和1132
‑
3174.r在存在epcam的情况下均在 dc上诱导dc活化,测量为cd86和hla
‑
dr的表达增加,而在不存在epcam的情况下不诱导背景活化。
[0671]
实例11:cd40
‑
epcam双特异性抗体1132
‑
3174.m和1132
‑
3174.r对树突状细胞产生 il
‑
12的激动作用
[0672]
背景和目的
[0673]
1132
‑
3174.m是morrison格式的cd40
‑
epcam双特异性抗体,其中1132是指cd40激动剂结构域,并且3174是指epcam结合(肿瘤靶向)结构域。1132
‑
3174.r具有相同的cd40 和epcam结合结构域,但以ruby
tm
格式生产。这些抗体已经过lala突变,以使fcγ受体结合沉默。
[0674]
本研究的目的是评估1132
‑
3174.m和1132
‑
3174.r在存在或不存在epcam的情况下对体外树突状细胞(dc)产生il
‑
12的影响。cd40交联将由在dc上表达的cd40和在中国仓鼠卵巢(cho)细胞上表达的epcam的同时结合介导。
[0675]
材料和方法
[0676]
在dc活化测定中基于源自原代人单核细胞的dc评估1132
‑
3174.m和1132
‑
3174.r的激动作用。简而言之,根据制造商的方案(miltenyi biotec#130
‑
050
‑
201)通过macs从人外周血单核细胞中分离单核细胞。通过在存在gm
‑
csf(150ng/ml,gibco)和il
‑
4(50ng/ml, gibco)的情况下将单核细胞培养7天,产生dc。对人epcam转染的cho细胞或用空载体转染的cho细胞进行uv照射,并接种在用组织培养物处理过的96孔平底板(eppendorf) 中。在存在gm
‑
csf、il
‑
4和滴定浓度的1132
‑
3174.m或1132
‑
3174.r的情况下,将dc与 cho细胞一起共培养。2天后,收集上清液并通过elisa分析il
‑
12p40含量(biolegend #430701)。
[0677]
结果和结论
[0678]
数据(如图12中示出)证明,1132
‑
3174.m和1132
‑
3174.r在存在epcam的情况下诱导dc释放il
‑
12p40,而在不存在epcam的情况下不诱导背景il
‑
12p40释放。
[0679]
实例12:cd40
‑
epcam双特异性抗体1132
‑
3174.m和1132
‑
3174.r对表达cd40的细胞系中epcam 肿瘤细胞碎片的共定位(如内化)的影响
[0680]
背景和目的
[0681]
1132
‑
3174.m是morrison格式的cd40
‑
epcam双特异性抗体,其中1132是指cd40激动剂结构域,并且3174是指epcam结合(肿瘤靶向)结构域。1132
‑
3174.r具有相同的cd40 和epcam结合结构域,但以ruby
tm
格式生产。这些抗体已经过lala突变,以使fcγ受体结合沉默。
[0682]
本研究的目的是评估1132
‑
3174.m和1132
‑
3174.r对来自epcam 肿瘤细胞系的细胞碎片共定位(如内化)到cd40 细胞中的影响。
[0683]
材料和方法
[0684]
将人epcam 肿瘤细胞系jar用荧光膜染料pkh26(sigma
‑
aldrich)染色,然后在45℃下热休克10分钟,以诱导细胞死亡。将热休克的肿瘤细胞在37℃下孵育过夜,离心并收集含有肿瘤细胞碎片的上清液。
[0685]
将cd40 raji细胞用核染色剂hoechst 33342(0.045μg/ml,赛默飞世尔)标记。将raji 细胞与肿瘤细胞碎片和滴定浓度的1132
‑
3174.m、1132
‑
3174.r或单克隆cd40抗体1132.m2 一起培养。使用活细胞成像系统cytation5(biotek)每小时对细胞进行一次成像。分析图像并使用gen5软件(biotek)量化位于raji细胞中的肿瘤碎片数量。
[0686]
结果和结论
[0687]
数据(图13中示出)证明,1132
‑
3174.m和1132
‑
3174.r均介导cd40 细胞中epcam 肿瘤细胞碎片的定位增加,而cd40单克隆抗体则不然。
[0688]
实例13:cd40单克隆抗体1132/1133、1140/1135和1150/1151的激动作用
[0689]
背景和目的
[0690]
本研究的目的是评估单克隆人cd40激动性igg1抗体1132/1133、1140/1135和1150/1151 在人cd40转基因(hcd40tg)小鼠体内活化抗原呈递细胞(如树突状细胞和b细胞)的能力。
[0691]
材料和方法
[0692]
在实验开始时向9
‑
12周龄的雌性hcd40tg小鼠腹膜内施用100μg的1132/1133、1140/1135 或1150/1151,并且三天后再次施用。还包含了一组对照igg处理的小鼠。在第4天,即最后一次给药后一天,处死小鼠并收集脾脏。将脾脏捣碎通过细胞滤网以获得单细胞悬浮液,随后将细胞fc封闭并用抗体混合物染色,所述混合物含有针对cd11b、cd11c、cd19、cd45、 cd80、cd86和mhcii的荧光标记的抗小鼠抗体。这样做是为了通过流式细胞术基于共刺激标志物cd80和cd86的水平确定cd11c
mhcii
树突状细胞和cd19
mhcii
b细胞的活化。细胞还用fixable viability stain 450染色以评估细胞活力。
[0693]
结果和结论
[0694]
数据(图14中示出)证明,抗体克隆1132/1133和1150/1151显示出非常有效的脾树突状细胞和b细胞活化,而克隆1140/1135显示出对这些细胞群活化的非常温和的影响。
[0695]
实例14:ruby
tm
格式的cd40
‑
epcam双特异性抗体1132
‑
3174.r到表达epcam的肿瘤的定位
[0696]
背景和目的
[0697]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0698]
本研究的目的是评估与cd40单特异性1132.m2相比,施用给接种了用人epcam (mb49
‑
hepcam)转染的小鼠mb49肿瘤的c57bl/6小鼠的1132
‑
3174.r的肿瘤定位。
[0699]
材料和方法
[0700]
用2.5x10
5 mb49
‑
hepcam细胞对13
‑
14周龄的雌性c57bl/6小鼠(无论是人cd40转基因(hcd40tg)小鼠还是非hcd40tg小鼠)在右侧进行皮下接种。在接种后第10天,向小鼠腹膜内施用333μg 1132
‑
3174.r或200μg lala突变的cd40单特异性抗体1132.m2。还包含了一
组媒剂处理的小鼠。在第11天,即小鼠最后一次给药后一天,处死小鼠并收集肿瘤。将肿瘤切成碎片,用dnase和释放酶(liberase)进行酶切,并捣碎通过细胞滤网以获得单细胞悬液。将细胞fc封闭并用apc efluor780偶联的抗小鼠cd45和pe偶联的抗人igg抗体染色,以通过流式细胞术确定抗体定位到肿瘤组织的程度。细胞还用fixable viability stain 450 染色以评估细胞活力。
[0701]
结果和结论
[0702]
数据(图15中示出)证明,与1132.m2相比,1132
‑
3174.r明显更有效地定位到非hcd40tg 小鼠中的mb49
‑
hepcam肿瘤。在hcd40tg小鼠中可以观察到类似程度的1132
‑
3174.r定位。
[0703]
实例15:morrison格式的cd40
‑
5t4双特异性抗体1132
‑
1210.m到表达5t4的肿瘤的定位
[0704]
背景和目的
[0705]
1132
‑
1210.m是morrison格式的cd40
‑
5t4双特异性抗体,其中1132是指其cd40激动剂结构域,并且1210是指其5t4结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0706]
本研究的目的是评估施用给接种了用人5t4(b16
‑
h5t4)转染的小鼠b16肿瘤或b16.f10 (h5t4阴性)肿瘤的人cd40转基因(hcd40tg)小鼠的1132
‑
1210.m的肿瘤定位。
[0707]
材料和方法
[0708]
用1x105个b16.f10或b16
‑
h5t4细胞在右侧对13
‑
15周龄的雌性hcd40tg小鼠进行皮下接种。在接种后第16天和第19天,向小鼠腹膜内施用100μg野生型或lala突变的cd40 单特异性抗体,分别为1132或1132.m2。可替代地,小鼠接受485μg的高剂量1132
‑
1210.m 或1188
‑
1210m,一种同种型
‑
5t4双特异性抗体。还包含了一组媒剂处理的小鼠。在第20天,即小鼠最后一次给药后一天,处死小鼠并收集肿瘤。将肿瘤切成碎片,用dnase和释放酶 (liberase)进行酶切,并捣碎通过细胞滤网以获得单细胞悬液。将细胞fc封闭并用apcefluor780偶联的抗小鼠cd45和pe偶联的抗人igg抗体染色,以通过流式细胞术确定抗体定位到肿瘤组织的程度。细胞还用fixable viability stain 450染色以评估细胞活力。
[0709]
结果和结论
[0710]
数据(图16中示出)证明,与1132或1132.m2相比,1132
‑
1210.m和1188
‑
1210.m明显更有效地定位到b16
‑
h5t4肿瘤。在缺乏靶肿瘤抗原5t4的b16.f10肿瘤中,1188
‑
1210.m的肿瘤定位作用几乎完全减弱。这表明1132
‑
1210.m有效定位到表达5t4的肿瘤,并且这是通过1210与5t4的结合介导的。
[0711]
实例16:morrison格式的cd40
‑
epcam双特异性抗体1132
‑
3174.m的抗肿瘤作用
[0712]
背景和目的
[0713]
1132
‑
3174.m是morrison格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40 激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0714]
本研究的目的是评估接种了用人epcam(mb49
‑
hepcam)转染的小鼠mb49肿瘤或 mb49
‑
wt(hepcam阴性)肿瘤的人cd40转基因(hcd40tg)小鼠中的1132
‑
3174.m的抗肿瘤作用。
[0715]
材料和方法
[0716]
用2.5x105个mb49
‑
wt或mb49
‑
hepcam细胞在右侧对12
‑
15周龄的雌性hcd40tg小鼠进行皮下接种。在接种后第7天、第10天和第13天,向小鼠腹膜内施用100μg野生型cd40 单特异性抗体1132或250μg lala突变的等效物1132.m2。可替代地,小鼠接受333μg1132
‑
3174.m。还包含了一组媒剂处理的小鼠。经常用卡尺测量肿瘤的宽度(w)、长度(l) 和高度(h),并使用以下公式计算肿瘤体积:(w/2x l/2x h/2xπx(4/3))。
[0717]
结果和结论
[0718]
数据(图17中示出)证明,与媒剂处理的小鼠以及用1132处理的小鼠相比,用1132
‑
3174.m 处理显著减少了肿瘤体积。另外,在施用了相同剂量的1132
‑
3174.m的携带mb49
‑
wt肿瘤的小鼠中,1132
‑
3174.m的抗肿瘤作用几乎完全减弱。因此,1132
‑
3174.m在mb49肿瘤模型中具有有效的epcam依赖性抗肿瘤作用。
[0719]
实例17:ruby
tm
格式的cd40
‑
epcam双特异性抗体1132
‑
3174.r的抗肿瘤作用
[0720]
背景和目的
[0721]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0722]
本研究的目的是评估接种了用人epcam(mb49
‑
hepcam)转染的小鼠mb49肿瘤或 mb49
‑
wt(hepcam阴性)肿瘤的人cd40转基因(hcd40tg)小鼠中的1132
‑
3174.r的抗肿瘤作用。
[0723]
材料和方法
[0724]
用2.5x105个mb49
‑
wt或mb49
‑
hepcam细胞在右侧对13
‑
16周龄的雌性hcd40tg小鼠进行皮下接种。在接种后第10天、第13天和第16天,向小鼠腹膜内施用100μg野生型cd40 单特异性抗体1132或250μg lala突变的等效物1132.m2。可替代地,小鼠接受417μg1132
‑
3174.r。还包含了一组媒剂处理的小鼠。经常用卡尺测量肿瘤的宽度(w)、长度(l) 和高度(h),并使用以下公式计算肿瘤体积:(w/2x l/2x h/2xπx(4/3))。
[0725]
在替代性实验设置中,如前所述用mb49
‑
wt或mb49
‑
hepcam细胞对hcd40tg小鼠进行皮下接种,取而代之的是,在接种后的第10天、第13天和第16天,向小鼠腹膜内注射100μg 1132、100μg 1132.m2或167μg(分子量与单特异性抗体等效的剂量)或417μg(与单特异性抗体相比,分子量高2.5倍的剂量)1132
‑
3174.r。还包含了一组媒剂处理的小鼠。如前所述,经常测量肿瘤。
[0726]
结果和结论
[0727]
数据(图18中示出)证明,与媒剂处理的小鼠以及用1132处理的小鼠相比,用1132
‑
3174.r 处理显著减少了肿瘤体积。另外,在施用了相同剂量的1132
‑
3174.r的携带mb49
‑
wt肿瘤的小鼠中,1132
‑
3174.r的抗肿瘤作用几乎完全减弱。因此,1132
‑
3174.r在mb49肿瘤模型中具有有效的epcam依赖性抗肿瘤作用。
[0728]
实例18:由ruby
tm
格式的cd40
‑
epcam双特异性抗体1132
‑
3174.r诱导的免疫记忆背景和目的
[0729]
免疫调节剂被认为会诱导针对癌症的长期治疗反应,因为免疫调节剂会诱导免疫记忆。本研究的目的是证明在hcd40tg小鼠中诱导的这种免疫记忆,其中1132
‑
3174.r治疗
导致肿瘤完全消退。用相同的mb49
‑
hepcam肿瘤或缺乏hepcam表达的mb49肿瘤再次攻击这些小鼠。
[0730]
材料和方法
[0731]
研究中使用了14周龄的幼稚雌hcd40tg小鼠,或先前已接种mb49
‑
hepcam肿瘤并在用1132
‑
3174.r治疗后从肿瘤中治愈的hcd40tg小鼠。所有小鼠均在侧腹的两侧皮下(s.c.) 接种有肿瘤细胞;左侧为2.5x105个mb49
‑
hepcam细胞,并且右侧为2.5x105个mb49
‑
wt 细胞。经常用卡尺测量肿瘤的宽度(w)、长度(l)和高度(h),并使用以下公式计算肿瘤体积:(w/2x l/2x h/2xπx(4/3))。在研究期间未施用治疗。
[0732]
结果和结论
[0733]
数据(图19中示出)证明,在再次攻击的小鼠中,mb49
‑
wt和mb49
‑
hepcam肿瘤均未显示任何可检测到的生长,而在幼稚小鼠中,mb49
‑
wt和mb49
‑
hepcam肿瘤均生长良好。这表明在用1132
‑
3174.r治疗后,再次攻击的小鼠获得了对mb49肿瘤的免疫记忆,并且这种免疫记忆并非专门针对epcam。
[0734]
实例19:ruby
tm
格式的cd40
‑
epcam双特异性抗体1132
‑
3174.r的体内安全性
[0735]
背景和目的
[0736]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0737]
本研究的目的是评估1132.3174.r与单特异性抗cd40抗体相比的安全性特征。评估的参数是脾脏肿大和il
‑
6细胞因子释放。
[0738]
材料和方法
[0739]
用mb49
‑
hepcam细胞在右侧对10
‑
14周龄的雌性hcd40tg小鼠进行皮下(s.c.)接种。在接种后第10天、第13天和第16天,向小鼠腹膜内(i.p.)施用两种剂量水平的野生型cd40 单特异性抗体1132或lala突变的等效物1132.m2,分别以100μg或250μg施用。可替代地,小鼠接受167μg或417μg 1132
‑
3174.r,分子量与单特异性抗体等效的剂量水平。对照组包含用100μg参考抗cd40抗体处理的小鼠或媒剂处理的小鼠。
[0740]
在第10天和第13天在疗法治疗后4小时,通过大隐静脉收集血液,并从样品中获得血浆。根据制造商的方案(invitrogen#bms603hs)使用il
‑
6高灵敏度elisa试剂盒分析样品的il
‑
6。在第20天,即最后一次疗法治疗后4天,处死小鼠并称重脾脏。
[0741]
结果和结论
[0742]
数据(图20和21中示出)证明,与媒剂处理的对照相比,施用两种剂量的1132导致脾脏肿大和il
‑
6细胞因子释放增加。在用1132.m2处理的小鼠中,脾脏肿大以及在某种程度上细胞因子的释放不太明显。与媒剂处理的对照相比,两种剂量的1132
‑
3174.r均未导致任何脾脏肿大或il
‑
6释放。
[0743]
因此,与1132和抗cd40参考抗体相比,这些数据清楚地证明了1132.3174.r在脾脏肿大和il
‑
6细胞因子释放方面的安全性特征改善。
[0744]
实例20:由cd40
‑
epcam双特异性抗体1132
‑
3174.r在体内诱导的免疫记忆
[0745]
背景和目的
[0746]
免疫调节剂被认为会诱导针对癌症的长期治疗反应,因为免疫调节剂会诱导免疫
记忆。本研究的目的是证明在hcd40tg小鼠中诱导的这种免疫记忆,其中1132
‑
3174.r治疗导致 mb49
‑
hepcam肿瘤完全消退。用缺乏hepcam表达的mb49
‑
wt肿瘤或用无关的panc02肿瘤再次攻击这些小鼠。
[0747]
材料和方法
[0748]
研究中使用了11周龄的幼稚雌hcd40tg小鼠,或先前已接种mb49
‑
hepcam肿瘤并在用1132
‑
3174.r治疗后从肿瘤中治愈的hcd40tg小鼠。所有小鼠均在侧腹的两侧皮下接种有肿瘤细胞;左侧为2.5x105个mb49
‑
wt细胞,并且右侧为2.5x105个panc02细胞。经常用卡尺测量肿瘤的宽度(w)、长度(l)和高度(h),并使用以下公式计算肿瘤体积:(w/2x l/2x h/2 xπx(4/3))。在研究期间未施用治疗。
[0749]
结果和结论
[0750]
数据(图22中示出)证明,在再次攻击的小鼠中,只有无关的panc02肿瘤能够生长,而mb49
‑
wt肿瘤没有表现出任何可检测到的生长。然而,在幼稚小鼠中,mb49
‑
wt和panc02 肿瘤均生长良好。这表明在用1132
‑
3174.r治疗后,再次攻击的小鼠获得了对mb49肿瘤的免疫记忆,并且这种免疫记忆并不限于epcam。
[0751]
实例21:cd40
‑
epcam双特异性抗体1132
‑
3174.r对体外坏死肿瘤碎片相关抗原交叉呈递的影响
[0752]
背景和目的
[0753]
1132
‑
3174.r是一种cd40
‑
epcam双特异性抗体,其旨在结合树突状细胞(dc)上的 cd40和肿瘤碎片或肿瘤细胞外囊泡(如外泌体)上的epcam,因为epcam在多种肿瘤中过表达。这些相互作用将导致dc的活化以及dc对肿瘤碎片或肿瘤细胞外囊泡的摄取。由于肿瘤细胞外囊泡含有新抗原,这将改善新抗原衍生肽从dc到t细胞的交叉呈递,并随后导致新抗原特异性t细胞扩增。
[0754]
本研究的目的是使用模型新抗原卵清蛋白(ova)评估1132
‑
3174.r对来自坏死肿瘤碎片的抗原的dc体外交叉呈递和cd8 t细胞引发的影响。
[0755]
材料和方法
[0756]
将人epcam和膜结合鸡ova转染到鼠膀胱癌细胞系mb49中,从而产生双转染细胞系 mb49
‑
hepcam
‑
ova。收获mb49
‑
hepcam
‑
ova细胞和未转染的mb49
‑
野生型(wt)细胞,并在45℃下热休克10分钟以诱导细胞死亡,并在37℃下孵育过夜。
[0757]
通过从ot
‑
1小鼠(ova t细胞受体转基因,设被计成在mhci的背景下识别ova肽) 收集脾脏并根据制造商的方案(miltenyi biotec#130
‑
104
‑
075)使用macs分离cd8 t细胞来获得ova特异性t细胞。将分离的cd8 ot
‑
1t细胞用celltrace violet增殖染料(ctv; invitrogen c34557)标记。
[0758]
从hcd40转基因小鼠收集脾脏,并用liberase tl(roche#05401020001)和dnase i(roche #0104159001)消化组织。根据制造商的方案(miltenyi biotec#130
‑
108
‑
338)通过macs分离cd11c dc。
[0759]
在96孔板中,在有或没有100nm 1132
‑
3174.r的情况下,将100000个dc/孔与200000 个cd8 t细胞/孔和100000个坏死mb49
‑
hepcam
‑
ova或mb49
‑
wt细胞/孔一起培养。三天后,收获细胞,用针对鼠cd45、mhc ii(i
‑
a/i
‑
e)和cd8的荧光标记抗体进行染色,然后用fixable viability stain 780(bd biosciences)染色。通过流式细胞术分析样品以确定
cd40和肿瘤碎片或肿瘤细胞外囊泡(如外泌体)上的epcam,因为epcam在多种肿瘤中过表达。这些相互作用将导致dc的活化以及dc对肿瘤碎片或肿瘤细胞外囊泡的摄取。由于肿瘤细胞外囊泡含有新抗原,这将改善新抗原衍生肽从dc到t细胞的交叉呈递,并随后导致新抗原特异性t细胞扩增。
[0775]
本研究的目的是通过使用卵清蛋白(ova)作为模型新抗原来评估1132
‑
3174.r对荷瘤小鼠体内t细胞引发的影响。因此,将hcd40tg小鼠用mb49肿瘤细胞皮下接种,用hepcam 和ova双重转染(mb49
‑
hepcam
‑
ova)。这些小鼠还接受了ot
‑
1t细胞(ova t细胞受体转基因,被设计成在mhci背景下识别ova肽)的过继转移,并用1132
‑
3174.r治疗,以评估其对转移的ot
‑
1t细胞引发的影响。为了能够研究在肿瘤引流淋巴结中引发的所有ot
‑
1 细胞,还用药物fty720治疗小鼠,以防止t细胞从淋巴结中流出。
[0776]
材料和方法
[0777]
用5x105个mb49
‑
hepcam
‑
ova细胞在右侧对10
‑
13周龄的雌性hcd40tg小鼠进行皮下接种。
[0778]
在接种后第17天,根据制造商的方案(miltenyi biotec#130
‑
104
‑
075),从ot
‑
1小鼠和通过macs分离的cd8 t细胞的队列中收集脾脏。将分离的cd8 ot
‑
1t细胞用celltraceviolet增殖染料(ctv;invitrogen c34557)标记,并将1x106个细胞通过静脉注射到尾静脉中而转移到携带mb49
‑
hepcam
‑
ova肿瘤的小鼠。
[0779]
ot
‑
1t细胞转移后二十四小时,向小鼠腹膜内注射417μg 1132
‑
3174.r。还包含了一组媒剂处理的小鼠。在治疗后的另外24小时,还向小鼠施用了20μg fty720(cayman chemicals #10006292),以防止已在肿瘤引流淋巴结中引发的任何ot
‑
1t细胞流出。
[0780]
fty720治疗后两天,即接种后第21天,处死小鼠并收集肿瘤引流(腹股沟)淋巴结。将淋巴结捣碎通过细胞滤网以获得单细胞悬浮液,随后将细胞fc封闭并用抗体混合物染色,所述混合物含有针对cd11b、cd19、mhcii、nk1.1和ter119(转储通道)和cd3、cd4 和cd8以及ova(siinfekl)mhci四聚体的荧光标记的抗小鼠抗体。细胞还用fixableviability stain 780(bd biosciences)染色以评估细胞活力。通过流式细胞术分析样品以确定 1132
‑
3174.r对活cd3 cd8 ova
‑
mhci四聚体 t细胞频率的影响。
[0781]
结果和结论
[0782]
数据(图25中示出)证明,与媒剂相比,1132
‑
3174.r处理导致肿瘤引流淋巴结中ova 特异性cd8 t细胞的频率增加。这表明1132
‑
3174.r改善了携带表达ova的肿瘤的小鼠中 ova特异性t细胞的引发。
[0783]
实例24:cd40
‑
5t4双特异性抗体1132
‑
1210.m对表达cd40的细胞系中5t4 肿瘤细胞碎片的共定位(如内化)的影响
[0784]
背景和目的
[0785]
1132
‑
1210.m是morrison格式的cd40
‑
5t4双特异性抗体,其中1132是指其cd40激动剂结构域,并且1210是指其5t4结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0786]
本研究的目的是评估1132
‑
1210.m对来自5t4 肿瘤细胞系的细胞碎片共定位(如内化) 到表达cd40的细胞系中的影响。细胞碎片获自用人5t4转染的鼠ct26细胞系。
[0787]
材料和方法
软件(biotek)量化位于raji细胞中的肿瘤细胞碎片数量。
[0802]
结果和结论
[0803]
对肿瘤细胞系bxpc3、mcf7、jar和jeg执行epcam定量,以确定epcam的密度。量化数据(如图28中示出)证明,bxpc3显示出每个细胞约2.5x105个分子的epcam密度(epcam
low
),mcf7显示出每个细胞约1.5x106个分子的epcam密度(epcam
int
),jar显示出每个细胞约2x106个分子的epcam密度(epcam
hi
)并且jeg显示出每个细胞约2.5x106个分子的epcam密度(epcam
hi
)。
[0804]
内化数据(如图29中示出)证明,1132
‑
3174.r介导cd40 细胞中epcam 肿瘤细胞碎片的定位增加,而cd40单克隆抗体1132.m2则不然(a)。进一步地,数据还证明,只有在使用来自epcam
int
细胞(mcf7)或epcam
hi
细胞(jar或jeg)的肿瘤碎片时才能实现这种效应(a和b)。因此,1132
‑
3174.r需要每个肿瘤细胞至少2.5x105‑
1.5x106个分子的epcam 密度以介导肿瘤细胞碎片的有效内化。
[0805]
实例26:cd40
‑
her2双特异性抗体1132
‑
曲妥珠单抗.r对表达cd40的细胞系中her2 肿瘤细胞碎片内化的影响
[0806]
背景和目的
[0807]
1132
‑
曲妥珠单抗.r是ruby
tm
格式的cd40
‑
her2双特异性抗体,其中1132是指cd40 结合结构域,并且曲妥珠单抗是指her2结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0808]
本研究的目的是评估1132
‑
曲妥珠单抗.r对来自her2 肿瘤细胞系的细胞碎片内化到表达cd40的细胞系中的影响。细胞碎片获自具有不同内源性her2表达的不同人肿瘤细胞系。
[0809]
材料和方法
[0810]
根据制造商的方案,使用quantum simply cellular试剂盒(bangs laboratories)在肿瘤细胞系bxpc3、ht29、mcf7、ls174t和sk
‑
ov
‑
3上测量her2的细胞表面密度。
[0811]
肿瘤细胞系bxpc3、ht29、mcf7、ls174t和sk
‑
ov
‑
3用荧光膜染料pkh26 (sigma
‑
aldrich)染色,然后在45℃下热休克10分钟,以诱导细胞死亡。还包含了her2被敲低的ls174t细胞(ls174t
‑
her2 ko)作为阴性对照。将热休克的肿瘤细胞在37℃下孵育过夜,离心并收集含有肿瘤细胞碎片的上清液。
[0812]
将cd40 raji细胞用浓度为0.045μg/ml的核染色剂hoechst 33342(赛默飞世尔)标记,并与bxpc3、ht29、mcf7、ls174t、ls174t
‑
her2 ko和sk
‑
ov
‑
3肿瘤细胞碎片一起培养。将滴定浓度的双特异性抗体1132
‑
曲妥珠单抗.r或单克隆cd40抗体1132.m2添加到raji细胞和肿瘤细胞碎片的培养物。使用活细胞成像系统cytation5(biotek)每两小时对细胞进行一次成像。分析图像并使用gen5软件(biotek)量化位于raji细胞中的肿瘤碎片数量。
[0813]
结果和结论
[0814]
对肿瘤细胞系bxpc3、ht29、mcf7、ls174t和sk
‑
ov
‑
3执行her2定量,以确定her2 的密度。量化数据(如图30中示出)证明,bxpc3显示出每个细胞约3x104个分子的her2 密度(her2
low
),ht29和mcf7显示出每个细胞约7.5x104个分子的her2密度(her2
int
), ls174t显示出每个细胞约1x105个分子的her2密度(her2
int
)并且sk
‑
ov
‑
3显示出每个细胞约3x106个
分子的her2密度(her2
hi
)。ls174t
‑
her2 ko在细胞表面未显示出可检测到的her2分子(数据未示出)。
[0815]
内化数据(如图31和32中示出)证明,1132
‑
曲妥珠单抗.r介导cd40 细胞中her2 肿瘤细胞碎片的定位增加,而cd40单克隆抗体1132.m2则不然。进一步地,数据还证明,只有在使用来自her2
hi
细胞(sk
‑
ov
‑
3)的肿瘤碎片时才能实现这种效应(图31和32)。因此,1132
‑
曲妥珠单抗.r需要每个肿瘤细胞至少1x105‑
3x106个分子的her2密度以介导肿瘤细胞碎片的有效内化。
[0816]
实例27:dec
‑
205
‑
epcam双特异性抗体3g9
‑
3174.r对表达dec
‑
205的细胞系中 epcam 肿瘤细胞碎片内化的影响
[0817]
背景和目的
[0818]
3g9
‑
3174.r是ruby
tm
格式的dec
‑
205
‑
epcam双特异性抗体,其中3g9是指dec
‑
205 结合结构域,并且3174是指epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0819]
本研究的目的是评估3g9
‑
3174.r对来自epcam 肿瘤细胞系的细胞碎片内化到表达 dec
‑
205的细胞系中的影响。细胞碎片获自具有不同内源性epcam表达的不同人肿瘤细胞系。
[0820]
材料和方法
[0821]
肿瘤细胞系bxpc3、mcf7和jar用荧光膜染料pkh26(sigma
‑
aldrich)然后在45℃下热休克10分钟,以诱导细胞死亡。将热休克的肿瘤细胞在37℃下孵育过夜,离心并收集含有肿瘤细胞碎片的上清液。
[0822]
将dec
‑
205 raji细胞用浓度为0.045μg/ml的核染色剂hoechst 33342(赛默飞世尔)标记bxpc3、mcf7或jar肿瘤细胞碎片一起培养。将双特异性抗体3g9
‑
3174.r或1188
‑
3174.r (一种同种型
‑
epcam双特异性抗体)以1.2nm的浓度添加到raji细胞和肿瘤细胞碎片的培养物中。使用活细胞成像系统cytation5(biotek)每两小时对细胞进行一次成像。分析图像并使用gen5软件(biotek)量化位于raji细胞中的肿瘤细胞碎片数量。
[0823]
结果和结论
[0824]
内化数据(如图33中示出)证明,3g9
‑
3174.r介导了dec
‑
205 细胞对来自mcf7的epcam
int
碎片和来自jar的epcam
hi
碎片的定位增加,而同种型
‑
epcam双特异性抗体 1188
‑
3174.r则不然(a和b)。进一步地,数据还证明,当使用来自epcam
low
细胞系bxpc3 的碎片时,无法实现这种效应(c)。因此,3g9
‑
3174.r需要每个肿瘤细胞至少2.5x105‑
1.5x106个分子的epcam密度以介导肿瘤细胞碎片的有效内化。
[0825]
实例28:cd40
‑
epcam双特异性抗体1132
‑
3174.r对体外外泌体相关抗原交叉呈递的影响
[0826]
背景和目的
[0827]
1132
‑
3174.r是一种cd40
‑
epcam双特异性抗体,其旨在结合树突状细胞(dc)上的 cd40和肿瘤碎片或肿瘤细胞外囊泡(如外泌体(直径30
‑
200nm))上的epcam,因为epcam 在多种肿瘤中过表达。这些相互作用将导致dc的活化以及dc对肿瘤外泌体或肿瘤细胞外囊泡的摄取。由于肿瘤细胞外囊泡含有新抗原,这将改善新抗原衍生肽从dc到t细胞的交叉呈递,并随后导致新抗原特异性t细胞扩增。
[0828]
本研究的目的是使用模型新抗原卵清蛋白(ova)评估1132
‑
3174.r对来自肿瘤来源的外泌体的抗原的dc体外交叉呈递和cd8 t细胞引发的影响,并将其与双特异性同种型
ꢀ‑
epcam抗体1188
‑
3174.r进行比较。
[0829]
材料和方法
[0830]
将人epcam和膜结合鸡ova转染到鼠膀胱癌细胞系mb49中,从而产生双转染细胞系 mb49
‑
hepcam
‑
ova。
[0831]
通过与总外泌体分离试剂(invitrogen#4478359)一起在4℃下孵育过夜,从在无血清条件下培养24小时的mb49
‑
hepcam
‑
ova细胞的细胞培养基中分离外泌体。孵育后,将样品在4℃下以10,000xg离心一小时。弃去上清液,通过在管底部重新悬浮沉淀物来收集外泌体。使用0.22μm millex
‑
gv(merck millipore#slgv033rs)过滤外泌体以去除较大的颗粒。然后使用截留分子量为100,000的amicon ultra
‑
4离心过滤装置(merck millipore#ufc810024) 过滤外泌体,以去除较小的颗粒。使用uncle(unchained labs)通过动态光散射(dls)分析纯化的外泌体,以确保去除了较大和较小的颗粒。为了评估分离的外泌体的产量,使用piercebca蛋白质检测试剂盒(thermo scientific#23227)测量总蛋白质的定量。
[0832]
通过从ot
‑
1小鼠(ova t细胞受体转基因,设被计成在mhci的背景下识别ova肽) 收集脾脏并根据制造商的方案(miltenyi biotec#130
‑
104
‑
075)使用macs分离cd8 t细胞来获得ova特异性t细胞。将分离的cd8 ot
‑
1t细胞用celltrace violet增殖染料(ctv; invitrogen c34557)标记。
[0833]
从hcd40转基因小鼠收集脾脏,并用liberase tl(roche#05401020001)和dnase i(roche #0104159001)消化组织。根据制造商的方案(miltenyi biotec#130
‑
108
‑
338)通过macs分离cd11c dc。
[0834]
在96孔板中,在存在100nm 1132
‑
3174.r或1188
‑
3174.r的情况下,将100000个dc/ 孔与200000个cd8 t细胞/孔和来自mb49
‑
hepcam
‑
ova细胞/孔的2倍连续稀释的外泌体一起培养。四天后,收获细胞,用针对鼠cd45、mhc ii(i
‑
a/i
‑
e)cd11c和cd8的荧光标记抗体进行染色,然后用fixable viability stain 780(bd biosciences#565388)染色。通过流式细胞术分析样品以确定ctv低(增殖性)cd8 t细胞的频率。
[0835]
结果和结论
[0836]
动态光散射(如图34中示出)证明,分离的外泌体是同质群体,没有较大的全细胞污染。进一步地,数据(图35中示出)还证明,在具有dc和mb49
‑
hepcam
‑
ova衍生外泌体的培养物中,与1188
‑
3174.r相比,1132
‑
3174.r诱导ova特异性t细胞增殖增加。这表明 1132
‑
3174.r促进外泌体中存在的抗原的摄取和交叉呈递。
[0837]
实例29:cd40
‑
epcam双特异性抗体1132
‑
3174.r的抗肿瘤作用
[0838]
背景和目的
[0839]
1132
‑
3174.r是ruby
tm
格式的cd40
‑
epcam双特异性抗体,其中1132是指其cd40激动剂结构域,并且3174是指其epcam结合(肿瘤靶向)结构域。该抗体已经过lala突变,以使fcγ受体结合沉默。
[0840]
本研究的目的是评估接种了用人epcam(mb49
‑
hepcam)转染的小鼠mb49肿瘤或 mb49
‑
wt(hepcam阴性)肿瘤的人cd40转基因(hcd40tg)小鼠中的1132
‑
3174.r的抗肿瘤作用。
[0841]
材料和方法
[0842]
用2.5x105个mb49
‑
wt或mb49
‑
hepcam细胞在右侧对13
‑
16周龄的雌性hcd40tg小鼠进行皮下接种。在接种后第10天、第13天和第16向小鼠腹膜内施用100μg野生型cd40 单特异性抗体1132或100μg lala突变的等效物1132.m2。可替代地,小鼠接受167μg 1132
‑
3174.r(分子量与单特异性抗体等效的剂量)或417μg 1132
‑
3174.r(与单特异性抗体相比,分子量高2.5倍的剂量)。还包含了一组媒剂处理的小鼠。将小鼠留在研究中直到单个肿瘤体积达到2000mm3的伦理极限,此时处死小鼠。
[0843]
结果和结论
[0844]
数据(图36中示出)证明,与媒剂处理的小鼠以及用分子量等效剂量的1132处理的小鼠相比,用1132
‑
3174.r处理显著改善了存活率。2.5倍高剂量的1132
‑
3174.r导致肿瘤完全根除,并且小鼠100%存活。另外,在施用了相同高剂量的1132
‑
3174.r的携带mb49
‑
wt肿瘤的小鼠中,1132
‑
3174.r的抗肿瘤作用完全减弱。因此,1132
‑
3174.r在mb49肿瘤模型中具有有效的epcam依赖性抗肿瘤作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。