对细胞死亡具有增加的抗性的经修饰的免疫效应细胞
1.引言
2.本发明涉及对修饰免疫效应细胞和免疫效应细胞系以制备它们的有用的衍生物。此外,本发明涉及制备经修饰的免疫效应细胞和细胞系的方法、含有所述细胞和细胞系的组合物以及所述细胞和含有所述细胞的组合物在癌症治疗中的用途。
背景技术:
3.通常,免疫细胞需要靶细胞通过主要组织相容性复合体(major histocompatibility complex,mhc)呈递抗原,然后才能触发导致靶细胞死亡的免疫反应。这使得不呈递mhc i类的癌细胞能够逃避大部分免疫反应。
4.然而,在缺乏mhc i类表达的情况下,nk细胞能够识别癌细胞。因此,它们在机体抵御抗癌方面发挥着关键作用。
5.另一方面,在某些情况下,癌细胞通过表达结合细胞膜上的抑制性受体的配体表现出抑制例如nk细胞和t细胞的免疫效应细胞的细胞毒活性的能力。对癌症的抗性可能涉及这些因素和其他因素之间的平衡。
6.在本文中,细胞毒性(cytotoxicity)是指例如nk细胞和t细胞的免疫效应细胞,通过例如,释放细胞溶解蛋白(cytolytic proteins),或通过结合癌细胞膜上的受体并诱导所述癌细胞的凋亡(无论是直接的还是间接的)而诱导癌细胞死亡的能力。细胞毒性不仅受诱导细胞溶解蛋白释放的信号的影响,还受抑制细胞溶解蛋白释放的信号的影响。如上所述,细胞毒性的增加将因此导致更有效地杀死癌细胞,癌细胞抑制免疫效应细胞的细胞毒活性的机会更小。
7.已建议通过遗传修饰去除nk细胞上的抑制性受体功能,作为用于增加nk细胞对缺乏mhc i类表达但能够抑制nk细胞毒性的癌细胞的细胞毒性的方法(bodduluru等人,2012年)。nkg2a已被确定为在这些情况下值得沉默的抑制性受体(inhibitory receptor worth silencing),因为已知某些癌细胞表达hla
‑
e,hla
‑
e与nkg2a结合,并在缺乏mhc i类表达(shook等,2011年;wo 2006/023148)(campana d.等,2019年)的情况下抑制nk细胞的细胞毒性。
8.另一种下调nkg2a表达的方法已在nk
‑
92细胞中显示,其中显示转染编码il
‑
15的基因与nkg2a表达的减少相关(zhang等,2004年)。然而,尽管观察到nk细胞的细胞毒性增加,但该增加很可能是活化受体nkg2d表达伴随增加的结果。观察结果支持了这一观点,即阻断nk
‑
92细胞上的nkg2a受体与针对多发性骨髓瘤细胞的细胞毒性增加无关(heidenreich等,2012年)。然而,值得注意的是,nk
‑
92细胞系是一种具有极低的抑制性受体表达的高细胞毒性细胞系。因此,任何与nkg2a表达减少相关的细胞毒性的增加都可能微不足道而无法检测到。
9.在小鼠中也进行了类似的研究。例如,小鼠在nk细胞上表达一种称为ly49的受体,其类似于人抑制性kir受体。已经表明,通过用抗体片段阻断ly49受体,nk细胞具有更强的细胞毒性,并且能够在体外和体内杀死鼠白血病细胞(murine leukemia cell)(koh等,
2001年)。
10.然而,这是抑制性受体功能降低的结果,身体中的“正常”细胞也变得更容易受到修饰的nk细胞的攻击,因为修饰的nk细胞变得不太能够区分“正常”细胞和癌细胞。这种副作用是降低“典型”抑制性受体功能的一个显著缺点。
11.已知nk细胞杀死癌细胞的另一种方式是在其表面表达trail。trail配体能够结合癌细胞上的trail受体并诱导所述癌细胞的凋亡。一种推测性方法描述了为了利用这种抗癌机制(ep1621550)而在nk细胞上过表达(overexpressing)膜结合trail配体。此外,据报道il
‑
12可上调nk细胞上的trail表达(smyth等,2001年)。
12.然而,癌细胞已经发展出规避(evasive)机制和保护机制来处理表达trail的nk细胞。诱骗性trail受体(decoy trail receptors)常表达于癌细胞膜上,而trail与这些诱骗受体(如dcr1和dcr2)的结合不能诱导细胞凋亡;尚未找到克服这种机制的方法。
13.使用表达trail的nk细胞靶向癌细胞的另一个问题是某些nk细胞自身表达trail受体。因此,在某些情况下,nk细胞上的trail表达可能导致自我杀伤(fratricide)。
14.急性髓系白血病(aml)是一种造血系统恶性肿瘤,其涉及致力于髓系发育的前体细胞,并且在成人(90%)和儿童(15
‑
20%)的急性白血病中占很大比例(hurwitz,mounce等,1995年;lowenberg,downing等,1999年)。尽管80%的患者通过标准化疗获得了缓解(hurwitz,mounce等,1995年;ribeiro,razzouk等,2005年),但由于微小残留病(minimal residual disease,mrd)复发率高,存活率仍不令人满意。5年生存率与年龄有关;儿童为60%(rubnitz,2012年),65岁以下成人为40%(lowenberg,downing等,1999年),65岁以上成人为10%(ferrara和schiffer,2013年)。如果患者有合适的造血细胞供体,这些结果可以得到改善,但许多患者没有,这突出表明需要一种替代治疗方法。
15.自然杀伤(nk)细胞是细胞毒性淋巴细胞,具有不同于例如自然杀伤t(nk
‑
t)细胞的独特表型和效应子功能(effector function)。例如,虽然nk
‑
t细胞同时表达cd3和t细胞抗原受体(tcrs)二者,但nk细胞不表达。通常发现nk细胞表达标志物cd16和cd56,其中cd16起fc受体的作用并介导抗体依赖细胞介导的细胞毒作用(adcc),下文将对此进行讨论。在这方面,khyg
‑
1是一个显著的例外。尽管nk细胞具有天然的细胞毒性,但已开发出具有增强的细胞毒性的nk细胞系。nk
‑
92和khyg
‑
1代表了两种已被广泛研究并在癌症治疗中显示出前景的nk细胞系(swift等,2011年;swift等,2012年)。
16.用于癌症治疗的细胞过继免疫治疗(adoptive cellular immunotherapy)通常包括向患者施用天然的和修饰的t细胞。t细胞可以通过各种方式进行修饰,例如遗传修饰,以便表达与某些靶癌细胞特异性结合的受体和/或配体。用特异性针对癌细胞抗原的高亲和力t细胞受体(tcrs)和嵌合抗原受体(cars)转染t细胞,可引起高反应性癌症特异性t细胞应答。这种免疫治疗方法的一个主要限制是,必须从患者体内获得t细胞用于自体体外扩增,或者必须使用mhc匹配的t细胞,以避免在将细胞转移给患者后立即进行免疫根除,或在某些情况下,移植物抗宿主病(gvhd)的发作。此外,成功转移的t细胞通常在循环中存活较长时间,因此难以控制治疗产生的持续性副作用。
17.在单倍体相合骨髓移植(haploidentical bone marrow transplantation)的情况下,当存在kir抑制性受体
‑
配体错配时,移植物抗白血病效应被认为是由nk细胞介导的,这可以提高aml治疗中的存活率(ruggeri,capanni等,2002年;ruggeri,mancusi等,2005
年)。此外,在aml中接受去t造血细胞移植(t
‑
depleted hematopoietic cell transplantation,hct)的患者中,nk快速恢复与更好的结果和更强的移植物抗白血病(gvl)效应相关(savani,mielke等,2007年)。其他试验已经使用离体(ex vivo)扩增的单倍体nk细胞治疗成人(miller,soignier等,2005年)和儿童(rubnitz,inaba等,2010年)中的aml。
18.已经建立了几种永久性nk细胞系,其中最值得注意的是nk
‑
92,其来源于一名表达典型的nk细胞标志物的非霍奇金淋巴瘤患者,但cd16(fcγ受体ⅲ)除外。nk
‑
92经过了广泛的临床前测试,与活化的nk细胞和淋巴因子激活的杀伤(lak)细胞相比,对多种肿瘤表现出优异的溶解能力(gong,maki等,1994年)。已经确定nk
‑
92细胞针对原发性aml的细胞毒性(yan,steinherz等,1998年)。
19.另一种nk细胞系khyg
‑
1已被确定为临床应用的潜在竞争者(suck等,2005年),但其细胞毒性降低,因此与nk
‑
92相比受到的关注较少。已知khyg
‑
1细胞是预先激活的。与内源性nk细胞不同,khyg
‑
1细胞始终处于极化状态,增加了其细胞毒性,并使它们对外部刺激做出更快的反应。nk
‑
92细胞的基线细胞毒性(baseline cytotoxicity)高于khyg
‑
1细胞。
20.因此,很明显,当前的过继免疫治疗方案受供体效应细胞数量和质量的可变性的影响,如果有效的细胞系可用于提供更标准化的治疗,则可以消除这些变量。
21.已使用小鼠模型对nk细胞毒性进行了大量研究。一个实例是发现穿孔素和颗粒酶b mrna在小鼠nk细胞中组成型转录,但在刺激或激活nk细胞之前检测到最低水平的蛋白(fehniger等,2007年)。尽管本研究和使用小鼠nk细胞的其他研究值得关注,但不能将其作为人类nk细胞毒性的确凿证据。与上述实例相反,人类nk细胞在刺激前表达高水平的穿孔素和颗粒酶b蛋白(leong等,2011年)。结果是,当在培养物中新鲜分离小鼠或人nk细胞时,小鼠nk细胞的细胞溶解活性较弱,而人nk细胞则表现出较强的细胞溶解能力。
22.小鼠和人类nk细胞在表达标记、信号级联反应和组织分布方面也存在很大差异。例如,cd56被用作人类nk细胞的标记,而小鼠nk细胞则根本不表达这种标记。此外,调节nk细胞的细胞毒性的一个成熟机制是通过结合nk激活和抑制受体(nk activation and inhibitory receptors)的配体进行的。已知两种最突出的人类nk激活受体是nkp30和nkp44,它们都不在小鼠nk细胞上表达。关于nk抑制受体,虽然人类nk细胞表达识别mhc i类并抑制细胞毒活性的kirs,但小鼠nk细胞根本不表达kirs,而是表达ly49s(trowsdale等,2001年)。总而言之,尽管小鼠nk细胞在其自然生理环境中实现了与人类nk细胞相同的功能,但实现这一作用的机制在物种之间存在显著差异。
23.因此,存在对替代的且优选改进的免疫效应细胞和细胞系的需求,例如具有更强的细胞毒性特征。
24.本发明的一个目的是提供不易受trail诱导的细胞死亡影响和/或具有更强的细胞毒性表型的免疫效应细胞和免疫效应细胞系。另一个目的是提供用于制备修饰的免疫效应细胞和细胞系的方法,含有所述细胞或细胞系的组合物以及所述组合物在治疗癌症中的用途。更具体的实施方案旨在提供为已识别的癌症提供治疗,例如血癌,如白血病;以及实体瘤(solid tumor)。具体实施方案旨在组合免疫效应细胞和细胞系的两种以上的修饰,以进一步增强经修饰细胞的细胞毒性。
技术实现要素:
25.本文提供了经修饰的免疫效应细胞和细胞系,它们对trail诱导的细胞死亡具有抗性,并且任选地,但优选地,具有更具细胞毒性的表型。进一步地,还提供了制备所述细胞和细胞系的方法。还提供了经修饰的免疫效应细胞和细胞系的组合物,以及所述细胞和组合物用于治疗癌症的用途。
26.优选地,免疫效应细胞/细胞系选自nk细胞和t细胞。
27.本发明提供了修饰免疫效应细胞的方法,所述方法使用例如,基因工程敲除(knock out)和/或敲低(knock down)编码trail受体、抑制性受体和/或检查点抑制性受体的基因,表达编码修饰的trail受体、trail配体和变体的基因,和/或表达编码嵌合抗原受体(car)和/或fc受体的基因。
28.此外,本发明的组合物包括其中提供了两种或更多种修饰的免疫效应细胞和免疫效应细胞系,其中多重修饰(multiple modifications)进一步增强了细胞和细胞系的细胞毒活性。
29.本发明提供了已被修饰以具有对trail诱导的细胞死亡的增加的抗性的免疫效应细胞或免疫效应细胞系。所述细胞自身对trail诱导的细胞死亡具有抗性。优选地,所述细胞已经被修饰(例如遗传修饰)为具有降低的一种或多种trail受体的功能。
30.根据本发明,进一步提供了使用经修饰的免疫效应细胞系,例如nk
‑
92细胞及其衍生物治疗例如血癌和实体瘤的癌症的方法,其中所述经修饰的免疫效应细胞系任选地被进一步工程化以缺乏检查点抑制性受体的表达、表达trail配体变体和/或表达car和/或fc受体。
31.根据本发明特别可治疗的疾病包括癌症、血癌、白血病和特别是急性髓系白血病。尤其可以治疗人类的肿瘤和癌症。本文提及的肿瘤(tumour)包括提及赘生物(neoplasm)。
32.因此,本发明提供了经修饰以抵抗trail诱导的细胞死亡的免疫效应细胞或细胞系。因此,细胞可能不太容易受到trail诱导的细胞死亡或自我杀伤的影响。
33.免疫效应细胞优选为淋巴细胞。
34.在优选的实施方案中,淋巴细胞是nk细胞。nk细胞优选为原代nk细胞、khyg
‑
1细胞或nk
‑
92细胞。
35.在其他优选的实施方案中,淋巴细胞是t细胞。t细胞优选为原代t细胞或jurkat细胞。
36.如下文详细描述,免疫效应细胞已被遗传修饰以便增加它们对trail诱导的细胞死亡的抗性,且任选地增加它们对癌细胞的细胞毒活性。
37.本发明的免疫效应细胞和细胞系将一起被称为免疫效应细胞(除非上下文另有要求)。同样,t细胞应包括t细胞系,nk细胞应包括nk细胞系(除非上下文另有要求)。
38.在一系列优选的实施方案中,免疫效应细胞已被修饰以具有降低的一种或多种trail受体的功能。可选地,这通过基因敲除或敲低(例如,使用sirna)或限制trail受体在细胞内质网内的表达来实现。有利地,经修饰的细胞对通过trail信号传导途径实现的细胞死亡具有抗性或具有更高的抗性。
39.优选地,本发明的细胞上的dr4和/或dr5功能降低。特别优选将dr4和/或dr5基因敲除。如果存在多个基因拷贝,则优选全部被敲除。
40.可以使用降低细胞对trail诱导的细胞死亡的敏感性的其他方法。可选地,通过在免疫效应细胞中过表达c
‑
flip和/或通过敲低半胱天冬酶(caspase)8的表达来减少trail诱导的细胞死亡。因此,在本发明的nk细胞和t细胞中,c
‑
flip可能过表达。因此,同样,在本发明的nk细胞和t细胞中,半胱天冬酶8表达被降低或敲低或敲除。
41.可以以既减少trail诱导的细胞死亡,又为细胞提供更具细胞毒性的表型的方式修饰免疫效应细胞。优选地,同一修饰可以实现这两个优点。
42.相对于野生型免疫效应细胞,根据本发明的免疫效应细胞对trail诱导的细胞死亡的抗性优选增加至少5%,更优选至少10%,更优选至少25%,最优选至少50%。可以以本领域技术人员已知的多种方式测量对细胞死亡的抗性,例如通过进行细胞活力(cell viability assay)测定。优选地,使用流式细胞术碘化丙锭细胞活力测定法(flow cytometric propidium iodide cell viability assay)测量对细胞死亡的增加的抗性。在一个实例中,将通过一种试验来鉴定根据本发明修饰以表现出对trail诱导的细胞死亡的抗性增加至少10%的免疫效应细胞群(cell population),其中将可溶性trail与(1)修饰的细胞以及(2)野生型细胞一起孵育,然后在用碘化丙锭对每个细胞群染色后,发现经修饰的细胞群的细胞活力比野生型群至少高10%。
43.优选地,免疫效应细胞被修饰以表达连接至共刺激结构域的trail受体。该细胞可表达与一个或多个共刺激结构域连接的trail受体。优选地,trail受体选自dr4和dr5。优选地,共刺激结构域选自4
‑
1bb、cd28、2b4、dap
‑
10、dap
‑
12、cd278(icos)和ox40中的一种或多种。更优选地,共刺激结构域是连接至cd3zeta的4
‑
1bb。
44.共刺激结构域是蛋白质结构域,其提供除了由抗原受体(例如dr4或dr5)发送的信号之外的信号,并且能够帮助诱导淋巴细胞(例如nk细胞)的完全激活。免疫效应细胞的完全激活导致细胞因子产生、持续增殖、抗凋亡细胞内信号传导和/或对通过抗原受体进一步刺激的敏感性增强。总体而言,这为免疫效应细胞提供了更具细胞毒性的表型。因此,配体与连接至共刺激结构域的受体的结合激活了配体结合的这种细胞刺激结果。
45.通过与不具有这种修饰的野生型细胞的细胞毒性进行比较,来定义由免疫效应细胞的修饰导致的细胞毒性的增加或增强。野生型细胞被定义为与包含修饰的细胞类型相同但本身不含该修饰的细胞。例如,本发明提供了经修饰以表达连接至共刺激结构域cd28的dr5的nk
‑
92细胞;相对于野生型nk
‑
92细胞(即未被修饰以表达连接至cd28的dr5的nk
‑
92细胞),这些nk细胞被修饰以表现出增加的对癌细胞的细胞毒性。
46.khyg
‑
1细胞在静息时通常表达低水平的dr4和dr5。然而,当细胞被激活或受外源因子影响/暴露于外源因子时,dr4和/或dr5的表达可能会被上调。因此,根据本发明,khyg
‑
1细胞也可被适当地修饰。
47.相对于野生型免疫效应细胞,本发明的免疫效应细胞对靶(例如癌症)细胞的细胞毒性优选增加至少10%,更优选至少20%,更优选至少50%,最优选至少100%。在与免疫效应细胞共孵育期间,使用已知方法测定靶细胞死亡时,细胞毒性很容易测量。优选地,使用流式细胞术碘化丙锭细胞活力测定法测量增加的细胞毒性。在一个实例中,将通过一种试验来鉴定根据本发明修饰以表现出对癌细胞的细胞毒性增加至少10%的免疫效应细胞群,其中将靶癌细胞与(1)本发明的经修饰细胞或(2)野生型(即未经修饰的)免疫效应细胞一起孵育,然后在对每个癌细胞群染色后,发现与野生型免疫效应细胞一起孵育的那些癌细
胞的细胞存活力比与经修饰的免疫效应细胞群一起孵育的癌细胞高至少10%。
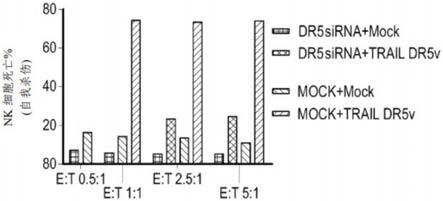
48.有利地,连接至一个或多个共刺激结构域的trail受体与本发明免疫效应细胞表面上的已有trail受体竞争,从而限制trail与这些诱导死亡的trail受体的结合。此外,表达与共刺激结构域连接的trail受体的免疫效应细胞在与trail结合时产生激活信号,这增加了免疫效应细胞的细胞毒活性。当使用经修饰的免疫效应细胞治疗癌症时,这可能是一个特别有利的特征。
49.在本发明的所有系列实施方案中,可以提供具有降低的或缺少检查点抑制性受体功能的免疫效应细胞。本发明的这种免疫效应细胞优选具有一个或多个被敲除的检查点抑制性受体基因。优选地,这些受体是特异性检查点抑制性受体。仍然优选地,这些检查点抑制性受体是cd96(tactile)、cd152(ctla4)、cd223(lag
‑
3)、cd279(pd
‑
1)、cd328(siglec7)、siglec9、tigit和tim
‑
3中的一种或多种或全部。
50.在其他实施方案中,提供了免疫效应细胞,其中一种或多种抑制性受体信号通路被敲除或表现出功能降低—结果再次是抑制性受体功能降低或缺失。例如,通过细胞的遗传修饰敲除由shp
‑
1、shp
‑
2和/或ship介导的信号通路。
51.由此产生的免疫效应细胞表现出改善的细胞毒性,因此在癌症治疗,尤其是血癌治疗,特别是在白血病和/或多发性骨髓瘤的治疗中具有更大的用途。
52.遗传修饰可能发生在细胞分化为成熟的免疫效应细胞之前。例如,多能干细胞(例如ipsc)可经遗传修饰而丧失表达一种或多种检查点抑制性受体的能力。然后使经修饰的ipsc分化以制备细胞毒性增加的经遗传修饰的免疫效应细胞。
53.由于检查点抑制性受体在免疫效应细胞激活后表达,因此与其他抑制性受体相比,优选降低检查点抑制性受体的功能。正常或“典型”抑制性受体,如大多数kir家族、nkg2a和lir
‑
2,与mhc i类结合,因此主要参与减少自我靶向问题。因此,优选地,敲除检查点抑制性受体。根据本发明,这些受体的功能降低或缺失可防止癌细胞抑制免疫效应子功能(如果受体完全发挥功能,则可能发生这种情况)。因此,本发明这些实施方案的关键优势在于免疫效应细胞对癌细胞抑制其细胞毒活性不太敏感;因此,它们可用于癌症治疗。
54.如本文所用,提及抑制性受体,通常是指在免疫效应细胞,例如nk细胞的质膜上表达的受体,由此结合其互补配体产生负责降低所述免疫效应细胞的细胞毒性的细胞内信号。这些抑制性受体在免疫效应细胞的“静息”和“激活”状态期间均表达,并且通常与向免疫系统提供抑制针对身体细胞和组织的细胞毒性应答的“自我耐受”机制有关。一个实例是抑制性受体家族“kir”,其在nk细胞上表达并识别在身体健康细胞上表达的mhc i类。
55.同样如本文所用,检查点抑制性受体通常被认为是上文一般提及的抑制性受体的子集。然而,与其他抑制性受体不同,检查点抑制性受体在免疫效应细胞,例如nk细胞的持续激活和细胞毒性过程中以更高水平表达。这种现象对于抑制例如炎症部位的慢性细胞毒性是有用的。实例包括检查点抑制性受体pd
‑
1、ctla
‑
4和cd96,它们都在nk细胞上表达。
56.本发明的免疫效应细胞也可能缺乏编码检查点抑制性受体的基因,所述检查点抑制性受体选自cd96(tactile)、cd152(ctla4)、cd223(lag
‑
3)、cd279(pd
‑
1)、cd328(siglec7)、siglec9、tigit和tim
‑
3。
57.缺乏基因的免疫效应细胞可以指完全缺失或部分缺失、突变或其他导致基本上没有功能性基因产物被表达的情况。本发明人先前已经表明了使用sirna敲低khyg
‑
1细胞中
的检查点抑制性受体的表达的细胞毒性作用。cd96敲低(kd)的khyg
‑
1细胞在效应子:靶(e:t)的各种比率下表现出对白血病细胞的增强的细胞毒性。在实施方案中,免疫效应细胞缺乏编码两种以上抑制性受体的基因。
58.更具体的实施方案包括缺乏编码选自cd96(tactile)、cd152(ctla4)和cd279(pd
‑
1)的检查点抑制性受体的基因的免疫效应细胞。
59.在进一步优选的实施方案中,免疫效应细胞是以下细胞的衍生物:原代t细胞、nk细胞或nk
‑
92nk细胞。所述nk细胞也可以是khyg
‑
1细胞的衍生物。
60.优选本发明的免疫效应细胞进一步表达突变体(变体)trail配体。因此,免疫效应细胞的细胞毒性增强修饰也包括trail配体和/或突变的trail配体变体二者的增加表达。
61.产生的免疫效应细胞表现出与trail受体的结合增加,因此,对癌症,尤其是血癌,特别是白血病的细胞毒性增加。然而,由于上文和下文所述的修饰,本发明的免疫效应细胞对trail诱导的细胞死亡较不敏感。
62.与野生型trail与诱骗受体的结合相比,突变体/变体优选对“诱骗”受体具有较低的亲和力(或实际上没有亲和力)。这类诱骗受体代表了一类与trail配体结合,但不具有引发细胞死亡的能力,并且在某些情况下起拮抗死亡信号通路的作用的trail受体。可根据wo 2009/077857制备突变体/变体trail配体。
63.突变体/变体可以分别对trail受体,例如dr4和dr5,具有增加的亲和力。通常已知野生型trail的k
d
对于dr4>2nm,对于dr5>5nm,且对于诱骗受体dcr1>20nm(wo 2009/077857;通过表面等离子体共振(surface plasmon resonance)测得),或对于dr4约为50至100nm,对于dr5约为1至10nm,且对于dcr1约为175至225nm(truneh,a等,2000年;通过等温滴定量热法(isothermal titration calorimetry)和elisa法测得)。因此,根据定义的分析,对dr4的亲和力增加宜分别定义为k
d
<2nm或<50nm,而对dr5的亲和力增加宜分别定义为k
d
<5nm或<1nm。对诱骗受体dcr1的亲和力降低宜分别定义为k
d
>50nm或>225nm。在任何情况下,trail变体/突变体表现出的亲和力的增加或减少是相对于野生型trail表现出的基线亲和力而言的。与野生型trail表现出的亲和力相比,亲和力优选增加至少10%、至少25%、至少50%、更优选至少100%。
64.与其对野生型trail的亲和力相比,trail变体优选对dr4和dr5中的一种或两种具有增加的亲和力。优选地,对dr4和/或dr5的亲和力是对野生型trail的至少1.5倍、2倍、5倍、10倍、100倍、或甚至1000倍以上。
65.在特定情况下,与其对dr4、dcr1和dcr2的亲和力相比,trail变体对dr5的亲和力可能增加。优选地,trail变体对dr5的亲和力是对dr4、dcr1和dcr2中的一种或多种的亲和力的至少1.5倍、2倍、5倍、10倍、100倍或甚至1000倍以上。更优选地,trail变体对dr5的亲和力是对dr4、dcr1和dcr2中的至少两种(优选全部)的亲和力的至少1.5倍、2倍、5倍、10倍、100倍或甚至1000倍以上。
66.进一步的具体实施方案包括表达突变的trail配体的免疫效应细胞,所述突变的trail配体对trail诱骗受体的亲和力降低或没有亲和力。优选地,该免疫效应细胞是nk
‑
92的衍生物。进一步的具体实施方案包括表达突变的trail配体的免疫效应细胞,所述突变的trail配体对trail诱骗受体的亲和力降低或没有亲和力,而对dr4和/或dr5的亲和力增加。
67.本发明的这些实施方案的关键优势在于与野生型细胞相比具有多种修饰并且在
杀死癌细胞方面具有更大的潜力的免疫效应细胞。
68.在某些实施方案中,trail变体在选自131、149、159、160、189、191、193、195、199、200、201、203、204、212、213、214、215、218、240、251、261、264、266、267、269和270的位置包含至少一个氨基酸取代。
69.在某些实施方案中,trail变体包含至少一个选自以下的取代:g131r、g131k、r149i、r149m、r149n、r149k、s159r、g160e、y189a、y189q、r191k、q193h、q193k、q193s、q193r、e195r、n199v、n199r、n199h、t200h、k201r、k201h、d203a、k204e、k204d、k204y、k212r、y213w、t214r、s215d、s215e、s215h、s215k、s215d、d218h、d218a、y240a、k251d、k251e、k251q、t261l、h264r、i266l、d267q、d269a、d269h和h270d。
70.在某些实施方案中,trail变体包含至少两个选自以下的取代:g131r、g131k、r149i、r149m、r149n、r149k、s159r、g160e、y189a、y189q、r191k、q193h、q193k、q193s、q193r、e195r、n199v、n199r、n199h、t200h、k201r、k201h、d203a、k204e、k204d、k204y、k212r、y213w、t214r、s215d、s215e、s215h、s215k、s215d、d218h、d218a、y240a、k251d、k251e、k251q、t261l、h264r、i266l、d267q、d269a、d269h和h270d。
71.在某些实施方案中,trail变体包含至少三个选自以下的取代:g131r、g131k、r149i、r149m、r149n、r149k、s159r、g160e、y189a、y189q、r191k、q193h、q193k、q193s、q193r、e195r、n199v、n199r、n199h、t200h、k201r、k201h、d203a、k204e、k204d、k204y、k212r、y213w、t214r、s215d、s215e、s215h、s215k、s215d、d218h、d218a、y240a、k251d、k251e、k251q、t261l、h264r、i266l、d267q、d269a、d269h和h270d。
72.在某些实施方案中,trail变体的氨基酸取代选自:g131r、g131k、r149i、r149m、r149n、r149k、s159r、g160e、y189a、y189q、r191k、q193h、q193k、q193s、q193r、e195r、n199v、n199r、n199h、t200h、k201r、k201h、d203a、k204e、k204d、k204y、k212r、y213w、t214r、s215d、s215e、s215h、s215k、s215d、d218h、d218a、y240a、k251d、k251e、k251q、t261l、h264r、i266l、d267q、d269a、d269h、h270d、t214r/e195r、t214r/d269h、y189a/q193s/n199v/k201r/y213w/s215d、y213w/s215d、n199r/k201h、n199h/k201r、g131r/n199r/k201h、g131r/n199r/k201h/r149i/s159r/s215d、g131r/r149i/s159r/s215d、g131r/n199r/k201h/r149i/s159r/s215d、g131r/d218h、y189q/r191k/q193r/h264r/i266l/d267q、t261l/g160e、t261l/h270d、t261l/g160e/h270d以及t261l/g160e/h270d/t200h(使用“/”表示多个氨基酸取代)。
73.在某些实施方案中,基于对dr5具有增加的亲和力的变体来选择trail变体的氨基酸取代;这种取代可以选自:d269h、e195r、t214r、d269h/e195r、t214r/e195r、t214r/d269h、n199v、y189a/q193s/n199v/k201r/y213w/s215d、y213w/s215d、d269a和y240a。
74.在某些实施方案中,基于对dr4具有增加的亲和力的变体来选择trail变体的氨基酸取代;这种取代可以选自g131r、g131k、r149i、r149m、r149n、r149k、s159r、q193h、w193k、n199r、n199r/k201h、n199h/k201r、g131r/n199r/k201h、g131r/n199r/k201h、g131r/n199r/k201h/r149i/s159r/s215d,g131r/r149i/s159r/s215d、g131r/d218h、k201r、k201h、k204e、k204d、k204l、k204y、k212r、s215e、s215h、s215k、s215d、d218h、k251d、k251e、k251q以及y189q/r191k/q193r/h264r/i266l/d267q。
75.在某些实施方案中,基于对trail诱骗受体具有降低的亲和力的变体来选择trail
变体的氨基酸取代;这种取代可选自t261l、h270d、t200h、t261l/g160e、t261l/h270d、t261l/g160e/h270d、t261l/g160e/h270d/t200h、d203a和d218a。
76.本发明人先前已经对nk细胞进行了遗传修饰,以表达突变的trail。经修饰的khyg
‑
1细胞和nk
‑
92细胞表达突变的trail。经修饰的khyg
‑
1细胞在体外表现出对癌细胞系的改善的细胞毒性。这些细胞系表达trail受体(例如dr4和dr5)。经修饰的免疫效应细胞的其他优选实施方案不表达或基本上不表达trail受体,或仅在低水平下表达
‑
足够低以致经修饰的免疫效应细胞的活力不受突变的trail表达的不利影响。此外,如本文所述,可以使用具有连接至共刺激结构域的trail受体的免疫效应细胞。
77.在一个任选的实施方案中,通过向患者施用能够上调癌细胞上的trail死亡受体的表达的药剂(agent)来增强使用表达trail或trail变体的经修饰的免疫效应细胞对癌症的治疗。该药剂可在施用经修饰的免疫效应细胞之前施用、与免疫效应细胞联合施用或在施用经修饰的免疫效应细胞之后施用。然而,优选在施用经修饰的免疫效应细胞之前施用所述剂。在一个优选的实施方案中,所述药物上调癌细胞上dr5的表达。该药剂可以任选地是化疗药物,例如硼替佐米,并且以能够上调癌细胞上的dr5表达的低剂量给药。本发明不限于能够上调dr5表达的任何特定药剂,但dr5诱导剂的实例包括硼替佐米、吉非替尼、哌隆明(piperlongumine)、阿霉素、α
‑
生育酚琥珀酸酯(alpha
‑
tocopheryl succinate)和hdac抑制剂。
78.也可以将突变体/变体trail配体连接至一个或多个免疫效应细胞共刺激结构域,例如41bb/cd137、cd3zeta/cd247、dap12或dap10。变体与其受体在靶细胞上的结合因此促进靶细胞内的凋亡信号,并进一步刺激了免疫效应细胞中的细胞毒性信号。
79.根据本发明的进一步优选的实施方案,提供了修饰的免疫效应细胞,其另外还具有降低的检查点抑制性受体功能并且还表达突变的trail配体,如上文关于这些各自的免疫效应细胞修饰更详细描述的。
80.本发明还提供了经修饰以表达一种或多种car的免疫效应细胞和免疫效应细胞系,优选nk
‑
92细胞及其衍生物。
81.适用于癌症治疗用途地,car特异性结合至癌细胞上的一种或多种配体,例如骨髓瘤细胞上的cs1(slamf7)。对于治疗特定癌症的用途,例如多发性骨髓瘤,car可结合cd38。例如,car可包括例如衍生自、类似于或等同于来自已知单克隆抗体达雷妥尤单抗(daratumumab)的可变区的结合特性。这种免疫效应细胞可与抑制血管生成的药剂,例如来那度胺联合用于癌症治疗。为了用于治疗癌症,特别是白血病,尤其是aml,car可与cll
‑
1结合。
82.car
‑
nk细胞和car
‑
t细胞可能是双特异性的,其中它们对两种不同的配体/抗原具有亲和力。双特异性car可用于增加癌细胞上潜在结合位点的数量,或可选地,用于将癌细胞定位于表达car特异性配体的其他免疫效应细胞。为了用于癌症治疗,双特异性car可以结合至靶肿瘤细胞和结合至效应细胞,例如t细胞、nk细胞或巨噬细胞。因此,例如,在多发性骨髓瘤的情况下,双特异性car可结合t细胞抗原(例如cd3等)和肿瘤细胞标记物(例如cd38等)。双特异性car可以选择性地结合两种单独的肿瘤细胞标志物,从而增加免疫效应细胞对靶肿瘤细胞的总结合亲和力。这可降低癌细胞通过下调靶抗原之一来产生耐药性的风险。在这种情况下,多发性骨髓瘤中的一个实例是car与cd38和cs
‑
1/slamf7结合。car适
当靶向的另一种肿瘤细胞标志物是肿瘤上的“不要吃我(don’t eat me)”型标志物,例如cd47。
83.本发明的可选特征包括提供对上述免疫效应细胞和免疫效应细胞系的进一步修饰,其中,例如,在细胞的表面上表达fc受体(其可以是cd16、cd32或cd64,包括亚型和衍生物)。在使用中,这些细胞可以表现出对抗体包覆的癌细胞的识别增加,并改善细胞毒性反应的激活。
84.本发明的进一步可选特征包括使经修饰的免疫效应细胞和免疫效应细胞系适应更好地归巢于身体的特定靶区。本发明的免疫效应细胞可以靶向特定的癌细胞位置。在用于治疗血癌的优选实施方案中,本发明的免疫效应细胞适于归巢于骨髓。特异性免疫效应细胞通过岩藻糖基化和/或唾液酸化进行修饰,归巢于骨髓中。这可以通过遗传修饰免疫效应细胞以分别表达合适的岩藻糖基转移酶和/或唾液酰基转移酶来实现。免疫效应细胞向肿瘤部位的归巢增加也可以通过破坏肿瘤脉管系统(例如,通过节拍式化疗(metronomic chemotherapy))或通过使用靶向血管生成的药物(melero等,2014年)来使免疫效应细胞经由癌血管的浸润正常化来实现。
85.本发明的又一任选特征是提供具有增加的用于在培养物中快速生长和增殖的内在能力的经修饰的免疫效应细胞和免疫效应细胞系。这可以通过例如转染细胞以表达或过表达一种或多种生长诱导细胞因子(growth
‑
inducing cytokine)来实现。用于此目的的合适的细胞因子的实例包括il
‑
2和il
‑
15。此外,这种可选的改变(alteration)提供了一种具有成本效益的替代方法,以连续地用细胞因子补充生长培养基。
86.优选使用il
‑
15扩增原代nk细胞,因为已观察到在il
‑
2的存在下扩增原代nk细胞可能会上调dr5表达,从而使细胞更易受自我杀伤的影响。
87.本发明还提供了一种制备经修饰的免疫效应细胞或免疫效应细胞系的方法,包括对本文所述的细胞或细胞系进行遗传修饰,以使其对trail诱导的细胞死亡更具抗性和/或增加其细胞毒性。这种遗传修饰可以是例如通过crispr对基因的稳定敲除,或者是例如通过sirna对基因的瞬时敲低。
88.在一个优选的实施方案中,为了提供具有增加的对trail诱导的细胞死亡的抗性和增加的细胞毒性的新的免疫效应细胞系(如上所述),例如nk
‑
92细胞的衍生物,使用了稳定的遗传修饰技术,例如crispr。
89.在实施方案中,所述方法还可用于制备已被修饰以降低抑制性受体功能的免疫效应细胞或免疫效应细胞系。优选地,这些抑制性受体是检查点抑制性受体。
90.更具体的实施方案包括用于制备具有降低的抑制性受体功能的免疫效应细胞或免疫效应细胞系的方法,其中所述检查点抑制性受体选自cd96(tactile)、cd152(ctla4)、cd223(lag
‑
3)、cd279(pd
‑
1)、cd328(siglec7)、siglec9、tigit和tim
‑
3。
91.在优选的实施方案中,该方法包括修饰免疫效应细胞以降低两种或更多种抑制性受体的功能。
92.本发明还进一步提供了制备经修饰的免疫效应细胞或免疫效应细胞系的方法,其包括对所述细胞或细胞系进行遗传修饰以表达trail配体或突变的trail(变体)配体。
93.在实施方案中,该方法包括对免疫效应细胞或免疫效应细胞系进行修饰以表达对trail受体具有增加的亲和力的突变的trail配体。优选地,trail受体是dr4和/或dr5。优选
的实施方案提供了一种对免疫效应细胞或免疫效应细胞系进行修饰以表达对诱骗trail受体具有降低的亲和力的突变的trail配体的方法。
94.在进一步优选的实施方案中,该方法包括对免疫效应细胞或免疫效应细胞系进行修饰以去除检查点抑制性受体的功能,并且还表达对诱骗trail受体具有降低的结合亲和力或没有结合亲和力的突变的trail配体。
95.进一步的典型实施方案提供了用于制备免疫效应细胞或免疫效应细胞系的方法,其中一种或多种检查点抑制性受体的功能已被去除和/或表达了突变的trail配体,其对诱骗trail受体的结合亲和力降低或没有结合亲和力,并且所述细胞被进一步修饰以表达car或双特异性car。car的特性可选地如上所述。
96.在实施方案中,该方法包括制备免疫效应细胞或免疫效应细胞系,其中一种或多种检查点抑制性受体的功能已被去除和/或表达了突变的trail配体,其对诱骗trail受体的结合亲和力降低或没有结合亲和力,并且所述细胞任选地被修饰以表达car或双特异性car,并且所述细胞被进一步修饰以表达一种或多种fc受体。合适的fc受体选自cd16(fcrⅲ)、cd32(fcrⅱ)和cd64(fcrⅰ)。
97.所有上述的优选实施方案包括制备nk细胞和nk细胞系的方法,并且nk细胞系是nk
‑
92的衍生物。
98.根据本发明的目的,具有增加的细胞毒性的经修饰的免疫效应细胞、免疫效应细胞系或它们的组合物用于治疗患者中的癌症,特别是血癌,特别是人类中的癌症。
99.在优选的实施方案中,经修饰的免疫效应细胞、免疫效应细胞系或组合物用于治疗血癌,所述血癌包括急性淋巴细胞白血病(all)、急性髓系白血病(aml)、慢性淋巴细胞白血病(cll)、慢性髓系白血病(cml)、霍奇金淋巴瘤、包括t细胞淋巴瘤和b细胞淋巴瘤的非霍奇金淋巴瘤、无症状骨髓瘤(asymptomatic myeloma)、冒烟型多发性骨髓瘤(smoldering multiple myeloma,smm)、活性骨髓瘤(active myeloma)或轻链骨髓瘤。
100.在甚至更优选的实施方案中,nk细胞系作为如本发明所述的nk
‑
92的衍生物而获得,任选地通过降低nk
‑
92细胞中的检查点抑制性受体功能或在nk
‑
92细胞中表达突变的trail配体或通过两种方式进行额外修饰,用于治疗血癌。
101.本文的上下文所述的修饰的免疫效应细胞、免疫效应细胞系及它们的组合物适用于治疗癌症,特别是人类中的癌症,例如用于治疗血细胞癌或实体癌。免疫效应细胞和衍生物优选为人类免疫效应细胞。对于人体治疗,优选使用人类免疫效应细胞。
102.本领域技术人员已知各种给药途径以将活性剂及其组合物递送至有需要的患者。本发明的实施方案用于血癌治疗。经修饰的免疫效应细胞和/或免疫效应细胞系的施用可以是全身性的或局部的,例如通过腹膜内(intraperitoneal)途径。
103.在其他实施方案中,活性剂被更直接地施用。因此,给药可以直接在肿瘤内进行,尤其适用于实体瘤。
104.一般认为免疫效应细胞适用于本发明的方法、用途和组合物。根据本文某些实施例中使用的细胞,nk细胞/t细胞可以是从癌细胞系获得的nk细胞/t细胞。有利地,nk/t细胞,优选被处理,例如通过使其死亡和/或不能分裂,以降低其致肿瘤性(tumourigenicity),可以从血癌细胞系获得并用于本发明治疗血癌的方法中。
105.为了使癌衍生细胞对于治疗用途更可接受,通常以某种方式对其进行处理或预处
理,以降低或消除其在患者中形成肿瘤的倾向。经特定修饰的nk细胞系,例如nk
‑
92细胞是安全的,因为它们可能变得不能分裂;它们被辐射并保持其杀伤能力,但在约3
‑
4天内死亡。因此,例如由于辐射,特定细胞和细胞系不能增殖。用于本文的方法中的潜在免疫效应细胞的处理包括辐射以防止它们在体内分裂并形成肿瘤,和遗传修饰以降低致肿瘤性,例如插入编码可被激活以防止细胞在体内分裂和形成肿瘤的自杀基因(suicide gene)的序列。自杀基因可由外源性的,例如循环的药剂开启(turned on),然后在表达该基因的细胞中导致细胞死亡。另一种选择是使用靶向疗法的特异性免疫效应细胞的单克隆抗体。例如,cd52在khyg
‑
1细胞上表达,单克隆抗体与该标志物的结合会导致抗体依赖性细胞介导的细胞毒性(antibody
‑
dependent cell
‑
mediated cytotoxicity,adcc)和khyg
‑
1细胞死亡。
106.正如suck等人在2006年发表的一篇文章中所讨论的,使用3000elan等辐照器可以轻松地对癌源性nk细胞和细胞系进行辐照。铯
‑
137源用于控制辐射剂量,例如,1gy至50gy之间的剂量响应曲线可用于确定消除细胞增殖能力的最佳剂量,同时保持增加细胞毒性的益处。这是通过在施用每剂辐射后测定细胞的细胞毒性来实现。
107.与成熟的自体或mhc匹配的t细胞方法相比,使用经辐照的nk细胞系进行过继性细胞免疫治疗具有显著优势。首先,使用具有高度增殖特性的免疫效应细胞系意味着可以更容易地在商业水平上实现经修饰的nk细胞系的扩增。然后可以在将细胞施用于患者之前对经修饰的免疫效应细胞系进行辐照。这些受辐照的细胞保留了其有用的细胞毒性,具有有限的寿命,并且与经修饰的t细胞不同,不会长时间循环而导致持续的副作用。
108.此外,使用同种异体经修饰的免疫效应细胞和免疫效应细胞系意味着患者中的mhc i类表达细胞不能以与抑制自体免疫效应细胞的细胞毒性应答相同的方式抑制免疫效应细胞细胞毒性应答。使用同种异体免疫效应细胞和细胞系杀死癌细胞受益于前面提到的gvl效应,并且与自体t细胞不同,同种异体免疫效应细胞和细胞系不刺激gvhd的发生,使得它们成为通过过继性细胞免疫疗法治疗癌症的更优选的选择。
109.实施方案
110.根据本发明,提供了以下实施方案:
111.1.一种免疫效应细胞或免疫效应细胞系,所述免疫效应细胞或免疫效应细胞系已被修饰以具有对trail诱导的细胞死亡的增加的抗性。
112.2.根据实施方案1所述的免疫效应细胞或免疫效应细胞系,其中所述免疫效应细胞是nk细胞。
113.3.根据实施方案1所述的免疫效应细胞或免疫效应细胞系,其中所述免疫效应细胞是t细胞。
114.4.根据任一项前述实施方案所述的免疫效应细胞或免疫效应细胞系,其中对trail诱导的细胞死亡的抗性相对于野生型免疫效应细胞增加至少10%。
115.5.根据任一项前述实施方案所述的免疫效应细胞或免疫效应细胞系,其被修饰以敲低或敲除一个或多个trail受体基因的表达。
116.6.根据任一项前述实施方案所述的免疫效应细胞或免疫效应细胞系,其表达或经修饰以表达连接至共刺激结构域的trail受体。
117.7.根据实施方案5或6所述的免疫效应细胞或免疫效应细胞系,其中所述trail受体选自dr4和dr5。
118.8.根据实施方案6或7所述的免疫效应细胞或免疫效应细胞系,其中所述共刺激结构域选自4
‑
1bb、cd28、2b4、dap
‑
10、dap
‑
12、cd278(icos)和ox40。
119.9.根据任一项前述实施方案所述的免疫效应细胞或免疫效应细胞系,其进一步表达或被修饰以表达突变的trail配体。
120.10.根据实施方案9所述的免疫效应细胞或免疫效应细胞系,其中所述突变的trail配体具有增加的对例如dr4和/或dr5的trail受体的亲和力。
121.11.根据任一项前述实施方案所述的免疫效应细胞或免疫效应细胞系,其中所述细胞系是nk
‑
92或khyg
‑
1或它们的衍生物。
122.12.根据任一项前述实施方案所述的免疫效应细胞或免疫效应细胞系,其用于治疗患者的癌症。
123.13.根据实施方案12所述的用途的免疫效应细胞或免疫效应细胞系,其中所述癌症是血癌。
124.14.根据实施方案13所述的用途的免疫效应细胞或免疫效应细胞系,其中所述血癌是急性淋巴细胞白血病(acute lymphocytic leukemia,all)、急性髓系白血病(acute myeloid leukemia,aml)、慢性淋巴细胞白血病(cll)、慢性髓系白血病(chronic myeloid leukemia,cml)、霍奇金淋巴瘤、包括t细胞淋巴瘤和b细胞淋巴瘤的非霍奇金淋巴瘤、无症状骨髓瘤(asymptomatic myeloma)、冒烟型多发性骨髓瘤(smoldering multiple myeloma,smm)、活性骨髓瘤(active myeloma)或轻链骨髓瘤(light chain myeloma)。
125.15.一种nk
‑
92细胞或khyg
‑
1细胞,所述nk
‑
92细胞或khyg
‑
1细胞经过修饰以表达连接至共刺激结构域的trail受体。
126.16.根据实施方案15所述的nk
‑
92细胞或khyg
‑
1细胞,其中所述trail受体选自dr4和dr5。
127.17.根据实施方案15或16所述的nk
‑
92细胞或khyg
‑
1细胞,其中所述共刺激结构域选自4
‑
1bb、cd28、2b4、dap
‑
10、dap
‑
12、cd278(icos)和ox40。
128.现在参照附图以特定实施方案说明本发明,其中:
129.图1示出了通过敲低dr5表达来减轻nk细胞自我杀伤;
130.图2示出了dr5在t细胞上的表达;
131.图3示出了用dr5
‑
41bb嵌合体转染t细胞;
132.图4示出了通过dr5
‑
41bb嵌合体的表达减轻trail诱导的t细胞死亡;
133.图5示出了dr5在nk细胞上的表达;
134.图6示出了用dr5
‑
41bb嵌合体转染nk细胞。
135.dna、rna和氨基酸序列参见下文,其中:
136.seq id no:1是dr5的grna的一个实例;
137.seq id no:2是dr4的grna的一个实例;
138.seq id no:3是dr4的grna的第二实例;
139.seq id no:4是dr5
‑
41bb嵌合体dna序列。
实施例
140.现在,关于免疫效应细胞的制备,本发明以更多和更具体的细节进行描述,所述免
疫效应细胞被修饰以表现出对trail诱导的细胞死亡的降低的敏感性和/或更强的细胞毒活性,并因此提高了引起人类中的癌细胞死亡的能力。
141.关于检查点抑制性受体功能的敲除/敲低和突变型trail的敲入的相关实例,参见wo 2017/017184。
142.实施例1nk细胞trail受体dr4和dr5的敲除
143.如下制备去除了死亡受体5(dr5)和/或死亡受体4(dr4)功能的nk细胞。
144.设计并制备了靶向trail
‑
r2(dr5)和trail
‑
r1(dr4)的grna构建体(例如seq id no:1:cccaucuugaacauaccag(dr5),seq id no:2:aaccggugcacagagggugu(dr4)以及seq id no:3:auuuacaagcuguacauggg(dr4))以靶向nk细胞中编码dr5基因和编码dr4基因的内源基因(endogenous genes encoding dr5 and dr4gene(s))。然后使用crispr/cas9基因组编辑敲除dr5靶基因和/或dr4靶基因。
145.总共为dr5基因选择了3个候选grna,并测定了它们在rpmi8226细胞中的切割效率(cleavage efficacy)。总共为dr4基因选择了3个候选grna基因,并测定了它们在hl60细胞中的切割效率。使用gt用grna:cas9核糖核蛋白(rnp)复合物对rpmi8226细胞和hl60进行电穿孔,随后敲除dr5和/或通过流式细胞术进行分析。还使用体外错配检测分析法(in vitro mismatch detection assay)测定了grna的切割活性。t7e1核酸内切酶识别并切割非完全匹配的dna,在crispr/cas9转染和非同源末端连接(nhej)后,可将亲本dr5基因/dr4基因与突变基因进行比较。
146.选择具有最高的ko效率的grna进行进一步实验,以在原代nk细胞、nk细胞系或cd34 祖细胞中敲除dr5/dr4(用于后续分化和扩增为nk细胞)。dr4/dr5的敲除通过基于流式细胞术的分析进行测定。
147.实施例2nk细胞中的trail受体dr4和dr5的敲低
148.通过电穿孔对nk
‑
92细胞、khyg
‑
1细胞和原代nk细胞中的dr4和/或dr5进行sirna敲低。由于其适用于nk细胞,且可成功转染分裂细胞和非分裂细胞,并实现高达90%的转染效率,因此可与购自lonza的amaxa核转染剂ⅱ一起使用核转染试剂盒t。
149.将nucleofector(核转染)溶液加热至室温(每份样本100ul)。在50ml试管中,也将一份含有血清和补充剂的培养基在37℃下预热。通过加入4ml含有血清和补充剂的培养基制备6孔板。将该板在加湿的37℃/5%co2的培养箱中预培养。
150.在100μl核转染溶液中将2
×
106个细胞与20μm sirna溶液轻轻混合以达到2μm的最终浓度。混合过程中避免出现气泡。将混合物转移至amaxa认证的比色皿中,并将其放入nucleofector比色皿固定器(cuvette holder)中。
151.使程序运行并完成,立即取出比色皿中的样本。然后向每个比色皿中加入500μl预平衡的培养基。然后,将每个比色皿中的样本轻轻移至制备得到的6孔板的相应孔中,以建立每孔5ml的最终体积。
152.然后在加湿的37℃/5%co2的培养箱中培养细胞,直至进行转染分析。在电穿孔后72小时进行流式细胞术分析,以测量dr4和/或dr5的表达水平。发现这种电穿孔方案可靠地导致了khyg
‑
1细胞、nk
‑
92细胞和原代nk细胞中的dr4和dr5的敲除。
153.实施例3dr4
‑
cd28/dr5
‑
cd28融合蛋白
154.免疫调节融合蛋白(ifp)可包含dr4或dr5的胞外结构域或它们的一部分,以及
cd28的胞内信号结构域或其一部分。疏水组分可由dr4/dr5的跨膜结构域(transmembrane domain)或cd28的跨膜结构域或它们的部分组成。在一些dr4
‑
cd28或dr5
‑
cd28融合蛋白中,疏水组分包含cd28的跨膜结构域,胞外组分还包含cd28的胞外部分,特别是与疏水组分相邻的胞外半胱氨酸残基。胞外组分可以包含dr4或dr5的全部胞外结构域或部分胞外结构域。
155.胞外组分可包括dr4/dr5的整个胞外结构域。因此,dr4
‑
cd28或dr5
‑
cd28构建体具有将通常来自与trail结合的dr4或dr5的抑制信号转化为由cd28胞内信号结构域产生的阳性信号的能力。
156.编码dr4
‑
cd28融合蛋白或dr5
‑
cd28融合蛋白的示例性核酸分子包含以下元件(5’至3’):胞外组分(dr4/dr5)
‑
多聚化结构域(cd28半胱氨酸)
‑
疏水组分(cd28跨膜)
‑
胞内组分(cd28胞内)。
157.编码构建体的核酸可通过pcr在内部产生,然后将其定向topo克隆到pentr
tm
/载体(invitrogen)中,并使用技术(invitrogen)将其转移到逆转录病毒载体pmp71
‑
attr中。在某些情况下,在被克隆到pmp71
‑
attr逆转录病毒载体之前,编码ifp的核酸分子是经过密码子优化的。
158.实施例4nk细胞中经修饰的trail受体敲入
159.用编码连接至共刺激结构域cd28(如上)或4
‑
1bb的dr5或dr4的基因转染nk
‑
92细胞、khyg
‑
1细胞和原代扩增的nk细胞。
160.产生了一组编码免疫调节融合蛋白(ifp)的基因,这些融合蛋白含有与4
‑
1bb或cd28共刺激结构域而非自然死亡结构域融合的dr5或dr4胞外结合结构域。具体地,所选基因可编码包含含有4
‑
1bb或cd28和cd3zeta内域(endodomain)的dr5主链和cd8a的跨膜和茎区的ifp。以mrna形式递送基因构建体用于瞬时表达,并使用sb载体建立稳定的长期表达。
161.用ifp转染nk细胞(如上所述使用核转染试剂盒t)后,基于其ifp功能选择成功转染的细胞。然后如前所述对所选细胞进行培养和传代。
162.在nk细胞中表达的所获得的ifp与野生型dr5竞争与trail的结合,但与野生型dr5不同,ifp结合时产生激活信号,导致细胞毒性更强的nk细胞表型。
163.实施例5经修饰的nk细胞对trail诱导的杀伤的增加的抗性
164.将野生型nk细胞与实施例1、实施例2、实施例3和实施例4的经遗传修饰的nk细胞进行比较。
165.实验设计一:
166.通过流式细胞术评估在与rpmi
‑
8226、mm1s、hl60、panc
‑
1和bxpc3共培养时,每种细胞类型对trail诱导的细胞死亡的敏感性。简言之,针对每种癌症靶细胞类型测试了:(1)野生型nk细胞,(2)表达高亲和力膜结合trail配体dr4
4c9
或dr5
e195r;d269h
的nk细胞,(3)具有dr4
ko
或dr5
ko
的nk细胞,以及(4)具有表达高亲和力膜结合trail配体dr4
4c9
或dr5
e195r;d269h
的nk细胞。
167.实验设计二:
168.通过流式细胞术评估了在与rpmi
‑
8226、mm1s、hl60、panc
‑
1和bxpc3共培养时,每种细胞类型对trail诱导的细胞死亡的敏感性。简言之,针对每种癌症靶细胞类型测试了:(1)野生型nk细胞,(2)表达高亲和力膜结合trail配体dr4
4c9
或dr5
e195r;d269h
的nk细胞,(3)具
有dr4
ki
‑
ifp
或dr5
ki
‑
ifp
的nk细胞,以及(4)nk细胞与具有dr4
ki
‑
if
p或dr5
ki
‑
ifp
且表达高亲和力膜结合trail配体dr4
4c9
或dr5
e195r;d269h
的nk细胞。
169.实验设计三:
170.通过流式细胞术评估了在与rpmi
‑
8226、mm1s、hl60、panc
‑
1和bxpc3共培养时,每种细胞类型对trail诱导的细胞死亡的敏感性。简言之,针对每种癌症靶细胞类型测试了:(1)野生型nk细胞,(2)表达高亲和力膜结合trail配体dr4
4c9
或dr5
e195r;d269h
的nk细胞,(3)具有dr4
ko
或dr5
ko
的nk细胞,(4)具有dr4
ki
‑
ifp
或dr5
ki
‑
ifp
的nk细胞,(5)nk细胞与具有dr4
ko
与dr4
ki
‑
ifp
或者dr5
ko
与dr5
ki
‑
ifp
且表达高亲和力膜结合trail配体dr4
4c9
或dr5
e195r;d269h
的nk细胞。
171.实施例6t细胞trail受体dr4和受体dr5的敲除
172.去除了死亡受体5(dr5)和/或死亡受体4(dr4)功能的t细胞制备如下。
173.设计并制备了靶向trail
‑
r2(dr5)和trail
‑
r1(dr4)的grna构建体(例如seq id no:1:cccaucuugaacauaccag(dr5),seq id no:2:aaccggugcacagagggugu(dr4)以及seq id no:3:auuuacaagcuguacauggg(dr4))以靶向t细胞中编码dr5基因和编码dr4基因的内源基因。然后使用crispr/cas9基因组编辑敲除dr5靶基因和/或dr4靶基因。
174.总共为dr5基因选择了3个候选grna,并测定了它们在rpmi8226细胞中的切割效率。总共为dr4基因选择了3个候选grna,并测定了它们在hl60细胞中的切割效率。使用gt用grna:cas9核糖核蛋白(rnp)复合物对rpmi8226细胞和hl60进行电穿孔,随后敲除dr5和/或通过流式细胞术进行分析。还使用体外错配检测分析法测定了grna的切割活性。t7e1核酸内切酶识别并切割非完全匹配的dna,在crispr/cas9转染和非同源末端连接(nhej)后,可将亲本dr5基因/dr4基因与突变基因进行比较。
175.选择具有最高的ko效率的grna进行进一步实验,以在原代t细胞、t细胞系或祖细胞中敲除dr5/dr4(用于后续分化和扩增为t细胞)。dr4/dr5的敲除通过基于流式细胞术的分析进行测定。
176.实施例7nk细胞自我杀伤的抗性
177.如图1所示,评估了下列细胞中的nk细胞自我杀伤:(1)原代nk细胞,也称为空白(mock)或野生型nk细胞,(2)表达高亲和力膜结合trail配体dr5
e195r;d269h
的原代nk细胞,(3)通过sirna具有dr5
kd
的原代nk细胞,和(4)通过sirna具有dr5
kd
并且还表达高亲和力膜结合trail配体dr5
e195r;d269h
的原代nk细胞。
178.在扩增第9天用dr5 sirna对接受dr5敲低的原代nk细胞进行电穿孔,而在扩增第12天用变体mrna对接受dr5 trail变体的原代nk细胞进行电穿孔。
179.据观察,在含有il
‑
2的生长培养基中对原代nk细胞进行长时间扩增后,dr5表达上调,导致在表达dr5 trail变体时自我杀伤增加。
180.数据清楚地表明,无论这些nk细胞表达的是野生型trail还是高亲和力dr5 trail变体,使用sirna敲低dr5的表达都可以保护原代扩增(primary expanded)的nk细胞免于自我杀伤。
181.实施例8t细胞上的dr5表达
182.在jurkat t细胞上检测了trail死亡受体5(dr5)的表达。
183.在rpmi
‑
1640、10%fbs和1%青霉素
‑
链霉素的存在下培养jurkat t细胞。在对数
生长期收获细胞,并根据标准操作方案对trail
‑
dr5/cd262的细胞表面表达进行表达的免疫表型分析。
184.简言之,用含有pbs、叠氮化钠和2%fbs的缓冲液洗涤细胞。随后,以适当的体积将细胞重新悬浮,并用抗
‑
dr5抗体(克隆:djr2
‑
4,来源:biolegend,产品编号:307406)染色。然后在冰上将细胞与2μl该抗体孵育20分钟。孵育后,用含有pbs、叠氮化钠和2%fbs的缓冲液洗涤细胞两次,以去除未结合的抗体。最后将细胞重新悬浮在含有pbs、叠氮化钠和2%fbs的200μl缓冲液中,并通过bd facs cantoⅱ流式细胞仪,使用488nm蓝色激光进行测量,并使用585/42带通滤波器检测发射的信号。结果采用flowjo软件(第
ⅹ
版)进行分析。
185.图2示出了fmo对照样本(1.29%)和抗
‑
dr5染色样本(86.8%)二者中的jurkat t细胞上的dr5的表达。
186.很明显,jurkat t细胞在它们的表面上高度表达trail死亡受体5(dr5)。
187.实施例9t细胞上dr5
‑
41bb嵌合体的表达
188.在jurkat t细胞中表达dr5
‑
41bb融合蛋白(seq id no:4),以将dr5凋亡信号级联转化为活性、刺激性t细胞应答。
189.在rpmi
‑
1640、10%fbs和1%青霉素
‑
链霉素存在下培养jurkat t细胞。在对数生长期收获细胞,并在标准电穿孔方案下使用mrna电穿孔进行转染。以dr5
‑
41bb mrna在柠檬酸盐缓冲液中的1μg/μl的浓度使用。将细胞在缓冲溶液中洗涤一次,然后以2
×
106个细胞/100μl的密度进行浓缩。用最终浓度为10μg/100μl的dr5
‑
41bb嵌合体对细胞进行空白电穿孔或电穿孔。电穿孔后,立即将细胞回收至6孔板中,并在37℃下复苏(recover)20分钟。孵育后,向细胞补充含有rpmi
‑
1640和10%fbs的培养基。在通过流式细胞术分析dr5
‑
41bb嵌合体的表达之前,使细胞复苏并在37℃下再次孵育24小时。
190.简言之,使用含有pbs、叠氮化钠和2%fbs的缓冲液洗涤细胞。随后,以适当的体积将细胞重新悬浮,并用抗
‑
dr5抗体(克隆:djr2
‑
4,来源:biolegend,产品编号:307406)染色。然后在冰上将细胞与2μl抗体孵育20分钟。孵育后,用含有pbs、叠氮化钠和2%fbs的缓冲液洗涤细胞两次,以去除未结合的抗体。最后将细胞重新悬浮在含有pbs、叠氮化钠和2%fbs的500μl缓冲液中,并通过bd facs cantoⅱ流式细胞仪使用488nm蓝色激光进行测量,并使用585/42带通滤波器检测发射的信号。结果采用第
ⅹ
版flowjo进行分析。
191.图3示出了dr5
‑
41bb嵌合体在jurkat t细胞上的表达。空白(mock)电穿孔的jurkat t细胞中dr5的表达显示平均mfi(平均荧光强度)值为698。转染的jurkat t细胞上的dr5表达和dr5
‑
41bb表达显示平均mfi值为2073。将空白电穿孔的(mock electroporated)t细胞归一化(normalizing)至背景mfi=0时,可以看出dr5
‑
41bb特异性表达等于平均mfi值1375。
192.因此表明dr5
‑
41bb嵌合体可在t细胞中成功表达。
193.实施例10dr5
‑
41bb嵌合体的保护作用
194.当暴露于trail配体时,评估了野生型jurkat t细胞和表达来自实施例9的dr5
‑
41bb嵌合体的jurkat t细胞的脆弱性(vulnerability)。
195.在rpmi
‑
1640、10%胎牛血清和1%青霉素
‑
链霉素存在下培养jurkat t细胞。在对数生长期收获细胞,并在标准电穿孔方案下使用mrna电穿孔进行转染。以dr5
‑
41bb mrna在柠檬酸盐缓冲液中的1μg/μl的浓度使用。将细胞在缓冲溶液中洗涤一次,然后以2
×
106个
细胞/100μl的密度进行浓缩。用最终浓度为10μg/100μl的dr5
‑
41bb嵌合体对细胞进行空白电穿孔(mock electroporated)或电穿孔。电穿孔后,立即将细胞回收于6孔板中,并在37℃下复苏20分钟。孵育后,向细胞补充含有rpmi
‑
1640和10%fbs的培养基。
196.使细胞复苏并在37℃下再培养4小时,然后将其用于96孔板中的功能测定,以评估trail配体对(a)空白电穿孔或(b)dr5
‑
41bb mrna电穿孔的jurkat t细胞的毒性。
197.如图4所示,分别在存在或不存在最终浓度为100ng/ml的可溶性trail配体的情况下,培养t细胞。每个图(plot)代表n=3。该测定持续进行了16小时,在基于bd facs cantoⅱ的分析平台上,使用流式细胞仪通过碘化丙锭评估t细胞中的细胞死亡。尽管trail配体的存在显然对t细胞具有毒性作用(约37.5%的细胞死亡),但这种trail诱导的细胞死亡可以通过表达dr5
‑
41bb嵌合受体来规避(约15%的细胞死亡)。
198.因此表明,dr5
‑
41bb嵌合体的表达为t细胞提供了对trail诱导的细胞死亡的抗性。
199.实施例11dr5
‑
41bb嵌合体在nk细胞上的表达
200.在原代扩增的nk细胞中表达dr5
‑
41bb融合蛋白(seq id no:4),以将dr5凋亡信号级联转化为活化的、激活的nk细胞应答。
201.根据制造商指南,在miltenyi biotec细胞扩增培养基存在下,在10%人类ab血清的存在下将原代扩增的nk细胞培养12天。在对数生长期收获细胞,并在标准电穿孔方案下使用mrna电穿孔进行转染。以dr5
‑
41bb mrna在柠檬酸盐缓冲液中的1μg/μl的浓度使用。将细胞在缓冲液中洗涤一次,然后以2
×
106个细胞/100μl的密度浓缩。用最终浓度为7.5μg/100μl的dr5
‑
41bb嵌合体对细胞进行空白电穿孔或电穿孔。
202.电穿孔后,立即将细胞回收至6孔板中,并在37℃下复苏20分钟。孵育后,向细胞补充含有10%人类ab血清的nk细胞macs培养基(miltenyi bioctec)。在通过流式细胞术分析dr5
‑
41bb嵌合体的表达之前,使细胞恢复并在37℃再次孵育24小时。
203.简言之,使用含有pbs、叠氮化钠和2%fbs的缓冲液洗涤细胞。随后,以适当的体积将细胞重新悬浮,并用抗
‑
dr5抗体(克隆:djr2
‑
4,来源:biolegend,产品编号:307406)染色。然后在冰上将细胞与2μl该抗体孵育20分钟。孵育后,用含有pbs、叠氮化钠和2%fbs的缓冲液洗涤细胞两次,以去除未结合的抗体。最后将细胞重新悬浮在含有pbs、叠氮化钠和2%fbs的500μl缓冲液中,并通过bd facs cantoⅱ流式细胞仪使用488nm蓝色激光测量,并使用585/42带通滤波器检测发射的信号。结果采用第
ⅹ
版flowjo进行分析。
204.图5示出了空白电穿孔nk细胞中的dr5受体表达(平均mfi值:208),而图6示出了dr5
‑
41bb嵌合mrna电穿孔nk细胞中的dr5受体表达(平均mfi值:608)。将空白电穿孔nk细胞归一化至背景mfi=0时,可以看出dr5
‑
41bb特异性表达(608减208)等于400mfi单位。
205.因此表明dr5
‑
41bb融合蛋白可以在nk细胞和t细胞中成功表达。
206.因此,本发明提供了对trail诱导的细胞死亡具有抗性的免疫效应细胞和细胞系,及它们的制备,用于癌症治疗的用途。这种方法涉及敲低/敲除免疫效应细胞上的trail受体的组合,以防止表达高亲和力膜结合trail配体的邻近的经遗传修饰的免疫效应细胞的自我杀伤。此外,与共刺激结构域连接的trail受体的敲入允许免疫效应细胞将来自邻近的免疫效应细胞的自我杀伤诱导信号转化为高效的免疫效应细胞细胞毒性所需的激活信号转导。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。