用于产生蜂粮的微生物学方法
1.描述
发明领域
2.本发明涉及用于产生蜂粮的微生物学方法。
3.本发明源于用于产生营养、饮食或食物产品的生物技术方法领域。
4.特别地,本发明涉及用于产生经发酵的花粉的生物技术方法,该经发酵的花粉类似于在蜂箱的蜂巢中自然产生的蜂粮。
现有技术
5.花粉是显花植物的雄性生殖元件,它以粉状形式存在于位于花的雄蕊的末端的花药中,并包括植物负责运输其生殖细胞的显微结构。蜜蜂收集花粉,并用它来产生蜂王浆和喂养幼虫。
6.在自然界中,花粉是蜜蜂(意大利蜜蜂(apis mellifera l.))的蛋白质、脂质、甾醇、矿物质和维生素的主要来源,而在食品和饮食领域,由于其营养含量高,花粉已成为人们越来越感兴趣的对象。
7.蜜蜂从植物花序或从环境收集花粉,并将其储存在蜂箱的蜂巢中,在蜂巢中花粉与花蜜(nectar)、蜂蜜(honey)和腺体分泌物混合,形成构成幼虫形态和成年昆虫的主要蛋白质来源的颗粒。
8.蜂箱的蜂巢内的花粉经受主要通过乳酸菌和其他微生物进行的一系列生化转化。在蜂巢内被发酵的花粉被称为“蜂粮(bee bread)”(vasquez&olofsson,2009)。
9.蜂粮与最初的花粉相比具有不同的组成,因为后者经历了生物化学修饰,诸如复合多糖的减少,氨基酸、蛋白质和脂质谱的变化以及简单碳水化合物和滴定酸度的增加(lee等人,2014;human和nicolson,2006;等人,2012)。
10.这些变化使蜂粮成为微生物学上稳定的环境,并且此外,与新鲜花粉相比,蜂巢中的花粉发酵提高了其消化性(digestibility)和营养价值。
11.营养和功能特性诸如抗氧化、抗炎、保肝、抗动脉粥样硬化和免疫调节活性使蜂粮成为适合人类饮食的产品(markiewicz
‑
等人,2013;nagai等人,2004;denisow和denisow
‑
pietrzyk,2016)。
12.然而,与市场需求相比,可用的蜂粮的数量是不够的,因为从蜂巢取出是昂贵的,会对蜂箱的结构造成损坏,并且在任何情况下,蜂箱中存在的数量都不能满足不断增长的市场需求。这种产品的缺乏决定了市场价格高。
13.为了克服这些限制和缺点,养蜂人在蜂箱入口处借助于“花粉陷阱”直接从职蜂(foraging bee)收集花粉,花粉陷阱由在其表面保持花粉的网格组成。
14.然而,与不需要任何类型的调理的蜂粮不同,新鲜花粉不是稳定的基质,并且会刺激霉菌毒素的产生。
15.因此,收集的新鲜花粉需要在储存前干燥或冷冻。
16.然而,已经发现,当在高于35℃的温度进行干燥时,会导致营养和挥发性化合物的损失。另一方面,冷冻具有高的生产成本。
17.低温除湿代表这两种技术的折衷。然而,这种技术在保持蜂粮的感官和营养特性方面被证明不如冷冻有效。
18.因此,目前,人们感到需要有数量足以满足市场需求的具有与新鲜产品相似的感官和营养特性的不同于天然来源的蜂粮。
19.鉴于以上所述,允许获得大量适合市场需求的产品,同时保护蜂箱的结构的产生蜂粮的工业方法是本发明的总体目的的一部分。
20.本发明的目的之一是提供一种用于产生具有与天然产品相似的感官特性的蜂粮的微生物方法。
21.本发明的另一个目的是提供一种用于产生营养和功能价值高于新鲜花粉的蜂粮的生物技术方法。
22.发明概述
23.本发明源于已经观察到,通过用选择的嗜果糖乳酸菌进行花粉发酵,导致蜂粮形成的类似于自然发酵的典型环境条件得以重现。
24.特别地,已经发现,通过用特定的嗜果糖乳酸菌与选择的酵母组合来发酵花粉,获得可与天然生产的蜂粮相似的经发酵的花粉,对于相同的起始量的花粉增加产量。
25.因此,申请人鉴定了选择的乳酸菌菌株,其相对于葡萄糖使用果糖为优选的底物作为用于产生蜂粮的碳源,并在生物技术方法中使用它们来合成或半合成地产生蜂粮。
26.根据第一方面,本发明提供了一种用于产生蜂粮的微生物学方法,包括:
27.步骤a)制备接种物并用促酵剂(starter)乳酸菌接种花粉,所述促酵剂乳酸菌相对于葡萄糖使用果糖为优选的底物作为用于产生蜂粮的碳源,和
28.步骤b)花粉发酵,
29.所述方法的特征在于,接种的促酵剂乳酸菌属于昆氏乳杆菌(lactobacillus kunkeei)物种。
30.发明人还发现,昆氏乳杆菌pf12、pf15和pl13菌株及其混合物特别适合作为本发明方法的促酵剂乳酸菌。
31.有利的是,用本发明的生物技术方法获得的蜂粮提供比天然来源的花粉更高的营养价值和更长的货架期。
32.从本发明的方法获得的蜂粮也具有比用作本方法起始材料的花粉更高的营养价值。
33.具体而言,通过本发明的微生物学/生物技术方法获得的蜂粮或经发酵的花粉具有比用作起始材料的未发酵的花粉更高的总游离氨基酸和肽含量以及更高的可消化蛋白质含量。
34.此外,获得的蜂粮或经发酵的花粉具有比起始花粉更高水平的可溶性游离酚类化合物,其通常具有细胞抗氧化活性。
35.用本发明方法获得的蜂粮的营养和持久特性的组合在营养和饮食方面是可观的,并使其适合于配制营养、饮食或食物产品。
36.有利的是,用本发明方法获得的通过保护蜂箱的结构获得的蜂粮具有蜂粮特有的
化学组成。
37.根据第二方面,本发明提供了根据本文所述的任一实施方案定义的方法获得的蜂粮或经发酵的花粉。
38.根据本发明的第三方面,提供了一种组合物,其包含用本文所述方法获得的蜂粮或经发酵的花粉,以及可食用载体。
39.本发明的另一个目的是属于昆氏乳杆菌物种的选择的乳酸菌及其混合物,所述昆氏乳杆菌物种优选地选自pf12、pf15和pl13。
40.根据一个方面,本发明涉及属于昆氏乳杆菌物种的三种细菌菌株,其中所述菌株是:
41.昆氏乳杆菌pf12,于2018年6月28日以保藏号dsm 32843保藏于国际保藏中心莱布尼茨研究所dsmz
‑
德国微生物保藏中心(leibniz
‑
institut dsmz
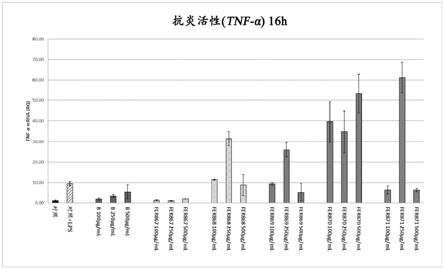
‑
deutsche sammlung von mikroorganismen und zellkulturen gmbh);
42.昆氏乳杆菌pf15,于2018年6月28日以保藏号dsm 32845保藏于国际保藏中心莱布尼茨研究所dsmz
‑
德国微生物保藏中心(leibniz
‑
institut dsmz
‑
deutsche sammlung von mikroorganismen und zellkulturen gmbh);
43.昆氏乳杆菌pl13,于2018年6月28日以保藏号dsm 32844保藏于国际保藏中心莱布尼茨研究所dsmz
‑
德国微生物保藏中心(leibniz
‑
institut dsmz
‑
deutsche sammlung von mikroorganismen und zellkulturen gmbh);
44.这三种之前鉴定的菌株证书附后,以目前的权利所有者朱利亚尼股份公司的名义保藏。
45.附图简述
46.本发明的特征和优点将从所附的附图明显可知,其中:
47.‑
图1显示了图表,该图表显示在接种了混合促酵剂(包括昆氏乳杆菌pf12、pl13和pf15以及葡萄有孢汉逊酵母(hanseniaspora uvarum)an8y27b)的花粉(实心符号)和进行自发发酵的未接种花粉(空心符号)于30℃孵育9天期间,乳酸菌的细胞密度值(log cfu g
‑1)(实线)和可滴定酸度(ml 0.1m naoh 10g
‑1)(tta)(虚线);
48.‑
图2显示新鲜花粉(黑色条)和用混合促酵剂(包括昆氏乳杆菌pf12、pl13和pf15以及葡萄有孢汉逊酵母an8y27b)在30℃发酵216小时的花粉(红色条)中游离氨基酸的浓度值(mg kg
‑1);
49.‑
图3显示了条形图a,新鲜花粉(黑色条)和用混合促酵剂(包括昆氏乳杆菌pf12、pl13和pf15以及葡萄有孢汉逊酵母an8y27b)在30℃发酵216小时的花粉(红色条)中蛋白质的体外消化率值(以总蛋白质的%表示);以及图b,显示关于新鲜花粉(黑色条)和用混合促酵剂(包括昆氏乳杆菌pf12、pl13和pf15以及葡萄有孢汉逊酵母an8y27b)在30℃发酵216小时的花粉(红色条)中通过分子排阻色谱法(rp
‑
fplc,214nm)确定的肽特征的两条曲线;
50.‑
图4显示关于新鲜花粉和用混合促酵剂(包括昆氏乳杆菌pf12、pl13和pf15以及葡萄有孢汉逊酵母an8y27b)在30℃发酵216小时的花粉中的水溶性游离酚类化合物(白色条)和甲醇(灰色条)的浓度(g没食子酸当量kg
‑1干重)的条形图。
51.‑
图5显示关于根据实施例12的测试,在用1mm h2o2诱导氧化应激后,人类角质形成细胞nctc2544的细胞生存力百分比的条形图。细胞预先与100μg/ml、250μg/ml和500μg/ml
的样品b、fer867、fer868、fer869、fer870和fer871一起孵育16小时。未处理的细胞(对照)。用1mm h2o2处理的细胞(用h2o2应激的细胞)。
*
(p<0.05),
**
(p<0.01),
***
(p<0.005),
****
(p<0.001)。
52.这些结果指示测试的化合物对诱导的氧化应激的保护,并突出了用本发明方法获得的发酵的蜂粮的显著抗氧化作用。
53.‑
图6a和6b显示关于根据实施例12通过qrt
‑
pcr评价的人类角质形成细胞nctc2544中与tnfα基因表达的条形图。将细胞在37℃,5%co2用以下处理16小时(a)和24小时(b):rpmi 2.5%fcs(对照);rpmi 2.5%fcs和10μg/ml lps(对照 lps);100μg/ml、250μg/ml和500μg/ml样品a(新鲜)、b(对照)以及fer867、fer868、fer869、fer870和fer871。未处理的细胞(对照)。用10μg/ml lps处理的细胞(lps)。数值代表一式两份进行的两个实验的平均值
±
sem。
54.这些结果指示抗炎活性,并突出了用本发明方法获得的发酵的蜂粮的显著抗炎效果。
55.发明详述
56.根据本发明的一般方面,提供了一种用于产生类似于蜂粮的经发酵的花粉的微生物学方法,其中用一种或更多种选择的菌株接种基于花粉的起始材料,以进行发酵,所述一种或更多种选择的菌株有利地为昆氏乳杆菌物种,所述发酵基本上再现了储存在蜂箱的蜂巢内的花粉在自然中发生的发酵。
57.根据一般方面,本发明涉及根据权利要求1的花粉发酵方法。
58.权利要求2
‑
7中定义了本发明方法的另外的实施方案。
59.发明人已经观察到,无论是相对于新鲜花粉还是相对于在蜂箱中自然发酵的蜂粮,用本发明的方法获得的经发酵的花粉具有更好的营养特性,并具有更长的货架期。这一特性组合使得用本发明的方法获得的经发酵的花粉特别适合作为营养、饮食或保健产品。
60.例如,用本发明方法获得的经发酵的花粉中存在的总游离多酚含量等于84.64g当量没食子酸/kg干重,该量比文献中表明的自然发生的发酵获得的蜂粮的含量(等于8.9
‑
36.52g当量没食子酸/kg干重)高得多,如markiewicz
‑
等人,2013;oltica等人,2007;zuluaga等人,2015在文献中描述的。
61.本文所述方法的起始材料基于花粉或由花粉组成。合适的花粉可以是新鲜的或经除湿的。后者更适合在工业规模实施该方法。
62.合适的经除湿的花粉是收集后经历在热气流中干燥的花粉,例如获得等于或小于12%的湿度百分比。如果包装和储存得当,低百分比的水,例如相对湿度低于0.5使花粉成为足够稳定的原料。
63.典型地,经除湿的花粉以颗粒的形式出现,其颜色取决于蜜蜂所访问的物种或不同植物物种。
64.举例来说,合适的经除湿的野蔷薇(multiflora)花粉具有以下感官特征:
65.‑
外观:小尺寸颗粒,颜色因来源的植物物种而异。
66.‑
气味:干草的植物气味。
67.‑
味道:特色的,植物的,干花的,干草的。溶解度:难溶于水和有机溶剂。
68.‑
水:7%至15%
69.‑
糖精(glucids):25%至48%
70.‑
蛋白质:11%至28%
71.‑
脂质:1%至14%
72.‑
矿物盐:1%至5%
73.在本文所述的方法中,通常以颗粒或团聚颗粒形式存在的经除湿的花粉可以原样使用,或者可以预先处理以降解或破坏颗粒的外壳,使内部内容物对于接种微生物的发酵活性有效。
74.为了打破通常包含纤维素、果胶物质、类胡萝卜素和多酚的花粉粒的包裹层,可以使用物理处理例如机械处理,或生物处理。
75.合适的机械处理包括花粉的粉碎(comminution)、粉化(pulverization)、微粉化、高压和/或超声波或热处理。
76.为了降解花粉颗粒的外壁,可以进行将颗粒破碎或尺寸减小成更小的颗粒,或者不会显著改变起始基质或花粉的营养特性,或者允许获得具有更高营养价值的产品的其他技术。
77.花粉粒外层的降解可以包括借助于食品或制药工业中传统使用的设备进行的减小其尺寸的处理。
78.举例来说,可以使用这样的设备,其包括将花粉通过具有足够网眼间隙的金属网,诸如摆动臂造粒机或使用多种类型的碾磨机,诸如刀、滚珠轴承等或微粉机或这些设备的组合。
79.花粉粒的尺寸减小或粉碎也可以使用湿法技术进行,例如使用带有切碎器和刀具的四向混合器、浸入流体介质中的定子转子均化器、超声波系统和其他商业上可获得的装置。
80.热处理也可以任选地在高于环境压力使用,或者超声波处理或其他允许借助高压的冷巴氏杀菌的工艺,诸如高压加工(hpp)。
81.例如,在压力下热处理的情况下,花粉可以方便地在10%水中重构。
82.在超声波处理的情况下,也可以按原样使用花粉。
83.也可以使用纯化的花粉提取物作为起始原料,所述纯化的花粉提取物从预先经过一个或更多个溶剂提取步骤,例如水和醇的混合物的虫媒花粉获得。
84.根据一些实施方案,花粉的外包裹层通过生物降解被破坏,例如通过用酵母处理花粉。
85.因此,本发明方法的一些实施方案提供了酵母的添加,该酵母降解或代谢包裹花粉粒的果胶组分。典型地,酵母的添加可以在方法的步骤a)之前或步骤a)期间进行。
86.添加的酵母与花粉粒接触,引发花粉外包裹层的崩解过程,这有利于花粉粒内存在的营养物和在该方法的步骤b)中接种的乳酸菌之间的接触。
87.典型地,当起始花粉没有被处理,并且特别是没有经过旨在破坏花粉粒的包裹层的机械作用例如粉碎或研磨时,提供酵母的添加。
88.根据优选的实施方案,降解或代谢包裹花粉粒的果胶组分的属于异常威克汉姆酵母(wickerhamomyces anomalus)或葡萄有孢汉逊酵母物种的酵母是这两种物种的混合物。
89.根据一种实施方案,使用的酵母是葡萄有孢汉逊酵母an8y27b菌株。
90.在本发明方法的实施方案中,接种物使用花粉本身作为生长基质制备。
91.在其他实施方案中,接种的微生物的生长基质是合适的培养基,诸如果糖酵母蛋白胨fyped,任选地含有酵母或植物提取物和蛋白胨,它们为微生物提供快速生长必需的营养。
92.可选地,可以使用花粉和提取物/蛋白胨的混合物。
93.在本发明方法的优选实施方案中,分别制备乳酸菌和酵母的接种物。
94.该方法的步骤b)的发酵通过接种通常属于乳杆菌属(lactobacillus),方便地为昆氏乳杆菌物种的乳酸菌来进行。
95.根据优选的实施方案,该方法的步骤a)包括接种属于昆氏乳杆菌物种的乳酸菌及其混合物,所述昆氏乳杆菌物种选自昆氏乳杆菌pf12、pf15和pl13菌株。这些选择的细菌菌株中的每一种具有在基于花粉的基质上生长和形成菌落的能力,出乎意料地高于同样属于昆氏乳杆菌物种的其他乳杆菌。此外,所述三种菌株具有令人惊讶的酸化和产生抗微生物化合物的能力,如以下实施例中报道的实验部分所记载的。
96.有利的是,本发明方法的发酵步骤在生物反应器内进行,通常在有氧条件进行。
97.根据一些实施方案,生物反应器内的产物的湿度的范围为总质量的30%至95%。
98.典型地,当湿度值低,例如30%
‑
45%时,包括花粉和接种的微生物的混合物可以是半固体形式,并且当湿度值高,例如60%
‑
95%时,包括花粉和接种的微生物的混合物可以是半固体或液体形式。
99.根据一些实施方案,在步骤b)的发酵开始时,生物反应器中环境的ph在4至6的范围内。
100.在本发明的优选实施方案中,系统的ph具有在5.25 /
‑
0.25之间的值,并且可以通过添加常规的ph校正物在所述范围内校正。
101.典型地,在步骤b)的发酵期间,监测以下反应参数和条件:
102.‑
糖(葡萄糖和果糖)的量
103.‑
总可滴定酸度
104.‑
ph
105.‑
乳酸和乙酸
106.‑
细胞密度
107.当获得了期望的量的有机酸/细胞密度/游离酚酸/残余糖/游离氨基酸时,该方法可以中断。
108.在本发明方法的实施方案中,对获得的经发酵的花粉进行降低微生物负荷的步骤c)。根据一种实施方案,使任选地进行步骤c)的获得的经发酵的花粉经历冷干燥(cold
‑
drying)步骤,例如冷冻干燥,典型地在liostat中。可选地,经发酵的花粉可以在离心后在例如
‑
40℃或更低的温度方便地冷冻储存。
109.在本发明的另一种实施方案中,将经发酵的花粉冻干,目的是保持微生物的存活和活力。可选地,获得的经发酵的花粉或生物质可以,通常在离心后冷冻储存在低于0℃,例如
‑
40℃或更低的温度。
110.为了本发明的目的,其他常规技术也可用于从经发酵的花粉除去水分,例如通过借助于喷雾干燥。
111.根据一种实施方案,本发明的方法包括以下步骤:
112.‑
供应基于新鲜的未经预处理的花粉的起始材料,优选地储存在
‑
20℃,或干燥或经除湿的花粉,方便地储存在 4℃或室温,和/或任选地通过粉碎、粉化、微粉化、热处理、高压和/或超声波处理进行预处理,或花粉提取物;
113.‑
任选稀释,通常用蒸馏水稀释,并校正花粉的ph值,直至达到5.25 /
‑
0.25之间的值;
114.‑
接种包含选自菌株昆氏乳杆菌pf12、pf15和pl13的乳酸菌或其混合物的细胞悬浮液,并且可能接种具有果胶分解活性、属于wickerhamomyces属或属于葡萄有孢汉逊酵母物种(例如菌株an8y27b)的酵母;
115.‑
添加典型地蒸馏水,直到最终湿度达到30%至95%。典型地,最终湿度值还包括花粉的初始含水量例如等于约21.56%以及在接种步骤期间加入的水。
116.‑
在无菌试管或生物反应器中在30℃孵育,优选地孵育24
‑
216小时,并分离获得的经发酵的花粉。
117.根据一些实施方案,从上述方法获得的经发酵的花粉可以在liostat中冷冻干燥,或者可以优选地在离心后在约
‑
20℃或更低的温度冷冻。
118.在某些实施方案中,可以对经发酵的花粉进行处理以减少微生物负荷,除去水分,或者进行其他处理以稳定经发酵的花粉。
119.根据第二方面,本发明提供了根据本文所述的任一实施方案描述的方法获得的蜂粮或经发酵的花粉。用本发明方法获得的经发酵的花粉具有比起始花粉更高水平的游离可溶性酚类化合物。这些和其他特征在下面的实施例中详细说明。
120.在本发明的其他实施方案中,可能由步骤b)的发酵产生的液体部分与固体组分分离,并用于食品、饮食或营养目的。
121.液体和固体部分都有营养用途。
122.根据本发明的第三方面,提供了一种营养或饮食组合物,其包含可食用载体和根据本文所述的任一实施方案获得的经发酵的花粉。
123.根据第四方面,提供了一种组合物,其包含属于昆氏乳杆菌菌株的乳酸菌及其混合物,以及可食用载体,所述昆氏乳杆菌菌株为昆氏乳杆菌pf12、pf15和pl13菌株。
124.组合物的细菌菌株可以是活的和有活力的,或者是根据传统技术,例如通间歇灭菌法的灭活的形式。
125.本文描述的组合物适合于口服施用。
126.用于口服施用的组合物可以呈固体或液体形式。在固体形式的情况下,它们包含从本文所述方法获得的蜂粮作为生物活性组分和一种或更多种生理上可接受的赋形剂。
127.典型的固体形式组合物包括具有不同组成和形状的片剂、颗粒、胶囊、粉末、临时剂型、糖果、口香糖、胶冻豆(jelly bean)。
128.本发明适用于任何固体、半固体和液体剂型,它们可以成为用于施用本发明的可食用载体。
129.本发明适用于所有剂型,其中制品在施用前被稀释或以固体、半固体或液体形式原样使用。
130.片剂通常包含合适的载体或赋形剂(通常呈干燥形式),植物提取物分散于其中。
131.在这种情况下,制剂中包含的合适赋形剂是纤维素衍生物,诸如羟甲基纤维素、羟丙基甲基纤维素、甲基纤维素、羟丙基纤维素、羟乙基纤维素、羧乙基纤维素、乙基羟乙基纤维素、乙酸丁酸纤维素、乙酸邻苯二甲酸纤维素及其混合物。
132.合适的赋形剂的另外的实例包括属于内酰胺家族的聚合物,诸如吡咯烷酮及其衍生物,例如聚乙烯吡咯烷酮、聚乙烯聚吡咯烷酮及其混合物,无机盐诸如磷酸钙或磷酸二钙,润滑剂诸如硬脂酸镁、三酰基甘油及其混合物。
133.在液体形式的情况下,组合物包含在步骤b)的发酵结束时分离的液体部分作为生物活性组分和一种或更多种生理上可接受的赋形剂。
134.呈液体形式的典型组合物包括溶液、乳液、悬浮液、糖浆。
135.包含在本发明组合物中的用本发明方法获得的蜂粮或经发酵的花粉可以以可变的量存在,例如以按重量计在0.0001%至100%;按重量计0.001%至50%,按重量计0.1%至按重量计20%,通常按重量计0.5%至5%的范围内被包含。
136.根据某些实施方案,本发明的组合物还包含一种或更多种活性物质,诸如维生素、矿物质、微量营养素和其他活性物质。
137.根据一些实施方案,用于口服施用的组合物是功能性食品、营养组合物、饮食产品、补充剂或营养产品。
138.组合物可以以常规剂型销售,诸如含有固体组分或固体组分在液体中的分散体的热熔铝型小袋的小袋或棒状包装(stick pack),用于在液体中临时重构固体的容器,含有分散在食品级油或其他相容液体中的固体的硬胶囊或软胶囊,含有固体在液体中的分散体的小瓶或瓶子。
139.根据一些方面,本发明涉及根据本文所述方法的任一实施方案获得的蜂粮或包含其的组合物,用于治疗代谢、心血管、骨、脑或肠道疾病或作为肠道微生物功能的驱动物。
140.根据其他方面,本发明提供了根据本文所述方法的任一实施方案获得的蜂粮或包含其的组合物通过口服摄取用于治疗的用途或皮肤美容用途,特别是作为抗衰老治疗或减少皮肤衰老;用于毛发治疗的用途。
141.用本发明的方法获得的蜂粮具有细胞抗氧化活性,并用于预防或治疗引起非生理性产生自由基的疾病,典型地皮肤病诸如肿瘤、癌前疾病或光化性疾病或发红状态,诸如晒伤引起的、皮肤瑕疵、粗糙或皮肤老化。此外,本发明的蜂粮可用于使个体得生物体维持在生理健康条件。
142.根据另一方面,本发明提供了选自pf12、pf15和pl13的属于昆氏乳杆菌物种的选择的乳酸菌及其混合物。
143.由于与属于同一物种的其他菌株相比,如下表1所示的生长、酸化能力,如下表2和3所示的抗菌化合物产生惊人地提高,发明人已经选择了昆氏乳杆菌pf12、pf15和pl13菌株。
144.例如,用于选择昆氏乳杆菌pf12、pf15和pl13细菌菌株的方案描述如下。该方案在以下实施例1中更详细地描述,包括测试从花、花粉、蜂粮和从蜜蜂胃肠道分离的细菌菌株。
145.测试了所鉴定菌株的生长、酸化和抗微生物化合物产生的能力。
146.花粉水性提取物被用作细菌生长的模型系统。花粉提取物根据以下程序获得。
147.向100克花粉加入玻璃珠,与1升蒸馏水混合,并以500rpm搅拌2小时。将混合物以
10,000
×
g离心20分钟。收集上清液,并且残留物进一步依次分别用1升酸化甲醇(0.1%hcl,v/v)、己烷/丙酮/乙醇50∶25∶25(v/v/v)的混合物和沸水提取,如上所述。将所有提取物干燥并溶解在10ml二甲基亚砜(dmso)中,混合在一起,并在蒸馏水中进一步稀释至最终体积为1升。将花粉提取物通过在0.22μm孔隙率的膜上无菌过滤灭菌。将菌株以约7.0log cfu/ml的最终细胞密度单独接种,并将花粉提取物在30℃孵育24小时。监测生长和酸化,并使用gompertz方程对菌株的生长和酸化动力学进行数学建模。针对8种劣化或致病指示细菌和8种指示真菌测试菌株的抗微生物活性。为了测试菌株的抗微生物活性,将乳酸菌在花粉提取物中于30℃生长24小时,并通过在4℃以10000
×
g离心10分钟回收上清液,并通过在具有0.22μm孔隙率的膜上无菌过滤灭菌。抗细菌活性通过琼脂扩散孔测定,而抗真菌活性通过琼脂稀释测定法测定。
148.下面的表1显示了细胞密度的数据(表示为光密度,do
620
)和酸化的数据(表示为在30℃用属于不同物种并从花、花粉、蜂粮和从蜜蜂的胃肠道分离的乳酸菌菌株发酵24小时的花粉提取物中的ph变化)(δph)。
149.表1.
150.151.152.[0153][0154]
从实验数据中可以看出,选择的昆氏乳杆菌pf12、pf15和pl13菌株具有比属于同一细菌物种的其他测试菌株令人惊讶的更高的生长和酸化能力。
[0155]
下表2显示了用乳酸菌菌株在30℃发酵24小时的花粉提取物的抑制谱
*
。针对8株致病或劣化的指示细菌测试了抗菌活性。未发酵的花粉提取物用作对照。
[0156]
表2.
[0157]
[0158][0159]
*抗细菌活性评价如下:
‑
,无抑制; ,直径<1mm的抑制晕(inhibition halo); ,直径为1
–
2.5mm的抑制晕; ,直径为2.5
–
4.0mm的抑制晕; ,直径为4.0
–
6mm的抑制晕;
,直径>6mm的抑制晕。
[0160]
生长条件:金黄色葡萄球菌dsm 20231,胰蛋白酶大豆酵母提取物培养基,37℃;单核细胞增生李斯特菌atcc 19115,脑心输注培养基,37℃;大肠杆菌dsm 30083,luria
‑
bertani肉汤,37℃;巨大芽孢杆菌f6,luria
‑
bertani肉汤,30℃;成团泛菌dtb8,营养肉汤,30℃;赫氏埃希菌ps2,营养肉汤,30℃;粘质沙雷氏菌dr8,营养肉汤,30℃;粘质沙雷氏菌dr10,营养肉汤,30℃。
[0161]
下表3显示了用乳酸菌在30℃发酵24小时的花粉提取物的抑制谱
*
。针对8株指示真菌测试了抗真菌活性。相对于指示菌株在补充有未发酵花粉提取物的马铃薯葡萄糖琼脂(pda)上的生长来计算菌丝生长的抑制百分比。
[0162]
表3.
[0163]
[0164][0165]
*抗真菌活性评价如下:
‑
,无抑制; ,菌丝径向生长抑制<25%; ,菌丝径向生长抑制25
‑
50%; ,菌丝径向生长抑制50
‑
75%; ,菌丝径向生长抑制>75%。
[0166]
生长条件:马铃薯葡萄糖琼脂,在25℃持续8天。
[0167]
表2和表3的实验数据进一步突出了,选择的昆氏乳杆菌pf12、pf15和pl13菌株具
有比所测试的属于相同或其他细菌物种的其他菌株令人惊讶的更高的抗微生物活性。
[0168]
术语
[0169]
在本发明的上下文中,术语花粉是指由职蜂收集并由它们加工的虫媒花粉;所述花粉可以来自单一植物物种(单花属(monoflora))或来自若干植物物种(多花属(multiflora))。
[0170]
功能性食品是指除了包含在其中的传统营养物之外,能够提供益处或保护免受问题或生理状况影响的任何改性的食物或食物成分。
[0171]
营养产品是指从可食用物质分离或纯化的产品。营养制品是当表明其具有生理益处或提供针对问题或生理障碍的保护时的制品。
[0172]
膳食补充剂或食品补充剂意指包含维生素、矿物质、植物提取物、氨基酸、代谢物、提取物、浓缩物或这些成分的混合物的产品。
[0173]
术语可食用载体是指任何可用于配制食品、营养制品或膳食/食品补充剂的可食用载体。
[0174]
在本说明书的范围内,用本发明的方法获得的术语蜂粮和经发酵的花粉表示相同的产品,并且是可互换的。
[0175]
在之前的章节中描述的属于现有技术的传统蜂粮的感官和/或营养特性与用本发明方法获得的经发酵的花粉基本相似。
[0176]
提供以下实施例仅为了本发明的一些实施方案的说明性目的。
[0177]
实施例1
[0178]
用于选择昆氏乳杆菌pf12、pf15和pl13细菌菌株的方案
[0179]
为了选择乳酸促酵细菌的3种菌株,测试了属于不同物种和从花、花粉、蜂粮和蜜蜂胃肠道分离的93种菌株生长、酸化和产生抗微生物化合物的能力。
[0180]
花粉提取物被用作细菌生长的模型系统。花粉提取物如下获得。
[0181]
向100克花粉加入玻璃珠,与1升蒸馏水混合,并以500rpm搅拌2小时。将混合物以10000
×
g离心20分钟。收集上清液,并且残留物进一步依次分别用1升酸化甲醇(0.1%hcl,v/v)、己烷/丙酮/乙醇50∶25∶25(v/v/v)的混合物和沸水提取,如上所述。将所有提取物干燥并溶解在10ml二甲基亚砜(dmso)中,混合在一起,并在蒸馏水中进一步稀释至最终体积为1升。将花粉提取物通过在0.22μm孔隙率的膜上无菌过滤灭菌。将菌株以约7.0log cfu/ml的最终细胞密度单独接种,并将花粉提取物在30℃孵育24小时。监测生长和酸化,并使用gompertz方程对菌株的生长和酸化动力学进行数学建模。针对8种劣化或致病指示细菌和8种指示真菌测试菌株的抗微生物活性。为了测试菌株的抗微生物活性,将乳酸菌在花粉提取物中于30℃生长24小时,并通过在4℃以10000
×
g离心10分钟回收上清液,并通过在具有0.22μm孔隙率的膜上无菌过滤灭菌。抗细菌活性通过琼脂扩散孔测定,而抗真菌活性通过琼脂稀释测定法测定。
[0182]
选择昆氏乳杆菌pf12、pf15和pl13菌株,因为它们具有更好的生长、酸化(上文表1)和产生抗微生物化合物(上文表2和3)的能力。
[0183]
实施例2
[0184]
利用乳酸菌发酵花粉提取物
[0185]
根据实施例1中描述的方案获得的花粉提取物用作93种乳酸菌生长的模型系统,
以测试其生长和酸化能力。将菌株在fyp肉汤(每升蒸馏水10g d
‑
果糖、10g酵母提取物、5g聚蛋白胨
*
、2g乙酸钠、0.5g吐温80、0.2g mgso4·
7h2o、0.01g mnso4·
4h2o、0.01g feso4·
7h2o、0.01g nacl[ph 6.8])中于30℃生长24小时。将细胞通过离心(10000
×
g,4℃10分钟)回收,在50mm磷酸盐缓冲液ph 7.0中洗涤两次,并悬浮于花粉提取物中至约7log cfu/ml的最终密度。然后将花粉提取物在30℃孵育24小时。在孵育过程中监测生长(光密度,do
620
)和酸化(ph变化,δph)。
[0186]
结果
[0187]
测试了属于不同物种的93种乳酸菌菌株在花粉提取物中的生长和酸化能力(表1)。最高的细胞密度值(do
620 1.473
‑
2.102)和最高的酸化能力在用属于昆氏乳杆菌物种的菌株发酵的花粉提取物中发现(表1)。
[0188]
实施例3
[0189]
用选择的乳酸菌菌株发酵的花粉提取物的抗微生物活性。
[0190]
为了测试乳酸菌在花粉发酵期间产生抗微生物化合物的能力,如实施例1所述地在花粉提取物中生长细菌,并通过离心(10000
×
g,在4℃10分钟)回收上清液,并通过在具有0.22μm孔隙率的膜上无菌过滤灭菌。提取物的抗细菌活性通过从琼脂孔的扩散测定来测定。在由15ml琼脂
‑
水(2%琼脂,w/v)和5ml用于指示菌株生长的特定琼脂培养基(表2)组成的双层上进行分析,并用从在最佳生长温度孵育24小时的指示菌株的培养物回收的细胞接种至约4log cfu/ml的细胞密度。在双层中制作孔(直径5mm),并向每个孔加入100μl的经发酵的花粉提取物和无细胞的花粉提取物。未发酵的花粉提取物用作对照。将平板在4℃储存1小时,以允许花粉提取物径向扩散,并在30℃或37℃孵育24小时。提取物的抗真菌活性通过琼脂稀释测定来测定,评价用作指标的真菌菌丝的径向生长率(表3)。将经发酵的花粉提取物和无细胞的花粉提取物以30%(v/v)的浓度添加到生长培养基(马铃薯葡萄糖琼脂,pda),并将15ml培养基倒入培养皿(直径90mm)。对照平板仅含pda,不添加花粉提取物。通过将直径为3mm的菌丝盖放置在含有培养基的培养皿的中心来进行测定。在有氧条件于25℃孵育8天后确定菌丝的径向生长(以mm计的直径)。生长抑制百分比计算如下:[(对照中菌丝的生长
‑
存在花粉提取物时菌丝的生长)/对照中菌丝的生长]x 100。结果表示为菌丝生长的至少4次测量的平均值。
[0191]
结果
[0192]
发酵花粉提取物具有高的抗菌和抗真菌活性,显著(p<0.05)高于未发酵花粉提取物(表2和表3)。以混合促酵剂的形式使用昆氏乳杆菌pf12、pf15和pl13菌株确保了最宽的抑制谱。
[0193]
实施例4
[0194]
用于制备和孵育昆氏乳杆菌pf12、pf15和pl13培养物的方案
[0195]
1)在30℃在fyp肉汤(每升蒸馏水10g d
‑
果糖、10g酵母提取物、5g聚蛋白胨
*
、2g乙酸钠、0.5g吐温80、0.2g mgso4·
7h2o、0.01gmnso4·
4h2o、0.01g feso4·
7h2o、0.01g nacl[ph 6.8])中生长昆氏乳杆菌pf12、pf15和pl13菌株24小时。
[0196]
2)将每种培养液在4℃以10000
×
g离心10分钟。
[0197]
3)除去上清液并将细胞重悬在生理溶液(9g/l nacl)中。
[0198]
4)将每种细胞悬液在4℃以10000
×
g离心10分钟。
[0199]
5)除去上清液并将细胞重悬在生理溶液(9g/l nacl)中。
[0200]
6)将每种细胞悬液在4℃以10000
×
g离心10分钟。
[0201]
7)除去上清液并将细胞重悬在生理溶液(9g/l nacl)中。
[0202]
8)使每种细胞悬液达到9log cfu/ml的细胞密度,对应于在含有100μl细胞悬液和900μl水的比色皿上在620nm波长的分光光度计上读取的0.25的光密度。
[0203]
9)按照1∶10的比例向每种菌株的细胞悬液加入花粉(花粉被预先解冻并置于室温),以获得对应于8log cfu/g的最终接种物。
[0204]
*聚蛋白胨可以用其他蛋白水解物(例如蛋白胨、肉膏、胰蛋白胨)代替。
[0205]
实施例5
[0206]
用于制备和接种异常威克汉姆酵母或葡萄有孢汉逊酵母an8y27b或属于wickerhamomyces属或有孢汉逊酵母属的其他酵母的培养物的方案:
[0207]
1)在30℃在酵母提取物蛋白胨葡萄糖肉汤(ypd,oxoid)中生长异常威克汉姆酵母或葡萄有孢汉逊酵母an8y27b或属于wickerhamomyces属或有孢汉逊酵母属的另一种酵母48
‑
72小时。
[0208]
2)将培养液在4℃以10000
×
g离心10分钟。
[0209]
3)除去上清液并将细胞重悬在生理溶液(9g/l nacl)中。
[0210]
4)将细胞悬液在4℃以10,000
×
g离心10分钟。
[0211]
5)除去上清液并将细胞重悬在生理溶液(9g/l nacl)中。
[0212]
6)将细胞悬液在4℃以10000
×
g离心10分钟。
[0213]
7)除去上清液并将细胞重悬在生理溶液(9g/l nacl)中。
[0214]
8)使细胞悬液达到7log cfu/ml的细胞密度,对应于在含有100μl细胞悬液和900μl水的比色皿上在600nm波长的分光光度计上读取的0.1的光密度。
[0215]
9)将细胞悬液在4℃以10000
×
g离心10分钟,除去上清液,并以比初始体积低100倍的体积重悬细胞。
[0216]
10)按照1∶10的比例向菌株的细胞悬液加入花粉(花粉被预先解冻并置于室温),以获得对应于8log cfu/g的最终接种物。
[0217]
实施例6
[0218]
用于制备和孵育昆氏乳杆菌pf12、pf15和pl13培养物的方案
[0219]
1)在30℃在fyp肉汤(每升蒸馏水10g d
‑
果糖、10g酵母提取物、5g聚蛋白胨
*
、2g乙酸钠、0.5g吐温80、0.2g mgso4·
7h2o、0.01gmnso4·
4h2o、0.01g feso4·
7h2o、0.01g nacl[ph 6.8])中生长昆氏乳杆菌pf12、pf15和pl13 24小时,用于制备预接种物。
[0220]
2)将每种菌株的预接种物的培养物以10%转移到生长培养基中,所述生长培养基用颗粒形式的干燥花粉制备并储存在 4℃,花粉用研磨机或制粒机预处理以至少部分地破坏花粉粒的外包裹层,重悬在浓度为10%和20%(重量/重量)之间的无菌软化水中,并使其ph值为5.25
±
0.25之间;在30℃孵育24小时。
[0221]
3)将每种菌株的培养物按1∶10的比例接种到生物反应器中,从而得到对应于7
‑
8log cfu/g的最终接种物。用干燥成颗粒并储存在 4℃的花粉制备生长培养基,如第1点所述,花粉被预处理以削弱花粉粒的外壁,重悬在无菌软化水中至10%和20%之间的浓度。
[0222]
*聚蛋白胨可以用其他蛋白水解物(例如细菌蛋白胨、肉膏、胰蛋白胨)代替。
[0223]
实施例7
[0224]
使用包含选择的菌株昆氏乳杆菌pf12、pf15和pl13以及酵母葡萄有孢汉逊酵母an8y27b的混合促酵剂发酵新鲜花粉。
[0225]
1)原料:未经预处理并储存在
‑
20℃的新鲜花粉。
[0226]
2)接种包含昆氏乳杆菌pf12、pf15和pl13以及以108cfu/g的细胞密度接种的葡萄有孢汉逊酵母an8y27b的混合促酵剂。实施例4和5中描述了用于制备和接种昆氏乳杆菌pf12、pf15和pl13以及葡萄有孢汉逊酵母an8y27b培养物的方案。
[0227]
3)加入蒸馏水,直到最终湿度为40%(最终湿度值还必须包括花粉的初始含水量[约21.56%]和接种步骤期间加入的水)。
[0228]
4)在50ml无菌试管中于30℃孵育216小时。
[0229]
结果
[0230]
确定了新鲜花粉的发酵方案,该方案包括接种包含昆氏乳杆菌pf12、pl13和pf15的选择菌株以及葡萄有孢汉逊酵母an8y27b的混合促酵剂至8log cfu/g的密度,并在30℃孵育216小时,最终花粉湿度为40%。在发酵期间,通过在fyp琼脂上平板计数和确定可滴定酸度(tta)来监测孵育期间乳酸菌的生长和酸化(图1)。在未接种花粉的自发发酵(对照)期间监测tta乳酸菌的细胞密度,除了混合促酵剂接种之外,所述未接种花粉在相同条件处理(图1)。加入选择的混合促酵剂后,花粉中乳酸菌的细胞密度在96小时后达到约9log cfu g
‑1,并保持恒定直到144小时,并在剩余的孵育时间内降至约7log cfu g
‑1。然而,在花粉的自发发酵期间,乳酸菌仅在120小时后达到约9log cfu g
‑1的密度,并在剩余的孵育时间内迅速降至4log cfu g
‑1。发酵期间tta的增加与乳酸菌的生长一致。在花粉的自发发酵期间,与用选择的混合促酵剂进行的发酵相比,酸化较慢且较不强烈(p<0.05)。
[0231]
实施例8
[0232]
花粉发酵方案
[0233]
1)原料:未预处理并储存在
‑
20℃的新鲜花粉,或储存在 4℃或室温,并通过粉化和校正花粉的ph直到达到5.25 /
‑
0.25之间的值进行预处理的干燥或经除湿的花粉,
[0234]
2)以107cfu/g的细胞密度接种包含选择的乳酸菌昆氏乳杆菌pf12、pf15和pl13以及酵母异常威克汉姆酵母的混合促酵剂,
[0235]
3)加入蒸馏水至最终湿度为70%,
[0236]
4)在无菌试管或生物反应器中于30℃孵育60小时。
[0237]
经发酵的花粉在liostat中冷冻干燥。
[0238]
实施例9
[0239]
在机械预处理条件下,在生物反应器中使用选择的昆氏乳杆菌pf12、pf15和pl13菌株,无酵母接种的花粉发酵方案
[0240]
1)原料:干燥成颗粒并储存在 4℃的花粉,花粉在研磨机或制粒机中进行机械预处理,以打破花粉粒的外壁,重悬在生物反应器中的无菌软化水中至10%和20%(重量/重量)之间的浓度,最终体积为5l。
[0241]
2)校正ph值,直到达到5.25 /
‑
0.25之间的值。
[0242]
3)以107和108cfu/g之间的细胞密度接种包含昆氏乳杆菌pf12、pf15和pl13的促酵剂。用于制备和接种昆氏乳杆菌pf12、pf15和pl13的培养物的方案在以下实施例6中描述。
[0243]
4)在30℃孵育2
‑
4天,同时以70
‑
100rpm搅拌,以保持发酵培养基均匀。
[0244]
5)经发酵的花粉在liostat中冷冻干燥(9a)或通过喷雾干燥干燥(9b)。
[0245]
实施例10
[0246]
在热预处理条件下,在生物反应器中使用选择的昆氏乳杆菌pf12、pf15和pl13菌株、无酵母接种的花粉发酵方案
[0247]
1)原料:颗粒状的经除湿的花粉,热预处理(121℃,15秒),重悬在生物反应器中的无菌软化水中,浓度为10%至20%(重量比)之间,最终体积为5升。
[0248]
2)校正ph值,直到达到5.25 /
‑
0.25之间的值。
[0249]
3)以107和108cfu/g之间的细胞密度接种包含昆氏乳杆菌pf12、pf15和pl13的促酵剂。用于制备和接种昆氏乳杆菌pf12、pf15和pl13的培养物的方案在以下实施例6中描述。
[0250]
4)在30℃孵育2
‑
4天,同时以70
‑
100rpm搅拌,以保持发酵培养基均匀。
[0251]
5)经发酵的花粉在liostat中冷冻干燥(10a)或通过喷雾干燥干燥(10b)。
[0252]
实施例11
[0253]
使用包含选择的菌株昆氏乳杆菌pf12、pf15和pl13以及酵母葡萄有孢汉逊酵母an8y27b的混合促酵剂对经发酵的花粉的营养增强。
[0254]
从化学和营养的角度对根据实施例7中描述的方案获得的经发酵的花粉进行了表征。花粉中的单一氨基酸、总氨基酸和游离氨基酸含量通过配备有阳离子交换柱的biochrom 30氨基酸分析仪(biochrom ltd.,cambridge science park,england)确定(图2)。模拟体外消化的多阶段方案用于估计花粉蛋白质的可消化性(图3)。此外,花粉的肽谱使用配备有superose 1210/300gl柱和214nm uv检测器的fplc系统分析(图3)。可溶于水和甲醇的游离酚类化合物的含量通过folin
‑
ciocalteu测定确定(图4)。
[0255]
结果
[0256]
与新鲜花粉相比,在使用包含昆氏乳杆菌pf12、pl13和pf15以及葡萄有孢汉逊酵母an8y27b的混合促酵剂的经发酵的花粉中,观察到总游离氨基酸(图2)和肽(图3)的显著增加(p<0.05),分别为约14和12g kg
‑1(干重)。此外,与新鲜花粉(62.11
±
0.8%)相比,经发酵的花粉显示出更高含量的可消化蛋白质(75.14
±
0.7%)(p<0.05)(图3)。此外,与新鲜花粉(8.43
±
0.85和45.73
±
4.81g没食子酸当量kg
‑1干重)相比,在经发酵的花粉中发现了更高水平(p<0.05)的水溶性(15.98
±
0.64g没食子酸当量kg
‑1干重)和可溶于甲醇(69.53
±
4.52g没食子酸当量kg
‑1)的游离酚类化合物。
[0257]
实施例12
[0258]
1.实验测试
[0259]
2.实验研究的目的
[0260]
下面报告的实验程序旨在研究不同测试的经发酵的花粉(蜂粮)的体外活性,以表征其对人类角质形成细胞系的抗氧化活性和抗炎活性(tnf
‑
α)。
[0261]
3.材料
[0262]
3.1测试样品
[0263]
*选择的促酵剂包含昆氏乳杆菌pf12、pf15和pf3以及异常威克汉姆酵母lcf1695
[0264][0265]
将发酵产物在30℃保持12小时。
[0266]
所有提取物在培养基中稀释50mg/ml(100%溶液
‑
溶解度贮存物),并无菌过滤(5mg/ml)。在
‑
20℃储存贮存物。
[0267]
3.2使用的试剂和仪器
[0268][0269]
[0270][0271]
3.3使用的生物学模型
[0272]
3.3.1人类角质形成细胞的培养物
[0273]
使用人类角质形成细胞nctc2544的永生化系(perry v.p.等人,1957),在无菌烧瓶(25cm3)中培养,在37℃在5%co2的潮湿气氛中在补充有胎牛血清(fbs)、在1%青霉素和链霉素以及0.1%庆大霉素存在下的2mm谷氨酰胺的rpmi培养基中孵育。
[0274]
1:3平分(split)每2天进行一次,通过用1
×
pbs(磷酸盐缓冲液,无ca
2
和mg
2
)洗涤并在37℃用胰蛋白酶
‑
edta溶液分离细胞2分钟,获得单层。在25cm3无菌烧瓶中保持细胞培养,并在5%co2的潮湿气氛中于37℃孵育。
[0275][0276]
3.3.2对照
[0277]
3.3.2.1诱导的氧化应激
‑
mtt测试
[0278]
阴性对照:在补充有2.5%胎牛血清(fbs)、谷氨酰胺2mm、存在1%青霉素和链霉素以及0.1%庆大霉素的rpmi中并在37℃和5%co2(在黑暗中)被保存在(96孔)培养板中的未处理的细胞。
[0279]
阳性对照:在补充有2.5%胎牛血清(fbs)、谷氨酰胺2mm、存在1%青霉素和链霉素以及0.1%庆大霉素的rpmi中的用1mm过氧化氢处理2h并在37℃和5%co2(在黑暗中)保存在(96孔)培养板中的细胞。
[0280]
3.3.2.2抗炎活性研究
[0281]
阴性对照:在补充有2.5%胎牛血清(fbs)、谷氨酰胺2mm、存在1%青霉素和链霉素以及0.1%庆大霉素的rpmi中并在37℃和5%co2被保存在(12孔)25cm2培养板中的未处理的细胞。
[0282]
阳性对照:在补充有2.5%胎牛血清(fbs)、谷氨酰胺2mm、存在1%青霉素和链霉素
以及0.1%庆大霉素、10μg/ml lps的rpmi中并在37℃和5%co2被保存在(12孔)25cm2培养板中的未处理的细胞。
[0283]
4.方法
[0284]
4.1对人类角质形成细胞系nctc2544诱导的氧化应激的保护的研究
[0285]
4.2.1方法的原理
[0286]
由rajapakse及同事在2005年进行的研究(2005)证明了使用广泛使用的且通用的方法诸如mtt测定的方法研究活性化合物的体外抗氧化剂活性的可能性。具体地,通过该方法可以研究这些化合物对随后经历氧化应激的细胞的保护作用。氧化应激的诱导通过与过氧化氢一起孵育进行,过氧化氢是一种通过形成ros来诱导细胞中产生氧化损伤的剂。任何保护作用可以通过评价在预处理/预暴露于待测试的活性化合物的细胞的氧化应激后的细胞与经历相同的氧化应激的细胞相比的生存力来确定。较高的细胞生存力将对应于测试化合物的保护作用。
[0287]
4.2.2实验程序
[0288]
该测定根据由coda及合作者(coda等人,2012)描述的方法进行,有一些修改。
[0289]
将人类角质形成细胞nctc2544以5*104个细胞/孔的密度接种在96孔板中,并且在37℃、在5%co2孵育直至约80%汇合。
[0290]
然后,将细胞与待测试的活性化合物和相应的对照在下列浓度孵育16小时:对于样品b、fer867、fer868、fer869、fer870和fer871分别为100
‑
250和500μg/ml。
[0291]
稀释物从dmso中50mg/ml的储备液开始制备,无菌过滤,并使用补充有2.5%胎牛血清(fbs)、2mm谷氨酰胺、存在1%青霉素和链霉素以及0.1%庆大霉素的rpmi培养基。
[0292]
将用1mm h2o2处理的细胞用作阳性对照;相反,将维持在单独的培养基(rpmi 2.5%fbs)中的细胞用作阴性对照。
[0293]
α生育酚分别以100、250和500μg/ml的浓度作为参考抗氧化剂进行测试。
[0294]
在16小时的预处理后,用pbs 1x洗涤细胞,并且在37℃和5%co2,在黑暗中,将其与无血清培养基中的1mm h2o2溶液(sigma
‑
aldrich,st.louis,mo,usa)孵育90分钟。
[0295]
在氧化应激诱导步骤结束后,根据第4.1.2点中描述的方法(mtt测定)评价多种样品的细胞生存力。
[0296]
根据以下公式,将数据表示为相比于非应激的对照细胞(ctr)的细胞生存力百分比:
[0297]
%细胞生存力/ctr=(abs样品/absctr)*100
[0298]
所有测定一式两份地进行至少两次。
[0299]
4.3抗炎活性(tnf
‑
α)的研究
[0300]
4.4.1实验程序
[0301]
通过相对定量rt
‑
pcr(定量逆转录聚合酶链式反应
‑
qrt
‑
pcr)评价nctc2544细胞中tnf
‑
α炎性标志物的基因表达。
[0302]
该分析需要3个连续的步骤:
[0303]
·
总rna的提取;
[0304]
·
逆转录成cdna;
[0305]
qrt
‑
pcr。
[0306]
将人类角质形成细胞nctc2544以0.5*106个细胞/孔的密度接种在12孔板中,并且孵育直至约80%汇合。
[0307]
然后,将细胞分别与样品b、fer867、fer868、fer869、fer870和fer871以下列浓度一起孵育16和24小时:100、250和500μg/ml。
[0308]
稀释物从补充有2.5%胎牛血清(fbs)、2mm谷氨酰胺、存在1%青霉素和链霉素以及0.1%庆大霉素的培养基(rpmi)中50mg/ml的储备液开始制备。
[0309]
以10μg/ml的量使用lps(脂多糖)作为炎症诱导剂,并与处理溶液共同孵育16和24小时。
[0310]
将维持在单独的培养基(rpmi 2.5%fbs)中的细胞用作阴性对照。
[0311]
将维持在单独的培养基(rpmi 2.5%fbs)和10μg/ml lps中的细胞改为用作阴性对照。
[0312]
孵育后,提取rna。
[0313]
根据chomczynski和mackey(1995)描述的,从nctc2544细胞提取总rna。
[0314]
在与感兴趣的活性化合物一起孵育后,用pbs(1x)洗涤细胞,并且最后进行rna提取程序。提取后,使用qiaexpert(qiagen)仪器对提取的rna进行定量,并计算在260nm波长提取的以μg/ml计的总rna的浓度。
[0315]
最后,通过在1%琼脂糖凝胶上进行电泳来评价rna(2μg/ml)的完整性。
[0316]
使用能够使用rna链作为模板合成dna分子的酶将总rna转化成cdna(互补dna);该依赖rna的dna聚合酶被称为逆转录酶。
[0317]
逆转录酶结合单链rna的3’末端,并且通过随机引物和脱氧核苷三磷酸(dntp)合成cdna链。
[0318]
对于该目的,使用商业试剂盒“primescript
tm rt reagent kit(perfect real time)”(takarabioinc.,japan),其包含5x primescript缓冲液(用于实时);primescript rt酶混合物1;oligodtprimer;random 6mers;无rna酶的2dh2o。
[0319]
将提取并定量的rna稀释至2μg/ml的浓度并逆转录成cdna。制备10μl主混合物(包含5x primescript缓冲液(用于实时)、primescript rt酶混合物1、oligodtprimer 50μm、random 6mers 100μm),向其添加10μl的rna(2μg/ml)。
[0320]
将样品放置在热循环仪(stratagene mx3000p实时pcr系统,agilent technologies italy s.p.a.,milan,italy)中,并且在以下条件下进行逆转录:
[0321]
37℃持续15分钟;
[0322]
85℃持续5秒;
[0323]
保持4℃。
[0324]
在逆转录后,向样品添加30μl的depc水,以获得终浓度40ng/μl的cdna。
[0325]
qrt
‑
pcr是一种实时扩增并通过监测反应期间发射的荧光定量扩增产物的方法。
[0326]
对于rt
‑
pcr扩增,使用了(appliedbiosystems)探针系统。使用了以下taqman探针:hs00174128_m1(tnf
‑
α)和hs99999905_m1(gapdh)。将gapdh.hs99999905_m1用作对照基因(管家)。
[0327]
taqman探针是允许荧光随着扩增发展而显现的探针类型。报告物(荧光团fam
tm
)结合在其5’末端,而猝灭剂结合在其3’末端。报告物和猝灭剂之间的接近阻止了荧光信号的
发射。仅用热稳定的dna聚合酶(taq聚合酶)的5’核酸外切酶活性检测荧光,并且可以通过报告物的荧光的增加来评价扩增产物的累积,该报告物的荧光随每个循环而增加。
[0328]
用于qrt
‑
pcr的主混合物设置如下:
[0329]
·
10μl“2x premix ex taq”;
[0330]
·
1μl“20
×
taqman基因表达测定”(包含2种引物和荧光团标记的荧光探针fam
tm
);
[0331]
·
0.4μl参比荧光rox ii
[0332]
·
5μl depc水
[0333]
对于靶基因,向主混合物添加4μl的cdna,并且对于管家基因,添加1μl的cdna。
[0334]
在以下条件下进行40轮扩增:
[0335]
·
95℃,30秒(扩增激活);
[0336]
·
95℃,5秒(变性)
[0337]
·
60℃,20秒(退火
‑
延伸);
[0338]
每个分析以一式两份进行。
[0339]
根据2
‑
δδct
方法分析获得的数据,并且因此可以计算相对于管家基因归一化的并且关于对照样品(未处理的细胞)校准的感兴趣的基因的相对表达值:
[0340]
δδct=δct
靶
‑
管家
(对照)
‑
δct
靶
‑
管家
(处理的细胞)
[0341]
假设扩增效率为100%,计算2
‑
δδct
。
[0342]
5.结果
[0343]
5.1针对诱导的氧化应激的保护测定
[0344]
图5显示了与已知作用的抗氧化剂α
‑
生育酚相比,对测试样品的诱导氧化应激的保护活性的相关数据。
[0345]
结果表明,在浓度为250和500μg/ml时,所有分析的化合物对诱导的氧化应激都有显著的保护活性,并且这种活性与α
‑
生育酚相当。
[0346]
5.2抗炎活性(tnf
‑
α)的研究
[0347]
附图6a和6b显示了分别在100
‑
250和500μg/ml浓度用样品b(对照)、fer867、fer868、fer869、fer870和fer871分别处理16小时(图6a)和24小时(图6b)后的tnf
‑
α基因表达数据。
[0348]
经过16小时的处理后,在100、250和500μg/ml浓度测试的样品b和fer867显示出最显著的抗炎活性(图6a)。
[0349]
抗炎活性在处理24小时后更明显(图6b),特别是对于fer867样品。
[0350]
6.结论
[0351]
综上,对于在250和500μg/ml的浓度测试的所有样品,所进行的测试显示出对诱导氧化应激的显著保护活性(图5)。
[0352]
此外,抗炎活性的研究表明,在处理16小时后,以100和250μg/ml的浓度测试的样品b、fer867显示出显著的抗炎活性(图6a)。
[0353]
对于化合物fer869,500μg/ml的浓度显著降低了tnf
‑
α相关的mrna表达。浓度为100μg/ml和500μg/ml的fer871显示mrna产生减少。处理24小时后,测试化合物的抗炎活性更明显(图6b),特别是对于fer867化合物。
[0354]
文献目录
[0355]
arch dermatol res 1976;256(3):255
‑
260
‑
pmid:990102
[0356]
arch dermatol res 1976;261(1):27
‑
31
[0357]
mosmann t,1983.rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays.j immunol methods 65(1
‑
2),55
‑
63.
[0358]
rajapakse n,mendis e,byun hg,kim sk,2005.purification and in vitro antioxidative effects of giant squid muscle peptides on free radical
‑
mediated oxidative systems.j nutrbiochem 16(9),562
‑
569.
[0359]
coda r,rizzello cg,pinto d,gobbetti m,2012.selected lactic acid bacteria synthesize antioxidant peptides during sourdough fermentation of cereal flours.appl environ microbiol 78(4),1087
‑
1096.
[0360]
chomczynski p,mackey k.modification of the tri reagent procedure for isolation of rna from polysaccharide
‑
and proteoglycan
‑
rich sources.biotechniques 1995;19:942
‑
5.
[0361]
实施例13
[0362]
软胶胶囊(soft jelly capsule)
[0363]
每粒胶胶囊(珠(pearl))包含:
……………………………………………
q.ty u.m.
[0364]
参考实施例5的用选择的昆氏乳杆菌菌株pf12、pf15和pl13发酵、无酵母接种的花粉
………………………………………………………………………………………
100mg
[0365]
大豆油
………………………………………………………………………
250mg
[0366]
大豆卵磷脂
…………………………………………………………………
5mg
[0367]
脂肪酸的单甘油酯和二甘油酯
……………………………………………
30mg
[0368]
壳的成分:
[0369]
明胶
…………………………………………………………………………
145mg
[0370]
甘油
…………………………………………………………………………
67mg
[0371]
实施例14
[0372]
片剂
[0373]
每剂含有
……………………………………………………………………
q.ty u.m.
[0374]
参考实施例5的用选择的昆氏乳杆菌菌株pf12、pf15和pl13发酵、无酵母接种的花粉
………………………………………………………………………………………
200mg
[0375]
微晶纤维素
…………………………………………………………………
100mg
[0376]
biogaba[来自葡萄汁(葡萄(vitis vinifera l.)果实)、植物乳杆菌c48发酵的γ
‑
氨基丁酸]
…………………………………………………………………………
100mg
[0377]
聚乙烯吡咯烷酮
……………………………………………………………
35mg
[0378]
大米(水稻(oryza sativa l.)种子干提取物)
……………………………
50mg
[0379]
紫花苜蓿(紫花苜蓿(medicago sativa l.)花的干提取物)
……………
40mg
[0380]
小球藻(蛋白核小球藻(chlorella pyrenoidosa h.chick))菌体干提取物
………………………………………………………………………………………
30mg
[0381]
磷脂酰丝氨酸
………………………………………………………………
40mg
[0382]
蜜蜂花(蜜蜂花(melissa officinalis l.))叶和花的干提取物100mg
[0383]
加纳籽[单叶加纳籽(griffonia simplicifolia)(dc.)baill]种子干提取物
………………………………………………………………………………………
51mg
[0384]
l
‑
茶氨酸
……………………………………………………………………
12.6mg
[0385]
二氧化硅
……………………………………………………………………
10mg
[0386]
硬脂酸镁
……………………………………………………………………
10mg
[0387]
实施例15
[0388]
咀嚼片
[0389]
每剂含有
……………………………………………………………………
q.ty u.m.
[0390]
麦芽糖糊精
…………………………………………………………………
50
‑
300mg
[0391]
右旋糖
………………………………………………………………………
50
‑
300mg
[0392]
果糖
…………………………………………………………………………
50
‑
300mg
[0393]
参考实施例5的用选择的菌株昆氏乳杆菌pf12、pf15和pl13发酵、无酵母接种的花粉
………………………………………………………………………………………
100mg
[0394]
芳香剂(aroma)
……………………………………………………………
10
‑
30mg
[0395]
玉米淀粉
……………………………………………………………………
10
‑
30mg
[0396]
微晶纤维素
…………………………………………………………………
10
‑
30mg
[0397]
二氧化硅
……………………………………………………………………5‑
15mg
[0398]
亮氨酸
………………………………………………………………………5‑
15mg
[0399]
实施例16
[0400]
片剂
[0401]
每剂含有
……………………………………………………………………
q.ty u.m.
[0402]
磷酸钙
………………………………………………………………………
150mg
[0403]
参考实施例5的用选择的昆氏乳杆菌菌株pf12、pf15和pl13发酵、无酵母接种的花粉
………………………………………………………………………………………
50mg
[0404]
乳香(齿叶乳香树(boswellia serrata roxb.))干提取物树脂
…………
150mg
[0405]
十六酰胺乙醇(palmitoylethanolamide,pea)
……………………………
150mg
[0406]
biogaba[来自葡萄汁(葡萄果实)、植物乳杆菌c48发酵的γ
‑
氨基丁酸]
……………………………………………………………………………………
100mg
[0407]
γ
‑
氨基丁酸
…………………………………………………………………
49mg
[0408]
姜黄(姜黄(curcuma longa l.))根茎干提取物
…………………………
100mg
[0409]
微晶纤维素
…………………………………………………………………
50mg
[0410]
维生素d(胆骨化醇)
…………………………………………………………
0.005mg
[0411]
维生素b3(烟酰胺)
…………………………………………………………
16mg
[0412]
羟丙基纤维素
………………………………………………………………
30mg
[0413]
二氧化硅
……………………………………………………………………
6mg
[0414]
脂肪酸的单甘油酯和二甘油酯
……………………………………………
10mg
[0415]
维生素b1(硝酸硫胺)
………………………………………………………
1.36mg
[0416]
维生素b2(核黄素)
…………………………………………………………
1.4mg
[0417]
维生素b5(泛酸钙)
…………………………………………………………
6.5mg
[0418]
维生素b6(盐酸吡哆醇)
……………………………………………………
1.7mg
[0419]
维生素k2(甲萘醌
‑
7)
………………………………………………………
0.075mg
[0420]
vit b12(氰基钴胺)
…………………………………………………………
0.026mg
[0421]
实施例17
[0422]
片剂
[0423]
每剂含有
……………………………………………………………………
q.ty u.m.
[0424]
印度人参(ashwagandha)(南非醉茄(withania somnifera l.dunal))根干提取物
………………………………………………………………………………………
150mg
[0425]
参考实施例4的使用包含选择的菌株昆氏乳杆菌pf12、pf15和pl13以及酵母葡萄有孢汉逊酵母an8y27b的混合促酵剂发酵的花粉
…………………………………
50mg
[0426]
微晶纤维素
…………………………………………………………………
100mg
[0427]
氧化镁
………………………………………………………………………
100mg
[0428]
假马齿苋(假马齿苋(bacopa monnieri l.pennel))干提取物上部物
………………………………………………………………………………………
100mg
[0429]
biogaba[来自葡萄汁(葡萄果实)、植物乳杆菌c48发酵的γ
‑
氨基丁酸]
……………………………………………………………………………………
100mg
[0430]
磷酸钙
………………………………………………………………………
100mg
[0431]
γ
‑
氨基丁酸
…………………………………………………………………
49mg
[0432]
藏红花(藏红花(crocus sativus l.))花提取物
…………………………
30mg
[0433]
羟丙基甲基纤维素
…………………………………………………………
30mg
[0434]
双甘氨酸锌
…………………………………………………………………
10mg
[0435]
二氧化硅
……………………………………………………………………
7mg
[0436]
(6s)
‑5‑
甲基四氢叶酸,氨基葡萄糖盐
……………………………………
0.2mg
[0437]
硬脂酸镁
……………………………………………………………………
11mg
[0438]
实施例18
[0439]
免疫刺激剂棒30克
[0440]
参考实施例5的用选择的菌株昆氏乳杆菌pf12、pf15和pl13发酵、无酵母接种的花粉
………………………………………………………………………………………
2g
[0441]
葡萄糖和果糖糖浆
…………………………………………………………
10
‑
14g
[0442]
米片
…………………………………………………………………………
10
‑
12g
[0443]
向日葵卵磷脂
………………………………………………………………
0.5
‑
3g
[0444]
棕榈油(油棕(elaeis guinensis))
………………………………………
0.5
‑
3%
[0445]
玉米麦芽糖糊精
……………………………………………………………1‑
2g
[0446]
巴西莓(巴西莓(euterpe oleracea))脱水果实
…………………………3‑
4g
[0447]
葡萄干(vitis apyrena l.)脱水果实
……………………………………1‑
2g
[0448]
柠檬酸
………………………………………………………………………
q.b
[0449]
芳香剂
………………………………………………………………………
q.b
[0450]
实施例19
[0451]
硬胶胶囊
[0452]
每个硬胶胶囊包含:
………………………………………………………
q.ty u.m.
[0453]
参考实施例4的使用包含选择的菌株昆氏乳杆菌pf12、pf15和pl13以及酵母葡萄有孢汉逊酵母an8y27b的混合促酵剂发酵的花粉
…………………………………
200mg
[0454]
麦芽糖糊精
…………………………………………………………………5‑
50mg
[0455]
不溶性天然纤维
……………………………………………………………5‑
100mg
[0456]
硬脂酸镁
……………………………………………………………………1‑
10mg
[0457]
二氧化硅
……………………………………………………………………3‑
6mg
[0458]
天然胶外壳
[0459]
实施例20
[0460]
口服可溶性颗粒
[0461]
每个小袋包含:
……………………………………………………………
q.ty u.m.
[0462]
参考实施例4的使用包含选择的菌株昆氏乳杆菌pf12、pf15和pl13以及酵母葡萄有孢汉逊酵母an8y27b的混合促酵剂发酵的花粉
…………………………………
1000mg
[0463]
菊粉
…………………………………………………………………………
200
‑
600mg
[0464]
麦芽糖糊精
…………………………………………………………………
0.5
‑
3.0g
[0465]
苹果酸
………………………………………………………………………1‑
10mg
[0466]
芳香剂
……………………………………………………………………
10.0
‑
50.0mg
[0467]
三氯蔗糖
……………………………………………………………………
0.005mg
[0468]
实施例21
[0469]
棒状包装中的颗粒混合物
[0470]
每个小袋包含:
……………………………………………………………
q.ty u.m.
[0471]
参考实施例5的用选择的菌株昆氏乳杆菌pf12、pf15和pl13发酵、无酵母接种的花粉
………………………………………………………………………………………
500mg
[0472]
松果菊(松果菊(echinacea purpurea))地上部分干提取物
……………
300mg
[0473]
蜂蜜芳香剂
…………………………………………………………………
10mg
[0474]
菊粉
…………………………………………………………………………1‑
2g
[0475]
阿拉伯胶
……………………………………………………………………
0.5
‑
2g
[0476]
苹果酸
………………………………………………………………………0‑
100mg
[0477]
三氯蔗糖
……………………………………………………………………
0.005mg
[0478]
芳香剂
………………………………………………………………………
0.25mg
[0479]
实施例22
[0480]
片剂
[0481]
每个片剂包含:
[0482]
参考实施例5的用选择的菌株昆氏乳杆菌pf12、pf15和pl13发酵、无酵母接种的花粉
………………………………………………………………………………………
50mg
[0483]
微晶纤维素
…………………………………………………………………
50mg
[0484]
花椰菜(青花菜(brassica oleracea italica var.))花序干提取物
…
125mg
[0485]
biogaba[来自葡萄汁(葡萄果实)发酵的γ
‑
氨基丁酸]
…………………
100mg
[0486]
经发酵的花粉
………………………………………………………………
100mg
[0487]
芥菜(芥菜(brassica juncea l.czern.))种子干提取物
………………
75mg
[0488]
朝鲜蓟(洋蓟(cynara scolymus l.))叶干提取物
………………………
60mg
[0489]
西印度樱桃(西印度樱桃(malpighia glabra l.))果实干提取物
………
100mg
[0490]
甜橙(甜橙(citrus sinensis l.))果实干提取物
………………………
50mg
[0491]
磷酸钙
………………………………………………………………………
50mg
[0492]
甜菜根(甜菜(beta vulgaris l.))全株干提取物
………………………
50mg
[0493]
羟丙基纤维素
………………………………………………………………
20mg
[0494]
蜡杨梅(蜡杨梅(myrica cerifera l.))树皮干提取物
…………………
30mg
[0495]
黄芪(黄芪(astragalus membranaceus))根干提取物
……………………
30mg
[0496]
槲皮苷
………………………………………………………………………
30mg
[0497]
维生素e(三烯生育酚(tocotrienol)生育酚(tocopherol))
……………
6mg
[0498]
β
‑
谷甾醇
……………………………………………………………………
20mg
[0499]
番茄红素
……………………………………………………………………
10mg
[0500]
烟酰胺
………………………………………………………………………
16mg
[0501]
二氧化硅
……………………………………………………………………
10mg
[0502]
脂肪酸的单甘油酯和二甘油酯
……………………………………………
10mg
[0503]
鼬瓣花(galeopsis segetum necker)地上部分干提取物
………………
5mg
[0504]
spermidine trichlorhydrate
……………………………………………
0.5mg
[0505]
生物素
………………………………………………………………………
0.05mg。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。