高分辨率成像设备和方法
1.相关申请的交叉引用
2.本技术要求于2018年6月18日提交的题为“high resolution imaging apparatus and method”的美国临时申请号62/686,341和2019年1月15日提交的题为“high resolution imaging apparatus and method”的美国临时申请号62/792,759的权益,这两个申请的全部内容通过引用结合于此。
技术领域
3.本发明涉及使用质谱成像技术(ims)对样本进行高分辨率成像以及通过质谱流式细胞技术(imc
tm
)对生物样本进行成像。
背景技术:
4.la
‑
icp
‑
ms(一种ims形式,其中,样本被激光烧蚀,烧蚀的材料然后在电感耦合等离子体中电离,之后通过质谱法检测离子)已用于各种物质的分析,例如,地质样本的矿物分析、考古样本的分析和生物物质的成像。
5.以前有报道称,通过imc对生物样本进行成像是为了以细胞分辨率成像。最近还报道了以亚细胞分辨率的细节成像。
6.尽管最近取得了这些进展,但仍需要进一步将imc的分辨率提高到亚微米级的设备和技术。将imc分辨率提高到亚微米级的两个主要挑战是:
7.1)将采样斑点区域限制在大约200nm以下(本文中所指的数值以下或以上是指包括该数值本身)的尺寸;并且
8.2)确保烧蚀材料中分析物的量产生足够的信噪比。
9.本发明的目的是提供克服这两个挑战的进一步改进的设备和技术,以便提供样本的高分辨率成像。
技术实现要素:
10.总的来说,本文公开的分析仪设备包括用于执行成像元素质谱法的两个广义表征系统。
11.第一个是采样和电离系统。该系统包含样本腔,该样本腔是样本被分析时放置样本的部件。样本腔包括保持样本的载物台(通常样本在样本载体上,例如,显微镜载玻片,例如,组织切片、单层细胞或单个细胞,例如,其中,细胞悬液已经滴到显微镜载玻片上,载玻片放置在载物台上)。采样和电离系统用于从样本腔中的样本中移除材料(被移除的材料在本文中被称为样本材料),该材料被转化为离子,作为促使从样本中移除材料的过程的一部分,或者经由采样系统下游的单独的电离系统。为了产生元素离子,使用硬电离技术。
12.电离后的材料由第二系统(即检测器系统)进行分析。检测器系统可以根据确定的电离样本材料的特定特性而采取不同的形式,例如,基于质谱法的分析仪设备中的质量检测器。
13.本发明通过应用利用厚度小于100nm的组织切片分析中的优势的各种设备和技术,提供了对当前ims和imc设备和方法的改进。当使用这种超薄切片时,增加了进一步分析技术的机会。发明人已经发现,可以使用在烧蚀光斑周围保持特别高折射率的透镜(例如,浸没透镜),其将用于激光烧蚀的激光聚焦到特别小的烧蚀光斑。发明人已经确定,当分析超薄切片时,这种透镜可以用于聚焦激光辐射,而不会对烧蚀目标区域之外的样本区域造成损害。这是因为透镜材料的高折射率确保激光通过透镜一直聚焦成紧密焦斑,向下聚焦到烧蚀光斑。因此,该紧密焦斑比没有高折射率材料的情况下可能的更小,并且因为焦斑的尺寸决定横向分辨率,所以本发明提供了提供改进的横向分辨率的设备和技术。此外,透镜的焦点不仅仅是二维的。它是集中辐射的三维体积。因此,烧蚀光斑的直径以及深度(即辐射的焦点)都是值得关注的。如果焦距被设置成使得辐射的焦点在基板中而不是在基板的表面,这可能导致不可预测的样本破裂和碎裂。这个问题尤其是由发明人发现的以下事实引起的:为了最有效地使用浸没透镜,最好以引导激光辐射穿过样本载体的方式烧蚀样本。
14.同样地,发明人已经发现,当使用薄切片时,可以对也通过ims或imc分析的样本(例如,在通过imc分析样本之前)进行电子显微镜检查。因此,高分辨率的结构图像可以通过电子显微镜检查获得,例如,透射电子显微镜检查,然后该高分辨率图像用于将由ims或imc获得的图像数据的分辨率细化到超过使用激光辐射烧蚀可获得的分辨率(由于电子的波长比光子短得多)。替代地或另外,电子显微镜图像可以与样本的相同区域的imc图像相关,例如,通过将imc成像的蛋白质目标的定位与电子显微镜检查识别的亚细胞(例如,纳米尺度)结构相关联。如下文更详细描述的,电子显微镜检查成像可以在单独的设备中“离线”执行,或者电子显微镜的部件可以包含到ims或imc设备中。
15.此外,发明人已经开发了在从样本溅射样本材料之后,或者在采样时,基于与样本材料的激光电离耦连的样本的带电粒子(例如,离子或电子)轰击的组合进行高分辨率成像的进一步技术。由于带电粒子可以更紧密地聚焦,同时仍然可以从样本中去除材料,因此与传统的基于激光烧蚀的技术相比,这种方法可以获得更高的分辨率。离子光学器件可用于将带电粒子引导向样本,和/或将电离的样本引导至质谱仪(例如,tof或磁扇形检测器)。离子光学器件可能类似于电子或离子显微镜中使用的那些。离子光学器件可以包括离子扫描光学器件(例如,用于在样本上扫描带电粒子)、离子聚焦光学器件(例如,用于确定光斑尺寸或朝向检测器聚焦样本离子)、以及离子加速光学器件(用于确定撞击样本的带电粒子的能量,或用于朝向检测器加速离子)。离子光学器件可以包括具有适当形状、电荷和/或方向的一个或多个带电表面(例如,板)。
16.因此,在根据本发明的一个设备的操作中,样本被放入设备,使用包括光学器件的激光系统对样本进行采样,以产生电离材料,其中,激光辐射通过浸没透镜被引导到样本上(采样可以产生蒸汽/特定材料,其随后被电离系统电离),并且样本材料的离子被传送到检测器系统中。
17.因此,在根据本发明的另一设备的操作中,将样本放入设备中,使用电子显微镜检查(例如,透射电子显微镜检查)对样本成像,然后使用采样和电离系统对样本进行采样,以产生电离材料(采样可以产生离子,或者可以产生不带电荷的蒸气/特定材料(或者不带电荷的蒸气/特定材料可以通过电荷中和在采样时形成的任何离子而形成),在后一种情况下,随后通过单独的电离系统电离该材料),并且样本材料的离子被传送到检测器系统中。
18.最后,在本发明的另一设备的操作中,样本被放入设备中,使用基于溅射的采样系统(基于带电粒子的采样系统)对样本进行采样,以产生材料,其中,在从样本中溅射样本材料之后或在对样本采样时,样本材料被激光后电离系统电离,并且样本材料的离子被传送到检测器系统中。
19.尽管本发明的设备的检测器系统可以检测许多离子,但是大多数离子将是本身构成样本的原子的离子。在某些情况下,例如,在分析生物样本时,样本的本身元素组成可能不具有适当的信息。这是因为,通常,所有的蛋白质和核酸都由相同的主要组成原子组成,因此,尽管可以将含有蛋白质/核酸的区域与不含有这种蛋白质或核酸物质的区域区分开,但是不可能将特定的蛋白质与所有其他蛋白质区分开。然而,通过用在正常条件下被分析的材料中不存在的原子标记样本,或者至少不存在大量的原子(例如,某些过渡金属原子,例如,稀土金属;关于进一步的细节,参见下面关于加标签的部分),可以确定样本的特定特性。与ihc和fish一样,可检测的标记可以附着在样本上或样本中的特定目标上(例如,载玻片上的固定细胞或组织样本),特别是通过使用样本上或样本中的目标分子的抗体、核酸或凝集素等sbp。为了检测电离标签,使用检测器系统,因为它将检测来自样本中天然存在的原子的离子。通过将检测到的信号与产生这些信号的样本的已知采样位置相关联,可以产生存在于每个位置的原子图像,包括天然元素成分和任何标记原子。在检测之前样本的天然元素成分被耗尽的方面,图像可能仅仅是标记原子。该技术允许并行分析许多标记(也称为多重,多路),这在生物样本分析中是很大的优势,由于在本文公开的设备和方法中应用激光扫描系统,使得现在速度得到提高。
20.因此,本发明提供了一种用于分析生物样本的设备,包括:
21.样本台;
22.激光源;以及
23.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束引导向样本台上的位置;并且其中,
24.该设备还包括位于物镜和样本台之间的浸没介质。
25.本发明还提供了一种制备用于分析的生物样本的方法,包括:
26.用用于电子显微镜检查的造影剂染色样本;
27.用标记原子标记样本。
28.本发明还提供了一种分析生物样本的方法,包括:
29.通过电子显微镜检查对样本成像;
30.将激光源发射的辐射束引导向样本上的位置,以产生样本材料的烧蚀羽流;
31.电离样本材料的烧蚀羽流;并且
32.从样本材料中检测样本离子。
33.本发明还提供了一种用于分析生物样本的设备,包括:
34.样本台;
35.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
36.第一激光源和第一聚焦光学器件,被配置为将由第一激光源发射的激光束引导向样本台。
37.本发明还提供了一种分析生物样本的方法,包括:将带电粒子束传送到样本上的
位置,以从样本溅射材料;用激光辐射脉冲照射溅射的样本材料,以产生包含样本离子的材料羽流;并且通过质谱法法检测所述样本离子。
38.本发明还提供了一种分析生物样本的方法,包括:将带电粒子束传送到样本上的位置,在样本上产生样本电离状态;用激光辐射脉冲照射样本,以从该位置产生包含样本离子的样本材料羽流;并且通过质谱法法检测所述样本离子。
附图说明
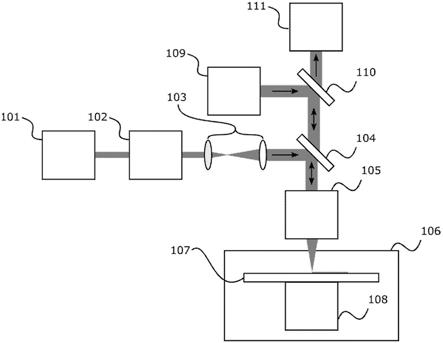
39.图1是现有设备装配的光学器件的示意图;
40.图2是另一现有设备装配的光学器件的示意图;
41.图3是本发明的示例性实施例的光学器件布置的示意图;
42.图4是本发明的另一示例性实施例的光学器件布置的示意图;
43.图5a是本发明的另一示例性实施例的光学器件布置的示意图,示出了激光束通过半球形固体浸没透镜的路径;
44.图5b是本发明的另一示例性实施例的光学器件布置的示意图,示出了激光束通过维尔斯特拉斯(weierstrass)固体浸没透镜的路径;
45.图6是使用激光后电离分析生物样本的设备的光学器件布置的示意图;
46.图7是使用样本的激光泵浦来分析生物样本的设备的光学器件布置的示意图;
47.图8是通过样本载体使用样本的激光泵浦来分析生物样本的设备的光学器件布置的示意图;
48.图9是通过样本载体使用样本的激光后电离来分析生物样本的设备的光学器件布置的示意图;
49.图10是用于分析生物样本的设备的光学器件布置的示意图,该设备包括至少两个激光源,一个用于激光后电离,一个用于样本的激光泵浦;
50.图11示出了显示根据本发明的示例性方法制备的样本中各种锇同位素的检测的图像;
51.图12示出了显示用于图11的根据本发明的示例性方法制备的样本中各种锇同位素的检测的图像,图12示出了2100
×
1087微米的面积,步长为250nm;
52.图13是双脉冲采样和电离系统的示意图;
53.图14是双脉冲采样和电离系统的示意图,其中,第一脉冲和第二脉冲从同一侧聚焦到样本上;
54.图15是双脉冲采样和电离系统的示意图,其中,样本放置在对第一脉冲和第二脉冲至少半透射的材料上;
55.图16是双脉冲采样和电离系统的示意图,其中,物镜具有允许烧蚀后产生的离子通过的开口;
56.图17是三脉冲采样和电离系统的示意图。
具体实施方式
57.因此,各种类型的分析仪设备可以用于实践本公开,其中的一些设备在下面详细讨论,例如,包括浸没透镜的设备、包括电子显微镜(或其部件)的设备以及用于执行二次中
性质谱法的设备。
58.基于质量检测的分析仪设备
59.1.采样和电离系统
60.a.激光烧蚀采样和电离系统
61.基于激光烧蚀的分析仪通常包括三个部件。第一部件是激光烧蚀采样系统,用于从样本中产生气态和粒子状物质的羽流,以供分析。在烧蚀的样本材料羽流中的原子(包括下面讨论的任何可检测的标记原子)可以被检测器系统(质谱仪部件(ms部件;第三部件))检测到,样本必须被电离(和原子化)。因此,该设备包括第二部件,该第二部件是电离系统,该电离系统将原子电离,以形成元素离子,以使ms部件能够基于质量/电荷比检测这些元素离子(样本材料的某种电离可能发生在烧蚀点,但是空间电荷效应导致电荷几乎立即中和)。激光烧蚀采样系统通过传送导管与电离系统相连。
62.激光烧蚀采样系统
63.简而言之,激光烧蚀采样系统的部件包括激光源,该激光源发射朝向样本的激光辐射束。样本被放置在激光烧蚀采样系统的腔室内(样本腔)的载物台上。该载物台通常是平移台,使得样本可以相对于激光辐射束移动,由此可以对样本上的不同位置进行采样,以进行分析(例如,由于激光束的相对移动(术语“激光束”可以与术语“激光辐射”互换使用)使得本文描述的激光扫描系统可以诱发比可以烧蚀的位置更远的位置)。如下文更详细讨论的,气体流过样本腔,并且气流带走激光源烧蚀样本时产生的原子化材料羽流,用于基于样本的元素组成(包括标记原子,例如,来自元素标签的标记原子)分析和构建样本的图像。如下文进一步解释的,在可替换的作用模式中,激光烧蚀采样系统的激光系统也可用于从样本中释出材料。
64.对于特别是生物样本(细胞、组织切片等),样本通常是异质的(尽管在本公开的其他应用领域中异质样本是已知的,即非生物性质的样本)。异质样本是包含由不同材料组成的区域的样本,因此样本的一些区域可以在给定波长下以比其他区域更低的阈值通量烧蚀。影响烧蚀阈值的因素是材料的吸收系数和材料的机械强度。对于生物组织,吸收系数将具有主要影响,因为它可以随激光辐射波长变化几个数量级。例如,在生物样本中,当使用纳秒激光脉冲时,包含蛋白质物质的区域在200
‑
230nm波长范围内更容易吸收,而主要包含dna的区域在260
‑
280nm波长范围内更容易吸收。
65.可以以样本材料的烧蚀阈值附近的通量进行激光烧蚀。以这种方式进行烧蚀通常会改善气溶胶的形成,进而有助于提高分析后数据的质量。通常为了获得最小的损伤,为了最大化最终图像的分辨率,使用高斯光束。高斯光束的横截面记录了具有高斯分布的能量密度分布。在这种情况下,光束的通量随着离中心的距离而变化。结果,烧蚀光斑尺寸的直径是两个参数的函数:(i)高斯束腰(1/e2)以及(ii)施加的通量和阈值通量之间的比率。
66.因此,为了确保用每个烧蚀激光脉冲一致地去除可再生量的材料,并因此使成像数据的质量最大化,保持一致的烧蚀直径是有用的,这又意味着调整由激光脉冲提供给目标的能量与被烧蚀材料的烧蚀阈值能量的比率。当烧蚀阈值烧蚀能量在样本中变化的非均质样本(例如,dna和蛋白质材料的比例变化的生物组织或者在阈值烧蚀能量随着样本区域中矿物的特定组成而变化的地质样本)时,该要求成为一个问题。为了解决这个问题,可以将多于一个的波长的激光辐射聚焦到样本上的同一烧蚀位置,以基于该位置处样本的组成
更有效地烧蚀样本。
67.激光烧蚀采样系统的激光系统
68.激光系统可以设置成产生单个或多个(即两个或多于两个)波长的激光辐射。通常,所讨论的激光辐射的波长是指具有最高强度的波长(“峰值”波长)。如果系统产生不同的波长,则可以用于不同的目的,例如,针对样本中的不同材料(此处的针对是指所选择的波长被材料良好地吸收)。
69.在使用多个波长的情况下,激光辐射的两个或更多个波长中的至少两个可以是离散的波长。因此,当第一激光源发射与第二波长辐射离散的第一波长辐射时,这意味着第一激光源在第一波长的脉冲中不产生或产生非常少量的第二波长辐射,例如,小于第一波长强度的10%,例如,小于5%、小于4%、小于3%、小于2%或小于1%。通常,当通过谐波产生法或其他非线性频率转换过程产生不同波长的激光辐射时,然后,当本文提到特定波长时,本领域技术人员将会理解,在由激光产生的光谱中,特定波长会有一定程度的变化。例如,对x nm的引用包括产生在x
±
10nm范围内的光谱的激光,例如,x
±
5nm,例如,x
±
3nm。
70.聚焦光学器件和物镜
71.作为常规设置,光学部件可以用于将激光辐射束引导向聚焦点。图1是现有设备装配的光学器件的示意图。在此处,激光源(例如,脉冲激光源,可选地包含脉冲拾取器)101发射激光辐射束,该激光辐射束被引导通过能量控制模块102,然后通过光学器件103。然后,光束/光照组合光学器件104将辐射光束引导通过聚焦光学器件和物镜105而导向样本。样本位于样本腔106中的样本台107上。样本台107(例如,载玻片)可以安装在样本腔106中的三轴(即x,y,z)平移台108上。图1的装配还包括相机111,用于使用相同的聚焦光学器件和物镜105观察样本。照射源109发射可见光,由照射/检查分离光学器件110引导可见光通过光束/光照组合光学器件104和聚焦光学器件105而导向至样本。
72.图2示出了现有设备装配的另一种配置。在此处,样本215位于样本台207的与物镜205相反的一侧,并且激光辐射通过样本台207或通过样本腔烧蚀样本215。在某些情况下,样本腔保持在真空或部分真空下。射线图线被示出为表示激光束216从物镜205穿过载玻片207的可能路径。
73.如上所述,在传统的imc和ims中,实现小于200nm(例如,小于150nm,例如,小于100nm)的空间分辨率的一个主要挑战是将激光的光斑尺寸限制在小于200nm(例如,小于150nm或小于100nm)的尺寸。对于数值孔径(na)超过0.7的系统,激光光斑尺寸的半峰全宽由定义,其中,λ是激光的波长(在本文中激光可与激光辐射互换使用),na是聚焦光学器件的物镜105、205的数值孔径。因此,在传统的imc和ims中,使用较短波长的激光器,例如,波长为213nm的深uv激光器,或者na大于0.7(例如,大于0.8,例如,高na(大于0.9))的聚焦光学器件,来减小激光光斑尺寸,从而提高分辨率。
74.然而,透镜的数值孔径表示为na=n
×
sinθ,其中,n是透镜和样本台107、207之间的介质的折射率,θ是物镜接受角的一半。因此,在典型的imc和ims中物镜(例如,图1和图2中所示的现有设备配置的物镜105、205)的最大理论数值孔径被限制在1.0,因为真空的折射率为1.0,空气的折射率约为1.0。
75.浸没透镜
76.本发明通过使用浸没介质克服了传统的imc和ims的局限性。浸没介质具有大于1.0的折射率,并且放置在物镜和样本台之间。这样,本发明的设备实现了大于1.0的数值孔径,因此激光的光斑尺寸小于200nm、小于150nm或小于100nm。因此,本发明提供了一种用于200nm或更高、150nm或更高、或100nm或更高的空间分辨率的成像质谱流式细胞技术的设备。
77.因此,本发明提供了一种激光采样系统,包括:
78.样本台;
79.激光源;以及
80.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射引导向样本台上的位置;并且其中,
81.激光采样系统还包括位于物镜和样本台之间的浸没介质。
82.因此,本发明提供了一种用于分析生物样本的设备,包括:
83.样本台;
84.激光源;以及
85.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射引导向样本台上的位置;并且其中,
86.该设备还包括位于物镜和样本台之间的浸没介质。
87.通常,该设备还包括基于质谱的检测器。
88.因此,在操作中,样本台保持样本,通常,其中,样本放置在样本载体上,并且同一载台保持样本载体。然后,引导激光辐射通过该设备的光学器件,通过物镜和浸没介质而导向至样本,其中,辐射烧蚀样本中的材料。
89.为了实现激光器的最佳聚焦条件,本发明的浸没介质具有大于1.00的折射率,例如,1.33或更大、1.50或更大、2.00或更大、或2.50或更大。
90.此外,为了重建生物细胞的单层厚度(或厚度以下)的图像或逐层读取较厚的样本并生成3d图像,如本文进一步讨论的,样本优选具有100微米或以下的厚度,例如,10微米或小于10微米、5微米或小于5微米、2微米或小于2微米、100nm或小于100nm、50nm或小于50nm、30nm或小于30nm。在本文更详细描述的一些实施例中,物镜和浸没介质的组合被称为浸没透镜。
91.在一些实施例中,如上所述的包括浸没介质的设备或采样系统包括中或高na物镜,例如,0.7或更大、0.8或更大、或0.9或更大的na。这种系统通常还包括质量检测器,例如,tof质谱检测器。
92.液体浸没介质
93.在本发明的一些实施例中,浸没介质是液体浸没介质,图3是本发明示例性实施例的光学器件配置的示意图。其包含与图1和图2所示的配置相同的元件。包括物镜305的聚焦光学器件将来自激光源(未示出的源)的辐射束316引导向样本台307上的位置,并且液体浸没介质312位于物镜305和样本台307之间。在此处,生物样本315位于样本台307的与液体浸没介质312相反的一侧。射线图显示了液体浸没介质312如何提供比图2所示的传统配置更紧密的聚焦条件。适用于液体浸没介质的液体是折射率n为1.333的水、甘油(n=1.4695)、诸如石蜡油(n=1.480)、雪松油(n=1.515)和合成油(n=1.515)等油、或茴香醚(n=
1.5178)、溴代萘(n=1.6585)和亚甲基碘(n=1.740)。商业浸没油也是可购买到的,并且这些商业油中的一些具有特别有利于在本发明中应用的性质。例如,低荧光或非荧光浸没油(例如,奥林巴斯低自发荧光浸油和nikon)特别适用于短波长激光,因为它们提供了比一般通用浸没油更高的信噪比。其他油具有非常高的粘度,例如,cargille实验室型nvh和ovh,当物镜305和样本台307之间的距离大时,这是有用的。
94.商业油浸没物镜可以实现大约1.49的最大数值孔径(接近浸没油的折射率),并且能够将515nm的激光束聚焦到大约160nm的fwhm焦点直径。
95.当使用液体浸没介质时,样本需要放置在样本载体与液体介质相反的一侧(如图3所示),以便载体气体可以收集烧蚀材料。因此,必须在此处应用穿透样本载体烧蚀技术。这具有烧蚀材料收集硬件可实现的更小工作距离的额外好处,并且不需要弯曲样本腔和检测器之间的传送导管。这也导致瞬变时间的减少,从而增加了每秒可实现的光斑烧蚀率。
96.液体浸没透镜(例如,水中物镜或油中物镜)可从奥林巴斯、thorlabs和leica购得。
97.固体浸没介质
98.在本发明的一些实施例中,本发明提供了一种设备,其中,浸没介质是固体浸没介质。图4是本发明另一示例性实施例的光学器件配置的示意图,其中,固体浸没件413位于物镜405和样本台407之间。图4的其他部件对应于图3中的部件。
99.类似于液体浸没介质,固体浸没透镜的折射率n大于空气。适用于固体浸没透镜的材料是玻璃,例如,s
‑
lah79
tm
玻璃型,在~520nm波长下工作时折射率为2.0。用于本发明的固体浸没介质的替代合适材料是金刚石或熔融石英。在266nm,金刚石变得非常适合光学应用,因为它在uv下的折射率>2.5,提供了将266nm的光聚焦到100nm甚至更小尺度的光斑尺寸的机会。从成本的角度来看,熔融石英可能更有吸引力。它既可以作为样本基底,也可以作为固体浸没透镜材料。然而,熔融石英在uv下的折射率仅为1.5,因此光斑尺寸会相应地变大。
100.针对固体浸没介质包括两种标准光学方案:半球形浸没透镜和维尔斯特拉斯浸没透镜。
101.半球形固体浸没透镜;
102.图5a)示出了半球形固体浸没透镜的几何形状。半球形固体浸没透镜能够将光学系统的数值孔径增加透镜材料的折射率n。
103.维尔斯特拉斯固体浸没透镜:
104.图5b)示出了维尔斯特拉斯固体浸没透镜的几何形状。维尔斯特拉斯固体浸没透镜是一个截头球体,距载玻片507的高度为(1 1/n)r,其中,r是透镜球面的半径。维尔斯特拉斯透镜能够将光学系统的数值孔径增加n2,因此维尔斯特拉斯透镜能够比半球形透镜进一步增加光学系统的数值孔径。
105.因此,本发明提供了一种设备,其中,固体浸没介质是半球形固体浸没透镜或维尔斯特拉斯固体浸没透镜。如图3和图4所示,当生物样本315、415安装在样本台307、407上时,生物样本可以安装在样本台的与固体浸没材料相反的一侧。其上安装有样本的载物台可以由与固体浸没透镜具有相同折射率的材料制成,并且可以将固体浸没透镜制造得更薄了等于基板的厚度的量,以保持焦点位置。
106.浸没透镜和生物样本的组合
107.当用于分析根据本文描述的本发明的其它方法制备的生物样本(pct公开的第112页)时,包括位于物镜和样本台之间的浸没介质的本发明提供了进一步的优点。特别地,当生物样本的厚度为100微米以下,例如,10微米以下,或100nm以下,或50nm以下,或30nm以下时,本发明提供了进一步的优点。
108.例如,在物镜和样本台之间包括浸没介质的本发明的设备可以用于分析厚度为100nm以下(例如,50nm以下、或30nm以下)的生物样本。由于本发明的设备提供了一种具有空间分辨率为200nm或更优(优选为100nm或更低)的成像质谱流式细胞技术的设备,所以激光的光斑尺寸为200nm或更低(优选为100nm或更低),因此烧蚀深度通常为200nm或更低(优选为100nm或更低)。因此,使用本发明分析厚度为200nm以下的生物样本将完全烧蚀贯通样本(或者当激光光斑尺寸为100nm以下时,优选为100nm以下)。因此,本发明提供了通过关于生物细胞的连续切片利用设备来重建生物细胞单层厚度的图像的可能性。
109.或者,在物镜和样本台之间包括浸没介质的本发明的设备可以用于分析100微米以下的生物样本,例如,10微米以下、5微米以下、2微米以下。如上所述,通过浸没介质对激光束的急剧聚焦产生了非常短的聚焦深度。因此,本发明提供了逐层读取较厚样本并生成3d图像的机会。本领域技术人员将会理解,样本越同质,对较厚样本的分析就越直接。在不同质的组织样本中,当激光传播通过组织时,激光会发生失真,导致聚焦处的光斑尺寸比预期得大。
110.因此,本发明提供了包括生物样本的成像质谱流式细胞仪或成像质谱仪,其中,生物样本的厚度小于100nm,例如小于50nm或小于30nm。本发明还提供了包含生物样本的成像质谱流式细胞仪或成像质谱仪,其中,生物样本的厚度小于100nm,例如,小于50nm,或小于30nm,并且其中,成像质谱流式细胞仪或成像质谱仪包括固体浸没透镜。本发明还提供了包含生物样本的成像质谱流式细胞仪或成像质谱仪,其中,生物样本的厚度小于100nm,例如,小于50nm,或小于30nm,并且其中,成像质谱流式细胞仪或成像质谱仪包括固体浸没透镜。
111.与薄生物样本结合的浸没透镜的替代选择:
112.如上所述,在传统的imc和ims中,使用短波长的激光器(例如,波长为213nm的深uv激光器)或者具有大于0.6(例如,大于0.7,例如,大于0.8,例如,高na(大于0.9))的聚焦光学器件来减小激光光斑尺寸的大小,从而将分辨率提高到100nm。
113.高na物镜可以是折射光学部件和/或反射光学部件。例如,可以使用非球面镜来允许反射物镜具有高达0.99的数值孔径(inagawa等人,scientific reports 5,12833(2015))。也可以使用反射折射镜系统。此外,可以通过使用波长为266nm或213nm的激光器、193nm的固态激光器,或从nd:yag、arf、f2激光器、极紫外光产生的六次谐波(例如,13.5nm和7nm波长)(co2激光器 sn等离子体)),来提供短波长激光器(300nm或更低)。
114.因此,本发明提供了一种用于分析生物样本的设备,包括:
115.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面被适配为容纳生物样本;以及
116.激光源;以及
117.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束朝向第二面引导以导向至样本台上的位置;并且其中,
118.物镜的数值孔径为至少0.7、至少0.8或至少0.9,例如,至少0.9。
119.因此,本发明提供了一种用于分析生物样本的设备,包括:
120.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面被适配为容纳生物样本;以及
121.激光源;以及
122.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束朝向第二面引导以导向至样本台上的位置;并且其中,
123.激光源的波长等于或小于300nm。
124.因此,本发明提供了一种用于分析生物样本的设备,包括:
125.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面被适配为容纳生物样本;以及
126.激光源,其中,所述激光源具有300nm或更低的波长;以及
127.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束朝向第二面引导以导向至样本台上的位置;并且其中,
128.物镜的数值孔径为至少0.7、至少0.8或至少0.9,例如至少0.9。
129.如本文进一步所述,烧蚀材料可以在靠近样本表面处电离或再电离,例如,通过激光电离烧蚀羽流,该烧蚀羽流已经扩展而超过显著(significant,有效)电荷中和点(一次电离/再电离)。在这样的系统和方法中,可能不需要气体射流,因为羽流不需要被输送到icp以进行电离。替代地,位于样本附近的离子光学器件可以将离子化的标记原子直接引导向质谱仪(例如,tof质谱仪或磁扇形质谱仪)。如本文所述,在某些情况下,小的烧蚀光斑尺寸可以减少烧蚀期间产生的离子的中和和空间电荷效应,使得更容易电离和将离子引导向质谱仪。在这种情况下,不需要用于再电离的第二脉冲。样本台和直接围绕的光学器件(例如,高na透镜和/或浸没介质)可以在真空或低压下操作(例如,通过碰撞减少电荷),如本文进一步所述。
130.如本领域技术人员将理解的,设备可以包括具有至少0.9的数字孔径的物镜的聚焦光学器件和/或具有300nm或更低波长的激光源。此外,尽管高数值孔径或短波长可以用作本文所述的浸没透镜的替代选择或补充,但是系统的其他部件与浸没透镜系统保持相同。
131.扫描系统
132.在某些方面,样本的烧蚀可以通过扫描系统来执行。辐射源(例如,激光束或带电粒子束(例如,离子束或电子束)源)可以扫描样本的一部分,以产生单个瞬变(例如,烧蚀材料的单个实例)。该瞬变可以是在由ms检测之前输送到icp以用于原子化和电离的烧蚀羽流。或者,该瞬变可以通过在样本表面或其附近的激光辐射电离,如本文所述。用离子束或电子束扫描(例如,使用离子光学器件)可以允许以高分辨率烧蚀样本的小的感兴趣区域(例如,单个细胞器)。例如,感兴趣区域的面积可以小于100,000nm2,小于50,000nm2,或小于20,000nm2,或小于10,000nm2。或者,感兴趣区域可以更大,例如,单个细胞或者甚至一组细胞。
133.在某些实施例中,激光扫描系统将激光辐射引导到待烧蚀的样本上。由于激光扫描仪能够比相对于静止激光束移动样本台更快地重新引导样本上激光焦点的位置(由于扫
描系统的操作部件的惯性低得多或没有惯性),因此能够更快地执行样本上离散点的烧蚀。这种更快的速度可以使显著更大的区域被烧蚀并记录为单个像素,或者激光光斑移动的速度可以简单地转化为例如像素采集速率的增加或者两者的结合。此外,激光辐射脉冲可以指向的光斑的位置的快速变化允许烧蚀任意的图案,例如,使得通过激光扫描系统快速连续地指向样本上的位置的激光辐射的一串脉冲/发射烧蚀不均匀形状的整个细胞,然后不均匀形状的整个细胞被电离并被检测为单个材料云,从而能够进行单细胞分析(参见pct公开文本第33页起的“激光烧蚀采样系统的样本腔”部分)。类似的快速突发脉冲技术也可部署在使用释出以从样本载体上移除样本材料的方法中,即细胞lifting(激光诱导向前转移)。
134.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
135.(i)采样和电离系统,用于从样本中去除材料并电离所述材料以形成元素离子,包括激光扫描系统和样本台;
136.(ii)检测器,用于接收来自所述采样和电离系统的元素离子,并检测所述元素离子。
137.同样,如本领域技术人员所理解的,特征的这种组合可以与本文描述的任何其他实施例相结合。使用扫描系统来提高采集速率,提供了优于其它提高样本成像速率的策略的许多优点。例如,100μm
×
100μm的区域可以通过适当的设备用单个激光脉冲烧蚀。然而,这种烧蚀会导致许多问题。用单个激光脉冲一次烧蚀样本的大面积,导致烧蚀的材料破成最初以接近声速的速度飞行的大块,而不是小粒子,也不是在载气流中被快速地从样本中带走(下面将更详细地描述)的材料,大块可能比小块需要更长的时间被带走(延长样本腔的冲洗时间),不能被带走,或者只是随机地从样本中飞出或飞到样本的另一部分上。如果大块材料从样本中飞出,则该大块材料中具有可检测原子形式的任何信息(例如,标记原子)都将丢失。如果材料块落在样本的另一部分上,烧蚀区域的信息就会丢失,而且材料块中任何可检测到的原子现在都在上面,会干扰从样本的另一部分获取的信号。由于烧蚀光斑中生物材料的差异(例如,软骨材料与肌肉)也会影响产品的破碎方式,较大的烧蚀光斑尺寸也会使样本的分裂复杂化,某些种类的材料在气流中带走的程度低于其他材料。此外,如此处所描述的,在许多应用中,小光斑尺寸是优选的,大约为μm而不是μm的100倍的量级,并且在多个不同数量级(例如,100μm对1μm)的激光光斑尺寸之间切换也提出了技术挑战。例如,能够烧蚀1μm光斑尺寸的激光所具有的能量可能不能在单个激光脉冲中烧蚀100μm光斑尺寸的区域,并且需要复杂的光学器件来促进在1μm和100μm之间转换,而不会显著损失激光束中的能量或损失烧蚀光斑的锐度。
138.因此,100
×
100(即10,000)个1μm直径的光斑可用于通过在该区域内进行光栅扫描来烧蚀该区域,而不是烧蚀100μm2的单个光斑。用于烧蚀的较小光斑尺寸自然不会在很大程度上受到上述问题的影响,较小烧蚀光斑产生的粒子本身的尺寸必然要小得多。此外,对于更小的光斑,由烧蚀产生的更小的粒子具有从样本腔更短和更明确的冲洗时间。当每个较小的光斑需要单独分辨时,这又会导致更快获取数据,因为每个烧蚀激光脉冲的瞬变在检测器中探测时不会重叠(或重叠了可接受的程度,如下所述)。
139.然而,如上所述,由于惯性,沿一行以1μm的增量移动样本台,然后向下移动相对较慢。因此,通过使用激光扫描系统在整个区域进行光栅扫描,而不移动样本台,或者不太频
繁地或以恒定速度移动样本台,样本台相对较慢的速度不会限制样本被烧蚀的速率。
140.因此,为了能够快速扫描,激光扫描系统必须能够快速切换激光辐射被引导到样本上的位置。切换激光辐射的烧蚀位置所花费的时间称为激光扫描系统的响应时间。因此,在本发明的一些实施例中,激光采样系统的响应时间快于1ms、快于500μs、快于250μs、快于100μs、快于50μs、快于10μs、快于5μs、快于1μs、快于500ns、快于250ns、快于100ns、快于50ns、快于10ns或大约1ns。
141.激光扫描系统可以在烧蚀过程中在相对于载有样本的样本台的至少一个方向上引导激光束。在某些情况下,激光扫描系统可以在相对于样本台的两个方向上引导激光辐射。举例来说,样本台可用于在x轴上递增地移动样本,激光可在y轴上扫过样本(参见图7
‑
图9的相对移动图示)。当使用1μm的光斑尺寸时,在x轴上的移动可以以1μm为增量。在x轴的给定位置,激光扫描系统可用于将激光引导向y轴上一系列相距1μm的位置。因为激光扫描系统可以将激光辐射引导向y轴上不同位置的速度比载物台在x轴上以增量移动的速度快得多,所以在扫描仪操作的简单图示中,烧蚀率显著增加。
142.在某些情况下,激光扫描系统在x轴和y轴上引导激光束。因此,在这种情况下,可以产生更先进的烧蚀模式。例如,当激光扫描系统可以在x轴和y轴上引导激光辐射时,样本台可以在x轴上以恒定的速度移动(从而消除了在跨每行移动期间与样本台的惯性相关联的低效率,而不是在行的开始/结束时的加速/减速),同时激光扫描系统在样本上上下引导激光辐射脉冲,同时补偿样本台的移动。为了实现这种移动,三角波控制信号可以在x方向施加到扫描仪,在y方向施加锯齿波信号。或者,如本领域技术人员所理解的,根据所使用的处理算法,可能希望在y方向上向扫描仪施加锯齿驱动信号。作为另一种选择,可以稍微预旋转一个扫描仪部件,以预补偿倾斜的扫描图案。在一些实施例中,当样本台移动时,激光扫描系统的控制器将使激光扫描系统以8字形图案移动光束。
143.如果激光采样系统中使用的激光具有足够高的重复速率(如下所述),则激光辐射到样本上不同位置的显著更快的(重新)定向相应地能够更快地烧蚀大面积的样本。例如,如果每秒钟只能将少于5个脉冲引导向样本上的不同位置,则以1μm的光斑尺寸进行烧蚀来研究1mm
×
1mm的区域所需的时间将超过两天。在200hz的频率下,这将是大约80分钟,随着脉冲频率的进一步增加,分析时间进一步减少。然而,样本通常要大得多。可以放置组织切片的平均显微镜载玻片为25
×
75mm。以200hz的速率烧蚀需要大约110天。然而,如果使用激光扫描系统,则时间可以显著缩短,例如,样本台沿x轴以恒定速度移动(1mm/s),而激光扫描系统使激光束沿y轴方向来回移动。激光扫描系统可以以与载物台运动速度相匹配的速度扫描激光焦点的位置,在这种情况下,频率为500hz。这将以这种速度在光栅图案中的相邻线之间产生1μm的间距。然后,根据最大激光重复频率,选择激光扫描系统偏转激光辐射的程度以进行匹配。在此处,为了产生100微米的峰峰值幅度,需要100khz的激光重复频率。这使得该装置能够处理0.1mm2/s,而当前的设备最多只能处理0.0004mm2/s。与上面讨论的110天的数字相比,使用本段中讨论的激光扫描系统,处理载玻片只需要大约5个小时。
144.另一应用是任意烧蚀区域成形。如果使用高重复频率激光,则可以在纳秒激光传送一个脉冲的相同时间内传送一串密集的激光脉冲。通过在一串激光脉冲期间快速调整烧蚀光斑的x和y位置,可以产生任意形状和尺寸(低至光的衍射极限)的烧蚀坑。例如,脉冲串中的n和n 1位置可以不大于与激光光斑直径的10倍相等的距离(基于第n个光斑和第(n 1)
个光斑的烧蚀光斑的中心),例如,小于光斑直径的8倍、小于5倍、小于2.5倍、小于2倍、小于1.5倍、大约1倍或小于1倍。采用这种技术的具体方法将在下面(pct公开文本第32页)的方法部分讨论。
145.因此,在一些实施例中,激光扫描系统包括定位器,以提供由激光器发射的激光束相对于样本台(例如,相对于样本表面的y轴)的第一相对运动。
146.在一些实施例中,激光扫描系统的定位器能够提供激光束相对于样本台的第二相对运动,其中,第一相对运动和第二相对运动不平行,例如,其中,相对运动是正交的(例如,第一运动方向相对于样本表面在y轴上,第二运动方向相对于样本表面在x轴上)。
147.在一些实施例中,激光扫描系统还包括能够提供激光束相对于样本台的第二相对运动的第二定位器,其中,第一相对运动和第二相对运动不平行,例如,其中,相对运动是正交的(例如,第一运动方向相对于样本表面在y轴上,第二运动方向相对于样本表面在x轴上)。
148.能够将激光辐射快速引导向样本上不同位置的任何部件都可以用作激光扫描系统中的定位器。下面讨论的各种类型的定位器是商业上可获得的,并且可以由技术人员根据将使用设备的特定应用来选择,因为每一种都具有固有的强度和限制。在本发明的一些实施例中,如下所述,下面讨论的多个定位器可以在单个激光扫描系统中组合。定位器通常可分组为依靠移动部件将相对运动引入激光束的定位器(其示例包括检流计反射镜、压电反射镜、mems反射镜、多边形扫描仪等)和那些不需要移动部件的(示例包括这种声光器件和电光器件)。前一句中列出的定位器类型用于可控地将激光辐射束偏转到不同的角度,这导致烧蚀光斑的平移。激光扫描系统可以包括单个定位器,或者可以包括定位器和第二定位器。激光扫描系统中有两个定位器的描述“定位器”和“第二定位器”没有定义激光辐射脉冲在其从激光源到样本的路径上入射到定位器的顺序。
149.轴上安装有反射镜的检流计马达可用于将激光辐射偏转到样本的不同位置。运动可以通过使用固定磁体和移动线圈,或者固定线圈和移动磁体来实现。固定线圈和移动磁铁的布置产生更快的响应时间。通常,传感器存在于马达中,以感测轴和反射镜的位置,从而向马达的控制器提供反馈。一个检流计反射镜可以在一个轴内引导激光束,因此使用这种技术可以利用成对的检流计反射镜来实现光束在x轴和y轴上的方向。
150.检流计反射镜的一个优点是它能够实现大的偏转角度(例如,比固态偏转器大得多),因此可以允许样本台更少的移动。然而,由于马达和反射镜的运动部件具有质量,它们将受到惯性的影响,因此必须在采样方法中考虑部件加速的时间。通常,使用非谐振式检流计反射镜。本领域技术人员将会理解,可以使用谐振式检流计反射镜,但是仅使用这种谐振部件作为激光扫描系统的定位器的设备将不能进行任意(也称为随机访问)扫描图案。由于它是基于反射镜的,检流计反射镜偏转器会降低激光辐射束的质量并增加烧蚀光斑的尺寸,因此本领域技术人员将再次理解为最适用于容许这种对束的影响的情况。
151.基于检流计反射镜的设备可能由于传感器噪声或跟踪误差而容易出现定位误差。因此,在一些实施例中,每个反射镜与位置传感器相关联,该传感器将反射镜的位置反馈给检流计,以细化反射镜的位置。在某些情况下,位置信息被中继到另一部件,例如,串联到检流计反射镜的aod或eod,检流计反射镜校正反射镜定位误差。
152.可从各种制造商处购得检流计反射镜系统和部件,例如,thorlabs(美国新泽西
州)、laser2000(英国)、scanlab(德国)和剑桥技术(美国马萨诸塞州)。
153.在仅包括基于检流计反射镜的定位器的实施例中,烧蚀激光脉冲能够导向样本的速率可以在200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、200hz
‑
10khz、1khz
‑
1mhz、5khz
‑
1mhz、10khz
‑
1mhz、50khz
‑
1mhz、100khz
‑
1mhz、1khz
‑
100khz或10khz
‑
100khz之间。
154.因此,在本发明的一些实施例中,激光扫描系统包括一个或多个定位器,该定位器是检流计反射镜,例如,检流计反射镜阵列。
155.图1是现有设备装配的光学器件的示意图。在此处,激光源(例如,脉冲激光源,可选地包含脉冲拾取器)101发射激光辐射束,引导该激光辐射束通过能量控制模块102,然后通过光学器件103。光学器件103可以包括光束成形光学器件。然后,光束/光照组合光学器件104将辐射光束引导通过聚焦光学器件和物镜105而导向至样本。样本可以放置在支撑件上,例如,载玻片107,位于样本腔106中的三轴(即,x,y,z)平移台108上。图1的装配还包括相机111,用于使用相同的聚焦光学器件和物镜105观察样本。照射源109发射可见光,照射/检查分离光学器件110将该可见光引导通过光束/光照组合光学器件104和聚焦光学器件105而导向至样本。
156.在更先进的配置中,光学器件(例如,光学器件103)可以还包括定位器(例如,如本文所述的可移动反射镜或扫描仪),以实现在样本上扫描激光。例如,在激光辐射束被光学器件203的光束成形光学器件成形之前,定位器(例如,检流计反射镜、压电反射镜、mems反射镜或多边形扫描仪)偏转激光辐射束。例如,基于检流计反射镜的设备中的单个反射镜允许在一个方向上扫描光束,例如,相对于样本的y轴。定位器引入的偏转通过光学系统传播,导致根据反射镜的位置烧蚀样本上的不同位置。定位器可以与样本台上的位置相协调(例如,通过控制器),以确定被激光辐射束烧蚀的样本上的特定位置。控制器还可以连接到激光源,以协调激光脉冲的产生(使得激光源在定位器处于限定位置时产生脉冲,而不是在位置之间移动时产生脉冲)。
157.然而,代替单个反射镜定位器,可以使用一对反射镜定位器来将偏转引入激光辐射束。如本文别处所述,反射镜对可以被设置成在两个正交方向(x和y)上提供扫描,这可以补偿样本在样本台上的移动。
158.类似地,安装有反射镜的轴上的压电致动器可以用作定位器,以将激光辐射偏转到样本上的不同位置。同样,作为基于具有质量的部件的运动的反射镜定位器,具有固有的惯性以及由该部件引起的反射镜运动中固有的时间开销。因此,本领域技术人员将理解,该定位器可应用于激光扫描系统的纳秒响应时间不是强制性的某些实施例中。类似地,由于它是基于反射镜的,压电反射镜定位器可能降低激光辐射束的质量并增加烧蚀光斑的尺寸,因此本领域技术人员将再次理解为最适用于容许对光束的这种影响的情况。
159.在基于倾斜镜配置的压电反射镜中,在单个部件中提供在x轴和y轴将激光辐射导向到样本上。
160.压电反射镜可从供应商处购得,例如,physik instrumente(德国)。
161.因此,在本发明的一些实施例中,激光扫描系统包括压电反射镜,例如,压电反射镜阵列或倾斜镜。
162.在仅包括基于压电反射镜的定位器(例如,压电反射镜阵列或倾斜镜)的实施例中,烧蚀激光脉冲能够指向样本的速率可以在200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、
200hz
‑
10khz、1khz
‑
1mhz、5khz
‑
1mhz、10khz
‑
1mhz、50khz
‑
1mhz、100khz
‑
1mhz、1khz
‑
100khz或者10khz
‑
100khz之间。第三种定位器是mems(微机电系统)反射镜,该定位器依赖于将激光辐射引导向样本的表面的物理运动。该部件中的微反射镜可由静电、机电和压电效应驱动。这种类型的部件的许多优点源于它们的小尺寸,例如,重量轻、易于在设备中定位和低功耗。然而,由于激光辐射的偏转仍然最终基于部件中零件的运动,因此零件将经历惯性。再一次,由于它是基于反射镜的,所以mems反射镜定位器将降低激光辐射束质量并增加烧蚀光斑尺寸,因此本领域技术人员将再次理解,这种扫描仪部件因此可应用于容许对激光辐射的这种影响的情况。
163.mems反射镜可从供应商处购得,例如,mirrorcle technologies(美国加州)、hamamatsu(日本)和preciseley microtechnology corporation(加拿大)。
164.因此,在本发明的一些实施例中,激光扫描系统包括mems反射镜。
165.在仅包括基于mems反射镜的定位器的实施例中,烧蚀激光脉冲能够指向样本的速率可以在200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、200hz
‑
10khz、1khz
‑
1mhz、5khz
‑
1mhz、10khz
‑
1mhz、50khz
‑
1mhz、100khz
‑
1mhz、1khz
‑
100khz或10khz
‑
100khz之间。另一种定位器是多边形扫描仪,它依赖于将激光辐射引导向样本的表面的物理运动。在此处,反射多边形或多面镜在机械轴上旋转,并且每当多边形的平面横穿入射光束时,就会产生角偏转扫描光束。多边形扫描仪是一维扫描仪,可以沿着扫描线引导激光束(因此需要辅助定位器,以便在激光束中引入相对于样本的第二相对运动,或者样本需要在样本台上移动)。与例如基于检流计的扫描仪的前后运动相反,一旦到达光栅扫描的一行的末端,光束被引导回到扫描行开始的位置。根据应用,多边形可以是规则的,也可以是不规则的。光斑尺寸取决于面尺寸和平面度,扫描线长度/扫描角度取决于面的数量。可以实现非常高的旋转速度,导致高扫描速度。然而,这种定位器实际具有缺点,由于面制造公差和轴向摆动以及来自镜面的潜在波前畸变,导致定位/反馈精度较低。技术人员将再次理解,这种扫描仪部件因此可应用于容许对激光辐射的这种影响的情况。
166.多边形扫描仪在市场上可以买到,例如,precision laser scanning(美国亚利桑那州)、ii
‑
vi(美国宾夕法尼亚州)、nidec copal electronics corp(日本)等。
167.在仅包括基于多边形扫描仪的定位器的实施例中,烧蚀激光脉冲能够指向样本的速率可以在200hz
‑
10mhz、200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、200hz
‑
10khz、1khz
‑
10mhz、5khz
‑
10mhz、10khz
‑
10mhz、50khz
‑
10mhz、100khz
‑
10mhz、1khz
‑
1mhz、10khz
‑
1mhz或100khz
‑
1mhz之间。与前述类型的激光扫描系统部件不同,eod是固态部件,即它们不包含移动部件。因此,它们在偏转激光辐射时没有机械惯性,因此具有约1纳秒量级的非常快的响应时间。它们也不像机械部件那样容易磨损。eod由光学透明材料(例如,晶体)形成,该材料的折射率根据施加在其上的电场而变化,而电场又通过在介质上施加的电压来控制。激光辐射的折射是由光束横截面上的相位延迟的引入引起的。如果折射率随电场线性变化,这种效应称为普克尔斯效应。如果它与场强成二次方变化,这被称为克尔效应。克尔效应通常比普克尔斯效应弱得多。两种典型的配置是基于光学棱镜界面处折射以及基于垂直于激光辐射传播方向的折射率梯度的折射的eod。为了在eod上施加电场,电极被结合到充当介质的光学透明材料的相对侧。结合一组相对的电极产生一维扫描eod。将第二组电极与第一组电极正交结合,产生二维(x,y)扫描仪。
168.例如,eod的偏转角比检流计反射镜小,但是如果给定设备装配需要的话,通过按顺序放置几个eod,可以增加偏转角。用于eod中的折射介质的示例性材料包括钽铌酸钾ktn(kta
x
nb1‑
x
o3)、litao3、linbo3、batio3、srtio3、sbn(sr1‑
x
ba
x
nb2o6)和ktiopo4,在相同的场强下,ktn显示出较大的偏转角。
169.eod的角度精度很高,主要取决于连接到电极的驱动器的精度。此外,如上所述,eod的响应时间非常快,甚至比下面讨论的aod更快(由于以材料中的光速而不是以材料中的声速建立晶体中的(变化的)电场的事实;参见和bechtold的讨论,2014,physics procedia 56:29
‑
39)。
170.因此,在本发明的一些实施例中,激光扫描系统包括eod。在一些实施例中,eod是两组电极正交连接到折射介质的eod。
171.在包括基于eod的定位器的实施例中,烧蚀激光脉冲能够指向样本的速率可以在200hz
‑
100mhz、200hz
‑
10mhz、200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、200hz
‑
10khz、1khz
‑
100mhz、5khz
‑
100mhz、10khz
‑
100mhz、50khz
‑
100mhz、100khz
‑
100mhz、1mhz
‑
100mhz、10mhz
‑
100mhz、1khz
‑
10mhz、10khz
‑
10mhz或100khz
‑
10mhz之间。这类定位器也是固态元件。元件的偏转基于声波在光学透明材料中的传播,以引起折射率的周期性变化。折射率的变化是由于声波在材料中传播导致材料的压缩和稀疏(即密度变化)而发生的。周期性变化的折射率像光栅一样对传播经过材料的激光束进行衍射。
172.通过将换能器(通常是压电元件)结合到声光晶体(例如,teo2)上而产生aod。由电子放大器驱动的换能器将声波引入折射介质。在相对端,晶体通常是斜切的,并装有吸声材料,以避免声波反射回晶体。当波沿一个方向传播穿过晶体时,就形成了一维扫描仪。通过将两个aod正交串联放置,或者通过将两个换能器结合在正交的晶面上,可以产生二维扫描仪。
173.对于eod,aod的偏转角比检流计反射镜低,但与这种基于反射镜的扫描仪相比,角度精度高,驱动晶体的频率受到数字控制,通常可分辨为1hz。和bechtold在2014年指出,基于检流计的扫描仪常见的漂移以及与模拟控制器相比的温度依赖性通常不是aod遇到的问题。
174.用作aod的折射介质的示例性材料包括二氧化碲、熔凝石英、晶体石英、蓝宝石、amtir、gap、gaas、inp、sf6、铌酸锂、pbmoo4、三硫化二砷、碲酸盐玻璃、硅酸铅、ge
55
as
12
s
33
、氯化汞(i)和溴化铅(ii)。
175.为了改变偏转角度,必须改变引入晶体的声音频率,声波填充晶体需要有限的时间(取决于声波在晶体中的传播速度和晶体的尺寸),从而意味着存在一定程度的延迟。然而,与基于移动部件的激光系统定位器相比,响应时间相对较快。
176.在特定情况下可以利用的aod的另一特性在于,施加到晶体上的声功率决定了激光辐射相对于零级(即非衍射)光束的衍射量。非衍射光束通常被引导向光束收集器。因此,aod可用于高速有效地控制(或调制)偏转光束的强度和功率。
177.aod的衍射效率通常是非线性的,因此,可以针对不同的输入频率映射衍射效率与功率的关系曲线。然后,每个频率的映射效率曲线可以被记录为等式或在查找表中,用于随后在本文公开的设备和方法中使用。
178.因此,在本发明的一些实施例中,激光扫描系统包括aod。
179.固态定位器(例如,aod或eod)可以代替旋转反射镜,并且用于将偏转引入激光辐射束而不是基于反射镜的定位器。如本文其他地方所述,通过将正交电极附接到eod介质上,或者通过正交串联排列两个aod,固态扫描仪可以在两个正交方向(x和y)上扫描。
180.在包括基于aod的定位器的实施例中,烧蚀激光脉冲能够指向样本的速率可以在200hz
‑
100mhz、200hz
‑
10mhz、200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、200hz
‑
10khz、1khz
‑
100mhz、5khz
‑
100mhz、10khz
‑
100mhz、50khz
‑
100mhz、100khz
‑
100mhz、1mhz
‑
100mhz、10mhz
‑
100mhz、1khz
‑
10mhz、10khz
‑
10mhz或100khz
‑
10mhz之间。在前面的段落中,讨论了两种类型的激光扫描系统定位器:基于反射镜的,包括移动部件;以及固态定位器。前者的特点是偏转角度大,但由于惯性,响应时间相对较慢。相比之下,固态定位器的偏转角范围更小,但响应时间更快。因此,在本发明的一些实施例中,激光扫描系统包括串联的基于反射镜的部件和固态部件。这种布置利用了两者的优点,例如,基于反射镜的部件提供的大范围,但是考虑了基于反射镜的部件的惯性。例如,参见matsumoto等人在2013年的(journal of laser micro/nanoengineering 8:315:320)。
181.因此,固态定位器(即,aod或eod)可以用于例如校正基于反射镜的扫描仪部件中的误差。在这种情况下,与反射镜位置相关的位置传感器向固态部件反馈,由固态部件引入激光辐射束的偏转角可以适当地改变以校正基于反射镜的扫描仪部件的位置误差。
182.组合系统的一个示例包括检流计反射镜和aod(其中,aod可以实现一个或两个方向的偏转(通过使用两个串联aod,或者将两个驱动器结合到单个aod的晶体的正交面))。该系统可以包括两个检流计反射镜,以便结合aod(其中,aod可以实现在一个或两个方向上的偏转(通过使用串联的两个aod,或者将两个驱动器结合到单个aod的晶体的正交面)),产生二维扫描系统。在这样的系统中,烧蚀激光脉冲能够指向样本的速率可以在200hz
‑
100mhz、200hz
‑
10mhz、200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、200hz
‑
10khz、1khz
‑
100mhz、5khz
‑
100mhz、10khz
‑
100mhz、50khz
‑
100mhz、100khz
‑
100mhz、1mhz
‑
100mhz、10mhz
‑
100mhz、1khz
‑
10mhz、10khz
‑
10mhz或100khz
‑
10mhz之间。组合系统的替换示例包括检流计反射镜和eod(其中,eod可以在一个或两个方向上偏转(通过将两个正交排列的电极结合到晶体上))。该系统可以包括两个检流计反射镜,以便结合eod(其中,eod可以实现一个或两个方向的偏转(通过将两个正交排列的电极结合到晶体上)),产生二维扫描系统。在这样的系统中,烧蚀激光脉冲能够指向样本的速率可以在200hz
‑
100mhz、200hz
‑
10mhz、200hz
‑
1mhz、200hz
‑
100khz、200hz
‑
50khz、200hz
‑
10khz、1khz
‑
100mhz、5khz
‑
100mhz、10khz
‑
100mhz、50khz
‑
100mhz、100khz
‑
100mhz、1mhz
‑
100mhz、10mhz
‑
100mhz、1khz
‑
10mhz、10khz
‑
10mhz或100khz
‑
10mhz之间。为了控制激光扫描系统的定位器,激光扫描系统可以包括扫描仪控制模块(例如,计算机或编程芯片),其协调定位器在y轴和/或x轴上的运动以及样本台的运动。在某些情况下,例如,来回光栅化,适当的图案将被预编程到芯片中。然而,在其他情况下,控制模块可以施加反向运动来确定要遵循的适当烧蚀图案。反向运动可能特别有用,例如,在生成任意烧蚀图案时,以便在多个和/或不规则形状的待烧蚀细胞之间绘制最佳烧蚀过程。扫描仪控制模块也可以协调激光辐射脉冲的发射,例如,也通过协调脉冲拾取器的操作。
183.有时,定位器会造成它所引导的激光辐射束发生色散。因此,在本文描述的设备的一些实施例中,激光扫描系统包括定位器和/或第二定位器与样本之间的至少一个色散补偿器,该色散补偿器适于补偿由定位器引起的任何色散。当定位器是aod和/或第二定位器
是aod时,色散补偿器是(i)具有适合于补偿由定位器和/或第二定位器引起的色散的线间距的衍射光栅;(ii)适用于补偿定位器和/或第二定位器引起的色散的棱镜(即适当的材料、厚度和棱镜角度);(iii)包括衍射光栅(i)和棱镜(ii)的组合;和/或(iv)另一声光装置。在第一定位器引起色散和第二定位器引起色散的情况下,激光扫描系统可以包括补偿由第一定位器引起的任何色散的第一色散补偿器和补偿由第二定位器引起的任何色散的第二色散补偿器。wo03/028940描述了如何使用另一适当调整的aod来补偿由aod定位器引起的色散。
184.有时,由于将激光辐射引导向不同位置的定位器的移动,辐射束的焦距可以相对于样本的位置而变化。这可以通过多种方式得到补偿。例如,可移动聚焦透镜可以移动,以便在样本上保持恒定或接近恒定直径的光斑尺寸,而不管激光辐射被引导向样本上的特定位置。或者,可以使用可调聚焦透镜(可从optotune购得)。也可以通过改变样本台在z轴上的高度来补偿光斑尺寸的变化。然而,这两种技术都依赖于移动部件,在系统操作中引入了定时开销。如果aod与高斯光束一起使用,则烧蚀光斑尺寸可以通过施加到aod中的晶体的功率来控制,以便快速调制一阶与零阶光束强度。
185.在图2至图4所示的替代布置中,除了系统操作以透过样本载体烧蚀样本之外,部件可以类似于图1所示的部件。这种布置可以是优选的,例如,当需要将额外的动能施加到被烧蚀的样本材料中时,以帮助从烧蚀光斑附近的区域清除材料。替代地或另外,图2、图3和/或图4中呈现的配置可以允许如本文所述的更小的光斑尺寸。在一些实施例中,透过样本载体的烧蚀可以与激光扫描光学器件相结合。
186.激光器
187.通常,用于样本烧蚀的激光的波长和功率的选择可以遵循细胞分析中的正常用途。激光必须具有足够的通量,以使烧蚀达到所需的深度,而不会显著烧蚀样本载体。0.1
‑
5j/cm2之间的激光通量通常是合适的,例如,从3
‑
4j/cm2或大约3.5j/cm2,并且激光器将理想地能够以200hz或更高的速率产生具有该通量的脉冲。在某些情况下,来自这种激光器的单个激光脉冲应该足以烧蚀细胞材料以用于分析,使得激光脉冲频率与产生烧蚀羽流的频率相匹配。一般来说,为了成为对生物样本成像有用的激光器,激光器应该产生持续时间低于100ns(优选低于1ns)的脉冲,该脉冲可以聚焦到例如本文讨论的特定光斑尺寸。
188.例如,激光系统的烧蚀频率在200hz
‑
100mhz、200hz
‑
10mhz、200hz
‑
1mhz、200hz
‑
100khz、500hz
‑
50khz的范围内或1khz
‑
10khz的范围内。
189.在这些频率下,仪器必须能够足够快速地分析烧蚀材料,以避免连续烧蚀之间的大量信号重叠,如果希望单独解析(resolve)每个烧蚀羽流的话(如下所述,当向样本发射脉冲串时可能不一定需要)。优选地,源自连续羽流的信号之间的重叠强度小于10%,更优选地小于5%,并且理想地小于2%。羽流分析所需的时间取决于样本腔的冲洗时间(见下面的样本腔部分)、羽流气溶胶到达和通过激光电离系统的运送时间以及分析电离材料所需的时间。每个激光脉冲可以与随后建立的样本图像上的像素相关,如下面更详细讨论的。
190.在一些实施例中,激光源包括具有纳秒脉冲持续时间的激光器或超快激光器(脉冲持续时间为1ps(10
‑
12
s)或更快),例如,飞秒激光器。超快脉冲持续时间提供了许多优点,因为它们限制了来自烧蚀区域的热扩散,从而提供了更精确和可靠的烧蚀坑,并且最小化了每次烧蚀事件的碎片散射。飞秒激光器在此处描述的系统和设备中特别有用。特别地,飞
秒激光器与包括激光扫描部件的系统高度兼容,并且因为短脉冲持续时间实现基于多光子事件和电子种植过程的烧蚀技术。飞秒激光器的三个特性使其特别适合这种应用。第一特性是飞秒激光器上典型配置的高重复频率,通常在1mhz和100mhz之间。相比之下,纳秒激光器的脉冲频率通常限制在低于100khz。第二特性是非线性烧蚀机制。非线性烧蚀锐化了烧蚀边缘的限定(definition),并允许以更高的空间分辨率进行烧蚀。第三,非线性烧蚀阈值也可以是更少地特定于材料,这使得在研究非均匀材料(例如,组织)时更容易获得一致的烧蚀光斑尺寸。
191.在某些情况下,飞秒激光器用作激光源。飞秒激光器是一种发出持续时间小于1ps的光脉冲的激光器。这种短脉冲的产生通常采用有源锁模技术。飞秒激光器可以使用多种类型的激光器产生。30fs至30ps之间的典型持续时间可以使用无源锁模固态体激光器来实现。类似地,各种二极管泵浦的激光器(例如,基于掺钕或掺镱增益介质的激光器)在这种状态下工作。具有先进色散补偿的钛蓝宝石激光器甚至适用于小于10fs的脉冲持续时间,在极端情况下可降至约5fs。大多数情况下,脉冲重复频率在10mhz至500mhz之间,但也有低重复频率版本,对于更高的脉冲能量,重复频率为几兆赫(可从lumentum(美国加利福尼亚州)、radiantis(西班牙)、coherent(美国加利福尼亚州)购得)。这种类型的激光器可以配备放大器系统,用于增加脉冲能量。
192.还有各种类型的超快光纤激光器,在大多数情况下也是无源锁模的,通常提供50至500fs之间的脉冲持续时间和10至100mhz之间的重复频率。这种激光器可以从例如nkt photonics(丹麦;前称fianium)、amplitude systems(法国)、laser
‑
femto(美国加州)购得。这种激光器的脉冲能量也可以通过放大器来增加,放大器通常是集成光纤放大器的形式。
193.一些锁模二极管激光器可以产生飞秒持续时间的脉冲。直接在激光输出端,脉冲持续时间通常约为几百飞秒(可从例如coherent(美国加州)购得)。
194.飞秒激光器特别适用于浸没透镜,例如,油浸透镜(如上所述)。油浸透镜可以实现约160nm的激光光斑直径,但由于使用飞秒激光器烧蚀是多光子过程,当与飞秒激光器一起使用时,有效光斑直径减少了倍,其中,m是非线性过程的数量级。通过这种方式,可以获得小于100nm的有效光斑直径。当与飞秒激光器一起使用时,包括如上所述的浸没透镜的设备的所有可能的配置可以实现100nm的烧蚀光斑尺寸,因此本发明提供的设备和方法与传统的imc和ims相比提供了十倍的空间分辨率改善。飞秒激光器的波长通常在近红外区(700
‑
1300nm),这意味着必须采用频率转换技术来缩短它们的波长,以便实现100nm的烧蚀光斑直径。其中最直接和众所周知的是二次谐波产生(shg),这可以有效地将近红外激光束转换成可见波长,其中,可以使用商业现成的显微镜光学器件。
195.在某些情况下,使用皮秒激光器。前面段落中已经讨论过的许多类型的激光器也可以适用于产生皮秒范围持续时间的脉冲。最常见的光源是有源或无源锁模固态体激光器,例如,有源锁模掺钕yag、玻璃或钒酸盐激光器。同样,皮秒锁模激光器和激光二极管也可以在市场上买到(例如,nkt photonics(丹麦)、ekspla(立陶宛))。
196.纳秒脉冲持续时间激光器(增益切换和q切换)也可以在特定的设备装配(coherent(美国加州)、thorlabs(美国新泽西州))中实用。纳秒uv激光器特别适用于上述固体浸没透镜。特别地,波长为266nm的纳秒uv激光器可以与金刚石和熔融石英固体浸没透
镜一起使用,来将光聚焦到100nm以下的光斑尺寸。如本领域技术人员所理解的,使用uv激光器的激光烧蚀通常是热过程,这意味着激光光斑尺寸周围的区域将受到源自烧蚀过程的热量的影响。这就对可获得的烧蚀光斑尺寸设置了限制,因此,本领域技术人员相应地将会理解,uv激光器将适用于某些情况,但是其它激光器在其它情况下可能更有用。
197.或者,可以使用连续波激光器,外部调制以产生纳秒以下持续时间的脉冲。
198.通常,在本文讨论的激光系统中用于烧蚀的激光束即在采样位置具有100μm以下的光斑尺寸,例如,50μm以下、25μm以下、20μm以下、15μm以下、或10μm以下,例如,约3μm以下、约2μm以下、约1μm以下、约500nm以下、约250nm以下。在物镜和样本之间使用浸没介质的情况下,(如pct公开文本第8页上的部分所述),可以获得更小的光斑尺寸,例如,200nm以下、150nm以下、或100nm以下。被称为光斑尺寸的距离对应于光束的最长内部尺寸,例如,对于圆形光束,它是光束直径,对于正方形光束,它对应于相对的角之间的对角线长度,对于四边形,它是最长对角线的长度,等等(如上所述,具有高斯分布的圆形光束的直径被定义为通量降低到峰值通量的1/e2倍的点之间的距离)。作为高斯光束的替代选择,可以采用光束成形和光束遮挡来提供期望的烧蚀光斑。例如,在一些应用中,具有顶帽能量分布的方形烧蚀光斑可能是有用的(即,与高斯能量分布相反,光束具有接近均匀的通量)。这种配置减少了烧蚀光斑尺寸对高斯能量分布的峰值的通量与阈值通量之间的比率的依赖性。接近阈值通量的烧蚀提供了更可靠的烧蚀坑生成,并控制了碎片的生成。因此,激光系统可以包括光束遮挡和/或光束成形部件,例如,衍射光学元件,其被设置在高斯光束中,以重新亚光(re
‑
shame)光束并产生均匀或接近均匀的通量的激光焦点,例如,在光束上的通量变化小于
±
25%,例如,小于
±
20%、
±
15%、
±
10%或小于
±
5%。有时,激光束具有正方形横截面形状。有时,光束具有顶帽能量分布。如上所述,在本发明的上下文中,被称为光斑尺寸的距离是采样位置处光束的最长内部尺寸,即光斑尺寸是光束的横向尺寸,因此,例如,圆形光束的光斑尺寸是直径。然而,本领域技术人员将会理解,物镜的焦斑是三维体积,并且聚焦光斑尺寸的轴向尺寸通常比横向尺寸长,因此在一些情况下,焦斑的轴向尺寸可能比在本发明的上下文中称为“光斑尺寸”的距离长。如果用户需要,还可以使用光束成形和遮挡来使设备能够在浸没透镜可实现的高分辨率光斑尺寸和更大的光斑尺寸之间切换。除了在某些条件下的高分辨率成像之外,当项目规范要求时,可以使用大光斑(例如,在更低分辨率是合适的情况下,或者在给定时间内需要对更大面积的组织进行采样和分析的情况下)。
199.当用于分析生物样本时,为了分析个体细胞,所用激光束的光斑大小将取决于细胞的大小和间距。例如,在细胞彼此紧密堆积的情况下(例如,在组织切片中),激光系统中的一个或多个激光源可以具有不大于这些细胞的光斑尺寸。该尺寸取决于样本中的特定细胞,但通常激光光斑的直径小于4μm,例如,约3μm以下、约2μm以下、约1μm以下、约500nm以下、约250nm以下。为了以亚细胞分辨率分析给定的细胞,该系统使用不大于这些细胞的激光光斑尺寸,更具体地,使用能够以亚细胞分辨率烧蚀材料的激光光斑尺寸。光斑尺寸越小,得到的图像分辨率越大。因此,在需要高分辨率亚细胞成像的情况下,可以使用本文描述的技术。有时,单细胞分析可以使用大于细胞大小的光斑进行,例如,在细胞在载玻片上铺开,细胞之间留有空间(例如,通过电子显微镜分析后,已经确定细胞的内部结构从细胞的初步分析中分离出来)。在此处,可以使用更大的光斑尺寸,并且实现单细胞表征,因为感兴趣的细胞周围的额外烧蚀区域不包括额外的细胞。因此,可以根据被分析细胞的大小来
适当选择所使用的特定光斑大小。在生物样本中,细胞很少都是相同的大小,因此如果需要亚细胞分辨率成像,如果在整个烧蚀过程中保持恒定的光斑大小,烧蚀光斑大小应该小于最小的细胞。使用激光束聚焦可以获得小的光斑尺寸。1μm的激光光斑直径对应于1μm的激光焦点(即激光束在光束焦点处的直径),但是由于目标上能量的空间分布(例如,高斯光束形状)和总激光能量相对于烧蚀阈值能量的变化,激光焦点可以改变 20%或更多。用于聚焦激光束的合适物镜包括反射物镜,例如,schwarzschild cassegrain设计的物镜(反向cassegrain)。也可以使用折射物镜,也可以使用反射
‑
折射物镜的组合。也可以使用单个非球面透镜来实现所需的聚焦。固体浸没透镜或衍射光学器件也可用于聚焦激光束。另一种控制激光光斑尺寸的方法是在聚焦前让光束通过孔径,这种方法可以单独使用,也可以与上述物镜结合使用。不同的光束直径可以通过使光束穿过来自一系列直径的不同直径的孔径来实现。在某些情况下,存在可变尺寸的单个孔径,例如,当孔径是光圈孔径时。有时,光圈孔径是虹膜光圈。光斑尺寸的变化也可以通过光学器件的抖动来实现。一个或多个透镜和一个或多个孔径位于激光器和样本台之间。
200.为了完整起见,本领域已知的亚细胞分辨率的la的标准激光器是准分子或激基复合物激光器。使用氟化氩激光器(λ=193nm)可以获得合适的结果。这些激光器的脉冲持续时间为10
‑
15ns,对于某些应用可以实现足够的烧蚀。
201.总的来说,激光脉冲频率和强度是结合ms检测器的响应特性来选择的,以允许对各个激光烧蚀羽流进行不同的检测。结合使用小激光光斑和具有短冲洗时间的样本腔,快速和高分辨率成像现在是可行的。
202.激光烧蚀焦点
203.为了最大化激光从样本上烧蚀材料的效率,样本应该在相对于激光焦点的合适位置,例如,在焦点处,因为焦点是激光束具有最小直径和能量最集中的地方。这可以通过多种方式实现。第一种方法是,样本可以在指向它的激光的轴上移动(即沿着激光的路径向上和向下/朝向和远离激光源)到期望的点,在该点,光具有足够的强度来实现期望的烧蚀。替代地或者另外,透镜可以用于移动激光的焦点,从而提高其在样本位置烧蚀材料的有效能力,例如,通过缩微。一个或多个透镜位于激光器和样本台之间。第三种方法是改变激光器的位置,该方法可以单独使用,也可以与上述两种方法中的一种或两种结合使用。
204.为了帮助系统的用户将样本放置在最合适的位置,以便从样本上烧蚀材料,可以将相机指向保持样本的载物台(下面将更详细地讨论)。因此,本公开提供了一种激光烧蚀采样系统,其包括指向样本台上的相机。相机检测到的图像可以聚焦到激光聚焦的同一点。这可以通过对激光烧蚀和光学成像使用相同的物镜来实现。通过使两者的焦点一致,用户可以确定当光学图像聚焦时,激光烧蚀将是最有效的。使用压电激励器可以实现载物台的精确移动,从而使样本聚焦,压电激励器可从physik instrumente、cedrat
‑
technologies、thorlabs和其他供应商处获得。
205.在另一种操作模式中,激光烧蚀透过样本载体引导向样本。在这种情况下,应选择样本支撑件,使其对用于烧蚀样本的激光辐射的频率是透明的(至少部分透明的)。透过样本的烧蚀在特定情况下会具有优势,因为这种烧蚀模式可以将额外的动能提供给从样本烧蚀的材料羽流,驱动烧蚀材料进一步远离样本表面,从而有利于烧蚀材料从样本中运送出,以便在检测器中进行分析。
206.为了实现样本的3d成像,可以将样本或其限定区域烧蚀至第一深度,该深度不完全穿过样本。在此之后,相同的区域可以被再次烧蚀到第二深度,以此类推到第三、第四等深度。这样就可以建立样本的3d图像。在一些情况下,可能优选的是,在以第二深度进行烧蚀之前,烧蚀所有要烧蚀的区域至第一深度。或者,可以在同一点重复烧蚀,以在前进到烧蚀区域的下一个位置之前烧蚀通过不同的深度。在这两种情况下,可以通过成像软件将ms上得到的信号解卷积成样本的位置和深度。可以使用厚组织染色,并且组织被稳定在潮湿状态,类似于共聚焦成像中使用的工作流程(clendenon等人,2011,microsc microanal,17:614
–
617)。
207.激光烧蚀采样系统的样本腔
208.当样本经受激光烧蚀时,样本被放置在样本腔中。样本腔包括载物台,载物台保持样本(通常样本放置在样本载体上)。当烧蚀时,样本中的材料形成羽流,从气体入口穿过样本腔到达气体出口的气流带走原子化材料的羽流,包括在烧蚀位置的任何标记原子。气体将材料带到电离系统,电离系统使材料电离,从而使检测器能够进行检测。包括标记原子在内的样本中的原子可以通过检测器来区分,因此它们的检测揭示了羽流中存在或不存在多个目标,从而确定了样本上烧蚀位置存在哪些目标。因此,样本腔起到容纳分析的固体样本以及作为将原子化材料传送到电离和检测系统的起点的双重作用。这意味着,通过腔室的气流会影响烧蚀后的材料羽流在通过系统时的扩散程度。衡量烧蚀羽流扩散程度的度量是样本腔的冲洗时间。这个数是从样本中烧蚀出的材料被流经样本腔的气体带出样本腔所需时间的度量。
209.以这种方式由激光烧蚀产生的信号的空间分辨率(即,当烧蚀用于成像而不是专门用于清除时,如下所述)取决于以下因素,包括:(i)激光的光斑尺寸,因为信号在烧蚀的总面积上集成;以及与样本相对于激光的运动相关产生羽流的速度,以及(ii)相对于羽流产生的速度,可以对羽流进行分析的速度,以避免来自如上所述的连续羽流的信号重叠。因此,如果需要对羽流进行单独分析,则能够在尽可能短的时间内分析羽流,可以最大限度地减少羽流重叠的可能性(从而使羽流产生的频率更高)。
210.因此,具有短冲洗时间(例如,100ms以下)的样本腔与本文公开的设备和方法一起使用是有利的。具有长冲洗时间的样本腔会限制图像产生的速度,或者会导致源自连续样本光斑的信号之间的重叠(例如,kindness等人(2003;clinchem 49:1916
‑
23),信号持续时间超过10秒)。因此,气溶胶冲洗时间是在不增加总扫描时间的情况下获得高分辨率的关键限制因素。冲洗时间<100ms的样本腔在本领域中是已知的。例如,gurevich&(2007;j.anal.at.spectrom.,22:1043
‑
1050)公开了冲洗时间低于100ms的样本腔。wang等人(2013;anal.chem.85:10107
‑
16)(也参见wo2014/146724)公开了冲洗时间小于等于30ms的样本腔,从而允许高烧蚀频率(例如,高于20hz)并因此快速分析。wo2014/127034中公开了另一种这样的样本腔。wo2014/127034中的样本腔包括被配置为可操作地靠近目标设置的样本捕获单元,该样本捕获单元包括:捕获腔,其具有形成在捕获单元的表面中的开口,其中,捕获腔被配置为通过开口接收从激光烧蚀部位喷射或产生的目标材料;以及暴露在捕获腔内的引导壁,被配置为将捕获腔内的载气流从入口引导向出口,使得捕获腔内接收的目标材料的至少一部分可作为样本传送至出口。wo2014/127034的样本腔中的捕获腔的体积小于1cm3,并且可以小于0.005cm3。有时,样本腔具有25ms以下的冲洗时间,例如,20ms、
10ms以下、5ms以下、2ms以下、1ms以下、500μs以下、200μs以下、100μs以下、50μs以下、或25μs以下。例如,样本腔的冲洗时间可为10μs以上。通常,样本腔的冲洗时间为5ms以下。
211.为完整起见,有时,可能比样本腔的冲洗时间更频繁地产生来自样本的羽流,并且产生的图像将相应地模糊(例如,如果最高可能的分辨率被认为对于正在进行的特定分析是不必要的)。
212.样本腔通常包括平移台,该平移台保持样本(和样本载体)并相对于激光辐射束移动样本。当使用要求激光辐射穿过样本载体到达样本的方向的操作模式时,保持样本载体的载物台也应该对所使用的激光辐射透明。
213.因此,当激光辐射被引导到样本上时,样本可以被定位在样本载体(例如,载玻片)面向激光辐射的一侧,使得在激光辐射被引导到样本上的同一侧上释放烧蚀羽流并从该侧捕获烧蚀羽流。或者,当激光辐射被引导到样本上时(即激光辐射在到达样本之前透过样本载体),样本可以被定位在样本载体的与激光辐射相反的一侧,并且在激光辐射的相反侧上释放和捕获烧蚀羽流。当使用浸没介质(例如,固体浸没透镜或液体浸没透镜)时,通过样本载体将激光辐射引导到样本上是特别有用的。
214.样本腔的一个特征在于大范围移动,其中,样本可以相对于激光在x轴和y轴(即水平)上移动(其中,激光束在z轴上被引导到样本上),x轴和y轴相互垂直,这个特征对于烧蚀样本的各个离散区域中的特定部分是特别有用的。通过在样本腔内移动载物台并保持激光器在设备的激光烧蚀采样系统中的位置固定,可以获得更可靠和更精确的相对位置。移动范围越大,离散烧蚀区域之间的距离就越大。通过移动放置有样本的载物台,样本相对于激光移动。因此,样本台在样本腔内的移动范围在x轴和y轴上至少为10mm,例如,在x轴和y轴上为20mm,在x轴和y轴上为30mm,在x轴和y轴上为40mm,在x轴和y轴上为50mm,例如,在x轴和y轴上为75mm。有时,移动的范围促使允许在腔室内分析标准的25mm
×
75mm显微镜载片的整个表面。当然,为了能够实现亚细胞烧蚀,除了大范围的移动之外,移动应该是精确的。因此,载物台可以被配置为在x轴和y轴上以小于10μm的增量移动样本,例如,小于5μm、小于4μm、小于3μm、小于2μm、1μm或小于1μm、小于500nm、小于200nm、小于100nm。例如,载物台可以被配置为以至少50nm的增量移动样本。精确的载物台移动可以以大约1μm的增量进行,例如,1μm
±
0.1μm。可以使用市售的显微镜载物台,例如,可从thorlabs、prior scientific和applied scientific instrumentation购得。或者,电动载物台可以由部件构建,基于定位器提供期望的移动范围和适当的精确移动,例如,smaract的slc
‑
24定位器。样本台的移动速度也会影响分析的速度。因此,样本台具有大于1mm/s的操作速度,例如,10mm/s、50mm/s或100mm/s。
215.当然,当样本腔中的样本台有大范围的移动时,样本腔的尺寸必须适当,以允许样本台的移动。因此,样本腔的尺寸取决于所涉及样本的尺寸,这又决定了移动样本台的尺寸。样本腔的示例性尺寸具有10
×
10cm、15
×
15cm或20
×
20cm的内室。腔室的深度可以是3cm、4cm或5cm。技术人员将能够根据本文的教导选择合适的尺寸。使用激光烧蚀采样器分析生物样本的样本腔的内部尺寸必须大于样本台的移动范围,例如,大于至少5mm,例如,至少10mm。这是因为如果腔室的壁太靠近载物台的边缘,则穿过腔室的载气流会变成湍流,其中该载气流将材料的烧蚀羽流从样本带走并带入电离系统。湍流扰乱了烧蚀的羽流,因此,在材料羽流被烧蚀并被带到设备的电离系统后,材料羽流开始扩散,而不是保持为紧密的
烧蚀材料云。烧蚀材料的更宽的峰对电离和检测系统产生的数据有负面影响,因为它会由于峰重叠而导致干扰,最终导致空间分辨率更低的数据,除非烧蚀速率降低到实验上不再感兴趣的速率。
216.如上所述,样本腔包括气体入口和将材料带到电离系统的气体出口。然而,它还可以包含用作入口或出口的其它端口,以引导腔室中的气流和/或向腔室提供气体混合物,这由技术人员根据所进行的特定烧蚀过程来确定。
217.相机
218.除了识别用于激光烧蚀的样本的最有效定位之外,在激光烧蚀采样系统中包括相机(例如,基于电荷耦合器件的图像传感器(ccd)相机或基于有源像素传感器的相机)或任何其他光检测装置,能够实现各种进一步的分析和技术。ccd是一种检测光并将其转换成可用于生成图像的数字信息的手段。在ccd图像传感器中,包括一系列检测光的电容器,每个电容器表示确定图像上的一个像素。这些电容器可以将入射光子转化为电荷。然后使用ccd读出这些电荷,记录的电荷可以转换成图像。有源像素传感器(aps)是由包含像素传感器阵列的集成电路组成的图像传感器,每个像素包含光电检测器和有源放大器,例如,cmos传感器。
219.相机可以包含到本文讨论的任何激光烧蚀采样系统中。相机可用于扫描样本,以识别特别感兴趣的细胞或特别感兴趣的区域(例如,具有特定形态的细胞),或对抗原或细胞内或结构特定的荧光探针。在某些实施例中,荧光探针是组织化学染色剂或抗体,其也包含可检测的金属标签。一旦已经识别这样的细胞,则激光脉冲可以指向这些特定的细胞,以烧蚀材料,用于分析,例如,在自动化(其中,系统识别和烧蚀感兴趣的特征/区域,例如,细胞)或半自动过程(其中,系统的用户(例如,临床病理学家)识别感兴趣的特征/区域,然后系统以自动化方式烧蚀)中。这使得分析的速度能够显著提高,因为不需要烧蚀整个样本来分析特定细胞,而是可以特定地烧蚀感兴趣的细胞。这导致分析生物样本的方法在执行烧蚀所花费的时间方面的效率得到提高,特别是在解释来自烧蚀的数据所花费的时间方面,在从其构建图像方面。从数据构建图像是成像过程中比较耗时的部分中的一个,因此通过将收集的数据最小化为来自样本相关部分的数据,提高了整体分析速度。
220.相机可以记录来自共焦显微镜的图像。共焦显微镜检查是光学显微镜检查的一种形式,它具有许多优点,包括能够减少来自远离焦平面的背景信息(光)的干扰。这是通过消除失焦光或眩光来实现的。共焦显微镜检查可用于评估未染色样本的细胞形态,或评估细胞是离散细胞还是细胞丛的一部分。通常,样本用荧光标记物(例如,标记的抗体或标记的核酸)特别标记。这些荧光标记物可用于染色特定的细胞群体(例如,表达某些基因和/或蛋白质)或细胞上的特定形态特征(例如,细胞核或线粒体),当用适当波长的光照射时,样本的这些区域是可特别识别的。因此,本文所述的一些系统可以包括用于激发用于标记样本的标记中的荧光团的激光器。或者,可以使用led光源来激发荧光团。非共焦(例如,宽视场)荧光显微镜检查也可用于识别生物样本的某些区域,但分辨率低于共焦显微镜检查。
221.可替换选择的成像技术是双光子激发显微镜检查(也称为非线性或多光子显微镜检查)。该技术通常使用近红外光来激发荧光团。每个激发事件吸收两个红外光光子。组织中的散射通过ir最小化。此外,由于多光子吸收,背景信号被强烈抑制。最常用的荧光团的激发光谱在400
‑
500nm范围内,而用于激发双光子荧光的激光在近红外范围内。如果荧光团
同时吸收两个红外光子,它将吸收足够的能量,以上升到激发态。然后荧光团将发射单个光子,其波长取决于可以检测到的所使用的荧光团的类型。
222.当激光器用于激发荧光显微镜检查的荧光团时,有时,该激光器是产生用于从生物样本中烧蚀材料的激光的同一激光器,但其使用的功率不足以从样本中烧蚀材料。有时,荧光团被激光器烧蚀样本所使用的光的波长激发。在其他情况下,可以使用不同的波长,例如,通过产生激光器的不同谐波,以获得不同波长的光,或者利用谐波产生系统中产生的不同谐波,如上所述,除了用于烧蚀样本的谐波之外。例如,如果使用nd:yag激光器的四次和/或五次谐波,则基波或二次至三次谐波可用于荧光显微镜检查。
223.作为结合荧光和激光烧蚀的示例技术,可以用与荧光部分结合的抗体或核酸来标记生物样本中的细胞核。因此,通过激发荧光标记,然后使用相机观察和记录荧光的位置,可以将烧蚀激光专门引导向细胞核或者不包括细胞核材料的区域。将样本分成细胞核和细胞质区域将在细胞化学领域得到特别的应用。通过使用图像传感器(例如,ccd检测器或有源像素传感器,例如,cmos传感器),通过使用控制模块(例如计算机或编程芯片)可以使识别感兴趣的特征/区域并且然后烧蚀它们的过程完全自动化,控制模块将荧光的位置与样本的x,y坐标相关联并且然后将烧蚀激光引导向该位置。作为该过程的一部分,由图像传感器拍摄的第一图像可以具有低物镜放大率(低数值孔径),这允许研究大面积的样本。在此之后,可以切换到具有更高放大率的物镜来聚焦感兴趣的特定特征,这些特征已经通过更高放大率的光学成像被确定为发荧光。被记录为发荧光的这些特征然后可以被激光烧蚀。首先使用较低数值孔径的透镜具有进一步的优点,即增加了景深,因此意味着与从一开始就用较高数值孔径的透镜进行筛选相比,可以以更高的灵敏度检测样本中埋藏的特征。
224.在使用荧光成像的方法和系统中,从样本到相机的荧光发射路径上可以包括一个或多个透镜和/或一个或多个滤光器。通过包括适于使来自一个或多个荧光标签的选定光谱带宽通过的滤光器,该系统适于处理与来自荧光标签的发射相关联的色差。色差是透镜无法将不同波长的光聚焦到同一焦点的结果。因此,通过包括滤光器,光学系统中的背景被减小,并且所得到的光学图像具有更高的分辨率。使到达相机的不希望的波长的发射光的量最小化的另一种方法是通过使用一系列透镜来有意地削弱透镜的色差,这些透镜被设计用于透射和聚焦由滤光器透射的波长的光,类似于wo 2005/121864中解释的系统。
225.更高分辨率的光学图像在光学技术和激光烧蚀采样的这种耦合中是有利的,因为光学图像的精度决定了烧蚀激光可以被引导以烧蚀样本的精度。
226.因此,在本文公开的一些实施例中,本发明的设备包括相机。该相机可用于在线识别样本的特征/区域,例如,特定细胞,然后可对其进行采样,例如,通过对感兴趣的特征/区域发射一串脉冲,以从感兴趣的特征/区域烧蚀样本材料。当脉冲串指向样本时,探测到的最终羽流中的材料可以是连续事件(每次单独烧蚀产生的羽流实际上形成单个羽流,然后被传送,用于检测)。虽然可以一起分析由来自感兴趣的特征/区域内的位置的聚集羽流形成的每个样本材料云,但是来自每个不同的感兴趣的特征/区域的羽流中的样本材料仍然保持离散。即,在不同的感兴趣的特征/区域的烧蚀之间留下足够的时间,以允许在第(n 1)个特征/区域的烧蚀开始之前烧蚀来自第n个感兴趣的特征/区域的样本材料。
227.在结合荧光分析和激光烧蚀采样的另一种操作模式中,不是在将激光烧蚀瞄准到那些位置之前分析整个载玻片的荧光,而是可以从激光器向样本上的一个斑点发射脉冲
(在低能量下,以便仅激发样本中的荧光部分,而不是烧蚀样本),并且如果检测到预期波长的荧光发射,则可以通过以全能量向该斑点发射激光来烧蚀该斑点处的样本,并通过检测器分析所得的羽流,如下所述。这样做的优点是保持了分析的光栅模式,但是速度加快,因为可以对荧光进行脉冲化和测试,并立即从荧光中获得结果(而不是花费时间来分析和解释来自检测器的离子数据,以确定该区域是否是感兴趣的),再次使得只有重要的位点能够作为分析的目标。因此,在对包含多个细胞的生物样本进行成像时应用该策略,可以执行以下步骤:(i)用一个或多个不同的标记原子和一个或多个荧光标记来标记样本中的多个不同的目标分子,以提供标记的样本;(ii)用光照射样本的已知位置,以激发一个或多个荧光标记;(iii)观察并记录该位置是否有荧光;(iv)如果有荧光,向该位置引导激光烧蚀,以形成羽流;(v)对羽流进行电感耦合等离子体质谱法,以及(vi)对样本上的一个或多个其他已知位置,重复步骤(ii)
‑
(v),由此检测羽流中的标记原子,从而允许构建已烧蚀区域的样本图像。
228.在一些情况下,样本或样本载体可以被改性为在特定位置包含光学可检测(例如,通过光学或荧光显微镜检查)部分。然后,荧光位置可用于在设备中定位样本。这种标记位置的使用是有用的,例如,在样本可能已经被视觉“离线”检查的情况下,即在本发明的设备以外的一件设备中。在突出显示具有感兴趣的特征/区域的光学图像和样本被传送到根据本发明的设备之前,这种光学图像可以由例如医师用对应于特定细胞的感兴趣的特征/区域来标记。在此处,通过参考注释光学图像中的标记位置,本发明的设备可以通过使用相机来识别相应的荧光位置,并相应地计算激光脉冲位置的烧蚀计划。因此,在一些实施例中,本发明包括能够执行上述步骤的定向控制器模块。
229.在一些情况下,可以使用本发明的设备,基于由本发明的设备的相机拍摄的样本的图像,来执行感兴趣的特征/区域的选择。
230.电子显微镜
231.在本发明的一些实施例中,该设备还包括执行电子显微镜检查的部件。
232.一般来说,电子显微镜包括电子枪(例如,带有钨丝阴极)、静电/电磁透镜以及控制光束以将其引导向样本腔中的样本的孔。样本被保持在真空下,使得气体分子不能阻碍或衍射从电子枪到样本的路径上的电子。在透射电子显微镜检查(tem)中,电子穿过样本,然后偏转。偏转的电子然后被检测器检测到,例如,荧光屏,或者在某些情况下被耦合到ccd的高分辨率磷光体检测到。在样本和检测器之间具有物镜,其控制检测器上的偏转电子的放大倍数。
233.tem需要超薄切片,以使足够的电子穿过样本,从而可以从撞击检测器的偏转电子重建图像。通常,tem样本为100nm或更薄,通过使用超微切片机制备。生物组织标本被化学固定、脱水并嵌入聚合物树脂中,以充分稳定它们,从而允许超薄切片。生物样本、有机聚合物和类似材料的切片可能需要用重原子标记进行染色,以获得所需的图像对比度,因为未染色的生物样本在其天然未染色状态下很少与电子发生强烈的相互作用从而使它们偏转以允许记录电子显微镜图像。
234.如上所述,当使用薄切片时,可以对同样由ims或imc分析的样本进行电子显微镜检查。因此,高分辨率的结构图像可以通过电子显微镜检查获得,例如,透射电子显微镜检查,然后该高分辨率图像用于将由ims或imc获得的图像数据的分辨率提高到超过使用激光
辐射进行烧蚀可获得的分辨率(由于电子的波长比光子短得多)。在某些情况下,在单个设备中对样本进行电子显微镜检查和由ims或imc执行的元素分析(因为imc/ims是破坏性过程,所以在imc/ims之前进行电子显微镜检查)
235.因此,本发明提供了如本文所述的成像质谱流式细胞仪或成像质谱仪,其还包括电子显微镜,例如,包括如上所述的部件,例如,电子源,例如,电子枪。如本领域技术人员将理解的那样,部件的特定设置将会变化(例如,电子被引导到样本上的方向和激光辐射被引导到样本上的方向),并且可以在没有过度负担的情况下实现部件的常规设置。在某些情况下,在电子显微镜检查进行的分析和随后的烧蚀之间,样本在设备内不移动。如本领域技术人员所理解的,在真空下进行电子显微镜检查,但是在气流存在的情况下进行如本节所述的烧蚀,该气流带走在样本烧蚀产生的羽流中的粒子材料。因此,在完成电子显微镜检查分析阶段后,在进行元素分析之前,将允许样本腔返回到接近大气压的压力。
236.在包括电子显微镜的icp和ims设备中,部件的设置可以使得用于烧蚀的激光辐射透过样本载体为被引导到样本,例如,如图3或图4所示,样本载体可以作为样本腔壁的一部分,允许样本腔保持在真空下,用于电子显微镜检查目的。因此,在本文的一些实施例中,该设备包括电子显微镜和浸没介质,例如,液体浸没透镜或固体浸没透镜。
237.激光烧蚀
238.根据本文相关的变形(例如,不强制使用icp来电离样本材料,也不强制使用tof ms检测器),激光烧蚀可以以先前阐述的方式进行,例如,giesen等人在2014年的wo2014169394中阐述。例如,如本文所述,用于样本表面处或附近的电离的方法和系统可以使用离子光学器件以将标记原子直接从样本传送到质谱检测器(例如,tof检测器或磁扇形检测器),而不需要气体射流将样本输送到icp。在一些情况下,方法和系统可以使用非激光形式的辐射(例如,电子束或离子束)来代替激光或补充激光。
239.在进行激光烧蚀而无需持续电离烧蚀样本的实施例中,烧蚀羽流可以传送到如下所述的icp
‑
ms。
240.传送导管
241.传送导管在激光烧蚀采样系统和电离系统之间形成连接,并允许将激光烧蚀样本产生的样本材料羽流从激光烧蚀采样系统传送到电离系统。传送导管的一部分(或全部)可以例如通过钻穿合适的材料来形成,用于产生传送羽流的内腔(例如,具有圆形、矩形或其他横截面的内腔)。传送导管的内径有时在0.2mm至3mm的范围内。有时,传送导管的内径可以沿其长度变化。例如,传送导管可以在端部成锥形(变细)。传送导管的长度有时在1厘米到100厘米的范围内。有时,长度不超过10厘米(例如,1
‑
10厘米),不超过5厘米(例如,1
‑
5厘米),或不超过3厘米(例如,0.1
‑
3厘米)。有时,从烧蚀系统到电离系统的整个距离或几乎整个距离上,传送导管内腔是直的。其他时候,传送导管内腔在整个距离上不是直的,而是改变取向。例如,传送导管可以制作成具有平缓的90
°
转弯。这种配置允许激光烧蚀采样系统中的样本烧蚀产生的羽流最初在垂直平面内移动,而传送导管入口处的轴将指向上方,并随着其接近电离系统而水平移动(例如,通常水平定向以利用对流冷却的icp炬)。传送导管可以是直的,距离羽流进入或形成所经由的入口孔至少0.1厘米、至少0.5厘米或至少1厘米。一般而言,通常,传送导管适于最小化将材料从激光烧蚀采样系统传送到电离系统所花费的时间。
242.传送导管入口,包括样本锥
243.传送导管包括激光烧蚀采样系统中的入口(特别是在激光烧蚀采样系统的样本腔内;因此它也表示样本腔的主要气体出口)。传送导管的入口接收从激光烧蚀采样系统中的样本烧蚀的样本材料,并将其传送至电离系统。在某些情况下,激光烧蚀采样系统入口是沿着传送导管到电离系统的所有气流的源。在一些情况下,从激光烧蚀采样系统接收材料的激光烧蚀采样系统入口是导管壁中的孔,第二“传送”气体从单独的传送流入口沿着该导管流动(例如,如wo2014146724和wo2014147260中所公开的)。在这种情况下,传送气体占很大比例,在许多情况下,大部分气体流向电离系统。激光烧蚀采样系统的样本腔包含气体入口。气体通过该入口流入腔室,产生了通过传送导管的入口流出腔室的气流。该气流捕获了烧蚀材料的羽流,并将其夹带到传送导管中(通常传送导管的激光烧蚀采样系统入口为圆锥形状,在此称为样本锥),并从样本腔出来,进入在腔室上方经过的导管。该导管也有气体从单独的传送流入口流入其中,(图的左手侧,由传送流箭头指示)。包括传送流入口、激光烧蚀采样系统入口并开始于将烧蚀的样品材料传送到电离系统的传送导管的部件也可以称为流动池(如wo2014146724和wo2014147260中)。
244.传送流至少起三个作用:沿电离系统的方向冲洗进入传送导管的羽流,并防止羽流材料接触传送导管的侧壁;在样本表面上方形成“保护区”,确保在受控的气氛下进行烧蚀;以及增加了传送导管中的流速。通常,捕获气体的粘度低于传送气体的粘度。这有助于将样本材料羽流限制在传送导管中心的捕获气体中,并最小化样本材料羽流在激光烧蚀采样系统下游的扩散(因为在流动中心,传送速率更恒定且几乎平坦)。气体可以是例如但不限于氩、氙、氦、氮或其混合物。一种常见的传送气体是氩气。氩特别适合于在羽流到达传送导管壁之前阻止羽流的扩散(并且还有助于在电离系统是基于氩气的icp的设备中提高仪器灵敏度)。捕获气体优选为氦气。然而,捕获气体可以被其它气体替代或包含其它气体,例如,氢气、氮气或水蒸气。在25℃时,氩的粘度为22.6μpas,而氦的粘度为19.8μpas。有时,捕获气体是氦气,传送气体是氩气。
245.如wo2014169394中所述,样本锥的使用使目标和传送导管的激光烧蚀采样系统入口之间的距离最小化。由于样本和捕获气体可流过锥体的锥体点之间的距离减小,这导致样本材料的捕获改善,湍流减少,因此减少了烧蚀样本材料的羽流的扩散。因此,传送导管的入口是样本锥的末端的孔。锥体伸入样本腔。
246.样本锥的可选修改是使其不对称。当锥体是对称的,则在正中心,来自所有方向的气流都是中性的,所以在样本锥体的轴上,沿着样本表面的总气流为零。通过使锥体不对称,沿着样本表面产生非零速度,这有助于从激光烧蚀采样系统的样本腔中冲刷羽流材料。
247.实际上,可以采用对样本锥体的任何修改,这些修改使得在锥体的轴上沿着样本表面的非零矢量气流。例如,非对称锥体可以包括凹口或一系列凹口,适于在锥体的轴上沿着样本表面产生非零矢量气流。不对称锥体可以包括在锥体侧面的孔,适于在锥体的轴上沿着样本表面产生非零矢量气流。该孔将使锥体周围的气流不平衡,从而再次在目标处在锥体轴线处沿着样本表面产生非零矢量气流。锥体的侧面可以包括多于一个的孔,并且可以包括一个或多个凹口和一个或多个孔。凹口和/或孔的边缘通常是平滑的、圆形的或倒角的,以防止或最小化湍流。
248.根据捕获和传送气体及其流速的选择,锥体不对称的不同方向将适用于不同的情
况,并且技术人员能够适当地识别每个方向的气体和流速的组合。
249.如本发明中所使用的,所有上述调整可以存在于单个不对称样本锥中。例如,椎体可以被不对称地截断,并且由两个不同的椭圆圆锥半部形成,椎体可以被不对称地截断,并且包括一个或多个孔等。
250.因此,样本锥适于捕获在激光烧蚀采样系统中从样本烧蚀的材料羽流。在使用中,样本锥可操作地定位在样本附近,例如,通过在可移动的样本载体托盘上操纵激光烧蚀采样系统内的样本,如上所述。如上所述,烧蚀样本材料的羽流通过样本锥的窄端的孔进入传送导管。孔的直径可以是a)可调的;b)大小确定为防止烧蚀羽流进入传送导管时受到扰动;和/或c)大约等于烧蚀羽流的横截面直径。
251.锥形导管
252.在内径较小的管中,相同流速的气体以更高的速度流动。因此,通过使用具有较小内径的管,气流中携带的烧蚀样本材料的羽流可以在给定的流速下更快地传送通过限定的距离(例如,传送导管中从激光烧蚀采样系统到电离系统)。分析单个羽流的速度的一个关键因素在于,从通过烧蚀产生羽流到在设备的质谱仪部件上检测到其成分离子这段时间(检测器的瞬变时间)内,羽流扩散了多少。因此,通过使用狭窄的传送导管,烧蚀和检测之间的时间减少,从而意味着扩散减少,因为扩散发生的时间更少,最终结果是检测器处每个烧蚀羽流的瞬变时间减少。更少的瞬变时间意味着每单位时间可以产生和分析更多的羽流,从而更高质量和/或更快地产生图像。
253.该椎体可以包括沿着传送导管长度的所述部分传送导管内径的逐渐变化(即,管的内径是穿过它截取的横截面沿着从该部分的朝向入口的端部(在激光烧蚀采样系统端)到出口(在电离系统端)的部分而减小)。通常,导管中靠近发生烧蚀的区域具有相对较宽的内径。椎体之前的导管的较大体积有利于限制烧蚀产生的材料。当烧蚀粒子从烧蚀光斑飞出时,它们以高速运动。气体中的摩擦力减慢了这些粒子的速度,但羽流仍然可以在亚毫米到毫米的范围内扩散。允许距离壁具有足够的距离,有助于在气流中心附近容纳羽流。
254.因为宽内径部分仅仅是短的(大约1
‑
2mm),如果羽流在内径较窄的传送导管的较长部分花费更多时间,它对总的瞬变时间没有显著贡献。因此,较大的内径部分用于捕获烧蚀产物,较小的内径导管用于将这些粒子快速输送到电离系统。
255.窄内径部分的直径受到对应于湍流开始的直径的限制。可以针对圆管和已知流量计算雷诺数。一般来说,雷诺数高于4000将表示湍流,因此应该避免。雷诺数高于2000将表示过渡流(介于非湍流和湍流之间),因此也可能需要避免。对于给定的气体质量流量,雷诺数与导管直径成反比。传送导管的窄内径部分的内径通常窄于2mm,例如,窄于1.5mm、窄于1.25mm、窄于1mm,但是大于导管中每分钟4升的氦流的雷诺数大于4000时的直径。
256.传送导管的恒定直径部分和椎体之间的过渡部分中的粗糙或甚至有角度的边缘可能导致气流中的湍流,并且通常被避免。
257.牺牲流
258.在较高的流量下,导管中发生湍流的风险增加。这尤其是在传送导管具有小内径(例如,1mm)的情况下。然而,如果使用诸如氦气或氢气之类的轻气体代替传统上用作气体传送流的氩气,则可以在具有小内径的传送导管中实现高速传送(高达并超过300m/秒)。
259.高速传送存在问题,因为它可能导致烧蚀样本材料的羽流穿过电离系统,而没有
发生可接受水平的电离。电离水平会下降,因为冷却气体流的增加会降低火炬末端等离子体的温度。如果样本材料的羽流没有电离到合适的水平,则烧蚀样本材料的信息就会丢失,因为质谱仪无法检测到其成分(包括任何标记原子/元素标签)。例如,在icp电离系统中,样本可能在火炬末端如此快速地通过等离子体,以至于等离子体离子没有足够的时间作用在样本材料上来电离它。由窄内径传送导管中的高流量、高速传送引起的这个问题可以通过在传送导管的出口引入流量牺牲系统来解决。流量牺牲系统被适配为容纳来自传送导管的气流,并且仅使该气流的一部分(该气流的中心部分包括任何烧蚀样本材料的羽流)向前进入通向电离系统的注射器。为了便于气体从流量牺牲系统中的传送导管扩散,传送导管出口可以向外张开。
260.流量牺牲系统被定位为靠近电离系统,因此从流量牺牲系统通向电离系统的管(例如,注射器)的长度较短(例如,约1cm长;与传送导管的长度相比,传送导管的长度通常为几十cm的数量级,例如,大约50cm)。因此,从流量牺牲系统通向电离系统的管内较低的气体速度不会显著影响总传送时间,因为整个传送系统的相对较慢的部分要短得多。
261.在大多数配置中,不希望或者在某些情况下可能显著增加从流量牺牲系统通向电离系统的管(例如,注射器)的直径,作为以体积流速降低气体速度的方式。例如,在电离系统是icp的情况下,来自流量牺牲系统的导管在icp炬的中心形成注射管。当使用更宽的内径注射器时,信号质量会降低,因为烧蚀样本材料的羽流不能如此精确地注入等离子体的中心(这是等离子体中最热且最有效的电离部分)。最优选的是内径为1mm或更窄的注射器(例如,内径为800μm以下,例如,600μm以下、500μm以下或400μm以下)。其他电离技术依赖于在三维空间中相对较小的体积内被电离的材料(因为电离所需的能量密度只能在较小的体积内实现),因此具有较宽内径的导管意味着通过导管的许多样本材料位于能量密度足以电离样本材料的区域之外。因此,从流量牺牲系统进入电离系统的窄直径管也用于具有非icp电离系统的设备中。如上所述,如果样本材料的羽流没有电离到合适的水平,则烧蚀样本材料的信息就会丢失,因为质谱仪无法检测到其成分(包括任何标记原子/元素标签)。
262.泵送可用于帮助确保牺牲流和进入电离系统入口的流之间的期望分流比。因此,有时,流量牺牲系统包括连接到牺牲流量出口的泵。可以在泵上增加可控限流器来控制牺牲流量。有时,流量牺牲系统还包括适于控制限流器的质量流量控制器。
263.在使用昂贵气体的情况下,从牺牲流出口泵出的气体可以使用已知的气体净化方法被净化,并再循环回到相同的系统中。如上所述,氦特别适合作为运输气体,但是它很昂贵;因此,减少系统中(即当氦进入电离系统并被电离时)氦的损失是有利的。因此,有时,气体净化系统连接到流量牺牲系统的牺牲流量出口。
264.电离系统
265.为了产生元素离子,需要使用能够蒸发、原子化(atomise,雾化)和电离原子化样本的强电离技术。
266.电感耦合等离子炬
267.通常,电感耦合等离子体用于电离待分析的材料,然后将其传送到质量检测器进行分析。这是一种等离子体源,其中,由电磁感应产生的电流提供能量。在由三个同心管组成的火炬中维持电感耦合等离子体,最里面的管被称为注射器。
268.提供维持等离子体的电磁能量的感应线圈位于火炬的输出端周围。交变电磁场每
秒钟反转极性数百万次。在两个最外面的同心管之间供应氩气。自由电子通过放电引入,然后在交变电磁场中加速,由此与氩原子碰撞并电离。在稳定状态下,等离子体主要由氩原子组成,有一小部分自由电子和氩离子。
269.icp可以保留在火炬中,因为两个最外层管之间的气流保持等离子体远离火炬壁。在注射器(中心管)和中间管之间引入的第二氩气流保持等离子体远离注射器。第三气体流被引入火炬中心的注射器。待分析的样本通过注射器引入等离子体中。
270.icp可以包括内径小于2mm且大于250μm的注射器,用于将来自样本的材料引入等离子体中。注射器的直径是指注射器在靠近等离子体的一端的内径。注射器远离等离子体延伸,可以具有不同的直径,例如,更宽的直径,其中,直径的差异通过直径的阶梯式增加来实现,或者因为注射器沿着其长度逐渐变细。例如,注射器的内径可以在1.75mm和250μm之间,例如,直径在1.5mm和300μm之间,直径在1.25mm和300μm之间,直径在1mm和300μm之间,直径在900μm和300μm之间,直径在900μm和400μm之间,例如,直径在850μm左右。使用内径小于2mm的注射器比使用较大直径的注射器具有显著的优势。该特征的一个优点是,使用较窄的注射器的情况下,当样本材料的羽流被引入等离子体时,在质量检测器中检测到的信号的瞬态减小(样本材料的羽流是通过激光烧蚀采样系统从样本中移除的特定的气态材料的云)。因此,从样本材料被引入到icp进行电离直到在质量检测器中检测到生成的离子以分析样本材料羽流所需的时间减少了。分析样本材料羽流所需时间的减少使得在任何给定的时间段内都能检测到更多的样本材料羽流。此外,具有较小内径的注射器导致将样本材料更精确地引入感应耦合等离子体的中心,其中,发生更有效的电离(与更大直径的注射器相反,该注射器可将样本材料更多地引入等离子体的边缘,其中,电离没那么有效)。
271.icp炬(agilent、varian、nu instruments、spectro、leeman labs、perkinelmer、thermo fisher等)和注射器(例如,来自elemental scientific和meinhard)均可购得。
272.其他电离技术
273.电子电离
274.电子电离包括用电子束轰击气相样本。电子电离室包括电子源和电子陷阱。电子束的典型源是铼或钨丝,通常在70电子伏特的能量下工作。用于电子电离的电子束源可从markes international获得。电子束导向电子陷阱,平行于电子行进方向施加的磁场使电子以螺旋路径行进。气相样本被引导通过电子电离室,并与电子束相互作用,以形成离子。电子电离被认为是一种硬电离方法,因为该过程通常会导致样本分子碎裂。商用电子电离系统的示例包括改进型markus电子电离室。
275.基于激光烧蚀的采样和电离系统的可选其他部件
276.离子偏转器
277.质谱仪在离子撞击检测器表面时检测离子。离子与检测器的碰撞导致从检测器表面释放电子。这些电子在通过检测器时会成倍增加(第一释放的电子撞出检测器中更多的电子,然后这些电子撞击二次极板,进一步放大了电子的数量)。撞击检测器正极的电子数量会产生电流。撞击正极的电子数量可以通过改变施加在二次极板上的电压来控制。电流是模拟信号,该模拟信号然后可以通过模数转换器转换成撞击检测器的离子数。当检测器在其线性范围内工作时,电流可以直接与离子数量相关联。一次可检测的离子数量具有极限(可以用每秒可检测的离子数来表示)。在这一点之上,离子撞击检测器释放的电子数量
不再与离子数量相关。因此,这给检测器的定量能力设置了上限。
278.当离子撞击检测器时,其表面会因污染而受损。随着时间的推移,这种不可逆的污染损坏会导致离子撞击检测器时检测器表面释放的电子减少,最终导致检测器需要更换。这被称为“检测器老化”,并且是ms中众所周知的现象。
279.因此,可以通过避免向ms中引入过量的离子,来延长检测器的寿命。如上所述,当撞击ms检测器的离子总数超过检测上限时,信号不如离子数低于上限时提供的信息多,因为它不再是定量的。因此,希望避免超过检测上限,因为这会导致检测器加速老化,而不会产生有用的数据。
280.质谱仪分析大量离子组,涉及常规质谱仪中没有的一组特殊挑战。具体地,典型的ms技术包括将低且恒定水平的材料引入检测器,该材料不会接近检测上限或导致检测器加速老化。另一方面,基于激光烧蚀的技术在ms中的非常短的时间窗口内分析相对大量的材料:例如,来自组织样本的细胞大小的块的离子比ms中通常分析的小离子分组大得多。实际上,这是故意用烧蚀或提升产生的分析离子分组使检测器几乎过载。在分析事件之间,信号处于基线(信号接近于零,因为没有来自标记原子的离子从采样和电离系统故意进入ms;一些离子将不可避免地被检测到,因为ms不是完全真空的)。
281.因此,在本文所述的设备中,存在加速检测器老化的高风险,因为来自标有大量可检测原子的电离样本材料分组的离子可能超过检测上限,并损坏检测器而没有提供有用数据。
282.为了解决这些问题,该设备可以包括位于采样和电离系统与检测器系统(质谱仪)之间的离子偏转器,该离子偏转器可操作以控制离子进入质谱仪。在一种配置中,当离子偏转器接通时,从采样和电离系统接收的离子被偏转(即,离子的路径改变,因此它们不到达检测器),但是当偏转器关闭时,离子不偏转并到达检测器。离子偏转器如何部署将取决于设备的采样和电离系统以及ms的配置。例如,如果离子进入ms所经由的入口不直接与离子离开采样和电离系统的路径在一条直线上,则默认情况下,适当设置的离子偏转器将接通,以便将离子从采样和电离系统引导到ms中。当检测到来自电离样本材料分组(见下文)的离子被认为可能过载ms这样的事件时,离子偏转器关闭,使得事件中剩余的电离材料不会偏转到ms中,而是可以仅撞击系统的内表面,从而保存了ms检测器的寿命。在阻止来自破坏事件的离子进入ms后,离子偏转器返回到其初始状态,从而允许来自随后电离样本材料分组的离子进入ms并被检测。
283.或者,在(正常操作条件下)从采样和电离系统出来的离子在进入ms之前方向没有变化的情况下,离子偏转器将关闭,来自采样和电离系统的离子将通过它,以在ms中进行分析。为了防止检测到检测器的潜在过载时的损坏,在这种配置中,离子偏转器阶梯,从而使离子转向,使它们不进入检测器,以防止对检测器的损坏。
284.从电离的样本材料进入ms的离子(例如,激光烧蚀产生的材料羽流)不会同时进入ms,而是以峰值进入,其频率遵循关于最大频率的概率分布曲线:从基线开始,首先有少量离子进入ms并被检测到,然后离子的频率增加到最大值,然后数量再次减少并缩小到基线。可以识别可能损坏检测器的事件,因为撞击检测器的离子计数快速增加,而不是峰值前沿的离子频率缓慢增加。
285.在分析电离样本材料分组中的离子期间,撞击tof ms检测器(如下所述的特定类
型的检测器)的离子流不是连续的。tof包括脉冲发生器,该脉冲发生器以脉冲组的形式周期性地将离子释放到tof ms的飞行室中。通过同时释放所有已知的离子,飞行时间质量测定得以实现。用于飞行时间质量测定的离子脉冲释放之间的时间被称为tof ms的提取或推送(push)。推送在微秒量级。因此,来自采样和电离系统的一个或多个离子分组的信号覆盖了许多推动。
286.因此,当离子计数读数在一次推动内从基线跳跃到非常高的计数(即来自特定电离样本材料分组的离子的第一部分)时,可以预测由电离样本材料分组产生的离子主体将更大,因此超过检测上限。在这一点上,可以操作离子偏转器,以确保破坏性的大量离子被引导远离检测器(通过被激活或停用,取决于系统的配置,如上所述)。
287.基于四极的合适的离子偏转器在本领域中是可获得的(例如,来自colutron research corporation和dreebit gmbh)。
288.本发明的基于激光烧蚀的采样系统
289.基于激光烧蚀的采样系统的部件可以根据正在进行的分析任务进行适当的组合。下面阐述了示例性实施例。
290.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
291.样本台;
292.激光源;
293.激光扫描系统;以及
294.包括物镜的聚焦光学器件,其中,物镜具有至少0.7、至少0.8或至少0.9的数值孔径,可选地还包括物镜和样本台之间的浸没介质。
295.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
296.样本台;
297.激光源,其包括飞秒激光器;
298.激光扫描系统;以及
299.包括物镜的聚焦光学器件,其中,物镜具有至少0.7、至少0.8或至少0.9的数值孔径,可选地还包括物镜和样本台之间的浸没介质。
300.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
301.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
302.激光源;
303.激光扫描系统;以及
304.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束朝向第二面引导向样本台上的位置;并且其中,物镜具有至少0.7、至少0.8或至少0.9的数值孔径,可选地还包括物镜和样本台之间的浸没介质。
305.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
306.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
307.激光源,其包括飞秒激光器;
308.激光扫描系统;以及
309.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束朝向第二面引导向样本台上的位置;并且其中,物镜具有至少0.7、至少0.8或至少0.9的数值孔径,可选地还包括物镜和样本台之间的浸没介质。
310.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
311.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
312.激光源;以及
313.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束朝向第二面引导向样本台上的位置;并且其中,物镜具有至少0.7、至少0.8或至少0.9的数值孔径,可选地还包括物镜和样本台之间的浸没介质。
314.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
315.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
316.激光源,其包括飞秒激光器;以及
317.包括物镜的聚焦光学器件,该聚焦光学器件适于将来自激光源的辐射束朝向第二面引导向样本台上的位置;并且其中,物镜具有至少0.7、至少0.8或至少0.9的数值孔径,可选地还包括物镜和样本台之间的浸没介质。
318.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
319.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
320.激光源;
321.激光扫描系统;以及
322.包括物镜的聚焦光学器件,可选地还包括物镜和样本台之间的浸没介质。
323.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
324.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
325.激光源,其包括飞秒激光器;
326.激光扫描系统;以及
327.包括物镜的聚焦光学器件,可选地还包括物镜和样本台之间的浸没介质。
328.在一些实施例中,用于分析样本(例如,生物样本)的基于激光烧蚀的采样系统包括:
329.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
330.激光源,其包括飞秒激光器;以及
331.包括物镜的聚焦光学器件,可选地还包括物镜和样本台之间的浸没介质。
332.上述基于激光烧蚀的采样系统中的每一个都适于包含在本发明的用于分析样本的设备中,该设备包括质量检测器(例如,tof)质量检测器,特别是包括icp电离系统。
333.b.基于溅射的采样和电离系统
334.基于溅射的采样系统和技术提供了上述基于激光烧蚀的系统和技术的替代的表面分析技术。一种这样的溅射技术是二次离子质谱(sims)。sims包括用聚焦离子束轰击样本,从样本中溅射材料。溅射材料包括离子和中性原子。在sims中,离子被浸没透镜捕获后,被传送到真空中的质量检测器。质量检测器可以是下面描述的任何质量检测器系统。类似的溅射可以通过在样本上引导其他带电粒子来实现,例如,电子。
335.sims是一种有用的表面分析技术,有几个原因。首先,该技术对低浓度的分析物质非常敏感。其次,由于一次离子的衍射效应在大多数实际条件下可以忽略,所以在sims中几乎没有衍射极限。因此,sims有潜力分析10至30nm尺度的材料。
336.然而,溅射材料的电离效率非常低,并且电离也非常依赖于被电离的表面化学性质和特定元素,因此,由sims产生的离子数量并不总是足以提供足够的信噪比。例如,电离效率不足以检测用maxpar试剂标记的抗体的单一拷贝(copy,副本)。由于用maxpar质量标签标记的单个抗体携带大约100个原子,在传统的sims工作流程中,可能需要大约100个抗体拷贝来在检测器上产生大于几个离子的信号。sims的另一缺陷是由于来自相同质量通道中的分子的光谱干扰以及由于化合物离子的形成,例如,氧化物和涉及主要标记元素和生物样本中存在的大量中性原子的其他物种。化合物离子消弱了元素离子的信号,并导致与更高质量元素的质量通道重叠。因此,使用sims成像的分辨率可能受到检测灵敏度低的限制,部分原因是电离效率低。
337.本发明通过提供使用基于激光的二次中性质谱(snms)分析生物样本的改进方法和设备,克服了sims的局限性。
338.本发明的激光
‑
snms方法和设备包括用聚焦的带电粒子束轰击样本,以从样本溅射材料。使用激光对中性溅射材料进行后电离。这些喷射的离子(包括如下所述的来自标记原子的任何可检测的离子)可以由检测器系统检测,例如,质谱仪(检测器将在下面更详细地讨论)。由于大多数溅射材料处于中性状态,并且snms电离溅射材料,使得可以使用质量检测器对其进行分析,所以snms提供了比sims更好的表面定量估计。此外,如上所述,提高传统ims和imc的空间分辨率的一个主要挑战是确保所分析的材料中的分析物的量提供足够的信噪比。因此,由于snms同时使用中性和电离溅射材料,与基于sims的ims和imc相比,基于snms的ims和imc提供了更高的分辨率。例如,snms可以用标记有maxpar试剂的抗体进行单个拷贝检测。例如,如果后离子化的效率达到10%,则每个抗体的100个原子将导致每个抗体产生10个离子,并且如果这些离子以良好的效率被传送到检测器,这将确保每个抗体拷贝的可靠检测。
339.激光snms系统通常包括三个部件。第一部件是带电粒子源,用于从样本中溅射材料,以进行分析(这种带电粒子源将在下面详细讨论)。第二部件是用于后电离溅射材料的
激光器。第三部件是检测电离材料的检测器部件,例如,质量检测器。在激光snms中,激光器和带电粒子源通常是脉冲的。在相关的系统中,第一部件是指向样本上的某一位置的带电粒子源(该带电粒子源将在下面更详细地讨论)。第二部件是激光器,用于使已经由带电粒子预种植了电子的轨迹被烧蚀和可选的电离。第三部件是检测电离材料的检测器部件,例如,质量检测器。在某些方面,撞击样本的带电粒子的光斑尺寸小于激光的光斑尺寸。带电粒子可以在该位置烧蚀样本,之后激光可以在样本表面附近电离样本(例如,如图6所示)。带电粒子可以在样本的位置种植电子,之后激光可以烧蚀和电离种植有电子的样本(例如,如图7所示)。激光可以在带电粒子撞击样本的皮秒(例如,10
‑
100ps)内(例如,在电荷点燃状态内)电离样本。在某些方面,撞击样本的带电粒子的光斑尺寸小于激光的光斑尺寸,例如,小于激光光斑尺寸的一半、小于五分之一、小于十分之一、小于二十分之一或小于百分之一。例如,激光可以具有小于10微米和/或大于500纳米的光斑尺寸(照射样本),例如,在500纳米和5微米之间,在800nm和2微米之间,或大约1微米。带电粒子可提供小的光斑尺寸(例如,在本文所述的范围内),以允许在激光辐射下中和最小的电离,例如,光斑尺寸的直径小于200nm、小于100nm、小于50nm、小于30nm或小于10nm。
340.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
341.样本台;
342.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
343.第一激光源和第一聚焦光学器件,第一聚焦光学器件被配置为将由第一激光源发射的激光束引导向样本台。
344.该设备通常包括质量检测器,例如,tof检测器。
345.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
346.样本台;
347.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
348.第一激光源和第一聚焦光学器件,第一聚焦光学器件被配置为将由第一激光源发射的激光束引导向样本台。
349.本发明的带电粒子柱包括适当的离子光学器件,其被配置成聚焦带电粒子,以便将光束传送到样本台上的位置。这种合适的离子光学器件可以包括质量过滤器、透镜和孔以及偏转板,以便成形一次离子束,如下面更详细描述的。
350.图6是本发明的示例性实施例的配置的示意图。能量源40发射辐射(例如,激光束、一次离子束或电子束,如下文进一步讨论的),该辐射通过光学器件80(例如,光学器件或离子光学器件,例如,带电粒子柱)传送到样本台20上的位置55。样本30定位在样本台20上,使得带电粒子被传送至位置55以从样本30溅射材料50。第一激光源60发射激光束,聚焦光学器件(未示出)将激光束引导向样本台,以电离溅射材料50,形成包含样本离子的材料羽流。然后,离子可以被传送到质量检测器,例如,飞行时间检测器或磁扇形检测器或下面更详细讨论的任何其他质量检测器。
351.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备或采样和电离系统,其中,第一聚焦光学器件被配置为同步激光束脉冲,以电离由带电粒子脉冲溅射的材料羽流(本文称为后电离)。
352.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
353.样本台;
354.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;
355.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以电离由来自带电粒子源的带电粒子脉冲溅射的材料羽流。
356.具体地,第一聚焦光学器件将激光束引导并聚焦到样本台表面上方的体积,使得当材料从样本台上的样本溅射时,从样本喷射出的材料羽流进入第一激光源的辐射聚焦到的体积,使得材料可以被电离。这种解释适用于本节下面讨论的所有设备,这些设备使用样本台、带电粒子源、第一激光源和电离羽流的第一聚焦光学器件的特征的组合。为了简洁起见,下面不再重复。
357.该设备通常包括质量检测器,例如,tof检测器。
358.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
359.样本台;
360.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
361.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以电离由来自带电粒子源的带电粒子脉冲溅射的材料羽流。
362.如上所述,第一聚焦光学器件将激光束引导并聚焦到样本台上的位置上方的体积(更具体地,样本台上的样本上的位置上方),使得当材料从样本台上的样本溅射时,从样本喷射出的材料羽流进入第一激光源的辐射聚焦到的体积中,使得材料可以被电离。本说明适用于本节以下讨论的所有系统,这些系统使用样本台、带电粒子源、第一激光源和电离羽流的第一聚焦光学器件的特征的组合。为了简洁起见,下面不再重复。
363.图7是本发明另一示例性实施例的配置的示意图。图7包括与图6共同的元件,并且这些元件共享相同的附图标记。然而,在图7所示的实施例的设备中,来自第一激光源60的激光束被引导向样本台20上的位置55,光学器件80(例如,带电粒子柱)将带电粒子引导向该位置。例如,朝向样本上的位置55传送的带电粒子脉冲与样本上的位置55处的自由电子形成激发态;这种激发态在本文被称为“样本点燃状态(ignition state)”。在带电粒子脉冲到达该位置之后,来自第一激光源的激光束直接照射样本上的该位置55,使得第一激光源照射处于点燃状态的样本。由于样本处于样本点燃状态,样本很容易将来自激光束的激光脉冲转化为烧蚀和电离能量;这种状态在本文被称为“样本能量泵送状态”。这个过程形成了包含样本离子的材料羽流。本领域技术人员将理解,在该实施例中,激光脉冲的能量小于样本的烧蚀阈值(使得邻近带电粒子被引导向的位置的相同区域不会响应于导致该位置进入“样本能量泵浦状态”的激光脉冲而烧蚀,尽管样本上的激光光斑可以大于带电粒子被引导向的位置的直径)。
364.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子脉冲之后立即到达样本台上的位置。本发明的这种配置可以克服仅通过带电粒子束的相对较慢的粒子溅射,因此提供了分析生物
样本的更快方法。
365.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
366.样本台;
367.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
368.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后立即到达样本台上的位置。
369.具体地,第一聚焦光学器件将激光束/激光辐射引导并聚焦到样本台上样本上的先前被带电粒子瞄准的相同位置。这种解释适用于本节下面讨论的所有设备,这些设备使用样本台、带电粒子源和第一激光源以及第一聚焦光学器件的特征的组合,使得来自第一激光源的辐射脉冲照射与带电粒子先前瞄准的位置相同的位置。为了简洁起见,下面不再重复。
370.该设备通常包括质量检测器,例如,tof检测器。
371.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
372.样本台;
373.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
374.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置。
375.具体地,第一聚焦光学器件将激光束/激光辐射引导并聚焦到样本台上的样本上的先前被带电粒子瞄准的相同位置。这种解释适用于本节下面讨论的所有系统,这些系统使用样本台、带电粒子源和第一激光源以及第一聚焦光学器件的特征的组合,该组合使得来自第一激光源的辐射脉冲照射与带电粒子先前瞄准的位置相同的位置。为了简洁起见,下面不再重复。图8是本发明另一示例性实施例的配置的示意图。图8包括与图6和7共同的元件,并且这些元件共享相同的附图标记。在该实施例中,样本台20是透明的(样本放置在其上的任何样本载体也是透明的)。本领域技术人员将理解,透明样本台或包括切除部分的样本台可以与本文所述的基于溅射的采样和电离系统的任何实施例一起使用。在本文更详细地描述透明样本台。
376.在图8所示的实施例中,带电粒子源和带电粒子柱、第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的相反侧。在图8所示的实施例中,带电粒子朝向样本上的位置55传送,激光束也被导向样本上的位置55。以与图7所示的实施例相同的方式,在图8的实施例中,带电粒子的脉冲束提供样本点燃状态,并且脉冲激光束提供能量泵浦状态,以产生包括样本离子的材料羽流。
377.图9是本发明另一示例性实施例的配置的示意图。图9包括与图6至图8共同的元件,并且这些元件共享相同的附图标记。类似于图8所示的实施例,在本发明的该实施例中,带电粒子源和带电粒子柱、第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的相反侧。样本30定位在样本台20上,使得带电粒子朝向位置55传送以从样本30溅射材料50。第一激光源60发射激光束,聚焦光学器件(未示出)将激光束引导
向样本台,以电离溅射材料50,形成包含样本离子的材料羽流。然后,离子可以被传送到质量检测器,例如,飞行时间检测器或者下面更详细讨论的任何其他质量检测器。
378.值得注意的是,在上述任一实施例中,带电粒子束可以在样本上扫描,以分析任意感兴趣区域,例如,细胞器,如前所述。
379.因此,本发明提供了一种设备,其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的相同侧。这种类型的设备的示例如图6和图7所示。
380.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
381.样本台;
382.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
383.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;并且
384.其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的同一侧。
385.该设备通常包括质量检测器,例如,tof检测器。
386.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
387.样本台;
388.带电粒子源和带电粒子柱,带电粒子柱用于将带电粒子束传送到样本台上的位置;以及
389.第一激光源和第一聚焦光学器件,第一聚焦光学器件被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;并且
390.其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的同一侧。
391.例如,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
392.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
393.带电粒子源和带电粒子柱,带电粒子柱用于将带电粒子束传送到样本台的第一面上的位置;以及
394.第一激光源和第一聚焦光学器件,第一聚焦光学器件被配置为将由第一激光源发射的激光束引导向样本台的第一面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置。
395.该设备通常包括质量检测器,例如,tof检测器。
396.例如,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
397.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
398.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;以及
399.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第一面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置。
400.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
401.样本台;
402.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
403.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以电离由来自带电粒子源的带电粒子脉冲溅射的材料羽流;并且
404.其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的同一侧。
405.该设备通常包括质量检测器,例如,tof检测器。
406.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
407.样本台;
408.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
409.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以电离由来自带电粒子源的带电粒子脉冲溅射的材料羽流;并且
410.其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的同一侧。
411.例如,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
412.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
413.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;以及
414.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第一面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以将由来自带电粒子源的带电粒子脉冲从样本溅射的材料羽流电离。
415.该设备通常包括质量检测器,例如,tof检测器。
416.例如,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
417.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
418.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;以及
419.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导
向样本台的第一面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以将由来自带电粒子源的带电粒子脉冲从样本溅射的材料羽流电离。
420.此外,本发明提供了一种设备,其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的相反侧。这种类型的设备的示例如图8和图9所示。这类设备的一个优点在于,它们最小化了组合带电粒子柱和聚焦光学器件的机械复杂性。在某些方面,带电粒子可透过对带电粒子至少部分透明的支撑件或基板而被引导向样本,并烧蚀样本或在样本中的种植电子。在这些方面,样本可以是薄的,例如,小于200nm、小于100nm、小于50nm或小于30nm。
421.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
422.样本台;
423.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
424.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;并且
425.其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的相反侧。
426.该设备通常包括质量检测器,例如,tof检测器。
427.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
428.样本台;
429.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;以及
430.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;并且
431.其中,带电粒子源和带电粒子柱以及第一激光源和第一聚焦光学器件被配置为使得带电粒子束和激光束被引导向样本台的相反侧。
432.例如,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
433.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
434.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;以及
435.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第二面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置。
436.该设备通常包括质量检测器,例如,tof检测器。
437.例如,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
438.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
439.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;以及
440.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第二面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置。
441.如本文其他地方所解释的,并且为了完整起见在此重申,当激光束通过样本台而到达第一面上的样本时,该样本台应当对激光辐射是透明的(样本的样本载体也是如此),或者样本台应该包括空隙,激光辐射可以通过该空隙到达样本(通过样本载体)
442.技术人员也将理解,图6至图9的配置可以以各种方式组合。图10示出了本发明的另一示例性实施例,该实施例是图6至图9的配置的组合,同样,与图6至图9相同的元件用相同的附图标记来标记。
443.图10所示的实施例包括第二激光源61和第二聚焦光学器件(未示出)。类似于图8的第一激光源60和第二聚焦光学器件,该实施例的第二激光源61和第二聚焦光学器件被配置为将第二激光束引导向样本台上的位置55。以与图7和图8所示的实施例相同的方式,带电粒子的脉冲束提供样本点燃状态,来自第二激光源61的脉冲激光束提供能量泵送状态,以产生包含样本离子的材料羽流。在本发明的这个实施例中,第一激光源60和第一聚焦光学器件被配置为电离由带电粒子脉冲溅射的材料羽流。因此,第一激光源60将电离从表面溅射的任何未被能量泵送状态电离的中性材料。因此,由于第一和第二激光源都被配置为电离材料羽流,以产生样本离子,所以本发明提供了一种进一步提高电离概率并因此提高信噪比的设备。因此,本发明提供了一种以提高的分辨率分析样本的设备。
444.因此,在该部分中,本发明提供了一种如上所述的设备,该设备包括第二激光源和第二聚焦光学器件,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光脉冲,以电离由带电粒子脉冲溅射的材料羽流。在某些方面,第一和第二激光源可以包括相同的激光器,其中,激光器和/或光学器件的控制允许本文描述的两步激光辐射。
445.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
446.样本台;
447.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;
448.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;以及
449.第二激光源和第二聚焦光学器件,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自样本上的位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生。
450.该设备通常包括质量检测器,例如,tof检测器。
451.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
452.样本台;
453.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;
454.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导
向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以电离由来自带电粒子源的带电粒子脉冲溅射的材料羽流;以及
455.第二激光源和第二聚焦光学器件,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自该位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生。
456.因此,本发明提供了一种设备,其中,第一激光源和第一聚焦光学器件以及第二激光源和第二聚焦光学器件被配置为使得来自第一激光源的激光束和来自第二激光源的激光束被引导向样本台的同一侧。
457.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
458.样本台;
459.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;
460.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;以及
461.第二激光源和第二聚焦光学器件,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自样本上的位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生,
462.其中,带电粒子源和带电粒子柱、第一激光源和第一聚焦光学器件、以及第二激光源和第二聚焦光学器件被配置为使得带电粒子束、来自第一激光源的激光束和来自第二激光源的激光束被引导向样本台的同一侧。
463.该设备通常包括质量检测器,例如,tof检测器。
464.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
465.样本台;
466.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;
467.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;以及
468.第二激光源和第二聚焦光学器件,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自样本上的位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生,
469.其中,带电粒子源和带电粒子柱、第一激光源和第一聚焦光学器件、以及第二激光源和第二聚焦光学器件被配置为使得带电粒子束、来自第一激光源的激光束和来自第二激光源的激光束被引导向样本台的同一侧。
470.例如,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
471.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
472.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;
473.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导
向样本台的第一面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子脉冲之后激光束脉冲立即到达样本台的第一面上的位置;以及
474.第二激光源和第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自样本上的位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生。
475.该设备通常包括质量检测器,例如,tof检测器。
476.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
477.样本台,包括第一面和第二面,第一面和第二面相反,并且其中,第一面适于容纳样本;
478.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;
479.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第一面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子脉冲之后立即到达样本台的第一面上的位置;以及
480.第二激光源和第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自样本上的位置的样本材料的羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生。
481.因此,本发明提供了一种设备,其中,第一激光源和第一聚焦光学器件以及第二激光源和第二聚焦光学器件被配置为使得来自第一激光源的激光束和来自第二激光源的激光束被引导向样本台的相反侧。
482.因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
483.样本台;
484.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;
485.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后立即到达样本台上的位置;以及
486.第二激光源和第二聚焦光学器件,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自样本上的位置的样本材料的羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生,
487.其中,所述带电粒子源和带电粒子柱以及所述第二激光源和第二聚焦光学器件被配置为使得带电粒子束和来自所述第二激光源的激光束被引导向所述样本台的同一侧;并且第一激光源和第一聚焦光学器件被配置为使得来自第一激光源的激光束被引导向样本台的相对侧。
488.该设备通常包括质量检测器,例如,tof检测器。
489.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
490.样本台;
491.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台上的位置;
492.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子的脉冲之后激光束脉冲立即到达样本台上的位置;以及
493.第二激光源和第二聚焦光学器件,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自样本上的位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生,
494.其中,所述带电粒子源和带电粒子柱以及所述第二激光源和第二聚焦光学器件被配置为使得带电粒子束和来自所述第二激光源的激光束被引导向所述样本台的同一侧;并且第一激光源和第一聚焦光学器件被配置为使得来自第一激光源的激光束被引导向样本台的相对侧。
495.例如,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
496.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
497.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;
498.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第二面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子脉冲之后立即到达样本台的第一面上的位置;以及
499.第二激光源和第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自该位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生。
500.该设备通常包括质量检测器,例如,tof检测器。
501.因此,本发明提供了一种用于分析样本(例如,生物样本)的采样和电离系统,包括:
502.样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
503.带电粒子源和带电粒子柱,用于将带电粒子束传送到样本台的第一面上的位置;
504.第一激光源和第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第二面,其中,第一聚焦光学器件被配置为同步激光束脉冲,以在带电粒子脉冲之后立即到达样本台的第一面上的位置;以及
505.第二激光源和第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光束脉冲,以电离来自该位置的样本材料羽流,该羽流由带电粒子脉冲和来自第一激光源的激光束脉冲产生。
506.本发明还提供了使用本部分中描述的设备分析生物样本的方法。例如,本发明提供了一种方法,包括:
507.将带电粒子束传送到样本上的一位置;
508.用第一激光束脉冲照射样本,以产生包含样本离子的材料羽流;并且
509.通过质谱法法检测所述样本离子。
510.在一些情况下,该方法包括使带电粒子束朝向样本上的位置传送,以从样本溅射材料;并且其中,该方法包括用第一激光束脉冲照射溅射的样本材料,并且电离溅射的材料,以产生样本离子。即,该方法包括使带电粒子束朝向样本上的位置传送,以从样本溅射材料;并且其中,该方法包括用第一激光束脉冲照射溅射的样本材料,从而电离溅射的材料,以产生样本离子。有时,将带电粒子束传送向样本上的某个位置产生样本点燃状态;并且其中,在该位置照射样本将在样本的该位置产生样本能量泵送状态。
511.在一些方法中,带电粒子束从样本的一侧朝向样本上的位置传送,并且其中,第一激光束脉冲从样本的同一侧照射样本。在一些实施例中,带电粒子束从样本的一侧朝向样本上的位置传送,并且其中,第一激光束脉冲从样本的相对侧照射样本。有时,将带电粒子束传送到样本上的位置还包括从样本溅射材料;并且其中,该方法包括用第二激光束脉冲照射溅射的样本材料并电离溅射的材料。
512.第一激光束脉冲和第二激光束脉冲从样本的同一侧照射样本,或者第一激光束脉冲和第二激光束脉冲从样本的相对(相反)侧照射样本。
513.如本领域技术人员所知,溅射材料的激光电离可以通过各种电离机制实现,包括单光子电离、谐振和非谐振多光子电离、雪崩电离和冷雪崩电离。此外,不同的电离机制可以同时工作,例如,多光子电离和雪崩电离。
514.单光子电离(spi)是指一个光子的吸收足以克服溅射材料的电离势的过程。然而,通过这种方式的电离需要非常高能量的紫外或真空紫外激光器,例如,准分子激光器或者在气体中采用非线性光学过程的复杂系统。因此,本发明提供了方法和设备,其中,第一和/或第二激光源是高能紫外或真空紫外激光器。
515.多光子电离(mpi)包括吸收多于一个的光子,以克服电离势,这种吸收可以是非谐振或谐振的步骤。多光子电离需要短而强的激光脉冲。适用于谐振系统的激光器包括泵浦两种染料激光器的脉冲nd:yag激光器,适用于非谐振激光系统的激光器包括高功率准分子或nd:yag激光器。因此,本发明提供了方法和设备,其中,第一和/或第二激光源是泵浦两个染料激光器的nd:yag激光器、高功率准分子激光器或nd:yag激光器。
516.雪崩电离(ai)是电子碰撞并电离溅射材料的过程,导致额外的电子加速并与其他溅射材料碰撞,从而产生连锁反应。在本发明中,初始“种子”电子可以是任何这种电离机制的结果,该电离机制是由激光脉冲的应用产生的,例如,多光子电离或单光子电离。一些模型暗示,当激光脉冲短于100fs时,雪崩电离并不重要。然而,已经证明了在短于100fs的激光脉冲下雪崩电离持续存在的各种技术。本发明提供了利用这些技术的方法,以便通过使用短于100fs的激光脉冲的雪崩电离来电离溅射材料。
517.在第一种技术中,由强电离激光施加在样本上的电场用于降低碰撞电离发生的有效能量阈值,因此即使在短脉冲长度(小于100fs)下也允许碰撞电离驱动雪崩电离。这是一种冷雪崩电离机制。合适的激光器可以是例如ti:蓝宝石激光器(800nm,40
‑
45fs脉冲长度,能量75nj,例如,octavius ti:蓝宝石激光器,可从thorlabs获得),并且已经表明熔融石英的雪崩电离可以用来自再生放大器的低至40fs的800nm激光脉冲来实现(rajeev、gertsvolf等人,2009,prl201)。因此,本发明提供了方法和设备,其中,第一和/或第二激光源是ti:蓝宝石激光器,用于通过雪崩电离来电离溅射的材料。在某些方面,等离子体发展
(例如,雪崩电离)之后的点燃(例如,电子种植)机制对于电介质和生物样本可能是相似的。在生物样本的情况下,样本形式可以是环氧树脂,该树脂是电介质,但不同于氧化硅。
518.在第二种技术中,将自由载流子注入样本中,以鼓励激子引发的多光子电离和雪崩电离的结合。自由载流子可以从高次谐波或阿托秒脉冲发生器产生的极紫外光源注入电介质,样本可以用短至45fs(800nm激光器)的激光脉冲电离(grojo、gertsvolf等人,2010,pr81)。因此,本发明提供了方法和设备,其中,第一和/或第二激光源是极紫外光源。
519.因此,本发明提供了方法和设备,其中,第一和/或第二激光器被配置为通过雪崩电离来电离溅射的材料。
520.这样,本发明进一步解决了将imc分辨率提高到亚微米尺度的两个主要挑战。首先,因为短于100fs的激光脉冲可以用来实现雪崩电离,所以激光光斑尺寸周围的区域由于热效应而被损坏的风险降低了。通过这种方式,本发明将光斑面积保持在大约200nm以下的尺寸。其次,本发明提高了多光子和雪崩电离的可能性,因此提高了总电离率。通过这种方式,烧蚀材料中分析物的总量提供了足够的信噪比。
521.基于溅射的采样和电离系统的部件
522.带电粒子源
523.如上所述,在本发明中,带电粒子源和带电粒子柱可用于将带电粒子束传送到样本上的位置。
524.一次离子束:
525.通常,二次中性质谱中使用的带电粒子源是一次离子束源。一次离子可以是用于从待分析的样本中产生溅射的任何合适的离子。一次离子源的示例有:双等离子体管,其产生氧((
16
o
‑
,
16
o
2
,
16
o2‑
),氩(
40
ar
),氙(xe
),sf
5
或c
60
一次离子;表面电离源,其产生
133
cs
一次离子;以及液态金属离子枪(lmig),其产生ga
一次离子。其他一次离子包括团簇离子,例如,au
n
(n=1
‑
5)、bi
nq
(n=1
‑
7、q=1和12)、c
60q
探针(q=1
‑
3)和大型氩团簇(muramoto、brison&castner,2012)。
526.离子源的选择取决于所使用的离子轰击类型(即静态或动态)和待分析的样本。静态包括使用低一次离子束电流(1na/cm2),通常是脉冲离子束。由于低电流,每个离子都会撞击样本表面的新部分,仅去除单层粒子(2nm)。因此,静态适用于成像和表面分析(gamble&anderton,2016)。动态包括使用高一次离子束电流(10ma/cm2),通常是连续的一次离子束,这导致快速去除表面粒子。因此,可以使用动态深度剖面。此外,由于从样本表面去除了更多的材料,所以动态sims比静态给出了更好的检测极限。动态通常会产生高图像分辨率(小于100nm)(vickerman&briggs,2013)。
527.氧一次离子增强了正电性元素的电离作用(malherbe,penen,isaure&frank,2016年),并用于商业上可获得的cameca ims 1280
‑
hr中,而铯一次离子用于研究负电性元素(kiss,2012),并用于商业上可获得的cameca nanosims 50。
528.为了快速分析样本,需要高频率的溅射,例如,超过200hz(即每秒钟有超过200个离子分组引导向样本)。通常,一次离子源产生一次离子脉冲的频率至少为400hz,例如,至少500hz或至少1khz。例如,在一些实施例中,离子脉冲的频率为至少10khz、至少100khz、至少1mhz或至少10mhz。例如,离子脉冲的频率在400
‑
100mhz范围内,在1khz
‑
100mhz范围内,在10khz
‑
100mhz范围内,在100khz
‑
100mhz范围内或在1mhz
‑
100mhz范围内。
529.因此,本发明提供了一种设备,其中,带电粒子源是一次离子束。
530.电子束
531.或者,在本发明的一些实施例中,带电粒子源是电子束。能量为2kv至30kv的电子束可能特别适合于查询(interrogate)厚度为30nm的样本。
532.高强度脉冲电子束用于引起烧蚀/溅射。当电子电流的脉冲不足以烧蚀时,其效果可仅用作如上所述的点燃事件,随后通过激光脉冲进行能量泵送,该激光脉冲的亮度水平被设置在低于天然材料的烧蚀水平但高于烧蚀已经活化的材料所需的能量泵送水平。在烧蚀/溅射的能量激活模式中,电子能量可以降低,因为电子仅用于将电荷载流子注入其他绝缘材料中。
533.在某些方面,电子束可以聚焦在比激光束更小的斑点(以更高的分辨率)。较低分辨率的激光器只能烧蚀和/或点燃电子束辐射的光斑处的样本,即使当它撞击电子束光斑以外的样本时也是如此。例如,电子束可以聚焦到200nm、100nm、50nm、30nm或10nm以下的光斑,激光可以聚焦到与电子束光斑重叠的200nm、300nm、500nm、800nm、1um、2um或更大的光斑,或者聚焦到由电子束释放的烧蚀羽流上。
534.为了快速分析样本,需要高频率的溅射,例如,超过200hz(即每秒钟有超过200电子分组引导向样本)。通常,电子源产生电子脉冲的频率至少为400hz,例如,至少500hz,或至少1khz。例如,在一些实施例中,电子脉冲的频率为至少10khz、至少100khz、至少1mhz或至少10mhz。例如,电子脉冲的频率在400
‑
100mhz范围内,在1khz
‑
100mhz范围内,在10khz
‑
100mhz范围内,在100khz
‑
100mhz范围内或在1mhz
‑
100mhz范围内。
535.将电子束用于带电粒子源的一个优点是,整个仪器可以建立在包含电子显微镜的平台上。因此,本发明提供了一种还包括电子显微镜的设备。因此,本发明提供了一种设备,其中,带电粒子源是电子束,其中,电子束是电子显微镜中的电子源。
536.带电粒子柱
537.带电粒子柱将带电粒子引导向样本。带电粒子柱包括:质量过滤器,用于过滤带电粒子束中的杂质;透镜和孔径,以便根据需要适当地控制一次离子束的强度和形状;以及偏转板,以便使一次离子束成形,并可选地使带电粒子束在样本表面上进行光栅化扫描(villacob,2016)。用于构建带电粒子柱的离子透镜和其他部件可从市场上买到,例如,agilent。因此,本发明的带电粒子柱可以提供一种带电粒子束扫描系统,该系统适于在样本台上的多个位置上扫描带电粒子束。
538.通常,本文用于二次离子产生的带电粒子束具有100μm以下的光斑尺寸(即,当带电粒子束撞击样本时带电粒子束的尺寸),例如,20μm以下、5μm以下、1μm以下、或500nm以下、或300nm以下、200nm以下、100nm以下、50nm以下、或30nm以下。被称为光斑尺寸的距离对应于离子束的最长内部尺寸,例如,圆形束是直径为2μm的光束,正方形束对应于相对的角之间的对角线长度,四边形是最长对角线的长度,等等。可以采用光束成形和光束掩蔽来提供光斑形状和尺寸。
539.当用于分析生物样本时,为了分析各个细胞,所用离子束的光斑大小将取决于细胞的大小和间距。例如,在细胞彼此紧密堆积的情况下(例如,在组织切片中),如果要进行单细胞分析,带电粒子束可以具有不大于这些细胞的光斑尺寸。该尺寸将取决于样本中的特定细胞,但通常离子束光斑的直径将小于4μm,例如,在0.1
‑
4μm、0.25
‑
3μm或0.4
‑
2μm的范
围内。因此,带电粒子束光斑可具有约3μm以下、约2μm以下、约1μm以下、约0.5μm或小于0.5μm、例如约400nm以下、约300nm以下的直径。在特定实施例中,光斑尺寸约为200nm以下,约为100nm或小于100nm。为了以亚细胞分辨率分析细胞,该系统使用不大于这些细胞的一次离子束光斑尺寸,更具体地,使用能够以亚细胞分辨率烧蚀材料的一次离子束光斑尺寸。有时,单细胞分析可以使用大于细胞大小的光斑尺寸进行,例如,细胞在载玻片上散开,细胞之间留有空间。因此,可以根据被分析细胞的尺寸来适当选择所使用的特定光斑大小。在生物样本中,细胞很少都是相同的尺寸,因此如果需要亚细胞分辨率成像,如果在整个溅射过程中保持恒定的光斑尺寸,则离子束光斑尺寸应该小于最小的细胞。
540.激光器
541.在本发明中,激光器可以用于烧蚀材料,或者通过在带电粒子脉冲已经朝向样本上的位置传送之后照射该位置来辅助材料的溅射(参见例如图7和图8以及相关描述)。此外,激光器可用于电离先前由带电粒子束溅射的溅射材料(例如,参见图6和图9及相关描述)。此外,激光器可以用于上述的组合,例如,参见图10和相关描述。
542.如本领域技术人员所理解的,对用于烧蚀/辅助材料溅射的激光器的要求不同于对用于电离材料的激光器的要求。通常,用于辅助材料溅射或烧蚀的激光器对于300至400fs或更大的脉冲长度提供μj量级的能量。相比之下,用于电离溅射材料的激光器的功率更大,对于短于100fs的脉冲长度,提供1mj或更大量级的能量。本发明的设备可以将不同的激光器用于第一和第二激光源,或者可以将一个激光器于第一和第二激光源,并且使用分束器来分离激光并提供第一和第二激光源。
543.各种不同的激光器可以用于snms,包括上面讨论的与激光烧蚀采样系统的激光器相关的商用激光器,其适于根据需要能够溅射材料。通常,激光器以最大可达到的强度工作,以便最大化电离。下面描述可用于本发明的各种类型的激光器。如上所述的飞秒激光器在特定的snms应用中也是有利的。例如,在上述包括第一和第二激光源的本发明的实施例中,单个飞秒激光器可以用于提供两个激光源。该激光器的重复频率为1mhz,脉冲宽度为200fs,能量脉冲为1微焦耳。本领域技术人员将会理解,分束器可以用于分离激光器的激光束,以提供要求保护的发明的第一和第二激光源。
544.一般来说,可用于电离的激光器包括每脉冲提供几微焦耳量度的能量的激光器,但它们能产生高频率的脉冲。激光器用于从样本材料中产生元素离子。然后,所产生的元素离子可以由设备中的质谱仪进行分析。激光器可以是皮秒激光器或飞秒激光器或纳秒激光器。在一些实施例中,激光器是飞秒激光器。
545.飞秒激光器可以是固态激光器。无源锁模固态体激光器可以发射高质量的超短脉冲,典型持续时间在30fs至30ps之间。这种激光器的示例包括二极管泵浦激光器,例如,基于掺钕或掺镱晶体的激光器。钛
‑
蓝宝石激光器可用于10fs以下的脉冲持续时间,在极端情况下可低至约5fs(例如,octavius ti:蓝宝石激光器,可从thorlabs获得)。在大多数情况下,脉冲重复频率在1khz和500mhz之间。
546.飞秒激光器可以是光纤激光器。也可以是无源锁模的各种类型的超快光纤激光器通常提供50到500fs之间的脉冲持续时间、0.10到100mhz之间的重复频率以及几毫瓦到几瓦之间的平均功率(飞秒光纤激光器可从toptica、imra america、coherent公司购得)。
547.飞秒激光器可以是半导体激光器。一些锁模二极管激光器可以产生持续时间为飞
秒的脉冲。直接在激光器输出端,脉冲持续时间通常至少为几百飞秒,但通过外部脉冲压缩,可以实现更短的脉冲持续时间。
548.在一些实施例中,激光器是纳秒激光器。纳秒激光器可以是泵浦激光器,例如,quantel的q
‑
smart dpss、solar laser lq929的高功率脉冲nd:yag激光器或litron high energy pulsed的nd:yag激光器。所有这些激光器都可以产生mj范围内的深紫外辐射,因此适合电离并具有短脉冲持续时间。
549.也可以无源锁模垂直外腔面发射激光器(vecsel);这些特别有趣,因为它们可以提供短脉冲持续时间、高脉冲重复频率和有时高平均输出功率的组合,但是它们不适合高脉冲能量。
550.在一些实施例中,激光器适于产生纳秒、皮秒或飞秒级脉冲持续时间的脉冲。例如,激光可以具有500fs以下的持续时间,例如,400fs以下、300fs以下、200fs以下、100fs以下、50fs以下、45fs以下、25fs以下、20fs以下或10fs以下。飞秒激光器适于产生持续时间小于1ps的脉冲。
551.在一些实施例中,激光器适于具有至少100,000hz的脉冲重复频率,例如,至少1mhz、至少2mhz、至少3mhz、至少4mhz、至少5mhz、至少10mhz、至少20mhz、至少50mhz、至少100mhz、至少200mhz、至少500mhz或1ghz或更高。
552.在一些实施例中,激光器适配为具有50m以下、20m以下、10m以下、或5m以下的光束宽度(1/e2)。激光器的焦点是光束能量最集中的地方,因此也是实现最大电离的地方。
553.在一些实施例中,激光器被适配为具有1纳焦耳至50毫焦耳之间的脉冲能量。用于辅助材料溅射或材料烧蚀的激光器可以被适配为具有1纳焦耳至100微焦耳之间的脉冲能量,例如,10纳焦耳至100微焦耳之间、100纳焦耳至10微焦耳之间、500纳焦耳至5微焦耳之间,例如,约1微焦耳、约2微焦耳、约3微焦耳或约4微焦耳。用于后电离的激光器可以被适配为具有1毫焦耳和50毫焦耳之间的脉冲能量,例如,5毫焦耳和40毫焦耳之间、10毫焦耳和30毫焦耳之间、20毫焦耳和35毫焦耳之间,或者大约25毫焦耳或35毫焦耳。
554.在一些实施例中,激光器被适配为具有约1微焦耳的脉冲能量,具有至少10mhz的脉冲重复频率,并产生持续时间小于100fs的脉冲,例如,50fs以下、45fs以下、25fs以下、20fs以下或10fs以下。
555.如本领域技术人员将理解的,本发明可以与本文描述的合适激光器中的一个或组合一起使用。然而,为了完整起见,可用于本发明的激光器的许多特定组合如下:
[0556][0557]
[0558]
后电离需要小体积(例如,5μm3以下)中的激光辐射的高能量密度。因为后电离体积很小,这限制了一次电离的材料量。如果在小体积中产生大量的正电荷和负电荷,所形成的离子的运动将由离子和电子诱发的空间电荷产生的局部场控制。如果在小体积中有太多的带电离子,外部场(例如,质谱仪中存在的用于将所得离子引导向检测器以进行检测的离子光学器件中的场)将不能有效地分离正电荷和负电荷,并且这种离子云最终将中和,从而降低电离效率。例如,包含10000个元素电荷的直径为10μm的离子云产生约3v的静电势。由于几ev是将电子保持在原子上的能量,所以它也是电离后自由电子的可能能级。因此,在10微米尺度的体积中,10000个离子的离子密度接近空间电荷行为开始占主导地位的极限。
[0559]
因此,通过确保溅射材料的量保持相当小,可以避免这种影响。例如,在10
×
10
×
10nm立方体到30
×
30
×
30nm立方体或类似体积的尺度上的材料的烧蚀表示可以传送到几微米的后电离区域中的材料的最高量的大小不会产生强烈的空间变化和离子中和。由于系统在每单个事件中只能处理30
×
30
×
30nm立方体,这创造了以30nm或者甚至10nm的空间分辨率进行成像的机会,离子束可以聚焦到该空间分辨率上(如本文所述)。
[0560]
后电离束与溅射束共准直到微米精度以内,这在光学设置中是常见的。
[0561]
在一些实施例中,激光束以一定角度被导向至样本并进入样本的先前烧蚀区域(见图6)。这种配置使激光和未烧蚀样本之间的相互作用最小化。激光束可以聚焦到与烧蚀羽流体积重叠的紧密焦点上。激光束聚焦可以在高数值孔径(na)下进行,以促进重叠区域的精细聚焦,并使激光能量快速扩散到重叠区域之外,以最小化对被采样区域周围的样本造成损坏的可能性。
[0562]
由于图6中聚焦一次束并传送二次束用于质量分析的离子光学器件的限制,在一些实施例中,激光束光学器件的空间可能受到限制。结果,在一些实施例中,激光束的数值孔径可以被限制在一个平面中。例如,激光束在绘图平面内会具有低的na,以避免干涉离子光学器件,而在垂直于绘图平面的平面内具有高的na。这种设置导致在低na平面中延伸的椭圆形焦斑。椭圆形焦斑可以提高与溅射/烧蚀羽流的重叠程度。因此,在一些实施例中,后电离系统的激光器具有椭圆形焦斑。
[0563]
除了空间协调之外,由一次离子或电子束引起的溅射需要与激光辐射的传送同步,以电离溅射的材料。溅射材料离开目标的速度通常在声速的尺度,即1000m/s。因此,为了确保溅射云和激光束以1微米的精度对准,需要1ns的时间精度。离子束聚束和计时到1ns通常是通过5到20kv数量级的加速电压来实现的。相同或相似的聚束技术可以应用于一次束。例如,这种技术用于目前的tof ms设备。
[0564]
因此,在这种操作模式下,一次离子束或电子束从样本中溅射出材料,并且在这之后不久,喷射的材料被激光辐射脉冲后电离。
[0565]
为了进一步促进从目标一致地溅射/喷射材料,在一些情况下,可以用与一次离子脉冲同步的激光脉冲照射目标(代替或除了上述后电离之外)。对于没有暴露于一次离子或电子束的材料,激光脉冲的能量应设置为低于烧蚀阈值。在一次离子束或电子束与目标相互作用的区域中,物质的状态类似于等离子体,并且因为它被限制在纳米级,所以在本文被称为纳米等离子体。因此,光束可以与纳米等离子体相互作用,并将额外的能量泵入该体积,导致材料的一致释出。这种释出模式可被视为点燃状态(由与目标相互作用并产生纳米等离子体的一次离子束或电子束提供),随后是能量泵浦状态,其中,激光将额外的能量泵
浦到纳米等离子体中,促进其喷射。
[0566]
这种操作模式有助于克服一次离子或电子束溅射相对较慢的限制。由于一次离子束/电子束的溅射速率受到轰击给定区域的一次离子/电子总数的限制。由于离子/电子电流和空间电荷效应,一次离子束/电子束的聚焦能力受到限制。这与当后电离激光器关闭时需要对一次离子束/电子束计时以仅溅射材料相结合,从而限制了溅射速率。使用激光辐射来增强溅射,可以克服该限制,因为用激光束的影响溅射/烧蚀所需的激发能量来对样本材料进行种植需要更少的一次粒子。
[0567]
在激光用于后电离和增强溅射的情况下,相同的激光器也适用于将能量泵入纳米等离子体,以促进材料释出。例如,单个飞秒激光器可以满足设备的两种需求。激光器的重复频率可以为1mhz,脉冲宽度为200fs,每脉冲能量为1微焦耳(即平均功率为1w)。这种激光脉冲可以分离(例如,使用分束器),并且其一部分用于纳米等离子体的能量泵浦。剩余部分可用于后电离。压缩级可以应用于后电离束,以减少后电离所需的每个脉冲的能量的量。
[0568]
在一些实施例中,通过将能量泵送到表面上的纳米等离子体来执行激光束的后电离。因此,释出泵浦和后电离过程被结合成由传送到目标上的纳米等离子体的激光脉冲激活的单个过程。
[0569]
此外,通过将激光波长调谐到等离子体的吸收带,同时避开未电离的目标材料的吸收带,可以实现将能量泵入目标上的等离子体。这样,一次离子束/电子束的轰击用于将目标中的物质的状态从不吸收泵浦光改变为吸收泵浦光。泵浦光的持续时间可以从皮秒到几纳秒,再向下到几飞秒。同时,皮秒脉冲足够短,以避免样本中等离子体体积的显著扩散加宽。
[0570]
在一些实施例中,用于能量泵送的激光辐射透过样本载体传送(见图8)。例如,一次电子束或一次离子束可以聚焦到10至30nm尺度上的光斑上,而激光聚焦受到衍射效应的限制,并且可能停留在100至1000nm尺度上。
[0571]
现有技术中已知的设备可以用于在激光脉冲之间引入延迟。因此,在一些实施例中,该设备包括光学延迟线,以在激光脉冲之间引入延迟。适用于本发明的光学延迟线的示例是可从thorlabs购得的任何光学延迟线。
[0572]
可变延迟线可用于使电离脉冲的到达相对于一次离子或电子分组同步,从而使同一激光器能够以后电离或泵浦模式工作,取决于一次离子或电子分组和激光脉冲的相对时间。
[0573]
样本腔
[0574]
基于溅射的采样系统的样本腔与上述基于激光烧蚀的采样系统的样本腔有许多共同的特征。它包括支撑样本的载物台。载物台可以是平移台,可在x
‑
y或x
‑
y
‑
z轴上移动。样本腔还将包括出口,通过该出口可以引导由激光辐射从样本中移除的材料。出口连接到检测器,使得能够分析样本离子。
[0575]
在某些情况下,样本腔保持在133322
‑
13.3pa下,例如1333.22
‑
133.322pa。在某些情况下,样本腔保持在真空下。因此,在一些情况下,样本腔压力低于50000pa、低于10000pa、低于5000pa、低于1000pa、低于500pa、低于100pa、低于10pa、低于1pa、约0.1pa或低于0.1pa,例如,0.01pa或更低。例如,部分真空压力可以是大约50
‑
2000pa、100
‑
1000pa或200
‑
700pa,并且真空压力低于10pa、1pa或0.2pa。合适的气体包括氩气、氦气、氮气及其混
合物。
[0576]
如本领域技术人员所理解的,选择样本压力是在大气压下、部分真空压力下还是在真空下,取决于正在进行的特定分析。例如,在大气压下,样本处理更容易,并且可以应用更软的电离。此外,气体分子的存在可能是期望的,以便能够发生碰撞冷却现象,当标记是大分子时,这可能是令人感兴趣的,不期望其断裂,例如,包括标记原子或其组合的分子片段。或者,在激光辐射用于后电离材料的情况下,气体分子的存在(例如,在部分真空压力下)可能是有利的。例如,碰撞冷却可以允许在样本表面产生的纳米等离子体冷却(例如,在带电粒子轰击或激光照射样本以产生能量泵送状态之后)和烧蚀的材料羽流扩展,并且在后电离系统中再电离之前。碰撞还可以允许至少部分电荷减少,减少空间电荷效应和/或提高离子光学器件引导离子的能力。电荷状态减少到每个离子只有一个电荷,使得读取不同质量标签的信号变得更加容易。
[0577]
将样本腔保持在真空下可以防止所产生的样本离子和室内的其他粒子之间的碰撞。
[0578]
snms系统的样本腔和基于激光烧蚀的系统的样本腔之间的主要区别在于,样本腔保持在真空下,以防止样本离子和样本腔内的其他粒子之间的碰撞,这可能导致离子电荷的损失,与基于激光烧蚀和释出的样本腔的情况类似。二次离子的损失会降低设备的灵敏度。
[0579]
离子显微镜
[0580]
经由位于样本附近的静电透镜从样本捕获样本离子,该静电透镜在本领域中称为浸没透镜(或提取透镜)。浸没透镜移除直接来自样本的位置的二次离子。这通常是通过具有较大的电压差的透镜和样本来实现的。根据样本相对于浸没透镜的极性,浸没透镜捕获正或负二次离子。浸没透镜捕获的样本离子的极性与带电粒子束的离子极性无关。
[0581]
样本离子然后经由一个或多个另外的静电透镜(在本领域中称为传送透镜)传送到检测器。传送透镜将二次离子束聚焦到检测器上。通常,在具有多个传送透镜的系统中,在给定的分析中仅使用一个传送透镜。每个透镜可以提供样本表面的不同放大倍数。通常,在浸没透镜和检测器之间存在另外的离子操纵部件,例如,一个或多个孔、质量过滤器或偏转板组。浸没透镜、传送透镜和任何其他部件一起构成了离子显微镜。用于生产离子显微镜的部件可从商业供应商处获得,例如,agilent。
[0582]
相机
[0583]
该系统还可以包括相机。在上文中关于激光烧蚀采样系统讨论了相机系统,并且上述相机的特征也可以存在于二次离子产生系统中,除非不兼容(例如,它可以连接到光学显微镜,例如,共焦显微镜,但是不可能通过与光引导到相机所经由的光学器件相同的光学器件聚焦一次离子束,因为一个光束是离子而另一光束是光子)。
[0584]
c.基于双脉冲激光器的采样和电离系统
[0585]
类似于上文1.b节讨论的某些设备、系统和技术,产生“样本点燃状态”的电子种植可以通过激光辐射脉冲在某个位置实现。在此之后,激光光斑直径大于该位置但通量低于样本的烧蚀阈值的第二激光脉冲可被引导向样本,以仅在第一激光脉冲所指向的位置处引起烧蚀,因为烧蚀预种植位置所需的能量低于周围区域。因此,可以使用紧密聚焦的低能量第一脉冲来种植电子,并且可以使用更高能量的不太聚焦的脉冲来在种有电子的位置处引
起烧蚀。因此,本发明提供了基于该技术的高分辨率成像的又一方式。
[0586]
光学行为是众所周知的,即,光学系统产生的最小光斑尺寸与光的波长成正比,与物镜的数值孔径成反比。由于可见光的波长约为500nm,典型物镜的数值孔径很少超过1.0,因此这种光的聚焦光斑尺寸最终仅低于1微米。因此,通过使用更短波长的激光器进行操作,光可以在样本上聚焦更小的光斑。例如,准分子激光器可以产生波长约为200nm的vuv光。此外,现代光刻工具使用波长为13.5nm的euv光。遗憾的是,产生能量足以烧蚀的vuv和euv光脉冲需要大型、复杂和昂贵的设备。
[0587]
本发明通过用少量uv、euv或xuv光预先种植待烧蚀的光斑来解决烧蚀光斑减少的问题。这种预种植另外地在介电材料中产生自由电子。材料特性的这种变化降低了后续脉冲烧蚀的阈值。预种植所需的能量比直接烧蚀所需的能量低许多数量级。这使得用于产生这种脉冲的设备相对经济。由于预种植脉冲的波长较短,因此可以聚焦到100或30nm的直径。预种植完成后不久,具有更常见波长(例如,ir或可见光)的脉冲被发送到同一样本。将能量更有效地储存在预种植区域。因此,预种植区域可以被烧蚀,而被红外光覆盖的其他区域不会被烧蚀。因此,烧蚀光斑的大小由uv、vuv、euv波长施加的衍射极限控制。该极限大大低于单独施加的可见光或红外光的烧蚀分辨率。
[0588]
此外,本发明可以导致烧蚀材料的电离。可分析烧蚀材料的离子组成,并提供成像质谱或成像质谱流式细胞工作流程。被烧蚀的材料将在等离子体中电离,导致产生大量元素离子。当使用maxpar试剂或类似试剂时,来自等离子体的电离和离子采样的效率可以变得足够高,以促进抗体的单拷贝检测。在此处,可以经由离子显微镜直接提取离子进行分析,如下所述。
[0589]
当在如此高的空间分辨率(例如,30nm)下操作时,存在几个分析问题。一个问题是总采集速率与视场(或感兴趣区域)规模(dimension,大小)。现有的hyperion以200像素/s运行,像素大小为1微米。这导致需要大约5000秒来记录1
×
1mm尺度的生物相关roi的图像。如果像素尺寸减小30倍(约30nm),则从相似区域记录图像的时间将增加到500000秒。显然,这是一个不切实际的漫长时间。本发明通过在至少部分真空中操作电离采样来解决这个问题(参见下面进一步对样本腔的详细讨论),其中,像素速率可以高达1mpixels/s,这意味着将在仅仅100秒内获得1
×
1mm的面积。可以分析多个连续的切片,以提供大约0.03mm的生物尺度的3d图像。这将需要1000个切片(每个30nm)和大约1天的实验。考虑到所获得数据的多参数和高空间分辨率特性,这是一个非常高的速度。如果采集速率提高到10mpixels/s,则允许在2.5小时内收集这种图像。在100nm的空间分辨率下,样本分析也会快约30倍。
[0590]
如上所述,使用maxpar试剂(质量标签的抗体试剂,如下所述)可以通过每一个抗体的拷贝具有约100个原子来补偿由于较小的烧蚀而导致的灵敏度损失。高于5%的离子采样和传送能够检测单个抗体拷贝。当物体以30nm的像素尺寸成像时,在这样的像素中只能发现非常少的抗体。因此,在如此小的范围内实现用于成像的单拷贝检测变得至关重要。
[0591]
本发明的双脉冲技术产生的等离子体可以解决高效电离和采样的问题。小规模的烧蚀导致小规模的等离子体,这又降低了离子采样期间等离子体中和的可能性。此外,被烧蚀的固体材料的密度导致10000atm的初始等离子体压力,这又导致等离子体的局部热平衡模型。局部热平衡允许产生最佳等离子体温度,以促进来自质量标签的标记原子的接近100%有效的电离,以形成可经由第二脉冲的参数控制的元素离子。
[0592]
基于双脉冲激光烧蚀系统的设备通常包括三个部件。第一部件是用于在样本(其将被容纳在本文公开的设备和系统中的样本台上)中种植电子的第一激光源。第二部件是用于烧蚀电子已经被第一激光源种植其中的样本的第二激光源。(这两个部件共同构成了双脉冲激光采样和电离系统。)第三部件是检测电离材料的检测器部件,例如,质量检测器。激光源通常是脉冲的。在一些情况下,第一(预种植)脉冲可以从传送第二(烧蚀)脉冲的同一激光器中获得,例如,通过谐波产生。在本节中提到的将激光束引导向样本台上的位置是指设备和系统中部件的配置,但是本领域技术人员将会理解,当设备/系统用于分析样本时,来自第一和第二激光源的激光辐射将照射在被分析的样本上。
[0593]
因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
[0594]
样本台;
[0595]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台;以及
[0596]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台。
[0597]
该设备通常包括质量检测器,例如,tof检测器。
[0598]
因此,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0599]
样本台;
[0600]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台;以及
[0601]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台。
[0602]
在一些实施例中,被配置为将由第一激光源发射的激光束引导向样本台的第一聚焦光学器件被配置为将由第一激光源发射的激光束引导向样本台上的位置,并且被配置为将由第二激光源发射的激光束引导向样本台的第二聚焦光学器件被配置为将由第二激光源发射的激光束引导向样本台上的该位置。
[0603]
例如,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
[0604]
样本台;
[0605]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台上的位置;以及
[0606]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台上的位置。
[0607]
该设备通常包括质量检测器,例如,tof检测器。
[0608]
例如,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0609]
样本台;
[0610]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台上的位置;以及
[0611]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二
聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台上的位置。
[0612]
图13是本发明的示例性实施例的配置的示意图,其展示了通过两个脉冲烧蚀减小了烧蚀光斑尺寸。支撑件20保持样本30的薄切片。在一些实施例中(例如,纳米加工应用),支撑件和样本可以是一体的。uv或vuv或euv或甚至xuv光40的脉冲通过物镜60聚焦50在样本30上。uv、vuv、euv光学器件的特殊物镜在本领域是已知的,并且通常基于反射光学配置。例如,euv光的脉冲在焦斑中产生自由电子的种子。由于样本通常是不导电的,用自由电子进行的预种植会改变激光的焦斑处的材料的性质。第二光脉冲70被发送到相同的区域,包括电子被预种植的位置,以提供能量,来在预种植的位置发展等离子体。第二光脉冲70由另一物镜80发送。由于第二脉冲的波长显著较长,第二脉冲的焦斑90比第一脉冲焦斑大得多。在第二脉冲期间,电子在样本中倍增的过程称为雪崩电离。实际上,许多现象都有助于预种植区域的优先激发。只要优先激发所需的能量显著低于直接烧蚀的阈值,通过用例如euv脉冲预种植来限定烧蚀区域的方案是有效的。
[0613]
因此,本发明提供了用于分析样本(例如生物样本)的设备和系统,其中,第二聚焦光学器件被配置为同步来自第二激光源的激光辐射的第二脉冲,以在来自第一激光源的激光辐射的脉冲之后立即到达样本台上的位置。
[0614]
因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
[0615]
样本台;
[0616]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台;以及
[0617]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台;
[0618]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置。
[0619]
该设备通常包括质量检测器,例如,tof检测器。
[0620]
因此,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0621]
样本台;
[0622]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台;以及
[0623]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台;
[0624]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置。
[0625]
在一些实施例中,被配置为将由第一激光源发射的激光束引导向样本台的第一聚焦光学器件被配置为将由第一激光源发射的激光束引导向样本台上的位置,并且被配置为将由第二激光源发射的激光束引导向样本台的第二聚焦光学器件被配置为将由第二激光源发射的激光束引导向样本台上的位置。
[0626]
因此,本发明提供了用于分析样本(例如,生物样本)的设备和系统,其中,第一聚焦光学器件和第二聚焦光学器件被配置为将激光辐射引导到样本台的相对侧。
[0627]
因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
[0628]
样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
[0629]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第一面;以及
[0630]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第二面;
[0631]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置。
[0632]
该设备通常包括质量检测器,例如,tof检测器。
[0633]
因此,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0634]
样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
[0635]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第一面;以及
[0636]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第二面;
[0637]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置。
[0638]
本发明还提供了一种用于分析样本(例如,生物样本)的设备,包括:
[0639]
样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
[0640]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第二面;以及
[0641]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面;
[0642]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置。
[0643]
该设备通常包括质量检测器,例如,tof检测器。
[0644]
因此,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0645]
样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
[0646]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第二面;以及
[0647]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面;
[0648]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第
二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置。
[0649]
图14示出了本发明的另一优选实施例。在此处,第一脉冲40和第二脉冲70从同一侧聚焦到样本上。单个物镜60用于组合和聚焦两个光脉冲。因此,本发明提供了用于分析样本(例如,生物样本)的设备和系统,其中,第一聚焦光学器件和第二聚焦光学器件被配置为将激光辐射引导到样本台的相对侧。
[0650]
因此,本发明提供了一种用于分析样本(例如,生物样本)的设备,包括:
[0651]
样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
[0652]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第一面;以及
[0653]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面;
[0654]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置;
[0655]
并且其中,第一聚焦光学器件和第二聚焦光学器件使用相同的物镜来聚焦来自第一和第二激光源的辐射。
[0656]
该设备通常包括质量检测器,例如,tof检测器。
[0657]
因此,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0658]
样本台,包括第一面和第二面,第一面和第二面相对,并且其中,第一面适于容纳样本;
[0659]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台的第一面;以及
[0660]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台的第一面;
[0661]
其中,所述第二聚焦光学器件被配置为同步来自所述第二激光源的激光辐射的第二脉冲,以在来自所述第一激光源的激光辐射的脉冲之后立即到达所述样本台上的位置;以及
[0662]
其中,第一聚焦光学器件和第二聚焦光学器件使用相同的物镜来聚焦来自第一激光源和第二激光源的辐射。
[0663]
图15示出了另一实施例,其中,样本(30)放置在对第一脉冲至少半透明并且对第二脉冲甚至更透明的材料上。这种材料可以是电子显微镜中使用的金属网的形式。这种几何形状允许烧蚀的等离子体膨胀成由离子、电子和中性材料组成的云100。此处的离子可以被采样到质谱仪中,用于成像质谱和成像质谱流式细胞应用。
[0664]
因此,在本文公开的基于双脉冲激光的设备以及采样和电离系统的一些实施例中,样本台至少部分由对来自第一激光源的激光辐射至少半透明并且对来自第二激光源的辐射甚至更透明的材料组成。或者,如本文其他地方所解释的,并且为了完整起见在此重申,当激光辐射被引导透过样本台到达第一面上的样本时,样本台应该包括空隙,激光辐射可以穿过该空隙到达样本(通过样本载体)。在样本台包括空隙的情况下,样本被放置在样
本载体上,该样本载体至少部分由对来自第一激光源的辐射至少半透明并且对来自第二激光源的辐射甚至更透明的材料组成。
[0665]
图16示出了另一实施例,其有助于烧蚀离子的有效采样。在此处,第一激光脉冲40从第一侧发送。第一激光脉冲由在中间具有开口的物镜60形成,以允许烧蚀后产生的离子100通过。
[0666]
因此,在本文公开的基于双脉冲激光的设备以及采样和电离系统的一些实施例中,第一聚焦光学器件的物镜在中间具有开口,以允许来自样本的电离材料通过该开口。
[0667]
双激光采样和电离系统的部件
[0668]
第一激光源
‑
用于预种植电子的激光器
[0669]
如上所述,实现高分辨率成像的要求是激光辐射的波长能够聚焦到直径为100nm以下的焦斑。因此,由第一激光源发射的激光辐射的波长必须是紫外(uv)光。在一些实施例中,由第一激光源发射的激光辐射是uv、vuv、euv或xuv。在一些实施例中,由第一激光源发射的激光辐射为200nm以下、175nm以下、150nm以下、125nm以下、100nm以下、75nm以下、50nm以下、25nm以下、20nm以下或15nm。例如,在一些实施例中,由第一激光源发射的激光辐射在10nm
‑
200nm、10
‑
175nm、10
‑
150nm、10
‑
125nm、10
‑
100nm、10
‑
75nm、10
‑
50nm、10
‑
25nm、10
‑
20nm或10
‑
15nm之间。
[0670]
根据以上讨论,第一激光源的脉冲能量被选择为使得它在材料中种植电子,但不烧蚀该材料。在一些实施例中,第一激光源的脉冲能量在微微焦至毫微微焦范围内,例如,在1微微焦
‑
100毫微微焦之间、在10微微焦
‑
100毫微微焦之间或者在100微微焦
‑
1毫微微焦之间。
[0671]
脉冲的持续时间必须足够短,以便在引起样本烧蚀的第二激光脉冲之前使种植的电子的扩散最小化。第一脉冲(来自第一激光源)开始和第二脉冲(来自第二激光源)结束之间的总时间应保持在低于10ps。因此,在一些实施例中,来自第一激光源的脉冲的持续时间为5ps以下,例如,2ps以下、1ps以下、500fs以下、400fs以下、300fs以下、200fs以下,或100fs以下、50fs以下、40fs以下、30fs以下、20fs以下,或10fs以下。
[0672]
第一聚焦光学器件
[0673]
第一聚焦光学器件将来自第一激光源的辐射引导向样本,并将其聚焦到样本上。为了实现高分辨率成像,第一聚焦光学器件必须将激光辐射聚焦到样本上的光斑尺寸为大约100nm以下,例如,75nm以下、50nm以下或大约30nm。
[0674]
在一些实施例中,第一聚焦光学器件的物镜是反射物镜。
[0675]
第二激光源
‑
用于烧蚀预种植的样本位置的激光
[0676]
系统中对第二激光源的要求因其功能不同而不同。来自第二激光源的激光辐射脉冲提供能量以在样本上形成等离子体并控制其温度。
[0677]
因此,由第二激光源发射的激光辐射的波长可以是红外光或可见光。如果可见光由第二激光源发射,则可以聚焦得更紧密,因此每次脉冲烧蚀所需的能量更少。在一些实施例中,由第二激光源发射的激光辐射为400nm以上、500nm以上、600nm以上、700nm以上、800nm以上、或1μm以上。例如,在一些实施例中,由第二激光源发射的激光辐射在400nm
‑
100μm之间,例如,在200nm
‑
100μm之间、在200nm
‑
10μm之间、在400nm
‑
10μm之间、在400nm
‑
1μm之间、在400nm
‑
900nm之间、在400nm
‑
800nm之间、在400nm
‑
700nm之间、在400nm
‑
600nm之间或
在500nm
‑
600nm之间。
[0678]
根据上述讨论,第二激光源的脉冲能量被选择为使得它在激光光斑中仅烧蚀已经预植入电子的样本材料,即脉冲通量低于材料的烧蚀阈值。在一些实施例中,第二激光源的脉冲能量在纳焦耳范围内,例如,在1纳焦耳
‑
1μj之间、10纳焦耳
‑
500纳焦耳之间、50纳焦耳
‑
250纳焦耳之间或大约100纳焦耳。
[0679]
脉冲的持续时间必须足够短,以便在引起样本烧蚀的第二激光脉冲之前使种植的电子的扩散最小化。第一脉冲(来自第一激光源)开始和第二脉冲(来自第二激光源)结束之间的总时间应保持在低于10ps。因此,在一些实施例中,来自第二激光源的脉冲的持续时间为5ps以下,例如,2ps以下、1ps以下、500fs以下、400fs以下、300fs以下、200fs以下,100fs以下、50fs以下、40fs以下、30fs以下、20fs以下,或10fs以下。
[0680]
第二聚焦光学器件
[0681]
第二聚焦光学器件将来自第二激光源的辐射引导向样本,并将其聚焦到样本上。高分辨率成像是通过第一短波长脉冲的紧密聚焦来实现的,因此光斑尺寸可以大于第一脉冲。尽管如此,相对较小的光斑尺寸可将种植位置周围的样本辐射降至最低。因此,在一些实施例中,第二聚焦光学器件将激光辐射聚焦到样本的光斑尺寸为约2μm或更的,例如,1μm以下、750nm以下、500nm以下、250nm以下、200nm以下、150nm以下或约100nm。
[0682]
在一些实施例中,第二聚焦光学器件的物镜是折射或反射物镜,例如,na大于0.7、大于0.8或大于0.9的透镜。在一些实施例中,第二聚焦光学器件的物镜也是如上所述的第一聚焦光学器件的物镜。
[0683]
第一激光源和第二激光源的同步
[0684]
本发明的设备可以对第一激光源和第二激光源使用不同的激光器。在此处,本领域中的技术程序(例如,包括指令的编程模块)可以用于协调从第一激光源向样本的第一脉冲传送和从第二激光源向样本的第二脉冲的传送,使得预种植和预种植区域的烧蚀按照上述讨论进行。在一些实施例中,第一脉冲和第二脉冲是同步的,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps。在一些实施例中,时间短于10ps,例如,短于5ps、短于2ps或短于1ps。
[0685]
在一些实施例中,设备和系统使用一个激光器作为第一激光源和第二激光源,并使用分束器来分离激光并提供第一激光源和第二激光源。
[0686]
例如,可以使用产生红外脉冲的单个激光引擎。脉冲可以通过二次或三次谐波发生器转换成可见光。为了产生第一脉冲的短波长辐射,激光器可以耦合到高次谐波产生级。可以使用光学延迟线来控制第一脉冲和第二脉冲之间以及第二脉冲和第三脉冲之外的时间间隔。
[0687]
因此,在一些实施例中,包括第一激光源和第二激光源的设备或采样系统包括单个激光器、分束器和两个谐波发生器,其中,一个谐波发生器适于从作为第一激光源的单个激光器产生uv、vuv、euv或xuv激光辐射(如上文针对第一激光源所讨论的),另一谐波发生器从作为第二激光源的单个激光器产生红外或可见波长激光辐射(如上文针对第二激光源所讨论的)。
[0688]
因此,在一些实施例中,包括第一激光源和第二激光源的设备或采样系统包括单个激光器、分束器、两个谐波发生器和光学延迟线,其中,一个谐波发生器适于从作为第一
激光源的单个激光器产生uv、vuv、euv或xuv激光辐射(如上文针对第一激光源所讨论的),另一个谐波发生器适于从作为第二激光源的单个激光器产生红外或可见波长的激光辐射(如上文针对第二激光源所讨论的);并且其中,所述光学延迟线被适配成在来自从单个激光器的脉冲得到的第一激光源的脉冲之后,传送来自从单个激光器的相同脉冲得到的第二激光源的脉冲,使得所述第二脉冲的结束短于所述第一脉冲开始之后的50ps,例如,短于25ps、短于10ps,例如,短于5ps、短于2ps或短于1ps。
[0689]
可选地,适于产生uv、vuv、euv或xuv激光辐射的谐波发生器的输出可以被过滤,以包含对预种植待烧蚀区域感兴趣的波长范围。
[0690]
磁扇形仪器可能更适合1m像素及以上的高速记录。对于100k像素/s的记录速率,飞行时间质量分析仪是合适的,并且设计和制造可能更简单。
[0691]
因为这种类型的离子源产生非常紧密的离子光斑,所以这种技术中离子束的特性使得离子束适用于许多类型的质量分析仪(目前已知的和将要发明的)。
[0692]
一般激光器考虑
[0693]
飞秒激光器可以是固态激光器。无源锁模固态体激光器可以发射高质量的超短脉冲,典型持续时间在30fs至30ps之间。这种激光器的示例包括二极管泵浦激光器,例如,基于掺钕或掺镱晶体的激光器。钛
‑
蓝宝石激光器可用于低于10fs的脉冲持续时间,在极端情况下可低至约5fs(例如,octavius ti:蓝宝石激光器,可从thorlabs购得)。在大多数情况下,脉冲重复频率在1khz和500mhz之间。
[0694]
飞秒激光器可以是光纤激光器。也可以是无源锁模的各种类型的超快光纤激光器通常提供50到500fs之间的脉冲持续时间、0.10到100mhz之间的重复频率以及几毫瓦到几瓦之间的平均功率(飞秒光纤激光器可从toptica、imra america、coherent公司购得)。飞秒光纤激光器特别适合这种应用。当能量输出小于1uj时,激光器价格合理。激光脉冲的重复频率大于1mhz,可能导致1m像素/s的采集速率。这种激光器的脉冲持续时间约为200fs,完全在由等离子体区域的扩散展宽决定的10ps的上限内。
[0695]
飞秒激光器可以是半导体激光器。一些锁模二极管激光器可以产生具有飞秒持续时间的脉冲。直接在激光器的输出端,脉冲持续时间通常至少为几百飞秒,但通过外部脉冲压缩,可以实现更短的脉冲持续时间。
[0696]
在一些实施例中,激光器是纳秒激光器。纳秒激光器可以是泵浦激光器,例如,quantel q
‑
smart dpss、solar laser lq929高功率脉冲nd:yag激光器或litron高能量脉冲nd:yag激光器。所有这些激光器都可以产生mj范围内的深紫外辐射,因此适合电离和短脉冲持续时间。
[0697]
也可以无源锁模垂直外腔面发射激光器(vecsel);这些特别有趣,因为它们可以提供短脉冲持续时间、高脉冲重复频率和有时高平均输出功率的组合,但它们不适合高脉冲能量。
[0698]
基于双脉冲激光烧蚀的采样系统和设备中的后电离
[0699]
图17示出了其中三个激光脉冲用于提供烧蚀和后电离的实施例。在此处,前两个脉冲40和70用于小规模烧蚀材料,类似于图13的实施例。发送第三脉冲110,以与烧蚀材料的羽流重叠。用于提供对这种材料的进一步电离。这一步骤对于抑制烧蚀羽流中可能出现的中和效应可能是必要的。然后通过物镜60中的开口(未示出)提取离子。
[0700]
后电离需要小体积内来自激光辐射的高能量密度,例如,5μm3以下。因为后电离体积很小,它限制了一次电离的材料量。如果在小体积中产生大量的正电荷和负电荷,所形成的离子的运动将由离子和电子感应的空间电荷产生的局部场支配。如果在小体积中有太多的带电离子,外部场(例如,质谱仪中存在的用于将所得离子引导向检测器进行检测的离子光学器件的场)将不能有效地分离正电荷和负电荷,并且这种离子云最终将中和,从而降低电离效率。例如,包含10000个元素电荷的直径为10μm的离子云产生约3v的静电势。由于几ev是将电子保持在原子上的能量,所以它也是电离后自由电子的可能能级。因此,在10微米尺度的体积中,10000个离子的离子密度接近空间电荷行为开始占主导地位的极限。
[0701]
因此,通过确保烧蚀的材料的量保持相当小,可以避免这种影响。例如,在10
×
10
×
10nm立方到30
×
30
×
30nm立方或类似体积的尺度上的烧蚀材料表示可以传送到几微米的后电离区域中的材料的最高量,其尺寸不会产生强烈的空间变化和离子中和。由于系统在每次单个事件中只能处理30
×
30
×
30nm立方体,这创造了以30nm甚至10nm的空间分辨率进行成像的机会,离子束可以聚焦到该空间分辨率上(如本文所述)。
[0702]
后电离激光束/辐射与第二激光源的光束在微米精度内共对准,这通常在光学设置中获得。
[0703]
在一些实施例中,后电离激光束/辐射以一定角度指向样本并进入样本的先前烧蚀区域(图6中基于带电粒子的采样和电离系统的装配)。这种配置使用于后电离的激光辐射和未烧蚀的样本之间的相互作用最小化。激光束可以聚焦到与烧蚀羽流的体积重叠的紧密焦点。激光束聚焦可以在高数值孔径(na)下进行,以促进重叠区域的精准聚焦,并使激光能量快速扩散到重叠区域之外,以最小化对被采样区域周围的样本造成损坏的可能性。
[0704]
在一些实施例中,后电离激光束/辐射的数值孔径可以被限制在一个平面中。这种设置导致在低na平面中延伸的椭圆形焦斑。椭圆形焦斑可以提高与溅射/烧蚀羽流的重叠程度。因此,在一些实施例中,后电离系统的激光器具有椭圆形焦斑。
[0705]
除了空间协调之外,由上述第一激光源和第二激光源的组合作用产生的羽流需要与激光辐射的传送同步,以电离烧蚀的材料。烧蚀材料离开目标的速度通常在声速的范围内,即1000m/s。因此,为了确保烧蚀羽流和后电离激光辐射/光束以1微米的精度对准,需要1ns的时间精度。在某些方面,速度可以在1km/s与10km/s之间,例如,在2km/s和5km/s之间,这取决于烧蚀材料的温度和成分。如本文所述,烧蚀可分为大气压、部分真空压力或真空压力。
[0706]
因此,在这种操作模式中,第一激光源和第二激光源一起作用,以从样本中烧蚀材料,并且在这之后不久,喷射的材料被来自第三激光源的激光辐射脉冲后电离。
[0707]
由第一激光和第二激光的作用产生的纳米等离子体包含元素离子,但是在使用后电离的情况下,不直接提取这些离子。相反,允许喷射的羽流膨胀,在此期间会发生至少一些电荷中和,因为当时的等离子体处于高压下而因此密集,这意味着非常迅速地发生碰撞冷却和电荷减少。如上所述,纳米等离子体羽流的膨胀速度约为1000
‑
5000m/s。因此,在几皮秒后,由样本上例如10nm直径斑点的烧蚀产生的等离子体将膨胀一个数量级,例如,膨胀至100nm3的体积。在原始纳米等离子体体积的10
‑
100倍尺寸膨胀之后,羽流的额外或再电离意味着原始羽流的成分现在明显更加分散,使得当电离以恢复微米级等离子体时,碰撞的可能性小得多(因此电荷中和的可能性小),因此可以从羽流中提取更高比例的元素离
子。通过更高效地提取离子,包括来自标记原子的元素离子,实现了更高的灵敏度。
[0708]
因此,在一些实施例中,基于双脉冲激光器的采样和烧蚀系统和设备包括第三激光源,其被配置为电离从样本烧蚀的样本材料的羽流。
[0709]
因此,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0710]
样本台;
[0711]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台;
[0712]
第二激光源,其被配置为烧蚀由第一激光源预种植有电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台;
[0713]
第三激光源,其被配置为电离从样本烧蚀的样本材料的羽流;以及第三聚焦光学器件,其被配置为将由第三激光源发射的激光束引导向烧蚀的样本材料在其中形成羽流的体积;
[0714]
其中,第二聚焦光学器件被配置为同步来自第二激光源的第二激光辐射脉冲,以在来自第一激光源的第一激光辐射脉冲之后立即到达样本台上的位置;以及
[0715]
其中,第三聚焦光学器件被配置为同步第三激光辐射脉冲,以在第二激光辐射脉冲之后立即到达样本台上的位置上方的体积。
[0716]
第三激光器提供快速脉冲,可以小于30ps、小于10ps、小于1ps、小于500fs或小于100fs,例如,在1fs和10ps之间、在1fs和1ps之间、在1fs和500ps之间、在100fs和500fs之间。在一些实施例中,被配置为将由第一激光源发射的激光束引导向样本台的第一聚焦光学器件被配置为将由第一激光源发射的激光束引导向样本台上的位置,并且被配置为将由第二激光源发射的激光束引导向样本台的第二聚焦光学器件被配置为将由第二激光源发射的激光束引导向样本台上的位置。
[0717]
上面讨论的来自第三激光源的激光辐射所涉及的体积是指样本上方的体积。这是当从样本中喷射出材料时形成烧蚀羽流的体积。以上是在这种场景中使用的相对于样本的术语,是在水平面上的样本。如果样本保持在垂直平面上,使得烧蚀后的羽流沿水平轴喷射出,则来自第三激光源的激光辐射到达的体积将在该样本的横向侧部。在一些实施例中,体积为5μm3以下,例如,2.5μm3以下、2μm3以下、1μm3以下、或100nm3以下。在一些实施例中,体积为5μm3以下,例如,2.5μm3以下、2μm3以下、1μm3以下、或100nm3以下。在一些实施例中,体积从样本表面延伸小于2μm,例如,小于1μm,或小于100nm。
[0718]
如上所述,第一激光源和第二激光源可以表示分立的激光器,或者可以源自同一单个激光器。同样,第三激光源可以是分立的激光器,或者可以源自(i)与第一激光源相同的单个激光器;(ii)与第二激光源相同的单个激光器,或者(iii)第一、第二和第三激光源可以全部来自相同的单个激光器。
[0719]
在使用不同激光器的情况下,本领域中的技术程序(例如,包括指令的编程模块)可以用于协调第一脉冲和第二脉冲到样本的传送,使得预种植和预种植的区域的烧蚀与上述讨论一致,来自第三激光源的脉冲在烧蚀位置处到达样本表面上方的体积。
[0720]
在一些实施例中,第一脉冲和第二脉冲是同步的,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于
25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的100ns在烧蚀位置到达样本表面上方的体积。在一些实施例中,第一脉冲和第二脉冲同步,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的10ns在烧蚀位置处到达样本表面上方的体积。在一些实施例中,第一脉冲和第二脉冲同步,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的1ns在烧蚀位置到达样本表面上方的体积,
[0721]
在一些实施例中,第一脉冲和第二脉冲是同步的,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的100ps到达样本表面的烧蚀位置上方的体积。在一些实施例中,第一脉冲和第二脉冲是同步的,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的50ps在烧蚀位置到达样本表面上方的体积。在一些实施例中,第一脉冲和第二脉冲是同步的,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的30ps在烧蚀位置到达样本表面上方的体积。在一些实施例中,第一脉冲和第二脉冲是同步的,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的20ps在烧蚀位置到达样本表面上方的体积。在一些实施例中,第一脉冲和第二脉冲是同步的,使得从来自第一激光源的脉冲开始到来自第二激光源的脉冲结束所经过的时间具有小于50ps的持续时间,例如,短于25ps、短于10ps、例如,短于5ps、短于2ps或短于1ps,并且来自第三激光源的脉冲在短于来自第二激光源的脉冲结束后的10ps在烧蚀位置到达样本表面上方的体积。
[0722]
因此,本发明提供了一种用于分析样本(例如,生物样本)的双脉冲激光采样和电离系统,包括:
[0723]
样本台;
[0724]
第一激光源,其被配置为在样本中种植电子;以及第一聚焦光学器件,其被配置为将由第一激光源发射的激光束引导向样本台;
[0725]
第二激光源,其被配置为烧蚀由第一激光源预种植了电子的样本材料;以及第二聚焦光学器件,其被配置为将由第二激光源发射的激光束引导向样本台;
[0726]
第三激光源,其被配置为电离从样本烧蚀的样本材料的羽流;以及第三聚焦光学器件,其被配置为将由第三激光源发射的激光束引导向烧蚀的样本材料在其中形成羽流的体积;
[0727]
其中,所述第一激光源、所述第二激光源和所述第三激光源源自单个激光器,还包括至少一个分束器、至少两个谐波发生器和至少两个光学延迟线,
[0728]
其中,一个谐波发生器适于从作为第一激光源的单个激光器产生uv、vuv、euv或xuv激光辐射(如上文针对第一激光源所述),另一谐波发生器适于从作为第二激光源和第三激光源的单个激光器产生红外或可见波长激光辐射(如上文针对第二激光源所述),
[0729]
其中,所述第二聚焦光学器件包括光学延迟线,该光学延迟线被配置为同步第二激光辐射脉冲,以到达所述样本台上的位置,使得所述第二脉冲的结束短于所述第一脉冲开始后的50ps,例如,短于25ps、短于10ps、短于5ps、短于2ps或短于1ps;并且
[0730]
其中,所述第三聚焦光学器件包括另一光学延迟线,其被配置为同步第三激光辐射脉冲,以在短于来自所述第二激光源的脉冲结束后的100ps到达所述样本台上的位置上方的体积,例如,短于50ps、短于30ps或短于10ps。
[0731]
现有技术中已知的设备可以用于在激光脉冲之间引入延迟。因此,在一些实施例中,该设备包括光学延迟线,以在激光脉冲之间引入延迟。适用于本发明的光学延迟线的示例是可从thorlabs购得的任何光学延迟线。
[0732]
样本腔
[0733]
基于双脉冲的采样系统的采样室可以具有与上述基于激光烧蚀的采样系统的采样室相同的特征。包括支撑样本的载物台。载物台可以是平移台,可在x
‑
y或x
‑
y
‑
z轴上移动。样本腔还将包括出口,通过该出口可以引导由激光辐射从样本移除的材料。出口连接到检测器,由此使得能够分析样本离子。
[0734]
在某些情况下,样本腔保持在133322
‑
13.3pa下,例如,1333.22
‑
133.322pa。在某些情况下,样本腔保持在真空下。因此,在一些情况下,样本腔压力低于50000pa、低于10000pa、低于5000pa、低于1000pa、低于500pa、低于100pa、低于10pa、低于1pa、约0.1pa或低于0.1pa,例如,0.01pa或更低。例如,部分真空压力可以在200
‑
700pa左右,真空压力为0.2pa或更低。典型的气体例如是氩气、氦气、氮气及其混合物。
[0735]
如本领域技术人员所理解的,选择样本压力是处于大气压下还是(部分)真空下取决于正在进行的特定分析。例如,在大气压下,样本处理更容易,并且可以应用更软的电离。此外,气体分子的存在可能是期望的,以便能够发生碰撞冷却现象,当标记是大分子时,这可能是令人感兴趣的,不期望其断裂,例如,包括标记原子或其组合的分子碎片。或者,在激光辐射用于后电离材料的情况下,气体分子的存在和碰撞冷却可能有利于冷却在样本表面产生的纳米等离子体(即,在带电粒子轰击和激光照射样本以产生能量泵送状态之后)并且在后电离系统中再电离之前烧蚀材料羽流的膨胀。
[0736]
如本领域技术人员所理解的,选择样本压力是处于大气压下还是(部分)真空下取决于正在进行的特定分析。例如,在大气压下,样本处理更容易,并且可以应用更软的电离。此外,气体分子的存在可能是期望的,以便能够发生碰撞冷却现象,当标记是大分子时,这可能是令人感兴趣的,不期望其断裂,例如,包括标记原子或其组合的分子片段。
[0737]
将样本腔保持在真空下可以防止所产生的样本离子和室内的其他粒子之间的碰撞。
[0738]
离子显微镜和光学器件
[0739]
经由位于样本附近的静电透镜从样本中捕获样本离子,该静电透镜在本领域中称
为浸没透镜(或提取透镜)。浸没透镜立即从样本的位置移除二次离子。这通常是通过样本和具有较大的电压差的透镜来实现的。根据样本相对于浸没透镜的极性,正或负二次离子被浸没透镜捕获。浸没透镜捕获的样本离子的极性与带电粒子束的离子极性无关。
[0740]
样本离子然后经由一个或多个另外的静电透镜(在本领域中称为传送透镜)传送到检测器。传送透镜将二次离子束聚焦到检测器上。通常,在具有多个传送透镜的系统中,在给定的分析中仅使用一个传送透镜。每个透镜可以提供不同的样本表面放大倍数。通常,在浸没透镜和检测器之间存在另外的离子操纵部件,例如,一个或多个孔、质量过滤器或偏转板组。浸没透镜、传送透镜和任何其他部件一起构成了离子显微镜。用于生产离子显微镜的部件可从商业供应商处购得,例如,agilent。
[0741]
相机
[0742]
该系统还可以包括相机。相机系统在上文中关于激光烧蚀采样系统进行了讨论,并且上述相机的特征也可以存在于二次离子产生系统中,除非不兼容(例如,它可以连接到光学显微镜,例如,共焦显微镜,但是不可能通过与引导到相机的光相同的光学器件聚焦一次离子束,因为一个光束是离子而另一光束是光子)。
[0743]
使用基于双脉冲激光的设备的方法
[0744]
本发明还提供了使用本节所述的设备或采样和电离系统分析生物样本的方法。因此,以上关于设备讨论的特征是包含在方法权利要求中的合适特征。因此,本发明提供了一种用于分析样本的方法,包括以下步骤:
[0745]
(i)使用由第一激光源发射的激光辐射在样本上的位置种植电子;以及
[0746]
(ii)使用由第二激光源发射的激光辐射从使用由第一激光源预接种有电子的样本上的位置烧蚀样本材料。
[0747]
步骤(ii)也可以电离(例如,可持续地电离)接种的样本。在一些实施例中,在短于第一脉冲开始之后的50ps内完成步骤(ii),例如短于步骤(i)开始后的25ps、短于10ps、例如短于5ps、短于2ps或短于1ps。在一些实施例中,步骤(i)用5ps以下的激光辐射脉冲来执行,例如,2ps以下、1ps以下、500fs以下、400fs以下、300fs以下、200fs以下或100fs以下、50fs以下、40fs以下、30fs以下、20fs以下或10fs以下。在一些实施例中,由第一激光源发射的激光辐射为200nm以下、175nm以下、150nm以下、125nm以下、100nm以下、75nm以下、50nm以下、25nm以下、20nm以下或15nm。在一些实施例中,由第一激光源发射的激光辐射在10nm
‑
200nm、10
‑
175nm、10
‑
150nm、10
‑
125nm、10
‑
100nm、10
‑
75nm、10
‑
50nm、10
‑
25nm、10
‑
20nm或10
‑
15nm之间。在一些实施例中,第一激光源的脉冲能量在微微焦至毫微微焦范围内,例如,在1微微焦
‑
999毫微微焦之间、在10微微焦
‑
100毫微微焦之间或在100微微焦
‑
1毫微微焦之间。在一些实施例中,该位置的直径为100nm以下,例如,75nm以下、50nm以下或大约30nm。
[0748]
在一些实施例中,用5ps以下的激光辐射脉冲来执行步骤(ii),例如,2ps以下、1ps以下、500fs以下、400fs以下、300fs以下、200fs以下或100fs以下、50fs以下、40fs以下、30fs以下、20fs以下或10fs以下。在一些实施例中,由第二激光源发射的激光辐射的波长在400nm
‑
100μm之间,例如在400nm
‑
10μm之间、在400nm
‑
1μm之间、在400nm
‑
900nm之间、在400nm
‑
800nm之间、在400nm
‑
700nm之间、在400nm
‑
600nm之间或在500nm
‑
600nm之间、在200nm
‑
100μm之间、在200nm
‑
10μm之间或者在200nm
‑
1μm之间。在一些实施例中,第二激光源的脉冲能量在纳焦范围内,例如,在1纳焦
‑
1μj之间、在10纳焦
‑
500纳焦之间、在50纳焦
‑
250
纳焦之间或大约100纳焦。
[0749]
在一些实施例中,该方法还包括用来自第三激光源的激光辐射照射在步骤(ii)中从样本上烧蚀的材料羽流。在一些实施例中,来自第三激光源的激光辐射在短于来自第二激光源的脉冲结束后的10ns到达样本上的位置上方的体积,例如,短于1ns、短于100ps、短于50ps、短于30ps或短于10ps。
[0750]
后电离系统和方法
[0751]
在本文所述的任何采样方法中,包括:通过来自第一能量源的初始辐射(例如,激光、离子束或电子束),从样本释放的材料可以在样本表面处或附近被激光电离。用于电离的激光可以是ir或可见光激光,并且可以是皮秒级的(例如,1
‑
1000ps、5
‑
100ps、10
‑
50ps)。释放的材料可能在初始辐射的100ps至10ns内被激光电离,允许材料膨胀超过临界密度(在此之前,中和将显著减少长期离子形成)。这可以产生微等离子体(在表面上方),与在样本表面直接电离形成的纳米等离子体相反。样本(例如,容纳样本的腔室)可以保持在真空或部分真空压力下,以允许烧蚀羽流膨胀超过临界密度和/或提高离子光学器件引导所得离子的能力。部分真空压力(例如,10
‑
10000pa或100
‑
1000pa)可以允许碰撞冷却和/或电荷减少,并且可以改善离子光学期间。
[0752]
2.质量检测器系统
[0753]
质量检测器系统的示例性类型包括四极杆、飞行时间(tof)、磁扇形、高分辨率、基于单个或多个收集器的质谱仪。磁扇形仪器特别适合每秒1兆像素及以上的高速记录。
[0754]
分析电离材料所需的时间取决于用于检测离子的质量分析仪的类型。例如,使用法拉第杯的仪器通常太慢,无法分析快速信号。总体而言,期望的成像速度、分辨率和多重程度将决定应使用的质量分析仪的类型(或者,相反,质量分析仪的选择将确定可实现的速度、分辨率和多重性)。
[0755]
例如,使用点离子检测器一次只能检测一种质荷比(m/q,在ms中通常称为m/z)的离子的质谱仪器在成像检测中会给出较差的结果。首先,在质荷比之间切换所需的时间限制了确定多个信号的速度,其次,如果离子丰度较低,当仪器聚焦于其他质荷比时,信号可能会丢失。因此,优选使用提供基本上同时检测具有不同m/q值的离子的技术。
[0756]
检测器类型
[0757]
四极检测器
[0758]
四极质量分析仪由四个平行的杆组成,杆的一端有一个检测器。在一对杆和另一对杆之间施加交变射频电势和固定dc偏移电势,使得一对杆(每个杆彼此相对)具有与另一对杆相反的交变电势。电离后的样本沿平行于杆的方向并朝向检测器穿过杆的中部。所施加的电势影响离子的轨迹,使得只有具有一定质荷比的离子才会具有稳定的轨迹,从而到达检测器。其他质荷比的离子会与杆碰撞。
[0759]
磁扇形检测器
[0760]
在磁扇形质谱术中,电离样本朝向离子检测器穿过弯曲的飞行管。施加在飞行管的磁场使离子偏离它们的路径。每个离子的偏转量基于每个离子的质荷比,因此只有一些离子会与检测器碰撞,其他离子会偏离检测器。在多收集器扇形场仪器中,检测器阵列用于探测不同质量的离子。在一些仪器中,例如,thermoscientific neptune plus和nu plasma ii,磁扇区与静电扇区相结合,以提供一种双聚焦磁扇形仪器,除了质荷比之外,还通过动
能分析离子。特别是可以使用具有mattauch
‑
herzog几何形状的多检测器(例如,spectro ms,它可以使用半导体直接电荷检测器在一次测量中同时记录从锂到铀的所有元素)。这些仪器可以基本上同时测量多个m/q信号。通过在检测器中包括电子倍增器,可以提高它们的灵敏度。阵列扇形仪器常常是适用的,然而,因为尽管它们对于检测增加的信号是有用的,但是当信号水平降低时,它们就不太有用了,因此它们不太适合于标签以特别高的变化浓度存在的情况。
[0761]
飞行时间(tof)检测器
[0762]
飞行时间质谱仪包括样本入口、在其上施加强电场的加速室和离子检测器。电离的样本分子分组通过样本入口引入加速室。最初,每个电离样本分子具有相同的动能,但是当电离样本分子加速通过加速室时,它们由于其质量分开,较轻的电离样本分子比较重的离子移动得更快。然后,检测器会在所有离子到达时对其进行探测。每个粒子到达检测器所需的时间取决于粒子的质荷比。
[0763]
因此,tof检测器可以准同时记录单个样本中的多个质量。理论上,tof技术并不理想地适用于icp离子源,因为它们的空间电荷特性,但tof仪器实际上可以足够快速和灵敏地分析icp离子气溶胶,以允许可行的单细胞成像。尽管tof质量分析仪通常不受原子分析的欢迎,因为处理tof加速器和飞行管中的空间电荷的影响所需要的折衷,但是根据本公开的组织成像可以通过仅检测标记原子而有效,因此可以去除其他原子(例如,原子质量低于100的原子)。这导致较低密度的离子束,富集在(例如)100
‑
250道尔顿区域的质量中,可以更有效地操纵和聚焦,从而促进tof检测并利用tof的高光谱扫描速率。因此,快速成像可以通过将tof检测与选择样本中不常见的标记原子相结合来实现,并且理想地具有高于未标记样本中所见质量的质量,例如,通过使用更高质量的过渡元素。因此,使用标记物的更窄窗口意味着tof检测可用于有效成像。
[0764]
合适的tof仪器可从tofwerk、gbc scientific equipment(例如,optimass 9500icp
‑
tofms)和fluidigm canada(例如,cytof
tm
和cytof
tm
2仪器)购得。这些cytof
tm
仪器的灵敏度高于tofwerk和gbc仪器,因其能够快速、灵敏地检测稀土金属质量范围内的离子(特别是m/q范围为100
‑
200;见bandura等人(2009年;anal.chem.81:6813
‑
22)),而被众所周知用于质谱流式细胞术中。因此,这些是用于本公开的优选仪器,并且它们可以用于利用本领域中已知的仪器设置进行成像,例如,bendall等人(2011;science 332,687
‑
696)&bodenmiller等人(2012;nat.biotechnol.30:858
‑
867)。其质量分析仪可以在高频激光烧蚀或样本释出的时间尺度上以高质谱采集频率准同时检测大量标记物。他们可以测量标记原子的丰度,每个细胞的检测限度约为100,从而可以灵敏地构建组织样本的图像。由于这些特点,现在可以使用质谱流式细胞术来满足亚细胞分辨率下组织成像的灵敏度和多重(multiplexing,多路)需求。通过将质谱流式细胞仪器与高分辨率激光烧蚀采样系统和快速运输低色散样本腔相结合,可以在实际时间尺度上以高多重性构建组织样本的图像。
[0765]
tof可以与质量分配校正器耦接。绝大多数电离事件产生m
离子,其中,从原子中撞出一个电子。由于tof ms的操作模式,有时一个质量(m)的离子会有一些泄漏(或串扰)到相邻质量(m
±
1)的通道中,特别是在大量质量为m的离子进入检测器的情况下(即,离子计数高,但没有高到使得位于采样电离系统和ms之间的离子偏转器会阻止它们进入ms,如果该设备包括这样的离子偏转器)。由于每个m
离子到达检测器的时间遵循关于平均值的概
率分布(这对于每个m是已知的),当质量为m
的离子数量高时,一些离子将在通常与m
‑1
或m 1
离子相关的时间到达。然而,由于每个离子在进入tof ms时具有已知的分布曲线,所以基于质量为m的通道中的峰,可以确定质量为m的离子进入m
±
1通道的重叠(通过与已知的峰形状进行比较)。该计算特别适用于tof ms,因为tof ms中检测到的离子峰是不对称的。因此,可以校正m
‑
1、m和m 1通道的读数,以将所有检测到的离子适当地分配给m通道。这种校正在校正成像数据中具有特殊的用途,这是由于采样和电离系统产生的大离子分组的性质,例如,本文公开的涉及激光烧蚀(或如下所述的释出)的系统,作为从样本中去除材料的技术。wo2011/098834、美国专利8723108和wo2014/091243中讨论了通过对tof ms的数据进行去卷积来提高数据质量的程序和方法。
[0766]
死区校正器
[0767]
如上所述,基于离子和检测器之间的碰撞以及从被离子撞击的检测器表面释放电子来在ms中检测信号。当ms检测到大量离子而导致大量电子释放时,ms的检测器可能会暂时疲劳,结果是从检测器输出的模拟信号对于一个或多个随后的离子分组会暂时减少。换言之,在检测来自电离样本材料分组的离子的过程中,电离样本材料分组中特别高的离子数导致从检测器表面和二次倍增器释放大量电子,这意味着当随后电离样本材料分组中的离子撞击检测器时,可释放的电子更少,直到检测器表面和二次放大器中的电子得到补充。
[0768]
基于检测器行为的特征,可以补偿这种死区现象。第一步是分析模拟信号中的离子峰,该信号是由检测器检测第n电离样本材料分组产生的。峰的大小可以由峰的高度、峰的面积或峰高和峰面积的组合来确定。
[0769]
然后比较峰值的大小,以确定它是否超过预定阈值。如果大小低于该阈值,则无需校正。如果大小高于阈值,则将执行来自至少一个随后的电离样本材料分组的数字信号的校正(至少第(n 1)个电离样本材料分组,但是可能更多的电离样本材料分组(例如,第(n 2)个、第(n 3)个、第(n 4)个等),以补偿来自这些电离样本材料分组的模拟信号的暂时下降,该暂时下降是由第n电离样本材料分组引起的检测器的疲劳造成的。第n电离样本材料分组的峰值的大小越大,后续电离样本材料分组中需要校正的峰值就越多,需要校正的大小也更大。stephan等人(1994;vac.sci.technol.12:405)、tyler和peterson(2013;.surf interface anal.45:475
–
478)、tyler(2014;surf interface anal.46:581
–
590)、wo2006/090138和美国专利6229142讨论了校正这种现象的方法,并且这些方法可以由死区校正器应用于数据,如本文所述。
[0770]
基于光发射光谱检测的分析仪设备
[0771]
1.采样和电离系统
[0772]
a.基于激光烧蚀的采样和电离系统
[0773]
包括上述与基于质量的分析仪相关的激光扫描系统的激光烧蚀采样系统可以用在基于oes检测器的系统中。为了检测原子发射光谱,最优选地,使用icp来电离从样本中去除的样本材料,但是可以使用能够产生元素离子的任何硬电离技术。
[0774]
如本领域技术人员所理解的,上文描述的与避免基于质量的检测器过载相关的基于激光烧蚀的采样和电离系统的某些可选的其他部件可能不适用于所有基于oes检测器的系统,并且如果不合适,本领域技术人员将不会将其并入。
[0775]
2.光电检测器
swipes)、宫颈黏膜(cervical swipes)或任何其他组织中的一种或多种的组织。生物样本可以是永生化细胞系或从活体获得的原代细胞。出于诊断、预后或实验(例如,药物开发)的目的,组织可以来自肿瘤。在一些实施例中,样本可以来自已知的组织,但是可能不知道样本是否包含肿瘤细胞。成像可以揭示指示肿瘤存在的目标的存在,从而便于诊断。来自肿瘤的组织可包含免疫细胞,所述免疫细胞也由本方法表征,并可提供对肿瘤生物学的洞察。组织样本可以包括福尔马林固定的、石蜡包埋的(ffpe)组织。可以从任何活的多细胞生物体中获得所述组织,活的多细胞生物体例如,哺乳动物、动物研究模型(例如,特定疾病,例如,具有人肿瘤异种移植物的免疫缺陷啮齿动物)或人类患者。
[0786]
组织样本可以是切片,其厚度例如在2
‑
10μm范围内,例如,在4
‑
6μm之间。制备这种切片的技术在ihc领域是众所周知的,例如,使用切片机,包括脱水步骤、固定、包埋、透化、切片等。因此,组织可以被化学固定,然后可以在期望的平面中制备切片。冷冻切片或激光捕获显微切片也可用于制备组织样本。样本可以是渗透性的,例如,允许摄取用于标记细胞内目标的试剂(见上文)。
[0787]
待分析的组织样本的尺寸将类似于当前的ihc方法,但是最大尺寸将由激光烧蚀设备决定,特别是由能够装入其样本腔的样本的尺寸决定。高达5mm
×
5mm的尺寸是典型的,但是较小的样本(例如,1mm
×
1mm)也是有用的(这些尺寸是指切片的尺寸,而不是其厚度)。
[0788]
除了可用于对组织样本成像之外,本发明还可用于对细胞样本成像,例如,粘附细胞或固定在固体表面上的细胞(如在常规免疫细胞化学中)的单层。这些实施例对于分析不容易溶解以用于细胞悬浮质谱流式细胞术的贴壁细胞特别有用。因此,除了用于增强当前的免疫组织化学分析之外,本公开可用于增强免疫细胞化学。
[0789]
超薄样本
[0790]
如上所述,传统的imc和ims技术使用几微米厚的组织样本。然而,在本文描述的本发明的一些实施例(例如,用于分析生物样本的设备)包括位于物镜和样本台之间的浸没介质(参见pct公开文本第9页),从而不适用于这种厚度的样本,因为烧蚀区域在所有三个维度上或者至少在横向维度上通常为100nm的量级。
[0791]
因此,本发明提供了一种制备用于分析的生物样本的方法,包括:用标记原子标记样本(在本文中进一步描述标记原子),并将样本切成切片,可选地,其中,将样本切成厚度小于10微米以下的切片,例如,1微米以下,或100nm以下,或50nm以下,或30nm以下。本发明还提供了一种制备用于分析的生物样本的方法,包括:将样本切成薄切片并用标记原子标记样本(在本文中进一步描述标记原子),可选地,其中,将样本切成厚度小于10微米以下的切片,例如,1微米以下,或100nm以下,或50nm以下,或30nm以下。根据本发明的方法,可以使用自动切片机,例如,可从rm boeckeler购得的atumtome,将样本切成一定厚度的切片。
[0792]
根据上述方法制备的样本可以与本文所述的imc和ims技术中的任一种一起使用。然而,根据上述方法制备的样本特别适合于通过包括位于物镜和本文所述的样本台之间的浸没介质的任何设备进行分析。
[0793]
此外,根据上述方法制备的样本也适用于通过上述任何一种基于溅射的采样和电离系统进行分析。
[0794]
样本载体
[0795]
在某些实施例中,样本可以固定在固体支持物(即样本载体)上,以将其定位用于
成像质谱法。固体支持物可以是光学透明的,例如,由玻璃或塑料制成。如图3至图5和图8至图10所示,当样本载体是光学透明时,使得能够透过载体烧蚀样本材料。当激光辐射透过浸没介质被引导到样本上时,透过样本载体的材料的烧蚀具有特别的优点。
[0796]
有时,样本载体将包括用作参考点的特征,用于本文所述的设备和方法,例如,以允许计算待烧蚀或释出和分析的特征/感兴趣区域的相对位置。参考点可以是光学可分辨的,或者可以通过质量分析来分辨。
[0797]
目标元素
[0798]
在成像质谱术中,一种或多种目标元素(即元素或元素同位素)的分布可能是感兴趣的。在某些方面,目标元素是本文所述的标记原子。标记原子可以单独直接添加到样本中,或者共价结合到生物活性分子或结合在生物活性分子中。在某些实施例中,标记原子(例如,金属标签)可以与特异性结合对(sbp)的元件偶联,例如,抗体(与其同源抗原结合)、适配体或寡核苷酸,用于与dna或rna目标杂交,如下文更详细描述的。标记原子可以通过本领域已知的任何方法附着至sbp。在某些方面,标记原子是金属元素,例如,镧系或过渡元素或本文所述的其他金属标签。金属元素的质量可以大于60amu、大于80amu、大于100amu或大于120amu。本文所述的质谱仪可以耗尽低于金属元素质量的元素离子,使得大量较轻的元素不会产生空间电荷效应和/或淹没(overwhelm)质量检测器。
[0799]
组织样本的标记
[0800]
本公开产生已经用标记原子(例如,多个不同的标记原子)标记的样本的图像,其中,标记原子由能够对样本的特定区域(优选地,亚细胞区域)进行采样的设备检测(因此标记原子表示元素标签)。引用多个不同的原子意味着使用多于一种的原子种类来标记样本。可以使用质量检测器来区分这些原子种类(例如,它们具有不同的m/q比),使得羽流中两种不同标记原子的存在产生两种不同的ms信号。还可以使用光学光谱仪来区分原子种类(例如,不同的原子具有不同的发射光谱),使得羽流中两种不同标记原子的存在产生两种不同的发射光谱信号。
[0801]
电子显微镜(em)技术的标记
[0802]
免疫显微镜利用电子显微镜研究组织或细胞的超微结构。在免疫显微镜中,电子显微镜用于检测用重金属粒子标记的抗体spb,例如,本文进一步描述的那些。扫描电子显微镜(sem)和透射电子显微镜(tem)都是众所周知的电子显微镜技术,可用于检测抗体spb。扫描电子显微镜(sem)用于检测电子与样本表面相互作用产生的信号。透射电子显微镜(tem)用于检测电子穿过超薄样本(小于50nm)产生的图像。制备用于免疫显微镜的样本的标准方案包括组织固定、包含在合适的包埋树脂中以及随后的超薄切片(厚度为50nm以下的切片)以及与需要确定超微结构位置的分子的特异性抗体一起孵化。
[0803]
本发明利用技术来制备适于通过电子显微镜分析的样本。一方面,本发明提供了一种制备用于分析的生物样本的方法,包括:用用于电子显微镜(em)检查的造影剂对样本进行染色;并用标记原子标记样本。在一些实施例中,该方法包括在染色或标记之前制备生物样本的超薄切片的步骤,例如,100nm或更薄、50nm或更薄或30nm或更薄。以这种方式,本发明提供了适于在使用本文讨论的imc和ims技术中的任何一个进行分析之前使用em进行成像的样本。因此,本发明提供了提供比传统的imc和ims技术更高分辨率和/或多重性的成像的机会。
[0804]
在本发明的一些实施例中,用于em的造影剂在成像质谱流式细胞仪或成像质谱仪中是可见的。因此,本发明提供了一种制备生物样本的方法,其中,造影剂包括四氧化锇、金、银和铱中的至少一种。因此,根据本发明的方法制备的生物样本可以首先通过em读取,从而为一个(亲和)通道(em造影剂)提供3nm尺度的空间分辨率,然后通过imc/ims以100nm的空间分辨率读取,其中,由标记原子提供尽可能多的亲和通道(例如,超过40个亲和通道)。利用在质谱流式细胞仪中也可见的用于em的造影剂(例如,四氧化锇或铱)的一个优点在于,imc/ims可以很容易地读出造影剂,因此通过em和imc/ims获得的图像可以重叠和共同配准。em提供了精细的细节,而imc/ims提供了在许多亲和通道上监测样本的生物状态的优势。以这种方式,根据本发明制备用于分析的生物样本提供了一种机会,将imc的能力扩展到细胞的超微结构分析,获得比传统imc和ims提供的图像更高分辨率的图像。
[0805]
此外,以适合电子显微镜的方式制备生物样本通常包括在树脂中制备样本,这与福尔马林固定石蜡包埋(在上面讨论的ffpe)相反。基于ffpe的样本在干燥时会移动和模糊,降低图像分辨率。另一方面,样本中的树脂有利于烧蚀的均匀性,进一步提高了分辨率。
[0806]
此外,以适于电子显微镜检查的方式制备生物样本通常包括将样本切成薄样本,(如例如pct公开文本第40页所述)。因此,本发明提供了一种制备用于分析的生物样本的方法,包括:首先将样本切成薄切片;可选地,其中,样本被切成厚度小于10微米以下的切片,例如,1微米以下,或100nm以下,或30nm以下。
[0807]
在本发明的一些实施例中,标记原子包括金和镧系元素标记的抗体中的至少一种。
[0808]
根据上述方法制备的样本可以与本文所述的imc和ims技术中的任一个一起使用。因此,本发明提供了一种分析生物样本的方法,包括:
[0809]
将激光源发射的辐射束引导向样本上的位置,以产生样本材料的烧蚀羽流;
[0810]
电离样本材料的烧蚀羽流;并且
[0811]
从样本材料中检测样本离子;
[0812]
可选地,其中,本发明的方法包括首先进行电子显微镜检查。在一些实施例中,离子由tof ms检测。在一些实施例中,样本材料由icp电离。
[0813]
为了重建生物细胞的单层厚度的图像或逐层读取较厚的样本并产生3d图像,如本文进一步讨论的,样本优选具有100微米以下的厚度,例如,10微米以下,或100nm以下,或50nm以下,或30nm以下。在本文更详细描述的一些实施例中,浸没介质被称为浸没透镜。本发明还提供了厚度为100nm以下的生物样本在成像质谱流式细胞术的方法中的用途。本发明还提供了用镧系元素和/或锕系元素原子标记的生物样本在电子显微镜方法中的用途。
[0814]
本发明还提供了一种分析生物样本的方法,该方法包括对样本进行电子显微镜检查(例如,透射电子显微镜检查),然后对样本进行imc。在一些实施例中,本发明提供了一种分析生物样本的方法,包括以下步骤:
[0815]
a)对样本进行透射电子显微镜检查,以产生em图像;
[0816]
b)从样本上的一个或多个位置采样并电离材料,包括在样本上的每个位置引导激光辐射以从每个位置产生样本材料羽流,
[0817]
c)检测样本材料羽流中的离子,由此检测羽流中的离子允许构建样本的元素图像。
[0818]
该方法有时还包括叠加em图像和元素图像的步骤。在一些实施例中,位置是已知的位置。
[0819]
在一些实施例中,本发明提供了一种分析生物样本的方法,包括以下步骤:
[0820]
a)用em造影剂染色生物样本,并用标记原子标记组织样本中的一种或多种目标分子,以提供染色和标记的样本;
[0821]
b)对染色和标记的样本进行透射电子显微镜检查,以产生em图像;
[0822]
c)从染色和标记的样本上的一个或多个已知位置采样并电离材料,包括在样本上的每个已知位置引导激光辐射,以从每个已知位置产生样本材料羽流;
[0823]
d)检测样本材料羽流中的离子,由此检测羽流中的标记原子的离子,从而允许构建样本的元素图像。
[0824]
该方法有时还包括叠加em图像和元素图像的步骤。在一些实施例中,激光辐射对材料进行采样并使其电离。在一些实施例中,通过icp产生用于检测的离子的电离与采样分开进行。
[0825]
质量标签的试剂
[0826]
本文使用的质量标签试剂包括许多构成。首先是sbp。其次是质量标签。质量标签和sbp通过连接物连接,该连接物至少部分由质量标签和sbp的偶联形成。sbp和质量标签之间的连接物也可以包括间隔物。质量标签和sbp可以通过一系列化学反应偶联在一起。示例性的偶联反应化学物包括硫醇马来酰亚胺、nhs酯和胺或点击化学反应物(优选不含cu(i)的化学物),例如,应变炔烃和叠氮化物、应变炔烃和硝酮以及应变烯烃和四嗪。
[0827]
质量标签
[0828]
本发明中使用的质量标签可以采取多种形式。通常,标签包括至少一个标记原子。下面讨论标记原子。
[0829]
因此,在其最简单的形式中,质量标签可以包含金属螯合部分,该金属螯合部分是金属螯合基团,具有在配体中配位的金属标记原子。在某些情况下,每个质量标签仅检测一个金属原子就足够了。然而,在其他情况下,可能希望每个质量标签包含多于一个的标记原子。这可以通过多种方式实现,如下所述。
[0830]
产生可包含多于一个的标记原子的质量标签的第一种方法是使用包含连接到聚合物的多于一个的亚基的金属螯合配体的聚合物。能够结合聚合物中至少一个金属原子的金属螯合基团的数量可以在大约1和10000之间,例如,在5
‑
100、10
‑
250、250
‑
5000、500
‑
2500或500
‑
1000之间。至少一个金属原子可以结合到至少一个金属螯合基团上。该聚合物的聚合度可以在大约1至10000之间,例如,在5
‑
100、10
‑
250、250
‑
5000、500
‑
2500或500
‑
1000之间。因此,基于聚合物的质量标签可以包含大约1至10000个标记原子,例如,在5
‑
100个、10
‑
250个、250
‑
5000个、500
‑
2500个或500
‑
1000之间。
[0831]
该聚合物可选自由线性聚合物、共聚物、分支化聚合物、嫁接共聚物、嵌段聚合物、星形聚合物和超支化聚合物组成的组中。聚合物的主链可以衍生自取代的聚丙烯酰胺、聚甲基丙烯酸酯或聚甲基丙烯酰胺,并且可以是丙烯酰胺、甲基丙烯酰胺、丙烯酸酯、甲基丙烯酸酯、丙烯酸或甲基丙烯酸的均聚物或共聚物的取代衍生物。该聚合物可以从由可逆加成断裂聚合(raft)、原子转移自由基聚合(atrp)和阴离子聚合组成的组中合成。提供聚合物的步骤可以包括由选自下组的化合物合成聚合物:n
‑
烷基丙烯酰胺、n,n
‑
二烷基丙烯酰
胺、n
‑
芳基丙烯酰胺、n
‑
烷基甲基丙烯酰胺、n,n
‑
二烷基甲基丙烯酰胺、n
‑
芳香基甲基丙烯酰胺、甲基丙烯酸酯、丙烯酸酯及其功能等同物。
[0832]
聚合物可以是水溶性的。该部分不受化学成分的限制。然而,如果骨架具有相对可再现的尺寸(例如,长度、标记原子的数量、可再生的树枝状大分子特征等),则简化了分析。稳定性、溶解性和无毒性的要求也考虑在内。因此,通过合成策略制备和表征功能性水溶性聚合物,该合成策略沿着主链放置许多官能团加上不同的反应性基团(连接基团),该反应性基团可用于通过连接物和可选的间隔物将聚合物连接到分子(例如,sbp)。聚合物的尺寸可以通过控制聚合反应来控制。通常,聚合物的尺寸被选择为使得聚合物的回转半径(辐射)尽可能小,例如,在2和11纳米之间。igg抗体(示例性sbp)的长度约为10纳米,因此,与sbp的大小相比,过大的聚合物标签可能在空间上干扰sbp与其目标的结合。
[0833]
能够结合至少一个金属原子的金属螯合基团可以包含至少四个乙酸基团。例如,金属螯合基团可以是二乙烯三胺五乙酸酯(dtpa)基团或1,4,7,10
‑‑
四氮杂环十二烷
‑
1,4,7,10
‑
四乙酸(dota)基团。替代基团包括乙二胺四乙酸(edta)和乙二醇
‑
双(β
‑
氨基乙基醚)
‑
n,n,n',n'
‑
四乙酸(egta)。
[0834]
金属螯合基团可以通过酯或酰胺连接到聚合物上。合适的金属螯合聚合物的示例包括可从fluidigm canada公司获得的x8和dm3聚合物。
[0835]
聚合物可以是水溶性的。由于它们的水解稳定性,可以使用n
‑
烷基丙烯酰胺、n
‑
烷基甲基丙烯酰胺和甲基丙烯酸酯或功能等同物。约为1
‑
1000(1
‑
2000个主链原子)的聚合度(dp)包含了大多数感兴趣的聚合物。较大的聚合物在本发明的范围内,具有相同的功能,并且如本领域技术人员所理解的那样是可能的。通常,聚合度在1至10000之间,例如,在5
‑
100、10
‑
250、250
‑
5000、500
‑
2500或500
‑
1000之间。该聚合物可以通过导致相对窄的多分散性的途径进行合成。该聚合物可以通过原子转移自由基聚合(atrp)或可逆加成断裂(raft)聚合来合成,这将导致mw(重均分子量)/mn(数均分子量)的值在1.1至1.2的范围内。另一种策略涉及阴离子聚合,其中,可获得mw/mn约为1.02至1.05的聚合物。这两种方法都允许通过选择引发剂或终止剂来控制端基。这允许合成可以附接连接物的聚合物。可以采用制备在重复单元中含有功能侧基的聚合物的策略,在随后的步骤中,配体的过渡金属单元(例如,ln单元)可以连接到该重复单元上。这个实施例有几个优点。避免了因进行含单体的配体的聚合而引起的复杂问题。
[0836]
为了使侧基之间的电荷排斥最小化,(m
3
)的目标配体应该提供螯合物上的
‑
1的净电荷。
[0837]
可用于本发明的聚合物包括:
[0838]
‑
无规共聚物聚乙烯(poly)(dma
‑
co
‑
nas):通过raft合成75/25摩尔比的n
‑
丙烯酰氧基琥珀酰亚胺(nas)与n,n
‑
二甲基丙烯酰胺(dma)的无规共聚物,转化率高,在5000
‑
130000范围内的优异的摩尔质量控制,mw/mn≈1.1,这在rel
ó
gio等人(2004)(polymer,45,8639
‑
49)中有报道。活性nhs酯与带有活性氨基的金属螯合基团反应,以产生通过raft聚合合成的金属螯合共聚物;
[0839]
‑
聚(nmas):nmas可由atrp聚合,获得平均摩尔质量为12
‑
40kda、mw/mn约为1.1的聚合物(例如,见godwin等人,2001年;angew.chem.int.ed,40:594
‑
97);
[0840]
‑
聚(maa):聚甲基丙烯酸(pmaa)可以通过其叔丁基或三甲基硅烷基(tms)酯的阴
离子聚合来制备;
[0841]
‑
聚(dmaema):聚(甲基丙烯酸二甲氨基乙酯)(pdmaema)可由atrp制备(参见wang等人,2004,j.am.chem.soc,126,7784
‑
85)。这是一种众所周知的聚合物,其制备方便,平均mn值为2
‑
35kda,mw/mn约为1.2。这种聚合物也可以通过阴离子聚合合成,具有较窄的粒径分布;
[0842]
‑
聚丙烯酰胺或聚甲基丙烯酰胺。
[0843]
金属螯合基团可以通过本领域技术人员已知的方法连接到聚合物上,例如,侧基可以通过酯或酰胺连接。例如,对于基于甲基丙烯酸酯的聚合物,金属螯合基团可以首先通过聚合物与乙二胺在甲醇中的反应连接到聚合物主链上,随后在碱性条件下在碳酸盐缓冲液中与dtpa酸酐反应。
[0844]
第二种方法是生成可以作为质量标签的纳米粒子。产生这种质量标签的第一途径是使用涂有聚合物的纳米级金属粒子。在此处,通过聚合物使金属与环境隔离并隔绝,并且当聚合物壳可以例如通过包含到聚合物壳中的官能团进行反应时金属不发生反应。官能团可以与连接物部件(可选地包含间隔物)反应,以附接点击化学试剂,因此允许这种类型的质量标签以简单、模块化的方式插入到上述合成策略中。
[0845]
嫁接到和从其嫁接是纳米粒子周围生成聚合物刷的两种主要机制。在嫁接到时,聚合物是单独合成的,因此合成不受保持纳米粒子胶体稳定的需要的限制。在此处,可逆加成断裂链转移(raft)合成由于单体种类繁多和易于官能化而表现优异。链转移剂(cta)可以容易地用作官能团本身,可以使用官能化的cta,或者聚合物链可以后官能化。化学反应或物理吸附用于将聚合物附着到纳米粒子上。嫁接到的一个缺点是通常较低的嫁接密度,这是由于卷曲的聚合物链在附着到粒子表面期间的空间排斥。所有的嫁接到方法都有一个缺点,即需要严格的处理来从官能化的纳米复合材料粒子中除去过量的游离配体。这通常通过选择性沉淀和离心来实现。在从其嫁接的方法中,分子(例如,用于原子转移自由基聚合(atrp)的引发剂或用于(raft)聚合的cta)固定在粒子表面。这种方法的缺点是发展了新的引发剂偶联反应。此外,与嫁接到相反,粒子必须在聚合条件下胶体稳定。
[0846]
产生质量标签的另一种方法是通过使用掺杂珠。螯合镧系元素(或其他金属)离子可用于细乳液聚合,以产生聚合物粒子,螯合镧系元素离子嵌入聚合物中。如本领域技术人员所知,以这种方式选择螯合基团,使得金属螯合物在水中的溶解度可以忽略不计,但在用于细乳液聚合的单体中具有合理的溶解度。可以使用的典型单体是苯乙烯、甲基苯乙烯、各种丙烯酸酯和甲基丙烯酸酯以及本领域技术人员已知的其它单体。为了机械强度,金属标记的粒子具有高于室温的玻璃转变温度(tg)。在一些情况下,使用核壳粒子,其中,通过细乳液聚合制备的含金属粒子用作种子乳液聚合的种子粒子,以控制表面官能度的性质。可以通过为第二阶段聚合选择合适的单体来引入表面官能度。此外,丙烯酸酯(和可能的甲基丙烯酸酯)聚合物优于聚苯乙烯粒子,因为酯基团可以结合或稳定镧系元素复合物上不满意的配体位点。制造这种掺杂珠的示例性方法是:(a)在溶剂混合物中混合至少一种含标记原子的复合物,该溶剂混合物包含至少一种含标记原子的复合物可溶于其中的至少一种有机单体(在一个实施例中,例如,苯乙烯和/或甲基丙烯酸甲酯)和所述有机单体和所述至少一种含标记原子的复合物不太可溶于其中的至少一种不同的溶剂,(b)将步骤(a)的混合物乳化足以提供均匀乳液的一段时间;(c)引发聚合并继续反应,直到大部分单体转化成聚合
物;以及(d)将步骤(c)的产物孵化一段时间,该时间足以获得聚合物粒子的胶乳悬浮液,其中,至少一种含标记原子的复合物包含在粒子中或粒子上,其中,选择所述至少一种含标记原子的复合物,使得在轮询聚合物质量标签时,从所述至少一种标记原子获得不同的质量信号。通过使用包含不同标记原子的两种或多种复合物,可以制备包含两种或多种不同标记原子的掺杂珠。此外,控制包含不同标记原子的复合物的比例,允许产生具有不同标记原子比例的掺杂珠。通过使用多个标记原子,在不同的无线电设备中,可区别地识别的质量标签的数量增加了。在核壳珠中,这可以通过将第一含标记原子的复合物掺入核中,并将第二含标记原子的复合物掺入壳中来实现。
[0847]
另一种方法是产生一种聚合物,该聚合物在聚合物主链中包括标记原子,而不是作为配位金属配体。例如,carerra和seferos(macromolecules 2015,48,297
‑
308)公开了在聚合物的主链中包含碲。其他含有能作为标记原子的原子的聚合物,包括锡、锑和铋的聚合物。这些分子在priegert等人,2016(chem.soc.rev.,45,922
‑
953)中进行了讨论。
[0848]
因此,质量标签可以包括至少两种成分:标记原子和聚合物,该聚合物螯合、包含或者掺杂有标记原子。此外,质量标签包括附着基团(当不与sbp偶联时),其在符合上述讨论的点击化学反应中发生两种成分反应后形成质量标签和sbp之间的化学连接物的一部分。
[0849]
聚多巴胺涂层可用作将sbp附着到例如掺杂珠或纳米粒子上的另一种方式。给定聚多巴胺的官能度范围,通过例如sbp上的胺或巯基基团(例如,抗体)的反应,sbp可以与由pda涂覆的珠或粒子形成的质量标签偶联。或者,pda上的官能团可以与试剂(例如,双功能连接物)反应,该双功能连接物进而引入其他的官能团,用于与sbp反应。在某些情况下,连接物可以包含间隔物,如下所述。这些间隔物增加了质量标签和sbp之间的距离,最小化了sbp的空间位阻。因此,本发明包括质量标签的sbp,其包括sbp和包含聚多巴胺的质量标签,其中,聚多巴胺包括sbp和质量标签之间的连接子的至少部分。纳米粒子和珠(特别是聚多巴胺涂覆的纳米粒子和珠)可用于信号增强,以检测低丰度目标,因为它们可具有数千个金属原子,并且可具有相同亲和试剂的多个拷贝。亲和试剂可以是二次抗体,可以进一步增强信号。
[0850]
标记原子
[0851]
可与本公开一起使用的标记原子包括可通过ms或oes检测到的并且在未标记的组织样本中基本上不存在的任何物种。因此,例如,
12
c原子不适合作为标记原子,因为它们是天然丰富的,而
11
c理论上可以用于ms,因为它是一种人造同位素,不是天然存在的。通常,标记原子是金属。然而,在优选实施例中,标记原子是过渡金属,例如,稀土金属(15种镧系元素,加上钪和钇)。这17种元素(可以用oes和ms区分)提供了很多不同的同位素(可以用ms容易区分)。这些元素以富集同位素的形式广泛存在,例如,钐有6种稳定同位素,钕有7种稳定同位素,所有这些元素都以富集形式存在。这15种镧系元素提供了具有非冗余唯一质量的至少37种同位素。适合用作标记原子的元素的示例包括镧(la)、铈(ce)、镨(pr)、钕(nd)、钷(pm)、钐(sm)、铕(eu)、钆(gd)、铽(tb)、镝(dy)、钬(ho)、铒(er)、铥(tm)、镱(yb)、镥(lu)、钪(sc)和钇(y)。除稀土金属外,其他金属原子也适用于检测,例如,金(au)、铂(pt)、铱(ir)、铑(rh)、铋(bi)等。放射性同位素的使用不是优选的,因为它们不太方便处理并且不稳定,例如,pm不是镧系元素中优选的标记原子。
[0852]
为了便于飞行时间(tof)分析(如本文所述),使用原子质量在80
‑
250范围内(例如,在80
‑
210范围内,或在100
‑
200范围内)的标记原子是有帮助的。该范围包括所有镧系元素,但不包括sc和y。100
‑
200的范围允许通过使用不同的标记原子进行理论上的101
‑
plex分析,同时利用tof ms的高光谱扫描速率。如上所述,通过选择其质量位于在未标记样本中看到的窗口之上的标记原子(例如,在100
‑
200的范围内),tof检测可用于在生物学显著水平上提供快速成像。
[0853]
根据所使用的质量标签(以及每个质量标签的标记原子的数量)和附着到每个sbp的质量标签的数量,可以将不同数量的标记原子附着到单个sbp元件上。当更多的标记原子附着在任何sbp元件上时,可以获得更高的灵敏度。例如,大于10、20、30、40、50、60、70、80、90或100个标记原子可以附着到sbp元件,例如,高达10000个标记原子,例如,5
‑
100、10
‑
250、250
‑
5000、500
‑
2500或500
‑
1000个。如上所述,可以使用含有多个单体单元的单分散聚合物,每个单体单元含有螯合剂,例如,二亚乙基三胺五乙酸(dtpa)或dota。例如,dtpa以大约10
‑6m的解离常数结合3 镧系离子。这些聚合物可以终止于硫醇,该硫醇可以用于经由与马来酰亚胺的反应附着到sbp,从而附着与上述讨论一致的点击化学反应性。其他官能团也可用于这些聚合物的偶联,例如,胺反应性基团,例如,n
‑
羟基琥珀酰亚胺酯,或对羧基或抗体糖基化反应的基团。任何数量的聚合物可以结合到每个sbp。可使用的聚合物的具体示例包括直链(“x8”)聚合物或第三代树枝状(“dn3”)聚合物,两者均可作为maxpar
tm
试剂获得。金属纳米粒子的使用也可以用于增加标签中的原子数量,如上所述。
[0854]
在一些实施例中,质量标签中的所有标记原子具有相同的原子质量。或者,质量标签可以包括具有不同原子质量的标记原子。因此,在一些情况下,标记的样本可以用一系列质量标签的sbp标记,每个sbp仅包含单一类型的标记原子(其中,每个sbp结合其同源目标,因此每种质量标签在样本上定位于特定的例如抗原)。或者,在某些情况下,标记的样本可以用一系列质量标签的sbp标记,每个sbp包含标记原子的混合物。在某些情况下,用于标记样本的质量标签的sbp可以包括具有单个标记原子质量标签的sbp和在其质量标签中标记原子的混合物。
[0855]
间隔物
[0856]
如上所述,在某些情况下,sbp通过包含间隔物的连接物与质量标签偶联。在sbp和点击化学试剂之间可能有间隔物(例如,在sbp和应变环炔(或叠氮化物);应变环烯烃(或四嗪)等之间)。在质量标签和点击化学试剂之间(例如,在质量标签和叠氮化物(或应变环炔);四嗪(或应变环烯)等之间)可以有间隔物。在某些情况下,在snp和点击化学试剂之间以及点击化学试剂和质量标签之间可能存在间隔物。
[0857]
间隔物可以是聚乙二醇(peg)间隔物、聚(n
‑
乙烯基吡咯烷酮)(pvp)间隔物、聚甘油(pg)间隔物、聚(n
‑
(2
‑
羟丙基)甲基丙烯酰胺)间隔物、或聚噁唑啉(poz,例如,聚甲基噁唑啉、聚乙基噁唑啉或聚丙基噁唑啉)或c5
‑
c20非环状烷基间隔物。例如,间隔物可以是具有3个或更多、4个或更多、5个或更多、6个或更多、7个或更多、8个或更多、9个或更多、10个或更多、11个或更多、12个或更多、15个或更多或20个或更多的eg(乙二醇)单元的peg间隔物。peg连接物可以具有3至12个eg单元,4至10个,或者可以具有4、5、6、7、8、9或10个eg单元。连接物可以包括胱胺或其衍生物,可以包括一个或多个二硫化物基团,或者可以是本领域技术人员已知的任何其它合适的连接物。
[0858]
间隔物可能有利于最小化与sbp接合的质量标签的空间效应。亲水性间隔物(例如,基于peg的间隔物)也可以用于提高质量标签的sbp的溶解度,并用于防止聚集。
[0859]
sbp
[0860]
质谱流式细胞术(包括成像质谱流式细胞术)是基于特异性结合对的元件之间的特异性结合原理。质量标签连接到特定的结合对元件,这将质量标签定位到目标/分析物,即该对的另一元件。然而,特异性结合并不要求只与一种分子物种结合,而排除其他分子物种。相反,定义了结合不是非特异性的,即不是随机相互作用。因此,与多个目标结合的sbp的一个示例是识别许多不同蛋白质之间共有的表位的抗体。在此处,结合是特异性的,由抗体的cdr介导,但抗体可以检测到多种不同的蛋白质。共同表位可以是天然存在的,或者共同表位可以是人工标记,例如,flag标记。类似地,对于核酸来说,限定序列的核酸可能不专有地与完全互补的序列结合,而是在使用不同严格性的杂交条件下,可以引入不同的错配容限,这是本领域技术人员所理解的。然而,这种杂交不是非特异性的,因为它是由sbp核酸和目标分析物之间的同源性介导的。同样,配体可以特定地结合至多种受体,一个简单的示例是tnfα,其结合至tnfr1和tnfr2。
[0861]
sbp可以包含以下任何一种:核酸双链体;抗体/抗原复合物;受体/配体对;或者适配体/目标对。因此,标记原子可以附着到核酸探针上,然后与组织样本接触,使得探针可以与其中的互补核酸杂交,例如,以形成dna/dna双链体、dna/rna双链体或rna/rna双链体。类似地,标记原子可以附着在抗体上,然后抗体与组织样本接触,使其能够与其抗原结合。标记原子可以附着在配体上,然后配体与组织样本接触,使其能够与其受体结合。标记原子可以附着在适配体配体上,然后适配体配体与组织样本接触,使其能够与其目标结合。因此,标记的sbp元件可用于检测样本中的多种目标,包括dna序列、rna序列、蛋白质、糖、脂质或代谢物。
[0862]
因此,质量标签的sbp可以是蛋白质或肽或多核苷酸或寡核苷酸。
[0863]
蛋白sbp的示例包括抗体或其抗原结合片段、单克隆抗体、多克隆抗体、双特异性抗体、多特异性抗体、抗体融合蛋白、scfv、抗体模拟物、抗生物素蛋白、链霉抗生物素蛋白、中性抗生物素蛋白、生物素或其组合,其中,可选地,抗体模拟物包括纳米体、亲和体、亲和素、亲和多聚体、附着素、α体、抗运载蛋白、亲和多聚体、darpin、fynomer、kunitz域肽、单体或其任何组合、受体(例如,受体
‑
fc融合体)、配体(例如,配体
‑
fc融合体)、外源凝集素(例如,凝集素,例如小麦胚芽凝集素)。
[0864]
该肽可以是线性肽,或者是环状肽,例如,双环肽。可以使用的肽的一个示例是鬼笔环肽。
[0865]
多核苷酸或寡核苷酸通常是指含有通过3'
‑
5'磷酸二酯键连接的脱氧核糖核苷酸或核糖核苷酸的单链或双链核苷酸聚合物以及多核苷酸类似物。核酸分子包括但不限于dna、rna和cdna。多核苷酸类似物可以具有不同于天然多核苷酸中发现的标准磷酸二酯键的主链,以及可选地,具有修饰的糖部分或除核糖或脱氧核糖之外的部分。多核苷酸类似物包含能够通过watson
‑
crick碱基配对与标准多核苷酸碱基形成氢键的碱基,其中,类似物主链以允许寡核苷酸类似物分子和标准多核苷酸中的碱基之间以序列特异性方式形成这种氢键的方式提供碱基。多核苷酸类似物的示例包括但不限于异种核酸(xna)、桥接核酸(bna)、乙二醇核酸(gna)、肽核酸(pnas)、ypna、吗啉多核苷酸、锁定核酸(lna)、苏糖核酸
(tna)、2'
‑0‑
甲基多核苷酸、2'
‑0‑
烷基核糖基取代的多核苷酸、硫代磷酸多核苷酸和硼磷酸多核苷酸。多核苷酸类似物可以具有嘌呤或嘧啶类似物,包括例如7
‑
去氮嘌呤类似物、8
‑
卤代嘌呤类似物、5
‑
卤代嘧啶类似物或可以与任何碱基配对的通用碱基类似物,包括次黄嘌呤、硝基唑、异羧基苯乙烯类似物、唑甲酰胺和芳香三唑类似物或具有额外官能性的碱基类似物,例如,用于亲和结合的生物素部分。
[0866]
抗体sbp元件
[0867]
在典型的实施例中,标记的sbp元件是抗体。抗体的标记可以通过一个或多个标记原子结合分子与抗体的接合来实现,通过使用例如nhs
‑
胺化学、巯基
‑
马来酰亚胺化学或点击化学(例如,应变炔烃和叠氮化物、应变炔烃和硝酮、应变烯烃和四嗪等)来附着质量标签。识别对成像有用的细胞蛋白质的抗体已经广泛用于ihc应用,并且通过使用标记原子代替当前的标记技术(例如,荧光),这些已知的抗体可以容易地适用于本文公开的方法,但是具有增加多重能力的益处。抗体可以识别细胞表面的目标或细胞内的目标。抗体可以识别多种目标,例如,它们可以特定地识别各个蛋白质,或者可以识别共享共同表位的多个相关蛋白质,或者可以识别蛋白质的特定翻译后修饰(例如,区分兴趣蛋白质上的酪氨酸和磷酪氨酸,区分赖氨酸和乙酰赖氨酸,检测泛素化等)。在与目标结合后,可以检测与抗体结合的标记原子,以揭示该目标在样本中的位置。
[0868]
被标记的sbp元件通常会与样本中的目标sbp元件直接相互作用。然而,在一些实施例中,标记的sbp元件可以与目标sbp元件间接相互作用,例如,一次抗体可以结合到目标sbp元件,然后标记的二次抗体可以以夹心测定的方式结合到一次抗体。然而,该方法通常依赖于直接相互作用,因为这可以更容易地实现,并且允许更高的多重。然而,在这两种情况下,样本与能结合至样本中的目标sbp元件的sbp元件接触,并且在稍后阶段检测到附着到目标sbp元件的标签。
[0869]
核酸sbp和标记方法学修改
[0870]
rna是另一种生物分子,本文公开的方法和设备能够以特定的、灵敏的和定量的(如果需要)方式检测rna。以与上述分析蛋白质相同的方式,可以通过使用用元素标签标记的sbp元件来检测rna(例如,如上所述的互补序列的多核苷酸或寡核苷酸,包括互补序列的锁定核酸(lna)分子、互补序列的肽核酸(pna)分子、互补序列的质粒dna、互补序列的扩增dna、互补序列的rna片段和互补序列的基因组dna片段),元素标签被特定地结合至rna。rna不仅包括成熟的mrna,还包括rna加工中间体和新生的前mrna转录物。
[0871]
在某些实施例中,使用要求保护的发明的方法来检测rna和蛋白质。
[0872]
为了检测rna,可以使用本文所述的方法和设备制备本文所述的生物样本中的细胞,以用于分析rna和蛋白质含量。在某些方面,在杂交步骤之前细胞被固定和渗透。细胞可以以固定的和/或渗透的方式提供。细胞可以用交联固定剂固定,例如,甲醛、戊二醛。替代地或另外,可以使用沉淀固定剂,例如,乙醇、甲醇或丙酮,来固定细胞。细胞可以被去污剂渗透,例如,聚乙二醇(例如,triton x
‑
100)、聚氧乙烯(20)脱水山梨醇单月桂酸酯(tween
‑
20)、皂苷(一组两亲性糖苷)或化学物质,例如,甲醇或丙酮。在某些情况下,可以用相同的试剂或试剂组进行固定和渗透。jamur等人在“permeabilization of cell membranes”(methods mol.biol.,2010)中讨论了固定和渗透技术。
[0873]
以前已经使用荧光团标记的寡核苷酸探针进行了细胞中目标核酸的检测或“原位
杂交”(ish)。如本文所述,质量标签的寡核苷酸与电离和质谱耦合,可用于检测细胞中的目标核酸。原位杂交的方法在本领域是已知的(参见zenobi等人,“single
‑
cell metabolomics:analytical and biological perspectives”,science vol.342,no.6163,2013)。也在美国专利号5,225,326和美国公开号2010/0092972和2013/0164750中描述杂交方案,这些通过引用结合于本文中。
[0874]
在杂交前,悬浮或固定在固体支持物上的细胞可以如前所述进行固定和渗透。渗透可以允许细胞保留目标核酸,同时允许目标杂交核苷酸、扩增寡核苷酸和/或质量标签的寡核苷酸进入细胞。可以在任何杂交步骤后洗涤细胞,例如,在目标杂交寡核苷酸与核酸目标杂交后,在扩增寡核苷酸杂交后,和/或在质量标签的寡核苷酸杂交后。
[0875]
为了便于操作,细胞可以在方法的所有或大部分步骤中悬浮。然而,该方法也适用于固体组织样本(例如,组织切片)中的细胞和/或固定在固体支持物(例如,载玻片或其他表面)上的细胞。因此,细胞有时可以在样本中和杂交步骤中是悬浮的。其他时候,细胞在杂交过程中被固定在固体支持物上。
[0876]
目标核酸包括任何感兴趣的核酸,并且在细胞中具有足够的丰度,以通过本发明的方法检测。目标核酸可以是rna,其多个拷贝存在于细胞内。例如,细胞中可以存在10个或更多、20个或更多、50个或更多、100个或更多、200个或更多、500个或更多、或1000个或更多的目标rna拷贝。目标rna可以是信使na(mrna)、核糖体rna(rrna)、转运rna(trna)、小核rna(snrna)、小干扰rna(sirna)、长非编码rna(incrna)或本领域已知的任何其他类型的rna。目标rna的长度可以是20个核苷酸以上、30个核苷酸以上、40个核苷酸以上、50个核苷酸以上、100个核苷酸以上、200个核苷酸以上、500个核苷酸以上、1000个核苷酸以上、20到1000个核苷酸之间、20到500个核苷酸之间、40到200个核苷酸之间等。
[0877]
在某些实施例中,质量标签的寡核苷酸可以直接与目标核酸序列杂交。然而,额外寡核苷酸的杂交可以提高特异性和/或信号放大。
[0878]
在某些实施例中,两种或多种目标杂交寡核苷酸可以与目标核酸上的近侧区域杂交,并且可以一起在杂交方案中提供杂交额外寡核苷酸的位点。
[0879]
在某些实施例中,质量标签的寡核苷酸可以直接与两种或多种目标杂交寡核苷酸杂交。在其他实施例中,可以同时或连续添加一种或多种扩增寡核苷酸,以使两种或多种目标杂交寡核苷酸杂交,并提供质量标签的寡核苷酸可以结合至的多个杂交位点。可以提供一种或多种扩增寡核苷酸(具有或没有质量标签的寡核苷酸),作为能够与两种或多种目标杂交寡核苷酸杂交的多聚体。
[0880]
虽然使用两种或多于两种的目标杂交寡核苷酸提高了特异性,但使用扩增寡核苷酸增加了信号。两个目标杂交寡核苷酸与细胞中的目标rna杂交。这两种目标杂交寡核苷酸提供了扩增寡核苷酸可以结合至的杂交位点。扩增寡核苷酸的杂交和/或随后的洗涤可以在允许与两个邻近的目标杂交寡核苷酸杂交但是高于扩增寡核苷酸与仅一个目标杂交寡核苷酸杂交的熔化温度的温度下进行。第一扩增寡核苷酸提供多个杂交位点,第二扩增寡核苷酸可以结合到这些位点上,形成分支样式。质量标签的寡核苷酸可以结合到由第二扩增核苷酸提供的多个杂交位点。这些扩增寡核苷酸(带有或不带有质量标签的寡核苷酸)在本文统称为“多聚体”。因此,术语“扩增寡核苷酸”包括提供相同结合位点的多个拷贝的寡核苷酸,其他的寡核苷酸可以退火到该结合位点。通过增加其他寡核苷酸的结合位点的数
量,可以发现目标的标记的最终数量增加。因此,多个标记的寡核苷酸与单个目标rna间接杂交。这使得能够通过增加每个rna所用元素的可检测原子的数量来检测低拷贝数的rna。
[0881]
进行这种扩增的一种特定方法包括使用高级细胞诊断学的方法,下面将更详细地讨论。另一种选择是使用一种适应flowrna方法(affymetrix ebioscience)的方法。该分析基于带有分支dna(bdna)信号扩增的寡核苷酸对探针设计。目录中有超过4000个探针,或者可以请求定制组而无需额外花费。根据前面的段落,该方法运行以将目标杂交寡核苷酸与目标杂交,随后形成包含第一扩增寡核苷酸(在方法中称为前扩增寡核苷酸)的分支结构,以形成多个第二扩增寡核苷酸可以退火的茎(在方法中简称为扩增寡核苷酸)。然后,多个质量标签的寡核苷酸可以结合。
[0882]
rna信号的另一种扩增方法依赖于滚环扩增方法(rca)。有各种方法可以解释为什么这个扩增系统可以被引入到扩增过程中。在第一种情况下,第一核酸用作杂交核酸,其中,第一核酸是环状的。第一核酸可以是单股的,也可以是双股的。它包含与目标rna互补的序列。在第一核酸与目标rna杂交后,与第一核酸互补的引物与第一核酸杂交,并用于使用聚合酶和核酸用于引物延伸,通常是外源添加到样本中。然而,在某些情况下,当第一核酸被添加到样本中时,它可能已经与用于延伸的引物杂交。由于第一核酸是环状的,一旦引物延伸完成了一轮完整的复制,聚合酶可以置换引物并继续延伸(即没有5
’→3’
外显子酶活性),产生第一核酸的互补的进一步连接和进一步成链的拷贝,从而扩增该核酸序列。因此,包含如上所述的元素标签(rna或dna,或lna或pna等)的寡核苷酸可以与第一核酸的互补序列的链状拷贝杂交。因此,rna信号的扩增程度可以由分配给环状核酸扩增步骤的时间长度来控制。
[0883]
在rca的另一应用中,例如与目标rna杂交的第一寡核苷酸并非是圆形的,它可以是线性的,并且包含具有与其目标互补的序列的第一部分和用户选择的第二部分。然后,具有与该第二部分同源的序列的环状rca模板可以与该第一寡核苷酸杂交,并如上所述进行rca扩增。使用例如具有目标特异性部分和用户选择部分的第一寡核苷酸是因为可以选择用户选择的部分,以便在各种不同的探针之间是共同的。这是试剂高效的,因为相同的后续扩增试剂可用于检测不同目标的一系列反应中。然而,如本领域技术人员所理解的,当采用这种策略时,对于在多重反应中特定rna的单独检测,与目标rna杂交的每个第一核酸将需要具有唯一的第二序列,并且进而每个环状核酸应该包含能够被标记的寡核苷酸杂交的唯一序列。以这种方式,可以特定性地扩增和检测来自每个目标rna的信号。
[0884]
技术人员将知道实现rca分析的其他配置。在一些情况下,为了防止例如第一寡核苷酸在随后的扩增和杂交步骤中从目标分离,例如第一寡核苷酸可以在杂交后被固定(例如,通过甲醛)。
[0885]
此外,杂交链式反应(hcr)可用于放大(amplify,扩增)rna信号(例如,参见choi等人2010,nat.biotech,28:1208
‑
1210)。choi解释说,hcr放大器由两个核酸发夹物种组成,在没有引发剂的情况下,它们不会聚合。每个hcr发夹由输入域和输出域组成,输入域有暴露的单股趾,输出域有隐藏在折叠发夹中的单股趾。引发剂与两个发夹中的一个的输入域杂交,打开发夹,以暴露其输出域。这个(先前隐藏的)输出域与第二个发夹的输入域杂交,打开了那个发夹,暴露出序列与引发剂相同的输出域。引发剂序列的再生为交替的第一发
夹聚合和第二发夹聚合步骤的链式反应提供了基础,导致形成有缺口的双股“聚合物”。在应用本文公开的方法和设备时,第一发夹和第二发夹中的任一个或两个可以用元素标签来标记。由于扩增程序依赖于特定序列的输出域,使用不同发夹组的各种离散扩增反应可以在同一过程中独立进行。因此,这种扩增也允许在多种rna物种的多重分析中进行扩增。正如choi指出的,hcr是等温触发的自组装过程。因此,发夹应该在原位进行触发自组装之前穿透样本,这表明样本穿透深和高信号背景比的可能性。
[0886]
杂交可以包括使细胞与一种或多种寡核苷酸接触,例如,目标杂交寡核苷酸、扩增寡核苷酸和/或质量标签的寡核苷酸,并提供可以发生杂交的条件。杂交可以在缓冲溶液中进行,例如,生理盐水
‑
柠檬酸钠(scc)缓冲液、磷酸盐缓冲盐水(pbs)、生理盐水
‑
磷酸钠
‑
edta(sspe)缓冲液、tnt缓冲液(具有tris
‑
hcl、氯化钠和tween 20)或任何其他合适的缓冲液。杂交可以在一种或多种寡核苷酸杂交的熔融温度左右或以下的温度下进行。
[0887]
可以通过在杂交后进行一次或多次洗涤来提高特异性,以便除去未结合的寡核苷酸。提高洗涤的严格性可以提高特异性,但会降低整体信号。可以通过增加或减少洗涤缓冲液的浓度、增加温度和/或增加洗涤的持续时间来增加洗涤的严格性。rnase抑制剂可用于任何或所有杂交孵育和随后的洗涤。
[0888]
第一组杂交探针(包括一个或多个目标杂交寡核苷酸、扩增寡核苷酸和/或质量标签的寡核苷酸)可用于标记第一目标核酸。额外的杂交探针组可用于标记额外的目标核酸。每组杂交探针可以特定用于不同的目标核酸。可以设计、杂交和洗涤额外的杂交探针组,以减少或防止不同组的寡核苷酸之间的杂交。此外,每组的质量标签寡核苷酸可以提供唯一的信号。因此,多组寡核苷酸可用于检测2、3、5、10、15、20或更多不同的核酸目标。
[0889]
有时,检测到的不同核酸是单个基因的剪接变体。质量标签的寡核苷酸可以被设计成在外显子序列内杂交(直接或通过下面解释的其它寡核苷酸间接杂交),以检测包含该外显子的所有转录物,或者可以被设计成桥接剪接接头,以检测特定的变体(例如,如果基因具有三个外显子和两个剪接变体,外显子1
‑2‑
3和外显子1
‑
3,则这两者可以区分:变体1
‑2‑
3可以通过与外显子2杂交而被特异性检测,变体1
‑
3可以通过与外显子1
‑
3接头杂交而被特异性检测。
[0890]
组织化学染色剂
[0891]
具有一个或多个固有金属原子的组织化学染色剂可以与本文所述的其他试剂和使用方法结合。例如,组织化学染色剂可以与含金属的药物、金属标记的抗体和/或积累的重金属共定位(例如,以细胞或亚细胞分辨率)。在某些方面,可以以低于用于其他成像方法(例如,荧光显微镜、光学显微镜或电子显微镜)的浓度,使用一种或多种组织化学染色剂(例如,小于一半、四分之一、十分之一等)。
[0892]
为了可视化和识别结构,组织学染色剂的宽光谱和指示剂是可用的,并且被很好地表征。含金属的染色剂有可能影响病理学家对成像质谱流式细胞术的接受。众所周知,某些含金属的着色剂揭示出细胞成分,并适用于本发明。此外,良好定义的染色剂可用于数字图像分析,为特征识别算法提供对比度。这些特征对于成像质谱流式细胞术的发展具有重要的战略意义。
[0893]
通常,组织切片的形态结构可以使用亲和产品(例如,抗体)进行对比。与使用组织化学染色剂相比,它们价格昂贵并且需要使用含金属标签的额外标记程序。在使用标记有
可用镧系元素同位素的抗体的成像质谱流式细胞术的开创性工作中,使用这种方法,从而消耗功能抗体的质量(例如,金属)标签,以回答生物学问题。
[0894]
本发明扩展了可用同位素的目录,包括诸如ag、au、ru、w、mo、hf、zr等元素(包括诸如用于识别粘液基质的钌红、用于识别胶原纤维的三色染色剂、作为细胞复染剂的四氧化锇等化合物)。银染用于核型分析。硝酸银染色核仁组织区(nor)相关蛋白,产生黑色区域,银沉积在该区域,并指示nor内rrna基因的活性。适应于imc可能需要修改方案(例如,使用高锰酸钾和1%的银浓度进行氧化),以使用更低浓度的银溶液,例如,低于0.5%、0.01%或0.05%的银溶液。
[0895]
自动金相放大技术已经发展成为组织化学中的一个重要工具。许多内源性和毒性重金属形成可通过与银离子反应自动催化放大的硫化物或硒化物纳米晶体。更大的银纳米团簇可以很容易地通过imc可视化。目前,已经建立了用于zn
‑
s/se纳米晶体的银放大检测以及通过银
‑
硒纳米晶体的形成来检测硒的稳健方案。此外,市售量子点(检测cd)也具有自催化活性,并且可用作组织化学标记。
[0896]
本发明的方面可包括组织化学染色剂及其在元素质谱成像中的用途。在本发明中可以使用通过元素质谱法可分辨的任何组织化学染色剂。在某些方面,组织化学染色剂包括质量大于用于对样本成像的元素质谱仪的截止值的一个或多个原子,例如,大于60amu、80amu、100amu或120amu。例如,组织化学染色剂可包括如本文所述的金属标签(例如,金属原子)。金属原子可以螯合到组织化学染色剂,或者共价结合到组织化学染色剂的化学结构中。在某些方面,组织化学染色剂可以是有机分子。组织化学染色剂可以是极性的、疏水性的(例如,亲脂性的)、离子性的或者可以包含具有不同性质的基团。在某些方面,组织化学染色剂可以包含多于一种的化学物质。
[0897]
组织化学染色剂包括小于2000、1500、1000、800、600、400或200amu的小分子。组织化学染色剂可以通过共价或非共价(例如,离子或疏水)相互作用与样本结合。组织化学染色剂可以提供对比度,以分辨生物样本的形态,例如,帮助识别单个细胞、细胞内结构和/或细胞外结构。组织化学染色剂可分辨的细胞内结构包括细胞膜、细胞质、细胞核、高尔基体、er、线粒体和其他细胞器。组织化学染色剂可能对一种生物分子有亲和力,例如,核酸、蛋白质、脂质、磷脂或碳水化合物。在某些方面,组织化学染色剂可以结合除dna以外的分子。合适的组织化学染色剂还包括结合细胞外结构(例如,细胞外基质的结构)的染色剂,包括基质(例如,粘膜基质)、基膜、间质基质、蛋白质(例如,胶原或弹性蛋白)、蛋白聚糖、非蛋白聚糖多糖、细胞外小泡、纤连蛋白、层粘连蛋白等。
[0898]
在某些方面,组织化学染色剂和/或代谢探针可以指示细胞或组织的状态。例如,组织化学染色剂可能包括重要的染色剂,例如,顺铂、曙红和碘化丙锭。其他组织化学染色剂可以染色以用于缺氧,例如,只能在缺氧条件下结合或沉积。探针(例如,碘脱氧尿苷(idu)或其衍生物)可以染色以用于细胞增殖。在某些方面,组织化学染色剂可能不能指示细胞或组织的状态。检测细胞状态(例如,生存力、缺氧和/或细胞增殖)但在体内给药(例如,对活的动物或细胞培养物)的探针可用于任何本方法,但不符合组织化学染色剂的条件。
[0899]
组织化学染色剂可对一类生物分子具有亲和力,例如,核酸(例如,dna和/或rna)、蛋白质、脂类、磷脂、碳水化合物(例如,糖类,例如,单糖或二糖或多元醇;低聚糖;和/或多
糖如淀粉或糖原)、糖蛋白和/或糖脂。在某些方面,组织化学染色剂可以是复染剂。
[0900]
以下是特定组织化学染色剂的示例及其在本方法中的应用:
[0901]
钌红染色剂作为用于粘液基质检测的含金属染色剂可以如下使用:可以用0.0001
‑
0.5%、0.001
‑
0.05%、小于0.1%、小于0.05%或大约0.0025%的钌红(例如,在4
‑
42℃或大约室温下至少5分钟、至少10分钟、至少30分钟或大约30分钟,)处理免疫染色的组织(例如,去石蜡化的ffpe或冷冻切片)。例如,可以用水或缓冲溶液冲洗生物样本。然后,在通过元素质谱术成像之前,可以干燥组织。
[0902]
磷钨酸(例如,作为三色染色剂)可以用作胶原纤维的含金属染色剂。载玻片上的组织切片(去石蜡ffpe切片或冷冻切片)可以固定在布恩氏液中(例如,在4
‑
42℃或室温左右至少5分钟、至少10分钟、至少30分钟或大约30分钟)。然后可以用0.0001%
‑
0.01%、0.0005%
‑
0.005%或约0.001%的磷酸处理切片(例如,在4
‑
42℃或室温左右至少5分钟、至少10分钟、至少30分钟或约15分钟)。然后,在通过元素质谱术成像之前,可以用水和/或缓冲溶液冲洗样本,并可选地干燥。与通过光(例如,荧光)显微镜成像使用的浓度相比,可以稀释(例如,5倍、10倍、20倍、50倍或更大稀释)地使用三色染色剂。
[0903]
在一些实施例中,组织化学染色剂是有机分子。在一些实施例中,第二金属共价结合。在一些实施例中,第二金属被螯合。在一些实施例中,组织化学染色剂特定地结合细胞膜。在一些实施例中,组织化学染色剂是四氧化锇。在一些实施例中,组织化学染色剂是亲脂性的。在一些实施例中,组织化学染色剂特定地结合细胞外结构。在一些实施例中,组织化学染色剂特定地结合细胞外胶原。在一些实施例中,组织化学染色剂是包含磷钨酸/磷钼酸的三色染色剂。在一些实施例中,在样本与抗体接触后使用三色染色剂,例如,以比用于光学成像更低的浓度,例如,其中,浓度是三色染色剂的50倍稀释或更高。
[0904]
含金属的药物
[0905]
医药中的金属是药理学中一个令人兴奋的新领域。在金属离子掺入金属蛋白、核酸金属复合物或含金属药物之前,短暂储存金属离子所涉及的细胞结构或金属离子在蛋白质或药物降解时的预期过程知之甚少。解开涉及痕量金属运输、储存和分布的调节机制的重要的第一步表示金属的识别和定量,理想的是在组织、细胞中的天然生理环境中,或者甚至在单个细胞器和亚细胞区室的水平上。组织学研究通常在薄的组织切片上或用培养的细胞进行。
[0906]
许多含金属的药物用于治疗各种疾病,然而对它们的作用机制或生物分布还知之甚少:顺铂、钌咪唑、含mo的茂金属抗癌剂、含w的钨烯、含hf或zr的b
‑
二酮复合物、含au的醋硫葡金、多钼酸盐药物。许多金属复合物用作mri造影剂(gd(lll)螯合物)。对基于金属的抗癌药物的摄取和生物分布的表征对于理解和最小化潜在毒性是至关重要的。
[0907]
药物中存在的某些金属的原子质量在质量流式细胞术的范畴内。具体地,顺铂和其他pt复合物(异丙铂、络铂)广泛用作治疗多种癌症的化疗药物。铂类抗癌药物的肾毒性和骨髓毒性是众所周知的。利用本文所述的方法和试剂,现在可以检查它们在组织切片中的亚细胞定位以及与质量(例如,金属)标记的抗体和/或组织化学染色的共定位。化疗药物可能通过直接的dna损伤、抑制dna损伤修复途径、放射性等对某些细胞(例如,增殖细胞)产生毒性。在某些方面,化疗药物可以通过抗体中间体对准肿瘤。
[0908]
在某些方面,含金属的药物是化疗药物。本方法可以包括在获得生物样本之前,将
含金属的药物提供给活的动物,例如,前述的动物研究模型或人类患者。生物样本可以是例如癌组织的活组织切片或原代细胞。或者,可以将含金属的药物直接添加到生物样本中,该生物样本可以是永生化细胞系或原代细胞。当动物是人类患者时,本发明的方法可以包括基于检测含金属药物的分布来调整包括含金属药物的治疗方案。
[0909]
检测含金属药物的方法步骤可以包括通过元素质谱术对含金属药物进行亚细胞成像,并且可以包括检测含金属药物在细胞内结构(例如,细胞膜、细胞质、细胞核、高尔基体、er、线粒体和其他细胞器)和/或细胞外结构(例如,包括基质、粘膜基质、基底膜、间质、蛋白质(例如,胶原或弹性蛋白)、蛋白聚糖、非蛋白聚糖多糖、细胞外小泡、纤连蛋白、层粘连蛋白等)中的滞留。
[0910]
解析(resolve)于(例如,结合至)一个或多个上述结构的组织化学染色和/或质量(例如,金属)标记的sbp可与含金属的药物共定位,以检测药物在特定细胞内或细胞外结构的滞留。例如,化疗药物(例如,顺铂)可以与结构(例如,胶原)共定位。替代地或另外,药物的定位可能与细胞活力、细胞增殖、缺氧、dna损伤反应或免疫反应的标记物的存在有关。
[0911]
在一些实施例中,含金属的药物包含非内源性金属,例如,其中,非内源性金属是铂、钯、铈、镉、银或金。在某些方面,含金属的药物是顺铂、钌咪唑、含mo的茂金属抗癌剂、含w的钨烯、含hf或zr的b
‑
二酮复合物、含au的醋硫葡金、多钼酸盐药物、含pd的n
‑
肉豆蔻酰基传送酶
‑
1抑制剂(三(二亚苄基丙酮)二钯)或其衍生物中的一种。例如,药物可以包含pt,并且可以是例如顺铂、卡铂、奥沙利铂、异丙铂、络铂或其衍生物。含金属的药物可以包括非内源性金属,例如,铂(pt)、钌(ru)、钼(mo)、钨(w)、铪(hf)、锆(zr)、金(au)、钆(gd)、钯(pd)或其同位素。在组织切片中可以识别用于癌症光热治疗的金化合物(例如,醋硫葡金)和金纳米粒子生物偶联物。
[0912]
多重分析
[0913]
本公开的一个特征是能够检测样本中多个(例如,10个或更多,甚至高达100个或更多)不同目标sbp元件的能力,例如,检测多个不同蛋白质和/或多个不同核酸序列的能力。为了允许对这些目标sbp元件进行不同的检测,它们相应的sbp元件应该携带不同的标记原子,从而可以区分其信号。例如,在检测10种不同蛋白质的情况下,可以使用10种不同的抗体(每种抗体特定用于不同的目标蛋白质),每种抗体都带有唯一的标记,从而可以区分来自不同抗体的信号。在一些实施例中,期望针对单个目标使用多种不同的抗体,例如,识别同一蛋白质上不同表位的抗体。因此,由于这种类型的冗余,方法可能使用比目标更多的抗体。然而,一般来说,本公开将使用多个不同的标记原子来检测多个不同的目标。
[0914]
如果本公开使用多于一种的标记抗体,优选地,抗体对其相应的抗原具有相似的亲和力,因为这有助于确保检测到的标记原子的数量和组织样本中目标抗原的丰度之间的关系在不同的sbp之间更加一致(特别是在高扫描频率下)。类似地,如果各种抗体的标记具有相同的效率,则是优选的,使得每种抗体携带相当数量的标记原子。
[0915]
在某些情况下,sbp可能携带荧光标记和元素标签。然后,样本的荧光可以用于确定样本的区域,例如,组织切片,包括感兴趣的材料,然后可以对该材料进行采样,以检测标记原子。例如,荧光标记可以与结合至癌细胞上的大量抗原的抗体偶联,然后可以对准任何荧光细胞,以确定与标记原子偶联的sbp附近的其他细胞蛋白质的表达。
[0916]
如果目标sbp元件位于细胞内,则在样本与标记物接触之前或期间,通常需要渗透
细胞膜。例如,当目标是dna序列但标记的sbp元件不能穿透活细胞的膜时,组织样本的细胞可以被固定和渗透。被标记的sbp元件然后可以进入该细胞并与目标sbp元件形成sbp。在这方面,可以利用用于ihc和fish的已知方案。
[0917]
一种方法可用于检测至少一种细胞内目标和至少一种细胞表面目标。然而,在一些实施例中,本公开可用于检测多个细胞表面目标,而忽略细胞内目标。总体而言,目标的选择将由该方法所期望的信息确定,因为本公开将提供样本中所选目标的位置的图像。
[0918]
如本文进一步所述,包含标记原子的特异性结合配偶体(即亲和试剂)可用于染色(接触)生物样本。合适的特异性结合配偶体包括抗体(包括抗体片段)。标记原子可以通过质谱术来区分(即,可以具有不同的质量)。当标记原子包括一个或多个金属原子时,在本文可以称为金属标签。金属标签可以包括具有碳主链和多个侧基的聚合物,每个侧基结合一金属原子。替代地或者另外,金属标签可以包括金属纳米粒子。抗体可以通过共价或非共价相互作用用金属标签标记。
[0919]
抗体染色可用于细胞或亚细胞分辨率的蛋白质成像。本发明的方面包括使样本与一种或多种抗体接触,该抗体特定地结合由生物样本的细胞表达的蛋白质,其中,抗体用第一金属标签标记。例如,样本可以与5个或更多、10个或更多、15个或更多、20个或更多、30个或更多、40个或更多、50个或更多抗体接触,每个抗体具有可区分的金属标签。在用抗体对样本进行染色之前、期间(例如,为了便于工作流程)或之后(例如,为了避免改变抗体的抗原目标),可以进一步使样本与一种或多种组织化学染色剂接触。样本可进一步包含如本文所述的一种或多种含金属的药物和/或累积的重金属。
[0920]
用于本发明的金属标记抗体可特定地结合不含金属的代谢探针(例如,ef5)。其他金属标记的抗体可以特定地结合荧光和光学显微镜中使用的传统染色剂的目标(例如,上皮组织、基质组织、细胞核等)。这种抗体包括抗钙粘蛋白、抗胶原、抗角蛋白、抗efs、抗组蛋白h3抗体以及本领域已知的许多其他抗体。
[0921]
在本文中可使用的常见组织化学染色包括钌红和磷钨酸(例如,作为三色染色)。
[0922]
除了对样本进行特殊染色之外,有时还会在样本中引入染色剂,该样本可能含有金属原子,这是由于服用含金属药物的组织或生物体,或者由于环境暴露而积累了金属。有时,可以在使用基于脉冲追踪实验策略的这种技术的方法中测试组织或动物,以观察含金属材料的残留和清除。
[0923]
例如,医药中的金属是药理学中一个令人兴奋的新领域。在金属离子掺入金属蛋白、核酸金属复合物或含金属药物之前,短暂储存的金属离子所涉及的细胞结构或金属离子在蛋白质或药物降解时的预期发展知之甚少。解开涉及痕量金属运输、储存和分布的调节机制的重要的第一步表示金属的识别和定量,理想的是在组织、细胞中的天然生理环境中,或者甚至在单个细胞器和亚细胞区室的水平上。组织学研究通常在薄的组织切片上或用培养的细胞进行。
[0924]
许多含金属的药物用于治疗各种疾病,然而对它们的作用机制或生物分布还知之甚少:顺铂、钌咪唑、含mo的茂金属抗癌剂、含w的钨烯、含hf或zr的b
‑
二酮复合物、含au的醋硫葡金、多钼酸盐药物。许多金属复合物用作mri造影剂(gd(lll)螯合物)。对基于金属的抗癌药物的摄取和生物分布的表征对于理解和最小化潜在毒性是至关重要的。
[0925]
药物中存在的某些金属的原子质量在质量细胞术的范畴。具体地,顺铂和其他pt
复合物(异丙铂、络铂)广泛用作治疗多种癌症的化疗药物。铂类抗癌药物的肾毒性和骨髓毒性是众所周知的。利用本文所述的方法和试剂,现在可以检查它们在组织切片中的亚细胞定位以及与金属标记的抗体和/或组织化学染色的共定位。化疗药物可能通过直接的dna损伤、抑制dna损伤修复途径、放射性等对某些细胞(例如,增殖细胞)产生毒性。在某些方面,化疗药物可以通过抗体中间体而靶向肿瘤。
[0926]
在某些方面,含金属的药物是化疗药物。本方法可以包括在获得生物样本之前,让活的动物(例如,前述的动物研究模型或人类患者)服用含金属的药物。生物样本可以是例如癌组织的活组织切片或原代细胞。或者,可以将含金属的药物直接添加到生物样本中,该生物样本可以是永生化细胞系或原代细胞。当动物是人类患者时,本发明的方法可以包括基于检测含金属药物的分布来调整包括含金属药物的治疗方案。
[0927]
检测含金属药物的方法步骤可以包括通过元素质谱仪对含金属药物进行亚细胞成像,并且可以包括检测含金属药物在细胞内结构(例如,细胞膜、细胞质、细胞核、高尔基体、er、线粒体和其他细胞器)和/或细胞外结构(例如,包括基质、粘膜基质、基底膜、间质、蛋白质(例如,胶原或弹性蛋白)、蛋白聚糖、非蛋白聚糖多糖、细胞外小泡、纤连蛋白、层粘连蛋白等)中的滞留。
[0928]
解析于(例如,结合至)一个或多个上述结构的组织化学染色和/或金属标记的sbp可与含金属的药物共定位,以检测药物在特定细胞内或细胞外结构的滞留。例如,化疗药物(例如,顺铂)可以与结构(例如,胶原)共定位。替代地或另外,药物的定位可能与细胞活力、细胞增殖、缺氧、dna损伤反应或免疫反应的标记物的存在有关。
[0929]
在某些方面,含金属的药物是顺铂、钌咪唑、含mo的茂金属抗癌剂、含w的钨烯、含hf或zr的b
‑
二酮复合物、含au的醋硫葡金、多钼酸盐药物、含pd的n
‑
肉豆蔻酰基传送酶
‑
1抑制剂(三(二亚苄基丙酮)二钯)或其衍生物中的一种。例如,药物可以包含pt,并且可以是例如顺铂、卡铂、奥沙利铂、异丙铂、络铂或其衍生物。含金属的药物可以包括非内源性金属,例如,铂(pt)、钌(ru)、钼(mo)、钨(w)、铪(hf)、锆(zr)、金(au)、钆(gd)、钯(pd)或其同位素。在组织切片中可以识别用于癌症光热治疗的金化合物(例如,醋硫葡金)和金纳米粒子生物结合物。
[0930]
通过摄入食物或水、皮肤接触或吸入气溶胶,可以暴露于重金属。重金属可能会积聚在身体的软组织中,因此长时间暴露会对健康产生严重影响。在某些方面,通过动物研究模型中的受控暴露,或者通过人类患者中的环境暴露,重金属可以在体内积累。重金属可以是有毒的重金属,例如,砷(as)、铅(pb)、锑(sb)、铋(bi)、镉(cd)、锇(os)、铊(tl)或汞(hg)。
[0931]
单细胞分析
[0932]
本公开的方法包括对样本中的多个细胞进行激光烧蚀,从而分析来自多个细胞的羽流,并将它们的成分(content,包含物)映射到样本中的特定位置,以提供图像。在大多数情况下,该方法的用户需要将信号定位到样本内的特定细胞,而不是整个样本。为了实现这一点,可以对样本中细胞的边界(例如,质膜,或者在某些情况下细胞壁)进行界定。
[0933]
细胞边界的界定可以通过多种方式实现。例如,可以使用能够界定细胞边界的常规技术来研究样本,例如,上面讨论的显微镜检查。因此,当执行这些方法时,包括如上所述的相机的分析系统特别有用。然后可以使用本公开的方法制备该样本的图像,并且该图像可以叠加在先前的结果上,从而允许将检测到的信号定位到特定细胞。实际上,如上所述,
在一些情况下,激光烧蚀可以仅针对样本中的通过使用基于显微镜的技术确定为感兴趣的细胞子集。
[0934]
然而,为了避免使用多种技术的需要,可以界定细胞边界,作为本公开的成像方法的一部分。这种边界界定策略是ihc和免疫细胞化学所熟悉的,并且可以通过使用可检测的标记来改编这些方法。例如,该方法可以包括标记已知位于细胞边界的目标分子,然后来自这些标记的信号可以用于边界界定。合适的目标分子包括丰富的或通用的细胞边界标记物,例如,粘附复合物的构成物(例如,β
‑
连环蛋白或e
‑
钙粘蛋白)。一些实施例可以标记多于一种的膜蛋白,以增强分界。
[0935]
除了通过包含合适的标记来界定细胞边界之外,也可以通过这种方式界定特定的细胞器。例如,诸如组织蛋白(例如,h3)等抗原可以用于识别细胞核,并且还可以标记线粒体特异性抗原、细胞骨架特异性抗原、高尔基体特异性抗原、核糖体特异性抗原等。从而允许通过本公开的方法分析细胞超微结构。
[0936]
界定细胞(或细胞器)边界的信号可以用眼睛评估,也可以用计算机通过图像处理进行分析。这种技术在其他成像技术领域中是已知的,例如,arce等人(2013;scientific reports 3,第2266条)描述了一种使用空间滤波从荧光图像中确定细胞边界的分割方案,ali等人(2011;mach vis appl 23:607
‑
21)公开了一种根据明场显微图像确定边界的算法,pound等人(2012;the plant cell 24:1353
‑
61)公开了从共焦显微镜图像中提取细胞几何形状的细胞集方法,hodneland等人(2013;source code for biology and medicine 8:16)公开了用于荧光显微镜图像的cellsegm matlab工具箱。对本公开有用的方法使用分水岭变换和高斯模糊。这些图像处理技术可以单独使用,也可以使用后用肉眼检查。
[0937]
一旦界定细胞边界,可以将来自特定目标分子的信号分配给个体细胞。也可以量化个体细胞中目标分析物的量,例如,通过对照定量标准来校准方法。
[0938]
参考粒子
[0939]
如本文所述,已知元素或同位素组成的参考粒子可添加到样本(或样本载体)中,以在检测样本中的目标元素离子期间用作参考。在某些实施例中,参考粒子包括金属元素或同位素,例如,过渡金属或镧系元素。例如,参考粒子可以包括质量大于60amu、大于80amu、大于100amu或大于120amu的元素或同位素。
[0940]
可以根据从单独的参考粒子中检测到的元素离子在样本连串(run)中目标元素(例如,标记原子)进行标准化。例如,本方法可以包括在从单独的参考粒子检测元素离子和仅检测目标元素离子之间进行切换。
[0941]
使用水凝胶的预分析样本膨胀
[0942]
传统的光学显微镜被限制在光源波长的大约一半,最小可能的分辨率约为200nm。膨胀显微镜是一种样本(特别是生物样本)制备方法,它使用聚合物网络来物理膨胀样本,从而将样本的光学可视化分辨率提高到约20nm(wo2015127183)。膨胀程序可用于制备用于成像质谱术和成像质谱流式细胞术的样本。通过这一过程,直径为1μm的烧蚀光斑在未膨胀的样本上提供1μm的分辨率,但在膨胀后,这1μm的烧蚀光斑表示约100nm的分辨率。在某些方面,烧蚀光斑的尺寸(例如,光斑尺寸)可以小于被辐射(例如,激光、离子或电子束辐射)撞击的样本的尺寸,例如,当烧蚀所需的能量大于撞击样本的光束边缘的能量时。
[0943]
生物样本的膨胀显微镜检查通常包括以下步骤:固定、锚定准备、凝胶化、机械均
化和膨胀。
[0944]
在固定阶段,样本在化学上固定和清洗。然而,特定的信号功能或酶功能(例如,作为生理状态的功能的蛋白质
‑
蛋白质相互作用)可以在没有固定步骤的情况下使用膨胀显微镜来检查。
[0945]
接下来,制备样本,使得它们可以附着(“锚定”)到在后续凝胶化步骤中形成的水凝胶上。在此处,本文别处所讨论的sbp(例如,抗体、纳米抗体、非抗体蛋白质、肽、核酸和/或能够特定地结合至样本中感兴趣的目标分子的小分子)与样本一起孵化,以结合至样本中存在的目标。可选地,样本可以用可用于成像的可检测化合物标记(有时称为“锚定”)。对于光学显微镜,可检测的化合物可以包括例如由荧光标记的抗体、纳米抗体、非抗体蛋白质、肽、核酸和/或可以特定地结合至样本中感兴趣的目标分子的小分子(us2017276578)提供。对于包括成像质谱流式细胞仪在内的质谱流式细胞仪,可检测标记可以由例如元素标签标记的抗体、纳米抗体、非抗体蛋白质、肽、核酸和/或能够特定地结合至样本中感兴趣的目标分子的小分子来提供。在某些情况下,与目标结合的sbp不包含标签,而是包含可被二次sbp结合的特征(例如,与目标结合的一次抗体和与一次抗体结合的二次抗体,如免疫组织化学技术中常见的)。如果仅使用一次sbp,其本身可以连接到将样本连接或交联到在随后的凝胶化步骤中形成的水凝胶上的部分,使得样本可以系到水凝胶上。或者,如果使用二次sbp,这可能包含将样本连接或交联到水凝胶的部分。在某些情况下,使用结合到二次sbp的三次sbp。chen等人提出了一个示例性的实验方案2015(science 347:543
‑
548),该方案使用一次抗体,以与目标结合,二次抗体与一次抗体结合,其中,二次抗体附着到寡核苷酸序列上,然后作为三次sbp,寡核苷酸与附着到二次抗体的序列互补,其中,三次sbp包含可以掺入丙烯酰胺水凝胶中的甲基丙烯酰基。在一些情况下,包含渗入到水凝胶中的部分的sbp也包括标签。这些标签可以是荧光标记或元素标记,因此在通过例如流式细胞术、光学扫描和荧光测定法(us2017253918)或质量流式细胞术或成像质谱流式细胞术的随后的分析中使用。
[0946]
凝胶化阶段通过向样本中注入包含密集交联、高电荷单体的水凝胶,在样本中生成基质。例如,丙烯酸钠与共聚单体丙烯酰胺和交联剂n
‑
n'亚甲基双丙烯酰胺一起被引入到固定和渗透的脑组织中(参见chen等人,2015)。当聚合物形成时,在锚定步骤中包含与目标相连的部分,使得样本中的目标附着在凝胶基质上。
[0947]
然后,用均化剂处理样本,以均化样本的机械特性,使得样本不抵抗膨胀(wo2015127183)。例如,样本可以通过用酶(例如,蛋白酶)降解、通过化学蛋白水解(例如,溴化氰)、通过将样本加热至70
‑
95摄氏度或通过物理破碎(例如,超声波处理)(us2017276578)来均化。
[0948]
然后,通过在低盐缓冲液或水中透析样本/水凝胶复合物而使该复合物膨胀,以使样本在三维方向上膨胀至其原始尺寸的4倍或5倍。随着水凝胶的膨胀,样本也膨胀,特别是附着在目标上的标签和水凝胶也膨胀,同时保持标签的原始三维排列。由于样本在低盐溶液或水中膨胀,所以膨胀的样本是透明的,在执行质谱流式细胞技术时,允许光学成像深入样本,并允许成像而不引入显著水平的污染元素(例如,通过使用蒸馏水或通过包括电容去离子、反渗透、碳过滤、微滤、超滤、紫外氧化或电去离子的其他过程纯化)。
[0949]
然后可以通过成像技术分析碰撞的样本,提供伪改进的分辨率。例如,荧光显微镜
检查可以与荧光标记一起使用,成像质谱流式细胞仪可以与元素标记一起使用,可选地组合使用。由于水凝胶的膨胀以及膨胀样本中标记物之间的距离相对于天然样本的伴随增加,先前不能单独分辨的标记物(由于光学显微镜中可见光的衍射极限,或imc中的光斑直径)现在可以识别。
[0950]
存在膨胀显微镜检查(exm)的变体,其也可以使用本文公开的设备和方法来应用。这些变体包括:蛋白质保留exm(proexm)、膨胀荧光原位杂交(exfish)、迭代exm(iexm)。迭代膨胀显微镜检查包括在已经使用上述技术进行了初步膨胀的样本中形成第二可膨胀聚合物凝胶。溶解第一膨胀凝胶,然后膨胀第二可膨胀聚合物凝胶,使总膨胀达到约20倍。例如,chang等人,2017(nat methods 14:593
‑
599)将该技术建立在上述chen等人2015的方法基础上,用可裂解的交联剂(例如,可购买的交联剂n,n
’‑
(1,2
‑
二羟基乙烯)双丙烯酰胺(dheba),其二醇键可在高ph下裂解)替代第一凝胶。在第一凝胶锚定和膨胀后,将标记的寡核苷酸(包含掺入第二凝胶的部分)和掺入第一凝胶的寡核苷酸的互补物加入膨胀的样本中。形成掺入标记寡核苷酸的一部分的第二凝胶,第一凝胶通过可裂解的连接子的裂解而被分解。然后,第二凝胶以与第一凝胶相同的方式膨胀,导致标记物的进一步空间分离,但是保持其相对于原始样本中目标物排列的空间排列。在一些情况下,在第一凝胶膨胀后,使用中间的“再包埋凝胶”,在进行实验步骤时将膨胀的第一凝胶保持在适当的位置,例如,在第一水凝胶和再包埋凝胶被分解以允许第二水凝胶膨胀之前,将标记的sbp杂交到第一凝胶基质上,形成未膨胀的第二水凝胶。如前所述,所用的标记可以是荧光或元素标记,因此在随后的分析中使用,例如,通过流式细胞仪、光学扫描和荧光测定法或质谱流式细胞仪或成像质谱流式细胞仪,视情况而定。
[0951]
参数和应用
[0952]
本文所述的方法和系统可获得直径等于或小于500nm、400nm、300nm、200nm、100nm、50nm、30nm或20nm的光斑尺寸直径。另外,光斑的深度可能比较浅;光斑深度可以类似于光斑尺寸的直径,或者可以小于光斑尺寸的直径。例如,fs激光器可以在很浅的深度烧蚀(例如,当羽流形成而从同一侧指向样本时,或者当穿过透明基板指向时,如果聚焦在样本的稍上方)。浅光斑深度可以等于或小于100nm、50nm、30nm、20nm或10nm。这样,一些光斑可能只包含质量标签的一个拷贝(例如,质量标签附着到目标的一个示例,例如,rna或蛋白质)。质量标签可以通过抗体中间体和/或杂交的寡核苷酸探针附着到目标上。在一些情况下,相同的位置(例如,x
‑
y坐标)可以被多次采样(例如,在不同的z深度),通过获取更多的样本和/或允许3d成像来改善检测。
[0953]
通过样本的膨胀(例如,通过凝胶膨胀等交联样本的基质的膨胀),可以进一步提高分辨率。
[0954]
此外,本文描述的方法和系统可以提供改进的电离效率(例如,通过激光snms、烧蚀前的电子种植、烧蚀后的激光电离和/或初始中和后的激光电离)。后电离效率(通过检测保持带电的离子化标记原子的百分比)可以大于等于5%、10%、20%、30%或50%。此外,在样本表面处或附近形成的离子允许这种离子通过离子光学器件直接传送到质谱仪,而不会在烧蚀羽流到icp的流体传送过程中引起损失。
[0955]
替代地或另外,可以用包含大量标记原子的质量标签来提高灵敏度。这种质量标签可以包括金属螯合聚合物、金属纳米粒子(例如,聚合物基质中截留的金属晶体或金属)、
或杂交方案,在该杂交方案中,多个金属标记的寡核苷酸与rna目标或与结合到目标蛋白的亲和试剂(例如,抗体)偶联的寡核苷酸杂交。高灵敏度质量标签可以具有至少20、50、100、200、500、1000、2000、5000或10000个标记原子。
[0956]
这样,本文描述的方法和系统可以允许以单个光斑(例如,像素)检测单个质量标签。当可以检测到单个质量标签时,质量标签可以包括对结合了质量标签(即目标条码)的目标特定的标记原子的唯一组合。这可能会增加可以被区分的目标的数量而超过不同标记原子质量的数量。目标条码可以具有来自多种不同元素的富集同位素。例如,包含10个不同标记原子中的5个的质量标签允许10个选择5个(即252个)唯一的目标条码。包含20个不同标记原子中的10个的质量标签允许20个选择10个(即,184756个)唯一的目标条码。这样,可以对超过50、100、200、500、1000、2000、5000或10000个不同的目标标记目标条码。如果目标条码包括相同预期数量的不同标记原子质量,则可以忽略包括多于预期数量的目标条码标记原子质量的任何像素(即,不可能对该光斑处存在的目标条码的组合去卷积)。在某些方面,一些质量标签可以仅包括从第一质量子集选择的单个标记原子质量,并且其他质量标签可以被标记目标条码,并且可以包括从与第一质量子集不重叠的第二质量子集选择的标记原子质量的唯一组合。例如,高丰度目标的质量标签可能不加目标条码。然而,通过控制质量标签的浓度和/或与没有加质量标签的亲和试剂竞争,结合高丰度目标的目标条码质量标签的实例可以减少到允许每像素单拷贝检测的水平。在一些情况下,以较低的分辨率和/或较低的采样密度对样本进行第一次成像,可以允许检测非目标条码质量标签,并识别感兴趣区域。然后,可以在所识别的感兴趣区域执行更高分辨率和/或更高密度的采样,以检测目标条码质量标签的单个拷贝。
[0957]
为了在单个细胞中以单分子分辨率检测许多目标,可能需要从细胞中采样许多像素。例如,如果对大致为球形的10微米细胞的相同位置(例如,x
‑
y坐标)进行多次采样(例如,在不同的z深度),则可以用10nm的光斑尺寸对该细胞进行近10亿次采样。像素的子集将具有单个目标条码质量标签,其中,许多可能具有重复出现的目标条码质量标签(其可以被计数,以量化目标的表达水平)。例如,如果在一个细胞中检测到100万个像素,并且这些像素中的10%具有目标条码质量标签的单个拷贝,并且该细胞中每个目标条码质量标签的平均数是100,则在该细胞中可以检测到1000个不同的目标条码质量标签。
[0958]
可以在试剂盒中提供上述质量标签,可选地在亲和试剂和/或寡核苷酸旁边或与之结合,以便结合样本中的目标。
[0959]
定义
[0960]
术语“包括”涵盖“包含”以及“组成”,例如,“包括”x的组合物可以仅由x组成,或者可以包含额外的物质,例如x y。
[0961]
与数值x相关的术语“大约”是可选的,例如表示x 10%。
[0962]
词语“基本上”不排除“完全”,例如,“基本上不含”y的组合物可以完全不含y。必要时,可以从本公开的定义中省略词语“基本上”。
[0963]
示例
[0964]
示例1
[0965]
方案
[0966]
在使用2%pfa和2.5%戊二醛获得器官后,浸泡固定小鼠肠道。用2%四氧化锇后
固定组织1小时。脱水后,将组织样本埋入epon树脂中并切片。
[0967]
对1000nm的组织切片进行激光烧蚀,并通过hyperion成像系统分析锇同位素的存在。
[0968]
结果
[0969]
图11示出了根据标准免疫电镜方案处理的小鼠肠道组织中存在的大量锇同位素(
188
os、
189
os、
190
os和
192
os)以及天然少量的同位素(0.02%
184
os、1.59%
186
os、1.96%
187
os)的检测。肠道形态由致密的平滑肌外层(左上角)和粘膜上皮良好定义,上皮下方有杯状细胞和分散的基质和免疫细胞。
[0970]
因此,电子显微镜可以对用2%四氧化锇处理的1μm切片进行成像,用于结构细节。用于固定组织的四氧化锇浓度对于imc检测器来说被确定为不过饱和。
[0971]
imc设定:小鼠肠道树脂,he=1050,ar=0_9,z=2871,atten=30,200μmx200μm,200hz 200脉冲200μm
‑
sec,面积1。
[0972]
小鼠肠道的较大区域也被烧蚀。图12的图像显示了2100
×
1087μm的面积,步长为250nm。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。