烟草ntimk2类受体蛋白激酶及其在抗旱中的应用
技术领域
1.本技术属于烟草基因组功能解析技术领域,具体涉及一个烟草ntimk2类受体蛋白激酶及其在抗旱中的应用。
背景技术:
2.干旱是严重破坏地球生态系统的自然灾害之一,具有范围广、频率高和破坏性强的特点,经常导致全球性或区域性严重经济损失。由干旱引发的水资源供应不足会严重影响农业生产,降低作物产量。因此,解析植物的干旱响应机制,并通过定向改良作物提高其干旱的抗性对于农业的可持续发展有重要意义。
3.现有研究中,对植物抗旱性机理的研究主要集中在脱落酸(abscisic acid,aba)、活性氧(reactive oxy gen species,ros)、渗透压调节的研究等方面。研究表明,脱落酸(aba)信号途径在植物干旱响应中具有重要作用,通过调节aba信号通路上的相关关键基因,对于植物干旱状态下的表型具有重要影响。活性氧主要是通过调节膜通透性、离子渗透性,以及通过破坏叶绿素、造成代谢紊乱等生理方式来响应干旱胁迫。因此,对于植物体内抗氧化系统相关调节基因的研究,可为植物抗旱机理研究奠定分子生物学的理论基础。而干旱胁迫条件下,植物体内会积累一些渗透调节物质,如脯氨酸、可溶性多糖、可溶性蛋白、甜菜碱等,这些物质作为渗透调节剂,通过细胞渗透压的生理变化来响应干旱胁迫。
4.在对干旱胁迫相关基因研究中,因作物类型不同,基因功能不同,由此导致实际基因调节方式和实际用途也存在较多差异。例如,已有研究中,部分研究表明,胚胎晚期富集蛋白(lea)参与了植物对干旱胁迫的响应过程,在水稻中过表达lea基因oslea3
‑
1能增强水稻的田间抗旱性,而拟南芥中,则是lea4基因响应干旱胁迫抗性。
5.现有研究中,有研究表明类受体激酶(rlks)参与了植物对干旱的胁迫响应,在植物的干旱调控机制中有重要作用。其中最典型的是油菜素内酯受体bri1,油菜素内酯(brassinolide, br)能提高多种物种对盐胁迫和干旱胁迫的耐受性(zhou, m. and h. luo,role of microrna319 in creeping bentgrass salinity and drought stress response,plant signaling & behavior,2014;ye, h et al,rd26 mediates crosstalk between drought and brassinosteroid signalling pathways. nature communications,2017)。而在水稻中,过表达水稻lrr类受体蛋白激酶基因ossik1能提高水稻对高盐和干旱胁迫的抗性,sik1突变体植株的抗旱能力则显著下降(ouyang,receptor
‐
like kinase ossik1 improves drought and salt stress tolerance in rice (oryza sativa) plants,the plant journal,2010)。
6.但其他作物、其他类型的类受体激酶(rlks)是否也具有类似的抗旱功能,显然都需进一步探索和研究后才能确定。
技术实现要素:
7.通过利用磷酸化蛋白质组学、转录组和mirna
‑
seq等多组学整合分析方法,发明人
前期在对烟草相关基因组和蛋白质组学研究基础上,本技术目的在于提供一个烟草lrr类受体激酶(rlks)ntimk2基因,通过对该基因抗旱功能的解析、研究,从而为抗旱烟草新品种培育奠定一定技术基础。
8.本技术所采取的技术方案详述如下。
9.烟草ntimk2类受体蛋白激酶的编码基因(cds 序列),长度为2511bp,碱基序列如seq id no.1所示,具体如下:atggataggtggaatacttcactgagtagatattataactacccttttcgattctggcatttttattccattattgttgtgattgtattttcttccaatttctctattatatcagctgggaggagttcagatggggttattgtaactcaagctgattttcaagcacttaaggccattaaacatgagctgattgattttagaggaatcttgaaaagttggaatgacagtggtttaggagcttgtggtggtggatggattggtataaagtgtgttaatggggaagttatagctatacagttgccttggaaaggattaggtggcagaatttctgaaaaaattggtcaattacaagctcttagaaagcttagtattcatgacaatgttattgctggtcctgttccaacttcattgagttttcttccaaatcttagaggtgtttatcttttcaataaccggctttcgggttcaatcccaccaacaattggaagatcaccacttcttcagactcttgatcttagcaacaatcaactcactggtactatccctcctagtcttgcgaattcgacaaggttatacagactcaacttgagctacaatgcactttcaggttcaatcccagtaagttttactcaatccccttctcttacttttcttgcacttgaacataacaatctttctggctctattcctgatacttggggtaatgttgttgtcaacaataagtcttatcaacttcagtatcttacccttgatcacaatcttttatatgggaaaattccaacttcaattagcaagttaagtatgcttgaggagattaatcttagtcataaccaaattaatgggactattcctgatgaattaggggcacttactaggcttgctattcttgatttatctaataattccataaatggaactattcctgttagtttctccaatctttcagctcttgttactttgaatttaaaaagcaatcttttggataaccaaatcccagatgttatatatagattgcaaaatctttcagtgttggatttgagtgacaataagctcactggtcatattccagccactattgggaatatttctaggctcaactcacttgatttatctgaaaacaacttcactggtgaaatcccaaagtctcttgtttcgttggcgaatttgactagttttgatgtctcttacaacaatctttctggggttgtcccatctcttctttctaagaagttcaattcaagtgcttttgttggaaatctagagctatgtggatatagtccctcaactccatgtgcttcaccacctcctcaaactcttccttcttctcctattggtggggttgccaagcctcgccatcgcaaacttagtactaaggatatcattctcatagcatctggagctcttctagttgttctacttcttttgtgttgcatgctactttgctgcttgattaggaaaaaagcaaattcgaaagcaaaaaatggtagtaaagccagtggcttagctaccacaggaagaggtgcaaagccagttccagcagcagcaggtgctgaggttgaatcaactggtggaaaactagtccatttcgatggaccattcgtgttcacagcggacgacttgttatgtgccactgcagagataatgggaaagagcacttatggaacagcatataaggctacattagaggatggtaatcaagttgctgtgaagaggctgcacgagaagatcacaaaagggcaaaaagagtttgaagctgaagttgctgaattaggcaagattcgacacccaaatattttggctctcagagcctattacttgggacctaaaggagaaaagcttcttgtctatgattatatgtctaatggaagtctctcgtccttcctccatgctcgaggtcctgagacaacaatagactggcctacaaggatgaggattgctattggtataacaaaaggcatatgctttttgcatagcaaagaaaacataatacatgggaatcttacatcaagcaatatacttcttgatgagcaaaacaacccaacgattgcagatgtaggcctctccaggcttatgacaagtgctggtaacaccaatgtgattgccactgcaggcacgttaggttatcgtgcaccagagctctcgaaaatcaagaatgcaagcaccaagaccgatgtctatagtgttggagtgatcattttggagctcttgactggaaaatcaccaagcggggcaacagatggactcgatttgccacagtgggtagcttccattgtgaaagaggagtggactaatgaagtgtttgatgttgaacttatgagggatgcacctaatattggtgatgaattgcttaatactttgaaactagctttgcattgtgttgatccaacgccaacagctcggcctgaagctgagcaagtacttcagaaattggaggagattaaaccagagatgatgttaacagccaccagttctggagatgatggcacagcagttcaagaaa
agagtgaataa。
10.烟草ntimk2类受体蛋白激酶氨基酸序列(836个氨基酸),如seq id no.2所示,具体如下:mdrwntslsryynypfrfwhfysiivvivfssnfsiisagrssdgvivtqadfqalkaikhelidfrgilkswndsglgacgggwigikcvngeviaiqlpwkglggrisekigqlqalrklsihdnviagpvptslsflpnlrgvylfnnrlsgsipptigrspllqtldlsnnqltgtippslanstrlyrlnlsynalsgsipvsftqspsltflalehnnlsgsipdtwgnvvvnnksyqlqyltldhnllygkiptsisklsmleeinlshnqingtipdelgaltrlaildlsnnsingtipvsfsnlsalvtlnlksnlldnqipdviyrlqnlsvldlsdnkltghipatignisrlnsldlsennftgeipkslvslanltsfdvsynnlsgvvpsllskkfnssafvgnlelcgyspstpcaspppqtlpsspiggvakprhrklstkdiiliasgallvvllllccmllcclirkkanskakngskasglattgrgakpvpaaagaevestggklvhfdgpfvftaddllcataeimgkstygtaykatledgnqvavkrlhekitkgqkefeaevaelgkirhpnilalrayylgpkgekllvydymsngslssflhargpettidwptrmriaigitkgicflhskeniihgnltssnilldeqnnptiadvglsrlmtsagntnviatagtlgyrapelskiknastktdvysvgviilelltgkspsgatdgldlpqwvasivkeewtnevfdvelmrdapnigdellntlklalhcvdptptarpeaeqvlqkleeikpemmltatssgddgtavqekse。
11.pcr扩增烟草ntimk2类受体蛋白激酶的编码基因用引物对,具体如下:ntimk2
‑
f:5
’‑
atggataggtggaatac
‑3’
,ntimk2
‑
r:5
’‑
tattcactcttttcttg
‑3’
。
12.沉默烟草ntimk2类受体蛋白激酶的编码基因用干涉序列(238bp),具体如下(如seq id no.3所示,):agcaaaacaacccaacgattgcagatgtaggcctctccaggcttatgacaagtgctggtaacaccaatgtgattgccactgcaggcacgttaggttatcgtgcaccagagctctcgaaaatcaagaatgcaagcaccaagaccgatgtctatagtgttggagtgatcattttggagctcttgactggaaaatcaccaagcggggcaacagatggactcgatttgccacagtgggtagc。
13.所述烟草ntimk2类受体蛋白激酶的编码基因在抗旱中的应用,通过将该基因超表达后,可增强植物耐旱性;具体超表达时,可利用pc2300s质粒载体进行超表达。
14.所述烟草ntimk2类受体蛋白激酶在抗旱中的应用。
15.一种抗旱烟草新品种培育方法,利用基因工程技术,将烟草ntimk2类受体蛋白激酶的编码基因超表达后,可增强植物耐旱性;具体超表达时,可利用pc2300s质粒载体进行超表达。
16.所述抗旱烟草新品种培育方法,具体操作而言:(一)构建超表达载体首先,pcr扩增获得ntimk2序列;随后,通过kpni、bamhi双酶切、连接方式将ntimk2基因重组到pc2300s载体骨架上,并进一步筛选、鉴定获得重组正确的质粒;(二)质粒的农杆菌转化将步骤(一)中鉴定正确的重组质粒转化农杆菌eha105 感受态细胞,并进一步制备转染用菌液;具体转化农杆菌eha105 感受态细胞时,可采用电转化方式;
制备转染用菌液时,将鉴定正确的含有转化质粒的菌液培养调节至od600=0.8左右的菌液(培养基为含50 mg/l卡那霉素的lb培养基)作为转染用菌液;(三)转化烟草,并筛选鉴定转化烟草时,采用叶盘转化法,具体操作如下:首先,提前将烟草种子消毒后接入萌发培养基,种子萌发约两周后,转至瓶装的萌发培养基(ms基本培养基 蔗糖30g/l,ph 5.7),光照培养约45d,以此作为烟草无菌苗备用;其次,使用打孔器在上述烟草无菌苗上取直径0.5cm左右的叶片(叶盘),转入预培养基(ms基本培养基 蔗糖30g/l bap(6
‑
ba) 1mg/l naa 0.1 mg/l pcpa (防落素)8 mg/l,ph 5.7)进行培养,放置培养时,上表皮朝上,25
°
c、18h光照培养24h,以对叶盘(外植体)预培养;随后,将上述预培养后叶盘外植体置于步骤(二)所制备农杆菌菌液中侵染30min,接着将侵染后外植体放入共培养基(ms基本培养基 蔗糖30g/l bap(6
‑
ba) 1mg/l naa 0.1 mg/l pcpa (防落素)8 mg/l mes 3.7 g /l acetosyringone(乙酰丁香酮)38mg /l,ph 5.4)上,上表皮朝上,24
°
c、18 h光照培养培养3 d;共培养结束后,用灭菌蒸馏水及含有抗生素水溶液清洗共培养后叶盘外植体,吸干叶盘表面水分后,转入筛选培养基(ms基本培养基 蔗糖30g/l bap(6
‑
ba) 1mg/l naa 0.1 mg/l carbenicillin(羧卞青霉素)100mg/l cefotaxime(头孢噻肟)100mg/l kan 150mg/l; ph 5.7),28
°
c、18 h光照培养,每2周继代一次;在筛选培养基中,外植体边缘会逐渐长出愈伤组织,芽点则会从愈伤中长出,在芽点长到3mm长度左右时,转至生根培养基(ms基本培养基 蔗糖30g/l naa 0.1 mg/l carbenicillin(羧卞青霉素)100mg/l cefotaxime(头孢噻肟)100mg/l kan 75mg/l,ph 5.7)中,光照培养直至生根成苗;最后,对再生植株叶片取样鉴定,确保筛选所得为超表达转化植株。
17.前期在对烟草基因组解析基础上,结合相关磷酸化蛋白质组学、转录组、和mirna
‑
seq等多组学整合分析,发明人发现一个lrr类受体激酶(rlks)ntimk2基因的表达与干旱响应高度相关。为进一步确定该基因功能及其在植物干旱胁迫响应机制中作用,本技术中,发明人利用rnai干涉及过表达技术,对ntimk2基因在干旱胁迫中的功能进行了初步研究,结果表明,超表达ntimk2基因时,能明显提高植物的抗旱能力。基于这一结果,可为相关植物新品种构建奠定一定技术基础。
附图说明
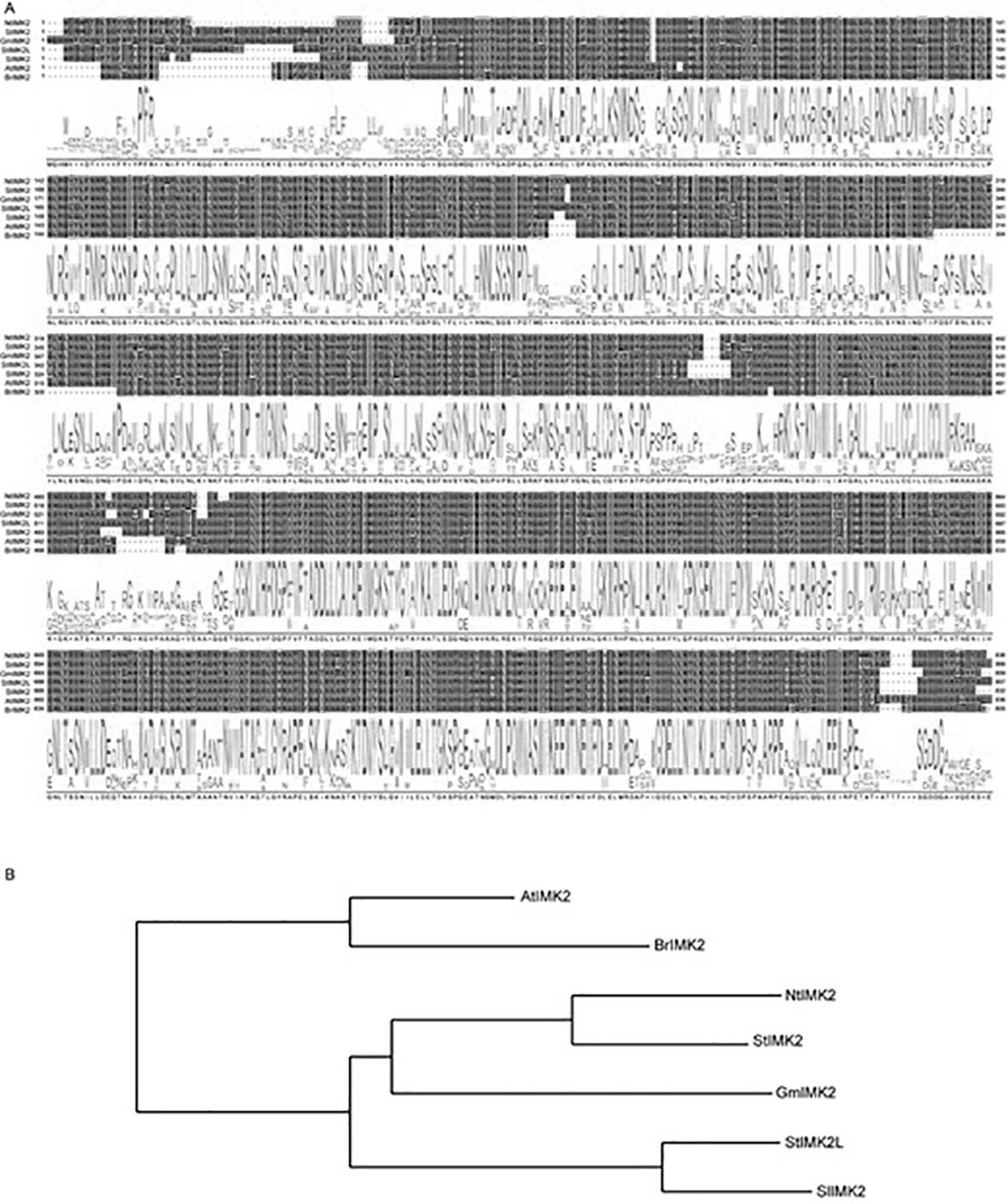
18.图1为ntimk2的基因序列结构对比(a)及进化树分析(b);图2为 pc2300s载体图谱;图3为重组后质粒酶切鉴定图;图4为s
‑
w ta载体的菌液pcr鉴定结果;图5为ds1301载体图谱示意图;图6为重组片段连接示意图;图7基因沉默用载体菌液pcr鉴定结果;图8为抗性筛选后基因沉默植株的pcr鉴定结果;图中从左到右泳道内被检测样品
株系编号依次是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28;图9为抗性筛选后基因超表达植株的pcr鉴定结果;图中从左到右泳道内被检测样品株系编号依次是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33;图10 为ntimk2基因沉默株系的基因表达量检测结果(a)和超表达株系的基因检测结果(b),以及超表达株系中的western blot的蛋白检测结果(c);图11为表型观察结果(左图,从左至右依次为:野生型、基因沉默株、超表达株)和叶片含水量结果。
具体实施方式
19.下面结合实施例对本技术做进一步的解释说明。在介绍具体实施例前,就下述实施例中部分实验背景情况简要介绍说明如下。
20.烟草(nicotiana tabacum)k326,种子购自中国农业科学院烟草研究所(中国青岛);相关质粒载体构建、测序及转化等工作,由武汉天问生物科技有限公司协助完成。
21.实施例1基于发明人前期对烟草基因组相关解析工作基础上,利用磷酸化蛋白质组学、转录组、和mirna
‑
seq等多组学整合分析方法,发明推测认为烟草lrr类受体激酶(rlks)ntimk2基因在抗旱功能方面具有一定功能。为此,本实施例就ntimk2基因的克隆获得过程简介如下。
22.(一)提取基因组将k326种子消毒之后接种在ms培养基上进行萌发,发芽两周后,幼苗移栽到盆里,在培养温度为23~26℃的植物培养间进行培养,取六周叶龄的第4片叶,采用植物基因组dna提取试剂盒提取基因组dna。
23.基因组dna提取时,参考试剂盒说明书操作即可,或者可具体参考如下:首先,将spin column置于collection tube中,加入250 μl buffer bl,12000
ꢀ×ꢀ
g离心1 min,活化硅胶膜;随后,取植物新鲜组织(不大于100 mg),加入液氮充分研磨;研磨后置于1.5 ml离心管中,加入400 μl buffer gp1,涡旋振荡1 min,65℃水浴20min(期间可取出颠倒混匀以充分裂解);再后,加入150 μl buffer gp2,涡旋振荡1 min,冰浴5 min;12000
ꢀ×ꢀ
g离心5 min,将上清转移至新的离心管中;加入上清等体积的无水乙醇(例如500 μl的上清液加500 μl无水乙醇),立即充分振荡混匀,液体全部转入spin column中,12000
ꢀ×ꢀ
g离心30 s,弃废液;再后,向spin column中加入500 μl buffer pw(使用前请先检查是否已加入无水乙醇), 12000
ꢀ×ꢀ
g离心30 s,弃废液;向spin column中加入500 μl wash buffer(使用前请先检查是否已加入无水乙醇),12000
ꢀ×ꢀ
g离心30 s,弃废液;重复此操作一次;
感受态细胞;随后,加入步骤(一)中鉴定正确且提取后质粒1.5ul,混合均匀后,电转仪内进行电击转化;再后,加入提前准备好的无抗lb培养基,混合均匀后,28℃、摇床复苏60min;接着,将复苏后菌液11000rpm离心1min,倒掉大部分上清,将剩余菌液吹打混匀后,涂抹于含有抗性的la平板,倒置、28℃培养2d;最后,挑选阳性克隆菌株,置于lb抗性培养基中28℃摇床培养2d以进行扩增,并进行菌液pcr鉴定,对鉴定正确的含有转化质粒的菌液保存备用,或者培养调节至od600=0.8左右的菌液(培养基为含50 mg/l卡那霉素的lb培养基)进行后续转染实验。
32.(三)转化烟草,并筛选鉴定转化烟草时,采用叶盘转化法,参考现有技术常规操作即可。或者可具体参考如下:首先,提前将烟草种子消毒后接入萌发培养基,种子萌发约两周后,转至瓶装的萌发培养基(ms基本培养基 蔗糖30g/l,ph 5.7),一瓶放置一株,光照培养约45d,以此作为烟草无菌苗备用。
33.其次,使用打孔器在上述烟草无菌苗上取直径0.5cm左右的叶片(叶盘),转入预培养基(ms基本培养基 蔗糖30g/l bap(6
‑
ba) 1mg/l naa 0.1 mg/l pcpa (防落素)8 mg/l,ph 5.7)进行培养,放置培养时,上表皮朝上,25
°
c、18h光照培养24h,以对叶盘(外植体)预培养。
34.随后,将上述预培养后叶盘外植体置于步骤(二)所制备农杆菌菌液中侵染30min,接着将侵染后外植体放入共培养基(ms基本培养基 蔗糖30g/l bap(6
‑
ba) 1mg/l naa 0.1 mg/l pcpa (防落素)8 mg/l mes 3.7 g /l acetosyringone(乙酰丁香酮)38mg /l,ph 5.4)上,上表皮朝上,24
°
c、18 h光照培养培养3 d。
35.共培养结束后,用灭菌蒸馏水及含有抗生素水溶液清洗共培养后叶盘外植体,吸干叶盘表面水分后,转入筛选培养基(ms基本培养基 蔗糖30g/l bap(6
‑
ba) 1mg/l naa 0.1 mg/l carbenicillin(羧卞青霉素)100mg/l cefotaxime(头孢噻肟)100mg/l kan 150mg/l; ph 5.7),28
°
c、18 h光照培养,每2周继代一次。
36.在筛选培养基中,外植体边缘会逐渐长出愈伤组织,芽点则会从愈伤中长出,在芽点长到3mm长度左右时,转至生根培养基(ms基本培养基 蔗糖30g/l naa 0.1 mg/l carbenicillin(羧卞青霉素)100mg/l cefotaxime(头孢噻肟)100mg/l kan 75mg/l,ph 5.7)中,光照培养直至生根成苗。
37.最后,对再生植株叶片取样,提取dna,并利用nptⅱ特异引物进行pcr检测鉴定。
38.实施例3实施例2为相关超表达转基因植株构建过程介绍说明,但为进一步确定ntimk2基因在干旱胁迫中的具体响应情况,在实施例1基础上,发明人进一步利用rnai沉默技术沉默了该基因表达,本实施例就相关实验过程简介如下。
39.(一)选择干涉片段序列,并进行pcr扩增首先,基于实施例1中测序结果,选择干涉片段序列如下(238bp):agcaaaacaacccaacgattgcagatgtaggcctctccaggcttatgacaagtgctggtaacaccaatg
tgattgccactgcaggcacgttaggttatcgtgcaccagagctctcgaaaatcaagaatgcaagcaccaagaccgatgtctatagtgttggagtgatcattttggagctcttgactggaaaatcaccaagcggggcaacagatggactcgatttgccacagtgggtagc针对上述干涉片段序列,设计pcr扩增用的正向干涉片段s、反向干涉片段as、waxy (w)(中间link序列)片段的引物如下:ntimk2
‑
sf:5
’‑
cggggtaccagcaaaacaacccaacgat
‑3’
,(用于扩增ntimk2s与ntimk2s
‑
w)ntimk2
‑
ovlapsr:5
’‑
gtgcacgcgtacgtaaggttgctacccactgtggcaaat
‑3’
;(用于扩增ntimk2s片段)waxy
‑
ovlapf:5
’‑
aaccttacgtacgcgtgcac
‑3’
,(用于扩增waxy片段)waxy
‑
salr:5
’‑
acgcgtcgaccactgaattgaattgtttaagg
‑3’
;(用于扩增waxy片段及 ntimk2s
‑
w)ntimk2
‑
asf:5
’‑
acgcgtcgacgctacccactgtggcaaat
‑3’
,(用于扩增ntimk2as)ntimk2
‑
asr:5
’‑
cgggagctcagcaaaacaacccaacgat
‑3’
;(用于扩增ntimk2as)。
40.随后,利用上述引物分别pcr扩增正向干涉片段s、反向干涉片段as、waxy (w)(中间link序列)片段序列。pcr扩增时,50
µ
l扩增体系设计如下:模板,0.5μl;10
×
buffer,5 μl;dntp mixture (2 mm),4 μl;f引物 (10 μm),0.5 μl;r 引物(10 μm),0.5μl;kod酶 (1u/μl),1μl;ddh2o,加至50 μl;pcr反应程序:94℃、5min;98℃、30sec,56℃、30sec,68℃、40sec,32个循环;68℃、5min;25℃、1min;再后,对正向干涉片段s与进行waxy (w) 重叠延伸pcr扩增(模板为稀释10倍后上述pcr扩增产物,具体体系及扩增程序参考上述即可),以获得沉默用片段序列;最后,对pcr产物进行琼脂糖凝胶电泳,胶回收试剂盒回收目的片段后,参考现有技术中常规操作,将扩增产物序列分别克隆至blunt3载体(peasy
®‑
blunt3 cloning vector,全式金),最终构建s
‑
w ta克隆载体和as ta克隆载体(blunt3载体为骨架);挑选阳性克隆子进行菌液pcr鉴定和测序鉴定,确保克隆序列正确。
41.其中,对s
‑
w ta重组载体的菌液pcr鉴定结果如图4所示,可以看出,其片段大小符合预期。进一步的测序分析结果也进一步证明了重组正确。
42.(二)酶切、连接,构建基因沉默用重组质粒对步骤(一)中所构建的s
‑
w ta重组载体进行kpni、sali双酶切,对as ta重组载体进行sali、spei双酶切,分别回收相应的外源片段;同步地,对ds1301载体进行kpni、spei双酶切(ds1301载体结构如图5所示);利用t4 dna连接酶,将上述所回收的外源片段与酶切后的ds1301载体进行连接(连接片段结构示意图如图6所示)。
43.随后,将连接产物电转化到大肠杆菌感受态细胞,进一步筛选后,挑取阳性克隆子,进行菌液pcr鉴定,并进一步进行测序鉴定,确保重组正确。
44.菌液pcr鉴定结果如图7所示。分析后可以看出,其片段大小均符合预期。进一步的测序分析结果也进一步证明了重组正确,即成功获得了基因沉默质粒。
45.(三)转化烟草植株,获得ntimk2基因沉默植物参考前述操作及现有常规操作,利用所构建的基因沉默质粒,进一步转化农杆菌菌株,并制备转染液,随后转化烟草,并筛选鉴定获得ntimk2基因沉默植物。
46.实验结果需要解释和说明的是,对实施例2、3中转化后的超表达植株和基因沉默植株进行鉴定时,以nptii基因为目标基因(阳性植株中含有nptii基因),采用pcr扩增方法进行鉴定。
47.pcr鉴定时,引物序列设计如下:nptiif68:5
’‑
actgggacaacagacaatcg
‑3’
,nptiir356:5
’‑
gcatcagccatgatggatacttt
‑3’
。
48.以待鉴定植物基因组为模板(cdna模板),利用上述引物进行pcr扩增时,阳性植株扩增片段长度为289 bp。
49.对抗性筛选后获得的28株基因沉默ntimk2
‑
rnai植株的pcr扩增产物的电泳检测结果如图8所示,可以看出,尽管抗性筛选所得植株中nptii基因表达量有所差异,但最终确实获得了成功转化的基因沉默植株。
50.对抗性筛选后获得的基因超表达的33株ntimk2
‑
oe转化植株的pcr扩增产物的电泳检测结果如图9所示,可以看出,类似的,尽管不同植株中nptii表达量有所差异,但确实获得了成功转化的超表达植株。
51.进一步地,基于上述pcr鉴定结果,发明人分别对超表达株系和基因沉默株株系中ntimk2基因表达量情况进行了检测分析。
52.检测分析时,分别提取超表达株系和基因沉默株系的rna(以幼苗生长三周后同一部位的第4片叶为样品),进行qrt
‑
pcr检测分析。结果如图10所示。
53.从图10a可以看出,在基因沉默株系中,不同株系的ntimk2表达量有明显差别。但ri
‑
8、ri
‑
19、ri
‑
21、ri
‑
22、ri
‑
52、ri
‑
54 这6株ntimk2基因表达量均明显低于野生型,因此,均为沉默有效的株系。可以用于后续研究。
54.从图10b可以看出,不同株系中ntimk2的超表达量有明显差别,其中:oe
‑
9、oe
‑
10、oe
‑
11、oe
‑
21、oe
‑
34、oe
‑
52、oe
‑
58这7株ntimk2基因超表达效率最好。
55.进一步地,利用western blot技术,对超表达株系中蛋白水平进行了检测。结果如图10c所示。分析可以看出,oe
‑
11、oe
‑
52这两个株系的基因超表达效率最好,这一结果与前述的基因表达量检测结果是一致的。
56.在上述表达量检测结果基础上,以野生型为对照,发明人进一步分别对超表达株系中表达量最高的转化烟草植株oe
‑
52和基因沉默株系中表达量最低的的转化烟草植株ri
‑
21进行了干旱处理,具体处理方式为烟草幼苗正常生长三周后,(停止浇水)干旱7天,并对其干旱表型进行观察分析。
57.干旱处理结束后,对不同株系的形态表型情况进行观察和统计分析。结果如图11
所示。具体而言:通过叶片形态观察可以看到,ntimk2沉默株系与野生型相比,叶片明显枯萎,而ntimk2过表达株系叶片饱满,与野生型并无差异,通过测定含水量进一步验证了这一现象,ntimk2沉默株系叶片含水量明显低于野生型,ntimk2过表达株系明显高于野生型。
58.总体而言,上述结果表明:ntimk2基因超量能提高抗旱能力,rnai 沉默株系对干旱敏感。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。