有效靶向基因组操纵剂的增强选择
1.相关申请的交叉引用
2.本技术要求于2019年2月5日提交的题为“systems and methods for chip
‑
assisted crispr”的美国非正式专利申请第62/801,555号、于2019年6月25日提交的题为“systems and methods for electronic detection of cleavage and collateral activity of crispr
‑
associated endonucleases”的美国非正式专利申请第62/866,312号、以及于2019年8月7日提交的题为“devices and methods for label
‑
free detection of analytes”的美国非正式专利申请第62/883887号的优先权,上述申请中的全部在法律允许的范围内通过引用以其整体并入本文。
技术领域
3.本文公开的主题涉及生物传感器系统和试验,并且更具体地涉及用于有效靶向基因组操纵剂的增强选择的设备、方法、计算机程序产品和系统。
背景技术:
4.靶向基因组操纵已经变成生物学和医学中非常有效的工具。例如,一些靶向基因组操纵技术通过细胞的dna修复机制执行基因编辑,以在基因组中的精确位置处产生双链断裂(“dsb”)、通过在dsb处引入插入缺失来敲除特定基因。当与产生特定dna序列的副本的载体共转染时,靶向基因组操纵技术可以在dsb处引入新的dna序列,从而允许例如使用工作副本替换经改变的基因或功能失调的基因。对于基因组操纵靶向组分的各种筛选和验证工具包括体外方法、体内方法和计算机(例如,计算机模拟)方法。
技术实现要素:
5.一个总体方面包括:第一基于芯片的生物传感器和第二基于芯片的生物传感器,所述第一基于芯片的生物传感器和所述第二基于芯片的生物传感器分别可以包括一个或更多个感测表面,所述一个或更多个感测表面被配置成对核酸样品与使用靶向基因组操纵剂功能化的一个或更多个捕获表面之间的生物分子结合相互作用进行检测,靶向基因组操纵剂具有基因组操纵组分和靶向组分,其中,一个或更多个捕获表面在一个或更多个感测表面的感测范围内,以及其中,第一基于芯片的生物传感器被配置成保持使用被配置成结合至与核酸样品的靶上序列重叠的序列的阻断剂来可选择地培育的核酸样品的第一等分试样,以及第二基于芯片的生物传感器被配置成保持省略了阻断剂的核酸样品的第二等分试样。所述设备还包括测量控制器,所述测量控制器被配置成对响应于第一等分试样和第二等分试样中的核酸样品与第一基于芯片的生物传感器和第二基于芯片的生物传感器的功能化捕获表面上的靶向基因组操纵剂之间发生的生物分子结合相互作用而产生的一个或更多个第一响应信号和第二响应信号进行测量。所述设备还包括分析模块,所述分析模块被配置成基于执行第一响应信号和第二响应信号的比较来确定与靶向基因组操纵剂相关联的一个或更多个基因组操纵效率参数。该方面的其他实施方式包括记录在一个或更多
个计算机存储装置上的相应计算机系统、设备和计算机程序,以上每一个都被配置成执行方法的动作。
6.一个总体方面包括:制备分别可以包括核酸样品的第一等分试样和第二等分试样,其中:核酸样品被测量以对分配至一个或更多个感测表面的核酸样品与靶向基因组操纵剂之间的生物分子结合相互作用进行检测,靶向基因组操纵剂具有基因组操纵组分和靶向组分并被功能化成一个或更多个感测表面的感测范围内的捕获表面;使用阻断剂可选择地培育第一等分试样,所述阻断剂被配置成结合至与核酸样品的靶上序列重叠的序列;以及第二等分试样省略了阻断剂。所述方法还包括:对响应于第一等分试样和第二等分试样中的核酸样品与第一基于芯片的生物传感器和第二基于芯片的生物传感器的功能化捕获表面上的靶向基因组操纵剂之间发生的生物分子结合相互作用而产生的一个或更多个第一响应信号和第二响应信号进行测量;基于将一个或更多个第一响应信号与一个或更多个第二响应信号进行比较来确定靶向基因组操纵剂的效率参数。该方面的其他实施方式包括记录在一个或更多个计算机存储装置上的相应计算机系统、设备和计算机程序,以上每一个都被配置成执行方法的动作。
7.一个总体方面包括一种可以包括计算机可读存储介质的计算机程序产品,所述计算机可读存储介质具有以计算机程序产品实施的程序指令,所述程序指令响应于核酸样品与靶向基因组操纵剂之间发生的生物分子结合相互作用,控制由第一基于芯片的生物传感器和第二基于芯片的生物传感器产生的一个或更多个第一响应信号和第二响应信号的测量,所述靶向基因组操纵剂具有操纵组分和靶向组分并且被功能化成在第一基于芯片的生物传感器和第二基于芯片的生物传感器的一个或更多个相应感测表面的感测范围内的捕获表面,其中:第一基于芯片的生物传感器被配置成保持使用阻断剂可选择地培育的核酸样品的第一等分试样,所述阻断剂被配置成结合至与核酸样品的靶上序列重叠的序列;以及第二基于芯片的生物传感器被配置成保持省略了阻断剂的核酸样品的第二等分试样。所述产品可以进一步使处理器基于执行第一响应信号和第二响应信号的比较分析来确定与靶向基因组操纵剂相关联的一个或更多个基因组操纵效率参数。该方面的其他实施方式包括记录在一个或更多个计算机存储装置上的相应计算机系统、设备和计算机程序,以上每一个都被配置成执行方法的动作。
附图说明
8.将通过参照附图中示出的特定实施方式来呈现上面简要描述的实施方式的更具体的描述。应当理解,这些附图仅描绘了一些实施方式并且因此不应认为是对范围的限制,将通过使用附图以附加的独特性和细节来描述和说明实施方式,在附图中:
9.图1是示出根据本公开内容的一个或更多个方面的用于有效靶向基因组操纵剂的增强选择的系统的示意性框图;
10.图2是示出根据本公开内容的一个或更多个方面的用于有效靶向基因组操纵剂的增强选择的设备的示意性框图;
11.图3a是示出根据本公开内容的一个或更多个方面的用于有效靶向基因组操纵剂的增强选择的方法的图;
12.图3b是示出根据本公开内容的一个或更多个方面的阻断剂(blocking agent)的
示例性实现方式的放大细节图;
13.图4是示出根据本公开内容的一个或更多个方面针对有效靶向基因组操纵剂的增强选择而使用具有生物门控晶体管的基于芯片的生物传感器的示例性实现方式的图;
14.图5a示出了根据本公开内容的一个或更多个示例的使用靶向基因组操纵剂功能化的捕获表面的实现方式;
15.图5b示出了根据本公开内容的一个或更多个示例的使用靶向基因组操纵剂功能化的捕获表面的实现方式;
16.图5c示出了根据本公开内容的一个或更多个示例的用于对使用靶向基因组操纵剂功能化的一个或更多个捕获表面进行检测的感测表面的实现方式;
17.图6示出了根据本公开内容的一个或更多个示例的用于确定关于固定至感测表面的靶向基因组操纵剂的结合效率参数的方法;
18.图7示出了根据本公开内容的一个或更多个示例的用于使用固定至感测表面的双链核酸来确定关于的靶向基因组操纵剂的结合效率参数的方法;
19.图8示出了根据本公开内容的一个或更多个示例的在基因组操纵参数的测量之后用于测序的核酸样品的片段化和衔接子连接;
20.图9示出了根据本公开内容的一个或更多个示例的在基因组操纵参数的测量之后用于测序的核酸样品的片段化和衔接子连接;
21.图10示出了根据本公开内容的一个或更多个示例的在基因组操纵效率参数的测量之后用于测序的核酸样品的标记化;
22.图11示出了根据本公开内容的一个或更多个示例使用所选择的靶向基因组操纵剂用于制备用于测序的核酸样品;以及
23.图12是示出根据本公开内容的一个或更多个示例的用于有效靶向基因组操纵剂的增强选择的方法的示意性流程图。
具体实施方式
24.如本领域技术人员将理解的,本公开内容的各方面可以实现为系统、方法或程序产品。因此,各方面或实现方式可以采用完全硬件实现方式、完全软件实现方式(包括固件、驻留软件、微代码等)或者结合软件方面和硬件方面的实现方式的形式,这些形式在本文中通常均可以被称为“电路”、“模块”、“控制器”或“系统”。此外,所公开的主题的各方面可以采用在存储机器可读代码、计算机可读代码和/或程序代码(下文中称为代码)的一个或更多个计算机可读存储装置中实现的程序产品的形式。存储装置可以是有形的、非暂态的和/或非传送的。存储装置可以不包括信号。在某个实现方式中,存储装置仅采用用于访问代码的信号。
25.本说明书中描述的特定功能性单元已经被标记为模块或控制器,以便更具体地强调可以使用的实现选项。例如,模块或控制器的一些功能可以被实现为包括定制的vlsi电路或门阵列、成品半导体例如逻辑芯片、晶体管或其他分立部件的硬件电路。模块或控制器也可以在例如现场可编程门阵列、可编程阵列逻辑、可编程逻辑装置等的可编程硬件装置中实现。
26.各种模块或控制器也可以部分或全部以用于由各种类型的处理器执行的代码和/
或软件来实现。所识别的控制器或代码的模块可以例如包括可以例如被组织为对象、过程或函数的可执行代码的一个或更多个物理块或逻辑块。然而,所识别的控制器或模块的可执行部分不需要在物理上位于一起,而是可以包括存储在不同位置的不同指令,当这些不同指令在逻辑上结合在一起时包括所述模块并且实现针对控制器或模块的所述目的。
27.实际上,控制器或代码的模块可以是单个指令或许多指令,并且甚至可以分布在若干个不同的代码段上、分布在不同的程序中以及跨若干个存储器装置来分布。类似地,操作数据在本文中可以被标识和图示为在模块内,并且可以以任何合适的形式来实施并且可以被组织在任何合适类型的数据结构内。操作数据可以被收集为单个数据集,或者可以分布在不同位置上,包括分布在不同计算机可读存储装置上。在控制器、模块或其部分以软件实现的情况下,软件部分被存储在一个或更多个计算机可读存储装置上。
28.可以利用一个或更多个计算机可读介质的任何组合。计算机可读介质可以是计算机可读存储介质。计算机可读存储介质可以是存储代码的存储装置。存储装置可以是例如但不限于电子的、磁的、光学的、电磁的、红外的、全息的、微机械的或半导体系统、设备或装置,或者前述的任何合适的组合。
29.存储装置的更具体示例(非详尽列表)将包括以下:具有一个或更多个布线的电连接、便携式计算机磁盘、硬盘、随机存取存储器(ram)、只读存储器(rom)、可擦除可编程只读存储器(eprom或闪存)、便携式光盘只读存储器(cd
‑
rom)、光学存储装置、磁存储装置或前述的任何合适的组合。在本文档的上下文中,计算机可读存储介质可以是任何有形介质,所述有形介质可以包括或存储由指令执行系统、设备或装置使用或者与指令执行系统、设备或装置结合使用的程序。
30.可以以一种或更多种编程语言的任何组合来编写用于执行针对一些实现方式的操作的代码,所述编程语言包括面向对象编程语言例如python、ruby、java、smalltalk、c 等以及常规过程性编程语言例如“c”编程语言等以及/或者机器语言例如汇编语言。代码可以完全在用户的计算机上执行、部分地在用户的计算机上执行、作为独立的软件包执行、部分地在用户的计算机上以及部分地在远程计算机上执行,或者完全在远程计算机或服务器上执行。在后一种情形下,远程计算机可以通过包括局域网(lan)或广域网(wan)的任何类型的网络连接至用户的计算机,或者可以(例如通过使用因特网服务提供商的因特网)与外部计算机进行连接。
31.贯穿本说明书中对“一个方面”、“方面”或类似语言的引用意指结合该方面描述的特定特征、结构或特性被包括在至少一个实现方式中。因此,除非另外明确地指出,否则贯穿本说明书的短语“在一个实现方式中”、“在实现方式中”以及类似的语言的出现可以但不必都指代相同的实现方式,而是意指“一个或更多个但并非所有的实现方式”。除非另外明确地指出,否则术语“包括”、“包括有”、“具有”及其变型意指“包括但不限于”。除非另外明确地指出,否则列举的项的列表并不暗指这些项中的任何项或全部项是互相排斥的。除非另外明确地指出,否则术语“一”、“一个”和“该”也指“一个或更多个”。
32.此外,可以以任何合适的方式组合这些方面或实现方式的所描述的特征、结构或特性。在以下描述中,提供了大量具体细节例如编程、软件模块、用户选择、网络交易、数据库查询、数据库结构、硬件模块、硬件电路、硬件芯片等的示例,以提供对各方面和各实现方式的透彻理解。然而,相关领域的技术人员将认识到,可以在不利用具体细节中的一个或更
多个具体细节的情况下或者利用其他方法、部件、材料等来实践实现方式。在其他情况下,未详细示出或描述公知的结构、材料或操作以避免使实现方式的各方面模糊。
33.下面参照根据示例的方法、设备、系统以及程序产品的示意性流程图和/或示意性框图来描述所公开的实现方式的各方面。将理解,可以通过代码来实现示意性流程图和/或示意性框图中的一些块以及示意性流程图和/或示意性框图中的块的组合。可以将该代码提供至通用计算机、专用计算机或其他可编程数据处理设备的处理器以产生机器,使得经由计算机或其他可编程数据处理设备的处理器执行的指令创建用于实现在示意性流程图和/或示意性框图的一个或更多个块中指定的功能/动作的手段。
34.附图中的示意性流程图和/或示意性框图示出了根据各种实施方式的设备、系统、方法和程序产品的可能实现方式的架构、功能和操作。关于这点,示意性流程图和/或示意性框图中的每个块可以表示代码模块、代码段或代码的一部分,其包括用于实现所指定的逻辑功能的代码中的一个或更多个可执行指令。
35.还应当注意,在一些替选实现方式中,在块中标记的功能可以以不同于附图中标记的顺序发生。例如,连续示出的两个块实际上可以基本上同时执行,或者这些块有时可以以相反的顺序执行,这取决于所涉及的功能。可以设想在功能、逻辑或效果上等同于所示出的附图中的一个或更多个块或这些块中的一部分的其他步骤和方法。
36.尽管可以在流程图和/或框图中采用各种箭头类型和线类型,但是它们要被理解为不限制相应方面或实现方式的范围。实际上,一些箭头或其他连接符可以用于仅指示所描绘的示例性方面的逻辑流。例如,箭头可以指示在所描绘的示例性实现方式的所列举步骤之间的未指定持续时间的等待或监测时间段。还应注意,框图和/或流程图中的每个块以及框图和/或流程图中的块的组合可以由执行特定功能或动作的基于专用硬件的系统或专用硬件和代码的组合来实现。
37.每个附图中对元件的描述可以参考前面附图的元件。除非明确指出或从上下文中以其他方式清楚,相同的附图标记指代包括涉及相同元件的替选实现方式的全部附图中的相同元件。
38.如本文中所使用的,使用“和/或”连词的列表包括列表中的任何单个项目或列表中的项目的组合。例如,a、b和/或c的列表包括仅a、仅b、仅c、a和b的组合、b和c的组合、a和c的组合或者a、b和c的组合。如本文中所使用的,使用术语“中的一个或更多个”的列表包括列表中的任何单个项目或列表中的项目的组合。例如,a、b和c中的一个或更多个包括仅a、仅b、仅c、a与b的组合、b与c的组合、a和c的组合或者a、b和c的组合。如本文中所使用的,使用术语“其中之一”的列表包括列表中任何单个项目中的一个且仅一个。例如,“a、b和c其中之一”包括仅a、仅b或仅c并且不包括a、b和c的组合。如本文中所使用的,“选自由a、b和c组成的组中的构件”包括a、b或c中的一个且仅一个,并且不包括a、b和c的组合。如本文中所使用的,“选自由a、b和c及其组合组成的组中的构件”包括仅a、仅b、仅c、a和b的组合、b和c的组合、a和c的组合或者a、b和c的组合。
39.本公开内容描述了用于有效靶向基因组操纵剂的增强选择的方法、系统和设备的各个方面和实现方式。所描述的方面的各种示例解决了与用于选择靶向基因组操纵剂的现有方法相关的许多缺点。
40.定义。如本文中所使用的,术语“珠状物(bead)”是指直径在约1nm至10μm范围内
的、具有被配置成与溶液中分子的相应组分结合的功能化表面的颗粒。一些珠状物是磁性的,而其他珠状物是非磁性的。珠状物的非限制性示例包括使用链霉亲和素涂层功能化的颗粒,该涂层被配置成与溶液中的生物素化分子结合。用于使珠状物表面功能化的材料的其他非限制性示例包括抗体、链霉亲和素、中性亲和素、亲和素、凯普亲和素(captavidin)、锌指蛋白、crisprcas家族酶、核酸和合成核酸类似物例如肽核酸、异种核酸等。
41.如本文中所使用的,术语“结合(binding)”是指基因组操纵剂与其核酸靶标之间的静电相互作用。非限制性示例包括通过例如使用talen或zfn基因组操纵技术的蛋白
‑
核酸相互作用或者通过核糖蛋白复合物例如crispr cas9和靶标子(targetron)促进的相互作用。
42.如本文中所使用的,术语“生物门控晶体管”是指通过由分子结合引起的表面电势变化来门控的晶体管。
43.如本文中所使用的,术语“生物分子”是指涉及由生物有机体产生的任何分子,所述分子包括大聚合物分子例如蛋白质、多糖、脂质和核酸(dna和rna)以及小分子例如初级代谢物、次级代谢物和其他天然产物。
44.如本文中所使用的,术语“基于芯片的生物传感器”是指包括布置在固体支承物上的一个或更多个固体二维传感器元件的装置,所述固体二维传感器元件直接或间接地响应于样品中的关于或足够接近于产生适用于放大、滤波、数字化以及其他模拟和数字信号处理操作的电或电磁响应信号的相似生化或生物分子分析物或相互作用或者二者的存在。一些“基于芯片的生物传感器”包括多个晶体管和多个检测部分,其中所述晶体管至少其中之一是液体门控晶体管。
45.如本文中所使用的,术语核酸的“裂解”或“切割”是指核酸分子的共价骨架的断裂。可以通过各种方法引发裂解,所述方法包括但不限于磷酸二酯键的酶促水解或化学水解。关于dna,本文中所使用的术语“裂解”或“切割”是指由于两个不同的单链断裂事件而发生的双链裂解。dna裂解可能导致产生平末端或交错的“粘性”末端。
46.如本文中所使用的,术语“dna识别复合物”在基因组操纵技术的上下文中可以指用于靶向特定区域、序列、或基因组的位点的蛋白、天然存在或人工开发的核酸或者核酸和蛋白的复合物。dna识别复合物的非限制性示例可以包括在crispr、指导rna和cas核酸酶例如cas9、cas13或有活性或突变以防止dsb的另一工程化cas核酸酶的上下文中。关于转录激活因子样效应核酸酶(talen)或者使用tal(转录激活因子样效应因子)例如tal
‑
脱氨酶的其他编辑基因组技术的dna识别复合物,其中,dna识别复合物是转录激活因子样效应物与活性核酸酶例如fok1或脱氨酶的组合或者是单独的tal。关于锌指聚合酶(zing finger polymerase)或(zfp)的dna识别复合物的另一示例是由小的锌指结构域cys2his2与fok1限制酶的iis型非特异性dna裂解结构域组合而成的复合物。dna识别复合物的另一示例包括靶标子,它是具有工程化ii组内含子rna套索分子和多结构域ii组内含子编码蛋白的核糖核蛋白颗粒(rnp)。通过rna套索分子和内含子编码蛋白二者促进识别和裂解,所述rna套索分子具有核酶活性,所述内含子编码蛋白有助于通过将rna稳定在其特定序列处来进行靶向序列的识别并有助于裂解处理和通过其逆转录酶活性来插入新的dna序列。
47.如本文中所使用的,术语“核酸内切酶”是指能够催化核酸分子例如dna和/或rna内的核酸之间的键的水解(裂解)的任何野生型或变体酶。核酸内切酶的非限制性示例包括
ii型限制性核酸内切酶例如fold、hhal、hindiii、notl、bbvcl、ecori、bglll和alwi。当具有典型的长度为约12个至45个碱基对(bp)更优选地14个至45个bp的多核苷酸识别位点时,核酸内切酶的非限制性示例还包括稀切核酸内切酶。稀切核酸内切酶在限定基因座处诱导dna双链断裂(dsb)。例如,稀切核酸内切酶可以是归巢核酸内切酶、大范围核酸酶、源自工程化锌指结构域或tal效应物结构域分别与诸如fokl的限制酶、其他核酸酶或化学核酸内切酶的催化结构域融合的嵌合锌指核酸酶(zfn)或tal效应物核酸酶(talen)。核酸内切酶也可以是cas家族例如cas9、casl2、casl3等的一部分。
48.如本文中所使用的,术语“基因组操纵”是指能够修饰核酸、基因、外显子、核酸序列、基因组和/或类似核苷酸组合的组分或行为的事物。基因组操纵不限于对整个基因组的操纵,或者甚至不限于对天然存在的基因组中发现的核酸序列的操纵,而是可以包括对无论是人工衍生的或天然存在的上述组分中的任何组分的操纵。基因组操纵的非限制性示例包括基因组编辑、染色质工程、染色质成像、表观遗传编辑、基因激活、基因抑制等。
49.如本文中所使用的,术语“脱靶”是指在核酸样品的除了核酸的例如关于核酸样品的结合、裂解、编辑、操纵和/或其他生物分子相互作用的预期或期望预定位点(例如,靶向序列)之外的区域处。如本文中所使用的,术语“靶上”是指在核酸样品的与核酸的例如关于核酸样品的结合、裂解、编辑、操纵和/或其他生物分子相互作用的预期或期望预定位点(例如,靶向序列)相对应的区域处。术语“靶上加脱靶(on
‑
plus
‑
off
‑
target)”是指靶上生物分子相互作用和脱靶生物分子相互作用二者的组合。
50.如本文中所使用的,术语“靶向基因组操纵剂”是指预期或期望在预期或期望区域、位点或序列的预定位点(例如,靶向序列)处对核酸、基因、外显子、核酸序列、基因组和/或类似核苷酸组合的组分或行为进行修饰的生物分子试剂。
51.尽管存在各种基因组操纵技术,但是用于有效靶向基因组操纵剂的增强选择的系统、设备、方法和计算机程序允许特定区域、基因、位点、序列等提供对现有技术的显著改进。益处不仅扩及发现有效靶向剂,而且还扩及改善了靶向基因组操纵剂的使用。例如,关于基因组编辑,在非常精确的位置处将非突变基因靶向诱导至基因组中呈现出若干优势。首先,它使得能够将添加的dna序列诱导在染色质的被编程成精确调控所述基因的表达的区域中。其次,靶向基因组编辑还有助于防止在非靶向基因治疗中发现会导致癌症的危险随机插入。因此,通过实践本公开内容的各个方面和实现方式,还可以通过使得下游技术例如靶向基因组操纵剂的扩增、测序和治疗用途被更有效地利用来提高这些下游技术的效率。
52.其他基因组操纵技术不会产生双链断裂dsb,而是校正导致有害基因的单核苷酸多态性。这种技术通常使用脱氨酶或其他dna修复酶来将突变逆转成野生型核苷酸碱基。另一类靶向基因组操纵技术不会改变dna,而是靶向驱动重要基因的表达的表观遗传密码。
53.靶向基因组操纵技术的各个方面在它们修复遗传密码或修饰表观遗传密码的方式上有所不同。然而,各种基因组操纵技术都使用靶向待修饰或影响的区域或基因的系统。用于有效靶向基因组操纵剂的增强选择的系统、设备、方法和计算机程序利用相对快速和不昂贵的电子生物传感系统,从而例如通过提高靶向精度以及减少用于这种筛选和验证的成本和时间来改进靶向基因组操纵技术。
54.本文中描述的系统、设备、方法和计算机程序产品的各个方面可以与不同的靶向
基因组操纵系统一起使用。例如,对于靶向基因组编辑系统,第一组特定dna序列靶向系统经由蛋白与dna的相互作用实现特定dna序列靶向。第一组中的系统可以包括例如大范围核酸酶(“mn”)、锌指核酸酶(zfn)和转录激活因子样效应物核酸酶(“talen”)。
55.第二组特定dna序列靶向系统经由核酸之间的相互作用实现特定dna序列靶向。第二组中的系统包括例如靶标子肽核苷酸三链形成寡核苷酸(“tfo”)、结构指导的核酸内切酶(“sgn”)和规律间隔成簇短回文重复序列(“crispr”)。
56.虽然本公开内容的各个方面可以与以上靶向技术中的任何靶向技术一起使用,但是将这些方面应用于第二组——且尤其是crispr
‑
cas9——有助于通过仅将指导修饰酶或核酸酶的核酸序列改变成它们的靶标来容易地靶向基因组中的期望序列。
57.利用现有技术,设计在没有脱靶位点识别的情况下提供有效靶标识别的指导核酸并不容易实现,特别是对于复杂的基因组例如人类基因组。附加地,特定核酸位点与靶向基因组操纵剂的脱靶结合的存在可能会产生超出时间和资源的无效使用的问题。例如,如果指导rna(“grna”)未被精心设计和测试,则crispr
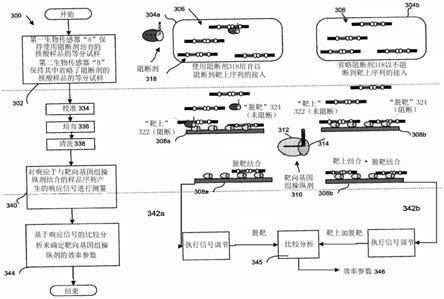
‑
cas9(最成功的基因组编辑技术之一)可能表现出在脱靶位点处进行编辑的显著可能性。反之,通过crispr
‑
cas9在脱靶位点进行编辑可能导致非特异性和/或非预期的遗传修饰例如有害突变和染色体畸变。
58.一些现有工具和/或方法评估了crispr相关grna的靶上位点效率和推定的脱靶位点,但是具有可以通过本公开内容的各个方面解决的缺陷。这种现有工具和/或方法可以被分成三组:计算机方法、体内方法和体外方法。
59.计算机方法(例如,计算机模拟)可以用于第一高水平筛选,以消除具有无法与靶上位点有效工作的高可能性的grna。然而,现有计算机方法尚未能够呈现用以确定grna将如预测的那样在现实世界应用中起作用的能力。此外,现有计算机方法可以用于预测特定grna的脱靶推定识别位点,但是缺乏制作可靠工具所需要的灵敏度和特异性,因为计算机方法可能遗漏某些重要的脱靶推定位点(例如,有效的指导rna的假阳性确定),并且可能给出体内未发现的推定脱靶位点的非常高的背景(例如,体内有效的指导rna的假阴性或拒绝)。
60.体外方法,例如,已经开发了通过分解追踪插入缺失(“tide”)、扩增子分析插入缺失检测(“idaa”)和错配裂解分析例如t7核酸内切酶i(“t7e1”)或surveyor核酸酶,用于评估grna裂解效率。然而,这样的方法需要转染细胞步骤,这使得它们比本文描述的不需要转染细胞步骤的各种系统、设备、方法和计算机程序产品更加用户不友好且更繁琐。
61.体内方法可以用于脱靶推定位点发现。例如,诸如guide
‑
seq或digenome
‑
seq的一些体内方法被一些人认为是用于评估针对grna的脱靶位点的良好预测工具。然而,这样的方法具有缺点。例如,guide
‑
seq需要双链寡核苷酸的有效递送,这在某些剂量下可能对某些细胞类型有毒并且尚未在体内模型中得到证实。体内方法繁琐、耗时、昂贵且更难以进行重现。体内方法也可能受到细胞适应性的影响(例如,可能对细胞固定的时间敏感)并且可能需要使用相对大量的细胞和/或转染或转导的细胞。
62.因此,已经开发了可以更方便的某些体外方法来克服体内方法的一些限制。体外方法的一些示例包括circle
‑
seq和site
‑
seq,它们丰富了在全基因组中发现的推定crispr cas9脱靶位点,然后通过下一代测序(“ngs”)对所述脱靶位点进行测序。尽管在过去20年中在降低每个人类基因组的ngs平均成本方面取得了重大进展,但是在过去5年中,ngs成本的
急剧下降已经显著地趋于平稳,并且这种方法在用于对针对相对于本公开内容的各种基因组生物感测系统和方法的grna效率进行筛选方面仍然是相当昂贵的。此外,许多体外方法对于作为评估体内cas9活性方面的决定因子的染色质效果不佳。wo2018097657(a1)的摘要中描述了一种直接在染色质上评估crispr
‑
cas9脱靶位点的方法。然而,该方法不提供脱靶推定位点的富化,并且需要全基因组测序来评估脱靶推定位点。
63.因此,本公开内容的各个方面还可以用于使用以下描述的基于芯片的生物传感器系统和方法来增强脱靶推定位点发现,以提供低得多的成本、更快的筛选和验证以及针对脱靶位点发现的更好的精确度。某些基于芯片的生物传感器(例如,利用场效应生物感测的生物传感器)提供了比非基于芯片的或者涉及昂贵的流体和/或精密光学测量装置的其他测量技术更快的、可以以更低的成本制造的、具有更高可重复性和更低复杂性的无标记测量。
64.图1是示出根据本公开内容的一个或更多个方面的用于有效靶向基因组操纵剂的增强选择的系统100的示意性框图。各种实现方式中的系统100包括样品制备设备112、生物分子测量设备102、计算装置114、富化设备118、测序设备120和数据网络122中的一个或更多个。
65.在至少一个实现方式中,生物分子测量设备102包括第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b。在各种实现方式中,生物分子测量设备还包括测量控制器124,该测量控制器124被配置成对响应于第一等分试样和第二等分试样中的核酸样品与第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b的功能化捕获表面上的靶向基因组操纵剂之间发生的生物分子结合相互作用而产生的一个或更多个第一响应信号和第二响应信号进行测量。第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b。在某些实现方式中,每个基于芯片的生物传感器104a、104b都具有被配置成在一个或更多个感测表面106a、106b的感测范围内对核酸样品108与一个或更多个捕获表面126之间的生物分子结合相互作用进行检测的一个或更多个感测表面106a、106b。
66.在图1中,基于芯片的生物传感器104a、104b被描绘为彼此分开并且可以从生物分子测量设备102的底盘移除。在一些实现方式中,第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b可以被实现为例如使得第一生物传感器、第二生物传感器和/或更多生物传感器由相同的基板支承。类似地,一个或更多个感测表面106a、106b可以以各种阵列配置布置并且可以被配置为相同或不同。此外,第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b可以是以不可移动的配置实现。在各种实现方式中,生物分子测量设备102包括测量控制器124,该测量控制器124被配置成对响应于第一等分试样和第二等分试样中的核酸样品与第一基于芯片的生物传感器和第二基于芯片的生物传感器的功能化捕获表面上的靶向基因组操纵剂之间发生的生物分子结合相互作用而产生的一个或更多个第一响应信号和第二响应信号进行测量。
67.在某些实现方式中,第一基于芯片的生物传感器104a被配置成保持使用阻断剂110可选择地培育的核酸样品108的第一等分试样108a,所述阻断剂110被配置成与核酸样品108的靶上序列重叠的序列结合。在各种实现方式中,使用阻断剂110的培育是有用的,因为它使得第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b二者能够利用相同的功能化捕获表面。在这种实现方式中,第二基于芯片的生物传感器104b被配置成
保持省略了阻断剂110的核酸样品108的第二等分试样108b。
68.替代在第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b二者上使用相同功能化捕获表面,基于芯片的生物传感器其中之一可以利用除了被测试的靶向基因组操纵剂之外的结合部分功能化。例如,在本公开内容的一些方面,可以通过利用靶向基因组操纵剂的版本使第一基于芯片的生物传感器功能化来比较分析裂解效率参数,其中,从第一等分试样中省略阻断剂并且第一基于芯片的生物传感器和第二基于芯片的生物传感器使用相同的靶向组分(例如,相同的grna),其中,被功能化成与第一基于芯片的生物传感器相关联的捕获表面的基因组操纵组分被配置成不裂解核酸样品,而被功能化成与第二基于芯片的生物传感器相关联的捕获表面的基因组操纵组分被配置成裂解核酸样品。利用这种布置,可以比较分析裂解效率参数。例如,可以通过选择用于在第一基于芯片的生物传感器上培育核酸样品的去活操纵组分例如crispr
‑
dcas9并选择据称执行裂解的操纵组分例如crispr
‑
cas9使用相同的核酸样品等分试样和相同的rna比较裂解参数。
69.在一些实现方式中,在样品容器例如pcr管或其他所选择的容器中手动制备第一等分试样108a和第二等分试样108b。在其他实现方式中,第一等分试样108a和第二等分试样108b通过样品制备设备112自动或半自动地制备,该样品制备设备112包括例如由分配机器人和/或流体系统执行的自动分配。在这种实现方式中,样品制备设备112可以包括其自身的控制器和用于设置培育的时间、温度等的用户界面。在其他实现方式中,样品制备设备112可以通过数据网络122从诸如计算装置114的另一装置乃至生物分子测量设备102接收命令。
70.生物分子测量设备102的某些实现方式可以根据用于感测核酸样品与靶向基因组操纵剂之间的生物分子相互作用的技术而变化。例如,在基于芯片的生物传感器104a、104b使用场效应生物感测的实现方式中(例如图4的设备400中所描绘的),可以在无需用以执行测量的流通池或流体推进构件的情况下测量无标记核酸样品的生物分子结合和/或裂解相互作用。在其他实现方式中,生物分子测量设备102使用包括流通池的基于芯片的生物传感器104。因此,可以根据本公开内容的一个或更多个实现方式使用本文中描述的设备、系统和方法的各种实现方式。以下在图2中描绘的设备200和图4中描绘的设备400的描述中更详细地描述生物分子测量设备102。在某些实现方式中,生物传感器104可以包括(但不是通过限制的方式)使用太赫兹光谱、表面增强光谱、石英晶体微天平、光栅耦合干涉测量等的各种类型的基于芯片的生物传感器。
71.系统100包括分析模块116。在一些实现方式中,使用计算装置114来实现分析模块116。在各种实现方式中,分析模块116被配置成基于执行第一响应信号和第二响应信号的比较分析来确定与靶向基因组操纵剂相关联的一个或更多个基因组操纵效率参数,所述第一响应信号和所述第二响应信号可以是由生物分子测量设备102的测量控制器124产生的第一组响应信号和第二组响应信号。
72.在某些实现方式中,分析模块116可以被编程成执行在使用基于芯片的生物传感器确定的基因组操纵效率参数与使用一个或更多个其他方法例如上述各种计算机方法、体外方法和体内方法确定的相应基因组操纵效率参数之间的比较分析。例如,在根据以下描述的方法800、900、1000、1100和1200中的一个或更多个方法执行片段化和衔接子连接之后,可以将基于芯片的生物传感器的分析结果与使用上述技术中的任一技术针对相同或相
似的靶向基因组操纵剂获得的体内、体外和/或计算机结合和/或裂解效率结果中的一个或更多个进行比较分析。因此,本公开内容的各种系统、设备和方法通过增强有效靶向基因组操纵剂的选择来改进这种体内、体外和/或计算机结合和/或裂解效率确定技术,并且通过提供用于利用或使用这种技术进行比较分析或验证的独立派生数据来进一步改进这种技术。
73.在某些实现方式中,分析模块可以在与生物分子测量设备102分开的装置上实现。例如,在某些实现方式中,分析模块116在计算装置114上实现。计算装置114可以是膝上型计算机、台式计算机、智能电话、手持计算装置、平板计算装置、虚拟计算机或集成至仪器中的嵌入式计算装置。计算装置包括处理器218、存储器220、通信接口222和键盘显示器或类似的视觉输出。在一些实现方式中,分析模块116完全地在计算装置内实现,而在其他实现方式中,分析模块116至少部分地在生物分子测量设备102中实现。
74.在分析模块116在计算装置114上实现的实现方式中,计算装置114可以通过数据网络122与测量控制器124进行通信。类似地,分析模块116可以将数据传送至系统的其他部件例如富化设备118、测序设备120和/或样品制备设备112。
75.在一些实现方式中,计算装置114是生物分子测量设备102的一部分并且可以利用生物分子测量设备102的处理器、存储器和通信接口来对响应于第一等分试样和第二等分试样中的核酸样品与第一基于芯片的生物传感器和第二基于芯片的生物传感器的功能化捕获表面上的靶向基因组操纵剂之间发生的生物分子结合相互作用而分别产生的第一响应信号和第二响应信号或者第一组响应信号和第二组响应信号进行测量。在某些实现方式中,分析模块116可以被实现为形成基于芯片的生物传感器104a、104b的一部分的嵌入式处理器系统或其他集成电路。
76.在一个示例性实现方式中,分析模块116可以被配置成例如当第一基于芯片的生物传感器104a暴露于已经使用阻断剂110培育的核酸样品108的第一等分试样108a以及第二基于芯片的生物传感器104b暴露于省略阻断剂110的相同核酸样品108的第二等分试样108b时对来自暴露于不同溶液的相同制备的生物传感器的第一响应信号组和第二响应信号组执行比较分析。在这种情况下,分析模块116可以被配置成根据由暴露于已知浓度的靶标核酸的相同制备的生物传感器的校准测量确定的经验模型来确定检测到的核酸浓度的概率分布。
77.然后,在某些实现方式中,分析模块116可以通过从来自不使用阻断剂110的情况下的第二等分试样108b的dna(或其他核酸)的浓度概率分布(使用第二基于芯片的生物传感器104b测量)中减去来自在使用阻断剂110的情况下的第一等分试样108a的dna的计算出的浓度概率分布(使用第一基于芯片的生物传感器104a测量)来确定脱靶dna的浓度的概率分布。
78.在一些实现方式中,分析模块116可以被配置成例如当利用dcas9制备(例如,功能化)第一基于芯片的生物传感器104a以及利用具有与第一基于芯片的生物传感器104b相同的grna的cas9制备第二基于芯片的生物传感器104b时对第一响应信号组和第二响应信号组的时间依赖性进行比较分析,并且将第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b二者暴露于相同的分析物(例如,核酸样品108)以确定暴露于已知浓度的核酸样品108的cas9的裂解速率。可以例如通过计算第一信号和第二信号的直方图对所观
察到的第一响应信号和第二响应信号或者第一组响应信号和第二组响应信号的变化进行统计分析以确定核酸样品(例如,dna)结合至基于芯片的生物传感器104a、104b的时间量,所述响应信号例如漏极电流、电容等。
79.分析模块116可以被配置成通过使用诸如快速傅立叶变换的算法将第一组响应信号值和第二组响应信号值转换至频率空间中,以确定裂解的频率。这些示例是非限制性的,并且两种类型的分析普遍用于相同或不相同制备的生物传感器中以及相同或不相同制备的第一等分试样108a和第二等分试样108b的测量中。
80.在各种实现方式中,系统100可以仅包括图1中描绘的项目例如生物分子测量设备102、测量控制器124和分析模块116中的一些项目,所述分析模块116可以实现在一些实现方式中的计算装置114上或实现在生物分子测量设备102上。
81.图2是示出根据本公开内容的一个或更多个方面的用于有效靶向基因组操纵剂的增强选择的设备200的示意性框图。在一个实现方式中,设备200包括生物分子测量设备102的实例。在各种实现方式中,生物分子测量设备102包括生物传感器104例如第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b。在各种实现方式中,生物分子测量设备102还包括以下中的一个或更多个:信号调节电路204、数字化电路206、处理器208、存储器210和通信接口212。在某些实现方式中,生物分子测量设备102还包括一个或更多个样品激发装置214和一个或更多个流体装置216。
82.在一些实现方式中,流体装置216可以用于驱动样品流过流通池或者其他流体或微流体通道。如果需要,图4中描绘的生物门控晶体管实现方式也可以使用流通池,但是由于生物门控晶体管的高灵敏度,因此不需要流通池来执行高灵敏度测量。
83.在各种实现方式中,生物传感器104包括被配置成对核酸样品108与生物传感器104的功能化捕获表面126之间的生物分子相互作用执行无标记感测的第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b。可以根据本公开内容的一个或更多个方面使用各种类型和技术的基于芯片的生物传感器104a、104b。例如,图4中描绘的设备400描绘了基于芯片的生物传感器的使用场效应生物感测技术用于生物分子结合相互作用的无标记检测的一种实现方式。
84.在这种实现方式中,可以测量各种生物传感器参数例如漏极电流、电化学电流(例如,栅极电流)、栅极电容、漏极阻抗、栅极阻抗、跨导、栅极曲线非线性、栅极曲线滞后、霍尔效应电压、磁阻等,以产生可以是第一组响应信号和第二组响应信号的第一响应信号和第二响应信号。
85.在一些实现方式中,一个或更多个样品激发装置214被配置成使核酸样品经受更多类型的激发,例如,电磁波谱的预定范围内的磁激发、电磁激发(例如,光、无线电波、电离电磁或其他辐射(例如,紫外光、x射线、伽马射线、电子束等))、物理激发(例如,超声波或搅动)、电激发(例如,调制栅极偏置电压)、温度激发(例如,用于控制基于芯片的生物传感器的加热和冷却的珀耳帖装置)等。在某些实现方式中,这些样品激发装置214可以由测量控制器124控制。
86.在某些实现方式中,如上所述,可以使用处理器208、存储器210和/或通信接口212来实现分析模块116。在其他实现方式中,可以使用计算装置114来实现分析模块116。在某些实现方式中,分析模块116可以被配置成例如当第一基于芯片的生物传感器104a暴露于
已经使用阻断剂110培育的核酸样品108的第一等分试样108a以及第二基于芯片的生物传感器104b暴露于省略了阻断剂110的相同核酸样品108的第二等分试样108b时对来自暴露于不同溶液的相同制备的生物传感器的第一响应信号组和第二响应信号组执行比较分析。在这种情况下,分析模块116可以被配置成根据由暴露于已知浓度的靶标核酸的相同制备的生物传感器的校准测量确定的经验模型来确定检测的核酸浓度的概率分布。
87.然后,在某些实现方式中,分析模块116可以通过从来自不使用阻断剂110的情况下的第二等分试样108b的dna(或其他核酸)的浓度概率分布(使用第二基于芯片的生物传感器104b测量)中减去来自在使用阻断剂110的情况下的第一等分试样108a的dna的计算出的浓度概率分布(使用第一基于芯片的生物传感器104a测量)来确定脱靶结合核酸(例如,dna)的浓度的概率分布。
88.在一些实现方式中,分析模块116可以被配置成例如当利用dcas9制备(例如,功能化)第一基于芯片的生物传感器104a以及利用具有与第一基于芯片的生物传感器104b相同的grna的cas9制备第二基于芯片的生物传感器104b时对第一响应信号组和第二响应信号组的时间依赖性进行比较分析,并且将第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b二者暴露于相同的分析物(例如,核酸样品108)以确定暴露于已知浓度的核酸样品108的cas9的裂解速率。可以例如通过计算第一信号和第二信号的直方图对所观察到的第一响应信号和第二响应信号或者第一组响应信号和第二组响应信号的变化进行统计分析以确定核酸样品(例如,dna)结合至基于芯片的生物传感器104a、104b的时间量,所述响应信号例如漏极电流、电容等。
89.分析模块116可以被配置成通过使用诸如快速傅立叶变换的算法将第一组响应信号值和第二组响应信号值转换至频率空间中,以确定裂解的频率。这些示例是非限制性的,并且两种类型的分析普遍用于相同或不相同制备的生物传感器中以及相同或不相同制备的第一等分试样108a和第二等分试样108b的测量中。尽管本文所述的系统、方法、设备可以利用各种基于芯片的生物传感器,但是如图4所示,使用场效应生物感测技术的实现方式在仪器成本、生物传感器成本、精度、采样时间等方面提供了显著优势,因为对于场效应生物感测不需要精密光学或流体学。
90.图3a是示出根据本公开内容的一个或更多个方面的用于有效靶向基因组操纵剂310的增强选择的方法300的图。图3b是示出根据本公开内容的一个或更多个方面的阻断剂的示例性实现方式的放大细节图。
91.在一个实施方式中,方法300开始并且包括制备302均包括核酸样品306的第一等分试样304a和第二等分试样304b,所述核酸样品306被测量以对分配至一个或更多个感测表面308a、308b的核酸样品306与靶向基因组操纵剂310之间的生物分子结合相互作用进行检测,该靶向基因组操纵剂具有基因组操纵组分312和靶向组分314并被功能化成一个或更多个感测表面308a、308b的感测范围内的一个或更多个捕获表面316。
92.在各种实现方式中,使用阻断剂318可选择地培育第一等分试样304a,所述阻断剂318被配置成结合至与核酸样品306的靶上序列322重叠的重叠序列320,而第二等分试样304b省略了阻断剂318。如图3b中的扩展细节所示,使用阻断剂318培育第一等分试样304a有效地阻断了核酸样品306的靶上序列322之间的结合。例如,在某些实现方式中,阻断剂318通过由靶上序列附近的材料引起的空间位阻或者通过使dna采取与结合不相容的形状
或者通过直接地覆盖靶上序列的至少一个部分,使得使用阻断剂的核酸样品与靶向基因组操纵剂310之间的靶上结合最小化。由于这些阻断机制,因此在靶向基因组操纵剂310与核酸样品306之间发生的可测量结合将在脱靶位点324处结合。
93.在某些实现方式中,靶向基因组操纵剂310的靶向组分314包括具有被配置成与靶上序列322互补结合的指导序列326的指导rna,并且基因组操纵组分312包括crispr相关蛋白分子例如cas9、cas12、cas13或类似的crispr cas复合物。在图3a和图3b所示的实现方式中,基因组操纵组分312被描绘为crispr
‑
cas9。然而,在一些实现方式中,可以使用非裂解基因组操纵组分312例如dcas分子。
94.在各种实现方式中,感测表面308a、308b包括功能化的一个或更多个捕获表面316。在某些实现方式中,一个或更多个捕获表面316是在一个或更多个感测表面308a、308b的感测范围328内使用靶向基因组操纵剂310功能化的珠状物305的表面,如图3b中所描绘的。以下相对于图5a、5b和5c的描述提供了关于捕获表面的功能化的更多细节。
95.在各种实现方式中,方法300继续并且包括对响应于第一等分试样304a和第二等分试样304b中的核酸样品306与第一基于芯片的生物传感器104a和第二基于芯片的生物传感器104b的功能化的一个或更多个捕获表面316上的靶向基因组操纵剂310之间发生的生物分子结合相互作用而产生的一个或更多个第一响应信号342a和第二响应信号342b进行测量340。在一些实现方式中,方法300包括在培育336第一等分试样108a(阻断)和第二等分试样108b(未阻断)之前校准334基于芯片的生物传感器104a、104b。校准334基于芯片的生物传感器104a、104b为第一响应信号342a和第二响应信号342b提供了标准化基线。
96.在各种实现方式中,方法300还包括清洗338核酸样品306的未结合部分。在第一等分试样304a(阻断)的情况下,清洗338掉具有靶上区段332的dna,并且保留表现出脱靶结合的核酸样品306的部分。因此,一个或更多个第一响应信号342a指示与使用阻断剂318培育的核酸样品306与被功能化成一个或更多个感测表面308a的感测范围内的一个或更多个捕获表面316的靶向基因组操纵剂310之间的脱靶结合相关联的结合参数。
97.例如,在使用生物门控晶体管作为第一生物传感器和第二生物传感器的实现方式中,第一响应信号342a例如在第一基于芯片的生物传感器的生物门控晶体管的[0078]中讨论的漏极电流或其他参数可以是存在的脱靶结合浓度的单调函数,而第二基于芯片的生物传感器的生物门控晶体管的相应第二响应信号342b可以是存在的靶上结合加脱靶结合浓度的单调函数。在某些实现方式中,可以使用相同制备的生物传感器芯片的代表性样品预先校准生物门控晶体管参数与靶标浓度(例如,无论是靶上或脱靶或者靶上和脱靶二者的结合分子的浓度)之间的各种关系。在一些期望的实现方式中,生物门控晶体管响应可以与dna的浓度成比例。
[0098]
在某些实现方式中,例如,以下相对于图4中描绘的设备400所示的使用场效应生物感测的实现方式中,使用满足预定奈奎斯特准则的采样率来可选择地测量一个或更多个第一响应信号342a和第二响应信号342b,用于对在与生物分子结合相互作用相关联的预定时间段内在核酸样品与靶向基因组操纵剂之间的生物分子结合相互作用的至少一个参数进行测量。在第一响应信号342a和第二响应信号342b涉及使用生物门控晶体管进行的测量的一些实现方式中,采样率可以是可编程的(例如,使用以上相对于图2描述的设备200的测量控制器124)。在某些实现方式中,预定奈奎斯特准则可以至少部分地基于生物分子结合
相互作用的频率相关特性(例如,带宽)和生物分子结合相互作用中涉及的组分。
[0099]
在一些实现方式中,预定奈奎斯特准则可以至少部分地基于测量电路的频率相关特性(例如,带宽)。例如,各种实现方式,采样率高于测量电路的测量带宽,以便使伪影例如混叠最小化。在某些实现方式中,在满足预定奈奎斯特准则的采样率足够高的情况下,可以基于通过以符合预定奈奎斯特准则的采样率测量340获得的附加精度和信息省略清洗338的步骤。
[0100]
在一些实施方式中,方法300继续并且包括基于将一个或更多个第一响应信号342a与一个或更多个第二响应信号342b进行比较345来确定344靶向基因组操纵剂的效率参数346。例如,可以使用响应信号来确定脱靶dna的浓度和靶上加脱靶dna的浓度,在这种情况下,可以通过从靶上结合加脱靶结合值减去脱靶结合值来导出靶上结合的更准确测量值。
[0101]
图4是示出包括根据本公开内容的一个或更多个示例的生物传感器202的一个实现方式的设备400的示意性框图。在一个实现方式中,生物传感器202是使用生物门控晶体管402——也称为液体栅极场效应晶体管——的基于芯片的生物传感器。在某些实现方式中,生物门控晶体管402包括源电极404、漏电极406和在源电极404与漏电极406之间延伸的通道410的一部分上的感测表面408。
[0102]
与在常规场效应晶体管中发现的那些栅电极相类似的栅电极不同,生物门控晶体管402具有液体栅电极412,所述液体栅电极412使得能够至少部分地基于感测表面408的感测范围418内的液体中的电荷量来使漏电源电流ids流过漏电极406与源电极404之间的通道410。在各种实现方式中,使用结合部分功能化捕获表面420。在某些实现方式中,出于增强有效靶向基因组操纵剂的选择的目的,使用感兴趣的靶向基因组操纵剂416功能化捕获表面420。在其他实现方式中,使用具有感兴趣的靶标的核酸样品424功能化捕获表面420。在另外的实现方式中,捕获表面420包括捕获感测表面408的感测范围418内的核酸样品424的感兴趣靶标的功能化珠状物。
[0103]
响应于核酸样品424与靶向基因组操纵剂416之间发生的生物分子结合相互作用,感测表面408被配置成检测由感测范围418内的生物分子结合相互作用引起的电荷或其他晶体管参数的相当轻微变化。那些检测到的电荷或其他晶体管参数的变化产生可测量的响应信号,例如,漏极电流、栅极电流、漏极阻抗、栅极阻抗、跨导、栅极滞后、栅极曲线非线性、栅极曲线滞后、霍尔效应电压和磁阻的变化。
[0104]
在一些实现方式中,设备400包括用于检测液体栅电极412的电位的参考电极413。在某些示例性实现方式中,生物传感器202包括用于调整液体栅电极412的电位的对电极414。在某些实现方式中,测量控制器124被配置成以可以递增地和程序化地被调整的速率来调制对电极414,以确定核酸样品424与靶向基因组操纵剂416之间的生物分子相互作用如何。
[0105]
在各种实现方式中,通道410可以层叠有支承层430例如二氧化硅层。在某些实现方式中,通道410由诸如石墨烯的高度敏感的导电材料制成。在一些实现方式中,通道410使用其他二维材料(有时也称为范德华材料,例如,具有强面内共价键合和弱层间相互作用的材料),例如,石墨烯纳米带(gnr)、双层石墨烯、磷烯、锡、氧化石墨烯、还原石墨烯、氟石墨烯、二硫化钼、拓扑绝缘体等。导电的以及表现出场效应特性且当直接暴露于各种溶液时在
室温下稳定的各种材料可用于生物门控晶体管(例如,作为感测表面或其部分)。在各种实现方式中,与一维替选(例如,碳纳米管)相比,使用利用平面二维范德华材料的生物门控晶体管提高了可制造性并且降低了成本。
[0106]
在一些实现方式中,图1中描绘的测量控制器124被配置成测量漏电流ids和/或其他生物门控晶体管参数,并且被配置成生成可以例如使用信号调节电路204进一步调节的一个或更多个响应信号。图2中描绘的数字化电路206被配置成将一个或更多个响应信号转换成可以与其他响应信号一起存储、分析和处理的数字信号。在一些实现方式中,生物门控晶体管的各种其他参数也是可测量的和/或可转换成可以被测量、记录、调节、数字化和比较分析的响应信号。
[0107]
靶向基因组操纵剂416包括操纵组分426和靶向组分422,所述靶向基因组操纵剂416被配置成在与靶向组分422互补的预定序列的位点处操纵(例如,裂解、阻断)核酸样品424。在核酸样品424的靶上位点未被阻断剂阻断的情况下,核酸样品424的结合可以在基因组的“靶上”位点处;或者在核酸样品424的靶上位点被阻断剂阻断的情况下,核酸样品424的结合可以在脱靶位点处。
[0108]
在某些实现方式中,设备400包括被配置成控制生物传感器202的各种器件、电极、信号调节、放大器等的测量控制器124。例如,除了控制栅极电压vg以用于增量调整和测量之外,在一些实施方式中,例如受以下更详细描述的德拜层的影响,测量控制器124可以施加和/或增量调整经调制的液体栅极偏置电压以用于调整生物传感器的感测范围。
[0109]
在其他实现方式中,测量控制器124可以控制一个或更多个样品激发装置214例如电阻加热器,所述电阻加热器用于将生物样品的温度升高至预定温度以便确定生物分子相互作用如何在预定体温下发生。这也可以使用集成器件例如用作焦耳加热器和热敏电阻的电阻丝来在芯片上完成。
[0110]
在某些实现方式中,分析模块116可以被编程成执行在使用本公开内容中描述的基于芯片的生物传感器确定的某些基因组操纵效率参数与使用一个或更多个其他方法例如上述各种计算机方法、体外方法和体内方法(例如,guide
‑
seq、site
‑
seq等)确定的相应基因组操纵效率参数之间的比较分析。例如,在使用在被配置成与用于另一效率确定技术(例如,上述体内系统中的一个)的相应条件对准的条件(例如,体温、ph等)下测量的第一组响应信号和第二组响应信号的比较分析来选择一个或更多个靶向基因组操纵剂之后,以及在根据以下描述的方法800、900、1000、1100和1200中的一个或更多个方法执行片段化和衔接子连接之后,分析模块116可以对使用基于芯片的生物传感器104a、104b的结果以及针对使用上述技术中的任何技术的相同或相似靶向基因组操纵剂获得的体内、体外和/或计算机结合和/或裂解效率结果中的一个或更多个确定的效率参数进行比较分析。
[0111]
因此,本公开内容的各种系统、设备和方法通过增强有效靶向基因组操纵剂的选择来改进这种体内、体外和/或计算机结合和/或裂解效率确定技术并且通过提供用于利用这种技术进行比较分析或使用这种技术进行验证的独立导出数据来进一步改进这种技术。
[0112]
作为另一非限制性示例,测量控制器124可以控制样品激发装置214例如珀耳帖装置来冷却感测表面408和核酸样品的温度,以便更精确地分析生物分子通过相互作用对样品激发装置214的冷却效果的响应。
[0113]
其他样品激发装置214例如任何期望波长的光发射器可以用于测量激发对生物分
子结合相互作用的影响。
[0114]
在捕获表面是功能化磁性珠状物的某些实现方式中,测量控制器124可以控制一个或更多个电磁体或可机械定位的磁体来影响感测范围内的珠状物的位置。珠状物可以被如此定位成与生物传感器表面接触以用于感测目的,并且远离表面以用于靶标捕获目的。这些运动会导致珠状物移动至双层之外,从而无法被传感器检测到。
[0115]
图5a、图5b和图5c示出了根据本公开内容的一个或更多个示例的捕获表面511的各种实现方式。在一些实现方式中,靶向基因组操纵剂510被功能化成一个或更多个捕获表面511。在某些实现方式中,捕获表面511是感测表面504的一部分。在一个或更多个实现方式中,捕获表面511仅为捕获表面并且结合效率和裂解效率的评估是分开进行的。在另一实施方式中,捕获表面511是由具有低核酸结合吸附和低蛋白结合吸附并且已知用于利用蛋白或dna进行功能化的生物相容性材料制成的平坦表面。生物相容性材料的各种示例包括但不限于利用靶向基因组操纵剂510功能化的玻璃、塑料、硅、金属或水凝胶。在另一实施方式中,捕获表面511是由结合至树脂的靶向基因组操纵剂510制成的柱。
[0116]
在一些实现方式中,靶向基因组操纵剂510包括基因组操纵组分512(例如,诸如dcas9或cas9的cas蛋白)和靶向组分514(例如,指导rna),其中,靶向组分514被配置成与核酸样品的靶上位点结合。在一些实现方式中,基因组操纵组分512是有活性的(例如,cas9)以在核酸样品的靶上位点处执行核酸的裂解。在某些实现方式中,基因组操纵组分512是无活性的(例如,dcas9)以执行到核酸样品的靶标位点的靶上结合而无需裂解。
[0117]
图5a示出了根据本公开内容的一个或更多个示例的利用靶向基因组操纵剂510功能化的捕获表面511的实现方式500。在各种实现方式中,靶向基因组操纵剂510经由基因组操纵组分512(例如,cas蛋白)被功能化成捕获表面511。在某些实现方式中,捕获表面511是诸如以上相对于图4描绘的生物门控晶体管402的生物门控晶体管的感测表面504的一部分。在其他实现方式中,感测表面504是表面等离子体共振(“spr”)传感器芯片、太赫兹光谱传感器芯片、表面增强光谱传感器芯片、石英晶体微天平传感器芯片、光栅耦合干涉测量传感器芯片等的表面。
[0118]
在一些实现方式中,感测表面504包括石墨烯,并且使用感测表面504的石墨烯修饰的cooh表面与基因组操纵组分512例如cas9中的一个或更多个胺(nh2)基团之间的胺键将靶向基因组操纵剂510功能化成捕获表面511。
[0119]
图5b示出了根据本公开内容的一个或更多个示例的利用靶向基因组操纵剂510功能化的捕获表面511的实现方式525。在一个实现方式中,靶向基因组操纵剂510经由靶向组分514(例如,cas
‑
grna复合物的grna部分)被功能化成感测表面504。在感测表面504作为诸如图4中所描绘的生物门控晶体管的一部分的实现方式525中,靶向基因组操纵剂503b(例如,cas
‑
grna复合物)经由靶向组分502b(例如,grna)系于感测表面504(例如,石墨烯表面)。
[0120]
在第一grna系链实现方式中,靶向组分502b是在一端处合成有氨基并被固定至装饰感测表面504(例如,石墨烯通道)的cooh化学物的grna。在第二grna系链实现方式中,靶向组分502b是在一端处合成有生物素并被固定(例如,系)至感测表面504处的链霉亲和素涂层的grna。在第三grna系链实现方式中,靶向组分502b是使用结合至感测表面504的寡核苷酸经由沃森
‑
克里克碱基配对被功能化成感测表面504的grna。
[0121]
图5c示出了根据本公开内容的一个或更多个示例的用于对使用靶向基因组操纵剂510功能化的一个或更多个捕获表面511之间的生物分子结合相互作用进行检测的感测表面504的实现方式530。在某些实现方式中,一个或更多个捕获表面511是具有从约1纳米(纳米粒子)至1000微米的尺寸的珠状物520。在一些实现方式中,珠状物520(至少在它们的外部表面上)由提供低核酸和蛋白结合吸附并且已知用蛋白或dna功能化的生物相容性材料组成。
[0122]
这种生物相容性材料包括但不限于使用靶向基因组操纵剂510功能化的玻璃、塑料、硅、金属或水凝胶。在各种实现方式中,珠状物520可以是非磁性的、磁性的或顺磁性的。在某些实现方式中,第一磁体516和第二磁体518可以设置在感测表面以上和感测表面以下。第一磁体516可以被激活以将磁性珠状物520吸引向感测表面504,并且第二磁体518可以被激活以引导磁性珠状物520远离感测表面504。因此,通过控制第一磁体516和第二磁体518的激活,功能化的靶向基因组操纵剂510可以向上或向下移动或者以其他方式被搅动,所述其他方式包括进入或离开德拜层。
[0123]
在实现方式530中,捕获表面511是一个或更多个功能化珠状物520的一部分,所述功能化珠状物520使得在核酸样品与靶向基因组操纵剂510之间发生生物分子结合相互作用时由基于芯片的生物传感器感测到的结合处于感测表面504的感测范围508内,所述靶向基因组操纵剂510被功能化成珠状物520的捕获表面511。
[0124]
在各种实现方式中,感测表面504是被配置成对核酸样品的一个或更多个组分执行无标记检测的基于芯片的生物传感器的一部分。图4描绘了作为基于芯片并且使用生物门控晶体管402执行场效应生物感测的生物传感器202的示例性实现方式。
[0125]
在某些实现方式中,一个或更多个捕获表面511可以既检测又捕获感兴趣的靶标核酸序列。在一些实现方式中,可以回收由捕获表面511捕获的核酸样品,以提供对由靶向基因组操纵剂510靶向的序列的富化。
[0126]
图6示出了根据本公开内容的一个或更多个示例的用于确定关于固定至感测表面的靶向基因组操纵剂的结合效率参数的方法600。在一个实现方式中,方法600开始并且包括使用参考缓冲液校准632基于芯片的生物传感器605。基于由基于芯片的生物传感器605生成的响应信号,所述方法显示校准基线540a,然后,所述校准基线540a用作例如通过由基于芯片的生物传感器605感测的感测范围618内的一个或更多个生物分子结合相互作用带来的液体栅极的电荷的变化的参考。在各种实现方式中,方法600包括通过使用低盐参考缓冲液减少德拜层的长度或厚度来提高基于芯片的生物传感器605的灵敏度。
[0127]
在一个示例中,用于确定靶上结合参数的方法600包括使用基于芯片的生物传感器605培育634核酸样品608例如dna,该基于芯片的生物传感器605具有与基于芯片的生物传感器605的感测表面604相关联的功能化捕获表面611。在一些示例中,靶向基因组操纵剂603是cas/grna复合物,其被功能化至利用生物门控晶体管例如石墨烯fet(“gfet”)的基于芯片的生物传感器104上。
[0128]
在某些实现方式中,基于芯片的生物传感器605是连接至外部或集成电子阅读器616的可移除或不可移除芯片,该外部或集成电子阅读器616被配置成对受到靶向基因组操纵剂603例如cas9/grna复合物和核酸样品608的靶标序列607的结合影响的不同晶体管参数进行测量。在各种实现方式中,基于芯片的生物传感器605的感测表面604对通过功能化
捕获表面611对核酸样品608的捕获而带入感测范围618内的负电荷和/或正电荷进行检测。在一些实现方式中,电荷的量和极性可以通过改变缓冲溶液的ph和离子浓度而被控制在生物学必要的界限内。
[0129]
在一些实现方式中,包括除电荷之外的参数的各种参数受到靠近感测表面604的捕获到的核酸分子或片段的存在的影响。一些这种参数包括例如栅极电容(例如,cgs、cgd)、漏电流(例如,“ids”)和栅极电压(例如,“vgs”)。例如,使用指示电容变化的响应信号可以使得能够检测不带电荷的分子。
[0130]
在某些实现方式中,参考缓冲液包括从约1mm至20mm的nacl和从0mm至20mm的edta。在一些实现方式中,参考缓冲液可以由纯水替代。方法600继续并且包括去除参考缓冲液并且在有利于核酸样品608的靶标位点的识别且有利于将核酸样品608的靶标位点结合至使用靶向基因组操纵剂603功能化的捕获表面611的结合缓冲液中培育核酸样品608(例如,dna分子)。在某些实现方式中,选择结合缓冲液以使在靶标序列607处的捕获到的核酸的裂解最小化。例如,在一些实现方式中,该方法包括向结合缓冲液中加入饱和量的猝灭剂分子例如edta以猝灭二价阳离子,例如,mg 2 、mn 2 、fe 2 、co 2 、ni 2 或zn 2 (如果存在于溶液中)。在一个示例中,具有猝灭剂分子的结合缓冲液含有从约1mm至500mm的nacl、从0mm至100mm的hepes、从100mm至1m的edta,并且所述结合缓冲液的ph在5至8.5之间。
[0131]
在某些实现方式中,方法600继续并且包括结合步骤636,用于在室温下在基于芯片的生物传感器中培育样品核酸约1分钟至约16小时。方法600继续并且包括在培育之后丢弃上清液并使用清洗缓冲液清洗基于芯片的生物传感器605从1次至10次。在各种示例中,清洗缓冲液包括1mm至500mm的nacl和1mm至500mm的edta。在某些示例中,方法600还包括再次使用参考缓冲液培育场效应生物传感器的感测表面604并测量用于所选择的参数的新值。
[0132]
在一方面,当诸如cas9/grna复合物的靶向基因组操纵剂603在不存在镁的情况下识别出预定靶标序列607时,它与靶标序列607紧密结合而不裂解所述靶标序列607。系至石墨烯表面的任何带电荷的分子——例如在该示例中为核酸样品608(例如dna)——会引起以上列出的参数的变化。方法600继续并且包括在使用靶向基因组操纵剂对核酸样品608的培育之前(例如,在使用参考缓冲液的校准步骤634期间)和之后记录的参数的强度差异进行显示、记录和/或比较。在各种实现方式中,方法600包括基于将在校准步骤634中测量的一个或更多个第一响应信号与在整个结合步骤636中测量的一个或更多个第二响应信号进行比较来确定靶向基因组操纵剂603的效率参数。
[0133]
由于dna是带电荷的分子,因此位于德拜层内部的dna分子可能会影响以上列出的参数中的一个或更多个参数。因此,方法600基于对从培育期到校准期的与捕获到的核酸成比例的响应信号的差异进行比较来确定640靶向基因组操纵剂603的效率参数。
[0134]
在各种实现方式中,方法600继续并且包括响应于确定在结合步骤636期间测量的一个或更多个响应信号与在校准步骤634期间测量的相应响应信号之间的差异满足预定结合效率条件而将靶向基因组操纵剂603识别为具有合适的靶向组分602。换言之,在结合步骤期间测量的响应越大,将捕获其靶向dna的靶向组分602(例如grna)越多,从而给予用户指示来进一步使用该特定grna或在响应信号的差异未满足预定结合效率条件的情况下向
用户指示用以设计推荐新靶向组分602。
[0135]
在各种实现方式中,方法600继续并且包括在记录靶向基因组操纵剂603的结合能力之后向基于芯片的生物传感器施加638裂解缓冲液。在一个示例中,裂解缓冲液包括1mm至500mm的nacl、5mm至20mm的mgcl2和0mm至100mm的hepes,所述裂解缓冲液的ph在5至8.5之间。在存在mg2 或其他二价阳离子例如mn2 、fe2 、co2 、ni2 或zn2 的情况下,cas9在靶标序列607(例如其识别位点)处切割dna。
[0136]
响应于在结合步骤636测量之后被施加至基于芯片的生物传感器605的裂解缓冲液,通过有效靶向基因组操纵剂603结合至捕获表面的核酸样品608例如dna被高效切割。所述切割导致核酸样品608中的一部分流动离开感测表面604。
[0137]
为了确定半定量或定量结果,方法600包括在室温下使用裂解缓冲液培育靶向基因组操纵剂603(例如,cas9/grna固定化复合物)达约30秒至约60分钟并使用参考缓冲液更换裂解缓冲液。取决于被测试的靶向基因组操纵剂的效率,以上列出的一个或若干个参数的响应信号将达到在校准步骤期间进行的第一测量值与结合步骤636期间的响应信号的水平之间的裂解水平638。由于基因组操纵组分例如cas9即使在有效裂解之后仍结合至其底物的一端610,因此响应信号不应当达到在校准步骤634期间进行的第一参考测量值。
[0138]
在某些实现方式中,方法600继续并基于对相对于在结合和裂解期间的所测量的响应信号的校准步骤的差异进行比较来确定靶向基因组操纵剂603的总体效率。相应的结合响应信号和裂解响应信号与校准响应信号之间的差异越大,给用户的下述指示就越多:所选择的靶向基因组操纵剂603有效,并且可以进一步被测试以确定它是否在感兴趣的基因组上诱导推定的脱靶结合。在各种示例中,假若适当的基因组操纵组分601例如cas13与适当的靶向组分602一起使用,则核酸样品608可以是扩增子、基因组dna链、染色质或其他类型的核酸例如rna。
[0139]
图7示出了根据本公开内容的一个或更多个示例的用于使用固定至感测表面704的双链dna708来确定关于靶向基因组操纵剂703的结合效率参数的方法700。在一个实现方式中,方法700开始并且包括提供702包括固定至感测表面704的双链dna708的基于芯片的生物传感器。固定化的双链dna708包含靶上序列707,靶向基因组操纵剂703被配置成与所述靶上序列707结合。相对于图6中描绘的方法600,使用类似的校准步骤702、结合步骤705和其中靶向基因组操纵剂703如上所述裂解核酸片段709的裂解步骤711执行方法700。然而,在方法600中,生物门控晶体管传感器监测的电荷不是dna电荷,而是响应于与固定至感测表面704的dsdna的结合的靶向基因组操纵剂703的电荷。该方法700在针对裂解效率测试基因组操纵组分例如工程化的cas9或类似的核酸酶时特别有用,因为可以使用相同的功能化的感测表面704直至识别出令人满意的靶向基因组操纵剂703例如cas9/grna复合物。方法700继续并显示712关于校准步骤702、结合步骤705和裂解步骤711的响应信号。响应信号随着上述所测量的参数(例如,结合分子的浓度)的改变而变化。
[0140]
推定的脱靶结合/裂解活性的检测。响应于确定靶向基因组操纵剂满足一个或更多个预定结合效率参数和裂解效率参数(例如,其中被测试的cas9/grna复合物显示出良好的结合/裂解活性),检查靶向基因组操纵剂是否靶向其被设计用于的基因组的脱靶区域或位点是有益的。以上相对于图1至图4描述的系统100、设备200、400和方法300提供了各种方式来比较分析靶上结合和脱靶结合。
[0141]
图8示出了根据本公开内容的一个或更多个示例的用于用于在基因组操纵效率参数的测量之后进行测序的核酸样品811的片段化dna812和衔接子连接813的方法800的一种实现方式。方法800开始并且包括将包括已经使用已知dna纯化技术纯化的全dna的核酸样品811片段化802。使用任何合适的片段化技术例如超声处理、声学剪切、流体动力剪切、核酸内切酶消化等来执行片段化802。在各种实现方式中,选择物理剪切的参数和酶促剪切的参数以产生包括在50bp至10000bp之间、更优选地在100bp至1000bp之间的dna片段。
[0142]
方法800继续并且使用基于所使用的片段模式选择的酶来修复804片段化的dna 812。例如,如果使用超声处理使片段化的dna 812片段化,则在dntp的存在下使用例如t4 dna聚合酶来修复片段化的dna 812,通过经由其5
’→3’
活性填充5’突出端并且经由其3
’→5’
核酸外切酶活性填充凹3’突出端来产生“平”末端。
[0143]
该方法继续并且包括将片段化的dna 812连接至被设计成与用户选择的ngs技术一起使用的衔接子813。每个衔接子813被设计成在它的末端的一个末端中产生突出端,并且使用另一末端的两个端的阻断部分进行修饰,以避免在与dna片段812连接到位时发生自连接和后续连接。
[0144]
图9示出了根据本公开内容的一个或更多个示例的用于制备用于在使用基因组操纵参数的一个或更多个基于芯片的生物传感器的测量之后进行测序的片段化的和衔接子连接的核酸样品的另一方法900。方法900开始并且包括培育902核酸样品例如被片段化并用衔接子913标记的衔接子连接的天然染色质912。衔接子连接的天然染色质912的一个或更多个实例在捕获表面920处培育,所述捕获表面920在一些实施方式中为基于芯片的生物传感器的感测表面。使用靶向基因组操纵剂903功能化捕获表面920。在一个实现方式中,用于该培育的缓冲液包括用于防止裂解(例如,cas9裂解)的二价阳离子猝灭剂分子例如edta。这种缓冲液的非限制性示例包含1mm至500mm之间的nacl、0mm至100mm之间的hepes和100mm至1m之间的edta,所述缓冲液的ph在5至8.5之间。
[0145]
在某些实现方式中,在室温下执行培育达范围从1分钟至24小时的时段。方法900继续并且包括在培育期间捕获904包含被靶向基因组操纵剂903识别出的靶标序列907的dna或染色质基因组片段,所述靶向基因组操纵剂903被功能化成捕获表面920。方法900继续并且包括使用清洗缓冲液清洗906捕获表面920,以保持靶标dna/染色质片段结合至靶向基因组操纵剂903并且清洗掉任何未结合的dna或染色质片段。在各种实现方式中,在室温下执行一次至五次清洗906。
[0146]
方法900继续并且通过施加包含一定量的mg2 或二价阳离子例如mn2 、fe2 、co2 、ni2 或zn2 的缓冲液来将与接近于基因组的靶向区域的序列相对应的一个或更多个染色质918段释放915至上清液来触发
[0147]
→
[0148]
cas9裂解。另外,方法900继续并且包括使用本领域已知的任何合适的酶混合物从待修复和加a尾的裂解染色质918中取出dna909。
[0149]
在一些实现方式中,方法900继续并且(在纯化和定量之后)包括使用t4 dna连接酶将裂解dna连接908至衔接子921。在各种实现方式中,方法900继续并且包括在将连接的dna样品纯化后对其进行扩增914。可以使用具有通用引物922、923和靶向衔接子921和923的pcr进行扩增914。在某些实现方式中,方法900继续并且包括例如使用下一代测序对纯化
的扩增子测序916。在一些实现方式中,衔接子913和921具有相同的序列。在其他实现方式中,衔接子913、921具有不同的序列。
[0150]
在一个实现方式中,衔接子913被配置成在其末端之一中产生突出端,并且使用另一末端处的阻断部分进行修饰,以避免在与dna片段连接到位时的自连接和后续连接。在各种实现方式中,方法900包括通过以下来降低衔接子913的自连接的可能性:将衔接子913的第一链的3’端配置成包括使用缺少磷酸部分的同一链的5’端通过硫代磷酸酯键与序列的其余部分连接的突出端胸腺嘧啶,以及将衔接子913的第二链配置成具有包括磷酸基团的5’端,并且进一步将第二链的3’端配置成包括被配置成防止任何连接的部分例如荧光团分子、点击化学部分或反向dt(反向连接)。
[0151]
图10示出了根据本公开内容的一个或更多个示例的用于对用于在靶向基因组操纵效率参数的测量之后进行测序的核酸样品执行标记的方法1000。在至少一个实施方式中,方法1000开始并且包括核酸样品1011(例如,裸dna)的标记1002(例如,执行一步标记和片段化)。标记1002使用包括转座酶(例如,tn5)和两个衔接子1013的转座子1015。转座子1015将两个衔接子1013片段化并将其转座至核酸样品1011(例如,基因组dna)中。在某些实现方式中,标记1002的步骤包括优化时间1004和优化转座酶浓度1006以产生约150个碱基对至约1000个碱基对的一个或更多个标记片段1012。
[0152]
图11示出了根据本公开内容的一个或更多个示例的用于使用所选择的靶向基因组操纵剂来制备用于测序的核酸样品1111的方法1100。在本文公开的系统、设备和方法的某些实现方式中,避免在核酸样品例如dna上形成双链断裂可能是有用的。
[0153]
因此,在一些实现方式中,方法1100开始并且包括制备1130具有使用靶向基因组操纵剂1126功能化的捕获表面1104的基于芯片的生物传感器,该靶向基因组操纵剂1126包括非裂解的操纵组分1124。例如,在各种实现方式中,操纵组分1124可以是已经在一个或两个催化切割位点中突变的失活cas蛋白(也称为dcas或死cas)。
[0154]
在某些实现方式中,使用靶向基因组操纵剂1126制备1130功能化捕获表面1104包括将靶向基因组操纵剂1126与所选择的酶1125例如脱氨酶或组蛋白脱乙酰酶融合,用于靶向基因组的特定等位基因和/或特定区域以修饰单核苷酸多态性(“snp”)和/或改变核酸样品1111的靶向核苷酸的甲基化。
[0155]
在各种实现方式中,方法1100包括测量1138一个或更多个基于芯片的生物传感器参数以评估靶向基因组操纵剂例如dcas9的非裂解靶向组分在整个基因组上的结合区域并评估一个或更多个腺嘌呤碱基编辑器脱靶位点。
[0156]
在一些实现方式中,靶向基因组操纵剂1126包括非裂解的操纵组分1124例如无活性的cas蛋白。在某些实现方式中,这种操纵组分1124的一个非限制性示例是dcas9。在各种实现方式中,操纵组分1124与所选择的酶1125(例如,脱氨酶)和诸如grna 1102的靶向组分融合组合以形成靶向基因组操纵剂1126。在各种实现方式中,根据本公开内容的一个或更多个方面,使用靶向基因组操纵剂1126功能化的捕获表面1120是基于芯片的生物传感器的感测表面。
[0157]
在某些实现方式中,方法1100继续并且包括使用(通过非限制性示例的方式)超声处理、声学剪切、流体动力学剪切和/或核酸内切酶消化来使核酸样品1111(例如,基因组dna)片段化1132以产生片段化的核酸样品1112(例如,片段化的dna)。在某些实现方式中,
方法1100的片段化1132的步骤还包括使用基于芯片的生物传感器1105——例如以上相对于图4描述的生物门控晶体管402——的功能化捕获表面1104培育核酸样品1112。在一些实现方式中,基于芯片的生物传感器1105由读取器1106读取。方法1100继续并且包括对与在基于芯片的生物传感器1105的感测表面的传感范围内发生的在靶向基因组操纵剂1126与片段化的核酸样品1112之间的生物分子结合相互作用相关联的一个或更多个结合参数进行测量1138。
[0158]
对于某些实现方式,例如,使用以上相对于图4描述的场效应生物感测的基于芯片的生物传感器的实现方式,指示生物化学和/或生物分子相互作用的速度和/或幅度的一个或更多个结合参数可以包括栅极电容、源极
‑
漏极电流、栅极相关电流和/或栅极电压中的任何一个的平均变化、变化率或特征形状。在各种实现方式中,该方法包括使用参考缓冲液培育功能化的捕获表面1120(例如,使用非裂解的靶向基因组操纵剂1126(例如,dcas复合物)功能化)。在一些实现方式中,方法1100包括通过选择具有低盐含量的参考缓冲液来使场效应生物传感器的德拜层长度最小化以提高灵敏度。在一些实现方式中,参考缓冲液包括从1mm至20mm的nacl和从0mm至20mm的edta。
[0159]
在某些实现方式中,方法1100继续并且包括以下作为测量1138的一部分:在参考缓冲液存在的情况下,首先测量一个或更多个基于芯片的生物传感器参数例如以上列出的那些参数。在一些实现方式中,方法1100包括去除参考缓冲液并且培育重新悬浮在结合增强缓冲液中的核酸样品1112(例如,片段化的dna),所述结合增强缓冲液被配置成增强非裂解的靶向基因组操纵剂1126(例如,dcas9/脱氨酶/grna复合物)的靶向功能并且增强靶向基因组操纵剂1126与预定靶标序列1107的结合。通过示例的方式,各种实现方式中的结合增强缓冲液包括从1mm至500mm的nacl、从0mm至100mm的hepes、从100mm至1m的edta,并且所述结合增强缓冲液的ph在5至8.5之间。
[0160]
在各种实现方式中,方法1100包括在室温下在结合增强缓冲液中培育核酸样品1112例如片段化的dna达从约1分钟至约16小时。在某些实现方式中,在培育之后,方法1100包括丢弃上清液并使用清洗缓冲液清洗基于芯片的生物传感器1105从1次至10次。在一个示例中,清洗缓冲液包括从1mm至500mm的nacl和从1mm至500mm的edta。
[0161]
在各种实现方式中,方法1100包括再次使用参考缓冲液培育基于芯片的生物传感器并使用例如以上相对于图1、图2和/或图4描述的测量模块124再次测量参数。
[0162]
在某些实现方式中,方法1100包括通过测量1138在预定靶标序列1107与所选择的酶1125(例如脱氨酶)之间的生物分子相互作用来确定核酸样品(例如,片段化dna)是否包括靶向smp 1127。在一些实现方式中,测量38包括测量任何带电荷的分子例如在该示例中的核酸样品1112是否引起上述基于芯片的生物传感器参数中任何参数的变化。在各种实现方式中,方法1100包括基于使用例如以上相对于图1和图2描述的分析模块116对在基于芯片的生物传感器1105的捕获表面和核酸样品112的培育之前记录的一个或更多个预结合培育参数之间的强度差异进行比较来确定靶向基因组操纵剂1126的效率参数。
[0163]
在各种实现方式中,在确定靶向基因组操纵剂的效率参数之后,方法1100包括使用有利于所选择的酶1125(例如,脱氨酶)的脱氨酶活性的脱氨缓冲液替换用于执行测量的参考缓冲液,所选择的酶1125与非裂解的操纵组分1124(例如,无活性的cas9)融合。
[0164]
在某些实现方式中,方法1100包括执行腺嘌呤的脱氨1134以产生被dna聚合酶读
取为鸟嘌呤的肌苷1128。在一些实现方式中,方法1100包括使用在有利于转座的缓冲液中包含有tn5转座酶1115和两个衔接子1129的溶液替换1136脱氨缓冲液。在各种实现方式中,衔接子1129均包括用于ngs的标准通用衔接子。在一些实现方式中,方法1100继续并且包括使用如图9的步骤910中描绘的通用引物922和923扩增1140具有衔接子1129的经脱氨的核酸样品1109。
[0165]
在各种实现方式中,方法1100包括捕获核酸样品的包括结合至第二基于芯片的生物传感器的捕获表面的靶上位点和脱靶位点的部分并且释放所捕获的样品部分。例如,在某些实现方式中,方法1100继续并且包括使用蛋白酶k消化从基于芯片的生物传感器1105回收所捕获的核酸样品1109(例如,标记的片段化dna)的部分以将所捕获的核酸样品1109例如标记和片段化的dna释放至上清液中。可以注意,可以在方法1100内或方法300、600、700、800、900、1000和/或1200内的其他点处执行所捕获的核酸样品的各种类型的释放。在至少一个实施方式中,方法1100包括使用例如pcr纯化扩增1140所释放的核酸样品1109。在一些示例中,通过脱氨酶添加的每种肌苷都在该点处改变成鸟嘌呤。
[0166]
可以注意,方法300、600、700、800、900、1000、1100和/或1200中的步骤中一个或更多个可以部分或全部与以上提及的方法的其他步骤任意组合执行。类似地,以上提及的方法的一个或更多个步骤可以与系统100的任何部件或整体以及/或者设备200、400或其部分中的任一个任意组合使用。
[0167]
图12是示出根据本公开内容的一个或更多个示例的用于有效靶向基因组操纵剂的增强选择的方法1200的示意性流程图。在一个实施方式中,方法1200开始并且包括制备1202第一等分试样和第二等分试样,每个等分试样包括被测量以对分配至一个或更多个感测表面的核酸样品与靶向基因组操纵剂之间的生物分子结合相互作用进行检测的核酸样品,所述靶向基因组操纵剂具有基因组操纵组分和靶向组分并在一个或更多个感测表面的感测范围内被功能化成捕获表面。在一些实现方式中,靶向组分是指导rna并且基因组操纵组分是crispr相关蛋白。
[0168]
如果意图是基于阳性效率确定来捕获用于扩增和测序的序列,则方法1200可以可选择地包括在确定效率参数之前将核酸样品片段化1202并标记片段以用于测序。在某些实现方式中可以分开进行片段化和标记,或者在其他实现方式中在将第一等分试样和第二等分试样分别施加至第一表面和第二表面之前同时进行片段化和标记以用于测序。
[0169]
为了可重复性,在各种实现方式中,方法1200包括校准1204每个基于芯片的生物传感器以建立基线,对照该基线对由结合产生的第一响应信号组和第二响应信号组进行比较分析。这在结合步骤期间第一响应信号组和第二响应信号组相对较弱的情况下可能特别有用。
[0170]
在校准1204之后,方法1200继续并且包括使用1206阻断剂和第一等分试样来使与第一基于芯片的生物传感器上的靶向基因组操纵剂的靶上结合最小化,以及省略1208与第二基于芯片的生物传感器一起使用的第二等分试样中的阻断剂以使得能够在核酸样品与用于第二基于芯片的生物传感器的功能化捕获表面之间发生靶上结合和脱靶结合。在一些实现方式中,阻断剂是与阻断rna复合的失活cas,阻断rna被配置成同与grna的指导序列重叠序列结合。在其他实现方式中,阻断剂是被配置成与grna的指导序列基本重叠的序列结合的合成核酸类似物。
[0171]
在使用阻断剂充分培育1206第一等分试样之后,方法1200继续并且包括在第一基于芯片的生物传感器上培育1210针对靶上结合而封闭的第一等分试样以及培育针对靶上结合和脱靶结合二者均未封闭的第二等分试样。
[0172]
方法1200继续并且包括可选择地从第一基于芯片的生物传感器和第二基于芯片的生物传感器清洗1212掉未结合的样品。在一些实现方式中,如果测量带宽足够高并且噪声足够低,则可以减少对于清洗步骤的需要。
[0173]
方法1200继续并且包括对响应于第一等分试样和第二等分试样中的核酸样品与第一基于芯片的生物传感器和第二基于芯片的生物传感器的功能化捕获表面上的靶向基因组操纵剂之间发生的生物分子结合相互作用而产生的一个或更多个第一响应信号和第二响应信号进行测量1214。对于每个芯片可以使用场效应生物传感器测量一个以上的响应信号。例如,关于漏极电流、栅极电容、栅极电流等的响应信号都可以产生响应信号,并且可以全部被监测以与来自第二基于芯片的生物传感器的第二组响应信号进行比较。
[0174]
在一些实现方式中,使用满足预定奈奎斯特准则的采样率可选择地测量所述一个或更多个第一响应信号和第二响应信号,用于在与生物分子结合相互作用相关联的预定时间段对核酸样品与靶向基因组操纵剂之间的生物分子结合相互作用的至少一个参数进行测量。
[0175]
使用满足关于给定参数的奈奎斯特准则的采样率进行测量使得能够更好地了解所述参数的动态,尤其是在多个结合相互作用同时发生的情况下。一个或更多个第一响应信号指示与使用阻断剂培育的核酸样品和第一基于芯片的生物传感器的一个或更多个感测表面的感测范围内的被功能化成捕获表面的靶向基因组操纵剂之间的脱靶结合相关联的结合参数,以及一个或更多个第二响应信号指示与省略了阻断剂的核酸样品和第二基于芯片的生物传感器的一个或更多个感测表面的感测范围内的被功能化成捕获表面的靶向基因组操纵剂之间的靶上结合加脱靶结合相关联的结合参数。
[0176]
方法1200继续并且包括确定1216靶向基因组操纵剂的结合效率和/或裂解效率。例如,在某些实现方式中,基于对源自由第一基于芯片的生物传感器产生的响应信号的浓度与源自由第二基于芯片的生物传感器产生的响应信号的浓度进行比较,推导对样品生物传感器的代表性群体使用预定校准过程。由于来自两个基于芯片的生物传感器的响应信号包括脱靶结合,因此浓度之间的差异代表靶向基因组操纵剂的靶上结合。此时,靶上结合和脱靶结合二者的值都是已知的并且可以作为比率或作为差异进行比较。
[0177]
在某些实现方式中,方法1200继续并且包括从未封闭的第二等分试样中捕获1222包括结合至第二基于芯片的生物传感器的捕获表面的靶上位点和脱靶位点的核酸样品的部分,并且释放捕获的样品部分。因此,基于芯片的生物传感器可以用于富化执行pcr等的片段。在一些实现方式中,方法1200继续并且包括响应于确定靶向基因组操纵剂的效率满足预定效率标准而对靶标样品的一个或更多个标记片段进行测序1224,并且方法1200结束。
[0178]
一种包括计算机可读存储介质的计算机程序产品,所述计算机可读存储介质具有以计算机程序产品实施的程序指令,所述程序指令可以由处理器执行以使处理器控制响应于核酸样品与靶向基因组操纵剂之间发生的生物分子结合相互作用而由第一基于芯片的生物传感器和第二基于芯片的生物传感器产生的一个或更多个第一响应信号和第二响应
信号的测量,所述靶向基因组操纵剂具有操纵组分和靶向组分并且被功能化成在第一基于芯片的生物传感器和第二基于芯片的生物传感器的一个或更多个相应感测表面的感测范围内的捕获表面,其中,第一基于芯片的生物传感器被配置成保持使用被配置成结合至与核酸样品的靶上序列重叠的序列的阻断剂来可选择地培育的核酸样品的第一等分试样,以及第二基于芯片的生物传感器被配置成保持省略了阻断剂的核酸样品的第二等分试样,并且基于执行第一响应信号和第二响应信号的比较分析来确定与靶向基因组操纵剂相关联的一个或更多个基因组操纵效率参数。
[0179]
在某些实现方式中,可以执行程序指令以使得处理器在使用基于芯片的生物传感器确定的基因组操纵效率参数与使用一个或更多个其他方法例如上述各种计算机方法、体外方法和体内方法确定的相应基因组操纵效率参数之间执行比较分析。例如,在根据方法800、900、1000、1100和1200中的一个或更多个执行片段化和衔接子连接之后,可以将基于芯片的生物传感器的分析结果与针对相同或相似靶向基因组操纵剂获得的体内、体外和/或计算机结合和/或裂解效率结果中的一个或更多个结果进行比较分析。
[0180]
可以以其他特定形式实践实施方式。所描述的实施方式在所有方面都应被视为说明性的而非限制性的。因此,本发明的范围由所附权利要求书而不是由前述说明书指示。在权利要求书的等效含义和范围内的所有变化都包括在它们的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。