rna结合蛋白ythdf3的应用、治疗神经轴突损伤的靶点及药物
技术领域
1.本发明涉及生物医学技术领域,尤其涉及一种rna结合蛋白ythdf3的应用、治疗神经轴突损伤的靶点及药物。
2.
背景技术:
3.目前在周围神经的长距离损伤或中枢神经损伤的病人中神经损伤修复效果并不显著。神经元轴突的再生能力是神经损伤修复的关键因素,因此,寻找一种可以有效促进神经损伤后轴突再生的调控靶点,通过调控该靶点促进神经损伤的治疗效果,以改善目前神经损伤治疗中周围神经的长距离缺损修复及功能恢复不完全的情况,有利于开发新的治疗手段及策略。
4.
技术实现要素:
5.本发明的目的是为了解决现有技术中无法准确获取神经损伤修复的情况的问题。
6.为了实现上述目的,本发明采用了如下技术方案:一种rna结合蛋白ythdf3的应用,所述rna结合蛋白ythdf3作为分子靶点,用于调控周围及中枢神经损伤后,神经轴突的再生。
7.本技术还提供了一种治疗神经轴突损伤的靶点,包括rna结合蛋白ythdf3及其调控下游的靶基因foxo3。
8.本技术还提供了一种治疗神经轴突损伤的药物,包括rna结合蛋白ythdf3及其调控下游的靶基因foxo3。
9.上述所述的一种rna结合蛋白ythdf3的应用,通过研究表明了体内外干扰ythdf3基因的表达均能显著抑制神经元轴突的生长。另外过表达drg中ythdf3可以促进坐骨神经轴突的再生过程。同时过表达ythdf3的下游重要调控靶基因foxo3的表达能够抑制ythdf3基因干扰对神经元轴突的抑制作用。本发明研究提示了ythdf3有可能通过调节foxo3基因的表达进而影响神经元轴突的生长,可以成为神经损伤修复的重要分子靶点。
10.附图说明
11.图1为本发明所述的抑制drg神经元中ythdf3的表达对轴突生长的影响各数据图;图2为本发明所述的干扰 ythdf3的表达对坐骨神经损伤后轴突再生的影响各数据图;图3为本发明所述的ythdf3的过表达对神经元轴突再生的影响的各数据图;图4为本发明所述的foxo3对ythdf3调控神经元轴突生长的影响的各数据图。
12.具体实施方式
13.为使本发明的目的、技术方案和优点更加清楚,以下结合具体实施例,对本发明作进一步地详细说明。
14.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是,本发明还可以采用不同于在此描述的其他方式来实施,因此,本发明并不限于下面公开说明书的具体实施例的限制。
15.本技术提供了一种rna结合蛋白ythdf3的应用,所述rna结合蛋白ythdf3作为分子靶点,用于调控周围及中枢神经损伤后,神经轴突的再生。
16.本技术还提供了一种治疗神经轴突损伤的靶点,包括rna结合蛋白ythdf3及其调控下游的靶基因foxo3。
17.以此为基础,本技术还提供了一种治疗神经轴突损伤的药物,包括rna结合蛋白ythdf3及其调控下游的靶基因foxo3。
18.为了验证本技术的技术方案,提供了以下几个验证实验:、实施例1:考察干扰ythdf3对drg神经元轴突生长的影响,具体包含以下步骤:(1) 分离培养drg神经元:准备解剖液放入培养皿中,加入抗生素后置于冰上预冷。腹腔麻醉大鼠,用手术剪从尾部沿脊椎向头部剪开皮肤,小心剔出整根脊柱,从颈部开始打开椎板,用显微镊拽出所有drg组织放入解剖液中。取出全部drg组织后弃去解剖液,用细胞级别pbs淋洗组织2遍,洗去多余组织和血迹。弃去pbs,加入2ml胶原酶(3mg/ml),将组织及消化液转移至5ml离心管中。用显微剪充分剪碎组织后放入细胞培养箱中,消化90min。离心弃去胶原酶,加入1ml胰酶消化液,用枪吹打1min左右至组织分散均匀,即可放进细胞培养箱消化10min,每5min拿出吹打均匀再放回培养箱。待组织消化至无明显组织块,即可向离心管中加入3ml消化终止液终止消化。用枪吹打1min左右即可过筛网(70μm),滤掉多余组织并收集细胞悬液至新的5ml离心管中,1200rpm
×
5min,弃去上清。向离心管中加入4ml提前预热的15%bsa溶液,重悬细胞,900rpm离心5min,小心吸弃漂浮的杂细胞。再重复上述步骤。加入提前预热的神经元培养基,吹打细胞均匀后接种到预包被多聚赖氨酸的细胞培养板中,十字混匀细胞后放入5% co2,37℃培养箱中培养。
19.(2) drg神经元aav病毒体外转染待drg神经元细胞接种到培养板后,同时加入1x10^10 vg/ml的ythdf3干扰aav病毒,轻轻摇匀后置于培养箱中培养12左右。更换新鲜神经元培养基,继续培养6d后,用0.025%的胰酶消化细胞重悬并重新接种至24孔培养板中,接种后12~18h内收取细胞。
20.(3)western blot实验利用western blot检测drg神经元ythdf3的蛋白表达变化。在aav病毒干扰drg神经元6d后,提取细胞总蛋白。通过聚丙烯凝胶电泳分离蛋白质,将胶上的蛋白质转移到pvdf膜上后,5%脱脂乳室温封闭2h后,加入anti
‑
ythdf3抗体(1:1000)4℃孵育过夜。弃去一抗,用1
×
pbst润洗,室温洗3次,10min/次。弃去pbst,轻轻滴加使用二抗稀释液稀释的辣根过氧化物酶耦联的goat anti
‑
rabbit(1:10000),室温孵育2h。弃去二抗,用1
×
pbst润洗,室
温洗3次,10min/次,显影。
21.(4)体外神经元轴突生长实验弃去细胞培养基,加入预热后的1
×
pbs润洗细胞。弃去1
×
pbs,加入预冷的4%多聚甲醛,冰上固定20min。弃去甲醛后,用1
×
pbs润洗,室温洗3次,5min/次。清洗结束后弃去pbs,轻轻滴加封闭液,每孔200μl,室温静置40min。弃去封闭液,轻轻滴加用一抗稀释液稀释anti
‑
β
‑
tublin
ꢀⅲ
抗体(1:1000),每孔200μl,4℃ 静置孵育过夜。弃去一抗,用1
×
pbs润洗,室温洗3次,5min/次。弃去pbs,滴加用二抗稀释液稀释的alexa fluor 594 goat anti
‑
rabbit(1:1000),每孔200μl,室温静置孵育2h。此过程避光。弃去二抗,用1
×
pbs润洗,室温洗3次,5min/次。此过程避光。清洗结束后,将圆玻片挑出孔,将有细胞一面朝下覆盖在滴有封片液的载玻片上,置于湿盒中存放在4℃中。注意过程中不要产生气泡。此过程避光。
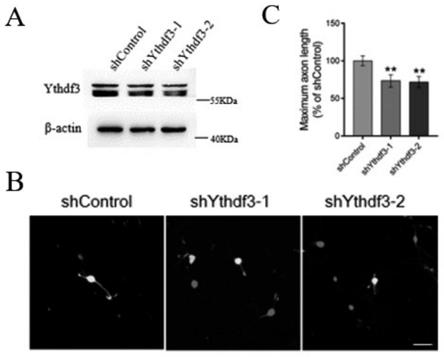
22.请参阅图1,图1a.通过 western blot 验证aav病毒介导的drg组织中ythdf3的表达变化(gapdh为内参),在aav病毒介导的干扰表达后ythdf3的水平显著减少;图1b.神经元轴突染色实验检测干扰ythdf3对神经元轴突生长的影响。图1c为神经元轴突最长的统计图。可以看出,ythdf3干扰后显著抑制神经元轴突的生长。
23.实施例2:考察干扰 ythdf3的表达对坐骨神经损伤后轴突再生的影响,具体步骤如下所示:(1) aav病毒的鞘内注射实验用180g左右龄雄性sd大鼠由实验动物中心提供。手术前首先进行腹腔麻醉,再将背部髂骨附近进行被毛消毒,接着用手术剪暴露皮肤,用眼科剪沿着髂骨切开肌肉组织,换骨剪剪除突起的棘突,将玻璃电极插入椎间隙后,用微量进样器匀速注入ythdf3干扰aav病毒(5x10^10 vg/只)。
24.(2)坐骨神经夹伤在aav病毒鞘内注射14天后再进行坐骨神经夹伤。首先进行腹腔麻醉,再将左侧后肢被毛消毒。用手术剪暴露皮肤,再用眼科剪钝性分离覆盖住坐骨神经的肌肉与基膜,使用夹伤钳夹住坐骨神经近端,夹伤处2mm宽,夹伤持续30s,夹伤结束后将坐骨神经收回肌肉下,最后将伤口缝合。注意术后护理。
25.(3) 组织灌流与脱水夹伤3d后取坐骨神经组织。现配4%甲醛溶液置于冰上预冷待用。首先进行腹腔麻醉,将动物固定好后用手术剪向心脏方向剪开腹部皮肤,暴露出横膈膜后沿边缘剪开即可暴露心脏,剥开盖在心脏上的脂肪组织暴露出动脉,将针管从心尖位置插入伸至动脉中,开启生理盐水灌流再用眼科剪剪开右心耳,待体内所有血液被生理盐水置换出来后打开甲醛灌流,观察到大鼠四肢均僵硬后可进行取材操作。注意暴露心脏前操作不能剪到内脏否则影响灌流效果。
26.(4) 坐骨神经免疫化学染色取出的组织浸泡在4%甲醛溶液中,8h后弃去甲醛溶液,用1
×
pbs清洗掉残留的甲醛,最后换成30%蔗糖溶液进行组织脱水。观察组织在蔗糖溶液中下沉即视为脱水完成,将组织取出置于解剖镜下,用显微镊修剪除去多余肌肉组织,然后小心捋直放置在附有蔗糖溶液的冻台上,再加入蔗糖溶液进行速冻,冻台制作好之后存放在
‑
20℃待切片处理。切片前准备用pll包被好的载玻片,按实验所需设定好切片的厚度后即可开始切片。切片完成后
goat anti
‑
rabbit(1:1000),每孔200μl,室温静置孵育2h。此过程避光。弃去二抗,用1
×
pbs润洗,室温洗3次,5min/次。此过程避光。清洗结束后,将圆玻片挑出孔,将有细胞一面朝下覆盖在滴有封片液的载玻片上,置于湿盒中存放在4℃中。注意过程中不要产生气泡。此过程避光。
31.请参阅图3,图3a.通过 western blot 验证aav病毒介导的drg组织中ythdf3的表达变化(gapdh为内参),在aav病毒介导的过表达后ythdf3的水平显著增加;图1b.神经元轴突染色实验检测过表达ythdf3对神经元轴突生长的影响。图1c为神经元轴突最长的统计图。可以看出ythdf3过表达后显著抑制神经元轴突的生长。
32.实施例4:考察过表达foxo3在ythdf3干扰对神经元轴突生长的影响 (1) 分离培养drg神经元:准备解剖液放入培养皿中,加入抗生素后置于冰上预冷。腹腔麻醉大鼠,用手术剪从尾部沿脊椎向头部剪开皮肤,小心剔出整根脊柱,从颈部开始打开椎板,用显微镊拽出所有drg组织放入解剖液中。取出全部drg组织后弃去解剖液,用细胞级别pbs淋洗组织2遍,洗去多余组织和血迹。弃去pbs,加入2ml胶原酶(3mg/ml),将组织及消化液转移至5ml离心管中。用显微剪充分剪碎组织后放入细胞培养箱中,消化90min。离心弃去胶原酶,加入1ml胰酶消化液,用枪吹打1min左右至组织分散均匀,即可放进细胞培养箱消化10min,每5min拿出吹打均匀再放回培养箱。待组织消化至无明显组织块,即可向离心管中加入3ml消化终止液终止消化。用枪吹打1min左右即可过筛网(70μm),滤掉多余组织并收集细胞悬液至新的5ml离心管中,1200rpm
×
5min,弃去上清。向离心管中加入4ml提前预热的15%bsa溶液,重悬细胞,900rpm离心5min,小心吸弃漂浮的杂细胞。再重复上述步骤。加入提前预热的神经元培养基,吹打细胞均匀后接种到预包被多聚赖氨酸的细胞培养板中,十字混匀细胞后放入5% co2,37℃培养箱中培养。
33.(2) drg神经元aav病毒体外转染待drg神经元细胞接种到培养板后,同时加入1x10^10 vg/ml的ythdf3干扰及foxo3过表达aav病毒,轻轻摇匀后置于培养箱中培养12左右。更换新鲜神经元培养基,继续培养6d后,用0.025%的胰酶消化细胞重悬并重新接种至24孔培养板中,接种后12~18h内收取细胞。
34.(3) 体外神经元轴突生长实验弃去细胞培养基,加入预热后的1
×
pbs润洗细胞。弃去1
×
pbs,加入预冷的4%多聚甲醛,冰上固定20min。弃去甲醛后,用1
×
pbs润洗,室温洗3次,5min/次。清洗结束后弃去pbs,轻轻滴加封闭液,每孔200μl,室温静置40min。弃去封闭液,轻轻滴加用一抗稀释液稀释anti
‑
β
‑
tublin
ꢀⅲꢀ
antibody(1:1000),每孔200μl,4℃ 静置孵育过夜。弃去一抗,用1
×
pbs润洗,室温洗3次,5min/次。弃去pbs,轻轻滴加用二抗稀释液稀释的alexa fluor 594 goat anti
‑
rabbit(1:1000),每孔200μl,室温静置孵育2h。此过程避光。弃去二抗,用1
×
pbs润洗,室温洗3次,5min/次。此过程避光。清洗结束后,将圆玻片挑出孔,将有细胞一面朝下覆盖在滴有封片液的载玻片上,置于湿盒中存放在4℃中。注意过程中不要产生气泡。此过程避光。
35.请参阅图4,图4a.神经元轴突染色实验检测过表达foxo3在ythdf3干扰后对神经元轴突生长的影响。图4b为神经元轴突最长的统计图。可以看出,过表达foxo3能够抑制
ythdf3干扰后对神经元轴突生长的抑制作用。
36.本技术提供的一种rna结合蛋白ythdf3的应用,通过研究表明了体内外干扰ythdf3基因的表达均能显著抑制神经元轴突的生长。另外过表达drg中ythdf3可以促进坐骨神经轴突的再生过程。同时过表达ythdf3的下游重要调控靶基因foxo3的表达能够抑制ythdf3基因干扰对神经元轴突的抑制作用。本发明研究提示了ythdf3有可能通过调节foxo3基因的表达进而影响神经元轴突的生长,可以成为神经损伤修复的重要分子靶点。
37.需要注意的是,本发明中使用的多种标准件均是可以从市场上得到的,非标准件则是可以特别定制,本发明所采用的连接方式比如螺栓连接、焊接等也是机械领域中非常常见的手段,发明人在此不再赘述。
38.以上所述仅为本发明的实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的权利要求范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。