1.本发明涉及细胞培养载体、其制造方法和制造装置。
背景技术:
2.近年来随着干细胞技术和组织工程的进步,人工形成由多个细胞组成的组织的三维结构体的开发已经取得了进步。作为形成三维结构体的细胞形成技术,细胞片方法(专利文献1)、椭球体堆叠(层叠,stack)方法(专利文献2)、凝胶挤出方法(专利文献3)和喷墨方法(专利文献4)等是已知的。其中,生物打印机方法例如凝胶挤出方法和喷墨方法在三维结构体的构建方面已经引起关注,因为细胞可快速固定在培养器皿底部上或在凝胶上。
3.″
凝胶挤出方法
″
为通过从喷嘴连续挤出含细胞的凝胶并堆叠细胞而制造三维结构体的方法。尽管堆叠凝胶是容易的,但问题在于高分辨率的细胞放置(定位,placement)是不可能的,因为细胞放置单元为几百微米或更大。由于细胞放置的分辨率取决于喷嘴直径,可通过减小喷嘴直径而改善分辨率,然而出现如下新问题:对细胞造成的剪切损伤加剧。
4.同时,
″
喷墨方法
″
能够通过从喷墨头排出含细胞的墨而将其以高精度放置来以高分辨率构建三维结构体。然而,所使用的墨需具有低粘度以避免喷墨头堵塞。例如,专利文献4公开凝胶三维结构体的制造方法,通过该方法将含细胞的海藻酸钠水溶液作为喷墨排出到氯化钙水溶液中以导致凝胶化。由于海藻酸钠水溶液具有低粘度并且可设计成缩短凝胶化时间,细胞的三维放置为可能的和容易的。然而,由于专利文献4中公开的凝胶三维结构体在液体中制造并且凝胶并未固定到支持体材料例如载玻片或培养器皿,一直存在如下缺陷:所制造的凝胶三维结构体的应用受限,并且细胞放置的再现性低。与之相比,例如,专利文献5公开以三维放置制造具有三维结构的凝胶的方法。通过该方法,将含细胞的海藻酸钠水溶液排出到载玻片上的氯化钙水溶液。海藻酸钠水溶液由低分子量材料构成,并且通过选择原材料可使粘度变低且可使凝胶化时间变短,使得高度精确的三维放置变得可能。然而,由于凝胶化通过海藻酸和氯化物之间的离子交联实现,在缓冲溶液或细胞培养介质中的浸渍期间,凝胶中的氯化物可逐渐移除,导致凝胶分解,且因此其形状几乎不能保持。进一步地,所知晓的是,包封在海藻酸盐凝胶中的细胞在凝胶中无法长时期生存。尽管可考虑用edta等使凝胶分解,但凝胶可瞬时分解,这可破坏细胞放置,并且出现关于其对细胞的影响的担忧。
5.专利文献6公开通过排出含明胶或纤维蛋白原的液体制造凝胶三维结构体的方法。调节到低浓度的明胶或纤维蛋白原的液体可从喷墨头排出。然而,调节到低浓度的明胶或纤维蛋白原的凝胶化时间如此长以至于细胞在其自身重量下沉降(即使将细胞三维地放置时也是如此),并且因此难以任意地放置细胞。
6.引文列表
7.专利文献
8.专利文献1:日本专利no.5322333
9.专利文献2:日本未审专利申请公布no.2017
‑
101015
10.专利文献3:pct国际申请公布no.2014
‑
531204的日文译文
11.专利文献4:日本专利no.4974144
12.专利文献5:日本未审专利申请公布no.2019
‑
17255
13.专利文献6:日本未审专利申请公布no.2017
‑
209103
附图说明
14.[图1]图1为本发明的细胞培养载体的制造方法的流程图。
[0015]
[图2]图2为作为本发明的排出手段的溶液排出头的示意图。
[0016]
[图3]图3为输入到第二溶液排出头的波形的实例。
[0017]
[图4]图4为设置有多个溶液排出头的本发明的细胞培养载体的制造装置的示意图。
[0018]
[图5]图5为由本发明的细胞培养载体的制造装置在支持体材料上以多种形状形成的细胞培养载体的示意图。
[0019]
[图6]图6为显示本发明的细胞培养载体的制造方法的实例的图。
[0020]
[图7]图7显示通过用排出速度受调整的溶液排出头控制点状水凝胶的邻接性(连续性,contiguity)而形成的水凝胶的实例。(a)显示通过逐渐地减小点状水凝胶间的间距(pitch)而线状连接的点状水凝胶的图案。(b)显示通过将同心圆周上的点连接而形成的曲线状水凝胶的图案。
[0021]
[图8]图8为本发明的除去手段的实例。
[0022]
[图9]图9为堆叠水凝胶的实例。(a)为说明所有2个堆叠层的水凝胶的透视图,(b)为说明2个层的仅第二层的水凝胶的透视图,和图9(c)为说明2个层的仅第一层的水凝胶的透视图。图中的各点表示染色的细胞,并且虚线圆圈表示其中含细胞的第二溶液的液滴以400μm的间距一滴一滴地滴落的范围。因此,在(a)中,虚线圆圈外的各点表示第一层中的细胞,且虚线圆圈内的各点表示第二层中的细胞。
[0023]
[图10]图10为堆叠水凝胶的实例。(a)为说明所有4个堆叠层的水凝胶的横截面视图,(b)为说明4个层的仅第二和第四层的水凝胶的横截面视图,和(c)为说明4个层的仅第一和第三层的水凝胶的横截面视图。
[0024]
[图11]图11为堆叠水凝胶的实例。(a)为说明所有10个堆叠层的水凝胶的横截面视图,(b)为说明10个层中的第一至第九层的奇数层的水凝胶的横截面视图,和(c)为说明10个层中的第二至第十层的偶数层的水凝胶的横截面视图。
[0025]
[图12]图12为堆叠水凝胶的实例。(a)为说明所有3个堆叠层的水凝胶的横截面视图,(b)为说明包含第一种细胞的所有3个层的水凝胶的横截面视图,和(c)为说明包含第二种细胞的3个层的仅第二层的水凝胶的横截面视图。
[0026]
[图13]图13为堆叠水凝胶的实例。(a)为说明所有20个堆叠层的水凝胶的横截面视图,(b)为说明20个层中的第一至第十九层的奇数层的水凝胶的横截面视图,和(c)为说明20个层中的第二至第二十层的偶数层的水凝胶的横截面视图。
[0027]
[图14]图14为具有两层结构的水凝胶的示意图,其中在第一和第二层中形成和堆叠四
‑
peg凝胶。(a)为顶视图,和(b)为(a)中显示的各圆点之一的侧视图。
[0028]
[图15]图15为具有两层结构的水凝胶的示意图,其中四
‑
peg凝胶作为第一层形成且海藻酸盐凝胶或纤维蛋白凝胶作为第二层堆叠。(a)为顶视图,和(b)为(a)中显示的各圆点之一的侧视图。
[0029]
[图16]图16为关于在多种条件下堆叠水凝胶时保持的凝胶形状的图表。分别标注了凝胶组分(peg和海藻酸盐)、排出方法(喷墨方法和分配器方法)、凝胶形状(点状和线状)和在凝胶形成后经过的时间(在排出时和在经过3天后)。xy意指顶视图,且x和y分别表示横轴和竖轴。yz意指侧视图,且z表示深度。
[0030]
[图17]图17为通过将作为细胞作用添加物的纤维蛋白原和凝血酶分别加入到第一溶液和第二溶液中而制备的细胞培养载体的横截面视图。使用pbs作为第一溶液和第二溶液的分散介质。图中,白色部分为水凝胶中存在的纤维蛋白。另外,
″
顶部
″
表示细胞培养载体的上部,且
″
底部
″
表示下部。
[0031]
[图18]图18为通过将作为细胞作用添加物的凝血酶和纤维蛋白原分别加入到第一溶液和第二溶液中而制备的细胞培养载体的横截面视图。使用deme作为第一溶液的分散介质。图中,白色部分为水凝胶中存在的纤维蛋白。另外,
″
顶部
″
表示细胞培养载体的上部,且
″
底部
″
表示下部。
[0032]
[图19]图19为说明水凝胶中的渗透性的时间依赖性(依赖于时间的变化)的图。
技术实现要素:
[0033]
技术问题
[0034]
考虑到前述问题,本发明旨在开发包括具有高形状保持性的水凝胶的细胞培养载体的制造方法和细胞培养载体的制造装置,并且提供包括使用其制造的细胞培养载体的结构体。
[0035]
问题的解决方案
[0036]
为了实现上述目的进行了大量研究,结果,本发明人已经提出下面的发明。
[0037]
(1)细胞培养载体的制造方法,其包括:保持第一溶液的保持步骤,所述第一溶液含有包含聚乙二醇作为主链的、在侧链和/或末端处具有一个或多个亲核官能团或亲电官能团的多支链聚合物;和形成一个或多个水凝胶的凝胶形成步骤,其通过将从液滴排出装置排出的第二溶液的液滴降落在所述第一溶液中使得所述液滴与所保持的第一溶液接触而进行,其中所述第二溶液含有包含聚乙二醇作为主链的、在侧链和/或末端处具有一个或多个其它亲核官能团或亲电官能团的多支链聚合物。
[0038]
本技术要求以日本专利申请no.2019
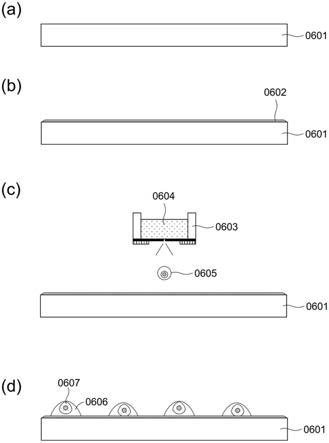
‑
053871、2019
‑
186411和2019
‑
217131为基础的优先权,其公开内容以其整体并入本文中。
[0039]
发明的有益效果
[0040]
根据本发明,可提供包括具有高形状保持性的水凝胶的细胞培养载体,及其制造方法和制造装置。
具体实施方式
[0041]
1.细胞培养载体的制造方法
[0042]1‑
1.概述
[0043]
本发明的第一方面为细胞培养载体的制造方法。本发明的制造方法为使用含有包含在侧链和/或末端处具有一个或多个亲核官能团的聚乙二醇或在侧链和/或末端处具有一个或多个亲电官能团的聚乙二醇的任一种作为主链的多支链聚合物的溶液、和含有包含具有另一种官能团的聚乙二醇作为主链的多支链聚合物(其与前面的多支链聚合物通过凝胶化反应而凝胶化)的溶液形成厚细胞培养载体的方法,这通过用液滴排出装置将含有所述聚合物之一的溶液的液滴排出以降落与含有另一种聚合物的溶液接触而凝胶化来进行。由于可通过本发明的制造方法将水凝胶以高分辨率和高精度三维地放置,可使用水凝胶作为细胞支持体材料制造确保高再现性和优异的成形性的细胞培养载体。
[0044]1‑
2.术语定义
[0045]
将定义在本文中频繁使用的以下术语。
[0046]
(1)包含聚乙二醇作为主链的多支链聚合物
[0047]
本文中的
″
包含聚乙二醇作为主链的多支链聚合物
″
(本文中常简称为
″
多支链聚合物
″
或
″
多臂peg
″
)为用作凝胶化材料的聚合物。当在多个聚乙二醇(peg)支链的末端处分别具有亲核官能团和亲电官能团的两种类型的多臂peg交联在一起时,可形成具有网络结构的凝胶(多臂peg凝胶)。例如,在4个peg支链的末端处分别具有亲核官能团和亲电官能团的两种类型的4重支化的聚合物(本文中常称为
″
四
‑
peg
″
)的情形中,可形成具有均匀网络结构的称为
″
四
‑
peg凝胶
″
的凝胶。对多支链聚合物的支链数量没有特别限制。正常地,如下是可接受的:若peg具有三个或更多个具有亲电末端和亲核末端的支链,并且数量可按需适当选择。构成多臂peg的两种或更多种peg可具有不同的支链数量,只要它们分别具有亲核官能团和亲电官能团。
[0048]
已经报道,在多臂peg中,四
‑
peg凝胶具有理想地均匀网络结构(matsunaga等人,macromolecules,vol.42,no.4,第1344
‑
1351页,2009年),但不限于此。另外,四
‑
peg凝胶可通过简单地混合两种类型的四
‑
peg(包括在本发明的第一溶液和第二溶液中)而容易且快速地现场形成。此外,凝胶化时间可通过调节各四
‑
peg的ph或浓度而控制。另外,由于其包含peg作为主要组分,因此其具有优异的生物相容性。当包含细胞和四
‑
peg的溶液通过液滴排出装置排出使得两种类型的四
‑
peg反应以使四
‑
peg凝胶成型时,细胞可三维地放置。
[0049]
本发明的四
‑
peg的实施方式为具有由下式(i)表示的结构的化合物。
[0050]
[化学式1]
[0051][0052]
式(i)中的
″
m
″
可相同或不同。m值越近似,三维结构可变得越均匀并且凝胶强度变得越高。因此,为产生高强度凝胶,相同的m值为优选的。当m值过高时,凝胶强度变弱,且当各m值过低时,由于化合物的位阻变得难以形成凝胶。因此,各m为例如25至250、优选地35至180、更优选地50至115、和特别优选地50至60的整数。四
‑
peg的分子量为例如5
×
103至5
×
104da、优选地7.5
×
103至3
×
104da、和更优选地1
×
104至2
×
104da。
[0053]
在式(i)中,
″
x1″
为将官能团和核部连接的连接部分。各x1可相同或不同,但为产生具有均匀三维结构的高强度凝胶而优选为相同的。x1表示c1‑
c7亚烷基基团、c2‑
c7亚烯基基团、
‑
nh
‑
ra
‑
、
‑
co
‑
ra
‑
、
‑
rb
‑
o
‑
rc
‑
、
‑
rb
‑
nh
‑
rc
‑
、
‑
rb
‑
co2‑
rc
‑
、
‑
rb
‑
co2‑
nh
‑
rc
‑
、
‑
rb
‑
co
‑
rc
‑
或
‑
rb
‑
co
‑
nh
‑
rc
‑
。此处,ra表示c1‑
c7亚烷基基团、rb表示c1‑
c3亚烷基基团,和rc表示c1‑
c5亚烷基基团。
[0054]
″
c1‑
c7亚烷基基团
″
为具有1个或更多个且7个或更少个碳原子的任选地支化的亚烷基基团,且包括直链c1‑
c7亚烷基基团和具有一个或多个支链(支链具有的碳原子为2个或更多且7个或更少)的c2‑
c7亚烷基基团。c1‑
c7亚烷基基团的实例包括亚甲基基团、亚乙基基团、亚丙基基团和亚丁基基团。c1‑
c7亚烷基基团的实例包括
‑
ch2‑
、
‑
(ch2)2‑
、
‑
(ch2)3‑
、
‑
ch(ch3)
‑
、
‑
(ch(ch3))2‑
、
‑
(ch2)2‑
ch(ch3)
‑
、
‑
(ch2)3‑
ch(ch3)
‑
、
‑
(ch2)2‑
ch(c2h5)
‑
、
‑
(ch2)6‑
、
‑
(ch2)2‑
c(c2h5)2‑
和
‑
(ch2)3c(ch3)2ch2‑
。
[0055]
″
c2‑
c7亚烯基基团
″
为具有2至7个碳原子和一个或多个在链中的双键的直链或支链亚烯基基团。其实例包括通过除去亚烷基基团的邻近碳原子的2至5个氢原子形成的具有双键的二价基团。
[0056]
式(i)中,
″
y1″
为如上所述的用于通过末端交叉(cross
‑
end)偶联反应(其为通过共价键的交联反应)形成网络结构的官能团,且选自亲核官能团或亲电官能团。
[0057]
作为
″
亲核官能团
″
,例如,优选能够缩短凝胶化时间的硫醇基团,但不限于此。该官能团可相同或不同,但优选的是,它们是相同的。当该官能团相同时,与参与交联反应中的亲核官能团的反应性变得均匀,并且可较容易地获得具有均匀三维结构的高强度凝胶。具有亲核官能团的四
‑
peg在本文中表述为
″
亲核四
‑
peg
″
。
[0058]
作为
″
亲电官能团
″
,例如,优选能够缩短凝胶化时间的马来酰亚胺基基团,但不限于此。该官能团可相同或不同,但优选的是,它们是相同的。当该官能团相同时,与参与交联反应中的亲核官能团的反应性变得均匀,并且可较容易地获得具有均匀三维结构的高强度凝胶。具有亲电官能团的四
‑
peg在本文中表述为
″
亲电四
‑
peg
″
。
[0059]
亲核四
‑
peg和亲电四
‑
peg可如此混合使得亲核官能团对亲电官能团的摩尔比落在0.5/1至1.5/1内。由于官能团可各自以1/1反应而形成交联,优选的是混合摩尔比尽可能接近于1/1,并且就形成高强度水凝胶而言,0.8/1至1.2/1的范围为优选的。同时,当第一或第二溶液中分散介质的ph为5至10时,相关溶液中包含的四
‑
peg的浓度可在0.3至20%范围内,并且当ph为6至10时,其优选地在1.7至20%范围内。
[0060]
根据本发明,第一溶液可由亲核四
‑
peg或亲电四
‑
peg的任一种构成,并且第二溶液可由另一种四
‑
peg构成。
[0061]
(2)第一溶液
[0062]
″
第一溶液
″
为包含作为组分的分散介质和多支链聚合物的水溶液,该多支链聚合物包含在侧链和/或末端处具有一个或多个亲核官能团的聚乙二醇或在侧链和/或末端处具有一个或多个亲电官能团的聚乙二醇的任一种作为主链。其按需可进一步包含细胞或细胞作用添加物。
[0063]
根据本发明的制造方法,可存在多种第一溶液。在该情形中,各第一溶液中包含的多支链聚合物(其包含在侧链和/或末端处具有一个或多个亲核官能团的聚乙二醇或在侧链和/或末端处具有一个或多个亲电官能团的聚乙二醇的任一种作为主链)、分散介质、细
胞和细胞作用添加物的全部或部分可不同。例如,第一溶液a中包含的分散介质和第一溶液b中包含的分散介质可相同或不同。在存在多种第一溶液的情形中,例如,当水凝胶形成为堆叠体时,各层中的分散介质可任意地改变。
[0064]
(3)第二溶液
[0065]
″
第二溶液
″
为包含作为必要组分的分散介质和多支链聚合物的水溶液,该多支链聚合物包含在侧链和/或末端处具有一个或多个与第一溶液中的不同的官能团(亲核官能团或亲电官能团)的聚乙二醇作为主链。其按需可进一步包含细胞或细胞作用添加物。如实施例中描述的包含细胞的第二溶液在本文中常称为
″
含细胞的第二溶液
″
。
[0066]
根据本发明的制造方法,可存在多种第二溶液。在该情形中,各第二溶液中包含的具有与第一溶液中的不同的官能团的多支链聚合物(其包含在侧链和/或末端处具有一个或多个亲核官能团或亲电官能团的聚乙二醇作为主链)、分散介质、细胞和细胞作用添加物的全部或部分可不同。例如,第二溶液a中包含的细胞和第二溶液b中包含的细胞可相同或不同。在存在多种第二溶液的情形中,例如,待在稍后描述的凝胶形成步骤(s0102)或凝胶堆叠体形成步骤(s0108)中排出以降落的第二溶液中的细胞物种可任意地改变。
[0067]
(4)水凝胶
[0068]
″
水凝胶
″
为如下凝胶:其具有三维网络结构并且在网络结构空间内部保持大量水,并且也称为保水凝胶。好的实例包括多糖凝胶例如琼脂、蛋白质凝胶例如果子冻、和超级吸收剂聚合物凝胶例如丙烯酸聚合物。通常,水凝胶可通过保持的水将各种物质引入到凝胶中。本文中的水凝胶通过分别包含在第一和/或第二溶液中的包含聚乙二醇作为主链的多支链聚合物之间的交联反应而形成。就此,本说明书的水凝胶的一些包含细胞并且一些不包含。本文中,包含细胞的水凝胶常称为
″
含细胞的水凝胶
″
,并且不含细胞的水凝胶常称为
″
无细胞的水凝胶
″
。
[0069]
(5)细胞培养载体
[0070]
″
细胞培养载体
″
在本文中意指包含作为主组分的水凝胶并且能够三维地培养所包含的细胞的载体。除水凝胶外,细胞培养载体还可包含其它组分例如细胞作用凝胶。对下文中的细胞培养载体的形状或尺寸没有特别限制。形状可为三维结构或二维结构。在三维结构的情形中,其可为立方体、近立方体、圆柱体、近立方体、圆锥体、近圆锥体、球体、纺锤体、未成形的、模拟组织或器官的形状、或这些的组合的任意者。在二维结构的情形中,其可为多边形、近多边形、圆形、近圆形、椭圆形、近椭圆形、未成形的、或这些的组合的任意者。
[0071]
(6)细胞作用凝胶
[0072]“细胞作用凝胶
″
在本文中意指包含细胞作用添加物(而非在前述水凝胶中包含的多支链聚合物)的凝胶。
[0073]
(7)细胞
[0074]
″
细胞
″
在本文中为本发明的细胞培养载体中包括的组分之一。对本文中使用的细胞的种类没有特别限制,并且可取决于预期意图任意选择任何种类的细胞。
[0075]
细胞按分类学可分为例如真核细胞和原核细胞、或多细胞生物细胞和单细胞生物细胞。在本文中所述的发明中,可使用任何细胞。
[0076]
″
真核细胞
″
的实例包括动物细胞(包括脊椎动物细胞和节肢动物细胞)、植物细胞和真菌细胞。在使用这些时,相同种类的细胞可单独使用,或两种或更多种不同种类的细胞
可组合使用。动物细胞为优选的,脊椎动物细胞为更优选的,并且哺乳动物细胞为进一步优选的。当容许细胞形成细胞聚集体时,如下的具有细胞粘附性的细胞是更优选的:其通过细胞间粘附而彼此强固地粘附,并且如在粘附细胞(adherent cell)的情形中那样在没有物理化学处理的情况下几乎不分离。
[0077]
对粘附细胞没有特别限制,并且它们可根据预期意图而适当地选择。其实例包括分化细胞和未分化细胞。
[0078]
分化细胞的实例包括作为肝实质细胞的肝细胞,星状细胞,库普弗(kupffer)细胞,内皮细胞例如血管内皮细胞、窦内皮细胞和角膜内皮细胞,成纤维细胞,成骨细胞,破骨细胞,牙周膜
‑
衍生细胞,表皮细胞例如表皮角化细胞,上皮细胞例如气管上皮细胞、肠上皮细胞、宫颈上皮细胞和角膜上皮细胞,乳腺细胞,周细胞,肌细胞例如平滑肌细胞和心肌细胞,肾细胞,朗格汉斯(langerhans)胰岛细胞,神经细胞例如末梢神经细胞,和视神经细胞,软骨细胞,和骨细胞。
[0079]
分化细胞可为直接取自个体、器官或组织的原代培养细胞,或者它们可为经过若干代的继代培养细胞。
[0080]
对未分化细胞没有特别限制,并且它们可根据预期意图而适当地选择。其实例包括多能干细胞例如胚胎干细胞(es细胞)和间叶干细胞(mcs细胞)、单能干细胞例如单能血管内皮祖细胞,和ips细胞。
[0081]
″
原核细胞
″
的实例包括衍生自真细菌的细胞和衍生自古细菌的细胞。
[0082]
细胞可包括在第一溶液、第二溶液和细胞作用凝胶的一种或多种中。在任意情形中,制备时的环境温度在4至40℃范围内和特别优选地在15至37℃范围内。虽然甚至当温度超过37℃时细胞也不立即死亡,但若温度显著超过37℃或若温度仅稍微超过37℃但持续长时间,则存在如下担忧:细胞可因热而损伤。另外,当环境温度下降到低于4℃时,细胞活动趋于减缓,尽管对细胞的寿命和死亡的影响小于在高温侧的影响。
[0083]
(8)分散介质
[0084]
″
分散介质
″
意指第一溶液、第二溶液、细胞作用凝胶等中包含的用于分散或溶解细胞或细胞作用添加物的介质。对介质没有特别限制,只要其能够分散细胞、或者分散或溶解细胞作用添加物。例如,稍后描述的缓冲溶液或细胞培养介质为适合的,并且特别地细胞培养介质为优选的。就此,第一溶液、第二溶液、细胞作用凝胶等中包含的分散介质可相同或不同。例如,细胞培养介质可用作含细胞的溶液或凝胶的分散介质,或可用于不含细胞的溶液或凝胶。
[0085]
(9)缓冲溶液
[0086]
″
缓冲溶液
″
具有调节至细胞或预期意图的ph,且可从已知的缓冲溶液中适当选择。其实例包括磷酸盐缓冲的生理盐水(下文中称为pbs(
‑
))、hepes缓冲剂和nahco3/co2缓冲剂。
[0087]
(10)细胞培养介质
[0088]“细胞培养介质
″
(本文中常简称为“培养介质
″
)至少包含对于维持细胞和形成有机体必要的组分。细胞培养介质在下文中包括在第一或第二溶液中,并且进一步用于维持形成的细胞培养载体中的细胞、用于形成有机体、或还用于洗涤细胞培养载体。
[0089]
通常,培养介质根据组成可分为天然培养介质、半合成培养介质、合成培养介质
等,并且根据形状或条件也可分为半固体培养介质、液体培养介质、颗粒培养介质(下文中也称为“粉末培养介质
″
)等。下文中使用的培养介质类型可为它们的任一种而没有特别限制,只要其包含对于使用的细胞所需的组分。
[0090]
培养介质可根据溶液或凝胶中包括的细胞种和细胞培养载体的应用意图从本领域中公知的那些中适当选择。其实例包括dulbecco的改良的eagle介质(dmem)、ham f12介质(ham营养素混合物f12)、d
‑
mem/f12介质、mccoy的5a介质、eagle的mem介质(eagle的最少必需介质;emem)、αmem介质(α改良的eagle的最少必需介质;αmem)、mem介质(最少必需介质)、rpmi1640(roswell park memorial institute
‑
1640)介质、iscove的改良的dulbecco介质(imdm)、mcdb131介质、william介质e、ipl41介质、fischer介质、m199介质、hight performance medium 199、stempro34(由thermo fisher scientific生产)、x
‑
vivo 10(由cambrex corporation生产)、x
‑
vivo 15(由cambrex corporation生产)、hpgm(由cambrex corporation生产)、stemspan h3000(由stemcell technologies inc.生产)、stemspansfem(由stemcell technologies inc.生产)、stemline ii(由sigma
‑
aldrich生产)、qbsf
‑
60(由quality biological生产)、stemprohescsfm(由thermo fisher scientific生产)、essential介质(由thermo fisher scientific生产)、mtesr 1或mtesr 2介质(由stemcell technologies inc.生产)、reproff或reproff2(由reprocell inc.生产)、psgro hesc/ipsc介质(由system biosciences生产)、介质(由biological industries生产)、csti
‑
7介质(由cell science&technology institute、inc.生产)、mesenpro rs介质(由thermo fisher scientific生产)、间叶干细胞生长介质(由toyobo co.、ltd.生产)、sf
‑
900ii(由thermo fisher scientific生产)和opti
‑
pro(由thermo fisher scientific生产)。这些可单独地或以两种或更多种的组合使用。尤其是在dmem/f12介质的情形中,其混合比没有特别限制,但是优选的是,dmem和f12就组分的重量浓度比而言以6/4至4/6范围混合。各培养介质的具体组成在本领域中是公知的并且其可基于适当文献(例如kaech s.和banker g,2006、nat.protoc.、1(5):2406
‑
15)中的描述而制备。关于制造商销售的培养介质可购买获得。对在细胞培养期间培养介质中的二氧化碳浓度没有特别限制,并且其可根据预期意图适当选择。通常2%或更大且5%或更小为优选的,并且3%或更大且4%或更小为更优选的。
[0091]
(11)细胞作用添加物
[0092]“细胞作用添加物
″
在本文中意指对细胞直接或间接起作用的物质。对作用和性质没有特别限制,并且其可根据意图适当选择。例如,细胞外基质蛋白例如胶原蛋白、层粘连蛋白、纤连蛋白、弹性蛋白和纤维蛋白,或生长因子例如神经生长因子可用于促进细胞的粘附、增殖和分化。这些可单独地或以两种或更多种的组合使用。当细胞作用添加物用作构成细胞作用凝胶的组分的凝胶时,作为细胞作用添加物,具有凝胶化性质的物质例如细胞外基质蛋白为优选的。例如,前述的细胞外基质蛋白为适合的。
[0093]
(12)支持体材料
[0094]“支持体材料
″
为保持第一溶液的成员。对支持体材料没有特别限制,只要其不抑制细胞的活动或增殖,并且其可根据意图适当选择。细胞可固定至其或细胞粘附材料可容易地粘附至其的材料为优选的。
[0095]
支持体材料可大致分为有机材料和无机材料。有机材料的实例包括合成树脂、基
于有机硅的材料、天然树脂、纤维素结构体(例如木材和纸)、壳质结构体、天然纤维(例如蚕丝、毛、棉和海绵质纤维)。另外,固定在基材上的细胞层可充当基于有机材料的支持体材料。合成树脂的实例包括聚(对苯二甲酸乙二醇酯)(pet)、聚苯乙烯(ps)、聚碳酸酯(pc)、tac(三乙酰基纤维素)、聚酰亚胺(pi)、尼龙(ny)、低密度聚乙烯(ldpe)、中密度聚乙烯(mdpe)、聚(氯乙烯)、聚(偏二氯乙烯)、聚(苯硫醚)、聚(醚砜)、聚(萘二甲酸乙二醇酯)、聚丙烯和丙烯酸类材料例如聚(氨基甲酸酯丙烯酸酯)。基于有机硅的材料包括例如聚二甲基硅氧烷(pdms)。无机材料的实例包括玻璃(包括玻璃纤维)、陶艺品(例如陶瓷和搪瓷)、金属、碳纤维和磷酸钙结构体(例如骨、牙齿和贝壳)。
[0096]
以上材料可单独使用,或者有机材料、无机材料、或有机材料和无机材料的组合的两种或更多种可组合使用。例如,存在纤维强化的塑料(frp),其为碳纤维或玻璃纤维和合成树脂的组合。
[0097]
对支持体材料的尺寸没有特别限制。其可根据意图适当选择。对支持体材料的形状没有特别限制,并且其可根据意图适当选择。例如,其可具有三维形状例如盘、多层板、瓶、膜和细胞培养插件(insert),或平板或平膜形状例如玻璃板、载玻片和盖玻片。
[0098]
对支持体材料的结构没有特别限制,并且其可根据意图适当选择。其实例包括多孔结构、网状结构、浮雕结构和蜂窝结构。由于多孔结构和网状结构可保持大量溶液,它们作为支持体材料是尤为优选的。
[0099]1‑
3.制造方法
[0100]
本发明的制造方法的工艺流程显示在图1中,并且制造工艺的实例的示意图描绘在图6中。
[0101]
如在图1中显示,本发明的制造方法包括作为必要步骤的保持步骤(s0101)和凝胶形成步骤(s0102)以及作为任选步骤的除去步骤(s0103)、平面形成步骤(s0104)、细胞接种步骤(s0105)、细胞作用凝胶形成步骤(s0106)、溶液堆叠步骤(s0107)、凝胶堆叠体形成步骤(s0108)、重复步骤(s0109)和培养步骤(s0110)。
[0102]
进一步地,在图6中,(a)至(d)按时间顺序表示直至含细胞(0607)的水凝胶(0606)形成在支持体材料(0601)上的过程。(a)仅描绘支持体材料(0601),且(b)描绘其中支持体材料(0601)保持第一溶液(0602)的状态,其对应于本发明的制造方法中的保持步骤(s0101)后的状态。(c)描绘其中含细胞的第二溶液(0604)以液滴(0605)形式从第二溶液排出头(0603)排出到(b)中的支持体材料(0601)使得液滴降落在支持体材料上的状态。(d)描绘其中由于第二溶液的降落而在支持体材料(0601)上形成水凝胶(0606)的状态,其对应于本发明的凝胶形成步骤(s0102)。
[0103]
下面将具体描述本发明的制造方法的各个步骤。
[0104]
(1)保持步骤
[0105]“保持步骤
″
(s0101)为保持第一溶液的步骤。保持位置没有限制。例如,其可在支持体材料上或在水凝胶上。保持第一溶液的方法也没有特别限制。例如,将支持体浸在第一溶液中使得支持体材料被第一溶液浸渍,使得第一溶液保持在整个表面和/或内部中。替代地,第一溶液可通过使用液滴排出装置的排出方法例如在下一步骤中详述的喷墨方法排出,使得第一溶液固定和保持在支持体表面或水凝胶表面上的特定位置。此外,如上所述,可使用细胞层作为支持体材料来保持第一溶液。
[0106]
当细胞层用作支持体材料时,对保持第一溶液的支持体材料上的细胞密度没有特别限制,并且其可根据细胞培养载体的用途或意图而适当决定。例如,其可在1000个细胞/cm2或更大、1500个细胞/cm2或更大、2000个细胞/cm2或更大、2500个细胞/cm2或更大、或3000个细胞/cm2或更大、且10000个细胞/cm2或更少、9500个细胞/cm2或更少、9000个细胞/cm2或更少、8500个细胞/cm2或更少、8000个细胞/cm2或更少、7500个细胞/cm2或更少或7000个细胞/cm2或更少的范围内。
[0107]
(2)凝胶形成步骤
[0108]
″
凝胶形成步骤
″
(s0103)意指其中通过液滴排出装置将第二溶液喷出以降落并与在保持步骤(s0101)中保持的第一溶液接触,使得第一溶液和第二溶液混合以使在各自的溶液中包含的具有聚乙二醇作为主链的多支链聚合物反应而形成水凝胶的步骤。
[0109]
″
将......接触
″
意指第一溶液和第二溶液通过接触而混合。
[0110]“液滴排出装置
″
为将储存在液体腔中的溶液作为液滴逐出以降落在目标位点处的手段。排出装置的排出方法的实例包括喷墨方法和通过凝胶挤出方法的分配器方法。通过喷墨方法,将溶液从排出孔(喷嘴)逐出。由于排出方法可从排出孔排出微小溶液(有时称为“液滴”),可产生高度精确的三维结构体。此时,从液体排出装置排出的液滴可包含或可不包含细胞。
[0111]
排出的液滴体积可为任意液体体积。优选地,其为9pl或更大、15pl或更大、20pl或更大、30pl或更大、40pl或更大、50pl或更大、60pl或更大、70pl或更大、80pl或更大、90pl或更大、或100pl或更大且900pl或更小、800pl或更小、700pl或更小、600pl或更小、500pl或更小、400pl或更小或300pl或更小。
[0112]“降落
″
意指使溶液与目标位点接触,如显示在图6(c)中。这通过根据排出方法将液滴朝向目标位点排出而实现。
[0113]
当第二溶液包含细胞时,细胞含量优选为5
×
105个细胞/ml至1
×
108个细胞/ml、和更优选为1
×
106个细胞/ml至5
×
107个细胞/ml。当细胞密度低于该含量时,难以形成包含适当的细胞数目的水凝胶,且相反地当其更高时,通过排出方法例如喷墨方法的溶液排出变难。
[0114]
排出溶液的位置没有特别限制。只需要排出溶液使得溶液降落在期望的目标位置处。另外,各个降落位点可分开、或部分接触或重叠。
[0115]
由于凝胶形成依赖于包括作为主链的具有亲核官能团和亲电官能团的聚乙二醇的多支链聚合物之间的反应,水凝胶当第二溶液降落在第一溶液时形成。当第二溶液通过液滴排出装置排出时,水凝胶可每一次降落通常但非唯独作为点状水凝胶形成。“点状”在本文中意指点状形状。因此,其不限于正圆形状或半球形状,并且其可为任意形状,包括近圆形形状或近半球形状,或另外的多边形形状、近多边形形状、未定型形状、及其组合。进一步地,对点状没有特别限制,只要其具有预定的长度和厚度。在其中第二溶液多次排出的情形中,可制成基于作为最小单元的点状水凝胶的形状各异的水凝胶。
[0116]
由通过单次降落导致的交联反应形成的水凝胶(也就是点状水凝胶)的体积取决于第二溶液至相同位点的排出次数。就此,当排出孔直径较大或至相同位点的排出次数较大时,点状水凝胶的体积变大。因此,点状水凝胶的体积可通过改变至相同位点的排出次数或排出孔直径而调节。本文中,点状水凝胶的体积优选为但不限于9pl或更大、15pl或更大、
20pl或更大、30pl或更大、40pl或更大、50pl或更大、60或更大、70pl或更大、80pl或更大、90pl或更大、或100pl或更大且900pl或更小、800pl或更小、700pl或更小、600pl或更小、500pl或更小、400pl或更小、或300pl或更小。点状水凝胶的直径应为但不限于10μm或更大且300μm或更小,并且厚度应为5μm或更大且150μm或更小。
[0117]
在该步骤中,第二溶液在一个步骤中排出任意次数,因此可形成多个点状水凝胶。点状水凝胶的全部或部分可彼此接触。当将多个点状水凝胶放置成排时,可形成不仅点状而且任选形状的水凝胶。形状可根据意图适当选择。例如,通过在单轴方向上排列点,可形成线状水凝胶。另外,通过将线状水凝胶排列在相同平面中而没有间隙,可形成膜状(平面
‑
形状)水凝胶。通过控制在点状水凝胶间的融合和分离以形成线状或膜状水凝胶,可调节或抑制各点状水凝胶中包含的细胞的迁移和延伸。此外,通过形成膜状水凝胶,可容易地堆叠凝胶。
[0118]
当将细胞加入到溶液中时,由于点状水凝胶中包含的细胞数与供应的浓度有关,细胞密度可通过点状水凝胶的形成次数而调节。
[0119]
(3)除去步骤
[0120]
″
除去步骤
″
(s0103)为在凝胶形成步骤(s0103)后且在稍后描述的溶液堆叠步骤(s0106)前除去例如在支持体材料或水凝胶上存在的多支链聚合物的未反应的(也就是未交联的)部分的步骤。该步骤为任选步骤(s0111),并且可按需进行。
[0121]
除去方法没有特别限制。公知的除去方法的任一种可使用,只要该方法对形成的水凝胶不具有物理、生物或化学影响。通常进行的简易除去方法为通过适当的清洗液体洗涤支持体材料或水凝胶。
[0122]
对清洗方法中使用的清洗液体没有特别限制,只要其为不影响水凝胶和细胞的溶液。其可视ph、渗透压等而适当选择。优选实例包括缓冲溶液和培养介质。
[0123]
对于清洗方法,将清洗液体倾倒在支持体材料或水凝胶上,或为减轻对水凝胶的物理损伤起见可将物体浸在清洗液体中。清洗在一个步骤中可多次进行。
[0124]
(4)平面形成步骤
[0125]“平面形成步骤
″
(s0104)为通过在凝胶形成步骤(s0102)或稍后描述的凝胶堆叠体形成步骤(s0108)中形成的水凝胶和支持体材料、或稍后描述的细胞作用凝胶形成步骤(s0106)中形成的细胞作用凝胶上将第一溶液和第二溶液堆叠而形成水凝胶层的步骤。该步骤为任选步骤(s0112),并且可按需进行。
[0126]
在凝胶形成步骤(s0102)或凝胶堆叠体形成步骤(s0108)中形成的水凝胶或细胞作用凝胶形成步骤(s0106)中形成的细胞作用凝胶以及周边之间可存在高度差,因为作为构成单元的点状水凝胶或点状细胞作用凝胶具有任意厚度。在该步骤中,这样的水凝胶及周边之间的高度差通过用水凝胶填充点状水凝胶或细胞作用凝胶的周边而减小。当堆叠凝胶时,另外目的是为了改善充当堆叠基材的较低(下面的)凝胶层的平坦性。另外,由于层间的混合被抑制,邻近层中的细胞或材料的污染不发生。
[0127]
该步骤的基本操作可与保持步骤(s0101)或凝胶形成步骤(s0102)相同。然而,该步骤中使用的第一溶液和第二溶液可包含或可不包含细胞。
[0128]
(5)细胞接种步骤
[0129]“细胞接种步骤
″
(s0104)为在形成的水凝胶上接种细胞的步骤。该步骤为任选步
骤(s0113),并且可按需进行。进一步地,该步骤、除去步骤(s0103)和平面形成步骤(s0105)的次序不重要,只要它们在凝胶形成步骤(s0102)后进行。细胞接种步骤(s0104)可在除去步骤(s0103)和平面形成步骤(s0105)后进行,或除去步骤(s0103)和平面形成步骤(s0105)可在细胞接种步骤(s0104)后进行。
[0130]
由该制造方法制造的水凝胶按需包含细胞作用添加物。通过将细胞接种到包含细胞作用添加物的水凝胶,细胞可粘附到水凝胶。另外,通过将细胞接种到稍后描述的细胞作用凝胶,可进行在凝胶外部的细胞图案化。
[0131]
对细胞接种方法没有特别限制,并且其可适当选择根据意图。其实例包括其中含细胞的溶液通过液滴排出装置排出使得细胞固定和保持在水凝胶或细胞作用凝胶上的特定位置处的方法。此时,每单位体积溶液的细胞含量优选为5
×
105个细胞/ml至1
×
108个细胞/ml、和更优选地1
×
106个细胞/ml至5
×
107个细胞/ml。
[0132]
(6)细胞作用凝胶形成步骤
[0133]“细胞作用凝胶形成步骤
″
(s0106)为在支持体材料或水凝胶上堆叠细胞作用凝胶的步骤。该步骤为任选步骤(s0114),并且可按需进行。细胞作用凝胶包含代替多支链聚合物的细胞作用添加物作为主凝胶组分。其可进一步包含除多支链聚合物外的各种组分。例如,其可包括分散介质、细胞或其组合。
[0134]
该步骤可在凝胶形成步骤(s0102)后进行。其优选地在平面形成步骤(s0105)或细胞接种步骤(s0104)后进行。
[0135]
作为细胞作用凝胶形成步骤(s0106)中的凝胶形成方法,将细胞作用凝胶通过液滴排出装置排出的方法为优选的,但不限于此。在该情形中,具体方法与前述凝胶形成步骤(s0102)一致。通过单次排出形成的细胞作用凝胶将呈现类似于点状水凝胶的点状。这样的细胞作用凝胶在本文中称为“点状细胞作用凝胶
″
。
[0136]
(7)溶液堆叠步骤
[0137]“溶液堆叠步骤
″
(s0107)为在形成的水凝胶或细胞作用凝胶上再次堆叠第一溶液的步骤。尽管该步骤为任选步骤(s0115),但其在水凝胶形成为堆叠体的情形中为必要步骤。
[0138]
该步骤和稍后描述的凝胶堆叠体形成步骤(s0108)的目的在于,在已经形成的水凝胶层上层积新的水凝胶。
[0139]
该步骤的基本操作与保持步骤(s0101)一致。在该步骤中,将第一溶液堆叠成使得第一溶液保持在形成的水凝胶或细胞作用凝胶的全部或部分上。此时,例如,第一溶液可在水凝胶尚未形成在其上的支持体材料上再次保持。
[0140]
对用于保持水凝胶的方法没有特别限制,并且其可根据意图从公知方法中适当选择。其实例包括:与前述的用于保持第一溶液方法相同地将已经形成水凝胶的支持体材料浸在第一溶液中以用第一溶液浸渍水凝胶表面的方法,和通过液滴排出装置将第一溶液排出使得第一溶液固定和保持在水凝胶上的特定位置处的方法。
[0141]
该步骤中使用的第一溶液可与本发明的制造方法中在该步骤前使用的第一溶液相同或不同。例如,其可包含与在已经形成的水凝胶中使用的分散介质不同类型的分散介质。
[0142]
(8)凝胶堆叠体形成步骤
[0143]
″
凝胶堆叠体形成步骤
″
(s0108)为通过排出第二溶液以降落成使得第二溶液与溶液堆叠步骤(s0107)中堆叠在水凝胶或细胞作用凝胶上的第一溶液接触而在水凝胶或细胞作用凝胶上堆叠新的水凝胶的步骤。尽管该步骤为任选步骤,但其在水凝胶形成为堆叠体的情形中为必要步骤。
[0144]
该步骤类似于凝胶形成步骤(s0102)。在该步骤中,排出第二溶液的位置没有特别限制。然而,需要排出的第二溶液至少一部分应降落在水凝胶或细胞作用凝胶的全部或部分上。当排出进行多次时,水凝胶或细胞作用凝胶上形成的点状水凝胶的全部或部分可彼此接触,如同在凝胶形成步骤(s0102)中一样。当将多个点状水凝胶在水凝胶
‑
细胞复合物上放置成排时,可形成厚的多次
‑
堆叠的水凝胶。
[0145]
该步骤中使用的第二溶液可与本发明的制造方法中在该步骤前使用的第二溶液相同或不同。例如,其可包含与已经形成的水凝胶中使用的细胞不同类型的细胞。
[0146]
(9)重复步骤
[0147]“重复步骤
″
(s0109)为将除去步骤(s0103)至凝胶堆叠体形成步骤(s0108)重复多次的步骤。尽管该步骤为任选步骤(s0116),但其在要形成具有足够高度的三维水凝胶时应优选地进行。
[0148]
在实施该步骤时,除去步骤(s0103)、细胞接种步骤(s0105)和平面形成步骤(s0104)可按需进行。
[0149]
该步骤旨在形成多次堆叠的水凝胶。通过该步骤,可制造立体(三维)水凝胶。
[0150]
(10)培养步骤
[0151]“培养步骤
″
(s0110)为培养形成的水凝胶中包含的细胞和/或与水凝胶和/或细胞作用凝胶接触的细胞的培养步骤。该步骤为任选步骤(s0117),并且可按需进行。
[0152]
取决于意图,由该制造方法制造的水凝胶任选地在凝胶中包含活细胞。当水凝胶包含作为分散介质的培养介质时,凝胶中的细胞可保持一段时间。然而,当储存水凝胶、或凝胶中的细胞生长或延伸时,必须将凝胶中的细胞保持长的时长。在该情形中,另外的向细胞的营养素供应、气体交换、废弃产物除去等的管理变得需要。该需要可通过培养通过本发明的制造方法在该步骤中形成的水凝胶中包含的细胞和/或与之接触的细胞而满足。对细胞培养方法没有特别限制,只要其可培养水凝胶中包含的细胞和/或与之接触的细胞。其实例包括其中培养通过将水凝胶浸在培养介质中进行的方法。
[0153]
培养介质根据意图或细胞类型可从如记载于
″1‑
2.术语定义
″
部分中本领域公知的培养介质中适当选择。
[0154]
培养方法可与普通细胞培养方法相同,并且没有特别限制。例如,可将水凝胶浸在容纳培养介质的培养罐中,并且在5体积
‑
%co2在37℃的环境中培养。取决于细胞增殖状态等可将培养介质适当地以若干天的间隔更换,或可将培养介质松动以向各细胞供应足够的氧气和营养素。对于使培养介质松动,可进行使用搅拌器或搅拌棒的搅拌、培养罐的摇动、或使用蠕动泵的循环等。然而,培养介质的松动应优选地温和地进行以避免由于流动水压等引起的对水凝胶的任何物理损伤。
[0155]
培养周期没有特别限制。培养按需可以适当周期进行。经常,1天到30天是足够的。其优选为1天到7天。
[0156]
2.细胞培养载体
[0157]2‑
1.概述
[0158]
本发明的第二方面为细胞培养载体。本发明的细胞培养载体用包括多支链聚合物的水凝胶构成,并且可成形为任选形状例如点状、线状、膜状或三维形状。如下是可能的:本发明的细胞培养载体提供具有高模型再现性和形状保持性的三维结构体。进一步地,其可提供能够在凝胶内部或在凝胶表面上长期培养细胞的人工形成的三维结构体。本发明的细胞培养载体可由第一方面中描述的细胞培养载体的制造方法制成。
[0159]2‑
2.构成
[0160]
构成本发明的细胞培养载体的水凝胶由一个或多个点状水凝胶组成。“点状水凝胶
″
为此方面的细胞培养载体中的水凝胶的构成单元。如第一方面中描述的,当第二溶液通过排出方法排出以降落在第一溶液上时,每一次排出形成的水凝胶称为点状水凝胶。
[0161]
构成此方面的细胞培养载体的点状水凝胶形状、尺寸、厚度等类似于第一方面中的那些。
[0162]
点状水凝胶可包含细胞、分散介质或添加剂(例如细胞作用添加物)。在该情形中,分别的点状水凝胶中包含的细胞、分散介质和添加剂可为相同或不同类型。
[0163]
本发明的细胞培养载体具有用单个点状水凝胶或用多个相互独立的点状水凝胶构成的点状结构、以及用彼此接触的这样的水凝胶形成的线状结构和/或膜状结构。其也可具有其中多个水凝胶在具有点状结构和/或线状结构和膜状结构的点状水凝胶上堆叠成使得它们的全部或部分彼此重叠的三维结构。图7显示通过用排出速度受调整的溶液排出头控制点状水凝胶的邻接性而形成的水凝胶的实例。(a)显示通过逐渐减小在点状水凝胶间的间距而线状连接的点状水凝胶的图案化。(b)显示点状水凝胶图案化为曲线状成型体(其通过将同心圆周上的点连接而形成)。
[0164]
在凝胶形成后,支持体材料可原样保持或可除去。在后一情形中,各种评价可仅使用细胞培养载体进行。
[0165]
在本发明中,
″
形状保持性
″
指的是与形状的经时变化有关的性质。当物质的形状保持性高时,其意指物质的经时变化小,并且制造时的形状易于保持。本发明的细胞培养载体包括水凝胶,且水凝胶具有高形状保持率。本文中的
″
形状保持率
″
为在水凝胶制备后立即放置在培养箱后培养3天的点状水凝胶的直径和厚度的变化率。在下面的细胞培养载体的情形中,关于水凝胶的直径和厚度的形状保持率为75%或更高。就线状水凝胶而言,其类似地基于线宽和厚度评价,且就膜状水凝胶而言,其基于膜厚度评价。
[0166]
3.细胞培养载体的制造装置
[0167]3‑
1.概述
[0168]
本发明的第三方面为细胞培养载体的制造装置。本发明的制造装置为将第一方面中描述的细胞培养载体的制造方法具体化并且能够制造包括具有高模型再现性和形状保持性的水凝胶的细胞培养载体的装置。进一步地,其可制造包括具有任选形状的且能够在凝胶中长期培养细胞的水凝胶的细胞培养载体。
[0169]3‑
2.构成
[0170]
本发明细胞培养载体的制造装置至少包括固定基材的工作台手段,保持第一溶液的保持手段,将第一溶液排出到在工作台手段上放置的基材的第一溶液排出手段,保持第二溶液的保持手段、将第二溶液排出到在工作台手段上放置的基材的第二溶液排出手段,
控制第一溶液排出手段和第二溶液排出手段中的各自溶液的排出的溶液排出控制手段,通过计算第一溶液排出手段和第二溶液排出手段以及工作台的相对位置并控制各自溶液的排出位置而控制各自溶液的排出位置的排出位置控制手段,和控制第一溶液排出手段和第二溶液排出手段的排出次序的排出次序控制手段。其可进一步包括除去残留在凝胶形成在其上的基材表面中的未反应的具有聚乙二醇作为主链的多支链聚合物的手段。下面将描述各部分和手段。
[0171]
(1)工作台手段
[0172]“工作台手段
″
为用于在细胞培养载体的制造装置中固定基材的部分。工作台手段配置成将基材固定在恰当位置处。
[0173]
此方面的制造装置中的“基材
″
为放置在工作台手段上并且在其表面上的预定位置处捕获从第一溶液排出手段或第二溶液排出手段排出的溶液以形成水凝胶的部件。其实例包括支持体材料和水凝胶。在水凝胶通过此方面的制造装置堆叠的情形中,必须将含凝胶化材料的溶液精确地放置在构成基材的水凝胶上,并且因此进行基材定位是优选的。
[0174]
对基材的固定方法没有特别限制,只要基材可固定在工作台手段上,并且公知的方法也可适用。例如,基材可通过从上面将其按压到工作台手段上或使用固定手段例如固定在工作台手段上的弹簧夹将其从侧面夹紧而固定。
[0175]
(2)保持手段
[0176]
″
第一溶液保持手段
″
和
″
第二溶液保持手段
″
为配置成使得将各自溶液供应到
″
第一溶液排出手段
″
和
″
第二溶液排出手段
″
以将其排出的手段。第一溶液保持手段和第二溶液保持手段的基本配置除如下外是相同的:前者保持第一溶液且后者保持第二溶液。对材质或形状没有特别限制,只要可保持第一溶液或第二溶液,且可应用公知的方法。例如,在如图2中的示意图中描绘的用于溶液排出的喷墨头(本文中常称为“溶液排出头”)的情形中,可保持液体,因为溶液排出头(0201)设置有用于容纳液体(0202)的液体腔(0203)。
[0177]
(3)第一和第二溶液排出手段
[0178]
″
第一溶液排出手段
″
和
″
第二溶液排出手段
″
(下文中将两部分统称为“溶液排出手段
″
)为配置成使得它们可将各自溶液排出到在工作台手段上放置的基材上的手段。
[0179]
第一溶液排出手段和第二溶液排出手段的基本配置除如下外是相同的:前者排出第一溶液且后者排出第二溶液。
[0180]
溶液排出手段的具体配置实例包括喷墨头。图2为用于溶液排出的喷墨头的示意图。如在该图中显示的,溶液排出头(0201)设置有用于容纳液体(0202)的液体腔(0203)、其中形成有排出孔(喷嘴)(0204)的膜(0205)和振动装置(0206)。在该图中,还显示驱动手段(0207),其向振动装置(0206)施加电压作为具体驱动信号且对应于稍后描述的溶液排出控制手段。
[0181]
本发明的制造装置可分别包括多个第一溶液排出手段和第二溶液排出手段。在该情形中,各溶液排出手段可保持相同或不同的溶液。例如,图4显示设置有两个第二溶液排出手段(第二溶液排出头)的制造装置的实例。此时,存在第二溶液排出头1(0401)和第二溶液排出头2(0402)包括相互不同的细胞的情形。在图4中,0403代表工作台,0404代表液体腔单元,0405代表振动单元,0406代表膜状部件,和0407代表驱动单元,0408代表大气通风单元,0409代表工作台驱动手段,和0410代表信号控制手段。
[0182]
(4)溶液排出控制手段
[0183]
″
溶液排出控制手段
″
为控制溶液排出手段中的各溶液的排出的手段。通过溶液排出控制手段,将溶液排出信号传送到各溶液排出手段以调节溶液的排出时机、排出次数或排出体积。作为溶液排出控制手段的具体配置实例,存在图2中显示的驱动手段(0207)。
[0184]
图3显示从驱动手段(0207)至溶液排出头的输入波形的实例。驱动手段(0207)配置成将图3(a)中呈现的排出波形(pj)作为驱动信号传送到图2中呈现的喷墨头的振动装置(0206),以经由振动装置(0206)调节膜(0205)的振动条件而将保持在液体腔(0203)中的液体(0202)(也就是所述溶液)以液滴形式排出。排出波形(pj)优选地以包括如在图3(b)中显示的适当的膜振动周期(t
o
)的驱动信号设定,以通过使膜共振而以尽可能低的电压排出液体。对于排出波形(pj),不仅可使用三角波和正弦波,而且可使用其边缘通过应用低通滤波器而变柔和的三角波。
[0185]
此外,驱动手段(0207)配置成可将图3(a)中呈现的衰减波形(ps)作为驱动信号传送到振动装置(0206)。通过该驱动信号,可快速抑制液滴形成后的膜残留振动,使得较高频率的连续排出变成可能。另外,由于卫星体(satellite)和雾减少,微小的液体体积调节变得可能。对于衰减波形(ps),不仅可使用三角波和正弦波,而且可使用其边缘通过应用低通滤波器而变柔和的三角波。
[0186]
对保持在溶液排出头(0201)的液体腔(0203)中的各溶液的体积没有特别限制,并且液体腔典型地配置成保持约1μl至1ml的体积。特别地,当溶液本身例如细胞分散在其中的细胞悬浮液昂贵时,溶液排出头优选地配置成液滴可通过少量液体形成。就此,液体腔(0203)可配置成保持约1μl至200μl体积的液体。
[0187]
平面视图中的膜(0205)的形状没有特别限制。例如,可使用圆形、椭圆形或正方形形状的任一种。与液体腔(0203)底部的形状一致的形状为优选的。同时,尽管对膜(0205)的材质没有特别限制,但具有太软材料的膜甚至当溶液未排出时也易于振动,并且难以抑制振动。因此,具有一定程度的硬度的材料为优选的。通常,使用金属、陶瓷或具有一定程度的硬度的聚合物材料例如塑料。在金属情形中,例如但不限于此,可使用不锈钢、镍、铝等。在陶瓷情形中,例如但不限于此,可使用二氧化硅、氧化铝、氧化锆等。
[0188]
如下为期望的:排出孔(0204)在膜(0205)中心处作为基本上完美的圆形贯通孔形成。
[0189]
作为振动装置(0206)的具体实例,存在压电装置。通过向压电装置施加电压,压缩应力在纸面的横向上作用,使得膜可形变。作为压电装置的材料(压电材料),可使用锆钛酸铅(本领域中最流行的材料)。替代地,作为压电材料,可使用铋氧化铁、金属铌酸盐、钛酸钡、或者金属或另外氧化物加入到其的这些材料。作为除压电装置外的另外实例,存在将具有不同于膜的线性膨胀系数的线性膨胀系数的材料结合到膜的装置。该装置可利用受热时的线性膨胀系数差而使膜形变。该装置优选地配置成将加热器安装在具有不同线性膨胀系数的材料上,并且当加热器通电时将膜形变以排出液滴。
[0190]
(5)排出位置控制手段
[0191]“排出位置控制手段
″
为用于控制各溶液的排出位置的手段。该手段配置成可通过计算溶液排出手段和工作台的相对位置而对来自溶液排出手段的溶液的排出位置进行调节以将溶液降落在固定在工作台上的基材上的特定位置处。通过来自排出位置控制手段的
信号,移动溶液排出手段或工作台,使得排出孔可定位在其中溶液应被排出的基材上的预定位置处。替代地,其可配置成可调节排出孔的方向。排出位置控制手段的配置的具体实例包括如上所述的图4中呈现的工作台驱动手段(0409)。
[0192]
通过向该手段指示水凝胶应在基材上形成的位置,可在基材上形成任选形状的水凝胶。图5为通过该手段在支持体材料上以各种形状形成的水凝胶的示意图。在图5(a)中,将点状水凝胶形成为具有间距(s)。在图5(b)中,点状水凝胶彼此接触并且邻接性地重叠而形成线状非个体(线状水凝胶)。在图5(c)中,点状水凝胶类似地重叠但以曲线进行而形成曲线状非个体(线状水凝胶)。就此,可通过由溶液排出控制手段调节溶液的排出速度而实现点状水凝胶的连接融合。例如,通过在第二溶液排出后但在第一溶液和第二溶液之间的凝胶化完成前将第二溶液排出到下一预定位置,可获得如图5(b)或5(c)右侧描绘的点状水凝胶融合线状非个体(线状水凝胶)。
[0193]
(6)排出次序控制手段
[0194]“排出次序控制手段
″
为控制溶液从第一和第二溶液排出手段的排出次序的手段。该手段将控制信号传送到溶液排出控制手段以控制溶液从各自的溶液排出手段的排出次序。通过该手段,可执行根据第一方面的制造方法中的步骤。排出次序控制手段的具体配置的实例包括上述的图4中显示的信号控制手段(0410)。
[0195]
(7)除去手段
[0196]
″
除去手段
″
为用于除去残留在凝胶形成在其上的支持体材料和水凝胶上的未反应的具有聚乙二醇作为主链的多支链聚合物的手段。通过该手段,可实施根据第一方面的制造方法中的除去步骤。
[0197]
作为具体实例,图8呈现除去手段的示意图。通过工作台驱动手段(0805)将支持体材料(0803)上形成的点状水凝胶(0804)放置于除去手段(其作为在内部保持清洗液体(0806)的清洗槽(0807)配置)中,支持体材料(0803)上残留有未反应的具有聚乙二醇作为主链的多支链聚合物(0802)且其在工作台(0801)上。如在图8(b)中显示的,支持体材料浸在清洗槽中的清洗液体中以进行洗涤,使得可获得未反应的具有聚乙二醇作为主链的多支链聚合物已经从中除去的细胞培养载体,如在图8(c)中显示的。
[0198]
4.使用细胞培养载体的方法
[0199]
本发明的第四方面为使用细胞培养载体的方法。细胞培养产物可通过使用由第一方面中所述的细胞培养载体的制造方法制造的细胞培养载体培养细胞而产生。
″
培养的细胞
″
可为接种或包埋在由第一方面中所述的制造方法制造的细胞培养载体中的细胞。同时,由第一方面中所述的制造方法制造的细胞培养载体中包括的细胞可为辅助细胞(佐细胞)例如饲养细胞,而
″
培养的细胞
″
可为接种到包含辅助细胞的细胞培养载体上的细胞。
″
培养的细胞
″
也可为根据第一方面的(2)凝胶形成步骤中从液滴排出装置排出的液滴中包含的细胞、或根据第一方面的(5)细胞接种步骤中接种的且包括在细胞培养载体的制造过程中的细胞。
[0200]
实施例
[0201]
下面将参考实施例具体地描述本发明,条件是本发明不限于下面的实施例。
[0202]
(方法)
[0203]
<实施例1>
[0204]
在该实施例中,使用本发明的细胞培养载体的制造方法制备其中在支持体材料上形成点状水凝胶的细胞培养载体。
[0205]
(1)第一溶液的制备
[0206]
通过如下制备包含2%四
‑
peg
‑
sh的第一溶液:将四
‑
peg
‑
sh(商品名称:sunbright pte
‑
100sh,由yuka sangyo co.,ltd.生产)溶解在pbs(
‑
)(thermo fisher scientific)中并且然后将溶液过滤通过平均孔径为0.2μm的过滤器(商品名称:minisart syringe filter 175497k,由sartorius生产)。
[0207]
(2)第二溶液的制备
[0208]
通过如下制备包含2%四
‑
peg
‑
马来酰亚胺基的第二溶液:将0.1g的四
‑
peg
‑
马来酰亚胺基(商品名称:sunbright pte
‑
100ma,由yuka sangyo co.,ltd.生产)溶解在pbs(
‑
)中并且然后将溶液过滤通过平均孔径为0.2μm的过滤器。
[0209]
(3)支持体材料的制备
[0210]
将直径为13mm的由聚酯构成的多孔培养膜(商品名称:ipcellculture track
‑
etched membrane filter,孔尺寸:0.45μm,孔密度:4e6 em
‑2,厚度:12μm,由it4ip生产)放置在35mm盘中,向其中加入2ml第一溶液以用第一溶液浸渍膜。在18mm
‑
正方形盖玻片(等级名称:no.1,厚度:0.13至0.17mm,由matsunami glass ind.,ltd.生产)的中心周围,放置3μl第二溶液并且将浸渍有第一溶液的膜堆叠在第二溶液部分上以借助水凝胶进行粘附,使得通过四
‑
peg
‑
sh和四
‑
peg
‑
马来酰亚胺基形成水凝胶,其将膜固定到盖玻片。将具有固定的膜的盖玻片放置在包含第一溶液的盘中,使得再次将膜用第一溶液浸渍。然后,将其从盘中取出以获得保持第一溶液的支持体材料。
[0211]
(4)水凝胶形成
[0212]
在将用于排出第二溶液的喷墨头(第二溶液排出头)的液体腔用第二溶液填充后,将该溶液以20
×
20间距的400μm间隔一个接一个地滴落到支持体上,使得第二溶液降落在第一溶液上,并且通过第一溶液和第二溶液的反应而形成由四
‑
peg凝胶构成的水凝胶。在形成后,将水凝胶转移到35mm盘,向其中缓缓地加入10质量%fbs和包含1质量%抗生素的dmem,并且将混合物放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0213]
<实施例2>
[0214]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体材料上形成含细胞的点状水凝胶的细胞培养载体。该实施例的基本程序与实施例1相同。然而,该实施例与实施例1的不同之处在于使用包含细胞的含细胞的第二溶液作为所述第二溶液。
[0215]
(1)细胞培养
[0216]
在培养箱(商品名称:km
‑
cc17ru2,由panasonic corporation生产,37℃,5体积%co2环境)中,并使用包含10质量%胎牛血清(下文中称为
″
fbs
″
)和1质量%抗生素溶液(抗生素
‑
杀真菌剂混合原液(100
×
),由nacalai tesque,inc.生产)的dulbecco的modified eagle介质(商品名称:dmem(1
×
),由thermo fisher scientific生产,下文中称为
″
dmem
″
),将正常的人皮肤成纤维细胞(商品名称:cc2507,由lonza生产,下文中称为
″
nhdf细胞”)在100mm盘中培养72小时。
[0217]
(2)细胞悬浮液的制备
[0218]
在将nhdf细胞培养72小时后,使用抽吸器将盘中的dmem除去。向盘中加入5ml pbs
(
‑
),并且将pbs(
‑
)通过用抽吸器抽吸而除去,并且洗涤表面。在将使用pbs(
‑
)的洗涤操作重复两次后,将2ml的0.05质量%胰蛋白酶/0.05质量%edta溶液(由thermo fisher scientific生产)加入到盘,并且在培养箱中加热5分钟以将细胞从盘脱离。在通过相差显微镜(装置名称:ckx41,由olympus生产)确认细胞脱离后,将4ml含fbs的dmem加入到盘以使胰蛋白酶失活。将盘中的细胞悬浮液转移到15ml离心管,进行离心(商品名称:h
‑
19fm,由kokusan co,ltd.生产,1.2
×
103rpm,5分钟,5℃),并且将上清液使用抽吸器除去。在除去后,将2ml含fbs的dmem加入到离心管,并且将细胞通过缓缓移液而分散以制备细胞悬浮液。从细胞悬浮液中将20μl转移到埃彭道夫(eppendorf)管,向其中加入20μl的0.4质量%锥虫蓝染色剂,然后移液。从染色的细胞悬浮液中取出20μl并置于由pmma
‑
制成的塑料载片上,并且使用细胞计数器(商品名称:countess automated cell counter,由thermo fisher scientific生产)对细胞数目计数并且计算溶液中的细胞数目。
[0219]
(3)细胞悬浮在其中的第二溶液的制备
[0220]
将(2)中获得的细胞悬浮液的一部分转移到埃彭道夫管并且离心(装置名称:minispin,由eppendorfag生产,2.5
×
103rpm,1分钟),并然后使用移液管将上清液除去。除去后,加入
″
实施例1
‑
(2)
″
中制备的第二溶液以获得含细胞的第二溶液,其由具有1
×
107细胞/ml细胞浓度的包含四
‑
peg
‑
马来酰亚胺基的细胞悬浮液构成。
[0221]
<实施例3>
[0222]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体材料上形成含细胞的点状水凝胶的细胞培养载体。该实施例的基本程序与实施例2中的相同。然而,该实施例与实施例2的不同之处在于,在制造方法中通过实施溶液堆叠步骤和凝胶堆叠体形成步骤来堆叠水凝胶。
[0223]
(1)凝胶形成步骤、溶液堆叠步骤和凝胶堆叠体形成步骤
[0224]
在凝胶形成步骤中,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以100μm间距一滴接一滴地滴落到支持体材料上而形成10mm
×
20mm的水凝胶。
[0225]
接着,作为溶液堆叠步骤,将水凝胶放置到容纳第一溶液的盘中,并且用第一溶液浸渍。然后,作为溶液堆叠步骤,将水凝胶放置到容纳第一溶液的盘中,并且用第一溶液浸渍。
[0226]
随后,作为凝胶堆叠体形成步骤,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以400μm间距一滴接一滴地滴落到水凝胶上而形成第二层水凝胶。
[0227]
最后,将堆叠体转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm盘,并且将其放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0228]
另外,将第一层中的细胞用绿色荧光染料(商品名称:cell tracker green,由thermo fisher scientific生产)染色,并且将第二层中的细胞用橙色荧光染料(商品名称:cell tracker orange,由thermo fisher scientific生产)染色。将各自放置到第二溶液排出头的液体腔中并且从第二溶液排出头排出以形成水凝胶。在水凝胶的制备后一小时,通过共聚焦显微镜fv10(上述的)观察水凝胶。观察结果呈现在图9中。
[0229]
<实施例4>
[0230]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体材料上堆叠含细胞的水凝胶的细胞培养载体。该实施例的基本程序与实施例3中的相同。然而,在
该实施例中,形成的水凝胶的形状不同于实施例3中的水凝胶的形状。也就是说,在实施例3中,在第二层中形成点状水凝胶,而在该实施例中,在第二层中形成线状水凝胶。
[0231]
(1)凝胶形成步骤、溶液堆叠步骤和凝胶堆叠体形成步骤
[0232]
在凝胶形成步骤中,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以100μm间距一滴接一滴地滴落到支持体材料上而形成10mm
×
20mm的水凝胶。然后,在溶液堆叠步骤中,将水凝胶放置到容纳第一溶液的盘中,并且用第一溶液浸渍。
[0233]
随后,作为凝胶堆叠体形成步骤,通过如下而以400μm间隔形成25个具有200μm宽度和20mm长度的线状图案水凝胶:由填充有含细胞的第二溶液的第二溶液排出头将液滴以50μm间距一滴接一滴地滴落到水凝胶上,由此形成第二层水凝胶。
[0234]
最后,将堆叠体转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0235]
<实施例5>
[0236]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体材料上堆叠含细胞的水凝胶的细胞培养载体。该实施例的基本程序与实施例4中的相同。然而,该实施例与实施例4的不同之处在于,进行重复步骤以将制造方法中的溶液堆叠步骤和凝胶堆叠体形成步骤重复多次而堆叠多个水凝胶层。
[0237]
(1)凝胶形成步骤以及包括重复步骤的溶液堆叠步骤和凝胶堆叠体形成步骤
[0238]
作为凝胶形成步骤,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以100μm间距一滴接一滴地滴落到支持体材料上而形成10mm
×
20mm的水凝胶。然后,作为溶液堆叠步骤,将水凝胶放置到容纳第一溶液的盘中,并且用第一溶液浸渍。
[0239]
随后,作为凝胶堆叠体形成步骤,通过如下而以400μm间隔形成25个具有200μm宽度和20mm长度的线状图案水凝胶:由填充有含细胞的第二溶液的第二溶液排出头将液滴以50μm间距一滴接一滴地滴落到水凝胶上,由此形成第二层水凝胶。
[0240]
然后,作为重复步骤,在如上用第一溶液浸渍后,在控制排出位置的同时通过第二溶液排出头重复相同操作,使得形成第三层和第四层的水凝胶以最终完成由4层水凝胶构成的三维水凝胶。
[0241]
最终,将堆叠体转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0242]
<实施例6>
[0243]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。该实施例的基本程序与实施例5中的相同。然而,该实施例与实施例5的不同之处在于,在凝胶形成步骤和凝胶堆叠体形成后进行除去步骤以除去过多的反应溶液,由此减小水凝胶层的厚度。当堆叠体的层厚度减小并且水凝胶的间距减小时,水凝胶中细胞间的距离变短。结果,促进细胞间相互作用并且可更精确地再现活体中的结构。
[0244]
(1)进行除去步骤的凝胶形成步骤以及进行除去步骤的包括重复步骤的溶液堆叠步骤和凝胶堆叠体形成步骤
[0245]
作为凝胶形成步骤,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以100μm间距一滴接一滴地滴落到支持体上而形成10mm
×
20mm水凝胶。
[0246]
在所述形成后,作为除去步骤,将水凝胶缓缓地浸渍在填充有pbs(
‑
)的35mm盘中并且洗涤。然后,作为溶液堆叠步骤,将水凝胶放置在容纳第一溶液的盘中并且用第一溶液浸渍。
[0247]
随后,作为凝胶堆叠体形成步骤,通过如下而以400μm间隔形成25个具有200μm宽度和20mm长度的线状图案水凝胶:由填充有含细胞的第二溶液的第二溶液排出头将液滴以50μm间距一滴接一滴地滴落到水凝胶上,由此形成第二层水凝胶。
[0248]
作为重复步骤,在以和上面相同的方式进行除去步骤后并且在如上用第一溶液浸渍后,在控制排出位置的同时通过第二溶液排出头重复相同操作,使得形成第三层和第四层的水凝胶以最终完成由4层水凝胶构成的三维水凝胶。
[0249]
最终,在通过将堆叠体缓缓地浸渍在填充有pbs(
‑
)的35mm盘中进行除去步骤后,将其转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0250]
<实施例7>
[0251]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。该实施例的基本程序与实施例4中的相同。然而,该实施例与实施例5的不同之处在于,在凝胶形成步骤和凝胶堆叠体形成后实施平面形成步骤。
[0252]
(1)进行平面形成步骤的凝胶形成步骤以及进行平面形成步骤的包括重复步骤的溶液堆叠步骤和凝胶堆叠体形成步骤
[0253]
将含细胞的第二溶液和无细胞的第二溶液分别放置到第二溶液排出头的液体腔中。作为凝胶形成步骤,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以100μm间距一滴接一滴地滴落到支持体上而形成10 mm
×
20mm的水凝胶。接着,通过填充有无细胞的第二溶液的第二溶液排出头,将液滴类似地以100μm间距一滴接一滴地滴落到10mm
×
20mm的第一层水凝胶上以改善第一凝胶层的平坦性。然后,作为溶液堆叠步骤,将水凝胶放置到容纳第一溶液的盘中并且用第一溶液浸渍。
[0254]
随后,作为凝胶堆叠体形成步骤,通过如下而以400μm间隔形成25个具有200μm宽度和20mm长度的线状图案水凝胶:由填充有含细胞的第二溶液的第二溶液排出头将液滴以50μm间距一滴接一滴地滴落到水凝胶上,由此形成第二层水凝胶。
[0255]
作为重复步骤,在以和上面相同的方式进行平面形成步骤后,并且在以和上面相同的方式用第一溶液浸渍后,在调节第二溶液排出头的排出位置的同时重复相同操作,以形成第三层、第四层和后续层的水凝胶并且最终完成由10层水凝胶构成的三维水凝胶。
[0256]
最终,将堆叠体转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0257]
<实施例8>
[0258]
在该实施例中,使用本发明的细胞培养载体的制造方法制造在支持体上形成含细胞的点状水凝胶的细胞培养载体。该实施例的基本程序与实施例1中的相同地进行。然而,该实施例与实施例1的不同之处在于,溶液1和/或2不含细胞,并且进行细胞接种步骤。
[0259]
(1)细胞接种步骤
[0260]
向转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm盘的细胞培养载体,使用以与实施例2中相同的方式制备的nhdf细胞悬浮液接种20000个细胞,并且放置
在5体积%co2环境中的37℃培养箱(上述的)中。
[0261]
<实施例9>
[0262]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。基本程序与实施例5中的相同。然而,该实施例与实施例4的不同之处在于,各堆叠的水凝胶包含不同细胞类型,具体地在用于第二和第四层的凝胶堆叠体形成步骤中,使用的第二溶液包含人脐静脉内皮细胞(下文中称为“huvec”或“huvec细胞”)来代替第一层和第三层中包含的nhdf细胞。
[0263]
(1)huvec细胞的培养
[0264]
将huvec细胞在5体积%co2环境中的37℃培养箱(上述的)中使用内皮细胞基本培养介质(包含ebm
tm
‑
2basal medium(cc
‑
3156)、egmtm
‑
2singlequots
tm supplements(cc
‑
4176)的培养体系,由lonza生产)在100
‑
mm盘中培养72小时。
[0265]
(2)含huvec细胞的第二溶液的制备
[0266]
将以和nhdf细胞相同的方式获得的细胞悬浮液的一部分转移到埃彭道夫管并且离心(装置名称:minispin,由eppendorfag生产,2.5
×
103rpm,1分钟),并且然后使用移液管除去上清液。在除去后,加入huvec细胞的第二溶液以获得含huvec细胞的第二溶液,其由具有1
×
107细胞/ml的细胞浓度且包含四
‑
peg
‑
马来酰亚胺基的细胞悬浮液构成。
[0267]
(3)水凝胶形成和凝胶层叠
[0268]
将含nhdf细胞的第二溶液和含huvec细胞的第二溶液放置在图4中显示的溶液排出头的液体腔中。通过如下形成水凝胶:由填充有含nhdf细胞的第二溶液的第二溶液排出头1(0401)类似于实施例4形成第一和第三层,并且由填充有含huvec细胞的第二溶液的第二溶液排出头2(0402)类似于实施例4形成第二和第四层。最后,将水凝胶转移到容纳包含10质量%fbs和1质量%抗生素的dmem和内皮细胞基本培养介质各1ml的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0269]
<实施例10>
[0270]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。基本程序与实施例5中的相同。然而,该实施例与实施例5的不同之处在于,将图2中显示的溶液排出头的排出孔(0204)改变为小孔,使得滴落的液滴变小。
[0271]
(1)凝胶形成步骤以及包括重复步骤的溶液堆叠步骤和凝胶堆叠体形成步骤
[0272]
作为凝胶形成步骤,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以50μm间距一滴接一滴地滴落到支持体上而形成10mm
×
20mm水凝胶。然后,作为溶液堆叠步骤,将水凝胶放置到容纳第一溶液的盘中并且用第一溶液浸渍。
[0273]
随后,作为凝胶堆叠体形成步骤,通过如下而以400μm间隔形成25个具有200μm宽度和20mm长度的线状图案水凝胶:由填充有含细胞的第二溶液的第二溶液排出头将液滴以25μm间距一滴接一滴地滴落到水凝胶上,由此形成第二层水凝胶。
[0274]
然后,作为重复步骤,在如上用第一溶液浸渍后,在控制排出位置的同时通过第二溶液排出头重复相同操作,使得形成第三层和第四层水凝胶以最终完成由4层水凝胶构成的三维水凝胶。
[0275]
最终,将堆叠体转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm
盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0276]
<实施例11>
[0277]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。基本程序与实施例5中的相同。然而,该实施例的不同之处在于,向第一溶液和第二溶液加入纤维蛋白原作为细胞作用添加物。
[0278]
(1)含纤维蛋白原的第一溶液的制备
[0279]
通过如下制备包含2%四
‑
peg
‑
sh的第一溶液:将0.04g四
‑
peg
‑
sh(上述的)溶解在2ml pbs(
‑
)中,并且之后将溶液用平均孔径为0.2μm的过滤器(上述的)过滤。进一步地,将0.02g纤维蛋白原(产品名称:来自牛血浆的纤维蛋白原(fibrinogen),由sigma
‑
aldrich生产)加入到第一溶液,并且用微管旋转器(型号:mtr
‑
103,airis 1co.jp)使其溶解以制备包含1%纤维蛋白原的第一溶液。
[0280]
(2)用于nhdf细胞的含凝血酶的第二溶液的制备
[0281]
通过如下制备包含2%四
‑
peg
‑
马来酰亚胺基的第二溶液:将0.04g四
‑
peg
‑
马来酰亚胺基(上述的)在2ml pbs(
‑
)中溶解,并且之后将溶液用平均孔径为0.2μm的过滤器(上述的)过滤。进一步地,将凝血酶(产品名称:来自牛血浆的凝血酶,由sigma
‑
aldrich生产)用以上第二溶液稀释至20u/ml以制备含凝血酶的第二溶液。
[0282]
图17显示该实施例中制备的水凝胶中纤维蛋白的状态。纤维蛋白通过第一溶液中的纤维蛋白原和第二溶液中的凝血酶的反应而形成。尽管目标纤维蛋白通过所述两种溶液的接触而在水凝胶中形成,但纤维蛋白往往稍微不均匀地分布在上部中。
[0283]
<实施例12>
[0284]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。基本程序与实施例11中的相同。然而,与实施例11不同,将matrigel(型号:354234,由coming生产)作为细胞作用添加物加入到第一溶液和第二溶液至0.1质量%浓度。
[0285]
<实施例13>
[0286]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的点状水凝胶的细胞培养载体。基本程序与实施例11中的相同。然而,该实施例与实施例11在形成的水凝胶形状方面不同,使得形成线状水凝胶作为第一层,并且堆叠点状水凝胶作为第二层。
[0287]
(1)凝胶形成步骤以及溶液堆叠步骤和凝胶堆叠体形成步骤
[0288]
作为凝胶形成步骤,通过填充有含细胞的第二溶液的第二溶液排出头将液滴以50μm间距一滴接一滴地滴落到支持体上而以400μm间隔形成20个具有200μm宽度和20mm长度的线状水凝胶。然后,作为溶液堆叠步骤,将水凝胶放置到容纳第一溶液的盘中并且用第一溶液浸渍。
[0289]
随后,作为凝胶堆叠体形成步骤,在水凝胶中,通过如下形成30个点状水凝胶作为各线状点状水凝胶的第二层:由填充有含细胞的第二溶液的第二溶液排出头将液滴以300μm间距一滴接一滴地滴落到水凝胶中的各线状点状水凝胶上。
[0290]
最后,将堆叠体转移到容纳2ml包含10质量%fbs和1质量%抗生素的dmem的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0291]
<实施例14>
[0292]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的膜状水凝胶的细胞培养载体。基本程序与实施例9中的相同。然而,该实施例与实施例9的不同之处在于堆叠的水凝胶形状,并且所有的第一层至第四层均以膜状水凝胶堆叠。
[0293]
(1)水凝胶形成和凝胶层叠
[0294]
将含nhdf细胞的第二溶液和含huvec细胞的第二溶液放置在图4中显示的溶液排出头的液体腔中。通过如下在第一和第三层中形成尺寸为10 mm
×
20mm的水凝胶:由填充有含nhdf细胞的第二溶液的第二溶液排出头1(0401)将液滴以50μm间距一滴接一滴地滴落到支持体和水凝胶上。通过如下在第二和第四层中形成尺寸为10mm
×
20mm的水凝胶:由填充有含huvec细胞的第二溶液的第二溶液排出头2(0402)将液滴以50μm间距一滴接一滴地滴落到水凝胶上。最后,将堆叠体转移到容纳包含10质量%fbs和1质量%抗生素的dmem和内皮细胞基本培养介质各1ml的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0295]
在该实施例中,膜状水凝胶由第一层形成,并且因此未确认是否形成点状水凝胶。
[0296]
将nhdf细胞用绿色荧光染料(商品名称:cell tracker green,由thermo fisher scientific生产)染色,并且将huvec细胞用橙色荧光染料(商品名称:cell tracker orange,由thermo fisher scientific生产)染色,然后进行以上操作。在形成后一小时,用共聚焦显微镜fv10(上述的)观察水凝胶。观察结果呈现在图10中。
[0297]
<实施例15>
[0298]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。基本操作与实施例5中描述的基本操作相同。然而,在该实施例中,使用根据凝胶挤出方法的分配器来替代实施例5中描述的根据喷墨方法的液滴形成装置。
[0299]
<实施例16>
[0300]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。该实施例的基本程序与实施例7一致。然而,该实施例与实施例7的不同之处在于,使用nih/3t3细胞(clone5611,jcrb cell bank,下文中也称为
″
3t3
″
)作为细胞,未进行平面形成步骤,使层数高至10层或20层,并且使用培养介质(dmem)代替pbs以制备溶液。
[0301]
将奇数层中的细胞用绿色荧光染料(商品名称:cell tracker green,由thermo fisher scientific生产)染色,并且将偶数层中的细胞用橙色荧光染料(商品名称:cell tracker orange,由thermo fisher scientific生产)染色。制备后一小时,用共聚焦显微镜fv10(上述的)观察细胞培养载体。10层堆叠体的观察结果呈现在图11中,并且20层层叠体的观察结果呈现在图13中。
[0302]
(1)含凝血酶的第一溶液的制备
[0303]
通过如下制备包含2%四
‑
peg
‑
sh的第一溶液:将0.04g 四
‑
peg
‑
sh(上述的)溶解在2ml dmem中,并且之后将溶液用平均孔径为0.2μm的过滤器(上述的)过滤。进一步地,用以上第二溶液将凝血酶(产品名称:来自牛血浆的凝血酶,由sigma
‑
aldrich生产)稀释至
20u/ml,从而获得含凝血酶的第一溶液。
[0304]
(2)用于3t3细胞的含纤维蛋白原的第二溶液的制备
[0305]
通过如下制备1%纤维蛋白原溶液:将0.02g纤维蛋白原(产品名称:来自牛血浆的纤维蛋白原,由sigma
‑
aldrich生产)加入到1 ml dmem,并且用微管旋转器(型号:mtr
‑
103,airisl co.jp)使其溶解。然后,加入四
‑
peg
‑
马来酰亚胺基(上述的),并且将混合物轻轻搅拌并溶解,从而获得包含1%纤维蛋白原的第二溶液。
[0306]
图18显示该实施例中制备的水凝胶中纤维蛋白的状态。目标纤维蛋白通过所述两种溶液的接触而在水凝胶中形成。当使用dmem作为分散介质时,纤维蛋白均匀地分散,并且还获得高的细胞存活率。
[0307]
<实施例17>
[0308]
在该实施例中,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠含细胞的水凝胶的细胞培养载体。第一溶液和第二溶液的制备与实施例16一致,并且基本程序与实施例9一致。然而,在该实施例中,细胞培养载体的结构不同。具体地,第一和第三层为包含nhdf细胞的膜状水凝胶,并且第二层为线状水凝胶。对于第二层,进行细胞作用凝胶形成步骤以在包含nhdf细胞的线状水凝胶之间形成包含huvec细胞的纤维蛋白凝胶的线状凝胶。制备后一小时,用共聚焦显微镜fv10(上述的)观察细胞培养载体。观察结果呈现在图12中。
[0309]
(1)用于含huvec细胞的细胞作用凝胶的溶液的制备
[0310]
通过将2ml pbs(
‑
)和0.02g纤维蛋白原加入到第一溶液,并且用微管旋转器使混合物溶解而制备1%纤维蛋白原溶液。
[0311]
(2)用于含huvec细胞的细胞作用凝胶的溶液的制造
[0312]
将以和nhdf细胞相同的方式获得的细胞悬浮液的一部分转移到埃彭道夫管并离心。然后,使用移液管除去上清液。在除去后,加入上述的1%纤维蛋白原溶液以产生由具有3
×
106细胞/ml细胞浓度的细胞悬浮液组成的用于含huvec细胞的细胞作用凝胶的溶液。
[0313]
(3)水凝胶形成、细胞作用凝胶形成和凝胶层叠
[0314]
将溶液排出头的液体腔分别用含nhdf细胞的第二溶液和用于细胞作用凝胶的含huvec细胞的溶液填充。用填充有含nhdf细胞的第二溶液的第二溶液排出头形成与实施例4中的类似的第一层。然后,作为溶液堆叠步骤,将水凝胶置于容纳第一溶液的盘中并且用第一溶液浸渍。
[0315]
随后,作为凝胶堆叠体形成步骤,通过如下形成第二层水凝胶构建体:由填充有含细胞的第二溶液的第二溶液排出头将液滴以90μm间距一滴接一滴地滴落到水凝胶上而以400μm间隔形成25个具有200μm宽度和20mm长度的线状图案水凝胶构建体。进一步地,通过如下形成第二层:由填充有用于细胞作用凝胶的含huvec细胞的溶液的溶液排出头将液滴以90μμm间距一滴接一滴地滴落在以上的第二层的线状
‑
图案化水凝胶构建体之间而形成具有宽度为200μm且长度为20mm的线状图案的细胞作用凝胶。第三层以与第一层相同的方式形成,并且最终将堆叠体转移到容纳包含10质量%fbs和1质量%抗生素的dmem以及内皮细胞基本培养介质各1ml的35mm盘,并且放置在5体积%co2环境中的37℃培养箱(上述的)中。
[0316]
<实施例18>
[0317]
在该实施例中,如实施例16中那样,使用本发明的细胞培养载体的制造方法制造其中在支持体上堆叠10层含细胞的水凝胶的细胞培养载体。该实施例的基本程序与实施例16一致。然而,该实施例与实施例16的不同之处在于,作为细胞,使用hepg2细胞(jcrb cell bank,下文中也称为“hepg2”)来替代3t3细胞。
[0318]
甚至在该不同种类的hepg2细胞的情况下,也与实施例16中一样获得高细胞存活率。
[0319]
<对比例1>
[0320]
基本程序以和实施例2中相同的方式实施。然而,对比例1与实施例2的不同之处在于:第一溶液和第二溶液是用以下材料而不是包含聚乙二醇作为主链的多支链聚合物制备的,并且形成海藻酸盐凝胶而不是四
‑
peg凝胶。
[0321]
(1)第一溶液的制备
[0322]
在将0.584g氯化钙(型号:192
‑
13925,由wako pure chemical industries,ltd.生产)(下文中称为
″
cacl2″
)溶解在100ml超纯水中后,将溶液用平均孔径为0.2μm的过滤器(上述的)过滤以制备由100mmol/l cacl2水溶液组成的第一溶液。
[0323]
(2)第二溶液的制备
[0324]
在将20mg海藻酸钠(商品名称:kimica algin skat
‑
one,由kimica corporation生产)溶解在2ml超纯水中后,将溶液用平均孔径为0.2μm的过滤器(上述的)过滤以制备具有1.0%浓度的海藻酸钠水溶液。
[0325]
<对比例2>
[0326]
基本程序以与实施例2和对比例1中相同的方式实施。然而,对比例2与实施例2的不同之处在于:第一溶液和第二溶液是用以下材料而不是包含聚乙二醇作为主链的多支链聚合物制备的,并且形成纤维蛋白凝胶而不是四
‑
peg凝胶。
[0327]
(1)第一溶液的制备
[0328]
通过如下制备1%含纤维蛋白原的第一溶液:将0.02g纤维蛋白原(产品名称:来自牛血浆的纤维蛋白原,由sigma
‑
aldrich生产)加入到1.98ml pbs(
‑
)并且用微管旋转器(型号:mtr
‑
103,airisl co.jp)溶解。
[0329]
(2)第二溶液的制备
[0330]
通过如下制备含凝血酶的第二溶液:用2ml pbs(
‑
)将凝血酶(产品名称:来自牛血浆的凝血酶,由sigma
‑
aldrich生产)稀释到20u/ml。
[0331]
<参考例1>
[0332]
基本操作与实施例5中描述的方法一致。在参考例1中,程序是手动地进行的,而不是基于喷墨方法的液滴形成装置。
[0333]
(结果)
[0334]
<<评价方法>>
[0335]
由实施例和对比例的方法形成的水凝胶通过下述方法评价,并且结果总结在表1
‑
1和表1
‑
2(本文中,表1
‑
1和表1
‑
2经常统称为
″
表1
″
)中。
[0336]
[0337][0338]
在表中,ij表示喷墨。
[0339]
(形状保持)
[0340]
在水凝胶制造过程中,当最后的反应溶液液滴降落并且水凝胶产生时,将水凝胶立即转移到35mm盘,并且向其中缓缓地加入包含10质量%fbs和1质量%抗生素的dmem。将所述盘放置在5体积%co2环境中的37℃培养箱中,并且水凝胶的直径和厚度使用显微镜(ckx41,由olympus corporation生产)在培养箱中放置后立即和在培养箱中放置后3天测量。当发现水凝胶的直径和厚度小于在培养箱中放置后立即的值的75%时评级为“差”,并且当其不小于75%时将其评级为“好”。在具有点状水凝胶的线状连续体(线状水凝胶)的情形中,评价类似地基于线宽和厚度进行。在膜状连续体(膜状水凝胶)的情形中,评价基于膜的厚度进行。结果在表1中作为
″
形状保持率
″
呈现。
[0341]
(平面放置:点状、线状、膜状)
[0342]
在实施例和对比例中,在水凝胶的制备后,将培养介质以与以上形状保持中相同的方式加入,将混合物在37℃在5体积%co2的环境中培养,并且在培养后1小时将水凝胶用共聚焦显微镜(fv10,由olympus corporation生产)观察。检查点状水凝胶是否以规定的间距放置,或是否形成线状水凝或膜状(无边界)水凝胶。在后续的评价方法中使用相同的观察方法。上述的
″
间距
″
意指相邻的点状水凝胶间中心对中心的距离。
[0343]
作为评价标准,当点状水凝胶以400μm的间距放置时,将其评级为好,否则将其评级为差。线状水凝胶在确认点状水凝胶为连续的时评级为好,并且当确认并非如此时评级为差。对于膜,当确认点状水凝胶在x
‑
y平面中在10mm
×
10mm区域内连续时将其评级为好,并且当确认并非如此时将其评级为差。结果呈现在表1中。在表中,
″
点
″
表示点状水凝胶,
″
线
″
指示线状水凝胶,和
″
无边界
″
指示膜状水凝胶。
[0344]
(堆叠(层叠))
[0345]
在实施例和对比例中,在水凝胶的制备后,将培养介质以与以上形状保持中相同的方式加入、将混合物在37℃在5体积%co2的环境中培养并且在1小时后将水凝胶用共聚焦显微镜(fv10,由olympus corporation生产)观察。检查点状水凝胶、线状水凝胶或膜状水凝胶是否在满足表2中指定的厚度和叠层数的情况下形成。表2中的叠层数意指所形成的层数。
[0346]
作为评价标准,当层以等于或小于表2中所列的值的厚度(间距)放置或叠层数等于或大于表2中所列的值时,将其评级为好或非常好,否则将其评级为差。结果在表1中作为
″
层叠
″
呈现。
[0347]
[表2]
[0348]
层叠厚度叠层数好200μm2非常好50μm10
[0349]
(存活率)
[0350]
‑
存活率评价液体的制备
[0351]
存活率评价液体通过将30μl pi(p1304mp,由thermo fisher scientific生产)和12μl hoechst 33342(h3570,由thermo fisher scientific生产)加入到60ml与各样品对应的培养介质而制备。
[0352]
‑
细胞观察
[0353]
在制备水凝胶后,将培养介质以和形状保持相同的方式加入,并且在37℃在5体
积%co2的环境中进行培养。培养后三天将3.5cm
‑
盘中的3ml培养介质更换为存活率评价液体,并且在5体积%co2环境中的37℃培养箱(上述的)中再次进行培养1小时。水凝胶中的细胞在培养后1小时用共聚焦显微镜观察,并且获得其三维图像。
[0354]
‑
存活率计算
[0355]
基于三维图像,将用pi染色的细胞视为死细胞,并且用hoechst33342染色的细胞视为总细胞,并且存活率(%)通过(总细胞数目
‑
死细胞数目)
×
100/(总细胞数目)而计算。关于3t3细胞的结果呈现在表3
‑
1中并且关于hepg2的结果呈现在表3
‑
2中。
[0356]
在水凝胶培养后4天的细胞存活率为60%或更大的情形中,将其评级为好;在其为80%或更大的情形中,将其评级为非常好;和在其为60%或更少的情形中,将其评级为差。结果在表1中作为“存活率
″
呈现。
[0357]
(长期存活率)
[0358]
‑
细胞观察
[0359]
在制备水凝胶后,将培养介质以与以上形状保持相同的方式加入,并且培养在37℃在5体积%co2的环境中进行。在7天后,将3.5cm
‑
盘中的3ml培养介质更换为3ml存活率评价液体,并且培养在5体积%co2环境中的37℃培养箱(上述的)中再次进行1小时。水凝胶中的细胞在培养后1小时用共聚焦显微镜观察,并且获得其三维图像。
[0360]
‑
存活率计算
[0361]
基于三维图像,将用pi染色的细胞视为死细胞,并且将用hoechst 33342染色的细胞视为总细胞,并且存活率(%)通过(总细胞数目
‑
死细胞数目)
×
100/(总细胞数目)计算。关于3t3细胞的结果呈现在表3
‑
1中并且关于hepg2的结果呈现在表3
‑
2中。
[0362]
在制备水凝胶后,加入培养介质并且在37℃在5体积%co2的环境中培养7天。在细胞存活率为50%或更大的情形中,将其评级为好;在其为80%或更大的情形中,将其评级为非常好;和在其为50%或更少的情形中,将其评级为差。结果在表1中作为“长期存活率
″
呈现。
[0363]
[表3
‑
1]
[0364][0365]
[表3
‑
2]
[0366][0367]
(形态)
[0368]
在就向其中加入细胞作用添加物的水凝胶而言的实施例和对比例中,在最后的反应溶液液滴降落并且产生水凝胶后,培养介质以与以上形状保持中相同的方式加入,然后将混合物在37℃在5体积%co2的环境中培养。7天后,通过细胞延伸与否来评价水凝胶中的
细胞形态。
[0369]
‑
形态观察溶液的制备
[0370]
形态观察的评价液体通过将12μlcalcein am(型号:l3224,由thermo fisher scientific生产)加入到60ml与各样品对应的培养介质而制备,
[0371]
‑
细胞观察
[0372]
在以上存活率的评价后,将3.5cm盘中的3ml存活率评价液体更换为3ml以上的形态观察评价液体并且培养在5体积%co2环境中的37℃培养箱(上述的)中再次进行1小时。水凝胶中的细胞形态用共聚焦显微镜在培养后1小时观察。
[0373]
从细胞形态来看,若细胞延伸,则将其评级为好,并且若它们未延伸,则将其评级为差。细胞延伸与否通过细胞伪足是否可识别来判断。结果在表1中作为“形态
″
呈现。
[0374]
(渗透性)
[0375]
与各实施例对应的制备实施例的水凝胶的物质渗透性通过下述方法评价。与各制备实施例对应的实施例以及结果总结在表4中。
[0376]
[表4]
[0377][0378]
‑
渗透性的评价凝胶的制备
[0379]
在该评价中,在对应于24
‑
孔板(falcon:353047)的插件(falcon:353097)中放置的厚度为1mm的水凝胶的渗透性通过渗透的荧光溶液体积来评价。对于染色溶液,将通过将500kda荧光蛋白质:dextran fluorescein anionic(invitrogen;d1823)溶解在2ml pbs(
‑
)中制备的原液用各种分散介质之一稀释至1%并且使用。
[0380]
‑
渗透性评价
[0381]
将以上荧光溶液放置在插件中的凝胶上,并且然后将24
‑
孔板用相同的作为荧光溶液的分散介质填充,并且在培养箱中在37℃静置。之后,将插件取出,并且将24
‑
孔板中的溶液以4孔50μl等分到用于荧光测量的96
‑
孔板(corning;3694)。其荧光强度用孔板读取器(biotek instruments;cytation5)测量。测量结果由渗透物质以摩尔浓度nm(nmol/m3)计的量表示。在该值为0.5nm或更大的情形中,将渗透性评级为好;并且在无法测量的情形中,将其评级为差。结果总结在表4中。
[0382]
(物质渗透量的时间依赖性变化)
[0383]
在该评价中,使用24
‑
孔板和对应于24
‑
孔板的插件。插件的孔尺寸为8μm。将插件设置在24
‑
孔板的孔中以制备插件上的凝胶。对于凝胶,采用使用dmem作为分散介质的包括纤维蛋白作为细胞作用添加物的peg凝胶(其具有与实施例16、17和18中使用的凝胶相同的
品质,并且不包含细胞)。体积由插件的底面积确定,并且将凝胶厚度调整在1至4mm范围内。在制备凝胶后,将0.3ml荧光溶液放置在凝胶上。对于荧光溶液,将通过将500kda dextran fluorescein anionic溶解在2ml pbs(
‑
)中而制备的原液用dmem稀释至1%并且使用。在放置荧光溶液后,将1ml无血清介质放置在24
‑
孔板中。在培养箱中在37℃分别静置2、5和24小时后使用小心到不使荧光溶液溅出到凝胶上的方式将插件从24
‑
孔板中取出,并且使用孔板读取器测量孔中的培养介质的荧光强度。物质渗透量使用由已知的物质量和测量的荧光强度获得的校准曲线的系数确定。
[0384]
水凝胶的蛋白质渗透的时间依赖性结果在图19中呈现。在经过2小时后,渗透量为约0.95nm,其比0.5nm高得多。物质渗透量随时间流逝而增大。
[0385]
<<评价>>
[0386]
从实施例1至18的结果可明晰可对于四
‑
peg凝胶保持凝胶形状,而从对比例1的关于海藻酸盐凝胶的结果来看,凝胶的形状保持由于水凝胶的脱离或坍塌而是困难的。
[0387]
此外,从实施例1至14的结果可明晰在四
‑
peg凝胶的情形中形成点状水凝胶是可行的,但在纤维蛋白凝胶的情形中点状水凝胶由于凝胶化缓慢而未能形成。
[0388]
图9显示实施例3中的两层结构水凝胶的荧光染色的图像的透视图。关于该图中显示的水凝胶,膜状水凝胶在第一层中形成,并且在其上堆叠点状水凝胶作为第二层。从(a)中可知,(b)中显示的第二层中的点状水凝胶堆叠在(c)中显示的第一层中的膜状水凝胶上。由该结果可明晰,含细胞的点状水凝胶可最起码以400μm的间距形成。
[0389]
图10显示实施例14中通过堆叠四个层制备的水凝胶的荧光染色的图像的横截面视图。由图10确认,含细胞的水凝胶只要厚度为至少60μm就可堆叠。
[0390]
图14为其中在第一和第二层中形成并且堆叠四
‑
peg凝胶的示意图。当可保持形状的点状水凝胶可如在本发明中那样形成时,可形成如在图14中显示的微小的点状或细的线状水凝胶。因此,用于细胞培养的水凝胶可以高分辨率形成和堆叠为期望的形状。也就是说,以高精度三维地放置细胞变得可能,并且活体中的结构可更精确地再现。
[0391]
同时,图15为其中在第一层中堆叠四
‑
peg凝胶并且在第二层中堆叠海藻酸盐凝胶或纤维蛋白凝胶的情形的示意图。在对比例1的海藻酸盐凝胶的情形中,凝胶形状无法保持并且形状坍塌。进一步地,在对比例2的纤维蛋白凝胶的情形中,由于凝胶化时间长且凝胶无法以任选形状形成和堆叠,因此不可能形成高分辨率的水凝胶。
[0392]
由实施例6和实施例7的结果确认,通过实施除去步骤或平面形成步骤可以小间距堆叠水凝胶。进一步地,由实施例9确认,即使当使用具有小排出孔的喷头时以小间距层叠也是可行的。当如实施例6、7和9中那样在厚度方向上以小间距层叠可行时,用于细胞培养的水凝胶可以高分辨率堆叠,并且活体中的结构可更精确地再现。进一步地,由实施例7确认,当实施平面形成步骤时,可堆叠10层,并且四
‑
peg凝胶的形状保持效果高。
[0393]
由实施例8确认,不仅当将细胞在第二容器中混合时而且当将细胞接种时,细胞均是活的。
[0394]
由实施例9确认,可堆叠多种细胞。
[0395]
由实施例11、12和13确认,细胞通过加入细胞作用添加物而延伸。
[0396]
从实施例15和参考例1的结果来看,用凝胶挤出方法的分配器或通过手动技术难以使点状水凝胶成形,并且不能连续地放置点状水凝胶。因此,不可能形成其中点状水凝胶
彼此接触的任选结构。
[0397]
由实施例16和实施例18的结果确认,在其中堆叠有10层或20层的含细胞的膜状水凝胶的细胞培养载体中三维放置的各凝胶层中没有无序,并且其形状得以保持。进一步地,如下变得明晰:通过使用用于形成水凝胶的第一和/或第二溶液的分散介质作为细胞培养介质,使水凝胶中存在的细胞作用添加物均匀地分散,并且当水凝胶包含细胞时细胞存活率也增大。
[0398]
由实施例1至18的结果明晰,在四
‑
peg凝胶或纤维蛋白凝胶中,凝胶渗透性为好的,而从对比例1的结果来看,在海藻酸盐凝胶中,凝胶渗透性为差的,其因此作为细胞培养载体是不利的。
[0399]
由呈现物质渗透量的时间依赖性变化的图19的结果变明晰的是:本发明的水凝胶作为细胞培养载体具有有利的物质渗透性,并且即使当用培养介质等培养细胞时也不抑制营养素组分等的递送。
[0400]
本发明的有益效果
[0401]
根据本发明,可获得包含水凝胶的细胞培养载体,其中细胞培养载体包括具有任选的直径和厚度的点状水凝胶,并且呈现75%或更大的从水凝胶形成起经过3天后的形状保持率。
[0402]
根据本发明,可获得如下的细胞培养载体:其包括包含具有聚乙二醇作为主链的多支链聚合物的水凝胶,并且呈现75%或更大的在从水凝胶形成起经过3天后的形状保持率。
[0403]
如从以上结果显然的是,根据本发明如下变得可能:提供具有高形状保持率的细胞培养载体的制造方法、这样的细胞培养载体和细胞培养载体的制造装置,它们是通过常规三维组织模型构建技术无法达成的。另外,由于可确立包括细胞存活率、分辨率、细胞密度和细胞种控制在内的要素,能够提供可以高精度三维地放置含细胞凝胶、容许细胞在凝胶中存活和确保高再现性的细胞培养载体的制造方法以及细胞培养载体和细胞培养载体的制造装置。
[0404]
本文中引用的所有公开文本、专利和专利申请应该通过引用直接并入本文中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

