1.本技术涉及一种重组菌株及制备方法与应用,属于基因工程技术领域。
背景技术:
2.目前靛蓝生产包括天然提取、化学合成、微生物合成等。利用大肠杆菌、酵母菌、枯草芽孢杆菌等合成靛蓝色素是该领域的重要研究方向,然而目前仍需依托质粒系统,且产量不稳定。不仅如此,为提高靛蓝发酵产量,完善发酵条件,目前多采用发酵罐分批发酵,但分批发酵存在营养物质、底物浓度不够导致菌种死亡,最终导致靛蓝生产不稳定不持续的情况。
技术实现要素:
3.根据本技术的一个方面,提供一种重组菌株,所述重组菌株的基因组上整合有苯乙烯单加氧酶基因stya和苯乙烯单加氧酶基因styb,具有良好的稳定性,和较高的靛蓝色素的产量。
4.一种重组菌株,所述重组菌株为在宿主的基因组上整合有片段i;
5.所述片段i含有苯乙烯单加氧酶基因stya和苯乙烯单加氧酶基因styb。
6.可选地,所述苯乙烯单加氧酶基因stya位于所述苯乙烯单加氧酶基因styb的上游。
7.可选地,所述宿主选自大肠杆菌中的任一种;
8.可选地,所述大肠杆菌为e.coli dh5α。
9.可选地,所述整合为利用片段i替换宿主整合位点的核苷酸序列;
10.可选地,所述整合位点选自trpr、trpb、hisd中的任一种。
11.可选地,所述苯乙烯单加氧酶基因stya的编码序列如seq id no.1所示;
12.所述苯乙烯单加氧酶基因styb的编码序列如seq id no.2所示;
13.可选地,所述片段i还含有诱导型启动子、操纵子;
14.按照诱导型启动子、操纵子、苯乙烯单加氧酶基因stya、苯乙烯单加氧酶基因styb依次排列;
15.可选地,所述诱导型启动子为诱导型启动子cat;
16.所述操纵子为乳糖操纵子lac。
17.根据本技术的另一个方面,提供上述任一项所述的重组菌株的制备方法,所述制备方法包括以下步骤:
18.将片段i整合到宿主的基因组上,得到所述重组菌株。
19.可选地,所述制备方法包括以下步骤:
20.(s1)以含有片段ii的重组载体为模板,扩增片段ii;
21.(s2)将片段ii转入表达有重组酶的宿主感受态细胞,得到所述重组菌株;
22.所述片段ii依次含有整合位点左同源臂’、片段i、整合位点右同源臂’;
23.优选地,所述整合位点左同源臂’的核苷酸序列如seq id no.3所示的第173~358位碱基、核苷seq id no.5所示的第104~353位碱基或seq id no.7所示的第164~346位碱基所示;
24.所述整合位点右同源臂’的核苷酸序列如seq id no.4所示的第1~337位碱基、seq id no.6所示的第1~311位碱基或seq id no.8所示的第1~180位碱基所示;
25.可选地,所述重组载体的骨架载体为phs
‑
avc
‑
lw;
26.可选地,所述片段ii依次含有整合位点左同源臂’、抗性基因、片段i、整合位点右同源臂’;
27.所述步骤(2)为将片段ii转入表达有重组酶的宿主感受态细胞,敲除抗性基因,得到所述重组菌株;
28.可选地,所述抗性基因选自氯霉素抗性基因、卡那霉素抗性基因中的至少一种;
29.可选地,所述表达有重组酶的宿主感受态细胞通过以下步骤得到:
30.将pkd46质粒转入宿主细胞,在含l
‑
阿拉伯糖培养基中培养得到所述表达有重组酶的宿主感受态细胞。
31.根据本技术的另一个方面,提供一种生产靛蓝色素的方法,所述方法包括以下步骤:
32.将重组菌株在培养基中发酵,得到所述靛蓝色素;
33.所述重组菌株包括上述任一项所述的重组菌株、根据上述任一项所述的制备方法制备得到的重组菌株中的至少一种。
34.可选地,所述培养基含有发酵底物,所述发酵底物包括吲哚、色氨酸中的至少一种;
35.可选地,所述吲哚的浓度为0.5~5g/l;
36.所述色氨酸的浓度为0.5~10g/l。
37.可选地,所述吲哚的浓度为0.5~3g/l;
38.所述色氨酸的浓度为0.5~3g/l。
39.可选地,所述吲哚的浓度为1~2g/l;
40.所述色氨酸的浓度为1~2g/l。
41.可选地,所述发酵的条件包括:
42.温度为30~40℃;
43.转数为50~400rpm;
44.优选地,所述发酵的条件还包括:
45.通气比0.2~1.0vvm;
46.ph值为6.0~8.0;
47.溶氧矫正为80%~100%。
48.在发酵液中补充底物溶液;
49.所述底物溶液的浓度为0~8g/l;
50.所述发酵液与所述底物溶液的体积比为1l:20~160ml。
51.可选地,所述补充底物溶液的间隔时间为4~20h。
52.可选地,所述补充底物溶液的流速为1~5ml/min。
53.可选地,所述补充底物溶液的次数为1~4次。
54.可选地,所述底物溶液的浓度上限选自1、2、3、4、5、6、7、8g/l,下限选自0、1、2、3、4、5、6、7g/l。
55.可选地,所述发酵液与所述底物溶液的体积比上限选自1l:20ml、1l:40ml、1l:80ml、1l:100ml、1l:120ml;下限选自1l:40ml、1l:80ml、1l:100ml、1l:120ml、1l:160ml。
56.作为一种实施方案,为解决上述问题,本技术对靛蓝色素合成相关基因styab在大肠杆菌中的染色体表达进行探究,旨在通过对基因的染色体表达提高靛蓝色素的产量,并以染色体为载体稳定地实现靛蓝色素的合成。利用同源重组的方法将靛蓝色素合成基因styab整合到大肠杆菌染色体中,选取trpr、trpb、hisd三个不同的染色体整合位点左右两端基因作为同源左臂和右臂,以诱导型cat lac启动子及乳糖操纵子进行目的基因片段整合,对三种不同位点的工程菌进行比较筛选,将目的基因整合到用于重组的骨架载体质粒当中保存,得到phs
‑
avc
‑
01、phs
‑
avc
‑
02,phs
‑
avc
‑
03,再获得目的打靶片段,用温敏型质粒pkd46制备电转e.coli dh5α感受态后,电转打靶片段,将左右同源臂整合到e.coli dh5α中,最后利用抗性平板筛选并挑取阳性单克隆,菌落pcr验证得到正确工程菌,得到整合型工程菌后,用发酵罐发酵产出靛蓝。
57.同时,在对靛蓝色素合成工程菌的优化过程中发现,长时间发酵会导致菌种不再生长,在用分批发酵时发酵至32h靛蓝产量便不再增加,此时考虑是发酵培养基营养成分不足导致菌种失活或质粒丢失的情况,针对营养成分不足进行分批补料发酵。该工作对后续天然靛蓝色素生物合成基因的染色体表达进一步研究提供了理论依据和技术指导。
58.本技术能产生的有益效果包括:
59.(1)本技术所提供的重组菌株的基因组上整合有苯乙烯单加氧酶基因stya和苯乙烯单加氧酶基因styb,可以提高重组菌株的稳定性,以及提高靛蓝色素的产量。
60.(2)本技术所提供的重组菌株,在染色体的特定位点整合有苯乙烯单加氧酶基因stya和苯乙烯单加氧酶基因styb,生物活性更好。
61.(3)本技术所提供的靛蓝色素,通过底物的选择、加料条件的控制等,有利于提高靛蓝色素的产量。
附图说明
62.图1是整合重组质粒phs
‑
avc
‑
01(a)、phs
‑
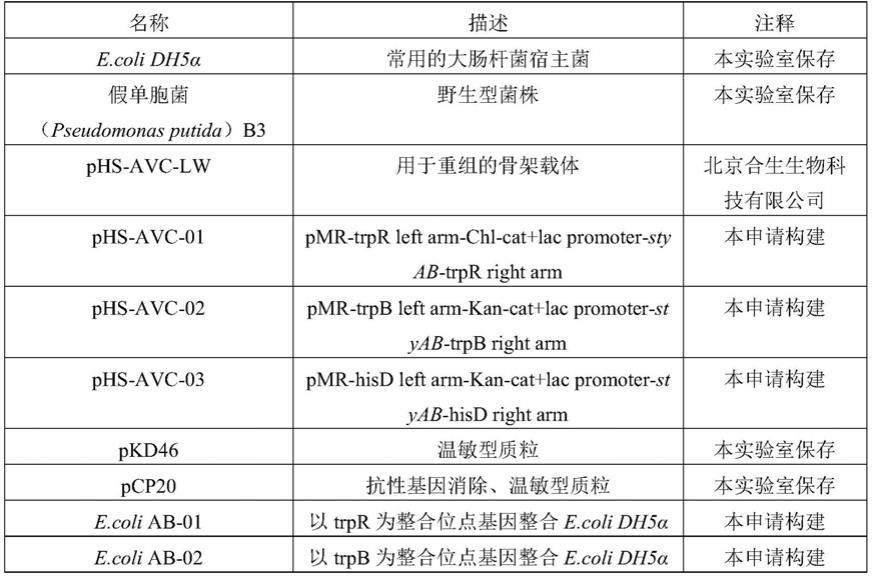
avc
‑
02(b)、phs
‑
avc
‑
03(c)构建图;
63.图2是整合重组质粒phs
‑
avc
‑
01及酶切验证电泳图;
64.图3是整合重组质粒phs
‑
avc
‑
02及酶切验证电泳图;
65.图4是整合重组质粒phs
‑
avc
‑
03及酶切验证电泳图;
66.图5是整合重组质粒phs
‑
avc
‑
01(a)、phs
‑
avc
‑
02(b)、phs
‑
avc
‑
03(c)的菌落pcr电泳图;
67.图6是phs
‑
avc
‑
01(a)、phs
‑
avc
‑
02(b)、phs
‑
avc
‑
03(c)整合序列与测序对比图谱;其中,图中left arm为同源左臂、right arm为同源右臂、promoter为启动子,repeat region为重复区域;
68.图7是phs
‑
avc
‑
01打靶片段电泳图;
69.图8是phs
‑
avc
‑
02、phs
‑
avc
‑
03打靶片段电泳图;
70.图9是工程菌e.coli ab
‑
01菌落pcr鉴定图;
71.图10是工程菌e.coli ab
‑
02、e.coli ab
‑
03菌落pcr鉴定图;
72.图11是工程菌的生长曲线测定图;
73.图12是以色氨酸为底物,在不同发酵时间时,工程菌e.coli ab
‑
01和e.coli ab
‑
02的stya和styb基因表达量;
74.图13是以吲哚为底物,在不同发酵时间时,工程菌e.coli ab
‑
01和e.coli ab
‑
02的stya和styb基因表达量;
75.图14是补料浓度对工程菌发酵产靛蓝色素的影响;
76.图15是补料次数对工程菌发酵产靛蓝色素的影响;
77.图16是补料间隔时间对工程菌发酵产靛蓝色素的影响;
78.图17是补料流速对工程菌发酵产靛蓝色素的影响;
79.图18是传代次数对不同类型工程菌稳定性的影响。
具体实施方式
80.下面结合实施例详述本技术,但本技术并不局限于这些实施例。
81.如无特别说明,本技术的实施例中的原料均通过商业途径购买。
82.其中:
83.(1)材料与试剂
84.靛蓝色素标准品购自美国sigma
‑
aldrich公司,色氨酸、吲哚、卡那霉素、氯霉素、氢氧化钠、n,n
‑
二甲基甲酰胺、十二水和磷酸氢二钠、磷酸二氢钾、氯化铵、氯化钠、硫酸镁、酵母浸粉、酵母提取物、胰蛋白胨、大豆蛋白胨、卡那霉素等均购自半夏生物科技有限公司;primestar hs(premix)、10000dl dna marker,购自宝生物工程(大连)有限公司;离心柱型超纯总rna快速提取试剂盒、fastking rt kit(with gdnase)反转录试剂盒、superreal premix plus(sybr green)试剂盒、高纯质粒小量制备试剂盒、多功能dna纯化回收试剂盒等,购自北京天根生化科技有限公司。
85.(2)仪器与设备
86.c1000 touch pcr仪、powerpac basic电泳仪(配有水平电泳槽)、cfx96 touch荧光定量pcr检测系统,美国bio
‑
rad公司;3k15高速离心机美国,美国sigma公司;spx
‑
150b生化培养箱,上海博讯医疗生物仪器股份有限公司;biospectrum凝胶成像仪,美国uvp公司;小型高速离心机,美国sigma公司;涡旋振荡器,德国ika公司;电子天平(0.01g),上海蒲春计量仪器有限公司;连续波长多功能酶标仪spectramax 13,美国molecular devices;恒温摇床,上海博讯医疗生物仪器股份有限公司;10联1l小型发酵罐,上海百伦生物有限公司。
87.(3)所用的菌种和质粒以及构建的菌种和质粒
88.所用的菌种和质粒以及构建的菌种和质粒如表1所示
89.表1菌种及质粒
[0090][0091]
需要说明的是:
[0092]
本技术实施例中以本实验是保存的野生型菌株假单胞菌(pseudomonas putida)b3作为靛蓝色素合成相关基因(苯乙烯单加氧酶基因)styab,但实施本技术所提供的方案,并不是非要用该菌株才可以实现,而是,只要是携带有靛蓝色素合成相关基因stya和styb基因的假单胞菌均可以作为靛蓝色素合成相关基因stya和styb的来源用于本技术,例如,公开号为cn105802986a的专利申请中所公开的保藏编号为cgmccno.12202的菌株可以用于本技术;或者是根据本技术所公开的靛蓝色素合成相关基因styab的核苷酸序列,利用现有的方法合成靛蓝色素合成相关基因styab,也可以用于本技术。
[0093]
e.coli dh5α、phs
‑
avc
‑
lw、pkd46、pcp20可通过商业途径购买。
[0094]
本技术所公开的重组载体phs
‑
avc
‑
01、phs
‑
avc
‑
02、phs
‑
avc
‑
03、重组菌株e.coli ab
‑
01、e.coli ab
‑
02,均可以通过重复本技术所公开的方法而获得。
[0095]
(4)培养基
[0096]
培养基按照下列方法配制:
[0097]
lb液体培养基(g/l):酵母提取物5.0,胰蛋白胨10.0,naci 10.0,ph 7.0,121.0℃高温灭菌15.0min。
[0098]
lb固体培养基(g/l):酵母提取物5.0,胰蛋白胨10.0,naci 10.0,琼脂15.0,ph 7.0,121.0℃高温灭菌15.0min。
[0099]
色氨酸发酵培养基(g/l):na2hpo4·
12h2o 17.0,kh2po
4 3.0,nh4cl 1.0,nacl 0.5,mgso
4 0.1,酵母浸粉3.0,底物色氨酸1.6,乳糖3.0 121.0℃高温灭菌15.0min。
[0100]
吲哚发酵培养基(g/l):na2hpo4·
12h2o 17.0,kh2po
4 3.0,nh4cl 1.0,nacl 0.5,mgso
4 0.1,酵母浸粉3.0,大豆蛋白胨3.0,底物吲哚1.6,121.0℃高温灭菌15.0min。
[0101]
抗生素配制:
[0102]
卡那霉素(kan):配制贮存液浓度为10.0mg/ml,使用浓度50.0μg/ml的卡那霉素,
在4℃下保存备用。
[0103]
氯霉素(chl):配制贮存液浓度为10.0mg/ml,使用浓度100.0μg/ml的卡那霉素,在4℃下保存备用。
[0104]
氨苄青霉素(amp):配制贮存液浓度为10.0mg/ml,使用浓度50.0μg/ml的卡那霉素,在4℃下保存备用。
[0105]
本技术中的接种量,指的是种子液的体积和发酵液的体积(即,种子液和培养基的总体积)的比,例如,1.2%的接种量指的是种子液的体积为1.2,发酵液的体积(即,种子液和培养基的总体积)为100。
[0106]
本技术中,styab指的是苯乙烯单加氧酶基因stya和苯乙烯单加氧酶基因styb顺着表达方向,按照苯乙烯单加氧酶基因stya、苯乙烯单加氧酶基因styb的顺序连接在一起。
[0107]
实施例1重组载体的构建
[0108]
1.1引物设计
[0109]
本技术的部分引物如表2所示。
[0110]
表2引物列表
[0111][0112][0113]
1.2 pcr扩增同源臂、靛蓝色素合成相关基因stya和styb
[0114]
以e.coli dh5αtrpr为整合位点扩增左臂和右臂,左臂大小为358bp(序列如seq id no.3所示),右臂大小为357bp(序列如seq id no.4所示);以e.coli dh5αtrpb为整合位点扩增左臂和右臂,左臂大小为353bp(序列如seq id no.5所示),右臂大小为351bp(序列
如seq id no.6所示);以e.coli dh5αhisd为整合位点扩增左臂和右臂,左臂大小为346bp(序列如seq id no.7所示),右臂大小为369bp(序列如seq id no.8所示)。
[0115]
提取野生型靛蓝合成菌株假单胞菌(pseudomonas putida)b3为全基因组模板,按照genebank中苯乙烯单加氧酶基因序列(genbank accession no.dq177365.1),利用primer premier 5.0进行引物设计,扩增苯乙烯单加氧酶基因stya和苯乙烯单加氧酶基因styb,序列分别如seq id no.1和seq id no.2所示。
[0116]
1.3 styab基因整合重组质粒的构建
[0117]
根据一步法构建同源重组载体原理,分别将大肠杆菌的三个整合位点trpr、trpb、hisd基因两侧的基因片段作为同源片段,将启动子、抗性基因,与同源臂、目的基因片段连接,最后再以质粒phs
‑
avc
‑
lw为模板通过同源重组构建整合重组质粒phs
‑
avc
‑
01、phs
‑
avc
‑
02、phs
‑
avc
‑
03。
[0118]
1.4 styab基因和重组质粒连接产物转化至大肠杆菌感受态
[0119]
制备e.coli dh5α电转感受态,分别电转1.3中构建的3个整合重组质粒,对应chl培养基、kan培养基、kan培养基三种抗性筛选,获得阳性单克隆,测序验证插入序列。
[0120]
实施例2打靶片段获取
[0121]
2.1质粒提取
[0122]
1.4中验证无误的阳性克隆的基因组dna提取采用百泰克公司的细菌基因组dna提取试剂盒(离心柱型),具体操作见试剂盒说明书。
[0123]
2.2 pcr扩增打靶片段
[0124]
测定2.1中提取的phs
‑
avc
‑
01、phs
‑
avc
‑
02、phs
‑
avc
‑
03三组整合重组质粒的dna浓度,提取浓度约为200ng/μl,phs
‑
avc
‑
01作为模板的pcr反应体系如表3所示:
[0125]
表3打靶基因片段的pcr反应体系
[0126][0127]
phs
‑
avc
‑
01作为模板的pcr反应执行如下程序:
[0128]
[0129]
phs
‑
avc
‑
02作为模板的pcr反应体系如表4所示:
[0130]
表4打靶基因片段的pcr反应体系
[0131][0132]
phs
‑
avc
‑
02的pcr反应执行如下程序:
[0133][0134]
phs
‑
avc
‑
03的pcr反应体系如表5所示:
[0135]
表5打靶基因片段的pcr反应体系
[0136][0137]
phs
‑
avc
‑
03的pcr反应执行如下程序:
[0138][0139]
2.3基因片段凝胶电泳及产物回收
[0140]
琼脂糖凝胶电泳具体操作见标准规范。
[0141]
凝胶电泳产物回收采用北京百泰克公司的离心柱型多功能dna纯化回收试剂盒,具体操作见试剂盒说明书。
[0142]
实施例3重组菌株的构建
[0143]
3.1 red基因的诱导表达
[0144]
将pkd46质粒转化至e.coli dh5α感受态中,30℃恢复培养1h,涂氨苄(amp
)平板30℃培养过夜。挑单克隆至含有amp的lb试管中培养过夜。
[0145]
按1:100接种至加有amp的lb培养基中,加入l
‑
阿拉伯糖至终浓度为1mm,30℃培养,od
600nm
不超过0.6,制备电转感受态。
[0146]
3.2电转打靶片段
[0147]
将2.2获得的打靶dna片段与电转感受态细胞混匀(100μl感受态细胞 大约200ng打靶dna片段,转入预冷电转杯,从步骤3.1中制备得到的电转感受态的平板上各取三个单克隆电击转化。电击后加入lb培养基,置于30℃复苏2h,涂在相应的双抗性(chl amp或kan amp)平板上,30℃培养过夜。
[0148]
3.3工程菌鉴定
[0149]
从步骤3.2中培养后的双抗性平板上,分别挑入到10μl ddh2o中,配制成菌悬液,取1μl菌悬液作为模板,f
‑
0151/r
‑
0151、f
‑
0152/r
‑
0152、f
‑
0153/r
‑
0153为引物进行pcr,体系如表6所示:
[0150]
表6菌株鉴定pcr反应体系
[0151][0152][0153]
pcr反应条件分别同实施例2中所述。利用1%琼脂糖凝胶电泳30min,凝胶成像仪检测并记录结果。
[0154]
剩余9μl菌悬液置于在相应的抗性(kan
或chl
)lb培养基42℃培养,以去除质粒pkd46,然后划线lb平板(kan
或chl
),之后对所得的单菌落进行amp
敏感型检测,对amp敏感的菌种即为去除了质粒pkd46的菌种。提取菌种dna后甘油保藏菌种,后送去公司测序。
[0155]
3.4基因敲除kan 或chl 抗性基因的去除
[0156]
在3.3鉴定无误的重组菌株中电转pcp20质粒后涂布amp
平板,30℃培养过夜。
[0157]
挑取单克隆到加入amp的试管中,30℃培养至od
600
约为0.4
‑
0.6,37℃热激1h(热激活蛋白表达),30℃过夜培养后,pcr验证kan
或chl
是否消掉(或直接在试管中加入卡那霉素或氯霉素进行验证)。
[0158]
验证正确的菌划线分离单克隆后42℃培养,再在amp
平板上火试管中验证pcp20质粒是否消掉。
[0159]
实施例4目标基因表达分析
[0160]
4.1工程菌的总rna提取
[0161]
菌体中总rna的提取采用北京百泰克公司的离心柱型超纯总rna快速提取试剂盒,具体操作步骤见试剂盒说明书。
[0162]
4.2总rna反转录成cdna
[0163]
选用东洋纺toyobo(上海)公司的revertra ace qpcr rt master mix反转录试剂盒进行cdna的合成,具体操作方法见说明书。
[0164]
4.3 rt
‑
pcr分析
[0165]
依据stya、styb基因序列信息,由beacon design软件进行引物设计和评价特异性。引物序列见表7。
[0166]
表7 rt
‑
pcr引物
[0167]
基因引物名称在序列表中的编号序列(5'
‑
3')styaf
‑
aseq id no.20ggcgagctgattgagattcstyar
‑
aseq id no.21ttttgccgttattgagggtstybf
‑
bseq id no.22aaaagatgtggtggtggatstybr
‑
bseq id no.23tgctgaagaatgccgataa16sf
‑
16sseq id no.24ccacctggactgatact16sr
‑
16sseq id no.25gcacctgtctcaatgtt
[0168]
本试验采用东洋纺toyobo(上海)公司的sybr green realtime pcr master mix试剂盒,通过sybr green法进行荧光定量,反应体系见表8。
[0169]
表8 rt
‑
pcr反应体系
[0170][0171][0172]
rt
‑
qpcr反应执行如下程序:
[0173][0174]
相对表达量计算:实时荧光定量以16s基因作为内参,以在1.2mg/ml色氨酸浓度或0.01wt%的吲哚下不同发酵时间e.coli
‑
styab
‑
01菌株作为对照并采用2
‑
δδct
法进行相对定量计算。数值表示实验组目的基因的表达量相对于对照组的变化倍数。
△△
ct值计算公
式:
[0175]
△△
ct=(ct
目的基因
‑
ct
内参基因
)实验组
‑
(ct
目的基因
‑
ct
内参基因
)对照组
[0176]
实施例5重组菌株生长曲线测定
[0177]
5.1生长曲线的测定
[0178]
将重组菌株菌种在lb培养基中培养,培养条件为37℃,400rpm,在不同的时间点使用实验室购买的ⅰ型微生物反应器对菌种种子液进行实时检测,记录其生长曲线。前12h每小时检测一次生物量,12h后每隔4h检测一次。
[0179]
实施例6靛蓝色素产量测定
[0180]
6.1靛蓝色素产量测定
[0181]
靛蓝标曲制定:利用dmf将靛蓝标品溶解定容成50.0μg/ml的标准溶液,制定其标准曲线,采用酶标仪测定,在od
610 nm
处检测吸光值。
[0182]
靛蓝浓度测定:取1%种子液接入到40ml lb液体培养基,37℃过夜得到菌液。取1ml菌液到40ml lb液体培养基中,37℃培养3h,加入iptg至终浓度为1mm,温度调到30℃,160r/min震荡培养3h后,加入吲哚(终浓度为1.0g/l)或色氨酸(终浓度为1.6g/l)接入50ml发酵培养基,31℃,200r/min培养48h,取发酵液9000r/min离心20min,去上清液后加入10mln,n
‑
二甲基甲酰胺溶液,超声处理至靛蓝完全溶解,稀释后采用酶标仪在od
610 nm
处检测吸光值,代入标曲计算得到靛蓝浓度。
[0183]
实施例7质粒稳定性分析
[0184]
7.1稳定性分析
[0185]
分别配制有kan、chl抗性的抗生素lb固体平板和无抗性的lb固体平板,取不同的时间点的发酵液(利用3.3中鉴定后、还未敲除抗性的重组菌株菌种在lb液体培养基中培养得到,培养条件为37℃,400rpm)分别稀释涂布在相应抗性平板上,于培养箱培养12h后利用菌落计数器计数菌落数目。
[0186]
质粒稳定性(%)=有抗性平板菌落数/无抗性平板菌落数
×
100%
[0187]
实施例8靛蓝发酵液的制备
[0188]
种子液的制备:在超净工作台中取200μl,
‑
20℃保藏的靛蓝工程菌菌液接入至含50.0μg/ml卡那霉素的20ml lb液体培养基中,放入摇床37℃,200r/min活化12h,再转接两次后备用。
[0189]
发酵液的制备:将制备好的种子液以1.2%的接种量接种至500ml的发酵培养基中,设置发酵罐温度31℃,转速200r/min,通气比0.5vvm,ph 7.0,溶氧矫正100%,培养48h得到靛蓝发酵液。
[0190]
实施例9分批补料(补充色氨酸)发酵法
[0191]
选取补料浓度、补料时间、补料流速、补料次数及发酵时间作为影响分批补料发酵靛蓝工程菌稳定性的主要因素,测定不同条件下质粒型工程菌的稳定性。
[0192]
9.1补料浓度对工程菌发酵产靛蓝色素的影响
[0193]
在1l发酵液中,分别补充浓度为原发酵培养基(原培养基中的色氨酸浓度为1.6g/l)0(对应图14中的“原浓度”)、1、2、3、4、5倍的色氨酸水溶液(即,分别补充浓度为1.6*0、1.6*1、1.6*2、1.6*3、1.6*4、1.6*5g/l的色氨酸水溶液),每隔8h补料一次,每次80ml,共补料两次,补料流速为5ml/min,发酵48h后取样,测定靛蓝色素产量。
[0194]
9.2补料次数对工程菌发酵产靛蓝色素的影响
[0195]
在1l发酵液中,补充浓度为原发酵培养基(原培养基中的色氨酸浓度为1.6g/l)2倍的色氨酸水溶液,每隔8h补料一次,设置补料次数为0、1、2、3、4次,每次80ml,补料流速为5ml/min,发酵48h后取样,测定靛蓝色素产量。
[0196]
9.3补料间隔时间对工程菌发酵产靛蓝色素的影响
[0197]
在1l发酵液中,补充浓度为原发酵培养基(原培养基中的色氨酸浓度为1.6g/l)2倍的色氨酸水溶液,设置补料时间间隔为4、8、12、16、20h,每次80ml,补料流速为5ml/min,发酵48h后取样,测定靛蓝色素产量。
[0198]
9.4补料流速对工程菌发酵产靛蓝色素的影响
[0199]
在1l发酵液中,补充浓度为原发酵培养基(原培养基中的色氨酸浓度为1.6g/l)2倍的色氨酸水溶液,每隔16h补料一次,每次80ml,共补料两次,设置补料流速为1、2、3、4、5ml/min,发酵48h后取样,测定靛蓝色素产量。
[0200]
实施例10实验结果分析
[0201]
所有试验均进行3次重复,采用originpro 2018软件对数据进行显著性分析及绘图,0.01<p<0.05为显著,p<0.01为极显著,p>0.05为不显著。
[0202]
10.1重组质粒构建图谱
[0203]
根据snapgene软件进行分析设计,整合型工程菌的质粒构建图谱如图1所示,其中a为phs
‑
avc
‑
01,b为phs
‑
avc
‑
02,c为phs
‑
avc
‑
03,后续实验均依此图谱进行。
[0204]
10.2苯乙烯单加氧酶基因styab整合重组质粒的构建与酶切验证
[0205]
酶切验证原理:phs
‑
avc
‑
lw骨架载体上自带1个ecorv酶切位点,tyb基因带有1个ecorv酶切位点,因此,如果重组质粒构建成功,其上含有两个ecorv酶切位点,利用ecorv酶酶切、电泳后得到两条条带。
[0206]
将大肠杆菌trpr基因两侧的基因片段作为同源片段,pcr扩增启动子及抗性基因,与同源臂、目的基因片段连接,构建trpr left arm
‑
chl
‑
lac promoter
‑
styab
‑
trpr right arm的整合重组质粒phs
‑
avc
‑
01。总质粒大小为6692bp,重组质粒凝胶电泳图及酶切电泳图(图2)可知,泳道1为质粒phs
‑
avc
‑
01构建基因条带,利用ecorv酶酶切验证,泳道2呈现4170bp和2522bp两条条带,证明重组质粒可被切割,且条带大小一致,说明重组质粒phs
‑
avc
‑
01已构建。
[0207]
将大肠杆菌trpb基因两侧的基因片段作为同源片段,pcr扩增启动子及抗性基因,与同源臂、目的基因片段连接,构建trpb left arm
‑
kan
‑
lac promoter
‑
styab
‑
trpb right arm的整合重组质粒phs
‑
avc
‑
02。总质粒大小为6742bp,重组质粒凝胶电泳图及酶切电泳图(图3)可知,泳道1为质粒phs
‑
avc
‑
02构建基因条带,利用ecorv酶酶切验证,泳道2呈现4255bp和2487bp两条条带,证明重组质粒可被切割,且与预期条带大小一致,说明重组质粒phs
‑
avc
‑
02已构建。
[0208]
将大肠杆菌hisd基因两侧的基因片段作为同源片段,pcr扩增启动子及抗性基因,与同源臂、目的基因片段连接,构建了hisd left arm
‑
kan
‑
lac promoter
‑
styab
‑
hisd right arm的整合重组质粒phs
‑
avc
‑
03。总质粒大小为6763bp,重组质粒凝胶电泳图及酶切电泳图(图4)可知,泳道1为质粒phs
‑
avc
‑
03构建基因条带,利用ecorv酶酶切验证,泳道2呈现4258bp和2505bp两条条带,证明重组质粒可被切割,且与预期条带大小一致,说明重组质
粒phs
‑
avc
‑
03已构建。
[0209]
10.3菌落pcr验证
[0210]
利用鉴定引物hs
‑
c
‑
0151
‑
1与hs
‑
avc
‑
0063
‑
7对phs
‑
avc
‑
01、hs
‑
c
‑
0151
‑
2与hs
‑
c
‑
kan对phs
‑
avc
‑
02、hs
‑
c
‑
kan与hs
‑
c
‑
0151
‑
3对phs
‑
avc
‑
03三个重组质粒分别进行pcr验证,由图5可以看出三个重组质粒均有明亮条带,证明质粒构建成功;其中a为phs
‑
avc
‑
01,b为phs
‑
avc
‑
02,c为phs
‑
avc
‑
03。
[0211]
10.4测序验证质粒整合序列
[0212]
分别将三个重组质粒测序验证,由图6可以看出,三个质粒的左臂
‑
styab
‑
右臂片段均整合正确,再次证明质粒整合序列无误,质粒构建成功,其中a为phs
‑
avc
‑
01,b为phs
‑
avc
‑
02,c为phs
‑
avc
‑
03。
[0213]
10.5pcr扩增打靶片段
[0214]
利用引物f
‑
0151/r
‑
0151、f
‑
0152/r
‑
0152、f
‑
0153/r
‑
0153分别对三种质粒进行pcr扩增,phs
‑
avc
‑
01、phs
‑
avc
‑
02、phs
‑
avc
‑
03打靶片段的碱基数量依次为3683bp、3740bp、3761bp。图7为phs
‑
avc
‑
01打靶片段电泳图,对其进行了6组平行试验,泳道1
‑
6均在2000
‑
4000bp之间有明亮条带,证明phs
‑
avc
‑
01打靶片段获取成功;图8中泳道1
‑
6为phs
‑
avc
‑
02的打靶片段电泳图,泳道7
‑
12为phs
‑
avc
‑
03的打靶片段电泳图,均为6组平行,从图中可以看出在2000
‑
4000bp之间有明亮条带,此为目的打靶片段,切胶回收目的片段,以备下一步试验。
[0215]
10.6工程菌鉴定
[0216]
电转完毕的菌种进行涂板培养,挑取单菌落对其进行工程菌的鉴定。图9中泳道1为空白对照组,泳道2
‑
4为phs
‑
avc
‑
01打靶片段电转涂板后同一个板上不同的单菌落,利用引物f
‑
0151f/r
‑
0151对其菌落模板进行鉴定,泳道2在2000
‑
4000bp处有明显条带,泳道3、4均无所需片段,证明泳道2的单菌落为构建成功的菌种,可继续进行后续试验,所以e.coli ab
‑
01构建成功。
[0217]
图10中泳道1、5为空白对照组,泳道2
‑
4为phs
‑
avc
‑
02打靶片段电转涂板后同一个板上不同的单菌落,利用引物f
‑
0152/r
‑
0152对其菌落模板进行鉴定,泳道2在2000
‑
4000bp之间有明显条带,泳道3、4均没有明显条带,证明泳道2的菌落是所需要的菌种,泳道3、4为假阳性菌种,所以对泳道6的菌种进行进一步培养,e.coli ab
‑
02菌种已构建;泳道6
‑
7为phs
‑
avc
‑
03打靶片段电转涂板后同一个板上不同的单菌落,利用引物f
‑
0153/r
‑
0153对其菌落模板进行鉴定,在2000
‑
4000bp处无明显条带,虽在抗性平板上有菌落长出,但未将基因片段整合完整,为假阳性,考虑为此整合位点整合效率不高,所以e.coli ab
‑
03未构建成功。
[0218]
综上所述,e.coli ab
‑
01、e.coli ab
‑
02菌种构建成功,可以进行后续实验。
[0219]
10.7生长曲线的测定
[0220]
测定假单胞菌b3、质粒型工程菌e.coli
‑
styab(根据以下学术论文中公开的方法制备得到:程雷.pseudomonas putida b4中靛蓝色素合成代谢调控机制研究[d].中国农业大学,2016.)、e.coli ab
‑
01、e.coli ab
‑
02的生长曲线如图11所示。其中e.coli ab
‑
01、e.coli ab
‑
02的生长趋势相同,8h时有一次生长高峰期,后继续增加但速率减缓,28h前e.coli ab
‑
02比e.coli ab
‑
01生物量高,说明此时e.coli ab
‑
02较e.coli ab
‑
01活力更
强,而28h后e.coli ab
‑
01比e.coli ab
‑
02生物量高,说明超过28h e.coli ab
‑
01活力开始增强。质粒型工程菌整体生长趋势与整合型工程菌相似,但其生物量整体低于整合型工程菌。野生型假单胞菌b3的生长曲线在10h时达到峰值,后逐渐下降,至40h时有所提升,可以看出野生型菌种死亡速度较快,没有工程菌株活性强。
[0221]
10.8 e.coli ab
‑
01、e.col ab
‑
02中stya和styb基因表达量
[0222]
以色氨酸为底物发酵工程菌e.coli ab
‑
01和e.coli ab
‑
02,通过rt
‑
pcr技术在转录水平定量分析了stya和styb基因的mrna表达水平,结果如图12所示。如图可见,不同发酵时间对靛蓝色素合成代谢中stya和styb基因的表达影响显著(0.01<p<0.05),呈现先增加后下降的趋势。发酵时间在12h和36h时,基因表达量均较低;当发酵时间达24h时,基因表达急剧增加。24h时e.coli ab
‑
02的stya基因表达量明显高于e.coli ab
‑
01,高出67.9%,styb基因表达量比e.coli ab
‑
01低,仅19.1%,且stya与styb基因总表达总量高于e.coli ab
‑
01,总共高出31.4%,所以e.coli ab
‑
02较e.coli ab
‑
01的基因表达水平更好。
[0223]
以吲哚为底物发酵工程菌e.coli ab
‑
01和e.coli ab
‑
02,通过rt
‑
pcr技术在转录水平定量分析了stya和styb基因的mrna表达水平,结果如图13所示。如图可见,不同发酵时间对靛蓝色素合成代谢中stya和styb基因的表达影响显著(0.01<p<0.05),呈现先增加后下降趋势,仅e.coli ab
‑
02的styb基因呈现持续增加的趋势。发酵时间在12h时,基因表达量较低;当发酵时间达24h时,基因表达急剧增加;当发酵时间达36h时,基因表达量缓慢下降,e.coli ab
‑
02的styb基因继续增加。且不论何时e.coli ab
‑
02均高于e.coli ab
‑
01的基因表达量,24h时总表达量高出43.3%,所以e.coli ab
‑
02较e.coli ab
‑
01的基因表达水平更好。
[0224]
综上所述,以吲哚为底物发酵工程菌e.coli ab
‑
01和e.coli ab
‑
02其基因表达量更为稳定,并且e.coli ab
‑
02的基因表达量更高。
[0225]
10.9补料浓度对工程菌发酵产靛蓝色素的影响
[0226]
9.1所进行的试验,发酵48h后结果如图14所示。由图中可以看出补料浓度为原发酵培养基浓度两倍时产出的靛蓝最多,此时浓度最高可达1.15g/l。补料浓度过低养分不足,不足以支撑菌种生长,使菌种生长过慢;补料浓度过高容易使菌种代谢过快,渗透压过高而导致菌种失水死亡。所以应选择适量的补料培养基继续后续的优化实验。
[0227]
10.10补料次数对工程菌发酵产靛蓝色素的影响
[0228]
9.2所进行的试验,发酵48h后结果如图15所示。未补料及只补料一次时靛蓝产量较低,发酵液中营养物质过少使菌种生长过慢,靛蓝产出率低;而补料次数在两次及以上时靛蓝浓度增长趋势相差不大,随着补料次数的增加靛蓝产量基本保持在1.15g/l左右,此时考虑为后期菌种质粒丢失的情况较多,导致靛蓝色素不再产出。所以选择每次发酵补料两次来继续后续实验。
[0229]
10.11补料间隔时间对工程菌发酵产靛蓝色素的影响
[0230]
9.3所进行的试验结果如图16所示。从图中可以看出不同补料时间靛蓝的产出趋势不同,在发酵20h时,补料间隔时间为16h时靛蓝浓度最高,此时靛蓝工程菌发酵48h后靛蓝浓度可达1.189g/l,而每4h补料一次的浓度最低。这是因为过早补料培养基内的营养物质丰富,再多加营养物质也不会使菌种生长,反而会因此时营养物质过多导致菌种死亡,并且随着前期营养物质的消耗,后期也会出现营养不足的情况导致产量不高;而每16h补一次
料的效果最佳,补料时间超过16h时,菌种前期已将营养物质消耗过多,生长缓慢,并且会导致质粒丢失过快。所以应选择合适的补料时间来进行补料,以达到最优的补料发酵效果。
[0231]
10.12补料流速对工程菌发酵产靛蓝色素的影响
[0232]
9.4中,设置补料流速为1、2、3、4、5ml/min,不同补料流速对靛蓝工程菌发酵产靛蓝色素的影响如图17所示。补料流速为3ml/min的效果最好,此时发酵48h后的靛蓝产量可达1.212g/l。补料流速过低在菌种生长期时营养物质跟不上,会造成部分菌种质粒丢失或死亡的情况,而过高的流速也会导致补料过快使培养基浓度过高导致部分菌种失水死亡。所以最终选用3ml/min的流速进行补料。
[0233]
10.13传代次数对工程菌稳定性的影响
[0234]
对菌种的稳定性进行对比分析,由图18可以看出,质粒型工程菌随着传代次数的增加稳定性逐渐降低,传代次数越多其代谢负担加重,质粒丢失越快,传代至20次时质粒稳定性仅有57.11%,最终随着质粒的丢失,质粒型工程菌的产量也会大不如前;而两种整合型工程菌的稳定性趋势相同,随着传代次数的增加其稳定性基本保持不变,稳定性下降趋势极为平缓,其质粒稳定性保持在94%左右。所以整合型工程菌虽产量没有质粒型高,但稳定性比其高了37%左右。
[0235]
综合两种不同工程菌的对比分析,质粒型工程菌由于是多拷贝,虽靛蓝产量比整合型工程菌高,但其稳定性不强,多次传代后发酵不能保证靛蓝产量稳定,而整合型工程菌可以解决传代后菌种不稳定的问题。
[0236]
本技术通过同源重组技术,构建了整合型工程菌e.coli ab
‑
01、e.coli ab
‑
02。对比分析不同位点的染色体型工程菌基因表达量,当色氨酸为底物时,发酵24h的基因表达量最高,同样trpb为整合位点的工程菌e.coli ab
‑
02的基因表达水平更高,总共高出31.4%。对不同位点的染色体型工程菌靛蓝产量进行对比分析:两种不同的底物进行发酵,均为trpb为整合位点的工程菌e.coli ab
‑
02的靛蓝色素产量较高。e.coli ab
‑
02在以色氨酸为底物发酵时靛蓝浓度较e.coli ab
‑
01高83.3%。
[0237]
因此,为提高工程菌产量,对构建得到的整合型工程菌e.coli ab
‑
02进行发酵罐分批补料发酵,设计优化补料条件,研究确定了最适合靛蓝工程菌补料发酵的条件:补料浓度为原发酵培养基浓度的2倍、发酵每隔16h补料,共补料2次、补料流速3ml/min共发酵48h,最终发酵产量为3.5g/l,比未补料时发酵产量提高5倍。
[0238]
综上所述,以色氨酸为底物发酵trpb为整合位点的工程菌e.coli ab
‑
02,其基因表达水平稳定且靛蓝色素稳定高产,在进行发酵培养优化和补料培养后,最终发酵产量为3.5g/l,为国内外当前靛蓝色素生物合成较高水平。
[0239]
以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![一种5-卤代-2[(烷氧基羰基)氨基]-3-甲基苯甲酸的制备方法与流程](/upload/img/202111/alq13fxki5y.jpg)