1.本发明涉及从胚胎干细胞(escs)或诱导多能干细胞(ipscs)产生神经前体细胞(npcs),特别是人神经前体细胞(hnpcs)的方法、细胞培养基及其组合,其中所述npcs特别适合于临床前和临床用途。
背景技术:
2.神经前体细胞在细胞治疗中特别有价值,因为它们不仅可以自我更新并分化成所有类型的神经细胞,还可以迁移并整合到中枢神经系统的受损部分。同时,这些移植的npcs可以分泌多种神经保护性和血管生成性细胞因子和微小rna(micrornas)来增强自主康复过程。因此,利用多能性的npcs修复大脑和脊髓损伤的细胞替代疗法极具前景。
3.从2008年(dimos等,2008)起,从人诱导多能干细胞(hipscs)或人胚胎干细胞(hescs)体外诱导分化成人神经细胞的方法,及其在神经系统疾病、药物筛选、药物神经毒性测试、移植研究等各个方面的使用,已经成为科研和药物开发中的热点。通过先前已经存在的诱导神经分化的方法获得的神经干细胞或npcs只能进一步分化成特定亚型的神经细胞,无论是在体外或是在体内,其通常难以具有相对成熟的功能,并且还存在诸如存活时间短和产量有限等问题。
4.在2016年,xu等人(xu等,science translational medicine,2016)给出了一种新的神经分化方法,其能够从多能干细胞批量分化得到高纯度叉头框(forkhead box)g1阳性(foxg1
)的npcs,分化得到的npcs能够进一步分化成正确对应不同大脑皮层的各种细胞类型的神经细胞,包括各种兴奋性和抑制性神经元和星形胶质细胞,并在体外具有成熟的电生理功能和更长的生存期。然而,这篇文章中公布的方法使用了动物来源的试剂和成分不确定的组分。因此,非常需要开发一种稳定的方法,用于从多能干细胞产生质量稳定且适合于临床应用的npcs。
技术实现要素:
5.本发明的发明人们建立了一套能够从escs或ipscs经由定向分化产生适合于临床和临床前应用的npcs的方法学,由此满足了上述需求并完成了本发明。
6.因此,第一方面,本技术涉及一种从escs或ipscs产生npcs的方法,包括:
7.(1)在人多能干细胞培养基(hpsc培养基)中培养escs或ipscs以形成拟胚体(embryoid bodies,ebs);
8.(2)在包含基础培养基和添加剂的eb培养基中培养通过步骤(1)形成的ebs;
9.(3)使用神经诱导培养基(nim)在用胞外基质(ecm)包被的培养表面上培养步骤(2)之后的ebs以形成玫瑰花环样神经聚集体(rosette neural aggregates,ronas),其中所述nim包含基础培养基和添加剂;
10.(4)培养通过步骤(3)形成的ronas以形成神经球;和
11.(5)将神经球分散成单个细胞并在使用npc培养基在用ecm包被的培养表面上培养
以形成单层npcs,
12.其中所述hpsc培养基,以及所述eb培养基、nim、npc培养基中包含的各种基础培养基和添加剂为临床级。
13.在进一步的实施方案中,所述eb培养基、nim、npc培养基中包含的各种基础培养基和添加剂中的一种或多种,优选全部,为gmp级、cgmp级或cts
tm
级。更优选地,所述hpsc培养基、eb培养基、nim和npc培养基中的一种或多种,更优选两种、三种或四种,为临床级,优选gmp级、cgmp级或cts
tm
级。
14.在具体的实施方案中,所述培养表面是培养板或培养瓶。
15.在一个实施方案中,所述hpsc培养基为临床级,优选gmp级、cgmp级或cts
tm
级。具体来说,所述hpsc培养基选自以下几种:hpsc xf培养基、cts
tm
essential 8培养基、basic03培养基、stemmacs
tm
ips
‑
brew培养基、acf培养基、tesr
tm
‑
aof培养基和tesr2培养基。在优选的实施方案中,所述hpsc培养基是hpsc xf培养基。
16.在一个实施方案中,所述hpsc培养基添加有rock抑制剂。在优选的实施方案中,所述rock抑制剂为临床级,优选gmp级、cgmp级或cts
tm
级。
17.在一个实施方案中,所述eb培养基包含:
18.(i)基础培养基,其选自a)至c):
19.a)单独的knockout
tm
dmem/f12培养基,
20.b)dmem/f12培养基和neurobasal
tm
培养基的组合,
21.c)knockout
tm
dmem/f12培养基和neurobasal
tm
培养基的组合;
22.(ii)添加剂,其包含d)或e),或由d)或e)组成:
23.d)n
‑
2添加剂和glutamax
tm
‑
i添加剂;
24.e)n
‑
2添加剂、glutamax
tm
‑
i添加剂和不含维生素a的b
‑
27
tm
添加剂(b
‑
27
tm
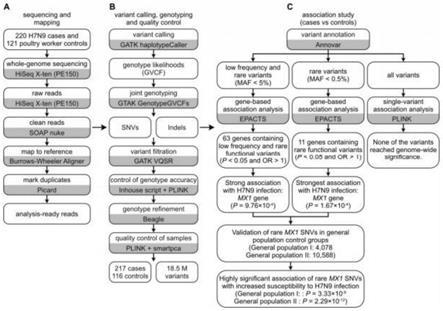
supplement,minus vitamin a);和
25.(iii)任选的抑制剂。
26.在进一步的实施方案中,所述eb培养基包含:
27.(i)基础培养基,其选自a)至c):
28.a)单独的cts
tm
knockout
tm
dmem/f12培养基,
29.b)cgmp级dmem/f12培养基与cts
tm
neurobasal
tm
培养基的组合,
30.c)cts
tm
knockout
tm
dmem/f12培养基和cts
tm
neurobasal
tm
培养基的组合;
31.(ii)添加剂,其包含d)或e),或由d)或e)组成:
32.d)cts
tm
n
‑
2添加剂和cts
tm
glutamax
tm
‑
i添加剂;和
33.e)cts
tm
n
‑
2添加剂、cts
tm
glutamax
tm
‑
i添加剂,和cgmp级或cts
tm
级的不含维生素a的无异源(xenofree)b
‑
27
tm
添加剂;
34.(iii)任选的抑制剂。
35.在优选的实施方案中,当所述eb培养基的基础培养基为a)时,所述添加剂包含e)或由e)组成。在具体的实施方案中,所述eb培养基的添加剂为d)或e)。
36.在优选的实施方案中,所述eb培养基包含抑制剂。更具体地,所述抑制剂包含bmp抑制剂、ampk抑制剂和alk抑制剂,或由bmp抑制剂、ampk抑制剂和alk抑制剂组成。在更具体
的实施方案中,所述抑制剂包含noggin、sb431542、ldn
‑
193189、dmh
‑
1和dorsomorphin中的一种或多种,或由noggin、sb431542、ldn
‑
193189、dmh
‑
1和dorsomorphin中的一种或多种组成。优选地,所述eb培养基包含sb431542与noggin、ldn
‑
193189、dmh
‑
1和dorsomorphin中的任何一种或多种,例如noggin、ldn
‑
193189、dmh
‑
1和dorsomorphin一种或两种的组合。在具体的实施方案中,所述eb培养基包含noggin、dorsomorphin和sb431542。在优选的实施方案中,所述抑制剂中的一种或多种,优选全部,为临床级,优选gmp级、cgmp级或cts
tm
级。
37.在一个实施方案中,所述nim包含:
38.(i)基础培养基,其选自a)至c):
39.a)单独的knockout
tm
dmem/f12培养基,
40.b)dmem/f12培养基和neurobasal
tm
培养基的组合,
41.c)knockout
tm
dmem/f12培养基和neurobasal
tm
培养基的组合;和
42.(ii)添加剂,其包含d)或e),或由d)或e)组成:
43.d)n
‑
2添加剂和glutamax
tm
‑
i添加剂;
44.e)n
‑
2添加剂、glutamax
tm
‑
i添加剂和不含维生素a的b
‑
27
tm
添加剂。
45.在一个实施方案中,所述nim包含:
46.(i)基础培养基,其选自a)至c):
47.a)单独的cts
tm
knockout
tm
dmem/f12培养基,
48.b)cgmp级dmem/f12培养基与cts
tm
neurobasal
tm
培养基的组合,
49.c)cts
tm
knockout
tm
dmem/f12培养基和cts
tm
neurobasal
tm
培养基的组合;和
50.(ii)添加剂,其包含d)或e),或由d)或e)组成:
51.d)cts
tm
n
‑
2添加剂和cts
tm
glutamax
tm
‑
i添加剂;和
52.e)cts
tm
n
‑
2添加剂、cts
tm
glutamax
tm
‑
i添加剂,和cgmp级或cts
tm
级的不含维生素a的无异源的b
‑
27
tm
添加剂。
53.在优选的实施方案中,当所述nim培养基的基础培养基为a)时,所述添加剂包含e)或由e)组成。在具体的实施方案中,所述nim培养基的添加剂为d)或e)。
54.将rona培养为神经球的步骤(4)使用与前一步骤或后一步骤相同的培养基。在一个实施方案中,将rona培养为神经球的步骤(4)中使用的培养基与前一步骤(步骤(3))相同,具体而言使用nim。在另一个实施方案中,将rona培养为神经球的步骤(4)中使用的培养基与后一步骤(步骤(5))相同,具体而言使用npc培养基,并且所述npc培养基包含基础培养基和添加剂。
55.在一个实施方案中,所述npc培养基是补充有glutamax
tm
‑
i添加剂和不含维生素a的b
‑
27
tm
添加剂的neurobasal
tm
培养基。在进一步的实施方案中,所述npc培养基是添加有cts
tm
glutamax
tm
‑
i添加剂和cgmp级或cts
tm
级的不含维生素a的无异源的b
‑
27
tm
添加剂的cts
tm
neurobasal
tm
培养基。在优选的实施方案中,所述npc培养基进一步包含脑源性神经营养因子(bdnf),和/或胶质细胞源性神经营养因子(gdnf),和/或l
‑
抗坏血酸,和/或n6,o2’
‑
二丁酰腺苷3’,5’环单磷酸钠盐(db
‑
camp)。在更具体的实施方案中,所述bdnf是无动物成分(animal
‑
free)重组bdnf或gmp级重组bdnf,和/或所述gdnf是无动物成分重组gdnf或gmp级重组gdnf。在优选的实施方案中,所述神经营养因子中的一种或多种是gmp级、cgmp级或cts
tm
级。更优选地,所述神经营养因子中的每一种均为gmp级、cgmp级或cts
tm
级。
56.在一个实施方案中,在步骤(5)中使用消化酶分散神经球。在另一个实施方案中,在步骤(5)中通过机械手段分散神经球。
57.在一个实施方案中,在步骤(1)之前,所述escs或ipscs维持培养并扩增到80%至90%汇合度,优选地培养在用层粘连蛋白(laminin)包被的培养表面上。所述培养表面可以是培养板。优选地用于包被的层粘连蛋白为临床级。
58.在一个实施方案中,其中在步骤(1)中,将escs或ipscs分散成单个细胞或细胞聚集体,例如通过消化酶或通过机械手段,然后接种到hpsc培养基中以诱导ebs形成。优选地,使用消化酶进行消化,以获得分散的更好、更均匀的细胞。在一个实施方案中,所述干细胞以5,000至40,000个细胞/孔,优选约10,000至35,000个细胞/孔,更优选约20,000至30,000个细胞/孔,最优选30,000个细胞/孔的密度接种到超低吸附96孔培养板中,使用hpsc培养基进行培养。在一个实施方案中,将所述干细胞以克隆集落形式接种到低吸附培养板中,使用所述hpsc培养基进行培养。
59.在一个实施方案中,步骤(1)或步骤(5)中使用的消化酶是cts
tm
tryple
tm
select酶。在一个实施方案中,所述消化酶是临床级、gmp级、cgmp级或cts
tm
级。
60.在具体的实施方案中,步骤(2)的培养为悬浮培养。在具体的实施方案中,步骤(3)的培养为贴壁培养。
61.在另一个实施方案中,步骤(2)中使用超过一种,例如两种、三种或更多种本发明的eb培养基。在另一个实施方案中,步骤(3)中使用超过一种,例如两种、三种或更多种本发明的nim。
62.第二方面,本发明涉及通过第一方面的方法产生的npcs,或自通过第一方面的方法产生的npc衍生的细胞。例如,所述自npc衍生的细胞可以是神经元、星形胶质前体细胞、星形胶质细胞、少突胶质前体细胞或少突胶质细胞。
63.在一个实施方案中,通过第一方面的方法产生的npcs中的大多数是foxg1
npcs。例如,产生的npcs中至少50%、至少60%、至少70%、至少80%、至少90%、至少95%是foxg1
npcs。
64.在优选的实施方案中,通过第一方面的方法产生的npcs或自衍生的细胞适合于临床前和临床应用。
65.第三方面,本发明涉及第二方面的npcs或自其衍生的细胞在药物开发或临床应用中的用途。
66.第四方面,本发明涉及从通过第一方面的方法产生的npcs来制备神经元、星形胶质前体细胞、星形胶质细胞、少突胶质前体细胞、少突胶质细胞或包含它们之中任何一种或多种的混合细胞群的方法。在一个实施方案中,所述方法包括对npcs进行进一步分化。在另一个优选的实施方案中,所述方法使用临床级、gmp级、cgmp级或cts
tm
级的培养基进行。
67.第五方面,本发明涉及从第一方面的方法产生的npcs分化得到的神经元、星形胶质前体细胞、星形胶质细胞、少突胶质前体细胞或少突胶质细胞。例如,通过第四方面的方法获得的神经元、星形胶质前体细胞、星形胶质细胞、少突胶质前体细胞或少突胶质细胞。优选地,所述神经元、星形胶质前体细胞、星形胶质细胞、少突胶质前体细胞或少突胶质细胞适合于临床前和临床应用。
68.从前文可知,所述eb培养基和nim可以共享相同的、促成本发明成功的重要成分,
包括基础培养基和添加剂。因此,第六方面,本发明涉及在从escs或ipscs通过分化产生npcs的过程中,基础培养基和添加剂的组合在配制eb培养基和/或nim中的用途,其中所述基础培养基是dmem/f12或knockout
tm
dmem/f12,并且所述添加剂是n
‑
2添加剂和glutamax
tm
‑
i添加剂,并且其中所述基础培养基和添加剂为临床级。优选地,所述基础培养基和添加剂中的一种或多种为gmp级、cgmp级或cts
tm
级。在一个实施方案中,所述基础培养基进一步包含临床级neurobasal
tm
培养基,优选cts
tm
neurobasal
tm
培养基。在另一个实施方案中,所述添加剂进一步包含临床级不含维生素a的b
‑
27
tm
添加剂,优选cgmp级或cts
tm
不含维生素a的无异源的b
‑
27
tm
添加剂。
附图说明
69.为了便于更好地理解本发明的特征和优势,提供以下发明详述和附图。然而,本领域技术人员应该理解这些内容只是为了说明本发明,而非对本发明进行限制。本发明的范围以权利要求为准。
70.图1示例了从人多能干细胞(hpscs)产生人神经前体细胞(hnpcs)的流程图,显示了关键的步骤,并配有明场显微照片展示各个步骤结束时细胞培养物的外观。
71.图2显示了从hescs分化得到的临床级hnpcs(实施例1)的明场图像。
72.图3显示了本发明实施例1中获得的临床级hnpcs的免疫荧光染色结果。术语“dapi”用于本文意指4’,6
‑
二脒基
‑2‑
苯基吲哚。
73.图4显示了本发明实施例1中获得的临床级hnpcs的流式细胞仪检测结果。
74.图5a
‑
d显示了临床级人神经细胞的表征结果,所述临床级人神经细胞由本发明实施例1中的hnpcs体外分化得到的。图5a和图5b显示了从本发明实施例1中扩增培养获得的临床级hnpcs体外分化2个月后的大脑皮层神经元标志物(brn2、ctip2、tbr1和satb2;图5a)和突触蛋白标志物(synapsin和psd95;图5b)的免疫荧光染色结果;图5c显示了体外分化第6天和第13天的临床级人神经细胞的电生理活动检测结果;图5d显示了从本发明实施例1中扩增培养获得的临床级hnpcs体外分化3个月后的胶质细胞标志物的免疫荧光染色结果,其中细胞核由dapi标记,星形胶质细胞由gfap标记,少突胶质前体细胞由olig2标记。
75.图6是从本发明实施例1中扩增培养获得的临床级hnpcs的生长曲线。
76.图7是本发明实施例4中从hipscs分化得到的临床级hnpcs的明场图像。
77.图8是从本发明实施例4中扩增培养的临床级hnpcs的免疫荧光染色结果。
78.图9是从本发明实施例4中扩增培养的临床级hnpcs的流式细胞仪检测结果。
79.图10a
‑
d显示了临床级人神经细胞的表征结果,所述临床级人神经细胞由本发明实施例4的hnpcs体外分化得到的。图10a和图10b显示了从本发明实施例4中扩增培养获得的临床级hnpcs体外分化2个月后的大脑皮层神经元标志物(brn2、ctip2、tbr1和satb2;图10a)和突触蛋白标志物(synapsin和psd95;图10b)的免疫荧光染色结果;图10c显示了体外分化第6天和第14天的临床级人神经细胞的电生理活动检测结果;图10d显示了从本发明实施例4中扩增培养获得的临床级hnpcs体外分化3个月后的胶质细胞标志物的免疫荧光染色结果,其中细胞核由dapi标记,星形胶质细胞由gfap标记,少突胶质前体细胞由olig2标记。
80.图11a
‑
e显示了使用实施例7和表2中描述的不同培养基组合的细胞分化方法的结果。图11a、11b、11c、11d和11e分别显示了组合1、4、5、8和10的结果。
81.图12显示了通过实施例8的方法形成的ebs的明场图像。
82.图13是从本发明实施例9中扩增培养的hnpcs的免疫荧光染色结果。
83.图14a
‑
d显示了临床级人神经细胞的表征结果,所述临床级人神经细胞由本发明实施例9的hnpcs体外分化得到的。图14a和图14b显示了从本发明实施例9中扩增培养获得的临床级hnpcs体外分化2个月后的大脑皮层神经元标志物(brn2、ctip2、tbr1和satb2;图14a)和突触蛋白标志物(synapsin和psd95;图14b)的免疫荧光染色结果。图14c显示了体外分化第7天和第14天的临床级人神经细胞的电生理活动检测结果。图14d显示了从本发明实施例9中扩增培养获得的临床级hnpcs体外分化3个月后的胶质细胞标志物的免疫荧光染色结果,其中细胞核由dapi标记,神经元由map2标记,星形胶质细胞由gfap标记,少突胶质前体细胞由olig2标记。
84.发明详述
85.除非在本发明中具体指明,否则本文使用的全部科技术语的含义按照本发明所属领域的普通技术人员的通常理解来解释。
[0086]“或”在本文中与“和/或”含义相同,除非明确指明。
[0087]
在本发明的上下文中,除非另行说明,否则“包含”、“包括”和“含有”应理解为意指包括所列元素,例如一种成分、一个特征、一个步骤或它们的一个组,但是不排除任何其它元素,例如其它组分、性质和步骤。当用于本文时,术语“包含”或其任何变型可以用“含有”、“包括”或“具有”或同义变型来替换。在某些实施方案中,“包含”还包括“由
……
组成”的情况。
[0088]
临床级
[0089]
在不限制使用已知或未知的其他来源的试剂、培养基和细胞衍生材料的前提下,在本技术的方法中,就用于产生hnpcs的材料,特别是构成本技术的培养基的一种或多种材料,以及基质和酶而言,术语“临床级”表明该试剂、培养基或细胞衍生材料本身就适合临床应用,并且/或者能够用于将干细胞,特别是胚胎干细胞或诱导多能干细胞,定向分化成适用于临床应用的安全、稳定的细胞,特别是hnpcs。
[0090]
更优选地,用于产生本发明的hnpcs的试剂、培养基或细胞衍生材料,特别是构成本技术的培养基的一种或多种材料,是gmp(优良制造标准)级或cgmp(现行优良制造标准)级,这意味着所述试剂、培养基或细胞衍生材料具有经过认证的gmp或cgmp质量并且在gmp或cgmp标准下生产,这些标准由权威机构如世界卫生组织、中华人民共和国卫生部、美国食品药品监督管理局或欧洲药品管理局制定。“gmp”或“cgmp”表示制造者应当遵循的(现行)标准,从而保证其产品的生产过程得到恰当的监测和控制,且其提供给最终用户的产品始终高度安全。
[0091]
术语“cts”或“cts
tm”是细胞治疗体系(cell therapy systems)的缩写。该术语是thermo fisher公司用来表示为了细胞治疗而生产的某种产品具有高质量且满足cgmp标准的术语。
[0092]
在本技术的上下文中,涉及npcs的短语“临床应用的”或“适合于临床应用的”意味着该npcs至少满足临床和临床前实践相关的特定规定所要求的标准,例如满足优良制造标准(gmp)。具体来说,本发明的方法分化得到的npcs所具有的特性使它们适合于临床应用。
[0093]
不同阶段的细胞类型
[0094]
术语“神经前体细胞”或“npcs”如用于本文指这样的一种细胞类型,其能够分化成为神经谱系(neural lineage)中的细胞,包括但不限于神经元、胶质细胞前体细胞和胶质细胞,例如星形胶质前体细胞、星形胶质细胞、少突胶质前体细胞和少突胶质细胞。前体细胞是一种干细胞样的细胞,但是其复制能力和增殖能力比干细胞弱。然而,与完全分化的细胞相比,前体细胞仍然具有分化成不同细胞类型的能力。因此,前体细胞可以作为更安全的种子细胞用于细胞替代疗法。一种细胞(特别是npcs)是否成功分化得到特定细胞类型,可以通过形态观察、细胞特异生物标志物检测以及体外可以分化得到具有特定生物标志物和电生理活动的特定神经细胞类型来确定。例如,通过本发明的方法产生的npcs可以展现出典型的神经前体细胞形态,包括相对均质的柱形胞体和玫瑰花环样的放射状细胞排列。
[0095]
缩写“foxg1”或“foxg1”如用于本文代表“叉头框g1”,其为人脑发育过程中最早表达的转录因子之一,诱导端脑发育成几种关键的结构,包括大脑皮层。大脑皮层衍生自表达前脑叉头框g1(foxg1)的器官原基。因此,foxg1可以作为最终会分化成前脑细胞的前体细胞的标志物。在本发明的一个实施方案中,通过本发明的方法产生的npcs表达foxg1。
[0096]
术语“胚胎干细胞”或“escs”如用于本文指源自胚胎的多能干细胞。术语“诱导多能干细胞”或“ipscs”如用于本文指从分化的体细胞重编程产生的多能干细胞。本发明的方法可以使用escs或ipscs作为定向分化的起始材料。在本发明的特定实施方案中,escs或ipscs为哺乳动物来源,特别是人体来源。本发明不限定干细胞包括escs和ipscs的来源,只要它们符合临床应用的要求即可。所述细胞可以直接获得自商业来源或者可以由制备获得,例如,通过将体细胞重编程为ipscs来制备。
[0097]
术语“拟胚体”或“ebs”如用于本文指将escs和ipscs通过三维培养生长而来的细胞聚集体。ebs可以通过悬浮培养形成。然而,按照传统培养ebs的方式难以获得均一大小和形状的ebs。
[0098]
在本发明的上下文中,术语“源自玫瑰花环样神经干细胞的神经聚集体”、“玫瑰花环样神经聚集体”或“ronas”等术语在本文中可以互换使用,指衍生自escs或ipscs的神经干细胞的聚集体,其由神经干细胞自发组织形成高度紧凑的三维柱状神经聚集体。在本发明的方法中,具体来说步骤(3)中形成的玫瑰花环样神经聚集体在免疫染色中呈foxg1和nestin阳性。在本技术的方法中,ronas通常在初始分化8天后形成,也就是在将ebs转移至本发明步骤(3)的包被的培养表面(如培养板)后培养约1天时形成。
[0099]
在本技术的上下文中,术语“神经球”如用于本文指从ronas分离的神经命运细胞经悬浮培养形成的球形聚集体。神经球是一种由不同类型的神经细胞组成的异质群体,包括神经干细胞、神经前体细胞和一些分化的神经细胞。在本技术的方法中,神经球主要由npcs组成,可以将其分散或消化成单细胞后接种至包被基质胶的培养表面上,如接种至细胞培养板中,形成高纯度的单层npcs。在本技术的方法中,神经球通常在开始分化之后21天时形成,也就是将ronas在本发明步骤(4)的培养基中培养大约1天之后。将rona培养成神经球的过程可以使用与前一步培养步骤或后一步培养步骤相同的培养基,如用于培养rona的nim或用于形成单层npc的npc培养基。
[0100]
在本发明中,可以使用机械手段或酶(如能够分离细胞基质的酶)使细胞与培养表面(如培养板)分离或使神经球分散。在优选的实施方案中,与机械手段相比,使用消化酶进行这样的分离或分散,能够使原本聚集在一起的细胞分散为更均匀的单个离散细胞。具体
来说,在本方法的不同步骤中可以使用消化酶进行处理以实现不同的目的。例如,在本发明步骤(5)中使用消化酶使神经球分散成单细胞。另外,消化酶也可以用于以下用途:(a)在本方法步骤(1)接种细胞之前,使干细胞分散并悬浮,和/或(b)在本方法步骤(5)之后的传代过程中分散npcs。前述步骤中使用的消化酶可以相同或不同。在具体的实施方案中,本发明的方法中使用的酶,特别是步骤(1)中使用的酶,可以将细胞集落消化成离散的单细胞,这有别于仅仅使细胞集落从培养表面如培养板剥离而集落仍然彼此连接在一起的酶。示例性的酶可以是accutase、dispase、versene(edta)或tryple。在优选的实施方案中,酶是cts
tm
tryple
tm
select酶,其可以用于消化干细胞(escs或ipscs)、神经球和npcs。在另一个实施方案中,步骤(5)中用于分散神经球的酶是cts
tm
tryple
tm
select酶。优选地,适合于在本发明的方法中用于消化或分离细胞的消化酶或细胞分离酶溶液为临床级、gmp级、cgmp级或cts
tm
级,或者所述消化酶适用于制备用于临床应用的npcs。所述酶可以按照其制造商推荐的剂量使用。
[0101]
对于ipscs/escs、ronas以及单层npcs的培养而言,将所述培养表面如培养板用胞外基质(ecm)包被以提供对细胞贴壁生长的支持。ecm是细胞外层基质并且主要由蛋白质如胶原蛋白、弹性蛋白和层粘连蛋白组成。ecm被广泛用于哺乳动物细胞的培养,也是本领域技术人员已知的。可用于包被固体支持物或培养表面的如培养板的ecm的非限定性实例包括matrigel
tm
、层粘连蛋白、多聚赖氨酸、多聚鸟氨酸(po)/纤连蛋白(fn)/层粘连蛋白(lam)的组合、纤连蛋白(fn)等。在优选的实施方案中,将用于培养ronas的培养表面如培养板用matrigel
tm
或层粘连蛋白包被。在更优选的实施方案中,将用于培养ronas的培养表面如培养板用从biolamina获得的laminin
‑
521包被,特别是mx521或ct521,其为临床级或gmp级。
[0102]
可以通过对蛋白质标志物进行免疫染色来判定一种细胞是否分化或转化形成了特定类型的细胞,这些蛋白质标志物特异性地表达于特定的细胞类型中。在神经组学中常用的标志物是本领域技术人员熟知的。例如,微管相关蛋白2(map2)a、b、c亚型只在神经元中表达,具体来说在核周体和树突中表达。
[0103]
本技术还涉及由本发明方法产生的npcs进一步产生分化细胞的方法,所述分化细胞包括但不限于神经元和胶质细胞,如星形胶质细胞和少突胶质细胞,所述方法通过例如将所述npcs在分化培养基中培养来进行。包括分化培养基在内的分化条件可由本领域技术人员根据希望培养的细胞类型来决定。优选地,所述分化培养基为临床级、gmp级、cgmp级或cts
tm
级,从而使得npcs分化获得的细胞适合于临床前和临床应用。
[0104]
在具体的实施方案中,将通过本发明的方法产生的npcs培养在神经分化培养基中以产生神经元。本发明的npc培养基例如cts
‑
npc培养基可用作神经分化培养基,这降低了从干细胞分化得到神经元的整个过程的复杂程度,并且能够产生适合于临床前和临床应用的神经元。
[0105]
培养基
[0106]
用于本技术各个步骤的培养基的组成对于npcs的分化成功至关重要。本技术的任何培养基和包含于其中的组分应为临床级,优选gmp级、cgmp级或cts
tm
级,或者能够用于分化得到适合于临床应用的npcs的级别。
[0107]
培养基是一种混合物,其中包含某种类型细胞生长所需的各种营养物质。培养基可以通过将添加剂添加到基础培养基来制备。广义上的添加剂指细胞培养所需但又没有包
含在基础培养基中的额外组分,包括蛋白质、脂质、氨基酸、维生素、激素、细胞因子、生长因子等。然而,在本文中,“添加剂”一词不包括单独添加到hpsc培养基或eb培养基中的抑制剂,也不包括l
‑
抗坏血酸、db
‑
camp、单独添加到npc培养基中的神经营养因子。本发明的方法中使用的任何基础培养基和添加剂为临床级,优选gmp级、cgmp级或cts
tm
级。
[0108]
在本技术的上下文中,hpsc培养基是本方法的步骤(1)中培养escs或ipscs形成ebs的培养基。适合于本方法的hpsc培养基可以选自下组:xf培养基、cts
tm
essential 8培养基、basic03培养基、stemmacs
tm
ips
‑
brew培养基、acf培养基、tesr
tm
‑
aof培养基和tesr2培养基。
[0109]
在优选的实施方案中,本发明方法的步骤(1)中可以使用添加了rock抑制剂的培养基。rock抑制剂是一类蛋白激酶抑制剂,其抑制属于丝氨酸
‑
苏氨酸蛋白激酶家族的rho相关蛋白激酶(rock)的活性,并防止细胞在消化或复苏后凋亡。rock通过作用于细胞骨架而参与调节细胞的形状和运动,还调节细胞的永生化和分化。示例性rock抑制剂包括但不限于y
‑
27632。为了分化得到适合于临床应用的npcs,在本技术的方法中使用临床级,优选gmp级、cgmp级或cts
tm
级的rock抑制剂。这些rock抑制剂可以通过商业途径获得。rock抑制剂可以以约10μm的浓度添加至hpsc培养基中。
[0110]
在本技术的上下文中,eb培养基是用于培养ebs和诱导神经分化的培养基。具体来说,eb培养基指本发明方法步骤(2)中使用的培养基。
[0111]
在优选的实施方案中,eb培养基包含抑制剂。更具体地,所述抑制剂包含bmp抑制剂、ampk抑制剂和alk抑制剂,或者由bmp抑制剂、ampk抑制剂和alk抑制剂组成。在一个实施方案中,eb培养基包含一种或多种选自下组的抑制剂:noggin、dorsomorphin、dmh
‑
1、ldn
‑
193189和sb431542。优选地,eb培养基包含sb431542与noggin、ldn
‑
193189、dmh
‑
1和dorsomorphin中一种或多种的组合,例如sb431542与一种或两种的组合。更具体地,eb培养基包含noggin、sb431542和dorsomorphin的组合。eb培养基中noggin的浓度可为25
‑
100ng/ml,优选40
‑
60ng/ml,最优选50ng/ml。eb培养基中dorsomorphin的浓度可为0.5
‑
2μm,优选0.75
‑
1.5μm,最优选1μm。eb培养基中sb431542的浓度可为5
‑
15μm,优选7
‑
13μm,更优选8
‑
12μm,最优选10μm。
[0112]
在具体的实施方案中,eb培养基的基础培养基和添加剂可以选自表1。在更具体的实施方案中,eb培养基具有下表1中所列的具体基础培养基和添加剂的组合。
[0113]
在本技术的上下文中,nim是用于诱导ronas形成的培养基。
[0114]
当eb培养基或nim的基础培养基是通过两种基础培养基混合而成时,那么这两种培养基的混合体积比约为1:1。
[0115]
在一个实施方案中,所述nim和eb培养基由相同的基础培养基和添加剂组成,差别仅在于eb培养基额外添加抑制剂。使用基础组分完全相同的nim和eb培养基可以使培养基的制备变得更加高效。
[0116]
在具体的实施方案中,nim的基础培养基和添加剂可以选自表1。在更具体的实施方案中,nim具有表1中所示的具体基础培养基和添加剂的组合。
[0117]
在表1中,“cts
‑
dmem/f12”指代cts
tm
knockout
tm
dmem/f12培养基(gibco);“dmem/f12”指代cgmp级dmem/f12(gibco);“cts
‑
nb”指代cts
tm
neurobasal
tm
培养基(gibco);“cts
‑
b27”指代cts
tm
级的不含维生素a的无异源的b
‑
27
tm
添加剂(gibco);“cts
‑
n2”指代cts
tm
n
‑
2添加剂(gibco);且“cts
‑
glutamax”指代cts
tm
glutamax
tm
‑
i添加剂(gibco);nds指代noggin、dorsomorphin和sb431542的组合。表格中的百分比基于培养基的体积来计算。
[0118]
表1.用于eb培养基和nim的基础培养基和添加剂的优选组合
[0119][0120]
在另一个实施方案中,在eb和rona的培养过程中可以使用超过一种用于相应步骤的本发明的培养基。在步骤(2)的eb培养过程中,可以以任意顺序和任意组合使用两种或更多种本发明的eb培养基,如包含表1中所列的基础培养基和添加剂的eb培养基。类似地,在步骤(3)的rona形成过程中,可以以任意顺序和任意组合使用两种或更多种本发明的nim,如包含表1中所列的基础培养基和添加剂的nim。例如,先后使用第一种培养基,再使用第二种培养基;或先使用第一种培养基,再使用第二种培养基,然后再换回第一种培养基;或先使用第一种培养基,再使用第二种培养基,然后再使用第三种培养基;以此类推。例如,在第(2)步和/或第(3)步中,可以先使用cts或gmp级的n2m培养基,再使用cts级的ndm培养基。当使用超过一种培养基时,培养基的更换可以在任意时间点以本领域技术人员熟知的方式进行。
[0121]
在本技术的上下文中,npc培养基是用于培养npcs的培养基。npc培养基优选包含如下成分或由如下成分组成:(i)适用于维持npcs培养的基础培养基;和(ii)包含cts
tm
glutamax
tm
‑
i添加剂和不含维生素a的cts
tm
的无异源的b
‑
27
tm
添加剂。在更优选的实施方案中,npc培养基进一步包含bdnf,和/或gdnf,和/或l
‑
抗坏血酸,和/或db
‑
camp。
[0122]
包括bdnf和gdnf在内的神经营养因子是分散的神经元群体生存、生长或分化的重要物质。npc培养基中包含的bdnf或gdnf可以使用无动物成分(animal
‑
free)的产品。bdnf和/或gdnf也可以是临床级、gmp级、cgmp级或cts
tm
级。
[0123]
本公开中示例的任何特定产品,如培养基、添加剂、抑制剂、神经营养因子或其他试剂都可以被商标或产品名称不同的同类型产品替换,或者其它功能等效物替换。本领域技术人员会理解,不同商标或产品名称下基本上相同的产品,以及功能等效物也涵盖在本发明的范围内。
[0124]
方法步骤
[0125]
仅出于方便参考的目的,本技术的方法可分为多个步骤,每个包括一个或多个培养流程和/或处理。方法的步骤(1)至(5)基本上基于培养基的变化和/或各个步骤结束时获得的细胞培养物的形式划分。
[0126]
方法的步骤(1)通过将干细胞培养在hpsc培养基中,使干细胞(特别是escs或ipscs)形成ebs。在一个实施方案中,将干细胞培养在培养容器如培养板或培养瓶中,优选
超低吸附培养板,更优选超低吸附96孔培养板。通常而言,步骤(1)的培养在37℃进行。将细胞培养24至72小时,优选2天,然后进行下一步。在步骤(1)结束时,干细胞形成ebs,形成的ebs具有圆球形且光滑表面的形态特征。所述hpsc培养基优选包含rock抑制剂。
[0127]
方法的步骤(2)将ebs培养在eb培养基中,eb会发生自发神经分化。具体来说,在步骤(2)以悬浮培养的方式培养ebs。在一个实施方案中,将ebs培养在培养容器如培养板或培养瓶中,优选低吸附培养板,更优选低吸附6孔培养板。通常而言,步骤(2)的培养在37℃进行。将ebs培养约100至140小时,优选约5天,然后将它们推进到下一步。优选地,每天将eb培养基更换为新鲜培养基。在步骤(2)结束时,ebs具有圆球形且光滑表面、并且体积变大的形态特征。优选的eb培养基进一步含有抑制剂,所述抑制剂有助于诱导eb的神经分化。
[0128]
方法的步骤(3)使生长到期望阶段的ebs在nim中生长以诱导ronas的形成。在一个实施方案中,ebs贴附在用临床级ecm材料包被的培养表面上,如培养板、培养瓶或培养皿上。通常而言,步骤(3)的培养在37℃进行。步骤(3)的神经诱导通常持续约5
‑
20天。在步骤(3)结束时,ebs分化形成ronas,ronas是由成簇的玫瑰花环样的细胞堆积在一起而形成的三维柱状细胞聚集体。
[0129]
方法的步骤(4)将ronas中玫瑰花环样的细胞分离出来并在npc培养基中进行悬浮培养以形成神经球。在一个实施方案中,将神经聚集体培养在培养容器如培养板或培养瓶中,优选低吸附培养板中,更优选低吸附6孔培养板。例如,步骤(4)起始接种一块低吸附6孔培养板的细胞量为来自一块6孔培养板的ronas的量。通常而言,步骤(4)的培养在37℃进行。将神经聚集体培养约12
‑
24小时,然后推进到下一步。在步骤(4)结束时,形成球形的神经球,其具有圆球形且光滑表面的形态特征。
[0130]
方法的步骤(5)使神经球在npc培养基中形成单层npcs。在一个实施方案中,步骤(5)包括分散神经球的步骤(5a)和进行培养的步骤(5b)。所述分散可以通过酶处理进行,或通过其他方法如机械手段进行。通过酶处理进行的步骤(5a)旨在通过用消化酶将神经球处理5
‑
10分钟来解离细胞。经过酶处理的神经球消化成单细胞,从而使它们能够以预定的数量进行铺种和培养。进行培养的步骤(5b)在用临床级emc材料包被的培养表面如培养板或培养瓶中进行。将细胞以大约0.5
‑
4.0x106个细胞/cm2,优选0.8
‑
3.5x106个细胞/cm2,更优选1.0x106个细胞/cm2的密度进行接种。通常而言,步骤(5b)的培养在37℃进行。次日,可以观察到npcs达到80%
‑
100%的汇合度。
[0131]
步骤(5)之后,可以继续培养npcs并进行一次或多次传代。优选地,细胞每三至五天传代一次,例如每四天传代一次。传代细胞时,可以将npcs用消化酶处理,洗涤并计数,然后将它们转移至用临床级ecm材料包被的培养表面如培养板或培养瓶中进行培养,优选6孔培养板。优选地,所述培养基每天或每隔一天更换一次,例如通过将一半体积的培养基用新鲜培养基替换。
[0132]
在步骤(1)之前,本发明的方法可以包括对干细胞的维持培养。为了启动步骤(1),将维持培养基中的干细胞用机械手段或消化酶处理、洗涤并计数。本领域技术人员能够选择合适的培养基用于维持培养。在使用可以通过商业渠道获得的干细胞时,可以按照供应商推荐的条件进行维持培养。
[0133]
用途
[0134]
本发明的方法可用于生产适合于临床和临床前应用的npcs。例如,通过本发明的
方法生产的npcs可以在药物开发、疾病模型建立、临床前和临床研究中使用,也可以用于现有的疗法和正在开发中的新疗法。
[0135]
通过本发明的方法生产的npcs也可以用作起始细胞来分化得到一种或多种不同类型的神经细胞,特别是适用于临床前和/或临床应用的分化的神经细胞。例如,所述分化的神经细胞可以是神经元或胶质细胞如星形胶质细胞或少突胶质细胞。
实施例
[0136]
实施例1.从hescs分化得到hnpcs
[0137]
本技术的方法的过程步骤概括在图1所示的流程图中。详细的步骤和材料如下文所述。
[0138]
拟胚体(ebs)的制备
[0139]
人胚胎干细胞(hesc)细胞系h1购自上海埃泽思生物科技有限公司(产品目录号ac
‑
2001002h1)并维持培养在含有hpsc xf培养基(biological industries,bi)的6孔板中。每孔加入1ml cts
tm
tryple
tm
select酶(gibco),在含5%co2的37℃培养箱中消化6至10分钟,细胞脱落并收获细胞之后,将escs以1.65x104个细胞/cm2的密度接种到用临床级laminin
‑
521(biolamina,mx521/ct521)包被的培养板中,其中每孔含有2.5mlhpsc xf培养基(bi)。
[0140]
当汇合度达到80%至90%时,弃培养基,每孔加入2ml cts
tm
dpbs(无氯化钙和氯化镁)(gibco)洗涤细胞。每孔加入1ml cts
tm
tryple
tm
select酶(gibco),在含5%co2的37℃培养箱中消化6至10分钟。在显微镜下观察,当部分细胞开始从培养板脱落时,每孔加入3mlhpsc xf培养基(bi)终止消化。离心之后,将细胞用包含10μm rock抑制剂(y
‑
27632,wako)的hpsc xf培养基(bi)重悬,并对活细胞进行计数。
[0141]
将细胞以每孔30,000个细胞的密度接种到超低吸附96孔培养板中,其中每孔含有包含10μm rock抑制剂(y
‑
27632,wako)的200μlhpsc xf培养基(bi),将细胞在含5%co2的37℃培养箱中培养。次日,在各个孔中观察到了拟胚体(ebs)的形成,并且这些ebs大小相同。
[0142]
ebs的定向分化
[0143]
细胞在含有10μm rock抑制剂(wako)的hpsc xf培养基(bi)的超低吸附96孔培养板中培养2天(定向分化的第0天至第2天)之后,将ebs以28至32个ebs每孔的密度转移至低吸附6孔培养板中,弃掉旧培养基。每孔加入2.5ml cts
‑
eb培养基,其中所述cts
‑
eb培养基由cts
tm
knockout
tm
dmem/f
‑
12培养基(gibco)与cts
tm
neurobasal
tm
培养基(gibco)以1:1(vol/vol)的比例混合的基础培养基,并添加50ng/ml noggin gmp(r&d)、1μm dorsomorphin(tocris)、10μm sb431542(tocris)、1vol%的cts
tm
n
‑
2添加剂(100x)(gibco)和0.5vol%的cts
tm
glutamax
tm
‑
i添加剂(200x)(gibco)制备。将ebs在含5%co2的37℃培养箱中培养5天,并且每天将所述培养基全量更换为新鲜的cts
‑
eb培养基。
[0144]
在分化开始后第7天,将ebs转移至用临床级laminin
‑
521(biolamina,mx521/ct521)包被的6孔培养板,从而使ebs能够完全贴附,并且使用临床级无血清神经诱导培养
基(nim)进行培养,促进神经干细胞和npcs的扩增。临床级无血清nim由cts
tm
knockout
tm
dmem/f
‑
12培养基(gibco)与cts
tm
neurobasal
tm
培养基(gibco)以1:1(vol/vol)的比例混合的基础培养基,并添加1vol%的cts
tm
n
‑
2添加剂(100x)(gibco)和0.5vol%的cts
tm
glutamax
tm
‑
i添加剂(200x)(gibco)来制备。在最初的五天,每隔一天用新鲜nim替换一半旧培养基,在五天之后每天用新鲜nim替换一半旧培养基。从ebs被接种至用临床级laminin
‑
521(biolamina,mx521/ct521)包被的培养板的第一天开始,ebs贴附到培养板上并逐渐形成贴壁细胞聚集体。此后,形成了典型的神经特异性玫瑰花环结构,说明神经干细胞聚集体的形成。随着神经干细胞和npcs的逐渐扩增,在集落的中心形成ronas。
[0145]
在分化开始后第21天,在体式显微镜下挑选并分离富含npcs的神经聚集体,并且将挑选的神经聚集体转移到低吸附6孔培养板中,其中每孔含有2.5ml cts
‑
npc培养基。所述cts
‑
npc培养基由cts
tm
neurobasal
tm
培养基(gibco)添加20ng/ml无动物成分重组人/鼠/大鼠bdnf(animal
‑
free recombinant human/murine/rat bdnf)(peprotech)、20ng/ml无动物成分重组人gdnf(animal
‑
free recombinant human gdnf)(peprotech)、0.2mm l
‑
抗坏血酸(vc)(sigma)、0.5mm n6,o2’‑
二丁酰腺苷3’,5’环单磷酸钠盐(db
‑
camp)(sigma)、1vol%cts
tm
glutamax
tm
‑
i添加剂(100x)(gibco)和2vol%cts
tm
不含维生素a的无异源b
‑
27
tm
添加剂(50x)(gibco)来制备。
[0146]
培养1天后,可观察到神经球的形成。选取低吸附6孔板的一个孔中的神经球并转移到24孔细胞培养板的一个孔中。小心弃掉旧培养基。每孔加入0.5ml cts
tm
tryple
tm
select酶(gibco),消化神经球5至10分钟,当神经球的外层细胞开始变得松散之后,轻柔地加入1.5ml cts
‑
npc培养基以终止消化。将神经球转移至15ml离心管并自然沉降2至5分钟。尽可能多地移除上清液。加入1ml cts
‑
npc培养基,用1ml枪头将神经球打散成单细胞,并对活细胞进行计数。将单细胞以1.0x106个细胞/cm2的密度接种至用临床级laminin
‑
521(biolamina,mx521/ct521)包被的6孔培养板上,其中每孔含有5ml cts
‑
npc培养基。次日,可观察到分离的hnpcs以贴壁形式生长,汇合度为90%至100%。每天或每隔一天通过用新鲜培养基替换一半旧培养基。
[0147]
每四天将生长在6孔培养板中的hnpcs消化并传代一次。具体来说,首先每孔用2ml cts
tm
dpbs(dulbecco's磷酸盐缓冲盐水,无氯化钙和氯化镁)(gibco)洗涤hnpcs一次,然后每孔加入1ml的cts
tm
tryple
tm
select酶(gibco),在含5%co2的37℃培养箱中消化6至10分钟。在显微镜下观察到细胞开始变圆且同时保持贴附在培养板上时,立即弃掉cts
tm
tryple
tm
select酶溶液。每孔加入3ml新鲜的cts
‑
npc培养基,用1ml枪头吹吸8
‑
10次直至所有细胞脱落。将细胞悬液转移至15ml离心管,200g离心4分钟。离心之后,弃上清,细胞沉淀用cts
‑
npc培养基重悬,并对活细胞进行计数。然后以1.0x106个细胞/cm2的密度将细胞接种至临床级laminin
‑
521(biolamina,mx521/ct521)包被的6孔培养板上,其中每孔含有5ml cts
‑
npc培养基。次日,可观察到hnpcs以贴壁形式生长,汇合度为90%至100%。每天或每隔一天通过用新鲜培养基替换掉一半旧培养基。在hnpcs传代四次之后,p5代的hnpcs可以冻存或者直接使用。
[0148]
实施例2.从hescs分化得到的hnpcs的表征
[0149]
为了确认通过实施例1中所示的方法是否从escs成功地分化得到了hnpcs,基于形态学观察和细胞特异生物标志物检测对获得的细胞进行鉴定。
[0150]
细胞形态
[0151]
图2是按照实施例1中的方法将hescs通过定向分化得到的hnpcs的明场图。从图2中可见,通过本发明提供的方法获得的hnpcs是贴壁生长并具有典型hnpcs的形态,即一种相对均质的柱形胞体,并且呈现出玫瑰花环样放射状细胞排列的特征。
[0152]
免疫荧光染色鉴定
[0153]
对实施例1中描述的方法获得的hnpcs进行了免疫荧光染色鉴定。如图3所示,大多数分化得到的细胞表达了foxg1和nestin,说明成功地分化得到了大量高纯度hnpcs。具体来说,在分化得到的细胞群体中,foxg1
细胞比例高达98.52%,nestin
细胞比例高达99.26%(图3)。
[0154]
流式细胞术
[0155]
对实施例1中分化得到的细胞进行了流式细胞仪检测,基于foxg1、pax6和nestin的表达来鉴定hnpcs,并获得了与上述免疫荧光染色鉴定相似的结果。根据流式细胞术的结果,foxg1
细胞比例高达95.69%的,pax6
细胞比例高达76.11%,nestin
细胞比例高达98.02%(图4)。
[0156]
实施例3.hescs衍生的hnpcs的分化
[0157]
进行了多种实验来检测实施例1中分化得到的hnpcs进一步分化成期望的细胞类型的能力。
[0158]
hnpcs分化成神经元
[0159]
将生长在6孔培养板中的hnpcs消化并接种以进行神经元分化。cts
‑
神经分化培养基与实施例1中描述的cts
‑
npc培养基相同。首先每孔加入2ml cts
tm
dpbs(dulbecco's磷酸盐缓冲盐水,无氯化钙和氯化镁)(gibco)洗涤hnpcs一次,然后每孔加入1ml cts
tm
tryple
tm
select酶(gibco),在含5%co2的37℃培养箱中消化6至10分钟。在显微镜下观察到细胞开始变圆且同时保持贴附在培养板上时,立即弃掉cts
tm
tryple
tm
select酶溶液。每孔加入3ml新鲜的cts
‑
神经分化培养基。用1ml枪头吹吸8
‑
10次直至所有细胞脱落。将细胞悬液转移至15ml离心管,200g离心4分钟。离心之后,弃上清,细胞沉淀用cts
‑
神经分化培养基重悬,并对活细胞进行计数。然后以2.5x104个活细胞的密度将细胞接种至临床级laminin
‑
521(biolamina,mx521/ct521)包被的24孔培养板上,其中每孔含有500μl cts
‑
神经分化培养基。次日,可观察到hnpc以贴壁形式生长。每3
‑
7天用新鲜培养基替换掉一半旧培养基。
[0160]
免疫荧光染色鉴定
[0161]
本发明实施例1生产的hnpcs的体外分化情况可以通过免疫荧光染色来鉴定。
[0162]
图5a显示了hnpcs在体外分化2个月后进行的免疫荧光染色的结果,检测了人大脑六层皮层特异性标志物的表达情况。如图5a所示,荧光信号代表了如下各种标志物的表达:针对第ii至iv层的brain
‑
2(brn2)和特殊富含at序列结合蛋白2(satb2),针对第v和vi层的鸡卵清蛋白上游启动子
‑
转录因子相互作用蛋白2(ctip2),针对第i、v和vi层的t框大脑蛋白1(tbr1),以及针对神经元的微管相关蛋白2(map2)。免疫染色的结果表明,通过实施例1的方法获得的hnpcs已经成功地进一步分化为人大脑皮层所有六层的神经细胞。
[0163]
图5b显示了突触蛋白(synapsin)和突触后密度蛋白95(psd95)的免疫荧光染色结果,说明了这两种标志物的表达,这两种蛋白分别为突触前标志物和突触后标志物。如图5b
所示,代表突触蛋白的信号分布呈离散的点,表明神经元已分化成熟。如图5c所示,可以在体外分化的一周内(第6天)检测到电生理活动。此外,在延长培养时间(第13天)后,神经元尖峰放电(spike firing)逐渐增强,并产生了更规则的自发放电、单一电极的簇状放电(single burst)和多电极协同的簇状放电(network burst)。
[0164]
本发明实施例1生产的hnpcs在体外分化3个月后,针对胶质纤维酸性蛋白(gfap)和少突胶质细胞转录因子2(olig2)的表达情况进行免疫荧光染色鉴定。如图5d所示,gfap和olig2的阳性信号表明,通过本发明的方法获得的hnpcs进一步分化出了星形胶质细胞和少突胶质前体细胞。
[0165]
综上所述,上述免疫荧光染色鉴定结果证明通过实施例1中所述的方法从escs生产的hnpcs能够进一步分化为人大脑皮层所有六层的神经细胞并具有相应的生理功能。
[0166]
生长曲线
[0167]
图6是本发明实施例1生产的hnpcs(第5代)的生长曲线。根据倍增时间公式pdt=lg2 x(t
‑
t0)/(lgn
t
‑
lgn0)计算hnpcs倍增时间,其中pdt为倍增时间,t为进行细胞计数的时间点,t0为细胞接种的时间点,n
t
是时间点t时细胞计数所得的数值,n0是接种的细胞数。hnpcs倍增时间经计算为73小时。
[0168]
另外,从图6可以看出,hnpcs在24小时开始增殖。在72小时,细胞数量约为接种细胞数的两倍,并在96小时达到平台期。此后,细胞数保持在较高水平不增加,表明细胞停止增殖。这个阶段的细胞仍然具有在体外分化的潜能。因此,在四天后传代细胞可以使本技术的npcs获得最大收率。
[0169]
实施例4.从ipscs分化得到hnpcs
[0170]
按照与实施例1中所述相同的方法进行生产,唯一的不同是使用购自中国科学院干细胞库、目录号为scsp
‑
1301的人诱导多能干细胞(ipscs)作为生产的起始细胞代替hesc细胞系h1。
[0171]
实施例5.从ipscs分化得到的hnpcs的表征
[0172]
为了确认通过实施例4中所示的方法是否从ipscs成功地分化得到了hnpcs,基于形态学观察和细胞特异性生物标志物检测对获得的细胞进行了鉴定。
[0173]
细胞形态
[0174]
图7是按照本发明实施例4中的方法将ipscs定向分化得到的hnpcs的明场图像。从图7中可见,通过本发明提供的方法获得的hnpcs是贴壁生长并具有典型hnpc的形态,即一种相对均质的柱形胞体,并且呈现出玫瑰花环样放射状细胞排列的特征。
[0175]
免疫荧光染色鉴定
[0176]
对通过实施例4中描述的方法获得的hnpcs进行了免疫荧光染色鉴定。如图8所示,大多数的细胞表达了foxg1和nestin,这两个是前脑hnpcs特异分子标志物,说明成功地分化得到了大量高纯度hnpcs。具体来说,在分化得到的细胞群体中,foxg1
细胞比例高达95.70%的,nestin
细胞比例高达96.84%(图8)。
[0177]
流式细胞术
[0178]
对实施例4中分化得到的细胞进行了流式细胞仪检测,基于foxg1、pax6和nestin的表达来鉴定hnpcs,并获得了与上述免疫荧光染色鉴定相似的结果。根据流式细胞术的结果,foxg1
细胞比例高达93.55%的,pax6
细胞比例高达70.66%,nestin
细胞比例高达
95.16%(图9)。
[0179]
实施例6.从ipscs衍生的hnpcs的分化
[0180]
进行了多种实验来检测实施例4中分化得到的hnpcs进一步分化成期望的细胞类型如神经元的能力。
[0181]
hnpcs分化成神经元
[0182]
按照与实施例3中所述相同的方式进行hnpcs的分化。
[0183]
免疫荧光染色鉴定
[0184]
本发明实施例4生产的hnpcs的体外分化情况可以通过免疫荧光染色来鉴定。
[0185]
图10a显示了hnpcs在体外分化2个月后进行的免疫荧光染色的结果,检测了人大脑六层皮层特异性标志物的表达情况。如图10a所示,荧光信号代表了如下各种标志物的表达:针对第ii至iv层的brn2和satb2,针对第v和vi层的ctip2,针对第i、v和vi层的tbr1,以及针对神经元的map2。免疫染色的结果表明,通过实施例4的方法获得的hnpcs已成功分化为人大脑皮层所有六层的神经细胞。
[0186]
图10b显示了synapsin和psd95的免疫染色结果,说明了这两种标志物的表达,这两种蛋白分别为突触前标志物和突触后标志物。如图10b所示,代表突触蛋白的信号分布呈离散的点,表明神经元已分化成熟。如图10c所示,可以在体外分化的第6天检测到电生理活动。此外,随着培养时间的延长,神经元尖峰放电逐渐增强,并产生了更规则的自发放电、单一电极的簇状放电和多电极协同的簇状放电。
[0187]
将本发明实施例4分化得到的hnpcs在体外进一步分化3个月后,针对gfap和olig2的表达情况进行免疫荧光染色鉴定。如图10d所示,gfap和olig2的阳性信号表明,在这个时间点通过本发明的方法获得的hnpcs进一步分化出了星形胶质细胞和少突胶质前体细胞。
[0188]
综上所述,上述免疫荧光染色鉴定结果证明通过实施例4中所述的方法从ipscs生产的hnpcs能够分化为具有所需生理功能的人大脑皮层所有六层的神经细胞。
[0189]
实施例7.使用不同培养基的定向分化
[0190]
发明人在实施例1所述的方法中测试了一系列不同的临床级培养基。具体地,在其余条件保持不变的前提下,在每次测试中改变eb培养基和nim的基础培养基和添加剂的组成。结果总结在下表2和表3中。
[0191]
表2和表3的培养基组合1至组合4与表1中所列的相同,组合5至组合10为测试的其它培养基组成,其中组合6至组合10的eb培养基和nim采用了不同的基础培养基和添加剂。“neaa”是指gmp级mem非必需氨基酸溶液(mem non
‑
essential amino acids solution);“cts
‑
kosr”是指knockout
tm
sr xenofree cts
tm
。“bi
‑
eb”是指hpsc xf培养基(无生长因子)。
[0192]
表2.不同组成的eb培养基和nim的测试结果
[0193][0194]
表3.不同组成的eb培养基和nim的详细测试结果
[0195][0196][0197]
实施例8.使用干细胞集落起始定向分化
[0198]
在本技术的优选实施方案中,例如在实施例1或实施例4中描述的方法中,是通过消化干细胞并将细胞以一定密度接种到培养板中形成了ebs。在这本实施例中,本发明人测试了一种以干细胞集落代替一定数量的单细胞进行接种的方法。本实施例参照了先前xu等人在2016年发表的文章中的方法,而培养基和添加剂则被替换为对应的临床级试剂。
[0199]
将escs或ipscs维持在用cts
tm
vitronectin包被的培养板中,使用hpsc xf培养基进行培养。用胶原酶nb 6gmp级(0.15pz u/ml hbss,钙,镁,无酚红)处理escs或ipscs集落约20分钟。无需对细胞进行计数,将脱落的集落直接转移至cts
‑
ebm中并
在其中培养一天。cts
‑
ebm由20%knockout
tm
sr xenofree cts
tm
(gibco)、1vol%gmp级mem非必需氨基酸溶液(gibco)、0.5vol%cts
tm
glutamax
tm
‑
i添加剂(gibco)添加到cts
tm
knockout
tm
dmem/f
‑
12中制备。
[0200]
其余流程与实施例1和实施例4中的步骤一致。从第2天至第6天,用于培养细胞的eb培养基为cts
‑
ebm nds。cts
‑
ebm nds包含50ng/ml noggin gmp、1μm dorsomorphin、10μm sb431542、20%knockout
tm
sr xenofree cts
tm
(gibco)、1vol%gmp级mem非必需氨基酸溶液(gibco)、0.5vol%cts
tm
glutamax
tm
‑
i添加剂(gibco)和cts
tm
knockout
tm
dmem/f
‑
12。
[0201]
在第6天形成的ebs不是球形(图12),未能分化出npcs。结果说明,在实验室中被证明成功的方案在临床转化时存在不确定性。仅用对应临床级的试剂替代基础培养基和添加剂并不能保证成功产生临床级的npcs。
[0202]
实施例9.使用两种nim的定向分化
[0203]
按照与实施例1或实施例4中所述相同的方法进行生产,唯一的不同是前后使用两种nim培养ronas诱导神经分化。在分化开始后第7天,将ebs转移至用临床级laminin
‑
521(biolamina,mx521/ct521)包被的6孔培养板,从而使ebs能够完全贴附,并且使用两种不同的临床级无血清神经诱导培养基(nim)进行培养,促进神经干细胞和npcs的扩增。在ronas分化的第1天至第7天使用的临床级无血清n2m由cts
tm
knockout
tm
dmem/f
‑
12培养基(gibco)与cts
tm
neurobasal
tm
培养基(gibco)以1:1(vol/vol)的比例混合的基础培养基,并添加1vol%的cts
tm
n
‑
2添加剂(100x)(gibco)和0.5vol%的cts
tm
glutamax
tm
‑
i添加剂(200x)(gibco)来制备。在ronas分化的第8天至第14天使用的临床级无血清ndm由cts
tm
knockout
tm
dmem/f
‑
12培养基(gibco)与cts
tm
neurobasal
tm
培养基(gibco)以1:1(vol/vol)的比例混合的基础培养基,并添加0.5vol%的cts
tm
n
‑
2添加剂(200x)(gibco)、1vol%cts
tm
不含维生素a的无异源b
‑
27
tm
添加剂(100x)(gibco)和0.5vol%的cts
tm
glutamax
tm
‑
i添加剂(200x)(gibco)来制备。
[0204]
对通过本实施例中描述的方法获得的hnpcs进行了免疫荧光染色鉴定。如图13所示,大多数的细胞表达了foxg1和nestin,说明成功地分化得到了大量高纯度hnpcs。具体来说,在分化得到的细胞群体中,foxg1
细胞比例高达98.03%的,nestin
细胞比例高达99.30%(图13)。
[0205]
本发明实施例9生产的hnpcs的体外分化情况可以通过免疫荧光染色来鉴定。
[0206]
图14a显示了hnpcs在体外分化2个月进行的免疫荧光染色的结果,检测了人大脑六层皮层特异性标志物的表达情况。如图14a所示,荧光信号代表了如下各种标志物的表达:针对第ii至iv层的brn2和satb2,针对第v和vi层的ctip2,针对第i、v和vi层的tbr1。免疫染色的结果表明,通过本实施例9的方法获得的hnpcs已成功分化为人大脑皮层所有六层的神经细胞。
[0207]
图14b显示了synapsin和psd95的免疫染色结果,说明了这两种标志物的表达,这两种蛋白分别为突触前标志物和突触后标志物。如图14b所示,代表突触蛋白的信号分布呈离散的点,表明神经元已分化成熟。如图14c所示,可以在体外分化的第7天检测到电生理活动。此外,随着培养时间的延长,神经元尖峰放电逐渐增强,并产生了更规则的自发放电、单一电极的簇状放电和多电极协同的簇状放电。
[0208]
将本发明实施例分化得到的hnpcs在体外进一步分化3个月后,针对map2、gfap和
olig2的表达情况进行免疫荧光染色鉴定。如图14d所示,map2、gfap和olig2的阳性信号表明,在这个时间点通过本发明的方法获得的hnpcs进一步分化出了神经元、星形胶质细胞和少突胶质前体细胞。
[0209]
综上所述,上述免疫荧光染色鉴定结果证明通过实施例9中所述的方法生产的hnpcs能够分化为具有所需生理功能的人大脑皮层所有六层的神经细胞。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![一种5-卤代-2[(烷氧基羰基)氨基]-3-甲基苯甲酸的制备方法与流程](/upload/img/202111/alq13fxki5y.jpg)