1.本发明属于基因突变检测技术领域,具体涉及一种筛查胃癌相关基因突变的方法和试剂盒。
背景技术:
2.胃癌(gastric cancer)是世界上常见的恶性肿瘤之一,全世界胃癌的年发病率为17.6/10万,居恶性肿瘤死亡率第二位。研究表明,胃癌其发病率在高发区和低发区之间可相差7~10倍,地区之间具有显著差异性。日本的胃癌死亡率居世界首位,其次为智利和哥斯达黎加,男女性均呈此趋势。新西兰、丹麦、澳大利亚的胃癌死亡率较低,美国最低,日本则约为美国的7倍。近些年来日本的胃癌发病率已有所降低,但仍是死亡率最高的恶性肿瘤。
3.国内外的调查资料表明,胃癌的发病与遗传因素有密切的关系,其方式为多基因遗传,但发生胃癌的遗传因素的功能机制目前尚不清楚。一般认为胃癌是一种有一定的遗传倾向和家庭聚集性、家族肿瘤史的遗传疾病,尤其是直系亲属胃癌史,是胃癌的显著危险因素,胃癌患者家庭成员比非胃癌患者家庭成员患胃癌的危险要高2~3倍,国内外的大量资料表明,胃癌患者中有明显家族倾向者占10%。这种家族性倾向可能是因为胃癌患者所处的生活环境及生活习惯相似,但该研究还同时发现,当患者处于相似的生活环境中,无血缘关系者的胃癌发病人数要明显低于有血缘关系的直系亲属,因此推测为遗传因素所起的作用。近些年来,越来越多的研究报道证实癌症发生的个体差异可以用遗传多态性来解释。随着全基因组关联研究及外显子测序等方法的出现,胃癌所表现出的家族聚集性及遗传易感性也被人们广泛关注。
4.单核苷酸多态性(single nucleotide polymorphism,snp)是指存在于某一(些)群体、正常个体的基因组dna中单碱基的序列差异,在人类基因组中广泛存在。目前认为人类遗传基因的多态性90%以上是由snp所引起的。随着人类基因组计划以及千人基因组计划的完成,已得出了迄今最详尽的基因多态性图谱。数据库公布人类基因组中大约存在1500万个常见的snp,其中还有很多频率为1%~5%的罕见变异。在全基因组范围内,平均每100到1000个碱基会出现1个 snp位点,因此多数基因都会存在大量的snp位点。snp的研究不仅为基因诊断,尤其是疾病的早期诊断提供了理论依据,而且在疾病治疗过程中对于药物敏感性和安全性的检测、疗效的预估及预后都具有重要意义。
5.snp由于其分布广、密度高而被认为是第三代遗传标志,已有许多实验室将snp应用于临床,在易感性及药物敏感性的判断等多个方面为临床提供理论依据。但是由于目前与胃癌风险相关的snp较多,单个位点的检测对易患胃癌风险的评估显得十分有限。
6.基因panel是一个基因组合,在基因检测中使用基因panel所检测的基因比单一的位点要多,比pcr技术检测的序列要长,相对来说,在检测中不只是检测一个位点、一个基因,而是同时检测多个位点、多个基因。这些位点和基因需要按照一个标准进行选择和组合,从而构成一个检测panel,从而使获得的基因信息量相对要多一些。多基因的全面检测
对于胃癌早期筛查及胃癌术后化疗耐药等的筛选是有临床意义的,如果早期了解到敏感性及肿瘤耐药情况,临床医生可根据检测的结果分析是机体自身原因还是肿瘤发生变异,在治疗方案上就会事先做出调整,避免医疗资源的浪费,同时可提高患者的治愈率。
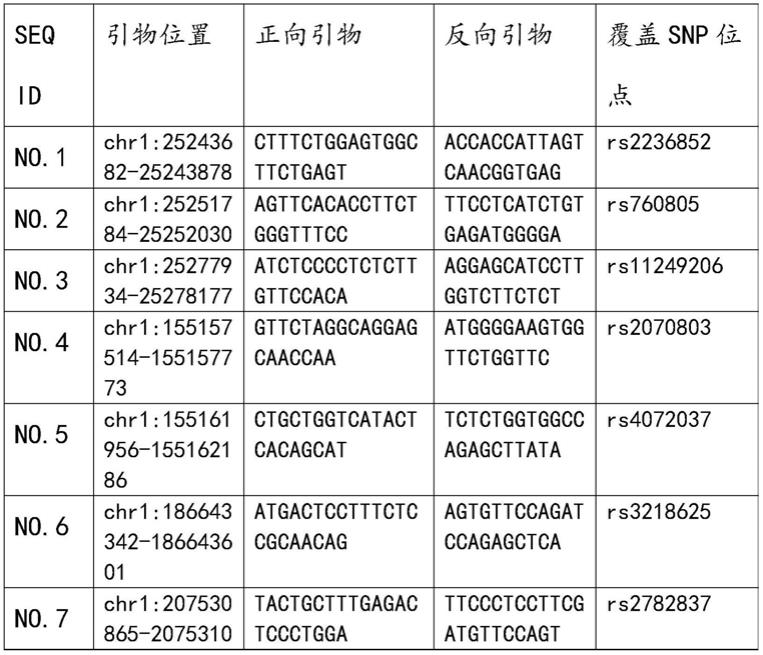
7.因此,本领域使用基因panel技术,对胃癌风险相关基因的snp 做了一个基因组合,尽可能的将目前研究与胃癌易感的强相关位点纳入该组合中,主要包括:daf(rs2782837)、mir
‑
194
‑
1(rs78888417、 rs3754060、rs75779112)、muc1(rs4072037、rs2070803)、mena (rs3795443)、cox
‑
2(rs3218625)、runx3(rs11249206、rs760805、 rs2236852)、nrp
‑
1(rs2273466)、mir
‑
194
‑
2(rs67679485)、muc6 (rs11246386)、ctsf(rs4576)、kras(rs7315339)、mir
‑
196a2 (rs11614913)、ppp2r5e(rs3742624)、p53基因pro72arg (rs1042522)、stard3(rs1877031)、timp
‑
2(rs2277698、rs1531796)、 bcl
‑
2(rs3744935)、smad4(rs12456284、rs8084630、rs17663887)、 mir
‑
125a(rs8111742)、dnmt1(rs2228611)、hif
‑
2α(rs7598371、 rs6715787、rs13419896)、il
‑
1f5(rs2472188、rs2515401、rs2515402)、 romo1(rs6060566、rs6060567、rs17092980)、adipoq(rs266729、 rs2241766)、bmpr1b(rs1434536)、spry1(rs300574)、kdr (rs7692791)、il4(rs2243267)、prkaa1(rs10074991、rs10036575)、 vegfa(rs3024997、rs833061)、il
‑
17a(rs3748067)、nt5e(rs6913634)、 tnf
‑
a(rs361525)、egfr(rs884225、rs763317)、ssbp1(rs6976500)、 il6(rs1800796、rs2069837、rs2069840)、ezh2(rs12670401)、mtdh (rs7754、rs2512450)、psca(rs2294008)、cldn23(rs12153、 rs11249884)、hdab2ip(rs2243421)。
8.上述基因突变与胃癌的发生发展有相关性,通过使用以上基因组合的方式不仅可以更加全面的指导临床判定标准,个体化合理用药,也能在提高用药的安全性和有效性上具有指导作用,尤其是在对胃癌高发风险人群的前期干预等方面也都具有重大意义。
9.目前,对于胃癌基因检测所涵盖的基因及基因突变位点不是很全面。因此,对于胃癌发生发展的预估会存在较大的偏差,在使用上会存在很大的局限。本产品涵盖的相关基因中,包括63个与胃癌发生强相关的snp位点。因此检测可信度更高,对胃癌发生发展风险的预估会更加准确。
10.因此,在对于胃癌发生风险预估的领域中,我们急需高灵敏度、涵盖基因及位点范围广、低成本、快速的方法和试剂盒。
技术实现要素:
11.本发明的目的是为了提供可用于高灵敏度、高通量、低成本检测胃癌相关基因突变的方法和试剂盒。本发明主要是利用多重pcr技术对胃癌相关基因进行捕获富集,然后通过高通量测序技术测定富集后的序列,最终通过生物信息学分析高通量测序数据,从而发现胃癌相关基因突变情况及其频率。
12.为了实现上述目的,本发明采用的技术方案是:
13.因此,本发明提供了一种检测胃癌基因突变位点的方法,所述方法包括:
14.1)捕获:进行第一轮特异性多重pcr反应,使用61对引物对样品dna进行扩增,所述61对pcr引物于t1试管进行反应,试管引物 61对seq id no.1
‑
seq id no.61;
15.2)建库:进行第二轮接头pcr反应,使用接头序列为igt
‑
i5 index 和igt
‑
i7 index,对步骤1)获得的扩增产物进行扩增,得到多重 pcr文库;3)定量和质量检测:对步骤
2)获得的多重pcr文库进行文库浓度测定,并对文库片段长度和纯度进行检测;
16.4)测序:对步骤2)获得的多重pcr文库进行测序;
17.5)分析:对步骤4)获得的测序结果进行分析,完成全编码区的突变检测。
18.本发明还提供了一种胃癌基因突变多重pcr检测试剂盒,所述试剂盒包括:两套pcr引物、igt
‑
em808聚合酶混合物、扩增缓冲增强剂nb、yf磁珠漂洗缓冲液b和试剂m;
19.所述的两套pcr引物,第一套pcr引物包括61对pcr引物,61 对引物的核酸序列如seq id no.1
‑
seq id no.61所示;
20.第二套pcr引物为通用引物,包括igt
‑
i5 index和igt
‑
i7 index, igt
‑
i5 index的核酸序列如seq id no.17所示,igt
‑
17 index的核酸序列如seq id no.18所示。
21.在一个优选的实施方案中,所述试剂盒还包括ddh20。
22.在一个优选的实施方案中,所述的试剂盒中,第一套引物的pcr 反应的反应体系按如下比例配制:igt
‑
em808聚合酶混合物10份、第一套pcr引物5份、扩增缓冲增强剂nb 3.5份、试剂m 2.5份、 gdna(ng/μl) ddh2o 9份。
23.在一个优选的实施方案中,第二套pcr反应的反应体系按如下比例配制:第一轮多重pcr产物13.5份、igt
‑
em808聚合酶混合物10 份、接头序列igt
‑
i5 index 1份(10μm)、接头序列igt
‑
17 index1 份(10μm)、试剂m2.5份、ddh2o 2份。
24.所述61对引物为:
25.26.27.28.[0029][0030]
所述第二套通用引物如下
[0031]
seq idindex序列名index序列no.17igt
‑
i5
‑
285ttgagctcno.18igt
‑
i7
‑
001tcgcatcg
[0032]
注:igt
‑
15 index和igt
‑
i7 inedx为分别艾吉泰康i5和i7端接头序列,接头序列是illumina测序平台所通用的接头序列,用作样本间的区分。
[0033]
本发明能够检测胃癌63个常见致病突变位点。
[0034]
所述63个位点的信息如下:
[0035]
[0036]
[0037][0038]
与现有技术相比,本发明具有如下有益效果:
[0039]
1)本发明的检测方法检测胃癌相关基因突变和现有技术相比,对待检测样品要求量低,可对血浆和血清中的极低dna样品进行分析;地毯式引物设计,可实现全编码区突变检测,不但能对已知突变进行分析,还能发现新的突变;成本低廉;灵敏度高;检测时间短,结合高通量测序技术,可短时间内实现全编码区突变检测。
[0040]
2)本发明的试剂盒可用于高灵敏度、高通量、低成本检测胃癌相关基因突变,协助临床医生实现肿瘤病人的个体化治疗,降低治疗风险以及患者负担。
附图说明
[0041]
图1为本发明样本c01利用实施例公开的引物组合制备的文库的质检峰图。
[0042]
图2为本发明样本c02利用实施例公开的引物组合制备的文库的质检峰图。
[0043]
图3为本发明样本c03利用实施例公开的引物组合制备的文库的质检峰图。
[0044]
图4为本发明样本c04利用实施例公开的引物组合制备的文库的质检峰图。
具体实施方式
[0045]
下面将结合附图以及具体实施例来详细说明本发明,在此本发明的示意性实施例以及说明来解释本发明,但并不作为对本发明的限定。
[0046]
本发明提供了一种检测胃癌相关基因突变的方法,虽然在某些情况下,对这些基因的检测对于相关癌症的诊断、预防和治疗有重要的辅助意义,但这些基因的突变不是必然导致所述疾病的发生,因此对这些基因的检测并不涉及疾病的诊断或治疗方法,另外,本发明的检测突变的方法还可以有许多其他用途,例如进行基因多态性分析和家族进化史研究。本发明的方法还可以用于非特定对象的样品研究,例如对混合血液制品进行检测。
[0047]
实施例1
[0048]
如图1
‑
4所示,本发明所述的一种筛查胃癌相关基因突变的方法和试剂盒,包括;
[0049]
1)捕获:进行第一轮特异性多重pcr反应,使用61对引物对样品dna进行扩增,所述61对pcr引物于t1试管进行反应,试管引物 61对seq id no.1
‑
seq id no.61;
[0050]
2)建库:进行第二轮接头pcr反应,使用接头序列为igt
‑
i5 index 和igt
‑
i7 index,对步骤1)获得的扩增产物进行扩增,得到多重 pcr文库;
[0051]
3)定量和质量检测:对步骤2)获得的多重pcr文库进行文库浓度测定,并对文库片段长度和纯度进行检测;
[0052]
4)测序:对步骤2)获得的多重pcr文库进行测序;
[0053]
5)分析:对步骤4)获得的测序结果进行分析,完成全编码区的突变检测。
[0054]
所述的两套pcr引物,第一套pcr引物包括61对pcr引物,第二套pcr引物为通用引物,包括igt
‑
i5 index和igt
‑
i7index。
[0055]
所述试剂盒还包括igt
‑
em808聚合酶混合物、扩增缓冲增强剂 nb、yf磁珠漂洗缓冲液b和试剂m,所述试剂盒中含有水。
[0056]
所述的试剂盒中,第一套引物的pcr反应的反应体系按如下比例配制:igt
‑
em808聚合酶混合物10份、第一套pcr引物5份、扩增缓冲增强剂nb3.5份、试剂m 2.5份、gdna(ng/μl) ddh2o 9份,第二套pcr反应的反应体系按如下比例配制:第一轮多重pcr产物 13.5份、igt
‑
em808聚合酶混合物10份、接头序列igt
‑
i5 index 1 份(10μm)、接头序列igt
‑
17index 1份(10μm)、试剂m2.5份、 ddh2o 2份。
[0057]
在本发明中,所述61对第一套pcr引物(seq id no.1
‑
seq idno.61),涵盖了胃癌高风险的63个snp位点,第二套pcr引物的为两条接头序列,为igr
‑
i5 index(seq id no.17)、igt
‑
i7 index(seqid no.18),接头序列是illumina测序平台所通用的接头序列,用作样本间的区分。
[0058]
本发明的多重pcr检测试剂盒的应用方法如下:
[0059]
1)提取待检测样品的dna(例如按照常规方法)作为模板;
[0060]
2)以第一套引物进行第一轮多重pcr扩增反应,在一个试管(t1 管)中进行;
[0061]
3)将pcr扩增产物通过磁珠进行纯化回收;
[0062]
4)用第一轮pcr回收的产物作为模板以第二套引物进行第二轮 pcr反应;
[0063]
5)将pcr扩增产物通过磁珠进行纯化回收;
[0064]
6)核酸定量仪文库浓度测定,全自动核酸蛋白分析系统检测文库片段长度和纯度;
[0065]
7)收集产物进行上机测序(例如第二代高通量测序);
[0066]
8)通过生物信息学分析鉴定胃癌相关基因是否发生了突变。
[0067]
其中,所述的多重pcr扩增反应条件优选如下:
[0068]
第一轮pcr反应扩增体系:
[0069]
反应体系t1管
[0070]
试剂体积(μl)igt
‑
em808聚合酶混合物10引物5扩增缓冲增强剂nb3.5试剂m2.5gdna(ng/μl) ddh2o9
[0071]
第一轮pcr反应扩增条件:
[0072][0073][0074]
第一轮pcr扩增后产物纯化:
[0075]
第1轮磁珠纯化
[0076]
1)向30μlpcr产物加入27μl室温平衡后的ampure xp 磁珠,用移液器轻缓吸打混匀20次,室温孵育5min后,将pcr 管置于磁力架上3min;
[0077]
2)彻底移除上清,将pcr管从磁力架上取下,加入50μl 9%yf buffer后用移液器轻缓吸打混匀20次,室温孵育5min后,将pcr管置于磁力架上3min;
[0078]
3)移除上清,将pcr管继续放置磁力架上,向管内加入 180ul 80%乙醇溶液,静置30s;
[0079]
4)移除上清,将pcr管继续放置磁力架上,向管内加入 180ul 80%乙醇溶液,静置30s后彻底移除上清;(建议使用10ul 移液器移除底部残留乙醇溶液)
[0080]
5)室温静置3
‑
5分钟,使残留乙醇彻底挥发;
[0081]
6)将pcr管从磁力架上取下,加入24ul nuclease
‑
free water洗脱,室温静置2min后,将pcr管置于磁力架上3min;
[0082]
7)用移液器吸取13.5ul上清,转移到新的200ulpcr管内,管内上清液为合并后的多重pcr产物。
[0083]
第二轮接头pcr扩增体系:
[0084]
试剂体积(μl)产物13.5igt
‑
em808聚合酶混合物10igt
‑
i5(10μm)1igt
‑
i7(10μm)1试剂m2.5ddh2o2
[0085]
第二轮pcr反应扩增条件:
[0086][0087]
第二轮pcr扩增后产物纯化:
[0088]
1)向30μl pcr产物加入27μl室温平衡后的ampure xp 磁珠,用移液器轻缓吸打混匀20次,室温孵育5min后,将pcr 管置于磁力架上3min;
[0089]
2)彻底移除上清,将pcr管从磁力架上取下,加入50μl 9%yf buffer后用移液器轻缓吸打混匀20次,室温孵育5min后,将pcr管置于磁力架上3min;
[0090]
3)移除上清,将pcr管继续放置磁力架上,向管内加入 180ul 80%乙醇溶液,静置30s;
[0091]
4)移除上清,将pcr管继续放置磁力架上,向管内加入 180ul 80%乙醇溶液,静置30s后彻底移除上清;(建议使用10ul 移液器移除底部残留乙醇溶液)
[0092]
5)室温静置3
‑
5分钟,使残留乙醇彻底挥发;
[0093]
6)将pcr管从磁力架上取下,加入24ul nuclease
‑
free water洗脱,室温静置2min后,将pcr管置于磁力架上3min;
[0094]
7)用移液器吸取20ul上清,转移到新的200ulpcr管内,管内上清液为制备好的文库。
[0095]
一、本发明多重pcr试剂盒的制备和组装
[0096]
1.两轮pcr引物的设计与配制
[0097]
1)第一轮61对pcr引物,每组各取1ul(单个引物浓度 1um),混匀;
[0098]
2)第二轮pcr引物各取1ul,单个引物浓度为10μm;
[0099]
3)所有引物均经过dna自动合成仪合成。
[0100]
2.试剂盒的组装
[0101]
1)igt
‑
em808聚合酶混合物:第一轮pcr 10ul,第二轮pcr 10ul;
[0102]
2)扩增缓冲增强剂nb:3.5ul;
[0103]
3)试剂m:第一轮pcr 2.5ul,第二轮pcr2.5 ul;
[0104]
4)第一轮pcr引物:5ul;第二轮pcr引物igt
‑
i5 1ul; igt
‑
i7 1ul。
[0105]
上述试剂为北京艾吉泰康公司所定制合成。
[0106]
二、本发明多重pcr试剂盒的应用实验
[0107]
1.检测样品
[0108]
所检测的样品来源于5位志愿者的血液以及唾液。
[0109]
2.检测方法
[0110]
dna提取:按照常规方法提取待检测样品的dna作为模板(dna 提取试剂盒采购自天根生化科技(北京)有限公司)。
[0111]
pcr扩增及纯化:
[0112]
第一轮pcr反应扩增体系同上文所述第一轮pcr反应扩增体系。
[0113]
第一轮pcr反应扩增条件同上文所述第一轮pcr反应扩增条件。
[0114]
第一轮pcr扩增后产物纯化步骤同上文所述第一轮pcr扩增后产物纯化。
[0115]
第二轮pcr扩增体系同上文所述第二轮pcr反应扩增体系。
[0116]
第二轮pcr反应扩增条件同上文所述第二轮pcr反应扩增条件。
[0117]
第二轮pcr扩增后产物纯化步骤同上文所述第一轮pcr扩增后产物纯化。
[0118]
定量和质量检测:使用核酸定量仪测定文库浓度,全自动核酸蛋白分析系统检测文库片段长度和纯度;
[0119]
3.检测结果
[0120]
1)文库浓度:
[0121][0122]
2)文库片段长度和纯度检测结果
[0123]
gdna起始量在10ng时rfu(荧光信号强度)值较高,纯度相对较弱但均为正常珠峰,当gdna起始量为40ng时文库主要为正常峰且 rfu值更好。
[0124]
鉴定结果见图1
‑
图4
[0125]
3)对pcr文库结果上机测序,并经过生物信息学分析。
[0126]
测序数据结果统计分析,按以下指标对测序数据的进行统计,以样本c01为例
[0127][0128][0129]
[0130]
全部样本的测序数据统计如下表所示:
[0131]
测序结果均检测合格。
[0132]
以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本发明实施例的原理以及实施方式进行了阐述,以上实施例的说明只适用于帮助理解本发明实施例的原理。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。