1.本发明属于抗成瘾药物领域。
背景技术:
2.氯胺酮,化学名称2
‑
(2
‑
氯苯基)
‑2‑
(甲氨基)环己酮,常用其盐酸盐形式,为白色结晶粉末。氯胺酮最早是作为一种非巴比妥类静脉麻醉药使用,具有安眠、镇痛作用,临床上主要用于小手术、小儿检查或诊断操作时麻醉诱导及辅助麻醉。人体静脉或肌肉注射后很快出现意识模糊,如入梦境,但仍可睁眼,肌张力增加呈木僵状,对周围环境的改变不再敏感,而痛觉却完全消失,意识和感觉分离。1971年,美国旧金山和洛杉矶市首先报告氯胺酮滥用病例。此后,毒贩们将制作成片剂、粉剂,登上街头毒品黑市交易中,由于其英文名为ketamine,又根据形状,人们取其首位字母,称其为“k粉”,为人熟知。
3.使用氯胺酮容易成瘾,危害身体健康,甚至滋生社会治安问题,因此国家对此管控强硬。但即便如此,氯胺酮非法滥用问题一直得不到解决,其中一个关键原因在于缺少治疗成瘾的药物。
4.mgll基因,也称为magl基因,即单酰甘油脂肪酶基因,它编码ab水解酶超家族的丝氨酸水解酶,其催化单酰基甘油酯向游离脂肪酸和甘油的转化。编码的蛋白质在几种生理过程中起着关键作用,包括通过内源性大麻素2
‑
花生四烯酸甘油酯的水解而引起的痛觉和痛觉。该基因的表达可能在癌症的肿瘤发生和转移中起作用。目前未见mgll与氯胺酮成瘾性之间的报道。
技术实现要素:
5.本发明要解决的问题是:提供一种治疗氯胺酮成瘾的药物。本发明的技术方案如下:
6.一种治疗氯胺酮成瘾的药物,所述药物以提高机体表达mgll基因的物质为活性成分。
7.进一步地,所述提高机体表达mgll基因的物质是过表达mgll的慢病毒、腺相关病毒或腺病毒。
8.进一步地,所述mgll的基因序列如seq id no.1所示。
9.进一步地,所述药物是提高机体纹状体mgll基因表达的药物。
10.进一步地,所述药物还包括药学上可接受的载体;
11.优选地,所述药物是注射制剂。
12.提高机体表达mgll基因的物质在制备治疗氯胺酮成瘾的药物中的用途。
13.进一步地,所述提高机体表达mgll基因的物质是过表达mgll的慢病毒、腺相关病毒或腺病毒。
14.进一步地,所述mgll的基因序列如seq id no.1所示。
15.进一步地,所述药物是提高机体纹状体mgll基因表达的药物。
16.进一步地,所述药物还包括药学上可接受的载体;
17.优选地,所述药物是注射制剂。
18.本发明首次发现mgll基因的表达与氯胺酮成瘾相关,过表达该基因可以显著降低氯胺酮成瘾。将提高机体表达mgll基因的物质用于制备治疗氯胺酮成瘾的药物,具有良好的产业前景和公益价值。
19.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
20.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
21.图1:qpcr定量数值及统计分析结果
22.图2:重组载体结构图谱。
23.图3:氯胺酮影响magl蛋白表达(蛋白印迹法)。
24.图4:氯胺酮影响magl表达(免疫荧光法)。
25.图5:dls脑区注射aav病毒示意图。
26.图6:aav
‑
mgll促进magl表达。
27.图7:aav
‑
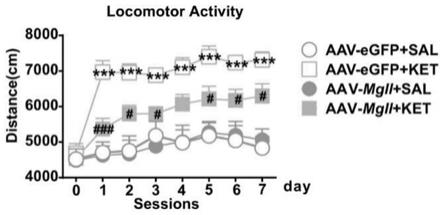
mgll影响氯胺酮诱导的自发活动。sal,生理盐水;ket氯胺酮。
28.图8:aav
‑
mgll影响氯胺酮自主给药行为。sal,生理盐水;ket氯胺酮;2
‑
ag,内源性大麻素主要信号分子,magl底物,激活cb1r和cb2r发挥镇痛、抗炎等多种生物学效应。
具体实施方式
29.腺相关病毒是常见的基因治疗药物载体,在本发明优选的实施方式中,采用过表达mgll的腺相关病毒作为治疗氯胺酮成瘾药物。
30.实验例1本发明aav
‑
mgll(过表达mgll的腺相关病毒)的构建
31.一、重组载体的制备
32.(一)载体信息:
33.质粒名称:h7286
34.基因名称:mgll,单酰甘油脂肪酶
35.基因种属:mus musculus
36.基因长度:912bp
37.基本方案:退火、酶切连接
38.(二)材料与方法
39.1、仪器设备
[0040][0041]
2、实验试剂
[0042][0043]
3、实验方法
[0044]
(1)根据靶基因mgll设计并合成过表达序列(seq id no.1)如下:
[0045]
atgcctgaggcaagttcacccaggcgaactccacagaatgttccctaccaggacctgcctcacctggtcaatgcagacggacagtacctcttttgtagatactggaagcccagtggcacacccaaggccctcatctttgtgtcccatggagctggggaacactgtggccgttatgatgagctggctcatatgttgaaggggctggacatgctggtatttgcccatgaccatgttggccatgggcagagtgagggagagaggatggtggtgtcggacttccaagtttttgtcagagatgtgctgcaacacgtggacaccatccagaaggactaccccgacgtccccatcttcctcctgggccactccatgggcggtgccatctccatcctagtggctgcaggaggccaacctacttttctggcatggtcctgatttcacctctggtccttgccaatccggaatctgcatcgactttgaaggtccttgctgccaaactgctcaattttgtcctgccaaatatgaccttggggcgcattgactccagcgtgctgtctcggaacaagtcggaggttgacctgtacaactctgacccactcgtctgccgagcagggctgaaggtgtgctttggcatacagctgctgaatgccgtcgcaagagtggagcgagcaatgcccaggctgacactgccattcctgctgctgcagggttctgctgaccggctttgcgacagcaaaggtgcctacctgctcatggaatcatcccggagtcaggacaaaacactcaagatgtatgaaggtgcctatcacgtcctccacagggagcttccggaagtgaccaactccgtcctccatgaagtaaactcgtgggtgtctcacaggatagcagcagcaggagctgggtgtccaccctga
[0046]
(2)pcr扩增目的基因:使用高保真的primestar酶扩增目的基因,反应体系和条件如下:
[0047][0048]
扩增引物如下:
[0049][0050]
pcr产物进行琼脂糖凝胶电泳检测扩增效果,并把目的基因条带从琼脂糖凝胶电泳后的胶中割下来,用takaraminibest agarose gel dna extraction kit ver.3.0做胶回收。
[0051]
(3)线性化表达载体的制备:
[0052]
用限制性内切酶对质粒进行酶切,酶切反应体系为:质粒2μg,10x反应buffer 5μl,限制性内切酶各1μl,用水补足50μl,于37℃水浴锅中孵育2h以上。酶切产物进行琼脂糖凝胶电泳检测酶切效果,并把目的载体条带从琼脂糖凝胶电泳后的胶中割下来,用takaraminibest agarose gel dna extraction kit ver.3.0做胶回收。
[0053]
(4)目的基因构建入线性化表达载体中:
[0054]
将目的基因片段和线性化载体以摩尔比2:1加到离心管中进行重组反应(20μl反应体系):
[0055][0056]
混匀后在37℃孵育30分种,然后转移到冰上放置5分钟。直接转化或者置于
‑
20℃保存等需要转化时解冻转化。
[0057]
(5)感受态细胞的制备和转化:
[0058]
a.取dh5α菌划线,过夜培养。划线方法:用100μl枪头在菌液中蘸一下,在平板上划s形,第二次从第一次一个角开始划,分一下,第三次从第二次划线一个角分一下,逐渐降低菌液浓度。
[0059]
b.用灭菌枪头挑圆形菌落于lb液体培养基中(试管中5ml),37℃,200rpm,振荡培养12h左右,直至对数生长期。
[0060]
c.将菌种接种在锥形瓶lb液体培养基中(1ml/100ml),37度200r/min,振荡培养2
‑
3h,至od600=0.4左右(可透过锥形瓶中菌液看报纸上的字,模糊可见即可)。
[0061]
d.分装到2个50ml离心管中,4℃,3000g,离心10min(离心前,离心机4℃预冷),弃上清。
[0062]
e.加10ml凉的0.1m cacl2于离心管中,重悬细胞沉淀,冰上摇匀10min。
[0063]
f.4℃,3000g,离心10min,弃上清(从离心机取出时离心管尽量不要摇动)。
[0064]
g.加10ml凉的0.1m cacl2于离心管中,重悬细胞沉淀,冰上摇匀30min。
[0065]
h.4℃,3000g,离心10min,弃上清。
[0066]
i.加入2ml(2ml/50ml初始菌液量)0.1m cacl2/15%甘油于50ml离心管中,轻轻摇匀。
[0067]
j.在每个灭过菌的ep管中装50μl~200μl菌液,
‑
80℃保存。
[0068]
k.在ep管中加入1.5ml菌液(2管)冰上10分钟,0~4度4000r/min离心2min,弃上清。
[0069]
l.加入0.1mol/l氯化钙0.6ml,缓和悬菌,冰上10min,4000r/min离心10min,弃上清。
[0070]
m.加入冰氯化钙0.2ml缓和悬菌,分四管,冰上待用(
‑
20℃保存)。
[0071]
n.具有抗生素抗性的质粒0.5~2μl放入100μl感受态细胞中,冰上30min.
[0072]
o.42℃热激90s,不要摇动管,立即放在冰上,冰上放置1~2min。
[0073]
p.加入1ml lb液体培养基至管中,37℃,200rpm,活化细菌30min~1h。
[0074]
q.取50ml菌液涂平板。如果转化效率低可以多取菌液或离心弃上清取下层涂板;涂菌棒在酒精灯上烘烤之后应搁置稍凉后再涂板。涂板时,感受态涂两个,有抗性,无抗性,转化后菌液涂一个有抗性。(涂板后的平板先正放一会,待菌液干燥后再倒置放于37℃培养箱中培养)
[0075]
(6)菌落pcr鉴定阳性转化子:
[0076]
挑取平板上长出的转化子重悬于10μl lb培养液中,取1μl作为模板进行菌落pcr鉴定。反应体系如下:
[0077]
[0078]
pcr循环条件如下:
[0079]
cycle 1:(1x)
[0080]
step 1:95.0℃ for 30s
[0081]
cycle 2:(40x)
[0082]
step 1:95.0℃ for 5s
[0083]
step 2:60.0℃ for 34s
[0084]
(7)阳性克隆送测序:
[0085]
菌落鉴定得到的阳性克隆,送测序公司进行测序验证。正向测序引物为catggtcctgctggagttcgtg(seq id no.6);反向测序引物为catagcgtaaaaggagcaaca(seq id no.7)。软件比对测序结果并分析。
[0086]
(8)质粒小提:根据axyprep质粒dna小量试剂盒说明书操作。
[0087]
a.取1
‑
4ml在lb培养基中培养过夜的菌液(若使用丰富培养基,菌液体积应减半或更少),12000g离心1min,弃尽上清。
[0088]
b.加250μl buffer s1悬浮细菌沉淀,悬浮需均匀,不应留有小的菌块。
[0089]
c.加250μl buffer s2,温和并充分地上下翻转4
‑
6次混合均匀使菌体充分裂解,直至形成透亮的溶液。此步骤不宜超过5min。
[0090]
d.加350μl buffer s3,温和并充分地上下翻转混合6
‑
8次,12000g离心10min。
[0091]
e.吸取步骤4中的离心上清并转移到制备管(置于2ml离心管(试剂盒内提供)中),12000g离心1min,弃滤液。
[0092]
f.将制备管置回离心管,加500μl buffer w1,12000g离心1min,弃滤液。
[0093]
g.将制备管置回离心管,加700μlbuffer w2,12000g离心1min,弃滤液;以同样的方法再用700μl buffer w2洗涤一次。弃滤液。
[0094]
h.将制备管置回2ml离心管中,12000g离心1min。
[0095]
i.将制备管移入新的1.5ml离心管(试剂盒内提供)中,在制备管膜中央加60
‑
80μl eluent或去离子水,室温静置1min。12000g离心1min。
[0096]
(三)结果
[0097]
1、质粒pcr检测结果:可见与过表达对照质粒h3909转染细胞组相比,过表达质粒h7286转染细胞组中mgll(magl)基因的表达量为227906034.75%(图1)。
[0098]
2、质粒测序结果:重组载体结构图谱如图2所示,测序结果可见mgll表达正确。
[0099]
测序结果显示序列(seq id no.8)如下:
[0100]
cgagctgtacaagggctccggagccacgaacttctctctgttaaagcaagcaggagacgtggaagaaaaccccggtccggctagcatgcctgaggcaagttcacccaggcgaactccacagaatgttccctaccaggacctgcctcacctggtcaatgcagacggacagtacctcttttgtagatactggaagcccagtggcacacccaaggccctcatctttgtgtcccatggagctggggaacactgtggccgttatgatgagctggctcatatgttgaaggggctggacatgctggtatttgcccatgaccatgttggccatgggcagagtgagggagagaggatggtggtgtcggacttccaagtttttgtcagagatgtgctgcaacacgtggacaccatccagaaggactaccccgacgtccccatcttcctcctgggccactccatgggcggtgccatctccatcctagtggctgcagagaggccaacctacttttctggcatggtcctgatttcacctctggtccttgccaatccggaatctgcatcgactttgaaggtccttgctgccaaactgctcaattttgtcctgccaaatatgaccttggggcgcattgactccagcgtgctgtctcggaacaagtcggaggttgacctgtacaactctgacccactcgtc
tgccgagcagggctgaaggtgtgctttggcatacagctgctgaatgccgtcgcaagagtggagcgagcaatgcccaggctgacactgccattcctgctgctgca
[0101]
二、病毒包装和滴度测定
[0102]
(一)质粒信息:aov004 paav
‑
cag
‑
egfp
‑
2a
‑
mgll
‑
3flag,其中aov004作为代号,没有实际意义,而paav
‑
cag
‑
egfp
‑
2a
‑
mgll
‑
3flag体现了腺相关病毒载体以及载体上的主要功能性片段:paav为腺相关病毒载体,cag为cag启动子,egfp是一种荧光蛋白基因,2a为自剪切2a肽,mgll即mgll基因,3flag为蛋白纯化标签序列。
[0103]
(二)材料与方法
[0104]
1、仪器设备
[0105][0106][0107]
2、实验试剂
[0108][0109]
3、实验方法
[0110]
(1)转染:
[0111]
转染前检查两天前传代的宿主细胞,它们应当达到70
‑
80%的汇合度;从
‑
20℃冰箱中取出共转染的质粒,用ph7.5 te缓冲液将质粒的浓度调整到1mg/ml。取10μl质粒(10μg)到1.5ml的ep离心管中,然后加入1ml的0.3m cacl2,轻轻混合。吸取1ml的2x hbs溶液到另一个15ml锥底管中,向其中滴加dna/cacl2混合液(上一步)。通过翻转或是反复吹打温和混匀。立即将混合后的dna/cacl2/hbs溶液滴加到细胞培养盘上。加入的同时轻轻晃动细胞培养盘,使得溶液尽量均一的分布在培养基中。将细胞培养盘放回到37℃培养箱放置6小时,转染结束后,将盘中的培养基替换为10ml新鲜的培养基。将培养盘送回到孵箱中,另外
培养66
‑
72小时。通过观察aav
‑
293细胞的形态变化可以得知aav颗粒的包装进行程度。病毒包装成功的最明显的征兆是培养基的颜色由红色变为橙色或黄色(与阴性对照比)。随着出毒的进行,有些细胞会圆。
[0112]
将产毒的细胞连同培养基一同收集到一个15ml的离心管中。收集细胞时,将培养盘倾斜一定角度将细胞刮到培养基中,200g离心3分钟,分离细胞和上清,将上清另外存放,细胞用1ml pbs重悬。将细胞悬浮液在干冰乙醇浴和37℃水浴中反复转移,冻融四次。每次融解后稍加震荡。注意:每次凝固和解冻大概需要十分钟的时间。10,000g离心去除细胞碎片,将离心上清转移到一个新离心管中。
[0113]
(2)aav病毒的浓缩:
[0114]
在上清中加入40%peg8000直到终浓度为8%,在冰上放置2小时后(每个15分钟来回混匀一次),2500g离心30分钟。去掉上清液,沉淀用pbs重悬后与细胞裂解上清合并。3000g离心30分钟,将上清转移到另一个干净的管中。此时上清中不应该有可见的细胞碎片。如果仍有部分碎片,则再次离心。加入benzonase核酸酶消化去除残留的质粒dna(终浓度为50u/ml)。合上管盖,颠倒几次用0.45μm过滤头过滤,取滤出液。
[0115]
(3)aav的纯化:
[0116]
向病毒浓缩液中添加固体cscl直到密度为1.41g/ml(折射率为1.372),大概是10ml病毒液中加6.5g cscl,振荡使之溶解。将样品加入到超速离心管中,用预先配好的1.41g/ml cscl溶液将离心管剩余空间填满。在175,000g下离心24小时,以形成密度梯度。按顺序分步收集不同密度的样品,取样进行滴度测定。收集富集有aav颗粒的组分,重复上述过程一次。在amicon
‑
15超滤装置中加入4ml去离子水,充分混合,在37℃孵育30分钟。将密度梯度离心得到的病毒液加入到超滤装置中。加pbs到总体积为4ml,盖上盖子过滤。将滤除液收集到一起以便做消毒处理,将滤膜放回到装置中。pbs稀释浓缩后的病毒使体积为4ml。离心超滤管,使最终体积大约为0.5ml。病毒的保存在病毒浓缩液中加入甘油使得终浓度为5%。分装后保存在
‑
80℃。病毒被命名为aav
‑
mgll。
[0117]
以下用实验例的方式验证本发明的有益成果。
[0118]
实验例1 aav
‑
mgll抑制氯胺酮成瘾
[0119]
一、材料
[0120]
仪器设备如下:
[0121][0122]
实验试剂及耗材:
[0123][0124]
二、实验方法
[0125]
(1)脑立体定位腺相关病毒注射手术
[0126]
a.小鼠用1%戊巴比妥钠(75mg/kg体重)麻醉,头顶部备皮。
[0127]
b.固定上颌:先将小鼠门齿卡在适配器门齿夹上,轻轻压上门齿夹横杆,调整适配器高度和前后,方便耳杆进入小鼠外耳道,且调整定位仪的门齿杆位置低于水平线3.3
±
0.4cm,即达到颅骨水平位。
[0128]
c.插入耳棒:先将一侧耳棒轻轻插入外耳道,碰到骨性外耳道底后固定耳棒,继之同样插入固定另一耳棒。检查小鼠头部固定是否稳定,两侧耳棒刻度是否对称,调整耳棒使两侧刻度一致、头位完全居中,再次固定耳棒。耳棒固定成功标准:鼻对正中,头部不动,提尾不掉。
[0129]
d.手术暴露颅骨:75%酒精棉球作头部皮肤消毒,沿矢状缝作切口,剥离筋膜和肌肉,推开骨膜,并用3%双氧水消毒,干棉球擦拭以暴露骨缝、止血。
[0130]
e.定位:根据确定的注射脑区的位置参数(背外侧纹状体:ap 0.6mm;ml
±
2.65mm;dv
‑
3.5mm),以前囟bregma为零点,移动颅骨钻,用笔标记处核团的位置范围,再根据该范围
的大小打开合适的骨窗(窗口尽量小但是又不妨碍实验)。小心地用颅骨钻在注射位点处轻磨颅骨,将颅骨慢慢打薄,当颅骨出现裂缝的时候,用医用注射器的针头小心挑破颅骨,如果在此过程中有出血,可以用很小的医药棉球拉成长条形将血吸走。钻孔控制好力度,以免损伤脑组织。
[0131]
f.用pbs冲洗微量注射器(5μl规格)3
‑
5次,洗干净后在空气中测试注射器是否通畅。然后先吸取1μl空气,再吸取1μl稀释好的病毒(方便病毒充分注射进脑)。将微量注射泵,微量注射器组装好,并置于骨窗上方,针尖与颅骨平行(z=0),微调注射器位置与之前钻孔时位置相同,根据定好的深度将注射针缓慢下降。以0.1μl/min速率往单侧dls脑区注射0.5μl aav病毒。保留10分钟,一方面让病毒扩散,一方面防止病毒随着针拔出而漏出核团。dls脑区双侧注射病毒。
[0132]
g.缝合头顶部伤口。术后恢复7天。经过此手术的动物用于研究dls区注射aav
‑
mgll过表达病毒调控氯胺酮成瘾行为学检测。
[0133]
(2)小鼠自发活动模型:
[0134]
a.实验前3天,每天由同一操作人员对小鼠进行抚摸,让动物适应操作人员。
[0135]
b.将小鼠放入自发活动箱体内,让动物在箱体内自由活动,每天15min,适应性训练三天后,测试小鼠15min内的活动距离作为自发活动基础值。
[0136]
c.每天约同一时间腹腔注射氯胺酮(15mg/kg)或生理盐水(连续7天,每天1次)后,将小鼠放入自发活动箱内,记录15min内小鼠的活动距离,结果以均数
±
标准差做折线图表示。
[0137]
(3)小鼠自主给药模型:
[0138]
a.小鼠颈静脉插管滞留术:
[0139]
(a)手术前3
‑
5天,实验动物每天与实验人员接触以适应实验人员,避免实验动物在手术及实验过程中产生应激反应。
[0140]
(b)制备颈静脉插管:将进口硅胶软管置于匹配的硅胶硬管(外径0.48mm,内径0.40mm)前端,保护血管不被硬管损伤。
[0141]
(c)根据小鼠体重腹腔注射戊巴比妥钠(1%,75mg/kg bw)麻醉动物,对背部胛骨部和颈部左侧锁骨部位备皮后,固定小鼠,使其头部朝向手术者。
[0142]
(d)在左锁骨上缘部位开一个纵向约1cm切口,钝性分离皮下组织,游离左侧颈外静脉,整个过程可滴少量生理盐水,防止干燥。
[0143]
(e)结扎颈外静脉远心端,用眼科剪在静脉上斜开口,迅速轻柔插入颈静脉插管,固定插管。
[0144]
(f)自背部经颈部皮下打一个皮下隧道到颈部切口,将颈静脉插管另一端从背部穿出并固定,以便与给药装置线连接。
[0145]
(g)用少量肝素钠溶液(25u/ml)和抗生素(160000u/ml,0.1ml/只小鼠)经背颈部插管注入体内,并用生理盐水冲洗防止残留,确保导管通畅后,用导管盖套在插管末端,缝合背部和颈部伤口。
[0146]
(h)手术结束后,将小鼠保温至苏醒,然后将小鼠放入干净笼中,单笼饲养。
[0147]
(i)从手术后第二天开始,每天经插管注射少量肝素钠和抗生素,保证插管通畅,防止伤口感染。术后恢复7天,硫喷妥钠通管实验证实管道畅通后的动物可用于氯胺酮静脉
自主给药成瘾模型。
[0148]
b.小鼠颈静脉自主给药模型:
[0149]
(a)实验前3天,每天由同一操作人员对小鼠进行抚摸,让动物适应操作人员。
[0150]
(b)将小鼠放入静脉自主给药箱内,让动物在箱体内自由活动,每天30min,适应性训练三天。
[0151]
(c)每天约同一时间,将小鼠放入静脉自主给药箱内,采用固定比率1(fix ratio1,fr1)程序进行训练,即一次有效鼻触触发一次泵药。每天训练120min。左侧鼻触为有效鼻触,即鼻触可以诱发泵药。生理盐水对照组获得生理盐水,氯胺酮组获得氯胺酮(0.75mg/kg)。每次泵药后,设备有20s不应期。最大泵药次数为100次,超过100次有效鼻触也不触发泵药。右侧鼻触为无效鼻触,即鼻触不能触发泵药。每次实验结束后清理操作箱及盛装垫料的托盘,并用医用酒精擦拭操作箱,起到消毒与去除动物气味的作用。
[0152]
(d)连续训练10天,判断模型是否成功:形成操作式条件反射;氯胺酮摄取频率稳定;该动物连续三天有效鼻触和摄取频率(injections)波动不超过15%。
[0153]
(4)蛋白提取:
[0154]
a.取
‑
80℃冻存的脑组织,加入适量100μl蛋白裂解液(按比例加入蛋白酶抑制剂和dtt),置于冰上裂解10分钟。
[0155]
b.冰浴超声破碎组织至无明显肉眼可见颗粒。
[0156]
c.4℃以13000g离心15min,收集清液,冰浴。
[0157]
d.采用碧云天bradford蛋白定量试剂盒进行蛋白定量:首先,稀释bsa至1,0.5,0.4,0.3,0.2,0.1,0.05,0mg/ml浓度梯度;然后将提取的蛋白液按照伏膈核(1:10稀释),纹状体(1:50稀释),海马(1:50稀释)以及前额皮质(1:10稀释)稀释,bsa和蛋白样品分别加入10μl至相应孔内。测定前,在各孔中加入200μl考马斯亮蓝g250,595nm测定吸光度值,bsa标准曲线现行相关性为r2>0.99为合格定量标准,然后计算出对应的蛋白浓度。
[0158]
e.用蛋白裂解液调整样本至统一浓度。
[0159]
f.每个样本加入蛋白上样缓冲液(含β
‑
巯基乙醇),煮沸样品5min,分装,储存于
‑
20℃备用。
[0160]
(5)蛋白印迹:
[0161]
a.配胶:按下表2
‑
6和表2
‑
7分别配制10%的分离胶和5%的浓缩胶。
[0162]
b.电泳:每空蛋白上样量为20
‑
30μg,上样体积为10μl,80v电压压缩蛋白样本至分离胶界限处后,将电压增加至120v,直至目的蛋白完全分离。
[0163]
c.转膜:电泳即将结束前,将大小适中的pvdf膜置于甲醇中浸泡10s活化后,与6张同等大小的滤纸一起置于转膜缓冲液中备用。电泳结束后,将凝胶、滤纸和pvdf膜按照(黑面)海绵
‑
3张滤纸
‑
凝胶
‑
pvdf膜
‑
3张滤纸
‑
海绵(红面)的顺序制成转膜“三明治”结构,排除各层间的气泡,并置于转膜夹内,以100v电压恒压转膜,转膜时间根据蛋白大小而定。
[0164]
d.封闭:转膜完成后,用tbst配制的5%的脱脂牛奶室温封闭1小时。
[0165]
e.抗体孵育和洗膜:将一抗用抗体稀释稀释到需要的比例,充分包裹pvdf膜,4℃孵育过夜。第二天用tbst洗膜三次,每次10min。根据一抗源性,稀释相应的第二抗体,室温孵育2h,结束后用tbst洗膜二次,每次10min,然后用tbs洗膜一次,10min。
[0166]
f.曝光:pvdf膜上均匀滴加显影液,用chemiscope mini曝光系统进行曝光。
[0167]
g.数据处理:用chemianalysis系统读取免疫印迹胶片各条带的灰度值,用β
‑
actin和gapdh条带灰度平均值作为内参进行标准化比较。
[0168]
(6)组织免疫荧光
[0169]
a.复温:从冰箱取出待用脑组织切片,室温放置15分钟。
[0170]
b.洗片:用含有0.2%triton
‑
100的磷酸盐缓冲液(phosphate buffered saline,pbs液)(pbs
‑
tx)洗涤切片3次,每次10min。
[0171]
c.封闭:用含有10%驴血清的pbs
‑
t
x
封闭液室温封闭1h。
[0172]
d.抗体孵育和洗片:用pbs
‑
tx配制一抗(不同抗体稀释比例不同,详见表2
‑
1),置于湿盒、4℃孵育过夜。第二天室温复温1h后pbs洗片3次,每次10min。随后用pbs
‑
tx按照1:400比例配制荧光二抗,置于湿盒、室温避光孵育2h。结束后pbs避光洗片4次,每次15min。
[0173]
e.封片:待切片自然风干片刻后滴加含有dapi染料的封片剂,小心盖上盖玻片(避免产生气泡)。切片可在4℃暂时储存,1周内完成拍照。
[0174]
f.拍片及数据分析:采用尼康a1rmp 双光子共聚焦显微镜拍摄、采图,采用image j分析荧光数据。
[0175]
(7)统计分析:
[0176]
用graphpadprism7.0软件进行分析。比较两个实验组的统计学差异,使用student’st检验;比较三个及以上的实验组使用单因素方差分析(oneway anova)以及tukey post hoc test方差后分析进行检验。对自发活动和静脉自主给药两个模型的行为学结果,采用重复测量数据双因素方差分析(2way anovas)以及dunnett's multiple comparisons test方差后分析。所有结果均以mean
±
s.e.m(*p<0.05,**p<0.01,***p<0.001)表示。
[0177]
三、实验结果
[0178]
1、氯胺酮成瘾小鼠背侧纹状体的magl(即mgll)表达:
[0179]
氯胺酮显著减少背侧纹状体magl的表达(非配对双尾t检验,*p<0.05),详见图3和图4。
[0180]
2、背外侧纹状体注射aav
‑
mgll病毒表达效果:
[0181]
dls脑区注射aav示意图如图5所示,与注射aav
‑
gfp组相比,注射aav
‑
mgll组背外侧纹状体magl蛋白表达也显著升高,详见图6(非配对双尾t检验,***p<0.001))。
[0182]
3、背外侧纹状体注射aav
‑
mgll病毒对小鼠自发活动的影响:
[0183]
注射aav
‑
gfp组的小鼠,氯胺酮可增强小鼠自发活动;注射aav
‑
mgll病毒后,氯胺酮诱导的自发活动减少,详见图7(双因素方差分析,n=10/组,与aav
‑
egfp 生理盐水组相比,***p<0.001;与aav
‑
egfp 氯胺酮组相比,#p<0.05,###p<0.001)。
[0184]
4、背外侧纹状体注射aav
‑
mgll病毒对小鼠自主给药的影响:
[0185]
注射aav
‑
gfp组的小鼠,氯胺酮可以诱导小鼠静脉自主给药行为,小鼠觅药行为(即有效鼻触active nose
‑
poke)和摄药量(injection)较生理盐水组显著增加;注射aav
‑
mgll小鼠觅药行为减少,摄药次数减少,详见图8(双因素方差分析,n=10/组,与aav
‑
egfp 生理盐水(sla)组相比,**p<0.01,***p<0.001;与aav
‑
egfp 氯胺酮(ket)组相比,#p<0.05,##p<0.01,###p<0.001)。
[0186]
四、结论
[0187]
实验表明,提高机体表达mgll,可显著减轻氯胺酮成瘾的自主给药行为,治疗氯胺酮成瘾。
[0188]
综上,本发明中提高机体表达mgll的重组质粒以及包含该质粒的腺相关病毒,可有效弱化氯胺酮奖赏行为,减轻自发活动和自主给药,治疗氯胺酮成瘾,临床应用前景良好。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

