1.本发明属于生物医药领域,涉及一种囊泡的制备方法及其应用。
背景技术:
2.细胞外囊泡(extracellular vesicles,evs)是细胞分泌的含有蛋白质、核酸及各种细胞因子的纳米级载体。细胞外囊泡可以通过内分泌或旁分泌的方式作用于靶细胞,在细胞间物质传递和信息交流过程中发挥了重要作用。研究发现,细胞外囊泡所介导的信息交流在机体生理或病理过程中发挥了重要的调控作用,涉及到免疫调节、肿瘤生长、血管生成、损伤修复等。细胞外囊泡是细胞间通讯的重要媒介,使得细胞内地生物活性分子从一个细胞转移到另一个细胞从而发挥功能。因此,越来越清楚的是,这些囊泡参与许多生理过程,这将为疾病的治疗提供了应用的机会。
3.目前该领域的研究主要集中在外泌体(exosomes)方向。外泌体是直径在30-150nm左右的细胞外囊泡,其内含有rna、脂质和蛋白质等成分。外泌体广泛参与了机体的各种生理/病理性调控,能够用作多种疾病的诊断、治疗和预后评估。迄今为止,间充质干细胞 (mesenchymal stem cells,mscs)被认为是产生外泌体能力最强的细胞。众多的研究发现 mscs来源的外泌体能模拟mscs的生物学功能,在促进细胞生长和分化,修复组织缺损等方面发挥了重要的调控作用。因此,近年来以mscs来源的外泌体为基础的细胞囊泡疗法取得了显著的发展。然而,目前以外泌体为基础的细胞囊泡治疗仍然存在诸多问题,主要表现在外泌体的提取和纯化过程复杂,耗时长,对设备和试剂的要求较高,生理性外泌体产量较低等等,这些缺陷都限制了外泌体治疗的临床转化和应用。
4.急性呼吸窘迫综合征(ards)自首次被描述以来,一直受到人们的关注,被认为是呼吸医学的主要临床问题,具有较高的发病率和死亡率。ards是由于肺内或/和肺外各种原因引起的、以肺损伤为主要表现的临床综合征,临床表现的显著特征是进行性呼吸困难和顽固性低氧血症。引起ards的肺内原因有重症肺炎、溺水误吸、肺挫伤、有毒物质吸入等,肺外原因有严重感染、严重外伤、休克、重症胰腺炎、中毒、大手术、心肺复苏后等,它们共同的病理基础是急性肺损伤。除了众所周知的ards的危险因素外,暴露于高臭氧水平和低维生素d血浆浓度也被发现是易感环境。ards治疗费用昂贵,然而目前除保护性肺通气、治疗原发病及支持治疗方法外,仍缺乏针对性治疗手段。基于最新研究,尽管ards总体生存率正在提高,但考虑到几项观察研究的住院死亡率,这可以解释为危险因素、诊断的可用性、识别ards的能力以及影响临床诊断的一些选择偏差试验,这些数据表明ards在世界范围内仍处于诊断不足和治疗不足的状态,目前对ards的定义在大多数临床情况下是不充分的。基于药物的预防战略仍然是一个重大挑战,一些最近的研究致力于改善这种疾病急性呼吸窘迫综合征的预后,但高死亡率和高致残并发症仍然有待改善。
5.结肠炎又称非特异性溃疡性结肠炎,其种类繁多,引发原因多样,并且起病多缓慢,病情轻重不一,主要临床表现腹泻、腹痛、粘液便及脓血便、里急后重、甚则大便秘结、数日内不能通大便,时而腹泻时而便秘,常伴有消瘦乏力等,多反复发作。腹痛一般多为隐痛
或绞痛,常位于左下腹或小腹。其它表现有食欲不振、腹胀、恶心、呕吐及肝大等,左下腹可有压痛,有时能触及痉挛的结肠。常见的全身症状有消瘦、乏力、发热、贫血等。有少部分病人在慢性的病程中,病情突然恶化或初次发病就呈暴发性,表现严重腹泻,给人或动物带来极大的痛苦。
技术实现要素:
6.一些实施方案中,本发明提供了一种制备囊泡的方法,所述方法包括通过外力诱导来源于人血液的样品凋亡而产生所述囊泡,所述外力包括添加双氧水。
7.一些实施方案中,所述血液为含有血细胞的血液样品。
8.一些实施方案中,所述样品包含人源外周血单个核细胞。
9.外周血单个核细胞(peripheral blood mononuclear cell,pbmcs)是外周血中具有单个核的细胞,包括淋巴细胞和单核细胞,是一个有用的细胞来源,因其收集容易,为临床应用提供了方便。单个核细胞的体积、形态和比重与外周血其他细胞不同,红细胞和多核白细胞的比重在1.092左右,单个核细胞的比重为1.075-1.090,血小板为1.030-1.035。因此利用一种介于1.075-1.092之间而近于等渗的溶液作密度梯度离心,使一定密度的细胞按相应密度梯度分布,可将各种血细胞与单个核细胞分离。
10.一些实施方案中,所述双氧水的浓度为20~2000μm。
11.一些实施方案中,所述双氧水的浓度为50~1500μm。
12.一些实施方案中,所述双氧水的浓度为50~1200μm。
13.一些实施方案中,所述双氧水的浓度为50~1000μm。
14.一些实施方案中,所述双氧水的浓度为100~1200μm。
15.一些实施方案中,所述双氧水的浓度为100~1000μm。
16.一些实施方案中,所述双氧水的浓度为100~800μm。
17.一些实施方案中,所述双氧水的浓度为100~500μm。
18.一些实施方案中,所述双氧水的浓度为100~400μm。
19.一些实施方案中,所述双氧水的浓度为100~300μm。
20.一些实施方案中,所述双氧水的处理时间为4~30h。
21.一些实施方案中,所述双氧水的处理时间为5~25h。
22.一些实施方案中,所述双氧水的处理时间为8~25h。
23.一些实施方案中,所述双氧水的处理时间为10~25h。
24.一些实施方案中,所述双氧水的处理时间为12~25h。
25.一些实施方案中,所述双氧水的处理时间为12~20h。
26.一些实施方案中,所述囊泡为诱导性囊泡。
27.一些实施方案中,本发明提供的这种以外周血为样品,采用双氧水处理的方法获得的所述囊泡由于诱导后所述的双氧水可以分解变成水和氧气,因此,无需担心试剂残留的问题。具有采样方便,来自自体,在体外获得诱导性囊泡之后可以直接再用回原个体的体内,因而具有极好的可操作性和安全性。
28.一些实施方案中,所述囊泡对annexinv,integrin alpha 5和syntaxin 4表达呈阳性。
29.一些实施方案中,所述囊泡的直径为0.03-6μm。
30.一些实施方案中,所述囊泡的直径为0.03-4.5μm。
31.一些实施方案中,所述囊泡的直径为0.03-1μm。
32.一些实施方案中,所述囊泡的直径为0.04-1μm。
33.一些实施方案中,所述囊泡的直径为0.05-1μm。
34.一些实施方案中,所述囊泡的直径为0.1-1μm。
35.一些实施方案中,所述囊泡的直径为0.15-1μm。
36.一些实施方案中,所述方法还包括对所述的囊泡进行提取。
37.一些实施方案中,所述的方法包括以下步骤:(1)获得外周血单核细胞,进行培养; (2)在培养基中,对所述的外周血单核细胞进行热处理,诱导所述囊泡的释放;(3)收集步骤(2)的培养基上清,分离出所述囊泡。
38.一些实施方案中,通过选自由聚合物沉淀、免疫分离、磁免疫捕获、超速离心、密度梯度离心、尺寸排阻色谱、超滤、超速离心、密度梯度离心、尺寸排阻色谱、超滤和它们的组合所组成的组中的方法从培养基中分离所述囊泡。
39.一些实施方案中,所述分离囊泡的方法包括以annexin v、integrin alpha 5和syntexin 4 为标志物进行分离。
40.一些实施方案中,通过选用超速离心的方法分离所述囊泡。
41.在一些实施方案中,所述超速离心的方法分离所述囊泡的步骤包括:(a)将收集到的培养上清进行第一次离心,取上清;(b)将步骤(a)中收集到的上清进行第二次离心,取上清;(c)将步骤(b)中收到的上清进行第三次离心,取沉淀;(d)将步骤(c)中收到的沉淀进行第四次离心,取沉淀。
42.在一些实施方案中,所述第一次离心为500-1500g离心5-30分钟;或者所述第一次离心为500-1000g离心5-20分钟;或者所述第一次离心为500-900g离心5-15分钟;或者第一次离心为800g离心5-10min。在一些实施方案中,所述第二次离心为1000-3000g离心5
‑ꢀ
30分钟;或者所述第二次离心为1500-2500g离心5-20分钟;或者所述第二次离心为1500
‑ꢀ
2200g离心5-15分钟;或者所述第二次离心为2000g离心5-10分钟。在一些实施方案中,所述第三次离心为10000-30000g离心15-60分钟;或者所述第三次离心为12000-25000g离心20-60分钟;或者所述第三次离心为12000-20000g离心20-40分钟;或者所述第三次离心为16000-16500g离心30-35分钟。在一些实施方案中,所述第四次离心为10000-30000g离心15-60分钟,或者所述第四次离心为12000-25000g离心20-60分钟;或者所述第四次离心为12000-20000g离心20-40分钟;或者所述第四次离心为16000-16500g离心30-35分钟。
43.一些实施方案中,所述乙醇的浓度为50~500nm。
44.一些实施方案中,所述乙醇的浓度为100~500nm。
45.一些实施方案中,所述乙醇的浓度为100~300nm。
46.一些实施方案中,所述乙醇的处理时间为4~30h。
47.一些实施方案中,所述乙醇的处理时间为8~25h。
48.一些实施方案中,所述乙醇的处理时间为12~20h。
49.一些实施方案中,所述紫外照射为紫外交联仪200~500mj/cm2处理1~8h。
50.一些实施方案中,所述紫外照射为紫外交联仪200~400mj/cm2处理2~6h。
51.一些实施方案中,所述紫外照射为紫外交联仪200~350mj/cm2处理2~5h。
52.一些实施方案中,本发明提供了一种所述的方法获得的囊泡。
53.一些实施方案中,本发明提供一种药物组合物,包括所述的囊泡以及药学上可接受的辅料;
54.一些实施方案中,所述药物组合物的制剂形式选自冻干粉针、注射剂、片剂、胶囊、或贴剂。
55.一些实施方案中,本发明提供了所述的囊泡在制备治疗或预防或改善疾病或所述疾病并发症的产品中的应用。
56.一些实施方案中,所述产品包括药品、食品、保健品、化妆品、添加剂或中间品。
57.一些实施方案中,所述疾病包括肺部疾病或肠道疾病。
58.一些实施方案中,所述肺部疾病为急性呼吸窘迫综合症。
59.一些实施方案中,所述肠道疾病为肠炎。
附图说明
60.图1为使用福麦斯pbmc分离管分离人源pbmc的过程。
61.图2为ficoll-hypaque密度梯度离心分离pbmc的过程。
62.图3为人源pbmc凋亡状态图。
63.图4为ievs提取标准化流程技术路线图。
64.图5为利用流式细胞技术对提取的ievs进行分析。其中:图5a为ievs的颗粒直径分布图。图5b为人源pbmcs在不同诱导条件下产出ievs的纳米粒子跟踪分析(nta)结果。图5c 为鼠源pbmcs在不同诱导条件下产出ievs的纳米粒子跟踪分析(nta)结果。
65.图6为流式细胞技术对分离提取的pbmcs以及pbmcs来源的ievs的表面膜蛋白进行分析的结果。
66.图7为利用蛋白印记验证不同方式诱导得到的pbmc-ievs的蛋白内容物表达的结果。
67.图8为pbmcs来源的ievs治疗急性呼吸窘迫综合症的肺组织的he染色结果。
68.图9为pbmcs来源的ievs治疗急性呼吸窘迫综合症的肺组织的肺的湿/干重比结果。
69.图10为pbmcs来源的ievs治疗肠炎的结果。其中:图10a显示ievs治疗显著减轻了dss 诱导的结肠炎小鼠体重减轻的趋势。图10b显示ievs治疗显著缓解dss诱导导致结肠长度显着减少,严重的结肠上皮和隐窝破坏以及炎性细胞的大量浸润的症状。图10c为he染色图显示ievs能抑制dss诱导的肠炎。
70.图11为pbmc来源的ievs能诱导肠炎小鼠cd3 t细胞的凋亡。
71.图12为pbms来源的ievs能抑制肠炎小鼠th17细胞的激活。
具体实施方式
72.以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
73.本发明实施例中的ievs为诱导性囊泡的简称,可称为诱导性囊泡,也可称为诱导性细胞外囊泡(induced extracellular vesicles,ievs)。诱导性细胞外囊泡是指的是一种在前体细胞 (例如干细胞)正常存活时,被干预或诱导,使其凋亡产生的一类亚细胞产物。通常这一类亚细胞产物,具有膜结构,表达凋亡性标志物,部分包含有遗传物质dna。发明人发现诱导性细胞外囊泡是区分于细胞和常规细胞外囊泡(如外泌体等)的一类物质。在在一些实施方案中,所述的正常存活时的细胞,例如是非凋亡的细胞、非衰老的细胞、非老化而增殖停滞的细胞、非冻存后复苏的细胞、非发生恶变而异常增殖的细胞或非出现损伤的细胞等。在一些实施方案中,所述的正常存活时的细胞取自细胞培养过程中,细胞接触融合80-100%的时候的细胞。在一些实施方案中,所述的正常存活时的细胞取自对数期细胞。在一些实施方案中,所述的正常存活时的细胞取自人或鼠组织来源的原代培养及其传代培养细胞。在一些实施方案中,所述的正常存活时的细胞取自已确立的细胞系或细胞株。在一些实施方案中,所述的前体细胞取自早期的细胞。
74.本文中,所述的“pbmc”是指外周血单个核细胞,是外周血中具有单个核的细胞,包括淋巴细胞和单核细胞。
75.本文中,“ab”同“ievs”或“apopevs”。
76.实施例1pbmc来源的ievs的获得
77.1、人源pbmc分离实验
78.抗凝管取血,用pbs稀释血液(pbs:外周血=1:1稀释血液),之后加入到福麦斯 pbmc分离管(预装,含分离液),800g离心10min,取离心后白膜层(如图1)到新的 50ml离心管,用适量pbs 300g,10min洗两次,rpmi(不含fbs)重悬细胞团进行细胞计数,细胞计数后调整细胞浓度为1x106/ml培养基,加入10cm培养皿中进行培养。
79.2、鼠源pbmc分离实验
80.ficoll-hypaque密度梯度离心分离pbmc细胞(solarbio各种动物外周血淋巴细胞分离液试剂盒):
81.1.采血:左手拇、食指抓取小鼠(c57bl/6wt 12周雄性小鼠)双耳及颈后皮肤,小指固定尾部
→
中指将小鼠左侧前肢轻压在胸骨心脏部位,无名指按在腹部,捻动拇指,轻压取血侧眼部皮肤,使眼球充血突出
→
用弯头镊夹取眼球
→
根据需要捻动拇指与食指的方向,使血液从眼眶内以不同速度垂直流入离心管
→
同时用左手中指轻按小鼠心脏部位,以加快心脏泵血速度
→
当血液流尽时,用脱臼法处死小鼠。此法取小鼠全血0.8~1.2ml,注入edta
‑ꢀ
k2抗凝管中,轻轻摇匀。
82.2.稀释:室温下加入等体积的稀释液或pbs,轻轻吹打摇匀;
83.3.加样:取15ml离心管,吸取与1 2步骤等体积的分离液于离心管中,移液枪头贴着管壁缓慢将稀释后的血液平铺在分离液液面上面,(当1 2稀释后血液体积小于3ml时,加入3ml分离液;大于等于3ml时,加入等体积分离液)。
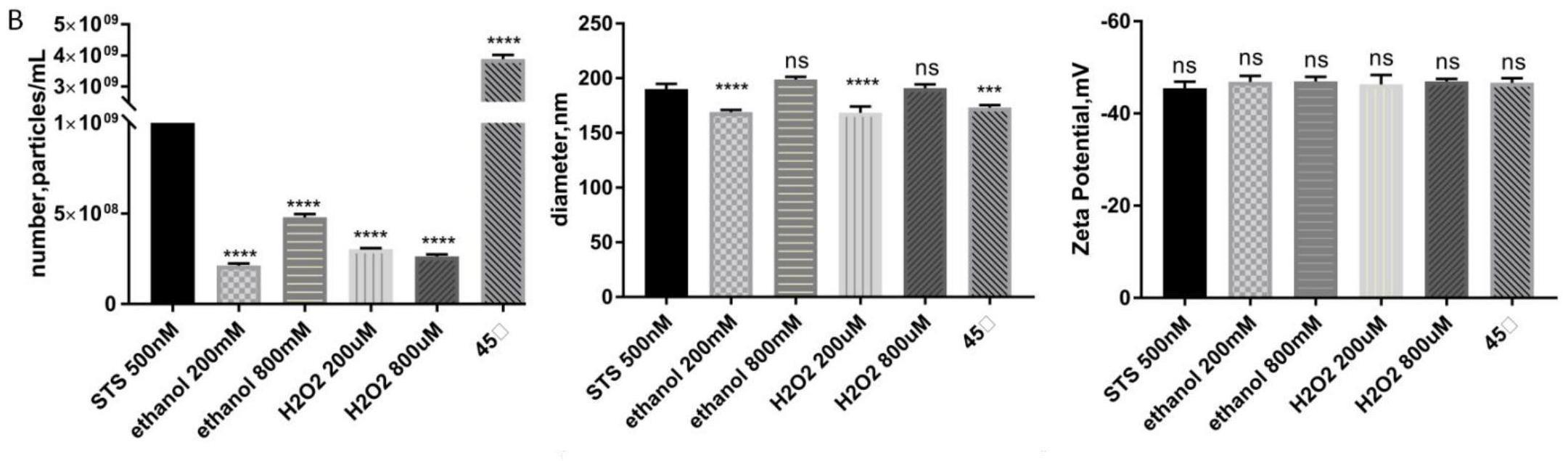
84.4.离心:室温,500g,15min,
↑4↓
0,离心后从管底至液面分4层,依次为红细胞和粒细胞层、分离液层、单个核细胞层、血浆层。
85.5.回收:将移液管直接插入白膜层(或先吸去上层的血浆),轻轻吸出白膜层(如图 2)至新的15ml离心管中。
86.6.洗涤:加入至少pbmc细胞体积3倍的pbs,室温,400g,5min,两次。
87.7.流式检测:取适量细胞进行cd11b和cd45染色,流式上机检测。
88.8.细胞计数:弃上清,加入1mlrpmi-1640培养基(含10%胎牛血清),吹打混匀,制成pbmc细胞悬液。
89.9.细胞培养:细胞计数后调整细胞浓度为1x106/ml培养基,加入10cm培养皿中进行培养。
90.3、pbmc来源的ievs的获得
91.分离提取的pbmc细胞,接种到不同刺激(pbmc sts 500nm 16h,pbmc 乙醇200 mm 16h,pbmc 乙醇800mm 16h,pbmc h2o2200μm 16h,pbmc h2o2800μm 16h, pbmc uv 4h,pbmc 45℃6h)的培养皿中诱导凋亡,sts组、酒精组和双氧水组于 37℃,5%二氧化碳培养箱培养;紫外线组于紫外交联仪300mj/cm2处理4h,加热组于45℃水浴锅处理6h。
92.各组的培养基为rpmi-1640培养基(含10%胎牛血清),如在其基础上添加sts或乙醇或h2o2,或进行uv或加热处理。
93.采用以下方法分离提取ievs:诱导凋亡以后,检查细胞状态,确认大部分细胞发生凋亡(图3),按照ievs提取标准化流程进行ievs的分离,技术路线详见图4:
94.(1)用移液器吹打分离细胞,收集细胞及上清液至15ml离心管;
95.(2)800g,10min,4℃;
96.(3)收上清转移至1.5ml ep管(注意,勿弃上清);
97.(4)2000g,10min,4℃;
98.(5)收上清至高速冷冻离心机适用玻璃管,弃沉淀;
99.(6)16,000g,30min,4℃(提前预冷);
100.(7)弃上清,pbs重悬,转移至1.5ml ep管中;
101.(8)16,000g,30min,4℃(提前预冷);
102.(9)弃上清,无菌pbs重悬ab沉淀,4℃冰箱保存。
103.实施例2pbmc来源ievs的分析
104.利用流式细胞技术对提取的ievs进行分析,结果显示从诱导后的1h至24h,ievs的颗粒直径分布主要都集中在1μm以下,占95%左右(图5a,其为实施例1中鼠源pbmc sts 500nm 16h组的结果)。纳米粒子跟踪分析(nta)结果显示人源(图5b,表1)和鼠源(图5c,表2)pbmcs在不同诱导条件下均可以产出ievs,且产生的ievs在粒径和电位方面与sts诱导下产生的ievs无显著差异。
105.利用流式细胞技术对上述实施例1分离提取的人源pbmcs进行分析,结果显示分离提取的pbmcs cd45阳性,可得出分离得到的就是pbmcs(如图6)。进一步对pbmcs来源的ievs的表面膜蛋白进行分析,结果显示,ievs能够表达细胞外囊泡的普遍性表面蛋白 cd9(图6)。
106.表1人源pbmc来源的ievs
[0107][0108]
表2鼠源pbmc来源的ievs
[0109][0110]
利用蛋白印记进行验证不同方式诱导的pbmc-ievs的蛋白内容物表达,结果表明,不同诱导方式产生的ievs均能特异性表达annexin v,integrin alpha 5和syntexin 4(图7)。以上3种蛋白为区分mscs来源的ievs和exosomes的特征性蛋白标志物。
[0111]
实施例3pbmc来源ievs的应用
[0112]
1、治疗急性呼吸窘迫综合症(ards)
[0113]
急性呼吸窘迫综合症(ards)发病率及死亡率均高,发病机制迄今尚未完全阐明,目前也无特效的治疗方法。本研究观察经气管滴注与尾静脉输注人外周血单个核细胞 (pbmc)来源的ievs(或称“apopev”)对急性呼吸窘迫综合症模型小鼠的治疗效果。
[0114]
(1)实验方法
[0115]
1)实验动物:c57bl/6小鼠,性别不限,8-12周龄,spf级。
[0116]
2)研究药物为人pbmc-apopev悬液,其制备步骤如下:采用ficoll密度梯度离心法分离人新鲜全血的pbmc(8ml人全血约分离出1
×
107个pbmc),pbs洗涤,加入星形孢菌素(sts)诱导凋亡,16小时候收集液体,800g 4℃离心10分钟,收集上清,2000g 4℃离心10分钟,收集上清,16000g 4℃离心30分钟,弃上清,1ml pbs重悬,16000g 4℃离心30分钟,再次弃上清。加pbs配置pbmc-apopev悬液,气管滴注1
×
106/30μl,静脉输注1
×
106/200μl,悬液在使用前4℃保存。
[0117]
3)ards小鼠模型构建及治疗:取8-12周龄c57bl/6小鼠,随机分为4组,每组3-5 只,分别是正常对照组(control),模型组(lps组),人pbmc-apopev经气管滴注治疗组 (pbmc-apopev-l组)及人pbmc-apopev尾静脉注射治疗组(pbmc-apopev-s组)。术前6小时禁
食禁水,麻醉使用4%水合氯醛10ml/kg。模型组及治疗组均先气管滴注给予30 μl lps(5mg/kg),4小时后,治疗组分别经气管滴注30μl的pbmc-apopev(apopev约 1
×
106个),经尾静脉注射200μl的pbmc-apopev(apopev约1
×
106个),造模24小时后处死小鼠(从lps给予后开始计算,到第24小时处死动物)。
[0118]
(2)实验结果
[0119]
1)肺组织的he染色:正常组的he染色切片可见图8中的control;lps组可见肺泡组织结构破坏严重,充血水肿明显,大量炎性细胞浸润,肺泡间隔明显增厚且结构紊乱; pbmc-apopev治疗组,小鼠肺组织的充血及炎症浸润明显减轻,肺组织渗出减少,肺泡间隔增厚和结构紊乱也有明显改善。其中气管滴注组(pbmc-apopev-l组)与全身静脉输注组(pbmc-apopev-s组)疗效相似(图8)。
[0120]
2)肺的湿/干重比:称量肺湿重,烤箱烤干到恒重称量得到肺干重。根据公式计算肺部 w/d值。结果表明,lps刺激显著增加了小鼠肺湿/干重比值,而经气管滴注或尾静脉输注的pbmc-apopev治疗则显著降低了这一比值,但各个治疗组之间没有差异(图9)。
[0121]
2、治疗肠炎
[0122]
(1)研究方法
[0123]
1)实验动物:c57bl/6小鼠,性别不限,8-12周龄,spf级。
[0124]
2)人pbmc-apopev悬液的制备:采用ficoll密度梯度离心法分离人新鲜全血的 pbmc(8ml人全血约分离出1
×
107个pbmc),pbs洗涤,加入500nm星形孢菌素(含有 500nm sts的rpmi-1640培养基)诱导凋亡,16小时候收集液体,800g 4℃离心10分钟,收集上清,2000g 4℃离心10分钟,收集上清,16000g 4℃离心30分钟,弃上清,1ml pbs 重悬,16000g 4℃离心30分钟,再次弃上清。加pbs配置pbmc-apopev悬液,静脉输注 1
×
106/200μl,悬液在使用前4度保存。
[0125]
3)dss诱导的小鼠肠炎模型构建及治疗:取8-12周龄c57bl/6小鼠,给予3%(w: v)硫酸葡聚糖硫酸钠(dss,分子量:36,000
–
50,000da;mp biochemicals,160110)饮水10天诱发结肠炎。在dss处理第3天时,小鼠经尾静脉注射200μl的pbmc-apope (apopev约1
×
106个),造模10天时处死小鼠。
[0126]
(2)实验结果
[0127]
1)如图10所示,pbmc能抑制dss诱导的肠炎。结肠炎小鼠的体重显著降低,ievs 治疗显著减轻了dss诱导的结肠炎小鼠体重减轻的趋势(图10a)。dss诱导导致结肠长度显著减少,严重的结肠上皮和隐窝破坏以及炎性细胞的大量浸润,而ievs治疗显著缓解这些症状(图10b,10c所示)。
[0128]
2)图11的结果显示,pbmc ievs能调节肠炎小鼠t细胞过度激活。ievs治疗可显著诱导肠炎小鼠过度激活的cd3
t细胞的凋亡。其中pbms来源ievs效果优于pbms外泌体 (exo或exosome)。
[0129]
3)pbms来源的iev能抑制肠炎小鼠th17细胞的激活。ievs治疗可显著诱导肠炎小鼠循环中的th17细胞(图12)。
[0130]
plasma-mv组,plasma-exo low组,plasma exo high组分别指未诱导状态下血浆中的大囊泡,外泌体(小囊泡)低剂量组,外泌体(小囊泡)高剂量组。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。